INDICE
CAPITOLO I - INTRODUZIONE...
pag.3
1.
Antiossidant vegetali
...pag.3
1.1 Introduzione...pag. 3
1.2 I flavonoidi...pag. 5
1.3 Antiossidanti in pomodoro...pag. 8
2. Fotomorfogenesi e fotorecettori...pag.10
2.1 La luce e le piante...pag.10
2.2 I fotorecettori...pag.11
3. Il pomodoro come modello nello studio della fotomorfogenesi...pag.22
3.1 Pianta modello...pag.22
3.2 La famiglia genica del fitocromo in pomodoro...pag. 22
3.3 La famiglia genica del criptocromo in pomodoro...pag. 23
4. Mutanti fotomorfogenici di pomodoro...pag.23
4.1 Introduzione...pag. 23
4.2 Mutanti con ridotta percezione della luce...pag. 25
4.3 mutanti con aumentata sensibilità della luce...pag. 26
CAPITOLO II...
...pag. 29
1. Sistematica e biologia del pomodoro...pag.29
1.1 Il pomodoro...pag. 29
CAPITOLO III-SCOPO DELLA TESI
...pag.34
CAPITOLO IV-MATERIALI E METODI
...pag. 36
Materiale vegetale...pag.36
Estrazione e det. dei flavonoidi da frutti di pomodoro...pag. 36
CAPITOLO V-RISULTATI
...pag.38
1. Quantificazione di flavonoidi nell’
epidermide...pag.39
1.1 Quercetina...pag. 40
1.2 Camferolo ...pag. 41
1.3 Rutina...pag. 42
1.4 Naringenina...pag. 42
2. Quantificazione di flavonoidi nella polpa...pag. 43
2.1 Quercetina ...pag. 44
2.2 Rutina...pag. 45
2.3 Naringenina...pag.46
CAPITOLO VI-DISCUSSIONE E CONCLUSIONI
...pag. 47
BIBLIOGRAFIA
...pag.50
CAPITOLO I
INTRODUZIONE
1.Antiossidanti vegetali
1.1 Introduzione
Gli organismi vegetali utilizzano per i processi relativi alla loro crescita e riproduzione un numero di sostanze piuttosto limitato (carboidrati, lipidi, proteine, acidi nucleici, coenzimi, vitamine); biosintesi e degradazione di questi composti costituiscono il metabolismo primario. I vegetali sono altresì capaci di sintetizzare una grande varietà di composti organici la cui funzione è nota solo in parte; la biosintesi di queste molecole si realizza attraverso vie metaboliche che utilizzano, come metaboliti di partenza, prodotti intermedi del metabolismo primario. Questo metabolismo è detto secondario, può variare da specie a specie, è condizionato da fattori ecologici e genetici e può quindi dare luogo a metaboliti molto differenti tra loro. Tra essi molto importanti sono le molecole a carattere antiossidante. La funzione positiva della maggior parte dei fitochimici benefici alla salute umana si esercita infatti attraverso la prevenzione di uno stato di stress ossidativo che può rappresentare la causa di molte patologie.
Col termine di antiossidante si identificano tutti quei composti, presenti nei tessuti vegetali, che, grazie ad un potenziale redox molto negativo, tendono ad ossidarsi, divenendo loro stessi il bersaglio preferenziale di radicali liberi e specie attive dell’ossigeno. La loro predisposizione all’ossidazione rende però gli antiossidanti molto instabili, poco conservabili e facilmente disattivabili nei processi tecnologici di trasformazione e confezionamento degli alimenti (Soldatini, 1996).
(O2.• -), idrossile (•OH) e l’acqua ossigenata (H2O2). Durante il funzionamento basale del
metabolismo cellulare le ROS vengono normalmente prodotte e le cellule posseggono dei sistemi enzimatici e non, per tenere sotto controllo la produzione di queste sostanze la cui tossicità risulta strettamente legata alla loro concentrazione. Quando essa nelle cellule risulta a livelli fisiologici bassi, tali molecole possono rappresentare un aiuto per la difesa da attacchi da parte dei patogeni. Ad un eccesso di ROS è stata invece attribuita la causa dell’instaurarsi, nell’organismo umano, di una vasta serie di patologie tra le quali alterazioni vascolari, alterazioni polmonari, alcuni tipi di cancro come ad esempio quello polmonare (Lesi, 2002), cataratta, artrite reumatoide, malattie neurodegenerative (il morbo di Parkinson e il morbo di Alzheimer). Anche il processo di invecchiamento sembra essere correlato all’accumulo nell’organismo di tali specie molecolari tossiche (Buring e Henneckens, 1997; Steinmetz e Potter, 1996; Block et al., 1992). I radicali liberi essendo specie chimiche molto reattive per la presenza di uno o più elettroni spaiati nell’orbitale più esterno, sono in grado di legarsi facilmente ed in modo rapido ad altre molecole originando reazioni a catena indesiderate e spesso lesive per le cellule. Gli antiossidanti neutralizzano i radicali liberi donando loro un elettrone e ponendo fine ad una serie di reazioni a catena. L’antiossidante, quando cede un elettrone, non diviene esso stesso un radicale libero in quanto raggiunge una forma chimica stabile.
Gli antiossidanti, svolgendo quindi un ruolo importante nel regolare, inibire ed evitare gli effetti dannosi dovuti all’instaurarsi di uno stress ossidativo, possono quindi essere utili nella lotta a certe patologie quali cancro, arteriosclerosi, artrite, cataratta e diabete, causate dall’azione di forme attive dell’ossigeno formatesi nell’organismo umano. Gli animali e l’uomo, non essendo in grado di sintetizzare tali sostanze, dipendono, per la loro vita, dall’assunzione di questi composti dagli alimenti.
Le principali sostanze che svolgono azione antiossidante derivano essenzialmente dall’attivazione del metabolismo secondario. Tra gli antiossidanti di origine vegetale possiamo annoverare: i carotenoidi (β-carotene, licopene e luteina, zeaxantina) l’acido ascorbico (vitamina C), l’α-tocoferolo (vitamina E), , i polifenoli, tra cui diversi flavonoidi.
I carotenoidi sono pigmenti polienici, appartenenti alla grande famiglia dei terpenoidi (tetraterpeni). Sono antiossidanti liposolubili. Nei tessuti possono essere protetti dalle ossidazioni dalla presenza dei tocoferoli.). Sono presenti praticamente in tutti i tessuti fotosintetici, nei fiori e nei frutti e nei pollini mentre nei semi si ritrovano soltanto in tracce. Spesso la loro presenza risulta mascherata dalla clorofilla. Le foglie delle piante erbacee sono assai ricche di carotenoidi, che possono raggiungere e superare i 250 mg/100 di sostanza secca e particolarmente ricchi ne sono gli agrumi.
I carotenoidi possono essere sintetizzati ex novo in tutti gli organismi fotosintetici ed in molti non fotosintetici (Bartley et al., 1994). Nei tessuti verdi delle piante superiori i carotenoidi esplicano essenziali funzioni protettive bloccando la formazione di ROS anche mediante il cosidetto ciclo delle xantofille deputato alla dissipazione dell’energia in eccesso sotto forma di calore. Questo ciclo, consistente nella de-epossidazione della violaxantina a zeaxantina attraverso l’intermedio anteraxantina, è comunemente attivato in condizioni di luminosità eccessiva o in presenza di stress che riducono la capacità di utilizzo della radiazione luminosa per via fotochimica. Questi pigmenti si trovano, inoltre, nei cromoplasti come responsabili della colorazione gialla, arancione e rossa di molti fiori, frutti e radici. Carote, pomodori e verdure (spinaci, broccoli e fagiolini verdi) sono esempi di eccellenti fonti di carotenoidi, per questo importanti nella dieta umana (Tonucci et al., 1995).
L’acido ascorbico (vitamina C) si presenta in cristalli di sapore acidulo gradevole, solubili in acqua e in alcool, ha potere riducente per cui si ossida facilmente all’aria dando acido L-deidroascorbico. La sua azione biologica è legata al fatto che costituisce un sistema redox assai efficiente a causa della presenza di un gruppo riduttore.
1.2 I flavonoidi
Recentemente è aumentata l’attenzione verso le funzioni nutrizionali e salutistiche dei polifenoli vegetali, in particolare dei flavonoidi (Hertog et al., 1993).
I flavonoidi costituiscono una grande classe di composti ubiquitari nelle piante che hanno in comune la struttura base del 2-fenil-α-benzopirone.
Struttura base dei flavonoidi
Essi presentano molti gruppi ossidrilici su strutture ad anello che conferiscono loro proprietà antiossidanti. Questi polifenoli vegetali possono funzionare da agenti riducenti, da antiossidanti, donatori di idrogeno, grazie al loro potenziale redox e da chelanti di metalli. Esistono sei classi principali di flavonoidi: i calconi, i flavononi, i flavoni, i flavonoli, le antocianidine e gli isoflavoni. I flavonoidi possono essere distinti in flavoni (per esempio crisina, butina, apigenina, luteolina etc) e nella loro forma ossidata, i flavononi (per esempio liquiritigenina, eriodictiolo etc). I rispettivi derivati idrossilati sono rappresentati dai diidroflavanoli e dai flavanoli (come quercetina campferolo), flavonoidi con caratteristiche peculiari sono la antocianine, derivate dal flavene, gli auroni derivati dal benzofurano e gli isoflavoni.
I flavonoidi sono sicuramente la classe di principi attivi alla quale sono state attribuite maggiori proprietà benefiche relative alla salute umana come attività anti-ipertensiva, antiallergica, antimutagena, antitumorale molte delle quali dimostrate nell’uomo e con effetto terapeutico o preventivo
Funzioni dei flavonoidi negli organismi vegetali.
La funzione fondamentale di questo gruppo di sostanze naturali presenti quasi esclusivamente nelle piante superiori, è quella di impartire una colorazione ai fiori, ma anche ai frutti e talora alle foglie. Molti flavonoidi hanno una colorazione gialla o giallastra, che rende ragione del loro nome (dal latino flavus, giallo). Oltre a determinare tali bellissime pigmentazioni, i flavonoidi hanno un ruolo chiave anche nel complesso sistema di segnali tra piante e microbi, nella fertilità maschile di alcune specie, come deterrenti per la predazione e nella difesa come agenti antimicrobici. Il ruolo svolto dai flavonoidi nella protezione della pianta nei confronti di attacchi microbici vede coinvolta non solo la loro presenza come agenti costitutivi, ma anche il loro accumulo con funzione di fitoalessine (Hartborne e Williams, 2000). I flavonoidi, soprattutto gli isoflavonoidi e i flavanoni hanno inoltre la capacità di inibire la germinazione delle spore dei patogeni fungini delle piante. Un’altra azione legata alle caratteristiche del loro spettro di assorbimento può anche essere quella di proteggere la foglia dalla radiazione UV, infatti, aumentando l’altitudine aumenta nelle foglie il contenuto in antocianidine. Dal momento che i primi steps della via biosintetica dei flavonoidi sono rintracciabili anche nelle briofite, si suppone che i flavoni, i flavanoni e i flavonoli abbiano avuto inizialmente il ruolo di messaggeri chimici per divenire solo in seguito filtri nei confronti delle radiazioni UV.
Biosintesi dei flavonoidi.
schichimato, attraverso il corismato, si giunge agli amminoacidi tiroxina e fenilalanina. L’enzima fenilalanina ammonio liasi (PAL) diammina la fenilalanina ad acido transcinnamico, che viene convertito da due ulteriori enzimi (acido-4-idrossilasi e 4-cumaril-CoA-ligasi) nel cumaril-CoA. Questo processo, denominato via del fenilpropano, fornisce l’anello B dei flavonoidi. Nella via biosintetica dei flavonoidi una molecola di cumaril-CoA è condensata dall’enzima calcone sintasi (CHS) consecutivamente con tre molecole di malonil-CoA. In questo modo si forma l’anello A dello scheletro di base del flavone.
La formazione delle strutture base per la sintesi di flavonoidi, e quindi per la chiusura dell’anello eterociclico centrale, prevede una serie di reazioni fra le quali la più conosciuta è catalizzata dall’enzima calcone isomerasi (CHI). La CHI catalizza l’isomerizzazione stereospecifica del composto 2’,4’,6’,4-tetraidrossicalcone nel composto naringenina che serve da precursore per la sintesi degli altri flavonoidi.
Fig.1.1- Rappresentazione schematica delle ramificazioni più importanti del percorso di biosintesi dei flavonoidi.
1.3 Antiossidanti in pomodoro
L'agricoltura è sempre più indirizzata verso la produzione di alimenti funzionali, in particolare frutta ed ortaggi ricchi di vitamine protettive e di altri composti con potenziali positivi effetti sulla salute. In particolare c'è un forte interesse verso quelle metodologie “environmental friendly” che possono indurre un innalzamento delle proprietà antiossidanti dei prodotti vegetali.
che vitamina C, necessarie per la salute umana, in relazione alla grande quantità di pomodori che vengono consumati nella dieta giornaliera, che non per l’elevato contenuto di queste due vitamine. Infatti 100 g di pomodoro forniscono circa il 20 ed il 40% della dose giornaliera suggerita negli Stati Uniti per gli adulti (NRC, 1989). Ben più importante è l’apporto di licopene che è presente in quantità sei volte più alte del β-carotene, 31 mg/Kg di peso fresco e 5 mg/Kg di peso fresco rispettivamente, mentre il contenuto di flavonoidi, metaboliti appartenenti alla classe dei polifenoli, è generalmente piuttosto basso, circa 5 mg/Kg di peso fresco, rispetto a molti altri prodotti orticoli (Crozier et al., 1997). Per quanto detto sopra, il pomodoro è considerato quindi una buona sorgente di carotenoidi ed una modesta fonte di flavonoidi. In un gran numero di studi epidemiologici che analizzavano le relazioni tra dieta e insorgenza di patologie cancerose, è stato riscontrato un effetto protettivo da parte del consumo di ortaggi e frutta nei confronti di queste patologie (Hertog et al. 1997; Pietta, 2000; Duthie e Crozier, 2000). L’esatto meccanismo protettivo degli ortaggi non è ancora perfettamente noto, ma viene generalmente accettato che la loro abbondanza in nutrienti e non nutrienti (carotenoidi, flavonoidi, composti fenolici in genere, acido ascorbico etc..) rappresenti un elemento di cruciale importanza.
E’ da tempo oggetto di studio l’influenza dei fattori genetici, fisiologici ed agronomico-ambientali sulle proprietà antiossidanti del frutto di pomodoro. Infatti in questa specie il contenuto di antiossidanti, oltre che dalla componente varietale, dipende strettamente dalle condizioni ambientali in cui sono allevate le piante (Crozier et al.1997). Persiste infatti una ampia variabilità nei livelli di composti bioattivi presenti nei frutti di pomodoro in funzione della cultivar, delle condizioni climatiche presenti nell’ambiente di coltura e durante la “shelf-life”. E’ ben noto che in molte piante, coltivate e non, elevati livelli di energia radiante inducono la produzione di maggiori livelli di flavonoidi nei vari tessuti. E’ stato inoltre visto in molte specie vegetali che le radiazioni UV-B favoriscono specificatamente significativi incrementi nel contenuto di flavonoidi rispetto a quelli riscontrati in piante che ricevevano soltanto luce visibile (Bornman e Teramura, 1993). Evidenze sperimentali indicano la presenza di interazioni fra fitocromo, criptocromo e catene segnalatorie degli UV-B nella regolazione dell'espressione del gene della Calcone sintasi (CHI) in plantule di Arabidopsis (Wade et al., 2001). Anche in plantule di pomodoro è stato dimostrato un forte effetto promotore sulla sintesi dei flavonoidi da parte delle radiazioni luminose (Drumm-Herrel e Mohr, 1982; Brandt et al., 1995; Lercari e Bertram, 1997). Il fitocromo ha un ruolo sia nella regolazione dell'accumulo di flavonoidi nell' epidermide del frutto di pomodoro (Piringer e Heinze, 1954; Yen et al., 1997) che di carotenoidi nell'epidermide e nel pericarpo (Mustilli et al., 1999; Alba et al., 2000). Anche per quel che riguarda il contenuto in licopene è stato visto che il sistema fitocromo localizzati nei frutti ne regolano l’accumulo indipendentemente dalla produzione
di etilene (Alba et al., 2000). Sembra quindi che i fitocromi dei frutti non siano regolatori globali della maturazione dei frutti, ma che piuttosto regolino uno o più componenti specifici del processo di maturazione.
D'altra parte, è ben noto che a livello di plantula le risposte fotomorfogeniche siano regolate da un complesso network di catene trasduttrici dei segnali luminosi (Batschauer et al., 1996; Ahmad e Casfmore, 1997; Cerdan et al.1999; Hennig et al., 1999; Short 1999; Casal 2000; Liscum and Stowe-Evans 2000; Bertram e Lercari, 2000; Wade et al., 2001).
2. Fotomorfogenesi e fotorecettori
2.1 La luce e le piante
La luce è una radiazione elettromagnetica che si propaga in linea retta nello spazio sotto forma di fotoni o quanti. L’energia radiante (identificabile con la radiazione luminosa) si esprime normalmente sotto forma di irradianza (μmol m-2 sec-1), ossia come flusso di energia che incide su
una superficie unitaria piana in un dato intervallo di tempo.
La luce è in grado di influenzare numerosi processi fisiologici attraverso stimoli direzionali e non direzionali. I primi sono responsabili di fenomeni quali il il fototropismo (crescita asimmetrica di un organismo in direzione della sorgente luminosa) e la fototassi (movimento di organismi, cellule e/o organelli cellulari regolato dalla luce). I secondi sono correlati al fotoperiodismo (risposta delle piante alla lunghezza relativa di luce e di buio nell’arco del giorno), alla fotosintesi (processo grazie al quale l’energia radiante è trasformata in energia chimica sotto forma di sostanze organiche a partire da CO2 ed H2O) ed alla fotomorfogenesi (regolazione luminosa della crescita, del
differenziamento e dello sviluppo, indipendente dai processi fotosintetici).
Le piante utilizzano quindi la luce come fonte di energia oppure come sorgente di segnali (in termini di intensità, qualità e durata), modulando il loro sviluppo in base alle informazioni che ricevono. La luce può quindi determinare l’attitudine di un seme a germinare, l’angolo di crescita del germoglio, la velocità di allungamento del fusto, l’espansione fogliare o il momento della fioritura.
2.2 I fotorecettori
Le piante sono in grado di recepire gli stimoli luminosi grazie alla presenza di macromolecole fotosensibili, i fotorecettori, capaci di assorbire i quanti di luce e, conseguentemente, di subire variazioni conformazionali. Tali macromolecole sono in genere costituite da due gruppi: una matrice di natura proteica e un gruppo fotosensibile, costituito da una o più molecole fotocromiche (cromofori), in grado di assorbire fotoni e soggiacere a stati di eccitazione diversi caratterizzati da differenti spettri di assorbimento.
A differenza dei pigmenti fotosintetici, i fotorecettori legati alla fotomorfogenesi sono presenti nei tessuti vegetali in basse concentrazioni, sono attivati da bassi livelli d’energia radiante e non sono necessariamente legati a specifiche membrane (Quail, 1991).
Le piante hanno sviluppato tre diversi gruppi di fotorecettori in funzione della quantità, qualità, direzione e durata del messaggio luminoso (Briggs W.R. e Olney, M.A., 2001):
- fotorecettori del rosso/rosso lontano: fitocromi;
- fotorecettori del blu/UVA: criptocromi, fototropine, zeaxantina e rodopsina; - fotorecettori dell’ UVB.
L’azione combinata dei diversi fotorecettori permette alla pianta di utilizzare un’ampia porzione dello spettro della radiazione solare, dai raggi ultravioletti fino ai rosso-lontani, e la rete di interazioni comporta fenomeni di ridondanza, antagonismo e rapporti effettore/modulatore (Chory, J. e Wu D., 2001).
2.2.1 Il fitocromo
Il sistema fitocromo è ben caratterizzato nelle piante superiori e risulta coinvolto in numerosi processi fisiologici quali la germinazione dei semi, il de-eziolamento, la crescita dell’ipocotile, la dormienza delle gemme, l’induzione fiorale e lo sviluppo dei cloroplasti.
osservarono che la germinazione dei semi di lattuga era stimolata dalla luce rossa (red (R), max 660 nm) ed inibita da quella rosso lontana (far red (FR), max 730 nm) (fig.1). Gli stessi autori
scoprirono che l’effetto stimolante del R sulla germinazione poteva essere annullato dalla successiva esposizione alla luce FR e viceversa. Sulla base della reversibilità R/FR dell’effetto ipotizzarono l’esistenza di un unico pigmento che si poteva interconvertire alla luce e che successivamente chiamarono fitocromo (Bortwick e Hendricks, 1960).
Studi effettuati sulla sua struttura chimica hanno dimostrato che il fitocromo è un pigmento solubile, di natura cromoprotidica.
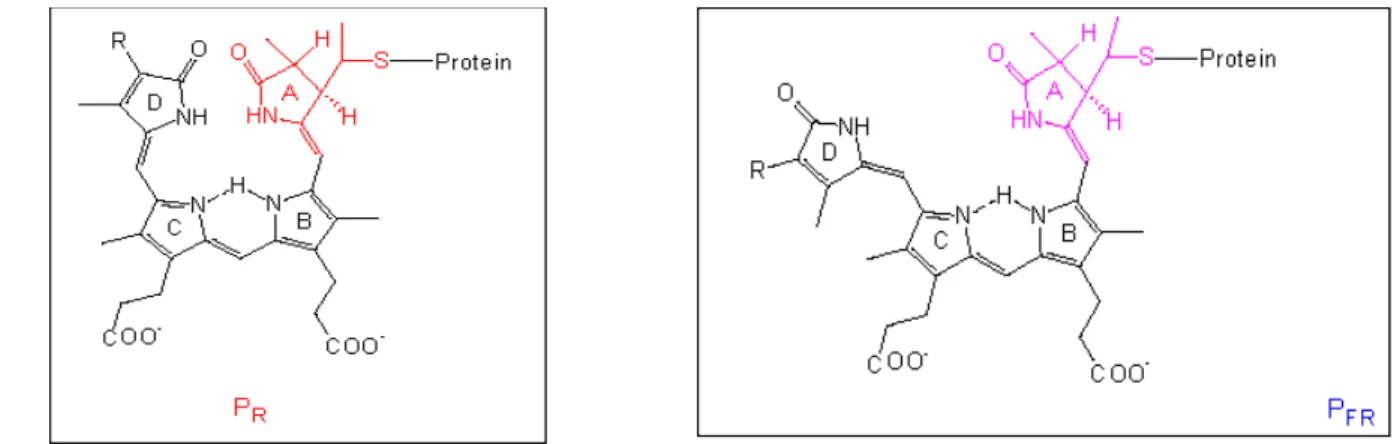
Ogni monomero ha un peso molecolare di circa 125 kD, variabile in funzione della specie vegetale, ed è costituito da un’apoproteina (circa 1100 aminoacidi) che presenta due regioni: una globulare su cui si inserisce un cromoforo, la fitocromobilina, di natura tetrapirrolica lineare, legata
covalentemente ad un residuo di cisteina all’estremità N-terminale dell’apoproteina, ed una
allungata C-terminale che partecipa alla dimerizzazione della molecola (Romanowski e Song, 1992; Edgerton e Jones, 1992; Quail, 1994).
Fig. 1.2 - Struttura del cromoforo del Pr e Pfr.
La funzione fotosensoriale del fitocromo è riconducibile alla sua presenza nelle cellule vegetali sotto forma di due fotoisomeri fotoconvertibili, il Pr ed il Pfr, che hanno il massimo di assorbimento rispettivamente nel rosso e nel rosso lontano. La luce rossa converte il Pr in Pfr, il quale, a sua volta, può essere riconvertito in Pr tramite luce rosso lontana.
Ogni radiazione luminosa satura determina perciò nei tessuti un fotoequilibrio dinamico, che si instaura molto rapidamente e che dipende dalla distribuzione spettrale della radiazione stessa.
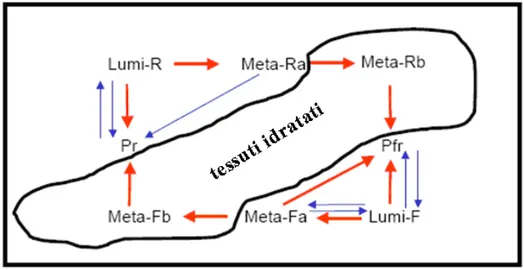
Il fitocromo funziona quindi come un interruttore molecolare regolato dalla luce ed il Pfr, che si forma dopo un impulso di luce R, è ritenuto la forma attiva. Le piante riescono a sintetizzare ex novo il Pr, mentre il Pfr si forma solo tramite fotoconversione, irradiando il Pr con luce rossa. La fotoconversione è un processo molto complesso che procede attraverso la formazione di isomeri intermedi instabili. Tale fenomeno può essere così descritto: Pr, assorbendo luce rossa, si trasforma in lumi-R e da questo, attraverso alcuni intermedi (meta-Ra, meta-Rb e probabilmente altri) si origina il Pfr. Quest’ultimo, assorbendo luce rosso lontana, genera lumi-F che a sua volta si converte in successivi isomeri (meta-Fa, meta-Fb) prima di dare nuovamente Pr (fig.1.3).
Fig. 1.3 - Le frecce rosse rappresentano passaggi non fotochimici, al contrario delle frecce blu. Alcune reazioni procedono solo in tessuti idratati.
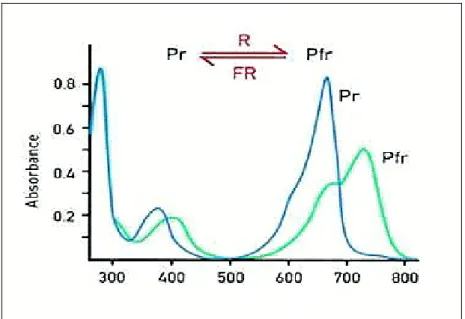
I due fotoisomeri, Pr e Pfr, hanno spettri di assorbimento molto ampi che si sovrappongono considerevolmente nel campo del visibile tra 650 e 690 nm (fig.1.4), per cui ogni volta che la luce colpisce un tessuto vegetale, essa viene assorbita, con proporzioni diverse a seconda della
lunghezza d’onda, da entrambe le forme del fitocromo che si trasformano perciò
contemporaneamente l’una nell’altra. Questo fa si che si stabilisca, per ogni lunghezza d’onda, una miscela di Pr e Pfr che dipende unicamente, con irradiazioni saturanti, dalla lunghezza d’onda.
Fig. 1.4 - Gli spettri di assorbimento delle forme Pr (linea blu) e Pfr (linea verde) del fitocromo.
E’ impossibile così isolare il Pfr perché tali irradiazioni saturanti conducono ad una continua interconversione tra Pr e Pfr determinando un fotoequilibrio dinamico:
α = Pfr/Ptot con Ptot = Pr + Pfr
Alla luce del sole il fotoequilibrio è pari a 0,55. Nelle bande del rosso e del rosso-lontano dello spettro luminoso, esso è raggiunto molto rapidamente e con livelli molto bassi di energia, mentre nella banda del blu, sono richiesti livelli di energia 50 volte più elevati. Il fotoequilibrio stabilito con luce rossa è circa 0,85 mentre con luce rosso lontana è circa 0,03.
La stima del vero stato del fitocromo “in vivo”, è complicata perché, in aggiunta alle reazioni fotochimiche, alcune reazioni non fotochimiche giocano un ruolo importante nel determinare il fotoequilibrio. Queste ultime includono: sintesi ex novo di Pr, inibita dal Pfr; degradazione del Pfr; reversione al buio di Pfr in Pr.
Tramite tecniche spettrofotometriche è stato possibile studiare la cinetica di trasformazione del Pfr nei tessuti esposti al rosso lontano e ciò ha rilevato che tale forma è molto più stabile nelle piante cresciute alla luce che in quelle eziolate. (Jabben e Holmes, 1983). Ciò ha permesso di dimostrare che nelle piante superiori esistono due tipi di fitocromo: un tipo instabile alla luce (Tipo I), presente in maggiore quantità nei tessuti eziolati (Furuya, 1989); un tipo stabile alla luce(Tipo II) il quale predomina nei tessuti verdi. Il fitocromo del Tipo I è quello la cui forma Pfr è rapidamente modificata quando è esposta a luce rosso lontana, con un tempo di dimezzamento di circa 1 ora a temperatura ambiente. Il Tipo II è invece più stabile nei confronti della luce rosso lontana, con un
tempo di dimezzamento superiore a 5 ore. E’ bene precisare che la conversione del Pfr avviene anche al buio, perciò la definizione per il Tipo I, “labile alla luce”, è in realtà un’utile semplificazione che non rispecchia fedelmente ciò che avviene in natura.
Le funzioni dei fitocromi sono state particolarmente studiate in Arabidopsis grazie alla disponibilità di mutanti per ognuno dei cinque fitocromi identificati. In questa specie sono stati caratterizzati cinque geni codificanti fitocromo: PHYA, PHYB, PHYC, PHYD E PHYE (Clack et al., 1994) e così anche in pomodoro (PHYA, PHYB1, PHYB2, PHYE E PHYF) (Hauser et al., 1995).In
Arabidopsis, PHYA, PHYB, PHYC E PHYE codificano per proteine che hanno dal 46% al 53% di
sequenze aminoacidiche identiche. L’apoproteina codificata da PHYD (PHYD) e quella codificata da PHYB (PHYB) condividono l’80% d’identità aminoacidica; si possono perciò considerare membri della stessa sottofamiglia. Questi cinque geni sono stati classificati in quattro sottofamiglie: A, B (che include PHYD), C ed E (Hauser et al., 1995).
La notevole diminuzione, più di 100 volte, del livello di PHYA riscontrata in piante cresciute alla luce è favorita anche dal fatto che la luce provoca l'inibizione della trascrizione e la degradazione dell'mRNA del phyA stesso. Il livello della proteina PHYA è quindi regolato dalla luce sia a livello trascrizionale sia post-trascrizionale. Perciò, il fitocromo A si accumula prevalentemente in plantule eziolate mentre gli altri fitocromi, più stabili, sono prevalentemente presenti in piante cresciute alla luce. E’ ormai ampiamente accettata l’ipotesi che il fitocromo di Tipo I coincida con il phyA, mentre tutti gli altri membri della famiglia appartengano al Tipo II.
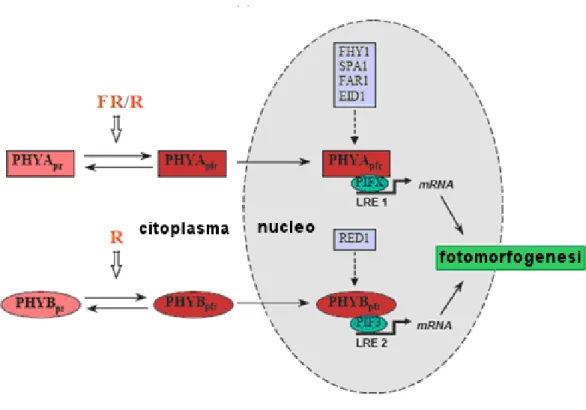
Anche la localizzazione subcellulare del fitocromo sembra essere influenzata dalla luce. Recentemente è stato dimostrato che c’è un distinto trasporto nucleare di PHYA e PHYB dipendente dalla luce (Nagy et al., 2000). In plantule cresciute al buio o in piante cresciute alla luce ma adattate al buio, PHYA e PHYB si trovano nel citoplasma. La traslocazione nucleare di PHYB può essere indotta dalla luce rossa e mostra la classica reversibilità R/FR caratteristica delle risposte mediate da fitocromo, mentre il trasporto di PHYA nel nucleo è indotto dalla luce rosso lontana sia con brevi impulsi sia con irradiazioni prolungate. Che il de-eziolamento sia il risultato della regolazione luce-dipendente dell’espressione genica è in accordo con la traslocazione dei fitocromi nel nucleo, dove sono state identificate SPA1 e PIF3, due proteine coinvolte nelle catene segnalatorie attivate dai fitocromi. Vale la pena notare che la percezione della luce da parte del fitocromo nel citoplasma attiva delle vie di trasduzione del segnale luminoso che coinvolgono lo ione Calcio e cGmp (Bowler et al., 1994). Sembra quindi che i fitocromi attivino due circuiti distinti ma coordinati: uno citosolico e l’altro nucleare.
2.2.1.1 Modalità di risposta del fitocromo
Le indagini condotte negli ultimi trenta anni hanno permesso di identificare almeno tre diverse modalità di risposta fotomorfogenica mediate dal fitocromo (fig.1.5), distinte in base alla reversibilità R/FR e alla cinetica di degradazione del fitocromo:
1. Risposte a fluenza molto bassa (Very Low Fluence Responses: VLFR) : richiedono, per essere indotte, livelli molto bassi di fluenza nel rosso (da 10-4 a 10-1 μmol m-2). In tali
condizioni solo una minima parte del Pr si fotoconverte in Pfr, per cui i valori di fotoequilibrio sono molto bassi e vanno da 10-6 a 10-3; concentrazioni così basse sono
sufficienti per dar luogo ad una risposta misurabile (Mancinelli, 1994). Le VLFR non mostrano la reversibilità R/FR, in quanto per la loro espressione bastano pochissime molecole di Pfr, che si formano anche con luce rosso lontana. Risposte appartenenti a questa categoria sono la sintesi della clorofilla durante il de-eziolamento e l’induzione della germinazione di alcune specie (Cone et al., 1985).
2. Risposte a bassa fluenza (Low Fluence Responses: LFR) : richiedono una breve esposizione alla luce rossa, con fluenza compresa tra 1 e 1000 μmol m-2. Costituiscono le tipiche
risposte del sistema fitocromo, mostrando la classica reversibilità R/FR, e cioè che l’induzione della risposta determinata dalla luce rossa può essere annullata tramite una successiva irradiazione con luce rosso lontana. Le risposte LFR comprendono: la germinazione dei semi e la regolazione dei movimenti fogliari.
3. Risposte ad alta irradianza (High irradiance Responses: HIR): richiedono un’esposizione alla luce lunga e continua con fluenza > 1000 μmol m-2 (Mohr, 1972; Mancinelli, 1994). In
questo caso, l’entità della risposta dipende dal tasso di fluenza impiegato. Le HIR non mostrano reversibilità R/FR e il loro spettro d’azione mostra la massima attività in genere a lunghezze d’onda del rosso lontano, del blu, dell’UVA, dell’UVB e del rosso nel caso di piante de-eziolate. L’efficienza di queste regioni dello spettro varia a seconda della specie, dell’età della pianta, del tipo di risposta e delle condizioni sperimentali (Beggs et al., 1980; Kerckhoofs, 1996). L’induzione delle risposte ad alta irradianza richiede la presenza costante nel tempo di quantità significative di Pfr e la massima attività del rosso lontano si può spiegare tenendo conto che in questa banda si ha la più alta concentrazione di Pfr durante l’irradiazione. Questo perché il tasso di conversione del Pfr, nel caso di lunghe esposizioni, è più alto sotto luce rossa che non rosso lontana. Sotto la luce rossa, la percentuale di Pfr è inizialmente alta, poi tende a diminuire rapidamente; mentre sotto il
rosso lontano il Pfr è poco, ma tale quantità è quasi costante (Hartmann, 1996). Le risposte HIR comprendono: la germinazione dei semi, la sintesi degli antociani, l’allungamento dello stelo e l’induzione della fioritura.
Fig.1.5 - Modelli di azione di PHYA e di PHYB che conducono alla regolazione dell’espressione genica. Nota: cR: risposta a luce rossa continua che non può essere indotta da singoli impulsi (modificata da Nagy F. et al, 2001). Gli studi hanno portato alla conclusione che phyA e phyB giocano un ruolo predominante mentre phyD, phyE ed in parte phyC hanno funzioni ridondanti con phyB (Franklin et al., 2003; Monte et al., 2003). phyA è l’unico fitocromo di tipo I, cioè labile alla luce, mentre gli altri sono di tipo II, cioè stabili alla luce. (Hirschfeld et al., 1998).
phyA può agire in due distinti modi: attraverso le risposte ad alta irradianza (FR-HIR, far-red high irradiance) e attraverso le risposte a fluenza molto bassa (VLFR, very low fluence response) all’interno dell’intero spettro di radiazione visibile (Casal et al., 2000). Le FR-HIR permettono alle plantule di de-eziolarsi sotto luce rosso-lontana continua. Le VLFR sono molto importanti per la germinazione dei semi. (Botto et al., 1996; Shinomura et al., 1996) e probabilmente agiscono solo all’emergenza della plantula durante la prima captazione di luce. Le plantule mutanti phyA cresciute in condizioni di luce rosso lontana continua mostrano essenzialmente la stesso fenotipo di quelle cresciute al buio, indicando la mancanza di sensibilità a questo tipo di luce. Le plantule eziolate di mutanti phyA sono inoltre insensibili a impulsi di luce rosso lontana o luce rossa a fluenza molto bassa. Sono invece fenotipicamente indistinguibili dal fenotipo wild type se cresciuti sotto luce rossa continua. Inoltre, le piante phyA sono facilmente distinguibili da quelle del wild type perché
presentano un notevole appassimento nelle giornate più soleggiate.
phyB è il fotorecettore che maggiormente media il de-eziolamento in risposta a luce rossa anche se ciò è dovuto all’interazione di più fitocromi (Franklin et al., 2003; Monte et al., 2003; Reed et al., 1994). I mutanti phyB hanno fenotipi molto evidenti: sono pallidi, alti ed esili, con piccioli ed internodi lunghi, forte dominanza apicale e fioritura precoce, particolarmente in giorni corti (Reed
et al., 1993; Whitelam and Devlin, 1997). Un fenotipo simile si osserva nelle piante cresciute
all’ombra. Questo fenotipo deriva dalla mancanza di fitocromo phyB, e più precisamente della sua forma Pfr, necessaria a limitare la crescita in vari organi (piccioli, internodi, ecc).
Nonostante PHYB di Arabidopsis e PHYB1 di pomodoro abbiano il 96% di aminoacidi in comune, differiscono parzialmente nelle loro funzioni. In contrasto con i mutanti phyB di Arabidopsis, i mutanti phyB1 di pomodoro sono solo temporaneamente insensibili alla luce rossa come giovani plantule. Inoltre, le piante adulte di phyB1 hanno un fenotipo molto simile alle wild type quando cresciute a livelli elevati di luce. Per questo i due geni non sembrano essere funzionalmente ortologhi.
2.2.1.2 Trasduzione del segnale del fitocromo
Benché l’esistenza del fitocromo sia stata postulata da molti anni, il meccanismo di azione del fitocromo non è stato ancora completamente chiarito, ma prove sperimentali (Miller et al., 1994) hanno messo in evidenza che si realizza, in concomitanza, un’attivazione delle proteine G (Neuhaus
et al., 1993; Romero e Lam, 1993) ed un temporaneo incremento nella concentrazione citosolica
degli ioni calcio (Chae et al., 1990; Shacklock et al., 1992) (fig.1.6). Gli studi sulla trasduzione del segnale del fitocromo hanno portato alla caratterizzazione e purificazione delle proteine G eterotrimeriche, che hanno una localizzazione cellulare simile a quelle animali, perché disposte sulla membrana (Miller et al., 1994). Per attivare queste proteine, il fitocromo, che è una proteina citosolica solubile, deve trasferirsi sulle membrane cellulari o servirsi di un intermediario per realizzare il segnale.
Sono stati definiti due distinti meccanismi di trasduzione del segnale fitocromico accoppiati alla trascrizione di specifici geni (Neuhaus et al., 1993). Uno di essi prevede il coinvolgimento del cGMP ed induce l’espressione genica, ad esempio, della calcone sintasi, mentre l’altro è calcio-calmodulina dipendente e stimola l’espressione dei geni che codificano per il tipo 1 della proteina legante la clorofilla a/b del light harvesting complex II e la subunità minore della RUBISCO. Entrambi i meccanismi sono richiesti per stimolare l’espressione del gene della ferredossina NADP+ ossidoreduttasi; successivamente si è arrivati a scoprire che questi percorsi mostrano
regolazioni negative reciproche.
E’ plausibile che, una volta avvenuta l’attivazione della proteina legante il GTP da parte dei fitocromi A e B, si inneschi un percorso di trasduzione del segnale che si realizza nel citoplasma ed appare biforcato dal momento che è in grado di modulare i livelli cellulari del secondo messaggero cGMP e del calcio attivando la trascrizione di geni regolati dalla luce (Kevei e Nagy, 2003). Nelle piante superiori un processo di fosforilazione di proteine citosoliche molto rapido e sotto controllo fitocromico era già stato descritto da Harter et al. (1994); ciò indica che un processo di fosforilazione a cascata potrebbe giocare un ruolo importante nel mediare i primi stadi del segnale fitocromico.
La maggior parte degli esperimenti condotti ha suggerito una localizzazione citosolica dei fitocromi, ma si sa ancora poco sugli eventi molecolari che mediano la transizione della fototrasduzione dal citosol al nucleo.
L’ipotesi maggiormente accreditata è quella che prevede una trasduzione del segnale fitocromico che includa processi sia citosolici che nucleari. Nel nucleo i fitocromi potrebbero funzionare da componenti attivabili dalla luce facenti parte di complessi impegnati nella regolazione trascrizionale dell’espressione di numerosi geni. La forma Pfr del fotorecettore fitocromico interagirebbe, nel nucleo, con un set di fattori trascrizionali e questi complessi a loro volta modulerebbero l’espressione genica (Kevei e Nagy, 2003).
2.2.2 Fotorecettori della luce blu-UVA
E’ ormai noto da tempo che la luce blu induce varie risposte nei vegetali, influenzando processi correlati all'inibizione dell'allungamento del fusto, all'espansione fogliare, all'apertura degli stomi, al fototropismo e all'espressione genica. Solo recentemente però sono stati caratterizzati nelle piante quattro fotorecettori per la luce blu: criptocromo 1, criptocromo 2, fototropina e zeaxantina (Briggs
et al., 1999); si ritiene, tuttavia che questa non sia ancora la lista completa di quelli esistenti.
2.2.2.1 Criptocromi
I criptocromi sono fotorecettori della luce blu ritrovati sia nei vegetali che negli animali. Già nel 1950 Galston ipotizzò che le flavine fossero cromofori in grado di assorbire luce blu, ma fu l’isolamento di un mutante di Arabidopsis (hy4, ora denominato cry1), che presenta un ipocotile allungato sotto luce blu continua, a consentire la scoperta del primo fotorecettore per la luce blu di tipo flavinico (Cashmore et al., 1999).
Il gene CRY1 presenta una sostanziale omologia con le sequenze che codificano le fotoliasi procariotiche responsabili della riparazione, dipendente da luce blu e UV-A, del DNA medesimo.
CRY1 codifica per una proteina di 75 kD legata ad una flavina (FAD) e ad una pterina, così come le
fotoliasi di Classe I, la quale però non possiede attività fotoriparatrice.
I risultati degli studi di sovraespressione condotti su Arabidopsis e su tabacco hanno mostrato che le piante che contengono alti livelli di cry1 presentano ipocotili corti in presenza di luce blu ed UVA, convalidando ulteriormente l’ipotesi che il criptocromo 1 è un recettore della luce blu che regola l’allungamento dell’ipocotile (Lin et al., 1995). Inoltre, piante mutate nel locus CRY1 hanno mostrato una ridotta espressione di diversi geni normalmente indotti da luce blu.
Oltre a CRY1, è stato isolato, sia in piante che in animali, un secondo gene codificante per un altro criptocromo: CRY2. I due geni mostrano elevata omologia di sequenza nei domini aminoterminali di tipo fotoliasico, mentre hanno bassa omologia nei domini C-terminali. Nelle piante le funzioni fisiologiche di cry1 e cry2 sembrano parzialmente sovrapponibili –inibizione dell’allungamento dell’ipocotile, induzione della sintesi di antocianine, ritmi circadiani (Somers et
fioritura.
2.2.2.2 Fototropine
Nel 1995 è stato isolato in Arabidopsis,un locus genico (NPH1, Nonphototropic Hypocotyl l) che codifica una proteina di membrana essenziale per la maggior parte delle risposte fototropiche alla luce blu (Liscum, E. and Briggs, W.R., 1995). Da allora un gran numero di fototropine omologhe sono state isolate in varie specie. Tutte queste fototropine putative contengono nella parte aminoterminale due domini LOV (Light Oxygen Voltage - attivati dalla luce, dall’ossigeno o dalla tensione elettrica) che legano FMN come cromoforo e una serina/treonina chinasi nella zona carbossi-terminale; questi domini mostrano autofosforilazione luce-dipendente (Briggs et al., 2001).
2.2.3 I fotorecettori del UV-B
Il fotorecettore per l’UV-B non è ancora stato identificato, anche se in natura ci sono molti composti che assorbono questa radiazione: DNA (Walker, 1984), fitocromi (Pratt e Bulter, 1970), flavine e pterine (Gallanda e Senger, 1988), ormoni vegetali (Kulandaivelu et al., 1989) e residui aromatici delle proteine (Kim et al., 1992).
Alcuni autori ritengono che le flavine siano i più probabili recettori per l’UV-B. Ensminger e Schafer (1992) hanno ottenuto una maggiore attivazione da parte dell’UV-B della calcone-sintasi (CHS), l’enzima chiave nella biosintesi dei flavonoidi, addizionando riboflavina ai cloroplasti di prezzemolo, mentre Ballarè e collaboratori (1995) hanno dimostrato che l’inibizione indotta dall’UV-B sulla crescita dell’ipocotile in pomodoro può essere eliminata da composti chimici (quenchers) in grado di dissipare l’eccitazione delle flavine.
Il parziale sovrapporsi degli spettri di assorbimento di differenti fotorecettori, che controllano lo stesso tipo di risposta nelle regioni del blu e dell’ultravioletto, non permette una esaustiva conclusione circa la natura, il ruolo e le interazioni tra i vari pigmenti assorbenti (Lercari et al., 1990). Le risposte fotomorfogeniche alla radiazione UV potrebbero essere mediate dal fitocromo, da fotorecettori UV o da entrambi contemporaneamente e, dal momento che trattamenti con UV determinano la fotoconversione del fitocromo, non è possibile escludere un coinvolgimento del Pfr in una data risposta (Lercari et al., 1990).
2.2.4 Interazione tra i diversi fotorecettori
I vari fotorecettori possono agire indipendentemente, sinergicamente o in maniera antagonistica (Mohr, 1983). La natura dell’interazione non è ancora ben conosciuta, ma è stato ipotizzato che essa avvenga a livello della catena di trasduzione del segnale luminoso (Terzaghi e Cashmore, 1995).
3. Il pomodoro come modello nello studio della fotomorfogenesi
3.1 Pianta modello
Il pomodoro, Solanum lycopersicum, appartiene alla famiglia delle Solanacee. E’ considerato una pianta modello per gli studi di fotomorfogenesi, alternativa ad Arabidopsis (Kendrick et al., 1997). L’habitus vegetativo del pomodoro differisce da quello dell’Aradopsis in quanto frutti, plantule e semi hanno dimensioni tali da poter essere facilmente manipolati in laboratorio. A livello genetico le due specie presentano caratteristiche comuni: un genoma diploide di piccole dimensioni costituito da DNA scarsamente ripetuto e caratterizzato principalmente da geni in singola copia (Zamir e Tanksley, 1988).
In pomodoro, tutti i fitocromi sono stati identificati geneticamente ed è stata studiata la loro espressione in funzione della luce e del fotoperiodo. Sono stati inoltre clonati e sequenziati i due geni codificanti i criptocromi e molti mutanti fotomorfogenici sono attualmente disponibili.
3.2 La famiglia genica del fitocromo in pomodoro
Il genoma di pomodoro contiene cinque geni per il fitocromo, ciascuno dei quali codifica per un’apoproteina diversa. I cinque geni sono distribuiti su differenti cromosomi: PHYA, PHYB1,
PHYB2, PHYE, e PHYF si trovano, rispettivamente, sui cromosomi 10, 1, 5, 2 e 7 (Van Tuinen et al., 1997).
I nomi assegnati ai cinque fitocromi di pomodoro sono dovuti alle loro rispettive omologie aminoacidiche con i fitocromi di Arabidopsis. Ad esempio, la sequenza di PHYA di pomodoro e i polipeptidi da essa codificati sono rispettivamente per l’82% e per il 98% identici al fitocromo A di
Arabidopsis.
Hauser et al. (1997) hanno determinato la quantità di RNA messaggero, relativo ai fitocromi, presente nei semi secchi, in differenti organi della plantula ed in piante mature. Nei semi sono stati osservati tutti e cinque i tipi di mRNA con una predominanza di PHYB1. Si deve anche sottolineare che la quantità di mRNA di fitocromo trovato nei semi è comunque molto bassa.
In plantule cresciute in serra, i patterns di espressione di PHYB1 e PHYE sono praticamente uguali, mentre quelli dei trascritti degli altri fitocromi differiscono l’uno dall’altro. Il livello degli mRNA è generalmente più elevato nell’ipocotile, ad eccezione del fitocromo A, per il quale la massima concentrazione si trova nelle radici. L’ordine decrescente della quantità di trascritti trovati nelle giovani plantule è: PHYA > PHYB1 = PHYE > PHYB2 > PHYF.
Le piante mature presentano invece un altro quadro: mentre PHYA, PHYB1 E PHYE mostrano un pattern di espressione simile nei vari organi, i livelli dei trascritti di PHYB2 E PHYF raggiungono le concentrazioni più alte nei frutti in maturazione.
Questa significativa variabilità suggerisce per ciascun tipo di fitocromo un’attività biologica organo-dipendente.
3.3 La famiglia genica del criptocromo in pomodoro
In pomodoro la famiglia dei criptocromi risulta costituita da almeno quattro geni: CRY1, CRY1B,
CRY2 e CRY3 (Giliberto et al., 2005). I più studiati sono il CRY1 ed il CRY2 che si trovano,
rispettivamente, sui cromosomi 4 e 9 e codificano proteine di 679 e 635 aminoacidi. Le apoproteine CRY1 e CRY2 presentano maggior affinità con quelle di Arabidopsis che tra loro.
4. Mutanti fotomorfogenici di pomodoro
4.1 Introduzione
luminoso ha contribuito molto al rapido progresso che si è avuto negli ultimi anni nella comprensione delle funzioni del fitocromo.
Chiaramente il metodo più veloce ed efficace per isolare mutanti fotomorfogenici è quello di monitorare, in varie condizioni luminose, il fenotipo sviluppato da semi mutagenizzati, una volta che essi abbiano raggiunto lo stadio di plantula.
Lo sviluppo della plantula nelle piante superiori segue due schemi differenti: la fotomorfogenesi (che si osserva alla luce) e la scotomorfogenesi (sviluppo al buio). Una plantula che cresce al buio è caratterizzata da ipocotile allungato, da cotiledoni chiusi e giallognoli su un uncino apicale, da assenza della biosintesi di clorofilla e antocianine e dalla mancanza di un vero e proprio sviluppo fogliare. Quando viene esposta alla luce, la plantula passa dalla scotomorfogenesi alla fotomorfogenesi: il tasso di allungamento dell’ipocotile diminuisce, i cotiledoni si allargano e diventano verdi, il meristema del germoglio apicale viene attivato, inizia la sintesi delle antocianine e nasce la prima foglia vera. La transizione da scotomorfogenesi a fotomorfogenesi, essendo mediata dalla luce, necessita di un’espressione genica regolata da fotorecettori. L’allungamento dell’ipocotile, l’accumulo delle antocianine e l’espansione dei cotiledoni sono le risposte luce-dipendenti più usate al fine dell’isolamento di mutanti fotomorfogenici.
In Arabidopsis ci sono due classi di mutanti fotomorfogenici: quelli insensibili alla luce e quelli capaci di uno sviluppo fotomorfogenico anche al buio (Nagy et al., 2000). I mutanti di pomodoro differiscono sostanzialmente da quelli di Arabidopsis per vari aspetti; in particolare non sono mai stati isolati, in pomodoro, mutanti che mostrino effettiva fotomorfogenesi quando cresciuti al buio (Kendrick et al., 1997). Si possono comunque distinguere anche in pomodoro due classi di mutanti per le risposte dipendenti dalla luce: una comprende i mutanti con una indebolita fotomorfogenesi, che hanno cioè, alla luce, una morfologia che mostra aspetti peculiari di piante cresciute al buio, l’altra, include i mutanti che danno, alla luce, risposte fotomorfogenetiche amplificate, mentre presentano un normale fenotipo eziolato al buio.
I mutanti che presentano una morfologia tipica delle piante cresciute al buio, sebbene siano cresciuti alla luce, rivelano l’esistenza di regolatori positivi della fotomorfogenesi, infatti, mostrano lesioni nei geni che controllano la biosintesi del cromoforo o che codificano per l’apoproteina del fotorecettore. I mutanti che danno risposte luce-dipendenti amplificate sono associati a regolatori negativi della trasduzione del segnale luminoso.
In pomodoro, è disponibile un gran numero di mutanti che interessano tutti gli stadi della vita della pianta, dal seme alla maturazione del frutto, permettendoci così di avere un quadro completo del ruolo dei fotorecettori nell’intero ciclo ontogenetico della pianta (Kendrick et al, 1997).
4.2 Mutanti con ridotta percezione della luce
Sono stati isolati numerosi mutanti fotomorfogenici di pomodoro attraverso screening eseguiti in presenza di luce bianca, blu, rossa e rossa lontana a bassa fluenza.
4.2.1 Mutanti phyA
Indagini genetiche, spettrofotometriche, immunochimiche e fisiologiche condotte su due mutanti insensibili alla luce rosso-lontana (far-red-light-insensitive, fri), fri1 e fri2, ottenuti trattando semi di pomodoro (cv. MoneyMaker) con etil-metano-sulfonato (EMS), hanno consentito di affermare che la mutazione risulta a carico del fitocromo A (Van Tuinen et al., 1995). Inoltre, mappature genetiche del locus FRI e mappature RFLP di PHYA (il gene codificante per l’apoproteina del fitocromo A) indicano che essi hanno la stessa localizzazione sul cromosoma 10 di pomodoro (Van Tuinen et al., 1997. Questi due mutanti producono meno dell’1% del normale contenuto di apoproteina di phyA.
4.2.2 Mutanti phyB1
In pomodoro sono stati isolati quattro mutanti allelici putativi di PHYB1 (temporarily red-light insensitive: tri) (Van Tuinen et al., 1995):
Mutante Evento mutagenico e backgraund genetico Mutazione Apoproteina mutante derivata tri1 EMS cv. GT C274 - T Stop al codone 92 tri2 EMS cv. GT G3731 - A Stop al codone 962 se l’introne 2 è trattenuto; stop al codone 694 se l’esone 2 è exciso insieme agli introni 1 e 2
tri3 Variante somaclonale
cv. MM G712 - T Valina 238 sostituita da fenilalanina tri4 EMS cv. MM C3567 - T Stop al codone 907
I loci tri ed il locus genico PHYB1 sono entrambi localizzati sul cromosoma 1; è stato così concluso che tri è il gene che codifica per l’apoproteina del fitocromo B1. Ogni mutazione sembra essere il risultato di una singola sostituzione in phyB1 che va così ad influenzare sia il trascritto sia la grandezza della proteina, compromettendone la concentrazione.
4.2.3 Mutanti phyA/phyB1
Il doppio mutante phyA/phyB1 è stato ottenuto da popolazioni segreganti derivate dall’incrocio dei mutanti monogenici phyA (fri) e phyB1 (tri1). Il doppio mutante è il risultato quindi dell’incrocio di due cv. diverse: MM e GT. Esso non contiene polipeptidi immunochimicamente riconoscibili di phyA e phyB1 ed il suo fenotipo alla luce bianca è simile a quello del mutante
phyB1, dimostrando che la mancanza di phyA non limita la fotomorfogenesi in normali condizioni
luminose e che i fotorecettori residui sono sufficienti a regolare i processi fotomorfogenici (Kendrick et al. 1997).
4.2.4 Mutanti phyA/phyB1/phyB2
La ridondanza funzionale che caratterizza i fotorecettori fotomorfogenici spiega, in parte, come mai sia stato difficoltoso identificare mutanti al di là di phya e phyB1. Una strategia utilizzata per identificare nuovi mutanti è stata quella di esaminare la progenie M2 derivata da doppi mutanti
phyA/phyB1, mutagenizzati con raggi gamma(Kerckhoffs et al., 1999).
Sono stati isolati due nuovi mutanti (55H e 70F) con ipocotili allungati e ridotto contenuto di antocianine. In ciascuno dei due sono state trovate lesioni molecolari in phyB2 (55H: delezione di A4483; 70F: sostituzione di TGGGTA3900 con CGGGAG) che inducevano la produzione di
apoproteine cui mancava una significativa porzione carbossi-terminale. Le piante mature dei tripli mutanti phyA/phyB1/phyB2 sono caratterizzate da internodi, racemi fiorali, pedicelli e peduncoli enormemente allungati e da fusto e foglie pallide (Weller et al., 2001).
4.2.5 Mutanti phyB2, phyA/phyB2, phyB1/phyB2
Da un monitoraggio eseguito sia su base fenotipica sia su base molecolare (PCR) delle piante ottenute reincrociando le linee triple mutanti (phyA/phyB1/phyB2) con il wild type, sono stati trovati i mutanti monogenici phyB2 e i doppi mutanti phyA/phyB2 e phyB1/phyB2. Il fenotipo del phyB2 è
quasi identico a quello del wild type, sia come plantula sotto luce rossa che come pianta adulta cresciuta in serra. Inoltre, l’effetto della mutazione di phyB2 su una mutazione di phyA già presente - cioè nel caso del doppio mutante phyA/phyB2 – è praticamente nullo. Contrariamente, il fenotipo del doppio mutante phyB1/phyB2 presenta, rispetto sia al wild type che al singolo mutante, un allungamento più pronunciato del fusto ed un contenuto più basso di clorofilla. Allo stadio di plantula, sotto luce rossa continua, la perdita di phyB2 influisce pesantemente sul fenotipo del pomodoro phyB1.
4.2.6 Altri mutanti con ridotta percezione della luce
Piante transgeniche con una ridotta quantità di mRNA e di proteina CRY1, ottenute con la tecnica dell’mRNA antisenso, hanno dato progenie caratterizzate da ipocotile allungato e ridotto accumulo di antocianine sotto luce blu. Questa è la prima evidenza sperimentale che in pomodoro il criptocromo riveste un ruolo nella fotomorfogenesi (Ninu et al., 1999). Attraverso ulteriori studi sulle popolazioni M2 ottenute in seguito a mutagenesi con raggi gamma dei doppi mutanti
phyA/phyB1, sono stati isolati mutanti recessivi caratterizzati da maggiore lunghezza dell’ipocotile,
ridotto contenuto di clorofilla e ritardata apertura dell’uncino apicale. Questi mutanti rispondevano scarsamente alla luce blu rispetto ai loro progenitori phyA/phyB1, comportamento risultante dalle lesioni occorse al gene codificante il criptocromo 1, fotorecettore della luce blu. L’incrocio del triplo mutante phyA/phyB1/cry1 con il wild type ha consentito l’isolamento di nuove combinazioni mutanti per i fotorecettori: il monogenico cry1, i doppi phyA/cry1 e phyB1/cry1. La progenie F2 dell’incrocio tra phyA/phyB1/phyB2 e phyA/phyB1/cry1 ha successivamente prodotto mutanti quadrupli caratterizzati da un fenotipo veramente estremo: ipocotile molto allungato, gravemente privo di clorofilla e antocianine, cotiledoni piccoli rispetto a tutti gli altri genotipi. Il mutante quadruplo non era comunque in grado di sopravvivere fino alla produzione di semi. Dal confronto tra tutti i genotipi emerge che cry1, phyA, phyB1 e phyB2 contribuiscono tutti alle risposte mediate della luce blu.
Importanti indicazioni sulle funzioni dei fotorecettori potrebbero essere svelate sovraesprimendo i geni dei singoli recettori. Boylan e Quail (1989) hanno mostrato come l’espressione eterologa di phyA di avena in pomodoro provochi notevoli effetti sia nelle plantule (ipocotili corti ed elevato contenuto di antocianine) che nelle piante adulte (nane, con foglie e frutti verdi scuri).
Esiste inoltre una sottoclasse di mutanti per i fotorecettori composta dai quei mutanti cui manca solo il cromoforo del fitocromo. Essi hanno una indebolita capacità di sintetizzare la catena
tetrapirrolica del cromoforo del fitocromo. Dato che tutti i fitocromi utilizzano lo stesso cromoforo, i mutanti per il cromoforo come aurea (au) e yellowgreen-2 (yg2) sono deficitari per molte specie di fitocromo. D’altra parte, mentre nelle plantule non si trova fitocromo rilevabile con lo spettrofotometro, nelle piante adulte del mutante au si riscontra circa il 60% di quello normalmente presente nel wild type. Il fenotipo di questi mutanti è caratterizzato da ipocotile allungato e pallido alla luce bianca; anche le piante adulte mostrano un colore giallo oro ed un habitus allungato più o meno marcato a seconda del background genetico. I frutti di au si presentano invece normalmente pigmentati. Il fenotipo pallido è dovuto all’inibizione della sintesi di clorofilla conseguente alla mancanza di fitocromo. Questo mutante è stato largamente usato per studiare la catena di traduzione del segnale del fitocromo poichè inizialmente si credeva che fosse specificatamente privo di phyA (Neuhaus et al., 1993).
4.3 Mutanti con aumentata sensibilità alla luce
In pomodoro sono stati isolati anche vari mutanti ipersensibili alla luce: high pigment (hp-1 e
hp-2), atroviolacea (atv) e intense pigmentation (Ip). Il locus genico HP-1 è stato individuato e
sequenziato in pomodoro sul cromosoma 2, mentre il locus HP-2 si trova sul cromosoma 1. I due mutanti presentano, se cresciuti in condizioni luminose, ipocotili più corti, elevato accumulo di antociani e frutti maggiormente pigmentati se confrontati con il loro tipo selvatico; esprimono, quindi, una risposta amplificata alla luce.
L’analisi dei doppi mutanti phyA/hp-1 e phyB1/hp-1 ha evidenziato che la mutazione hp-1 potenzia l’efficacia di entrambi i fitocromi. Allo stesso tempo, si è visto che il fenotipo di hp-1 viene represso nel doppio mutante au/hp-1, confermando che il fenotipo hp-1, per esprimersi, necessita di un fitocromo attivo. Il mutante hp-1 presenta un contenuto di fitocromo simile a quello del wild type. Il gene hp1 è stato clonato e si è visto che in pomodoro codifica un omologo del det1 di Arabidopsis (Mustilli et al., 1999). Anche nel caso di hp-2, la mutazione è espressa solo in presenza di fotorecettori attivi.
Nel mutante hp-1 manca il gene DET. Esso consiste in un repressore delle risposte fotomorfogeniche mediate dal sistema fitocromo. Il contenuto di fitocromo totale e dei singoli fitocromi è simile a quello del tipo isogenico selvaggio.
CAPITOLO II
1.Sistematica e biologia del pomodoro
1.1 Il Pomodoro
Il pomodoro (Lycopersicon esculentum Mill.) è una solanacea originaria dell'America Latina che fu per lungo tempo coltivata in Europa a solo scopo ornamentale, poiché i frutti non erano ritenuti commestibili. Solo con l'inizio del secolo, nei paesi mediterranei, iniziò la coltivazione intensiva e la trasformazione e conservazione industriale del prodotto. In Italia la coltivazione ha una lunga tradizione ed il nostro Paese figura al terzo posto nella graduatoria mondiale per la produzione e
l'esportazione. Il pomodoro è diffuso come coltura ortiva in tutta Italia, ma in pieno campo è coltivato soprattutto in Puglia, Campania, Emilia-Romagna, Calabria e Sicilia. In base alla destinazione del prodotto si ha infatti la coltura per consumo fresco o da mensa e quella da industria per la produzione di pelati, concentrati e succhi. Il pomodoro è una pianta a fusto sarmentoso e pubescente, che si ramifica abbondantemente nelle parti più basse. Nelle varietà a sviluppo indeterminato il fusto si accresce continuamente, mentre in quelle a sviluppo determinato si arresta dopo aver emesso un certo numero di fiori e di foglie. Le infiorescenze, a grappolo, sono inserite sugli internodi e la fioritura avviene a partire dai primi palchi. Il frutto è una grossa bacca, rossa a maturità, di pezzatura e forma diversa a seconda della varietà. Il pomodoro è una pianta da clima temperato-caldo, esigendo una temperatura minima di germinazione di 12-13 °C e di 22-25°C per svilupparsi e produrre. La pianta si adatta a tutti i tipi di terreno, anche se predilige quelli di medio impasto ben drenati. Ci sono numerose tipi di varietà come: le varietà da mensa che presentano frutti tondo-globosi, lisci o costoluti, di varia dimensione i frutti sono a sviluppo indeterminato e a maturazione scalare e necessitano di sostegno. Note ed apprezzate sono le cultivar Marmande, Money Marker, Early Pack e alcuni ibridi come il Montecarlo e il Fandango. Le varietà da pelati sono di forma cilindrico- piriforme e tra esse la più nota ed apprezzata è la San Marzano, che mal si adatta alla coltura in pieno campo in quando necessita di sostegni. La produzione media è molto variabile, comunque sono da considerare buone produzioni di 700-800q/ha per il pomodoro da mensa e di 500-600 q/ha per quello da industria. I principali prodotti che si ottengono dalla lavorazione industriale del pomodoro sono i pelati, privati dalla buccia ed inscatolati, i concentrati con percentuale variabile di residuo secco tra il 12 ed il 55%, il succo di pomodoro e le salse
agrodolci. I residui della lavorazione, bucce e semi, vengono utilizzati per la preparazione di mangimi ad uso zootecnico dopo l'estrazione dell'olio dai semi.
1.1.2 Il frutto di pomodoro: aspetti anatomici
Il frutto di pomodoro, dal punto di vista botanico, è una bacca: il pericarpo, sviluppatosi da un ovario, è dunque interamente carnoso ed i semi sono contenuti all’interno delle cavità loculari (Ho e Hewitt, 1988). I frutti della specie coltivata hanno da due a molti carpelli, con un peso finale variabile da pochi grammi a qualche etto.
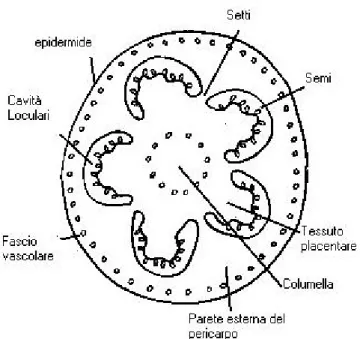
un parenchima con un fascio vascolare, e un singolo strato di cellule costituenti l’endocarpo, che riveste le cavità loculari. La parete del pericarpo è ulteriormente divisibile in parete esterna e pareti radiali (setti) che separano cavità loculari adiacenti e la parete interna detta columella. Il mesocarpo della parete esterna è composto principalmente da cellule parenchimatiche le cui dimensioni sono massime nella regione centrale e diminuiscono man mano che si procede verso l’epidermide e le cavità loculari. Anche i setti e la columella presentano le stesse caratteristiche cellulari del mesocarpo. Talvolta la columella può apparire meno colorata del pericarpo a causa dell’inclusione di ampi spazi di aria che rendono il tessuto più chiaro (Fig.2.1)
Fig 2.1- Rappresentazione dell’anatomia del frutto di pomodoro in sezione trasversale.
Accrescimento. La struttura definitiva del frutto è il risultato di una serie di profondi cambiamenti
che iniziano già a partire dalle prime fasi dell’allegagione. Durante la prima settimana di sviluppo del frutto sono osservabili cambiamenti anatomici a carico delle cellule del pericarpo. Uno, due giorni dopo l’impollinazione, i piccoli vacuoli presenti all’interno di ogni cellula si uniscono a formare un grosso vacuolo centrale (Mohr e Stein, 1969) e, nel giro di un paio di settimane il citoplasma si riduce divenendo un sottile strato confinato alla periferia cellulare. In contemporanea si ha lo stadio iniziale di separazione delle cellule, che inizia nei punti di contatto delle pareti comuni a cellule contigue e continua lungo la lamella mediana. I plasmodesmi, che costituiscono punti di continuità tra i citoplasmi di cellule adiacenti, sono molto piccoli.
Mentre ciò avviene, tutti gli organelli oltre al tonoplasto ed al plasmalemma, rimangono fisicamente intatti (Mohr e Stein, 1969) e fisiologicamente attivi (Vickery e Bruinsma, 1973). Il frutto maturo conserva infatti un alto grado di organizzazione ultrastrutturale osservata, in particolare, a carico dei mitocondri, cromoplasti e reticolo endoplasmatico rugoso (Crookes e Grierson, 1983). I plastidi contengono amido e sono dotati di un sistema tilacoidale con grana ed intergrana (Harris e Spurr, 1969). Nel frutto verde le cellule epidermiche contengono meno amido di quelle parenchimatiche più interne (Rosso, 1968). A livello di pericarpo le mitosi avvengono soprattutto nella prima settimana dopo la fecondazione (Davies e Cooking, 1965) e continuano ad un ritmo elevato anche nella seconda (Asahira et al., 1977): in questo periodo il numero delle cellule può incrementarsi da 8 a 30 volte (Smith, 1935).
L’esocarpo consiste in uno strato epidermico esterno di 2-4 strati di cellule ipodermali che costituiscono una parete e un ispessimento tipo collenchima. E’ rivestito da una sottile cuticola. La struttura cuticolare misura 4-10 µm di spessore e consiste in due regioni, uno strato di cutina che copre le cellule epidermiche e una cuticola che, a sua volta, riveste la precedente (Wilson e Sterling, 1976). Il processo di cutinizzazione può estendersi fino alle pareti radiali dell’epidermide e può interessare l’ipodermide. Questo processo di ispessimento può avere notevoli riflessi sugli scambi gassosi del frutto. Durante i primi 10 giorni di crescita del frutto la placenta comincia ad espandersi verso le cavità loculari per inglobare i semi, e riempie l’intera cavità loculare nei giorni seguenti. Nei frutti immaturi la placenta è piuttosto consistente ma, con la maturazione del frutto, le pareti cellulari degenerano ed il tessuto loculare dei frutti verdi ad accrescimento completo assume una consistenza gelatinosa. A stadi più avanzati il fluido intracellulare può accumularsi nei loculi. Nonostante questa degenerazione, i protoplasti di solito rimangono intatti.
Tasso di crescita e cambiamenti fisici. Il tasso di crescita può essere descritto da una curva ad
andamento sigmoidale suddivisibile in tre fasi. La prima è una fase di lenta crescita che si protrae per 2-3 settimane con un peso del frutto che è minore del 10% del peso finale (Archbold et al., 1982). La seconda fase, che ha una durata di 3-5 settimane, è di rapida crescita. Infine si ha un periodo di lenta crescita di due settimane durante il quale si nota un piccolo aumento di peso del frutto ed in cui hanno luogo intensi cambiamenti metabolici. La lenta crescita iniziale risulta dalla divisione e dalla successiva distensione cellulare, mentre la seguente rapida crescita è interamente dovuta alla distensione (Monselise et al., 1978) e comporta, quindi un notevole incremento nel peso fresco. Si ha, infine, una nuova fase di lento accrescimento in cui il frutto va incontro ad una serie di profondi cambiamenti anatomici, fisiologici e metabolici, che lo portano alla maturazione (Ho e Hewit, 1988).
Tra le modificazioni metaboliche una evidente anche a occhio nudo, è la variazione di colore. Il primo cambiamento di colore è già visibile 2-3 giorni dopo lo stadio verde chiaro e progressivamente evolve da giallo ad arancione ed infine a rosso. La produzione della normale colorazione rossa del pomodoro maturo è dovuta alla distruzione della clorofilla e all’intenso accumulo dei carotenoidi β-carotene e licopene nel momento in cui i cloroplasti si trasformano in cromoplasti. Sebbene i plastidi del frutto immaturo sintetizzino piccole quantità di carotenoidi, il loro accumulo all’interno del frutto prevede l’utilizzo di un separato set di enzimi che viene attivato all’inizio del processo maturativo.
Dal momento che il colore della buccia è un eccellente indicatore del grado di maturazione del frutto, sono state sviluppate alcune scale di valutazione per classificare gli stadi maturativi dei pomodori sulla base della colorazione mostrata dal frutto (Grierson e Kader, 1986).
La colorazione arancione tipica di un frutto giunto a circa metà maturazione è attribuibile all’incremento nel contenuto di β-carotene, mentre la colorazione rossa che caratterizza il frutto completamente maturo è dovuta al successivo rapido accumulo di licopene. L’accumulo di tale carotenoide nel frutto di pomodoro in maturazione ha un andamento particolare, dal momento che esso è un intermedio nella biosintesi del β-carotene. Questa apparente anormalità potrebbe essere spiegata con l’esistenza di sistemi enzimatici separati per la produzione di licopene e β-carotene; l’aver scoperto che la sintesi del licopene, ma non del β-carotene, risulta inibita da parte di temperature comprese in un range tra i 30 ed i 35°C contribuisce a sostenere l’ipotesi relativa all’esistenza di un doppio sistema enzimatico (Grierson e Kader, 1986). L’accumulo di licopene potrebbe essere inoltre spiegato attraverso l’inibizione del passaggio costituito dalla ciclizzazione, che porta normalmente alla sintesi dei caroteni.
Mentre l’aumento di dimensioni del pericarpo è correlato positivamente all’attività dell’auxina nel frutto (Asahira e Hosoki, 1977), la crescita delle cavità loculari è influenzata dallo sviluppo dei semi. La dimensione finale del pomodoro è infatti strettamente connessa con il numero o il peso dei semi e il numero delle cavità loculari (Imanishi e Hiura, 1977; Maisonneuve e Philouze, 1982). Non è comunque ancora chiaro se la crescita del frutto sia regolata direttamente dai semi o mediata indirettamente dalla auxina prodotta dai semi.
CAPITOLO III
Studi sperimentali ed epidemiologici hanno dimostrato l’importanza di una dieta ricca di composti antiossidanti nella prevenzione delle malattie cronico-degenerative. Fra i numerosi vegetali, il pomodoro ed i composti a base di pomodoro risultano essere un’importante fonte di antiossidanti naturali grazie al fatto che se ne fa ampio consumo.
Nell’ambito dei fattori in grado di influenzare il contenuto di antiossidanti in pomodoro si è considerato l’effetto delle mutazioni genetiche ed in particolare di quelle a carico dei fitocromi, i quali sono in grado di influenzare il contenuto di antiossidanti in diverse parti della pianta. Da quanto finora noto appare evidente che le condizioni luminose dell’ambiente ed i livelli e l’efficienza del sistema fotosensoriale (livelli di fitocromi, interazioni fra fotorecettori, livelli di intermedi nella catena di trasduzione del segnale luminoso…) giocano un ruolo fondamentale sull’accumulo di composti bioprotettivi in frutti di pomodoro.
L’obiettivo di questa tesi è stato quindi quello di fornire dei dati relativi al ruolo del sistema fitocromo sull’accumulo di flavonoidi in frutti di pomodoro, essendo a tutt’oggi scarse le informazioni disponibili. Nel nostro caso sono stati analizzati tramite cromatografia ad alta prestazione (HPLC) i principali flavonoidi presenti nel frutto di pomodoro quali rutina, naringenina, quercetina e camferolo che sono stati quantificati sia nella buccia che nella polpa del frutto. Le analisi sono state compiute su mutanti fotomorfogenici singoli (phyA, phyB1, phyB2, hp-1) doppi (phyA/phyB1, phyA/phyB2, phyB1/phyB2) e tripli (phyA/phyB1/phyB2) di pomodoro e relativo wild type, Money Maker. Le informazioni ottenute potranno essere utilizzate in lavori di miglioramento genetico o nella messa a punto di tecniche colturali finalizzati all’ottenimento di frutti caratterizzati da un maggiore accumulo di antiossidanti quali i flavonoidi.