1
Sommario
1. INTRODUZIONE ... 2 1.1 Epidemiologia ... 2 1.2 Fattori di rischio ... 3 2. I SISTEMI DI SCORING ... 5 3. DIAGNOSI ... 63.1 Gli esami colturali ... 6
3.1.1 Isolamento e identificazione ... 7
3.1.2 I test di suscettibilità ... 8
3.1.3 La fungicidia ... 10
3.2 I test sierologici ... 11
3.3 Altri esami non colturali ... 12
4. PREVENZIONE ... 13 5. TERAPIA ... 13 5.1 I farmaci ... 13 5.1.1 Amfotericina B ... 13 5.1.2 Azoli ... 14 5.1.3 Echinocandine ... 15 5.1.4 Flucitosina ... 16 5.2 Strategie terapeutiche ... 16 5.2.1 Profilassi ... 17
5.2.2 Terapia empirica e pre-emptive ... 18
5.2.3 Candidemia... 19
5.2.4 Altre infezioni ... 21
6. LO STUDIO ... 23
6.1 Materiali e metodi ... 23
6.2 Risultati ... 24
6.2.1 Demografia e fattori di rischio ... 24
6.2.2 Presentazione clinica ... 25 6.2.3 Candida Score ... 27 6.2.4 Sierologia ... 28 6.2.5 Microbiologia ... 28 6.2.6 Terapia ... 37 6.2.7 Outcome ... 38 6.3 Discussione ... 40
2
1. INTRODUZIONE
Il genere di lieviti Candida spp è il più importante agente eziologico fungino di infezioni umane [1]. Comunemente causa di infezioni mucocutanee, provoca sempre più spesso malattie invasive, in particolare in pazienti immunocompromessi o con rilevanti comorbidità, ed è quindi responsabile di un elevato carico di morbidità, mortalità e impegno per il sistema sanitario, soprattutto in ambito ospedaliero [2].
1.1 Epidemiologia
La Candida rappresenta il più comune genere di funghi responsabile di infezioni invasive, e rientra fra i primi dieci patogeni identificati nel sangue di pazienti ospedalizzati, con il 5-10% degli isolamenti a seconda delle casistiche [3-6]. L’incidenza delle candidiasi invasive può arrivare fino al 10% dei pazienti ospedalizzati, con un picco in quelli ricoverati nei reparti di terapia intensiva [7].
La mortalità di queste infezioni è molto alta, anche se in molti casi attribuibile alla gravità del quadro sottostante [8]. Il rischio di mortalità aumenta con l’età del paziente, superando il 50% nei pazienti di età superiore a 65 anni [9].
La sede più frequente di isolamento è il sangue: le candidemie rappresentano da sole il 70%-90% delle candidiasi invasive, con o senza un focus localizzato. La seconda sede più frequente è la cavità peritoneale [1]. La candidemia si associa inoltre allo sviluppo di endoftalmite, che rappresenta una complicanza caratteristica della patologia [10, 11]. La specie di più frequente riscontro è Candida albicans, anche se stanno aumentando le infezioni da forme non-albicans, in particolare nei pazienti ricoverati nei reparti di terapia intensiva [12, 13]. C. albicans costituisce ancora la maggioranza assoluta delle infezioni da Candida in Europa, ma in America le infezioni da non-albicans sono già più del 50% [14].
La distribuzione delle specie non-albicans dipende dalla zona geografica, ma le due più frequenti sono Candida glabrata e Candida parapsilosis [2], seguite da Candida tropicalis, Candida krusei, Candida guilliermondii e Candida lusitaniae [15]. C. glabrata tende a infettare pazienti di età elevata o con patologie croniche o
neoplastiche sottostanti [16, 17], mentre C. parapsilosis si associa alla presenza di cateteri intravascolari [2] ed è una causa frequente di endocardite nei tossicodipendenti [18]. C. krusei colpisce soprattutto pazienti immunocompromessi [16].
3 La crescente incidenza di infezioni da specie non-albicans può essere attribuita all’uso estensivo di fluconazolo come profilassi antifungina e al frequente impianto di cateteri venosi centrali [19]. C. Glabrata e C. krusei sono frequentemente resistenti agli azoli, e in un crescente numero di casi anche all’amfotericina B; C. parapsilosis mostra invece ridotta suscettibilità alle echinocandine [20, 21]. In generale le infezioni da non-albicans sono più frequentemente dovute a ceppi resistenti e sono quindi più difficili da eradicare: la loro mortalità è di conseguenza superiore a quella delle infezioni da C. albicans [1]. La mortalità più alta è stata associata a C. krusei, mentre la più bassa è dovuta a C.
parapsilosis. C. albicans, C. glabrata e C. tropicalis hanno mortalità intermedia [9]. 1.2 Fattori di rischio
Sono stati riconosciuti numerosi fattori di rischio per l’insorgenza di una candidiasi invasiva.
Un importante fattore è la colonizzazione cutaneo-mucosa da parte del fungo, che
predispone al rischio di sviluppare una forma invasiva. È stato visto che il rischio correla con l’intensità di colonizzazione, intesa sia come densità di crescita sia come numero di siti coinvolti; in particolare, la presenza di Candida in più del 50% di almeno 3 siti
esaminati è legata a un alto rischio di malattia invasiva [22]. La colonizzazione può essere favorita da una prolungata terapia antibiotica, che espone a un’alterazione della normale flora microbica e quindi alla selezione di specie fungine [23]. La terapia antibiotica rappresenta infatti uno dei principali fattori di rischio riconosciuti per la patologia [24]. L’invasione fungina è favorita da una riduzione delle difese dell’ospite
(immunosoppressione, diabete) o dall’utilizzo di procedure invasive che possono lesionare l’integrità della barriera cutaneo-mucosa (cateteri intravascolari, chirurgia maggiore) [23]. In particolare, i maggiori fattori di rischio identificati comprendono una pregressa
chirurgia addominale, la presenza di un catetere venoso centrale, l’uso di nutrizione parenterale totale, il diabete mellito; altri fattori sono l’età, le ustioni, l’insufficienza renale, la dialisi, la BPCO, l’uso prolungato di corticosteroidi sistemici [2, 25-27]. Queste condizioni sono frequenti nei pazienti ospedalizzati, a conferma del fatto che la candidiasi invasiva è un’infezione a carattere nosocomiale [2].
Il diabete può agire nel favorire l’insorgenza dell’infezione attraverso due meccanismi: la disfunzione di neutrofili e linfociti legata all’iperglicemia e la malattia microvascolare che facilità un danno splancnico [28].
4 Un altro fattore che favorisce l’infezione è un soggiorno prolungato in un reparto di terapia intensiva, dove le numerose procedure invasive facilitano l’invasione da parte del fungo [23]. La candidiasi è tipicamente un’infezione tardiva, che insorge in media dopo circa 20 giorni di degenza in una terapia intensiva, differenziandosi così dalle infezioni batteriche che insorgono molto più precocemente [3, 29].
La candidiasi è inoltre favorita dall’immunosoppressione: ad esempio, pazienti con infezione da HIV in stadio avanzato sono ad alto rischio di sviluppare l’infezione [30]. L’alterazione immunologica più frequentemente associata alla candidiasi è la neutropenia [16], che rappresenta un importante fattore di rischio per tutte le specie di candida [31]: le classiche categorie ad alto rischio sono infatti rappresentate da pazienti con neoplasie ematologiche, pazienti sottoposti a trapianto di midollo e pazienti neoplastici sottoposti a chemioterapia [32, 33]. Con l’introduzione della profilassi antifungina, la frequenza di infezione in queste categorie si è notevolmente ridotta, in parallelo con l’aumento dei casi legati alle procedure mediche invasive. La terapia antifungina si è anche resa responsabile in questi pazienti di uno shift verso le infezioni da forme non-albicans [34].
Sono stati identificati fattori di rischio specifici per le varie specie di Candida non albicans: C. parapsilosis è legata a procedure invasive, età neonatale e nutrizione parenterale; C. glabrata a chirurgia, cateteri vascolari o urinari e profilassi con azoli; C. krusei alla profilassi antifungina; C. tropicalis a neutropenia, trapianto di midollo e
profilassi antifungina; C. lusitaniae e C. guilliermondii all’uso di polieni; C. rugosa alle ustioni [15].
In conclusione, i principali fattori di rischio identificati per lo sviluppo di una candidiasi invasiva comprendono:
Colonizzazione da Candida Prolungata terapia antibiotica Chirurgia addominale maggiore Cateteri intravascolari
Nutrizione parenterale Diabete mellito
Soggiorno in terapia intensiva maggiore di 7 giorni Immunosoppressione (in particolare neutropenia).
5
2. I SISTEMI DI SCORING
I sistemi di scoring consistono nell’attribuzione di un punteggio a vari fattori di rischio in modo da ottenere un numero predittivo del rischio di sviluppare una candidiasi invasiva: quando il risultato supera una certa soglia è ritenuto utile iniziare una terapia antifungina preventiva. Questi sistemi hanno un basso valore predittivo positivo ma un alto valore predittivo negativo: la loro utilità consiste soprattutto nell’evitare un eccessivo ricorso alla terapia profilattica [23].
Uno dei primi sistemi ideati è il Candida Colonization Index (CCI), risalente al 1994 [22]. Il CCI consiste nel rapporto fra il numero di siti non sterili positivi per Candida e il
numero di siti campionati: un rapporto maggiore di 0,5 indica un’elevata intensità di colonizzazione e correla con il rischio di sviluppare una forma invasiva [22, 35]. Questo sistema ha avuto un impatto limitato a causa dei costi e delle difficoltà di applicazione nell’uso routinario [23].
In seguito sono stati sviluppati altri sistemi di scoring:
Nel 2003 è stato creato un sistema per prevedere il rischio di peritonite da Candida attraverso la combinazione di 4 fattori di rischio: genere femminile, origine dal tratto gastrointestinale superiore, collasso cardiovascolare
intraoperatorio e precedente terapia antibiotica [36].
Nel 2005 è stato ideato un sistema che prevede una combinazione fra soggiorno maggiore di 3 giorni in terapia intensiva, diabete mellito, emodialisi, nutrizione parenterale totale e terapia antibiotica ad ampio spettro [37].
Nel 2007 questo sistema è stato implementato, indicando la necessità di terapia antifungina in pazienti con precedente terapia antibiotica o CVC più almeno due fra nutrizione parenterale totale, dialisi, chirurgia maggiore, pancreatite, uso di steroidi e uso di immunosoppressori [38].
Nel 2011 una nuova modifica prevede la presenza di ventilazione meccanica, CVC, terapia antibiotica ad ampio spettro e almeno uno fra gli altri fattori di rischio identificati [39].
Il sistema che ha avuto maggiore successo è però il Candida Score (CS). Il CS, ideato e valutato da León et al con due studi nel 2006 e nel 2009, è un sistema a punteggio che permette di prevedere il rischio di sviluppare una candidiasi invasiva in pazienti critici non neutropenici, identificando così quelli che potrebbero beneficiare di un trattamento
6 preventivo [40, 41]. Ulteriori studi hanno confermato la validità del CS, evidenziando inoltre l’assenza di differenze fra pazienti medici e pazienti chirurgici [42-45].
Il CS prevede la valutazione di quattro parametri: Pregressa chirurgia maggiore.
Colonizzazione multifocale, intesa come l’isolamento della Candida da almeno due siti non contigui.
Nutrizione parenterale totale.
Sepsi severa, definita come la presenza di sepsi associata a segni di disfunzione d’organo [46].
Ai primi tre viene assegnato un punto, mentre all’ultimo vengono assegnati due punti. Nei pazienti con CS inferiore a 3 è altamente improbabile lo sviluppo di una candidiasi
invasiva (rischio < 5%); la presenza di un CS maggiore o uguale a 3 identifica invece pazienti ad alto rischio nei quali è utile iniziare una terapia antifungina [41].
Uno studio del 2009 ha identificato i livelli ematici di procalcitonina come possibile ulteriore parametro per il CS [47], ma tale ipotesi è stata successivamente smentita [48].
3. DIAGNOSI
L’esame colturale rappresenta il gold standard per la diagnosi di una candidiasi invasiva. Sfortunatamente le colture richiedono un certo periodo di latenza per positivizzarsi, portando così alla dilazione del trattamento, che contribuisce ad aumentare la morbidità e la mortalità della patologia. Per questo sono state sviluppate varie strategie per permettere una diagnosi più precoce: queste comprendono i sistemi di scoring, i marker sierologici e altri test non colturali [1].
3.1 Gli esami colturali
Gli esami colturali rappresentano il gold standard diagnostico per questa patologia: la crescita di una specie di Candida da un sito normalmente sterile permette infatti di
stabilire definitivamente una diagnosi di candidiasi invasiva. Le colture permettono inoltre di identificare la specie infettante e di elaborare un antimicogramma che guidi la scelta terapeutica [2, 23].
La sensibilità delle colture non è ottimale: nonostante il miglioramento e la
7 inoltre un periodo di latenza di almeno 24-48 ore prima di poter identificare la specie e conoscere le suscettibilità agli antifungini [1, 23]. L’associazione con i sistemi di scoring e con i test non colturali successivamente descritti permette un incremento della sensibilità e una maggiore precocità della terapia [23, 49].
3.1.1 Isolamento e identificazione
I terreni liquidi comunemente usati per le emocolture permettono la crescita della Candida, e per questo possono essere usati routinariamente per l’individuazione delle candidemie [50-55]. Le preparazioni aerobie sono quelle con la sensibilità più elevata, mentre quelle anaerobie hanno scarsa efficacia e sono utili soprattutto come esame complementare alle precedenti [50, 51, 56]. Alcuni suggeriscono la possibilità di usare anche terreni liquidi specifici per miceti, ma il loro costo e lo scarso miglioramento della performance rispetto alle preparazioni tradizionali ne hanno impedito un uso estensivo [50, 56]; questi terreni sembrano inoltre avere una ridotta sensibilità in corso di terapia antifungina [51]. Un'altra possibilità per aumentare la sensibilità delle colture è
l’esecuzione di una subcultura di controllo su terreni solidi per funghi in caso di emocolture negative [50, 55].
Il tempo di positivizzazione (time to positivity, TTP) di un’emocoltura per Candida è maggiore rispetto a quello della maggioranza dei batteri: il tempo medio è in fatti di circa 25-30 ore, senza differenza significative fra C. albicans e specie non-albicans [57, 58]. Un’eccezione è costituita da C. glabrata, che ha un TTP decisamente più lungo; C. tropicalis ha invece un TTP molto breve [57]. Le candidemie da CVC hanno un TTP più breve rispetto alle altre, mai superiore alle 30 ore [58].
Quando un’emocoltura risulta positiva, viene effettuato un esame microscopico con la colorazione di Gram per individuare la presenza di cellule batteriche o fungine [59]. A questo punto il laboratorio deve avvertire immediatamente il clinico che ha in cura il paziente del risultato dell’esame, in modo da instaurare una terapia adeguata; ciò è
particolarmente importante in caso di riscontro di funghi, poiché è raro che un antifungino venga prescritto empiricamente. Se vengono identificate cellule di lievito, il preparato viene seminato su terreni solidi specifici: il terreno classico per la crescita dei lieviti è l’agar di Sabouraud [59, 60], ma oggigiorno sono stati sviluppati vari terreni cromogenici, capaci di assumere un colore diverso a seconda della specie presente e quindi di
8 L’identificazione definitiva della specie viene generalmente fatta con i test biochimici, siano essi manuali o, più frequentemente, automatici. Questi test permettono di
riconoscere la specie in base al risultato di varie reazioni, di cui le più importanti sono quelle di assimilazione degli zuccheri (glucosio, maltosio, saccarosio, trealosio, lattosio, ecc.) [59, 65-70].
Esistono poi altre tecniche meno usate per l’identificazione della specie. Il metodo classico per la distinzione fra C. albicans e forme non-albicans è l’individuazione della formazione di tubuli germinativi dopo incubazione ad alte temperature: i tubuli si formano infatti solo in C. albicans e C. dubliniensis [71-75]. Altri metodi sono l’esame
microscopico diretto della morfologia del lievito [59, 70] e l’uso di sonde FISH [76, 77]. Quando il campione da esaminare consiste in un prelievo bioptico tissutale, è possibile eseguire un esame istologico, nel quale la Candida è riconoscibile dall’associazione di blastocellule e forme filamentose (pseudoife e ife vere) [78].
3.1.2 I test di suscettibilità
Gli esami colturali permettono l’esecuzione di test di suscettibilità ai vari farmaci
antifungini, in modo da conoscere quelli più efficaci contro il ceppo in questione [20, 21]. La sensibilità del fungo viene espressa con la MIC (minima concentrazione inibente), cioè con la minima concentrazione del farmaco capace di inibirne la crescita. La correlazione della MIC con l’outcome clinico non è ancora ben definita: anche se si ritiene che MIC elevate siano indicative di una cattiva risposta alla terapia, non sempre esiste una chiara corrispondenza fra valori in vitro e risultati in vivo [20, 79, 80].
Esistono vari metodi per definire la MIC. La diluizione in brodo rappresenta la metodica di riferimento: la MIC è definita come la più bassa concentrazione di farmaco che produce una prominente riduzione di torbidità della sospensione (>50%); per l’amfotericina B è invece la più bassa concentrazione senza una crescita visibile [20, 79, 81]. La lettura viene effettuata a 24 o 48 ore e può essere visuale o spettrofotometrica [79, 81]. Fino al 5% degli isolati può presentare il fenomeno del trailing: in questi isolati la MIC per gli azoli indica un fenotipo sensibile a 24 ore, ma aumenta drasticamente a 48 ore fino a indicare un fenotipo resistente [20, 79, 82]. Da alcuni studi sembra che questi isolati siano
suscettibili, e che quindi la MIC da prendere in considerazione sia quella a 24 ore [79, 82-84].
9 Sono stati introdotti vari metodi commerciali, fra i quali i più importanti sono l’E-test e il Sensititre. L’E-test consiste in una striscia imbevuta di concentrazioni scalari di
antifungino e posta sulla piastra contenente il fungo: la MIC è data dal punto di intersezione fra la striscia e l’alone di inibizione generatosi attorno a essa [20, 79]. Il Sensititre consiste invece in una serie di pozzetti, contenenti concentrazione scalari dei farmaci, nei quali viene inoculato il brodo: la MIC corrisponde al primo pozzetto nel quale non avviene un viraggio di colore dal blu al rosso, indice di mancata crescita fungina [20, 85].
Vari studi sono stati effettuati per verificare la concordanza fra i test commerciali e il metodo di riferimento. A parte qualche eccezione, i due metodi sono risultati comparabili e utilizzabili per l’elaborazione routinaria dell’antimicogramma [20, 85-94]. Le maggiori incertezze sembrano riguardare la scarsa attendibilità dell’E-test per la sensibilità alle echinocandine di C. parapsilosis e C. tropicalis e di entrambi i metodi per la sensibilità agli azoli di C. glabrata [20, 89-92].
L’interpretazione di una MIC necessita di breakpoint, in base ai quali è possibile classificare un ceppo come S (sensibile) o R (resistente). Per gli azoli esiste anche una categoria intermedia definita S-DD (sensibile dose dipendente), nella quale sono necessarie livelli ematici massimali del farmaco per ottenere un effetto [21, 79].
La suscettibilità in vitro varia in funzione della specie, del ceppo e del farmaco testato [20, 80]. In generale la maggioranza dei ceppi di Candida risulta sensibile agli antifungini, con C. albicans che mostra la maggiore suscettibilità. C. glabrata e C. krusei hanno le MIC più alte per gli azoli, mentre C. parapsilosis ha la MIC più alta per le echinocandine [80]. Il farmaco con la MIC più bassa è l’amfotericina B, che risulta attivo contro quasi tutte le specie [20, 80], a eccezione di C. lusitaniae e alcuni isolati di C. glabrata e C. krusei [21]. Le echinocandine sono molto attive contro C. albicans, C. glabrata e C. krusei e poco efficaci contro C. guilliermondii e C. parapsilosis; gli azoli sono efficaci su tutte le specie a eccezione di C. glabrata e C. krusei [20]. Se viene riscontrata una MIC elevata in specie normalmente suscettibili, può essere utile l’esecuzione del test di riferimento per
confermare la presenza di resistenza [20].
In definitiva, l’antimicogramma rappresenta un valido contributo nella scelta della terapia, anche se la presenza di numerose variabili, fra cui i fattori dell’ospite, impedisce alla MIC di essere un corretto predittore della risposta clinica. Un ulteriore aiuto può venire dalla conoscenza delle specie di Candida e delle loro suscettibilità [21, 79].
10
3.1.3 La fungicidia
L’aumento di incidenza delle infezioni fungine ha portato a considerare la necessità di valutare, oltre alla MIC, anche l’attività fungicida dei vari farmaci. L’attività fungicida è stata definita come la capacità di uccidere più del 99,9% delle colonie dell’inoculo iniziale (riduzione di 3 unità logaritmiche) [95]. La determinazione della fungicidia è ancora problematica e necessita di standardizzazione: oltre ai fattori di interferenza presenti anche nei test di battericidia, si aggiungono anche problematiche peculiari, come la maggiore complessità della cellula fungina, la sua variabilità morfologica o il pattern di crescita più lento [79, 95].
Il gold standard per la determinazione dell’attività fungicida è la definizione della quantità di tessuti fungini residui in modelli animali dopo esposizione al farmaco. Nella routine laboratoristica vengono invece utilizzati test in vitro come gli studi di cinetica della fungicidia o la determinazione della MFC [95].
Gli studi di cinetica consistono nella valutazione dell’effetto di diverse concentrazioni del farmaco, multiple della MIC, a determinati intervalli di tempo. Inizialmente vengono preparate delle sospensioni fungine cui vengono aggiunte le varie dosi del farmaco; successivamente si procede all’esecuzione di subculture a intervalli stabiliti e alla conta delle colonie formatesi; con i valori ottenuti vengono quindi costruite delle curve che mostrino la variazione di crescita fungina nel tempo. Questi studi sono più accurati nella definizione della fungicidia, ma la loro complessità li rende di difficile utilizzo
nell’attività routinaria [95, 96].
L’MFC (minima concentrazione fungicida) è la più bassa concentrazione di farmaco capace di determinare una riduzione maggiore del 99,9% (o di 3 unità logaritmiche) delle CFU/mm rispetto all’inoculo iniziale [95]. La sua maggiore praticità la rende un valido sostituto per le valutazioni di routine [18].
Vari studi hanno ipotizzato che l’MFC abbia maggiore valore predittivo rispetto alla MIC per quanto riguarda l’outcome clinico [79, 80, 97]: ciò è particolarmente vero per i pazienti immunocompromessi oppure per le infezioni di determinati siti corporei, difficili da raggiungere (SNC, osso) o particolarmente critici (valvole cardiache) [79, 95].
I valori della MFC variano a seconda del farmaco e della specie testati. In genere l’MFC è correlata con la MIC [95], anche se è stato dimostrato che a seconda della specie la stessa MIC può corrispondere ad attività fungicide diverse [18]. Gli azoli non hanno attività
11 fungicida contro Candida, e per questo non vengono testati per l’MFC nell’attività clinica [80, 95]; le echinocandine sono invece fungicide verso la maggioranza degli isolati [95, 98-100]. L’amfotericina B ha una forte attività fungicida, in particolare contro C. albicans e C. dubliniensis; l’attività più bassa è invece quella diretta contro C. krusei e C. tropicalis [18, 80, 95].
In conclusione, l’attività fungicida, misurata comunemente con l’MFC, rappresenta un parametro utile per la scelta della terapia e un possibile predittore dell’outcome clinico del paziente.
3.2 I test sierologici
I principali marker sierologici per le infezioni da Candida sono il mannano e il glucano [23].
I test più diffusi sono quelli che identificano il mannano, un antigene della parete cellulare specifico per il genere Candida. Sono stati condotti numerosi studi su questo antigene, con risultati discordanti: nella maggioranza dei casi è stata però messa in evidenza un’alta specificità (80-100%) a fronte di una sensibilità relativamente bassa (40-70%) [101-107]. La bassa sensibilità è probabilmente legata alla rapida clearance dell’antigene [108]. La sensibilità più alta è stata associata a infezioni da C. albicans, mentre la più bassa è legata a infezioni da C. parapsilosis [35, 109, 110].
Nonostante la bassa sensibilità, il test si è dimostrato utile per la diagnosi precoce di una candidiasi invasiva. L’esecuzione di più misurazioni in successione temporale può ovviare alla transitorietà della mannanemia, permettendo quindi di migliorare la sensibilità del test [101]. Un altro metodo per aumentare la sensibilità è la contemporanea misurazione degli anticorpi anti-mannano: l’associazione dei due test permette infatti di avere risultati migliori rispetto a quelli dei singoli test isolati [103, 105-107, 110]. Un'altra possibilità è la combinazione fra i test sierologici e i sistemi di scoring [111].
Più recentemente è stato introdotto un test per la misurazione dell’ (1,3)-β-D-glucano (BDG), un antigene di parete comune a molti tipi di funghi, in particolare Candida e Aspergillus [112]. Vari studi hanno dimostrato l’utilità di questo test per la diagnosi precoce delle infezioni fungine invasive [107, 112-114].
Il BDG ha dimostrato un’elevata sensibilità (70-100%) per le candidiasi invasive, che però può essere ridotta da una concomitante terapia antifungina, in particolare con
12 echinocandine [112]. L’antigene ha inoltre dimostrato una bassa specificità (50-60%), legata da un lato alla sua presenza in molti tipi di funghi e dall’altro a un alto numero di falsi positivi [112, 114]. Sono stati identificati numerosi fattori che potrebbero dare falsi positivi: emodialisi con membrane di cellulosa [115]; somministrazione di emoderivati (albumina, immunoglobuline, fattori della coagulazione) attraverso particolari tipi di filtri [116]; garze chirurgiche contenenti glucano [117]; uso di alcuni antibiotici [118];
concomitanti batteriemie, in particolare da gram-positivi [119]; mucositi severe [120]. La ricerca combinata di mannano e BDG può essere utile per ridurre il numero di falsi positivi [107]. Questi problemi, assieme ai costi elevati, hanno impedito la diffusione di questo test per la diagnosi precoce di una candidiasi invasiva [1]: la sua utilità è legata soprattutto alla possibilità di individuare pazienti con un’aspecifica infezione fungina invasiva, principalmente da Candida o Aspergillus [112].
Recentemente alcuni studi hanno mostrato una correlazione fra i livelli di BDG e la prognosi dell’infezione: questo test potrebbe quindi essere usato anche per valutare la risposta dell’infezione alla terapia antifungina [121, 122].
In conclusione, i test sierologici hanno una loro utilità nella diagnosi delle candidiasi invasive, ma necessitano di essere integrati con altri tipi di valutazione diagnostica. 3.3 Altri esami non colturali
La ricerca del DNA del fungo tramite PCR è un metodo rapido che ha dimostrato elevate sensibilità e specificità [107, 108, 123-126]. La ridotta quantità di DNA disponibile, dovuta alla resistenza della parete cellulare ai metodi di estrazione, può portare alla presenza di falsi negativi; falsi positivi sono invece imputabili alla contaminazione ambientale o a fenomeni di cross-reattività [125]. Inoltre non è ancora chiara la correlazione con l’outcome clinico [126]. Questi problemi, assieme alla mancanza di metodi commerciali facilmente adoperabili, hanno impedito la diffusione di questo test nella pratica clinica [23].
Il MALDI-TOF è un sistema di spettrometria laser capace di identificare specifiche proteine micotiche. Vari studi ne hanno dimostrato la rapidità e l’elevata concordanza con gli esami colturali, rendendolo un test promettente per l’identificazione rapida delle specie infettanti [127-133]. La sua maggiore debolezza consiste nell’incapacità di fornire risultati attendibili in caso di infezioni miste da diverse specie fungine [127].
13
4. PREVENZIONE
L’acquisizione esogena gioca un ruolo limitato nelle infezioni da Candida: ciò nonostante, appare utile una corretta igiene delle mani da parte degli operatori sanitari per prevenire la trasmissione del fungo fra pazienti. Altre misure per il controllo delle infezioni sono un uso razionale della terapia antibiotica, in modo da limitare lo sviluppo di colonizzazione, e una corretta gestione dei cateteri venosi centrali. In pazienti selezionati ad alto rischio può essere utile una terapia profilattica [2].
5. TERAPIA
5.1 I farmaciI farmaci efficaci per il trattamento di una candidiasi invasiva ricadono in quattro categorie: amfotericina B, azoli, echinocandine e flucitosina [17].
5.1.1 Amfotericina B
L’amfotericina B appartiene alla categoria dei polieni [134] ed è stata a lungo lo standard per il trattamento delle candidiasi invasive [17]. Agisce interagendo con gli steroli di membrana (in particolare l’ergosterolo) in modo da determinare la formazione di pori che portano alla morte della cellula [2, 134]; pur legandosi più avidamente alle cellule
fungine, presenta una certa attività anche contro le cellule di mammifero [134].
Ha azione fungicida [2] e viene somministrata esclusivamente per via endovenosa [134]; ha scarsa penetrazione tissutale ma in caso di infiammazione riesce a raggiungere elevate concentrazioni nell’essudato [134].
Lo sviluppo di resistenza è raro e avviene attraverso il riorientamento o la ridotta sintesi dell’ergosterolo, in modo da rendere la cellula meno responsiva [2, 135].
Gli effetti collaterali sono frequenti: i principali sono l’ipersensibilità all’infusione (febbre, brividi, vomito) [2, 134], l’ipokaliemia [134, 136] e soprattutto la nefrotossicità [2, 17, 134, 136]. Fino all’80% dei pazienti presenta una certa compromissione della funzionalità renale [2], e in molto casi è possibile sviluppare un’insufficienza renale acuta [136].
La preparazione classica è l’amfotericina B deossicolato (Fungizone) [17]; a questa si sono aggiunte le formulazioni contenenti lipidi, di cui le principali sono l’amfotericina B liposomiale (AmBisome) e l’amfotericina B in complessi lipidici (Abelcet) [21]. Le
14 formulazioni lipidiche hanno una migliore farmacocinetica, che consente una minore tossicità senza variazioni di efficacia [2, 17, 136-139]: per questo stanno progressivamente sostituendo la forma classica, inizialmente nei soggetti ad alto rischio di nefrotossicità (terapia prolungata, disfunzione renale preesistente, uso di altri agenti nefrotossici) e successivamente anche negli altri pazienti trattati [17, 134, 140, 141].
5.1.2 Azoli
Gli azoli utilizzati per il trattamento delle candidiasi invasive comprendono fluconazolo, itraconazolo, posaconazolo e voriconazolo [2, 17]. Agiscono inibendo la lanosina 14α-demetilasi, un enzima citocromo P450-dipendente responsabile della conversione del lanosterolo in ergosterolo: la deplezione di ergosterolo dalla membrana fungina porta a una perdita di stabilità della stessa e quindi a un arresto della replicazione [2, 134, 142, 143]. Ciascun azolo ha un differente spettro antifungino [2], ma tutti mostrano attività esclusivamente fungistatica contro il genere Candida [80].
La resistenza agli azoli è comune, in particolare in C. glabrata e C. krusei [17, 20], e può avvenire attraverso vari meccanismi: aumentata concentrazione e ridotta affinità al
farmaco delle proteine target [144, 145]; iperespressione della sintesi di ergosterolo [146]; ridotto uptake o aumentata espulsione del farmaco dalle cellule [146-149]. È stata
descritta la presenza di cross-resistenza in vitro fra fluconazolo e voriconazolo [150, 151]. L’assenza di ergosterolo nella membrana cellulare dei mammiferi rende l’azione degli azoli selettiva per le cellule fungine [2]. Gli azoli possono però inibire molti enzimi dipendenti dal citocromo P450, e per questo possono interagire con numerosi farmaci, come le benzodiazepine o il warfarin [2, 17]; ad alte dosi possono inibire la sintesi degli ormoni steroidei [134]. Gli azoli dovrebbero inoltre essere evitati nelle donne incinte per il rischio di difetti alla nascita [17].
Il fluconazolo rappresenta l’azolo più utilizzato per il trattamento delle candidiasi invasive [17]. Può essere somministrato per via orale o endovenosa [134]; nel primo caso ha
un’elevata biodisponibilità (90%) e il suo assorbimento non è influenzato dall’assunzione di cibo né dal pH gastrico [17]. È capace di raggiungere elevate concentrazioni nel liquido cefalorachidiano e nel corpo vitreo dell’occhio [152], e per questo è usato nelle infezioni oculari e nelle meningiti [17]. È escreto immodificato con le urine, dove raggiunge concentrazioni fino a 20 volte maggiori di quelle del sangue [17, 134].
15 L’itraconazolo è somministrato per via orale ed è generalmente riservato alle infezioni superficiali, mentre il suo uso nelle forme invasive è limitato [17, 134]. Esistono due formulazioni orali: una in capsule, il cui assorbimento è aumentato dal cibo e dalle bevande acide e diminuito dall’uso di inibitori di pompa protonica e anti-H2, e una in soluzione, che è meglio assorbita a stomaco vuoto [17, 153, 154]. Le concentrazioni sieriche sono molto variabili, per cui è indicato monitorare i livelli ematici del farmaco [17]. Esiste anche una preparazione per la somministrazione endovena che potrebbe essere usata per il trattamento delle candidiasi invasive, ma la sua diffusione è tuttora limitata [21, 134].
Il voriconazolo è disponibile sia per via orale, sia per via endovenosa [17]. La forma orale ha una biodisponibilità attorno al 90% e il suo assorbimento è ridotto dall’assunzione di cibo; inoltre richiede un aggiustamento della dose in caso di insufficienza epatica [17]. Con la forma endovena si può avere un accumulo del solvente ciclodestrina in caso di insufficienza renale [155], e per questo non è indicato il suo uso con una clearance della creatinina inferiore a 50 ml/min [17]. La concentrazione sierica presenta notevole variabilità a causa dei polimorfismi del gene che metabolizza il farmaco; è quindi necessario un monitoraggio dei livelli ematici, in modo da evitare valori tossici o
inefficaci [17, 156, 157]. L’uso di voriconazolo è indicato in caso di infezioni resistenti al fluconazolo, principalmente da C. glabrata e C. krusei [1, 17].
Il posaconazolo è disponibile solo per via orale [2]: ha un’elevata biodisponibilità, soprattutto se associato a cibi grassi e a pH gastrico acido [17], ma l’assorbimento è saturato a bassi dosaggi, per cui sono necessarie più somministrazioni giornaliere [158]. Non è indicato come terapia primaria della candidiasi invasiva, anche se le indagini in vitro dimostrano una buona attività contro Candida, simile a quella del voriconazolo [17].
5.1.3 Echinocandine
Le echinocandine comprendono la caspofungina, la micafungina e l’anidulafungina [2, 17]. Agiscono inibendo la sintesi dell’(1,3)-β-D-glucano, un polimero del glucosio necessario per la stabilità della parete cellulare fungina [2, 134, 159-161]. A causa
dell’assenza della parete nelle cellule di mammifero, le echinocandine hanno scarsi effetti collaterali [2], anche se dovrebbero essere usate con cautela in caso di gravidanza [17]. La somministrazione è esclusivamente endovenosa [2, 17]. Non ci sono rilevanti differenze fra i tre farmaci: hanno lunga emivita, vengono somministrate una volta al giorno e non richiedono aggiustamento della dose in casi di insufficienza renale [17,
159-16 161]; per la caspofungina è raccomandata una riduzione della dose in caso di insufficienza epatica moderata-severa [159]. Non passano la barriera ematoencefalica, e quindi non possono essere usate per il trattamento delle meningiti [2].
La resistenza è rara [2] e avviene tramite l’insorgenza di mutazioni nel gene della proteina target [162]. È possibile lo sviluppo di cross-resistenza fra le varie echinocandine [163]. La specie che dimostra la minore sensibilità a questi farmaci è C. parapsilosis [20].
5.1.4 Flucitosina
La flucitosina (o 5-fluorocitosina) è un antimetabolita che interferisce con il metabolismo delle pirimidine, bloccando la sintesi del DNA [2, 134, 164].
Generalmente viene somministrata per via endovenosa, ma può essere data anche per via orale [134]. In caso di insufficienza renale è necessario un aggiustamento della dose [134, 165].
Le resistenze insorgono rapidamente e consistono in una ridotta captazione da parte delle cellule e in una ridotta conversione intracellulare nella forma attiva [2, 164, 166]. A causa della facilità di insorgenza di resistenza la flucitosina non è mai somministrata in
monoterapia, ma sempre in associazione con l’amfotericina B, che agendo sulla membrana permette anche una migliore penetrazione cellulare [2, 134].
Il suo uso è limitato alle infezioni gravi (endocardite, meningite) in aggiunta all’amfotericina B [17].
5.2 Strategie terapeutiche
Esistono quattro possibili strategie terapeutiche per la prevenzione e il trattamento delle candidiasi invasive [1, 2]:
Terapia profilattica, diretta contro soggetti ad alto rischio senza evidenza d’infezione.
Terapia pre-emptive, per soggetti a rischio senza evidenza d’infezione ma con positività dei marker microbiologici (colonizzazione, mannano, (1,3)-β-D-glucano, test molecolari).
Terapia empirica, in caso di sospetta candidiasi invasiva in pazienti ad alto rischio con febbre persistente non responsiva alla terapia antibiotica ad ampio spettro. Terapia mirata a seguito di isolamento colturale
17
5.2.1 Profilassi
La terapia profilattica è fattibile nelle categorie ad alta incidenza di candidiasi invasiva, in cui il numero di pazienti da trattare per prevenire un’infezione è basso. In caso contrario, i benefici sono sopravanzati dai rischi, come la tossicità o la selezione di resistenze [1, 167-170].
Le categorie a rischio che potrebbero beneficiare di una terapia profilattica sono i pazienti sottoposti a trapianto d’organo, quelli ricoverati in un reparto di terapia intensiva, quelli sottoposti a chemioterapia e quelli sottoposti a trapianto di midollo [2, 17].
In caso di trapianto d’organo, sono considerati a rischio quelli di fegato, pancreas e intestino, a causa della complessità tecnica e soprattutto del danno alla mucosa
gastrointestinale che può favorire la disseminazione del fungo. Un altro fattore che può favorire l’infezione è la profondità dello stato di immunosoppressione successivo al trapianto [2].
Il trapianto di fegato è quello su cui sono stati condotti più studi: è indicata una profilassi con fluconazolo, o in alternativa con amfotericina B, per almeno 7-14 giorni nei pazienti considerati ad alto rischio, nei quali i benefici della terapia superano gli effetti avversi [17, 171-175]. Le linee guida americane identificano come pazienti ad alto rischio quelli che hanno almeno due fra ritrapianto, creatinina maggiore di 2, coledocodigiunostomia, uso di più di 40 sacche di sangue durante l’operazione, tempo intraoperatorio maggiore di 1 ora, colonizzazione fungina individuata nelle immediate vicinanze del trapianto [17]. Le linee guida canadesi suggeriscono invece di trattare i pazienti con almeno due fra epatite fulminante, somministrazione preoperatoria di corticosteroidi, insufficienza renale (o dialisi) e infezione postoperatoria da batteri o da CMV [2].
Per i trapianti di pancreas e intestino esistono minori evidenze, ma molti concordano nella necessità di una profilassi con fluconazolo o amfotericina B nelle settimane successive al trapianto [2, 17, 175, 176].
Il rischio di candidiasi invasiva dopo il trapianto di altri organi solidi è troppo basso per giustificare una terapia profilattica [2, 17].
Per i pazienti ricoverati in terapia intensiva è raccomandata una profilassi antifungina con fluconazolo solo in soggetti selezionati e in reparti ad alta incidenza di candidiasi invasiva [17, 170, 177, 178]. I pazienti ad alto rischio sono caratterizzati da una combinazione di vari fattori di rischio come diabete, CVC, nutrizione parenterale, precedente chirurgia,
18 dialisi, pancreatite, terapia antibiotica prolungata o terapia immunosoppressiva [2, 170, 178]; l’uso dei sistemi di scoring può essere utile per definire i pazienti che
beneficerebbero della terapia [22, 39, 41]. Una categoria particolare è data da pazienti chirurgici con ricorrenti perforazioni gastrointestinali o riapertura dell’anastomosi [2, 179]. La terapia profilattica riduce l’incidenza di candidiasi invasiva, ma non sembra ridurre la mortalità complessiva [177, 180, 181].
In caso di neutropenia indotta dalla chemioterapia, è raccomandata una profilassi antifungina per tutta la durata della neutropenia [17, 182]. I farmaci consigliati sono fluconazolo, posaconazolo e caspofungina; l’itraconazolo è efficace ma meno tollerato [17]. La profilassi dovrebbe essere iniziata assieme alla terapia citotossica, anche se secondo alcuni gli azoli dovrebbero essere somministrati successivamente per il rischio di interazioni farmacologiche [2].
In caso di trapianto di midollo è indicata la somministrazione di fluconazolo,
posaconazolo o micafungina [17]. La durata ottimale della profilassi non è nota, per cui sono state ipotizzate varie strategie: per un periodo prestabilito (75, 100, 120 o 180 giorni); fino alla scomparsa della neutropenia; fino alla cessazione della terapia immunosoppressiva [2].
5.2.2 Terapia empirica e pre-emptive
Nonostante sia provata l’efficacia di una terapia precoce nel ridurre morbidità e mortalità [183, 184], non è ancora chiaro quando e se convenga iniziare il trattamento in caso di sospetta candidiasi.
Fra i pazienti non neutropenici, il rischio di candidiasi invasiva è elevato in quelli
ricoverati in terapia intensiva o sottoposti a un intervento chirurgico [2]. In questi pazienti, la scelta di iniziare una terapia pre-emptive dovrebbe basarsi sulla valutazione dei fattori di rischio, della colonizzazione e dei marker sierologici [1, 17, 23]. Pochi studi hanno valutato l’efficacia della terapia pre-emptive [2, 17], anche se sembra abbia una certo impatto sull’incidenza di candidiasi invasiva [185, 186]. Non è indicato iniziare una terapia in caso di colonizzazione senza altri marcatori positivi [2].
Recentemente è stato valutato da alcune rianimazioni l’utilizzo del β-D-glucano (BDG) come test di screening per iniziare una terapia pre-emptive appena diventa positivo [43, 187]. Il BDG si è dimostrato efficace nel diagnosticare precocemente un’infezione invasiva in pazienti selezionati con segni di sepsi e un soggiorno in terapia intensiva
19 maggiore di 5 giorni [43]; non è invece utile nei primi 3 giorni di degenza a causa dell’alto numero di falsi positivi che si registrano in questo periodo [114, 187]. È stato anche testato il dosaggio del BDG su sangue arterioso, reso possibile dalla frequente presenza di cateteri arteriosi in questi reparti: l’esame non ha mostrato significative differenze con il dosaggio su sangue venoso [43]. La terapia pre-emptive basata sul BDG si è dimostrata una strategia promettente, ma sono comunque necessari ulteriori studi per valutarne l’effettiva efficacia e applicabilità [43, 187, 188].
Una terapia empirica può essere presa in considerazione in pazienti ad alto rischio con febbre persistente non responsiva agli antibiotici [1, 17]. Il farmaco di scelta è il fluconazolo [2, 17, 189]; le echinocandine sono preferite in caso di recente esposizione agli azoli, malattia severa o alto rischio di infezione da C. glabrata o C. krusei [17]. Bisogna però tenere presente che le cause di febbre in terapia intensiva o nei pazienti chirurgici sono molte, per cui non è detto che la terapia antifungina risulti efficace [1, 2, 190].
Nei pazienti neutropenici con febbre persistente la terapia antifungina empirica è uno standard da molti anni, visto l’elevato rischio di infezione fungina invasiva [1, 2, 17, 191, 192]; la terapia riduce la morbidità associata all’infezione ma non sembra avere un
impatto sulla mortalità complessiva [193]. Non c’è accordo sul farmaco di scelta [2]: i più usati sono l’amfotericina B [194-197], la caspofungina [198] e il voriconazolo [199] (anche se gli studi sul voriconazolo sono stati caratterizzati da controversie statistiche [200]); il fluconazolo [201-203] e l’itraconazolo [204] possono essere un’alternativa nei pazienti meno gravi [2, 17, 205]. Gli azoli devono essere evitati nel caso in cui siano già stati usati come profilassi [2, 17]. La terapia empirica deve essere protratta fino alla risoluzione dei sintomi e della neutropenia [2].
La terapia pre-emptive nei pazienti neutropenici non è ancora definita e non ha indicazioni [2].
5.2.3 Candidemia
In caso di candidemia la terapia deve essere iniziata il più precocemente possibile in modo da ridurre il rischio di mortalità [2, 183, 184]. È anche importante scegliere il farmaco più adatto per il patogeno in questione [2, 206].
In generale il farmaco di prima scelta è il fluconazolo [207, 208], mentre le echinocandine [209-211] sono indicate in caso di malattia severa, recente esposizione agli azoli o alto
20 rischio di infezione da C. glabrata e C. krusei (ad esempio pazienti anziani o neoplastici) [2, 17]. L’identificazione della specie infettante è d’aiuto nella scelta: il fluconazolo è la prima opzione in caso di specie probabilmente suscettibili (C. albicans, C. parapsilosis, C. tropicalis, C. lusitaniae), mentre le echinocandine sono preferite contro C. glabrata e C. krusei; ciò nonostante, se il paziente è migliorato clinicamente e le colture si sono sterilizzate è possibile continuare la terapia in atto anche se non è quella raccomandata [1, 2, 17]. Nei pazienti stabilizzati e con emocolture negative è possibile passare al
fluconazolo orale per il completamento della terapia, ma solo in caso di isolati suscettibili [1, 2, 17]. L’amfotericina B può essere un alternativa in caso di intolleranza agli altri farmaci o di una loro scarsa disponibilità [2, 17, 212]; non può essere usata in caso di infezione da C. lusitaniae, che tende a essere resistente a questo farmaco [21]. Il voriconazolo [213] è efficace ma gravato da una difficile gestione, ed è quindi indicato solo in casi selezionati, come il passaggio alla terapia orale in caso di infezione da C. krusei, C. guilliermondii o C. glabrata resistenti al fluconazolo [1, 2, 17].
La durata della terapia è di 2 settimane dopo la sterilizzazione delle emocolture e la risoluzione di tutti i segni e sintomi attribuibili alla candidemia [1, 2, 17, 207]; per questo è importante l’esecuzione di emocolture seriate durante il corso del trattamento [1, 17]. In caso di malattia disseminata è necessario continuare fino alla risoluzione di tutte le
manifestazioni cliniche [2].
Un altro importante accorgimento è la rimozione, se possibile, di tutti i cateteri
intravascolari [1, 2, 17, 214-216]. Tutti i pazienti devono inoltre eseguire un esame del fundus oculi per escludere lo sviluppo di un’endoftalmite [1, 17, 217].
In caso di assenza di risposta alla terapia, bisogna valutare le possibili cause (endocardite, infezione di un catetere intravascolare, immunosoppressione, resistenza microbiologica) e agire di conseguenza [1, 21].
Nei pazienti neutropenici la situazione è diversa: questi pazienti mostrano infatti una minore risposta alla terapia [2] e un rischio elevato di insufficienza multiorgano e morte [17], e per questo è preferibile un trattamento con farmaci fungicidi, come le
echinocandine o l’amfotericina B [17]. Le echinocandine sono preferite a causa della loro minore tossicità, ma in caso di infezione da C. parapsilosis è consigliabile una terapia con amfotericina B. Il fluconazolo può essere usato nei pazienti meno gravi con neutropenia di breve durata, ma deve essere evitato se già usato come profilassi. Anche il voriconazolo può essere usato in particolari situazioni [2, 17].
21 La terapia deve essere continuata per almeno 14 giorni dopo la negativizzazione delle emocolture, la risoluzione di tutti i segni e sintomi e la ricostituzione della conta neutrofila [2, 17]. La durata della neutropenia rappresenta un importante fattore prognostico [17, 218].
Può essere utile la somministrazione di fattori stimolanti le colonie per favorire la ripresa della conta neutrofila [191, 219]. Bisognerebbe anche cercare di incidere su altre possibili cause di immunosoppressione, come l’uso di steroidi [21].
La gestione dei cateteri intravascolari è più controversa rispetto ai pazienti non
neutropenici [17]. Nei neutropenici l’origine della candidemia risiede principalmente nel tratto gastrointestinale, a eccezione delle forme da C. parapsilosis [220]; ciò nonostante, è difficile stabilire nel singolo paziente il contributo dato dall’intestino o dal catetere [17], anche perché il catetere rappresenta comunque un fattore di mantenimento della fungemia [221], e per questo è sempre preferibile rimuovere tutti i dispositivi intravascolari quando possibile [2, 17, 221, 222].
I pazienti neutropenici possono non manifestare alcun segno visibile di endoftalmite fino al recupero della neutropenia; per questo l’esame del fundus oculi dovrebbe essere eseguito solo dopo la ricostituzione della conta neutrofila [21].
5.2.4 Altre infezioni
La candidiasi disseminata cronica (anche detta candidiasi epatosplenica) è una forma non acuta, caratterizzata dalla formazione di numerosi piccoli ascessi nel fegato e nella milza, che si manifestano tipicamente con il recupero della neutropenia [2, 223]. La terapia deve essere continuata fino alla risoluzione o alla calcificazione delle lesioni; poiché ciò può richiedere mesi, è preferibile usare un farmaco a bassa tossicità come il fluconazolo, mentre l’amfotericina B è riservata alle forme acute o refrattarie [17, 21]. Alcuni
suggeriscono una terapia d’attacco con amfotericina B per 1-2 settimane, seguita da una terapia di mantenimento con fluconazolo; le echinocandine rappresentano un’alternativa per la terapia iniziale [17, 224]. Recentemente è stato supposto che questa patologia rappresenti una forma di IRIS, per cui potrebbe essere utile la somministrazione di corticosteroidi assieme agli antifungini [225].
L’endoftalmite rappresenta una complicanza caratteristica della candidemia [10, 11]. La terapia classica prevede l’utilizzo di amfotericina B associata a flucitosina, mentre il fluconazolo rappresenta un’opzione nelle forme meno gravi [11, 17, 226, 227]. Se il
22 paziente non risponde, può essere utile tentare con il voriconazolo o con un’echinocandina [17, 228]. La durata della terapia è di almeno 4-6 settimane fino alla risoluzione delle lesioni [17]. Nei casi più gravi può essere necessario un intervento di vitrectomia parziale, associato all’instillazione endovitreale di amfotericina B [11, 17].
La meningite rappresenta la più comune presentazione delle infezioni da Candida del sistema nervoso centrale [17, 229]; più raramente è possibile la formazione di ascessi [230]. La terapia di scelta è data dall’amfotericina B, con o senza l’aggiunta di flucitosina, per numerose settimane [17, 229, 231, 232], seguita dal fluconazolo quando il paziente mostra una risposta al trattamento iniziale [17]. Le echinocandine non sono indicate per la loro scarsa penetrazione attraverso la barriera ematoencefalica [2]. La terapia dovrebbe essere continuata fino alla risoluzione delle manifestazioni cliniche, delle alterazioni del liquor e delle lesioni radiologiche [17].
L’endocardite da Candida rappresenta un’infezione difficile da eradicare che richiede la combinazione di terapia medica e chirurgica [233-235]. La terapia iniziale prevede la somministrazione di amfotericina B, con o senza flucitosina [17, 234, 235];
un’echinocandina ad alte dosi può essere un’alternativa [17, 236, 237]. Nei pazienti stabili con emocolture negative è possibile passare al fluconazolo se l’isolato è suscettibile [17]. È inoltre indicato un intervento di sostituzione valvolare, seguito da ulteriore terapia antifungina per almeno 6 settimane; se l’intervento non è possibile, è necessaria una terapia soppressiva a lungo termine in caso di valvole native o a vita in caso di valvole protesiche [17, 235, 238, 239]. L’alto numero di recidive tardive suggerisce la necessità di un lungo follow-up [234].
In caso di infezione di pacemaker o di altri device intracardiaci è necessaria la rimozione del dispositivo associata a terapia antifungina analoga a quella delle endocarditi [17, 240]. L’osteomielite può essere trattata con fluconazolo per 6-12 mesi, eventualmente preceduto da qualche settimana di amfotericina B o echinocandine. In casi selezionati è indicata una pulizia chirurgica [17, 241].
L’artrite settica va trattata con il drenaggio della cavità articolare associato a terapia medica con fluconazolo per almeno 6 settimane, eventualmente preceduta da una terapia d’attacco con amfotericina B o echinocandine . In caso d’infezione di una protesi
23 quella dell’artrite; se la protesi non può essere rimossa è necessaria una terapia
soppressiva cronica, generalmente con fluconazolo [17].
La peritonite da Candida può derivare dall’uso di cateteri addominale per la dialisi peritoneali oppure da una perforazione intestinale di origine chirurgica o traumatica; altri fattori di rischio comprendono chemioterapia, immunosoppressione o malattie
infiammatorie intestinali [21, 242-244]. La forma da catetere è trattata con l’asportazione del dispositivo, mentre nella forma da perforazione è necessario un intervento di
riparazione e drenaggio; in entrambi i casi viene inoltre effettuata una terapia con amfotericina B o fluconazolo per almeno 2-3 settimane [21, 244-246].
6. LO STUDIO
6.1 Materiali e metodi
Sono stati considerati 78 ceppi di Candida analizzati nel laboratorio del reparto di
Malattie Infettive dell’Ospedale di Pisa. I ceppi in questione sono stati isolati da 73 casi di candidiasi invasiva avvenuti in 71 pazienti nel periodo compreso fra il novembre 2009 e il luglio 2012.
Le emocolture sono state effettuate con il sistema Bactec 9040 (Becton Dickinson, Sparks, MA, USA), e alla positivizzazione subcoltivate per l’identificazione sui terreni solidi Chromagar Candida (cromogenico) e GC-Choco (agar cioccolato) della stessa ditta. I campioni costituiti da materiali diversi dal sangue sono stati seminati su vari tipi di terreno solido e in caso di materiale normalmente sterile inoculati in un flacone da emocoltura per arricchimento.
La MIC (minima concentrazione inibente) è stata ottenuta con il sistema Sensititre® YeastOne™. Sono stati analizzate le sensibilità a 8 farmaci: 4 azoli (fluconazolo,
voriconazolo, itraconazolo e posaconazolo), 3 echinocandine (caspofungina, micafungina e anidulafungina) e l’amfotericina B. In 26 casi i kit a disposizione non permettevano di misurare la MIC degli azoli, che sono state quindi misurate con l’E-test (AB Biodisk, Solna, Svezia); una situazione analoga si è verificata per la micafungina, per la quale è stato usato l’E-test in 11 casi.
Sono state quindi effettuate delle sub-culture quantitative dai pozzetti limpidi, dove la crescita del fungo era stata inibita, per misurare l’MFC (minima concentrazione fungicida) di echinocandine e amfotericina B. L’MFC è stata definita come la concentrazione di farmaco che determina una riduzione del 99,9% dell’inoculo.
24 I livelli di mannano su siero sono stati ricavati dal database del laboratorio di Malattie Infettive; oltre ai valori dei pazienti oggetto dello studio sono stati controllati anche gli esami del periodo in questione per i quali fossero disponibili delle colture che
permettessero di verificare la reale presenza di un’infezione invasiva da Candida. Il kit usato per la rilevazione del mannano è il Platelia Candida Ag Plus (Bio-Rad, Marnes-la-Coquette, Francia).
I dati clinici ed epidemiologici sono stati ottenuti dalla lettura delle cartelle dei pazienti in questione. È stato possibile l’accesso alle cartelle di 59 pazienti, dalle quali sono stati ottenuti i dati su età, sesso, comorbidità, fattori di rischio (CVC, precedenti terapie antibiotica, steroidea e immunosoppressiva), esami ematici, Candida Score, terapia. Le analisi statistiche sono state effettuate con il test t di Student per le variabili quantitative e con il test del χ2
per le variabili qualitative. 6.2 Risultati
6.2.1 Demografia e fattori di rischio
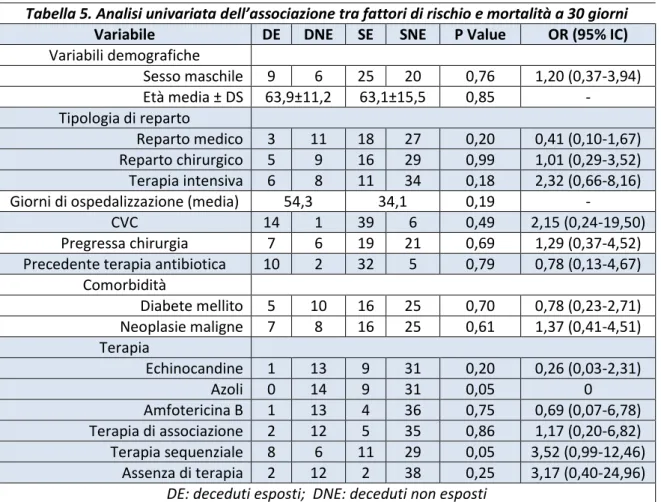
In totale sono stati identificati 71
pazienti, dei quali il 54,9% erano maschi e il 45,1% femmine. L’età media era di 64 ± 28 anni e la mediana di 67 anni; il 67,6% aveva più di 60 anni, mentre solo il 4,2% ne aveva meno di 40.
Il 39,7% era affetto da diabete mellito e il 38,1% aveva una forma di neoplasia maligna. Il 33,3% aveva una malattia
cardiovascolare, il 23,8% una malattia polmonare cronica, il 17,5% un’epatopatia cronica e il 15,9% una malattia renale cronica. Otto pazienti (12,7%) erano affetti da obesità.
Sessantanove pazienti erano ricoverati in ospedale al momento della diagnosi,
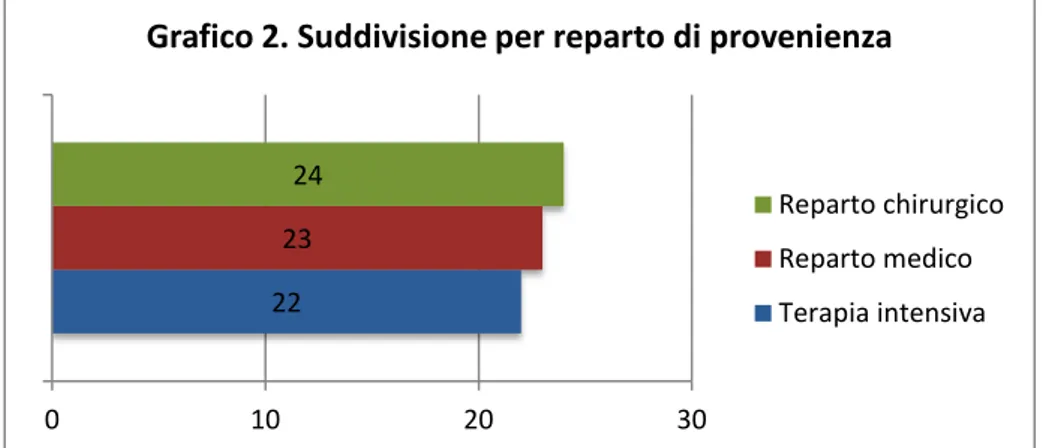
mentre i 2 rimanenti erano seguiti rispettivamente dall’ambulatorio di malattie infettive e dal centro dialisi. Fra i pazienti ricoverati, 22 (31,9%) si trovavano in un reparto
intensivistico (fra cui 2 al centro ustioni), 24 (34,8%) in un reparto chirurgico (fra cui 2 in
Tabella 1. Prevalenza delle comorbidità Comorbidità N° %
Diabete 25 39,7% Neoplasie 24 38,1% Mal. cardiovascolari 21 33,3% Mal. Polmonari croniche 15 23,8% Epatopatie croniche 11 17,5% Malattia renale cronica 10 15,9%
Obesità 8 12,7% Totale pazienti 63 100% 2 1 8 12 19 21 8 0 10 20 30
Grafico 1. Distribuzione per fasce d'età <30 30-39 40-49 50-59 60-69 70-79 ≥80
25 ortopedia) e 23 (33,3%) in un reparto medico. Il tempo medio di ospedalizzazione al momento della diagnosi era di 40 giorni.
L’86,8% dei pazienti (59 su 68) era portatore di un CVC: 11 avevano un PICC, 6 un PORT, mentre per i restanti 42 non è stato possibile identificare il tipo di catetere vascolare.
L’85,5% dei pazienti (47 su 55) aveva fatto una terapia antibiotica nel periodo precedente all’isolamento della Candida. Il 16,9% (10 su 59) aveva invece fatto una terapia steroidea, il 3,4% una terapia immunosoppressiva e l’1,7% una chemioterapia.
6.2.2 Presentazione clinica
La sede più frequente di isolamento è il sangue: le emocolture rappresentano infatti l’83,6% di tutti gli isolamenti (61 su 73). Di queste 48 sono risultate delle sepsi, 2 delle endocarditi e delle restanti 11 non si è potuto accedere ai dati clinici; al netto, le sepsi sono state il 96% e le endocarditi il 4%. Nel 31,1% delle candidemie è stata dimostrata un’origine a partenza da un CVC tramite coltura della punta del catetere, mentre nel 3,3% è stata supposta un’origine dalle vie urinarie. Entrambe le endocarditi hanno coinvolto pazienti con impianti artificiali: in un caso una protesi valvolare tricuspidale e nell’altro un pacemaker.
In 2 casi su 73 (2,7%) l’isolamento è avvenuto dopo l’espianto di un dispositivo
intracardiaco: in questi casi non sono state riscontrate emocolture positive. In altri 3 casi (4,1%) l’isolato veniva da una protesi endovascolare.
Tabella 2. Prevalenza dei fattori di rischio Fattori di rischio N° % CVC 59/68 86,8% Antibiotici 47/55 85,5% Steroidi 10/59 16,9% Immunosoppressori 2/59 3,4% Chemioterapia 1/59 1,7% 22 23 24 0 10 20 30
Grafico 2. Suddivisione per reparto di provenienza
Reparto chirurgico Reparto medico Terapia intensiva
26 Altri 2 isolamenti (2,7%) riguardano delle biopsie di un disco intervertebrale. Questi pazienti hanno quindi avuto una diagnosi di spondilodiscite, confermata in un caso da una successiva emocoltura.
I materiali d’isolamento dei restanti casi comprendono un ascesso epatico, un liquido peritoneale, un liquido pleurico, un liquido di drenaggio e un liquido articolare da protesi di ginocchio.
In 33 casi la punta del CVC rimosso è stata messa in coltura per verificare la presenza di un’infezione CVC-relata: le colture risultate positive sono state 19 (57,6%). Il tempo di positivizzazione (time to positivity, TTP) medio delle emocolture nel gruppo con coltura della punta positiva è stato di 17,56 ore per le colture da CVC e 37,77 ore per le colture da vena periferica (VP) o arteria; nel gruppo con coltura della punta negativa i TTP medi sono stati invece rispettivamente di 34,35 ore e 25,98 ore. Nel primo gruppo la differenza media del TTP fra emocoltura da CVC ed emocoltura da VP o arteria è stata di 18,46 ore, mentre nel secondo gruppo è stata di 12,06 ore.
Gli esami ematici hanno mostrato leucocitosi (G.B. > 10.000) nel 32,2 % dei casi e leucopenia (G.B. < 4.500) nel 20,3% dei casi; la media della conta leucocitaria è stata di 9.457 globuli bianchi. Il 78,9% delle leucocitosi aveva carattere neutrofilo (neutrofili > 75%), mentre nel complesso dei pazienti si è avuta neutrofilia nel 54,2% dei casi. La PCR era aumentata (> 0,5 mg/dl) nel 92,3% dei pazienti: di questi il 44,4% aveva valori compresi fra 0,5 e 5 mg/dl, il 52,8% fra 5 e 50 mg/dl, e il 2,8% superiori a 50 mg/dl. La procalcitonina era positiva nel 58,1% dei pazienti.
84% 4% 3% 3% 2% 1% 1% 1% 1%
Grafico 3. Distribuzione per sede d'isolamento
Emocoltura Protesi vascolare Dispositivo intracardiaco Disco intervertebrale Ascesso epatico Liquido peritoneale Liquido pleurico Liquido di drenaggio Liquido di protesi articolare
27 Sono stati controllati gli esami del fundus oculi effettuati in 11 pazienti ricoverati nel reparto di Malattie Infettive. In nessun caso sono state riscontrate lesioni compatibili con un’endoftalmite da Candida.
6.2.3 Candida Score
Il Candida Score (CS) richiede la conoscenza di 4 parametri: pregressa chirurgia, nutrizione parenterale totale, colonizzazione multifocale e sepsi severa. I pazienti
sottoposti a recente chirurgia sono stati il 48,7% (28 su 58), mentre quelli che ricevevano una nutrizione parenterale totale erano il 55,2% (32 su 58); la colonizzazione multifocale era presente nel 37,1% dei pazienti (13 su 35), e il 38,6% (22 su 57) rientrava nei criteri di sepsi severa.
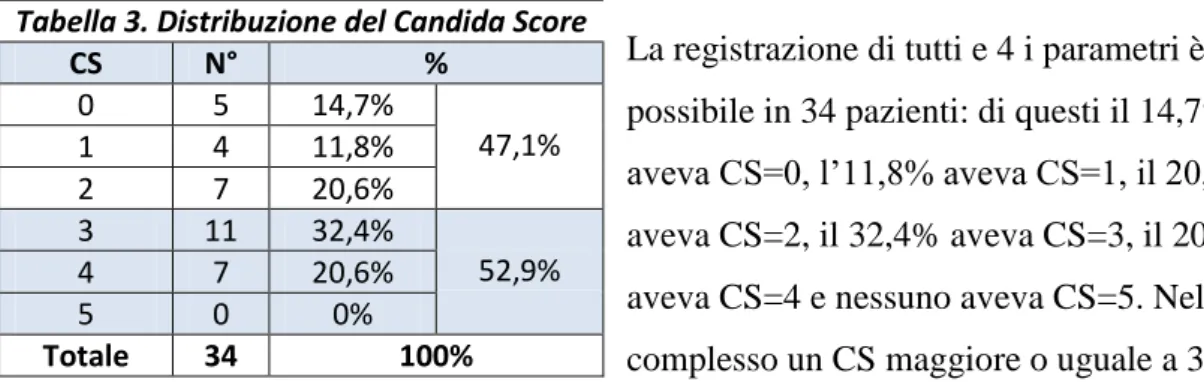
La registrazione di tutti e 4 i parametri è stata possibile in 34 pazienti: di questi il 14,7% aveva CS=0, l’11,8% aveva CS=1, il 20,5% aveva CS=2, il 32,4% aveva CS=3, il 20,5% aveva CS=4 e nessuno aveva CS=5. Nel complesso un CS maggiore o uguale a 3, indicativo della necessità di una terapia antifungina, era presente nel 52,9% dei pazienti. Fra i 34 pazienti con CS definito, 13 provenivano da un ambiente intensivistico, 10 da un reparto chirurgico e 11 da un reparto medico. Fra i casi con CS≥3 i tre ambienti erano rappresentati rispettivamente dal 38,9%, dal 33,3% e dal 27,8%; in quelli con CS<3 erano invece il 37,5%, il 25% e il 37,5%.
I CS≥3 erano rappresentati per il 94,4% da sepsi e per il 5,6% da ascessi epatici; fra i CS<3 le sepsi erano l’81,25%, le spondilodisciti il 12,5% e le infezioni di protesi vascolari il 6,25%.
Nei CS≥3 la specie più frequente era C. albicans, presente nel 50% dei pazienti, seguita da C. glabrata (22,2%) e C. parapsilosis (16,7%); nei CS<3 la specie più rappresentata era invece C. parapsilosis, isolata nel 56,25% dei casi, mentre C. albicans si attestava al 50% e C. glabrata non era presente in alcun paziente.
La mortalità a 30 giorni dei pazienti con CS definito era del 34,4%. I CS≥3 avevano una mortalità del 35,3%; i CS<3 del 33,3%.
Tabella 3. Distribuzione del Candida Score
CS N° % 0 5 14,7% 47,1% 1 4 11,8% 2 7 20,6% 3 11 32,4% 52,9% 4 7 20,6% 5 0 0% Totale 34 100%
28
6.2.4 Sierologia
Il mannano è stato misurato in 45 pazienti, dei quali i positivi sono stati 16 (35,6%). Nel 50% dei casi positivi i livelli di mannano erano compresi fra 500 e 1.000 pg/ml, mentre nel 18,75% dei casi erano superiori a 1.000; solo il 12,5% aveva valori inferiori a 100 pg/ml.
Considerando l’intero database del mannano nel periodo studiato, sono stati ottenuti 24 veri positivi, 634 veri negativi, 88 falsi positivi e 48 falsi negativi. La sensibilità
dell’esame è risultata quindi del 33,3% e la specificità dell’87,8%; il valore predittivo positivo è stato del 21,4% e il valore predittivo negativo del 93%.
La media dei valori di mannano è stata di 854 pg/ml fra i veri positivi e di 418 pg/ml fra i falsi positivi.
6.2.5 Microbiologia
Sono stati isolati 78 ceppi da 73 casi di candidiasi invasiva in 71 pazienti: 5 casi sono infatti risultati essere delle coinfezioni da 2 specie differenti. La specie più frequentemente isolata è C. albicans, che rappresenta il 50% dei ceppi; fra le specie non-albicans, le più rappresentate sono C. parapsilosis (24,4%) e C. glabrata (14,1%). Le specie rimanenti comprendono C. tropicalis (7,7%), C. krusei (2,6%) e C. guilliermondii (1,3%).
Le echinocandine hanno mostrato una buona attività in vitro, con una MIC massima di 2. Il farmaco con le MIC più basse è risultato la micafungina, per la quale il 70,6% degli isolati aveva una MIC inferiore a 0,03, contro il 28,6% dell’anidulafungina e l’1,28% della caspofungina. Nella fascia alta dei valori la caspofungina aveva pochi ceppi (3,8%
6 19 2 1 11 39 0 5 10 15 20 25 30 35 40 45
Grafico 4. Distribuzione per specie isolata
29 con MIC uguale a 1 o 2), a differenza di micafungina (23,5%) e anidulafungina (20%). In generale micafungina e anidulafungina tendevano ad avere la maggioranza degli isolati concentrati nelle fasce più basse e un piccolo picco in corrispondenza del valore di 1, mentre per la caspofungina la maggioranza dei ceppi si concentrava a valori intermedi; ciò è confermato dai valori delle MIC50 e delle MIC90 (grafici 25 e 26).
I ceppi di C. albicans avevano una MIC inferiore alla media, che in nessun caso superava 0,25, mentre fra i ceppi non-albicans la situazione era diversa a seconda della specie: C. glabrata mostrava un andamento simile a quello di C. albicans, mentre C. parapsilosis aveva una tendenza opposta, con una MIC nella grande maggioranza dei casi compresa fra 0,5 e 2. 0 10 20 30 40 <0,03 0,03 0,06 0,125 0,25 0,5 1 2
Grafico 5. Concentrazioni minime inibenti (MIC) delle echinocandine verso Candida spp
Micafungina Anidulafungina Caspofungina 0 5 10 15 20 25 30 <0,03 0,03 0,06 0,125 0,25 0,5 1 2
Grafico 6. Concentrazioni minime inibenti (MIC) delle echinocandine verso Candida albicans
Micafungina Anidulafungina Caspofungina 0 5 10 15 <0,03 0,03 0,06 0,125 0,25 0,5 1 2
Grafico 7. Concentrazioni minime inibenti (MIC) delle echinocandine verso Candida non albicans
Micafungina Anidulafungina Caspofungina
30 L’amfotericina B è risultata efficace in vitro su tutti gli isolati: nessun ceppo aveva infatti una MIC superiore a 1, che rappresenta il breakpoint riconosciuto da EUCAST e CLSI per questo farmaco, e la maggioranza aveva una MIC uguale a 0,25 o 0,5. La MIC 50 era di 0,25 e la MIC90 di 0,5 (grafici 25 e 26).
Fra i ceppi di C. albicans la MIC era leggermente più alta della media: gli isolati con MIC=0,5 erano infatti il 43,6%, superando quelli con MIC=0,25 che erano il 41%. Fra i
ceppi non-albicans la MIC più frequente era invece 0,25 (51,3%): questo dato era dovuto principalmente a C. parapsilosis, mentre in C. glabrata prevaleva una MIC superiore (0,5 nel 63,6% dei casi). 0 2 4 6 8 10 12 14 <0,03 0,03 0,06 0,125 0,25 0,5 1 2
Grafico 8. Concentrazioni minime inibenti (MIC) delle echinocandine verso Candida parapsilosis
Micafungina Anidulafungina Caspofungina 0 2 4 6 8 10 12 <0,03 0,03 0,06 0,125 0,25 0,5 1 2
Grafico 9. Concentrazioni minime inibenti (MIC) delle echinocandine verso Candida glabrata
Micafungina Anidulafungina Caspofungina 0 10 20 30 40 <0,25 0,25 0,5 1
Grafico 10. Concentrazioni minime inibenti (MIC) dell'amfotericina B verso Candida
31 Il fluconazolo, che rappresenta il farmaco più usato della classe degli azoli, aveva una MIC inferiore o uguale a 2 nel 79,7% degli isolati, ma una quota consistente (il 9,5%) aveva una MIC maggiore di 8. La MIC50 era di 0,5 e la MIC90 di 8 (grafici 25 e 26). I ceppi di C. albicans mostravano un’ampia suscettibilità al fluconazolo: nel 97,2% dei casi la MIC era infatti inferiore o uguale a 1, che rappresenta il breakpoint stabilito da EUCAST e CLSI per questa specie. Fra i ceppi non-albicans molti isolati (il 18,9%) avevano una MIC superiore a 8: tutti questi casi erano dovuti a C. krusei e C. glabrata, mentre C. parapsilosis aveva tutti gli isolati con MIC compresa fra 0,25 e 4.
0 5 10 15 20 <0,25 0,25 0,5 1 Grafico 11. Concentrazioni minime inibenti (MIC) dell'amfotericina B verso Candida
albicans 0 5 10 15 20 25 <0,25 0,25 0,5 1 Grafico 12. Concentrazioni minime inibenti (MIC) dell'amfotericina B verso Candida
non albicans 0 2 4 6 8 <0,25 0,25 0,5 1 Grafico 14. Concentrazioni minime inibenti (MIC) dell'amfotericina B verso Candida
glabrata 0 5 10 15 20 <0,25 0,25 0,5 1 Grafico 13. Concentrazioni minime inibenti (MIC) dell'amfotericina B verso C. parapsilosis 0 5 10 15 20 25 30 <0,25 0,25 0,5 1 2 4 8 16-32 >32
Grafico 15. Concentrazioni minime inibenti (MIC) del fluconazolo verso Candida spp
32 0 5 10 15 20 <0,25 0,25 0,5 1 2 4 8 16-32 >32
Grafico 16. Concentrazioni minime inibenti (MIC) del fluconazolo verso Candida albicans
0 2 4 6 8 10 <0,25 0,25 0,5 1 2 4 8 16-32 >32
Grafico 17. Concentrazioni minime inibenti (MIC) del fluconazolo verso Candida non albicans
0 2 4 6 8 10 <0,25 0,25 0,5 1 2 4 8 16-32 >32
Grafico 18. Concentrazioni minime inibenti (MIC) del fluconazolo verso Candida parapsilosis
0 1 2 3 4 5 <0,25 0,25 0,5 1 2 4 8 16-32 >32
Grafico 19. Concentrazioni minime inibenti (MIC) del fluconazolo verso Candida glabrata
33 Le MIC degli altri azoli erano più basse di quelle del fluconazolo, in particolare quelle del voriconazolo, che erano inferiori a 0,03 nel 70,2% dei casi; itraconazolo e posaconazolo avevano invece valori più alti, come evidenziato dalle MIC 50 (rispettivamente ≤0,008, 0,125 e 0,06, vedi grafico 25).
C. albicans mostrava un andamento simile alla media, ma con una maggiore
accentuazione dei valori più bassi, e nessun farmaco aveva una MIC superiore a 0,5. Fra i ceppi non -albicans la situazione era più diversificata: C. parapsilosis aveva valori simili a quelli di C. albicans, mentre C. glabrata aveva valori più alti e C. tropicalis si trovava in una situazione intermedia fra le due.
0 10 20 30 40 50 60 <0,03 0,03 0,06 0,125 0,25 0,5 1 2 >2
Grafico 20. Concentrazioni minime inibenti (MIC) degli azoli verso Candida spp
Voriconazolo Itraconazolo Posaconazolo 0 10 20 30 40 <0,03 0,03 0,06 0,125 0,25 0,5 1 2 >2
Grafico 21. Concentrazioni minime inibenti (MIC) degli azoli verso Candida albicans
Voriconazolo Itraconazolo Posaconazolo 0 5 10 15 20 <0,03 0,03 0,06 0,125 0,25 0,5 1 2 >2
Grafico 22. Concentrazioni minime inibenti (MIC) degli azoli verso Candida non albicans
Voriconazolo Itraconazolo Posaconazolo