Indice
PREMESSA………....pag.2
INTRODUZIONE
2.1 SEDOANALGESIA E ANALGOSEDAZIONE……….pag.5
2.2 IL DELIRIO
2.2.1 Introduzione………pag.7
2.2.2 Definizione e Criteri Diagnostici………..
pag.11
2.2.3 Etiopatogenesi………...
pag.14
2.2.4 Prevalenza e Sottotipi………...
pag.17
2.2.5 Fattori di rischio………
pag.20
2.3 IL DISTURBO POST-TRAUMATICO DA STRESS
2.3.1 Definizione e Criteri diagnostici………...
pag.24
2.3.2 Etiopatogenesi………...
pag.25
2.3.3 Epidemiologia………..pag. 28
2.3.4 Decorso……….pag.30
3. STUDIO CLINICO
3.1 OBIETTIVI……….pag.32
3.2 MATERIALI E METODI………...pag.32
3.3 RISULTATI………pag.43
3.4 DISCUSSIONE………...pag.49
4. CONCLUSIONI………
pag.54
5. BIBLIOGRAFIA………...
pag.56
1. Premessa
Sedoanalgesia e Analgosedazione sono termini estremamente frequenti all’interno di un’Unità di Terapia Intensiva. L’analgesia e la sedazione hanno lo scopo di garantire al paziente il soddisfacimento del “Diritto all’Analgesia” e il raggiungimento di un adeguato livello di sedazione, tali da interrompere la cascata neuroendocrina/metabolica che accompagna il paziente critico.
La terapia intensiva per sua natura intrinseca è un ambiente estremamente ostile per i pazienti. Ciò è dovuto sia alle condizioni critiche dei ricoverati sia al tipo di terapie che vi vengono effettuate. Il paziente spesso vi si ritrova senza cognizione di causa, incapace di comunicare, confuso, sottoposto a pratiche terapeutiche di difficile sopportazione e collegato a macchinari per il monitoraggio e la terapia, dolorosi e invasivi. Per questi motivi si può ben comprendere, il ruolo fondamentale che svolgono le terapie volte a migliorare la “sopportabilità” di tali regimi di cura e del dolore.
La permanenza all’interno della terapia intensiva può spesso comportare la comparsa di manifestazioni a carico delle funzioni cognitive. Nel breve termine, si può verificare un temporaneo e transitorio peggioramento di tali funzioni come deficit di memoria, di attenzione, di linguaggio e di comprensione così come si possono manifestare episodi di delirio. Nel lungo termine invece si può assistere ad un deterioramento più evidente delle funzioni cognitive, che può divenire un disordine persistente, oppure allo sviluppo di un disturbo post-traumatico da stress (PTSD).
Questo studio verterà sull’individuazione e la comprensione del fenomeno delirio in terapia intensiva e sulla sua associazione con il PTSD.
Storicamente, i medici della terapia intensiva si sono principalmente interessati alle cure delle disfunzioni polmonari, cardiache e renali ritenendole la fonte primaria di morbilità e mortalità nei loro pazienti, sottovalutando però l’impatto della disfunzione cerebrale(1). Il delirio, è una manifestazione comune di disfunzione cerebrale acuta nei pazienti critici ed è associata sia ad un ridotto outcome sia a conseguenze negative anche dopo mesi o anni dalla dimissione dalla terapia intensiva(2,3). Per questo motivo deve essere considerato anch’esso un fattore importante di morbilità e mortalità alla stregua delle disfunzioni sopra citate.
Ad oggi si attribuisce al delirio un’etiologia di tipo multifattoriale. Sono stati identificati vari fattori di rischio che possono predisporre o far precipitare verso l’insorgenza di delirio, ma nessuno di questi può essere identificato come fattore unico scatenante.
Sicuramente questo evento è strettamente legato alla gravità della patologia o delle patologie che affliggono il paziente ed alle terapie a cui questo viene sottoposto. Attraverso lo studio del fenomeno delirio ci siamo resi conto che un altro fattore etiologico importante, che poi cercheremo di comprendere meglio, è lo stress cui il paziente viene sottoposto durante la degenza in terapia intensiva; esso può portare anche all’insorgenza, dopo la dimissione del paziente, a sequele che possono considerarsi “parte di” o un vero e proprio disturbo post-traumatico da stress.
Questo studio fa parte di un progetto più grande, il “Progetto Van Gogh”. Per un periodo di tre mesi abbiamo monitorato i pazienti che hanno necessitato di cure intensive e che sono stati ricoverati nel reparto IV Anestesia e Rianimazione Universitaria dell’Azienda Ospedaliera Universitaria Pisana, cercando di individuare e comprendere i fattori di rischio correlati al delirio. In particolar modo questo studio andrà a valutare se esiste una correlazione
tra sedoanalgesia versus analgosedazione nell’insorgenza del delirio e del PTSD.
2. Introduzione
2.1 SEDOANALGESIA E ANALGOSEDAZIONE
Obiettivi dell’ analgesia e della sedazione sono(4):
• Un adeguato livello di analgesia, ansiolisi e amnesia • Ridurre le risposte ormonali e metaboliche allo stress • Evitare brusche riemersioni dello stato di coscienza • Evitare estubazioni accidentali
• Facilitare l’adattamento al ventilatore
• Evitare aumenti della PIC (Pressione Intra-Cranica) • Ridurre l’uso di bloccanti neuromuscolari
Si utilizzano i termini di Sedoanalgesia, quando il controllo dell’dolore e dell’ansia viene effettuato attraverso l’utilizzo primario di un farmaco ipnotico a cui può essere associato un farmaco analgesico; di Analgosedazione quando il controllo del dolore e dell’ansia viene effettuato attraverso l’utilizzo primario di un analgesico oppioide a cui può essere associato un farmaco ipnotico.
Analgosedazione Sedoanalgesia
I farmaci maggiormente utilizzati in terapia intensiva, al giorno d’oggi, per tale scopo, sono, grazie ai progressi farmacologici , molecole assai vicine al modello “ideale” tanto agognato da tutti gli intensivisti, con caratteristiche farmacologiche favorevoli quali:
• Rapida eliminazione • Accumulo limitato
• Effetto sedativo modulabile
• Avere scarsi effetti emodinamici e respiratori
• Non dare tachifilassi o sintomi astinenziali alla sospensione
• Possibilità di impiego in pazienti affetti dalle più svariate patologi Tra gli ipnotici, il Propofol e le Benzodiazepine di ultima generazione (per es. Midazolam) e tra gli oppioidi, il Fentanyl e il Remifentanil.
È indubbio che l’impulso decisivo all’impiego sistematico dei sedativi e degli oppioidi in terapia intensiva è stato dato dalle nuove modalità di somministrazione, frutto di innovazioni tecnologiche che hanno permesso l’impiego di pompe per l’infusione controllata; le stesse, in altre parole, che hanno consentito il rapido ingresso, nel bagaglio culturale e pratico di ogni anestesista, della TIVA e della TCI.(5)
2.2 IL DELIRIO
2.2.1 INTRODUZIONE
Il delirio è una particolare condizione psicofisica in cui il soggetto, incapace di controllarsi, perde la comune percezione di se stesso e del mondo che lo circonda, immaginando, in termini allucinatori , realtà inesistenti o attribuendo a fatti o persone reali caratteristiche e atteggiamenti inesistenti. Essendo quelle richiamate le peculiari caratteristiche della situazione di delirio non è difficile comprendere perché nelle culture primitive come nel mondo antico ed oltre, si sia sempre guardato al delirio ed alle allucinazione in genere con atteggiamenti misti di terrore e di rispetto: colui che delira veniva considerato preda di incontrollabili forze demoniache (i tanti casi di indemoniati di cui parlano anche i Vangeli, sono, in proposito, significativi), ma al tempo stesso verso di lui si nutriva una specie di rispetto reverenziale, inquanto, nel delirio, potevano venire alla luce verità e sentimenti altrimenti nascosti, poteva ascoltarsi perfino la voce di un dio (secondo il ben noto concetto del sacro “fascinans” e “tremens”). Il delirio, le situazioni deliranti sono anche richiamate in molte opere letterarie e teatrali, dai tragici dell’antica Grecia fino a Shakespeare. Tale situazione perdura fino al Rinascimento, fino all’Età Moderna, allorché, come viene illustrato da Michel Focault nella sua Storia della Follia (6), nascono contemporaneamente la nuova scienza psichiatrica e il suo oggetto, ossia il folle, il pazzo.
Le concezioni della nuova scienza non possono non riflettersi sulle idee riguardo al delirio, fenomeno che pur essendo una manifestazione presente in molti disturbi mentali gravi, compare, tuttavia, con diverso significato come si spiegherà più oltre, in situazioni non associate alla malattia mentale.
Come è noto la scienza psichiatrica così come viene evolvendo dal XVII secolo in poi, si distingue in primo luogo per il presupposto secondo cui sia la malattia mentale sia il disturbo mentale (anche temporaneo come certe forme di delirio) ha sempre una base organica nel cervello a livello fisico-chimico e può, quindi, essere curata attraverso un intervento farmacologico in grado di agire sulle basi fisico-chimiche attenuando il disturbo e le relative manifestazioni (l’altro presupposto della scienza psichiatrica classica, l’istituzione manicomiale, pur così rilevante, non interessa in questa sede). Naturalmente le posizioni e i risultati della neuropsichiatria rappresentano un importante progresso: è innegabile che l’apporto farmacologico abbia permesso di migliorare incomparabilmente la gestione dei casi e dato anche un essenziale contributo per diminuire la sofferenza dei soggetti disturbati. Tuttavia l’impostazione prevalente della neuropsichiatria non è condivisa da tutti interamente. Nel corso della prima metà del Novecento ed oltre approcci diversi vengono avanzati, infatti, sia dalla psicoanalisi che dalla psichiatri di impostazione fenomenologica(7): tali orientamenti teorici pur non mettendo in discussione le dinamiche e le reazioni di ordine chimico-biologico che compaiono ad esempio nel delirio (come in altri fenomeni) si preoccupano anche della genesi del fenomeno stesso e della sua funzione.
Scrive Umberto Galimberti: <<la genesi del delirio consente di comprenderne la funzione che è di solito a sfondo protettivo, per cui occorre molta cautela prima di “disfare” un evidente delirio. Consentendo di ristrutturare una realtà che non si domina, il delirio offre un nucleo di significato intorno a cui poter riorganizzare un mondo che, sia pure alterato, ricomincia a funzionare. La spiegazione anche se delirante rimette in moto un’esistenza che si era bloccata, offre un senso al mondo che si abita e un significato a se stessi in quel mondo. Da questo punto di vista la funzione protettiva del delirio, detta anche riorientamento nel delirio, è ciò per cui, ad esempio, scrive Freud: “il
paranoico ricostruisce il mondo non più splendido in verità, ma almeno tale da poter di nuovo vivere in esso. La formazione delirante che noi consideriamo il prodotto della malattia costituisce in verità il tentativo di guarigione, la ricostruzione”(1910 p396)>> (8).
Sulla stessa linea argomentativa si collocano anche Giovanni Jervis ed Ernesto Bornia. Il primo afferma: << il mondo appare (al soggetto delirante) insopportabilmente estraneo, ostile, minaccioso, falso e destrutturato. La ristrutturazione della realtà parte da un’interpretazione di significato intorno al quale tutto il mondo si riorganizza e, per così dire, ricomincia a funzionare…improvvisamente il soggetto intuisce: egli è invaso da forze estranee, succede qualcosa, c’è un complotto o una mascheratura; qualcosa gli viene nascosto ma egli comincia a capire, vede significati nuovi e cifrati>>. (9) Il secondo sostiene dal canto suo che : << una impostazione terapeutica adeguata verso il paziente che delira (o che allucina) non può essere quella intesa semplicemente alla eliminazione delle manifestazioni psicotiche. Le esperienze deliranti e anche quelle allucinatorie possono riassumere in sé il senso di una nuova fondazione relazionale: il senso, cioè, di una compensazione fenomenologica che riempia il vuoto creato dalla lacerazione psicotica>>. (10)
Come è noto il dibattito tra sostenitori delle terapie chimico-farmacologiche e della matrice organico-biologica del disturbo mentale da un lato e le impostazione di origine fenomenologica o psicanalitica dall’altro, è un dibattito tanto acceso quanto inconcluso: se fino agli anni ‘80 dello scorso secolo prevalevano le tesi psicoanalitiche e fenomenologiche connesse agli orientamenti della nuova psichiatria e dell’antipsichiatria, nei decenni successivi, anche a seguito degli indiscussi progressi della neurologia, sembrano avere netta prevalenza i sostenitori dell’organicismo e delle terapie farmacologiche. È pero probabile che come accaduto spesso in passato ci si
trovi di fronte a una delle periodiche oscillazioni tra l’uno e l’altro polo, sicché non si può escludere che, a scadenza più o meno ravvicinata si torni al prevalere dell’opposta tendenza.
Sembra tuttavia interessante un orientamento sorto di recente che, piuttosto che insistere sulla contrapposizione dualistica (organicismo e terapia farmacologica vs psicoanalisi e psichiatria fenomenologica), ricerca, piuttosto le connessioni tra i due livelli, tra una visione del disturbo mentale che faccia riferimento all’esperienza in prima persona (quella cara alle teorie psicoanalitiche e fenomenologiche) e una visione in terza persona (su cui insiste la neurologia); ciò proprio nella convinzione che si tratti di aspetti non opposti e reciprocamente escludentesi, bensì complementari. (11)
Ma, al di là dell’esito del dibattito appare opportuno richiamare l’attenzione sulla fondamentale differenza che intercorre tra il delirio manifestazione di una psicosi (e come tale distinguibile in diverse fenomenologie: dal delirio di colpa a quello di grandezza o di persecuzione fino al delirio confuso degli schizzofrenici) e il delirio (quello che a noi più interessa) che si manifesta nei malati sedati con farmaci ipnotici a partire da sensazioni di estrema passività, isolamento, vulnerabilità (il percepirsi completamente in balia dell’altro). Questa seconda forma di delirio come si è già accennato pur motivata da una situazione occasionale può tuttavia perdurare e produrre conseguenze ben oltre la situazione generante.
È evidente che le interpretazioni che del delirio sono date dalle scuole psicoanalitiche e fenomenologiche anche a prescindere dal loro effettivo valore, rivestono importanza prevalente per la prima tipologia di delirio, mentre riguardo alla seconda, sarà soprattutto necessario puntare a prevenire il fenomeno che, per le sue caratteristiche più difficilmente può pervenire a quelle caratteristiche di compensazione rinvenibili nei deliri di origine psicotica. Questo non toglie che alcune indicazioni importanti possono valere
anche nel caso nostro: in particolare per le procedure da adottare (test, ecc..) per l’accertamento della situazione di delirio durante o dopo l’intervento farmacologico.
2.2.2 DEFINIZIONE E CRITERI DIAGNOSTICI
Una distinzione fondamentale è quella che separa il delirio lucido (delusion) dal delirio confuso (delirium). Si noti che all’unico termine italiano “delirio”, corrispondono due termini diversi in inglese (delusion,delirium). Il delirio lucido è associato a stato di coscienza vigile ed organizzato, articolato in idee con vario grado di complessità e sistematizzazione; il delirio confuso si verifica in condizioni di coscienza alterata ed è sempre sconnesso, frammentario, mutevole, mai organizzato in sequenze ideative complesse. (12)
Per i fini e l’argomentazione di questo studio, prenderò in considerazione unicamente il delirio confuso (delirium).
Secondo il DSM-IV-TR, la caratteristica essenziale del delirium è un alterazione di coscienza accompagnata da modificazioni cognitive che non può essere meglio giustificata da una demenza stabilizzata o in evoluzione. L’alterazione si sviluppa in un breve periodo di tempo, generalmente di ore o giorni, e tende a fluttuare durante il corso del giorno. Vi sono segni evidenti dalla storia, dall’esame fisico, o dai test di laboratorio che il delirium è una conseguenza fisiologica diretta di una condizione medica generale, di un Intossicazione o Astinenza da Sostanze, dell’uso di un farmaco, dell’esposizione a una tossina, o di una combinazione di questi fattori.
L’alterazione di coscienza è manifestata da una riduzione della lucidità della percezione dell’ambiente. La capacità di focalizzare, mantenere, o spostare l’attenzione è compromessa (Criterio A). Le domande devono essere ripetute
perché l’attenzione del soggetto è labile, oppure il soggetto può perseverare nella risposta ad una domanda precedente invece di spostare adeguatamente l’attenzione sulla domanda in questione. La persona viene facilmente distratta da stimoli irrilevanti. A causa di questi problemi, può essere difficile (o impossibile) impegnare la persona in una conversazione.
A questa sintomatologia si accompagna una modificazione cognitiva (che può comprendere: deficit della memoria, disorientamento, o alterazioni del linguaggio) oppure lo sviluppo di alterazioni percettive (Criterio B). Il deficit di memoria è di solito più evidente nella memoria recente, e può essere testato chiedendo al soggetto di ricordare una serie di oggetti non correlati o una frase breve, e poi di ripeterla dopo alcuni minuti di distrazione. Il disorientamento è generalmente manifestato dal fatto che il soggetto è non orientato nel tempo (per es. a notte fonda egli pensa che sia mattina), oppure nello spazio (per es., mentre si trova in ospedale egli crede di essere a casa). Nel delirium lieve, il disorientamento nel tempo può essere il primo sintomo a comparire. Il disorientamento riferito a se stessi è meno comune. Le alterazioni dell’eloquio o del linguaggio possono evidenziarsi come disartria (cioè compromissione della capacità di articolare la parola), come disnomia (ossia compromissione della capacità di nominare gli oggetti), come disgrafia (cioè compromissione della capacità di scrivere) o come afasia. In certi casi l’eloquio è divagante non pertinente, in altri casi è incalzante e incoerente con imprevedibili salti da un argomento all’altro. Può essere difficile per il clinico valutare le modificazioni delle funzioni cognitive poiché il soggetto può essere disattento e incoerente. In queste circostanze, è utile riesaminare accuratamente la storia del soggetto e procurarsi informazioni da altri conoscenti, in particolare dai familiari.
Le alterazioni percettive possono includere false interpretazioni, illusioni o allucinazioni. Benché le false percezioni sensoriali siano più comunemente
visive, esse possono verificarsi anche con altre modalità sensoriali: uditive, tattili, gustative ed olfattive. Le false percezioni variano da quelle semplici e uniformi a quelle altamente elaborate. Il soggetto può avere una percezione delirante della realtà, delle allucinazioni, e presentare delle risposte emotive e comportamentali reattive al loro contenuto.
Il disturbo si sviluppa in un breve periodo di tempo e tende a fluttuare durante il corso del giorno (Criterio C). Per es. durante il “giro” ospedaliero del mattino, il soggetto può essere coerente e collaborante, ma di notte potrebbe
Tab. 2.1 - ICD 10: criteri diagnostici di delirio
1. Alterazione della coscienza e dell'attenzione ( che va dall'obnubilamento al coma; ridotta capacità a dirigere, focalizzare, mantenere o spostare l'attenzione)
2. Disordine globale dello stato cognitivo (distorsioni percettive, illusioni e allucinazioni soprattutto visive; alterazione del pensiero astratto e della comprensione con o senza transitorie illusioni, ma tipicamente con alcuni gradi di incoerenza; alterazioni della memoria a breve termine, ma con la memoria a lungo termine relativamente intatta; disorientamento temporale e nei casi più gravi anche spaziale con mancato riconoscimento delle persone.)
3. Disturbi psicomotori (ipo o iper-‐attività e imprevedibili passaggi dall'una all'altra forma; tempo di reazione aumentato; aumentato o diminuito flusso di parole)
4. Disturbo del ciclo sonno/veglia (insonnia o, nei casi più gravi, totale perdita del sonno o capovolgimento del ciclo sonno/veglia; sonnolenza diurna; peggioramento dei sintomi durante la notte; sogni disturbati o incubi che possono sfociare in allucinazioni durante la veglia)
5. Disturbi della sfera emozionale, come depressione, ansietà, paura, irritabilità, euforia, apatia.
insistere per strapparsi la fleboclisi, e per recarsi a casa di parenti che sono morti da anni.(13)
Riassumendo, il delirium o Sindrome confusionale è caratterizzato da alterazioni della coscienza e delle funzioni cognitive che si sviluppano in un breve arco di tempo, generalmente ore o giorni, e tendono a fluttuare nell’arco della giornata, con una maggiore gravità nelle ore serali o notturne.(12)
2.2.3. ETIOPATOGENESI
Il delirium può essere causato da patologie cerebrali o extracerebrali. La sindrome non è di solito dovuta ad una lesione localizzata, ma ad una diffusa compromissione del metabolismo neuronale o della stabilità di membrana. La fisiopatologia non è ancora molto conosciuta, anche se gli studi in questo senso stanno dando risultati sempre più attendibili. Comunque ci sono varie ipotesi che correlano alcuni meccanismi di malattie gravi con il delirio in terapia intensiva.
I principali meccanismi individuati sono:
1-Squilibrio dei Neurotrasmettitori
Si è teorizzato che il Delirium faccia parte di una manifestazione neuro comportamentale, dovuta allo squilibrio nella sintesi, rilascio e inattivazione dei neurotrasmettitori che normalmente controllano le funzioni cognitive, il comportamento e l’umore. (14)
Disordini di più sistemi di neurotrasmettitori sono stati implicati nella fisiopatologia del delirio, in particolar modo i sistemi che utilizzano come mediatori la dopamina e l’acetilcolina.
dopamina aumenta l’eccitabilità neuronale mentre l’acetilcolina la diminuisce. Uno squilibrio in uno o entrambi questi sistemi porta ad una instabilità neuronale e ad una neurotrasmissione che può risultare imprevedibile.
Nello specifico, un eccesso di dopamina (15) o la deplezione dell’acetilcolina (16), sono stati associati al delirio. È probabile che anche altri neurotrasmettitori giochino un ruolo importante nella patogenesi del delirio, come: l’acido γ-aminobutirrico (GABA), la serotonina, le endorfine e il glutammato. (14)
2-Infiammazione
L'infiammazione gioca un ruolo importante nella disfunzione di molti organi causata da malattie gravi (17), e le alterazioni infiammatorie indotte da endotossine e citochine probabilmente contribuiscono allo sviluppo di delirio in terapia intensiva.
I mediatori infiammatori prodotti durante malattie gravi (per esempio, il TNF-α, l'interleuchina-1, e altre citochine e chemochine) avviano una cascata di danno endoteliale, che porta alla formazione di trombina, e alla compromissione microvascolare(18). Studi in modelli animali hanno rivelato che questi mediatori infiammatori attraversano la barriera emato-encefalica (19), provocando l’aumento della permeabilità vascolare nel cervello (20), e modifiche all’elettroencefalogramma (EEG) che sono coerenti con quelle osservate in pazienti settici con delirium (21).
L'infiammazione può indurre una disfunzione cerebrale anche diminuendo il flusso sanguigno cerebrale attraverso la formazione di microaggregati di fibrina, piastrine, neutrofili ed eritrociti nel microcircolo cerebrale; attraverso la costrizione vascolare cerebrale
sintesi dei neurotrasmettitori e la neurotrasmissione (23).
3-Alterazioni del metabolismo ossidativo
Precedenti ipotesi, che ancora oggi rimangono rilevanti, tentano di spiegare il delirio come una manifestazione comportamentale di un diffusa riduzione del metabolismo ossidativo cerebrale con un conseguente squilibrio nella neurotrasmissione (24). Engel e Romano (25) hanno condotto degli esperimenti valutando i pazienti deliranti attraverso l’ EEG. Questi studi hanno dimostrato che il delirio è associato a un rallentamento diffuso nel tracciato EEG, e questo risultato si ritiene sia dovuto ad una riduzione del metabolismo cerebrale. Così, si è ipotizzato che il delirio è il risultato di un insufficienza cerebrale (ovvero un malfunzionamento globale del metabolismo ossidativo cerebrale), che,come risaputo, è un fattore importante nella patogenesi della disfunzione d'organo multipla in malattie gravi (26).
4-Disponibilità dei grandi aminoacidi neutri
I livelli dei neurotrasmettitori e la loro funzione possono essere influenzati da cambiamenti nelle concentrazioni plasmatiche dei loro precursori aminoacidici. Alcuni ricercatori hanno affermato che questa alterata disponibilità di grandi aminoacidi neutri contribuisca allo sviluppo di delirio (23). L’entrata degli aminoacidi nel cervello è regolata dal Large neutral Amino acid Transporter type 1(LAT1) (27). Il Triptofano, un aminoacido essenziale e precursore della serotonina, compete con alcuni grandi aminoacidi neutri (per esempio, la tirosina, la fenilalanina, la valina, la leucina e l’isoleucina) per il trasporto attraverso la barriera emato-encefalica attraverso i trasportatori LAT1.
attraverso la barriera emato-encefalica. Un aumento della captazione cerebrale di triptofano e fenilalanina, rispetto a quella degli altri grandi aminoacidi neutri, porta ad elevati livelli di dopamina e norepinefrina (noradrenalina), due neurotrasmettitori che sono stati implicati nella patogenesi del delirio (24).
2.2.4 PREVALENZA E SOTTOTIPI
La prevalenza del delirium nella popolazione generale è dello 0,4% negli adulti sopra i 18 anni e dell’ 1,1% in quelli sopra i 55 anni. Nella popolazione ospedalizzata invece la prevalenza aumenta: il delirio colpisce il 10% dei pazienti ricoverati in medicina interna, il 40% dei geriatrici (12), il 10% dei pazienti chirurgici, il 42% dei pazienti sottoposti a chirurgia ortopedica (28). Fra i pazienti ricoverati in terapia intensiva le percentuali di delirio sono intorno al 40% (29), con variazioni negli studi che variano dal 20 all’ 80% (29,30,31).
Negli anziani ricoverati circa il 10-15% presenta delirium all’ammissione e il 10-40% può ricevere diagnosi di delirium durante il ricovero. Fino al 60% dei residenti delle case di riposo di età superiore ai 75 anni può presentare delirium in qualsiasi momento. Fino al 25% dei pazienti ricoverati per cancro ed il 30-40% dei pazienti ricoverati per AIDS sviluppano delirium durante il ricovero. Fino all’80% dei pazienti con malattie terminali sviluppa delirium in
Tab. 2.2 - Meccanismi fisiopatologici responsabili del delirio in terapia intensiva
1. Squilibrio dei neurotrasmettitori 2. Infiammazione
3. Alterazioni del metabolismo ossidativo 4. Disponibilità dei grandi aminoacidi neutri
prossimità della morte. Il tasso di delirium in queste popolazioni dipende strettamente dalla natura delle condizioni mediche generali e dalle procedure chirurgiche associate.
Il delirium nei pazienti internistici si associa ad una significativa morbosità. I pazienti medici con delirium, in particolare gli anziani, presentano un rischio significativamente aumentato di complicazioni mediche, quali polmonite ed ulcere da decubito, che comportano una più lunga durata della degenza ospedaliera.(13) Tale patologia è causa di un aumentata durata del ricovero e di un’aumentata mortalità fra i pazienti ricoverati in UTI (32). Infatti un paziente affetto da delirio presenta diversi tipi di problemi clinici: per esempio ci possono essere problematiche nel passaggio da una ventilazione di tipo invasivo a una non invasiva, il delirante può estrarsi cateteri, drenaggi o accessi venosi, può presentare una condotta di tipo lesivo per sé e per gli altri, può necessitare di una prolungata ospedalizzazione al fine di monitorare i segni vitali (33). Il delirium inoltre si associa con un aumentato declino funzionale e rischio di istituzionalizzazione. I pazienti sopra i 65 anni con delirium hanno un rischio di istituzionalizzazione tre volte superiore, e un declino funzionale di circa tre volte superiore rispetto ai pazienti ricoverati senza delirium sia alla dimissione che dopo tre mesi dalla stessa. Nei pazienti operati, il delirium è segnale di recupero limitato e di peggiore esito a lungo termine, ed è spesso associato con un aumentato rischio di complicanze post operatorie, di un più lungo periodo di recupero postoperatorio, di più lunga ospedalizzazione e di aumentata disabilità a lungo termine.(13)
Il delirium può evolvere favorevolmente con restitutio a integrum, di solito in breve tempo(da alcune ore a qualche settimana), se il fattore eziologico può essere corretto o limitato in tempi brevi. Una maggior durata della sindrome, anche fino a sei mesi, si riscontra soprattutto nei casi in cui insorge nel corso di malattie croniche, quali carcinomi, endocarditi batteriche subacute, ed
epatopatie croniche. Tuttavia è importante ricordare che in alcuni casi si può avere un evoluzione verso lo stato stuporoso e il coma, con possibile esito fatale. Nei pazienti ospedalizzati la mortalità varia dall’ 11% al 65%, in relazione principalmente con la gravità della patologia medica alla base del delirium. (12)
I pazienti che sviluppano delirium durante il ricovero hanno anche un tasso di morte molto elevato nei mesi che seguono la dimissione. Fino al 15% dei pazienti anziani che hanno sviluppato delirium muore entro un mese e fino al 25% muore entro sei mesi dalla dimissione. Altri fattori di rischio, come il tipo di malattia, la gravità di quest’ultima, l’alterazione cognitiva preesistente e l’età, contribuiscono significativamente a questa associazione.(13)
Possono essere distinte tre varianti cliniche di delirio: la forma iperattiva o “agitata”, la forma ipoattiva o “letargica” e una forma detta “mista”, in quanto presenta caratteristiche di entrambe le precedenti forme di delirio.
Tab 2.3 - Forme cliniche di delirio
1. IPERATTIVO: Si osserva uno stato di agitazione psicomotoria: agitazione, nervosismo, irrequietezza, insonnia, comportamento aggressivo. Spesso caratterizzato da allucinazioni e disorientamento. È la forma più rara (vedi tab.1)
2. IPOATTIVO: Caratterizzato da lentezza o mancanza di movimenti, linguaggio povero spesso privo di tono, mancanza di risposta agli stimoli, confusione e sedazione. Meno frequenti le allucinazioni e le illusioni. In alcuni studi è associato ad una maggiore mortalità (34). È la forma più frequente nei pazienti >65 anni.(vedi tab.1)
3. MISTO: Si osserva un’alternanza di periodi di iperattività e periodi di ipoattività. È la forma più frequente. In particolar modo nei <65anni (vedi tab.1)
2.2.5 FATTORI DI RISCHIO
I fattori di rischio per il delirio possono essere suddivisi in fattori predisponenti e fattori precipitanti [37]. I fattori predisponenti sono presenti fin da prima il ricovero in terapia intensiva e sono difficili da alterare, mentre i fattori precipitanti possono presentarsi durante il corso della malattia e della degenza. Essi possono essere fattori propri delle patologie acute o essere iatrogeni; questi fattori rappresentano aree di rischio che sono potenzialmente modificabili con interventi preventivi o terapeutici. Solo pochi studi hanno esaminato i fattori di rischio per il delirio in terapia intensiva, ma numerosi fattori di rischio per il delirio sono stati identificati in pazienti non in terapia intensiva. La tabella 1 evidenzia i fattori che sono stati identificati sia in terapia intensiva che negli studi non-ICU. In uno dei più grandi studi, ad oggi, che ha esaminato i fattori di rischio per il delirio in terapia intensiva, Ouimet e collaboratori [21] hanno studiato 820 pazienti in terapia intensiva ed hanno stabilito che l'ipertensione, l'alcolismo, la gravità della malattia, e
l'esposizione a sedativi e analgesici (Quando questi vengono utilizzati per indurre il coma) aumentano la probabilità di delirio.
Tabella 2.5 - Fattori di rischio per il delirio
Dubois e colleghi [9] analogamente hanno trovato, studiando un campione di 216 pazienti, che l'ipertensione può essere un fattore di rischio per il delirio. Anche, la storia di fumo, l’iperbilirubinemia, la morfina e l'analgesia somministrata attraverso una via epidurale sono stati associati a delirio. Ad oggi, comunque, nessuno studio ha confermato questo tipo di associazione. In
Fattori Predisponenti Fattori Precipitanti ♦ Età avanzata (>65 aa)
♦ Demenza, Depressione Ansietà ♦ Terapie multi farmacologiche ♦ Ipertensione
♦ Condizione medica severa (compr. Cardio-polmonare, Disturbi endocrino-metabolici, Affezioni cerebrali (traumi; neoplasie; vascolari) ♦ Deficit sensoriale ♦ Alcolismo, Tossicodipendenza, Tabagismo ♦ Chirurgia maggiore ♦ Anestesia generale (Tecnica,Farmaci)
♦ Ipossiemia, ipotensione (eventi avversi perioperatori) ♦ Farmaci psicoattivi ♦ Ventilazione Meccanica ♦ Sepsi ♦ Alterazione metabolismo ed elettroliti ♦ Deprivazione di Sonno Altri fattori:
♦ Conduzione di una vita isolata ♦ Durata dell’ospedalizzazione
♦ Presenza di catetere vescicale o sondino naso-gastrico ♦ Isolamento
♦ Mancanza di luce naturale
uno dei rari studi fatti per esaminare se vi sia una predisposizione genetica al delirio in terapia intensiva,Ely e collaboratori [38] hanno valutato l'associazione tra il genotipo dell’ Apolipoproteina E (APOE) e la durata del delirio nei 53 pazienti in ventilazione meccanica. I pazienti con il polimorfismo apoE4 (un fattore di rischio per la malattia di Alzheimer) hanno manifestato uno stato delirante per un tempo doppio rispetto a quelli senza il polimorfismo apoE4. Studi più grandi sono in corso per confermare questa associazione. Altri fattori associati con delirio in terapia intensiva sono:
l’età avanzata, un deterioramento cognitivo di base, disturbi metabolici (Per esempio, disordini del sodio, calcio e presenza nel sangue di alte concentrazioni di azoto e urea), infezioni acute, malattie respiratorie, acidosi, anemia e l’ ipotensione [10,39,40].
I pazienti critici sono particolarmente esposti a numerosi fattori che possono precipitare il delirio. In uno studio di 53 pazienti in terapia intensiva medica, Ely e collaboratori [2] hanno identificato una media incredibile di 11 fattori di rischio per paziente.
Due fattori di rischio per delirio presenti in quasi tutti i pazienti della terapia intensiva sono risultati essere l'esposizione ai sedativi e ai farmaci analgesici e la privazione del sonno.
Sedativi e farmaci analgesici
Sedativi e farmaci analgesici sono somministrati di routine nei pazienti sottoposti a ventilazione meccanica per ridurre il dolore e l'ansia, come raccomandato dalla Society of Critical Care Medicine(SCCM) [42].
Molteplici studi hanno dimostrato un'associazione tra delirio e l'esposizione a farmaci sedativi e analgesici.
I sedativi che risparmiano i recettori per il GABA, come gli oppioidi e la dexmedetomidina (un agonista dei recettori α2), possono ridurre il rischio di delirio in pazienti in terapia intensiva, rispetto al rischio attribuibile alle benzodiazepine.
Gli studi hanno costantemente identificato il lorazepam e il midazolam quali fattori di rischio per delirio, mentre i dati relativi agli oppioidi sono meno consistenti. Per esempio, Ouimet e collaboratori [21] hanno osservato che dosi medie giornaliere di oppioidi sono state più elevate tra i pazienti in terapia intensiva senza delirio che tra i pazienti affetti da delirio.
Disturbi del sonno
L'associazione tra disturbi del sonno e delirio in terapia intensiva non è stato ancora ben studiato. D’altro canto e conosciuto il fatto che la privazione del sonno altera le cognizioni [46] e quindi lo studio della relazione tra sonno durante la malattia critica e il delirio è una promettente area di ricerca. In media, i pazienti in terapia intensiva riescono a dormire solo 2 ore al giorno [47], e meno del 6% del loro sonno è costituito da sonno REM.
Cooper e collaboratori [48] hanno studiato 20 pazienti ventilati meccanicamente in terapia intensiva con la polisonnografia e hanno osservato che ogni paziente ha un sonno gravemente perturbato o del tutto assente. Questi disturbi possono incidere negativamente sulla sintesi proteica, l'immunità cellulare e umorale e sull'energia spesa e, infine, possono contribuire a disfunzioni d’organo come il delirio.
Il rumore che può esserci in una terapia intensiva, in seguito alle varie attività sanitarie rappresenta solo una causa minore dei risvegli de pazienti in terapia intensiva, mentre le alterazioni metaboliche, la ventilazione meccanica e l'esposizione a farmaci sedativi e analgesici probabilmente svolgono un ruolo più significativo nei disturbi del sonno[49].
Quindi i farmaci sedativi e analgesici sono un fattore di rischio sia diretto che indiretto (attraverso la perturbazione del sonno) per lo sviluppo di delirio. Proprio per questo alcuni ricercatori hanno privilegiato gli studi che cercano di comprendere le relazioni tra l’esposizione a sedativi e analgesici, i disturbi del sonno e le disfunzioni cerebrali nei pazienti critici.
2.3 IL DISTURBO POST-TRAUMATICO DA STRESS
2.3.1 DEFINIZIONE E CRITERI DIAGNOSTICI
Il disturbo post-traumatico da stress (Post Traumatic Stress Disorder, PTSD), o forse meglio, disturbo da stress traumatico, si caratterizza per un peculiare quadro psicopatologico che si sviluppa in connessione causale con un evento di grande impatto emotivo, che supera le normali capacità di adattamento. Oltre alla tipologia dell’evento (guerre, incidenti, disastri di varia natura, episodi di violenza ecc.) sembrano essere importanti le modalità con le quali esso si verifica, la gravità, la durata e la vicinanza dell’esposizione all’evento(12).
Secondo quanto riportato dal DSM.IV-TR, la caratteristica essenziale del disturbo post-traumatico da stress è lo sviluppo di sintomi tipici che seguono l’esposizione ad un fattore traumatico estremo che implica l’esperienza personale diretta, di un evento che causa o può comportare morte o lesioni gravi o altre minacce all’integrità fisica; o la presenza ad un evento che comporta morte, lesioni o altre minacce all’integrità fisica di un'altra persona; o il venire a conoscenza della morte violenta o inaspettata, di grave danno o minaccia di morte o lesioni sopportate da un membro della famiglia o da altra persona con cui è in stretta relazione(CritetioA1). La risposta della persona all’evento deve comprendere paura intensa, il sentirsi inerme o il provare orrore (oppure, nei bambini, la risposta deve comprendere comportamento disorganizzato o agitazione) (Criterio A2). I sintomi caratteristici che risultano dall’esposizione ad un trauma estremo includono il continuo rivivere l’evento traumatico (Criterio B), l’evitamento persistente degli stimoli associati con il trauma, l’ottundimento della reattività generale (Criterio C) e sintomi costanti dell’aumento dell’arousal (Criterio D). Il quadro
sintomatologico completo deve essere presente per più di un mese (Criterio E) e il disturbo deve causare disagio clinicamente significativo o menomazione del funzionamento sociale, lavorativo o di altre aree importanti (Criterio F) (13).
2.3.2 ETIOPATOGENESI
Neuroanatomia:
Secondo il modello neurobiologico, può essere distinta una memoria a breve termine (di lavoro) ed una a lungo termine, quest’ ultima a sua volta distinguibile in una dichiarativa (cosciente,esplicita) ed una procedurale (repressa, implicita). Mentre la memoria dichiarativa utilizza il circuito che fa capo all’ippocampo, una struttura dedicata all’acquisizione ed al mantenimento dei nuovi ricordi coscienti, la memoria procedurale fa capo all’ amigdala, struttura che media l’esperienza emotiva della paura.
Le due vie sono completamente indipendenti. Mentre nell’amigdala le connessioni neurali che mediano le associazioni traumatiche tendono a rimanere intatte per tutta la vita del paziente, l’ippocampo, che si è perfezionato nella capacità di ricordare i dettagli e le sfumature degli eventi presenta una maggiore plasticità e dunque dimentica con più facilità.
I ricordi lampo (flashbulb memories) e l’amnesia o i falsi ricordi caratterizzano i disturbi post traumatici. I ricordi lampo possono essere attribuiti alla liberazione di cortisolo e catecolamine in seguito alla “risposta di lotta o fuga” che segue uno stress. Il cortisolo agisce con un’azione opposta su amigdala e ippocampo.
Sull’amigdala ne aumenta l’attività cosi da avere un rinforzo della memoria emozionale legata all’evento, sull’ippocampo invece ha un’azione di soppressione così che la memoria cosciente risulta essere confusa o assente. E’ attraverso questo meccanismo che si creano i ricordi di sentirsi “ seppelliti
vivi” o di una “morte silenziosa” riferiti da tante vittime di un PTSD.
Per quanto riguarda il meccanismo della false memorie è dimostrato che durante situazioni traumatiche il soggetto può trattenere sia vere che false tracce mnesiche. La vittima di un trauma spesso utilizza meccanismi quali la dissociazione dei sentimenti o l’amnesia per fronteggiare l’evento. La liberazione di cortisolo durante uno stress provocherebbe una riduzione del volume dell’ippocampo destro di circa l’ 8% nei pazienti con PTSD e la riduzione del volume sarebbe proporzionale alla durata dell’evento stressante. La creazione delle false memorie sarebbe dovuta al tentativo di colmare gli intervalli vuoti tra quello che si prova realmente grazie alle sensazioni di paura generate dall’amigdala e la frammentata memoria dichiarativa che proviene dall’ ippocampo.
Attraverso studi di diagnostica funzionale condotti con la PET, i ricercatori sono stati inoltre in grado di discriminare i ricordi veri dalle false memorie in quanto associati a differenti modelli di attività cerebrale. Quando si compara l’attività regionale cerebrale durante un ricordo vero ed un ricordo falso, in entrambi si ha un aumento di attività dell’ ippocampo sinistro e questo spiega il perché i ricordi falsi sembrano perfettamente reali alla persona che li prova. Tuttavia soltanto le memorie vere sono associate ad un aumento dell’ attività della corteccia temporo- parietale sinistra dove viene processata l’ informazione verbale uditiva. Memorie vere e memorie false sono dunque associate a schemi di attività neurale differenti ma parzialmente sovrapposti. Ci possiamo chiedere dunque se si può guarire da un simile evento o se questo è destinato a rimanere una ferita indelebile per la nostra mente. Il PTSD è un evento che richiede un intervento psicoterapeutico che attraverso la rielaborazione dell’esperienza traumatica volga ad ottenere una sua completa rielaborazione nella vita psichica del paziente così che il trauma venga distanziato e da fatto attuale possa divenire un evento storico.
breve termine e di SSRI, TCI e iMAO nel trattamento prolungato così da ottenere il controllo del quadro sintomatologico (50).
Neurobiologia:
Il modello dello “shock inevitabile” nell’animale da laboratorio sembra suggerire che nella fisiopatologia del PTSD siano coinvolti i sistemi noradrenergico, dopaminergico, serotoninergico, degli oppioidi endogeni e l’asse ipotalamo-ipofisi-surrene.
La serotonina (5HT) sembra essere interessata nella risposta allo stress e
avrebbe un ruolo nella patogenesi di alcuni sintomi del PTDS in rapporto all’attività modulatoria della 5HT sul Locus Coeruleus, centro noradrenergico fondamentale nelle reazioni di paura. La risposta d’allarme (Startle reflex) è aumentata nei pazienti con PTSD, i quali sobbalzano per stimoli di intensità anche moderata (Criterio D del DSM-IV-DR). Il sistema serotoninergico sembra svolgere un ruolo di inibizione nei confronti dello startle reflex. Inoltre le vie serotoninergiche sembrerebbero anche coinvolte nell’evitamento e nel superamento e adattamento allo stress cronico.
Lo stress determina un aumento del turnover della Noradrenalina nel locus coeruleus, nelle aree limbiche e nella corteccia cerebrale. Alcuni studi psicofisiologici condotti su pazienti affetti da PTSD hanno dimostrato l’incremento della reattività del sistema autonomico (aumento della frequenza cardiaca e della pressione arteriosa in condizioni basali e specialmente in seguito a esposizione a stimoli visivi o uditivi associati al trauma) che è mediata dal sistema noradrenergico.
L’iperattività dei sistemi dopaminergici centrali indotta dallo stress potrebbe determinare alcuni sintomi del PTSD come lo stato di tensione continua, gli attacchi di panico, l’ipervigilanza, e le esagerate risposte d’allarme.
Nello stress non traumatico si verifica un innalzamento del cortisolo plasmatico mentre in quello traumatico una riduzione. A essa seguirebbe, come già detto, un incremento compensatorio dell’attività recettoriale per i glucocorticoidi a livello ippocampale che potrebbero svolgere un effetto “tossico” responsabile dell’ipotrofia dell’ippocampo e conseguentemente delle turbe mnesiche nei pazienti con PTSD.
In seguito ad uno stress acuto si verifica il rilascio di oppioidi endogeni con conseguente analgesia. L’appiattimento emotivo (numbing), tipico del PTSD, potrebbe essere correlato ad una disfunzione del sistema oppioide insorta dopo il trauma. La successiva esposizione a eventi traumatici determinerebbe un aumento degli oppioidi endogeni che potrebbe spiegare il così detto addiction to trauma (ricerca compulsiva di situazioni pericolose) che è facilmente riscontrabile in pazienti affetti da PTDS, così come in persone che hanno subito traumi psichici. La riesposizione a situazioni stressanti evocherebbe una risposta degli oppioidi a livello cerebrale con conseguente sensazione soggettiva di calma (12).
2.3.3 EPIDEMIOLOGIA
Studi di comunità effettuati negli Stati Uniti hanno rilevato una prevalenza lifetime del PTSD di circa l’8% nella popolazione adulta, più elevata nel sesso femminile (fino al 16% nelle giovani donne).
Secondo il United States National Comorbidity Survey, circa il 55% della popolazione americana è esposta nel corso della vita ad almeno un evento traumatico. I traumi più frequenti, con una prevalenza doppia negli uomini rispetto alle donne, sono l’essere testimone di un evento drammatico (25%), un incidente con rischio per la vita (20%), un disastro naturale (17%), una minaccia personale con un arma (13%). Più comuni nelle donne sono la
violenza sessuale (12%) e lo stupro (9%).
Lo sviluppo del PTSD sembra essere proporzionale alla gravità del trauma, con percentuali del 7% per l’essere testimoni di un evento drammatico e di oltre il 50% per lo stupro. L’evento che più frequentemente causa il PTSD (31% dei casi) è la morte improvvisa e traumatica di un parente o ci un conoscente (12).
Nei pazienti dimessi dalla terapia intensiva, il PTSD o sintomi di PTSD sono riportati tra il 5% e il 63% dei casi (45).I fattori di rischio includono la durata del ricovero in terapia intensiva, la durata della ventilazione, l’utilizzo di elevate dosi di benzodiazepine, la pre-esistente storia psichiatrica e la presenza di ricordi deliranti o esperienze psicotiche. Meno importanti, in questo caso, la giovane età e il sesso femminile (46)(vedi Tab.2)
È importante tenere di conto però che i tassi di prevalenza del PTSD dopo dimissione dalla terapia intensiva tendono ad essere estremamente elevati rispetto alle popolazioni di altri traumi, compresi i pazienti medici e chirurgici, e sono probabilmente sovrastimati, in quanto gli studi sul PTSD a seguito di malattia critica sono caratterizzati da significative carenze metodologiche, che sollevano questioni chiave sul tasso di prevalenza effettiva del PTSD e la generalizzabilità dei risultati degli studi.
Tab. 2.6 - Fattori di rischio per lo sviluppo di PTDS o di Sintomi di PTDS alla dimissione dalla terapia intensiva
1. Durata del ricovero 2. Durata della ventilazione
3. Utilizzo di elevate dosi di Benzodiazepine 4. Pre-esistente storia psichiatrica del paziente 5. Ricordi “spaventosi” legati al recovero 6. Esperienze psicotiche durante il ricovero
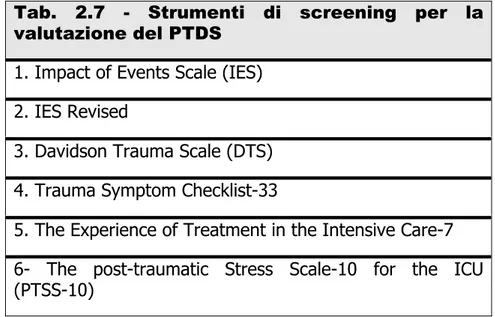
I futuri studi sul PTSD dovranno essere metodologicamente più rigorosi e dovrebbero usare un campione più grande e più omogeneo, impiegando una diagnostica completa al posto dei test di screening e dei vari strumenti finora utilizzati (vedi Tab.3) (45).
2.3.4 DECORSO
Per quanto riguarda la modalità di esordio, il PTSD insorge tipicamente dopo un esperienza traumatica. Tuttavia, in alcuni pazienti, il quadro del PTSD compare ad una certa distanza dal trauma. Se l’esordio si verifica dopo più di sei mesi dal trauma, il PTSD è considerato a esordio ritardato; in tal caso lo sviluppo del disturbo può essere determinato da un qualsiasi evento che richiama, anche solo per aspetti secondari, l’evento primario.
Riguardo alla durata dei sintomi, il DSM-IV-TR considera la diagnosi di
disturbo acuto da stress per quei pazienti nei quali i sintomi del PTSD hanno
una durata inferiore ad un mese. Per i soggetti nei quali i sintomi durano più di un mese, ma meno di tre, viene posta la diagnosi di PTSD acuto, mentre per quelli i cui sintomi persistono per oltre tre mesi è prevista la diagnosi di
PTDS cronico (percentuali significative di veterani di guerra presenta il
Tab. 2.7 - Strumenti di screening per la valutazione del PTDS
1. Impact of Events Scale (IES) 2. IES Revised
3. Davidson Trauma Scale (DTS) 4. Trauma Symptom Checklist-33
5. The Experience of Treatment in the Intensive Care-7
6- The post-traumatic Stress Scale-10 for the ICU (PTSS-10)
disturbo anche a distanza di 40 anni; più del 10% delle vittime di stupro lo presenta anche dopo 15 anni). Nella letteratura sono segnalate anche forme ricorrenti di PTDS caratterizzate da fasi di remissione di durata anche consistente, alternate a fasi di riesacerbazione in coincidenza dell’esposizione a stressor psicosociali (lutto, problemi economici) oppure in risposta a ricordi del trauma o a nuovi eventi traumatici (12).
Le conseguenze a lungo termine di tale patologia hanno effetto non solo sul ricovero in terapia intensiva, ma soprattutto possono determinare un ritardo nel processo di guarigione e nella ripresa di una vita normale da parte del paziente (47, 48).
3. Studio Clinico
3.1 OBIETTIVI DELLO STUDIO
• Valutare se due modalità di sedazione in terapia intensiva, sedoanalgesia vs analgosedazione, sono caratterizzate da una differenza di incidenza di delirio.
• Stabilire quale rapporto sussista tra delirio e sviluppo di disturbo post-traumatico da stress nel paziente dimesso dalla terapia intensiva
3.2 MATERIALI E METODI
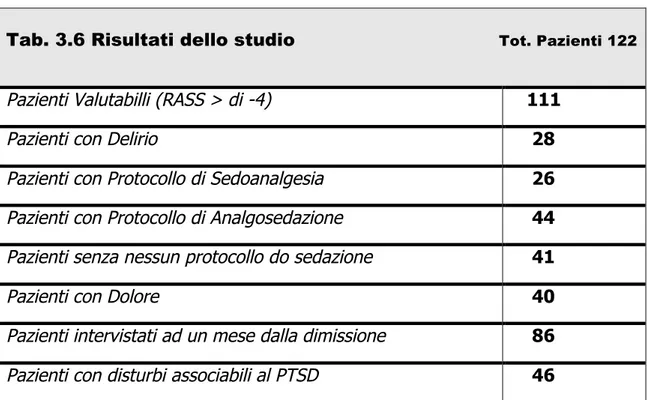
Sono stati studiati 122 pazienti ricoverati presso l'U.O. IV Rianimazione dell'Ospedale S. Chiara di Pisa tra il 26 Ottobre 2009 e il 26 Gennaio 2010. I criteri di esclusione prevedevano: Età del paziente minore di 18 anni, ricovero in seguito a trauma cranico, ricovero in seguito a interventi di neurochirurgia, anamnesi positiva per malattie psichiatriche
Tab. 3.1 - Criteri di Esclusione 1.Paziente <18 aa.
2. Ricovero in seguito a trauma cranico
3.Ricovero in seguito a interventi di neurochirurgia 4. Anamnesi positiva per malattie psichiatriche
All’ingresso di ogni paziente sono stati raccolti alcuni dati generali ed il
SAPS II score (Tab. 3.2).
I dati generali comprendevano:
• Nome, cognome, età e livello d’istruzione del paziente
• Reparto di provenienza del paziente, Data e Motivo del ricovero nella nostra U.O.
• Diagnosi di ammissione e stato clinico
• Tipo e Data dell’eventuale intervento chirurgico (se effettuato) e tipologia dell’eventuale anestesia
• Breve anamnesi patologica remota, anamnesi patologica remota respiratoria e cardiovascolare
• Protocollo di sedazione
Dopo l’ammissione al reparto, quotidianamente, per tutto il periodo della degenza, venivano effettuate due rilevazioni, una al mattino, tra le ore 8.00 e le 9.00, ed una il pomeriggio, tra le 19.00 e le 20.00, in cui venivano raccolti i seguenti dati:
• Tipo di Ventilazione • Pressione Arteriosa • Frequenza Cardiaca
• Dolore: valutato attraverso la scala NUMERICA VERBALE
• PaO2 e la PaCO2 1
• Il pH, l’eccesso di basi (BE) e la concentrazione di Bicarbonati
(NaHCO3)1
• La concentrazione degli ioni: Sodio(Na), Potassio(K), Cloro(Cl) e
Calcio(Ca)1
• La Glicemia1
• Il SOFA score (tabella 3.2)
• Utilizzo di farmaci vasoattivi e/o inotropo positivi
Protocollo di sedoanalgesia: ⇒ Propofol 2%, 2,5-3 mg/Kg/h
⇒ Remifentanil 0,05 gamma/Kg/min
Protocollo di Analgosedazione: ⇒ Remifentanil, 0,2-0,25 gamma/Kg/min
⇒ Propofol 0,5-1 mg/Kg/h
*i punteggi SOFA sono evidenziati in grassetto SOFA Score* Apparato Respiratorio (PaO2/FiO2) Coagulazione
(Piastrine) Fegato (Bilirubina)
<100 in VM 4 <20000 4 >12 4 <200 in VM 3 <50000 3 6-‐11.9 3 <300 2 <100000 2 2-‐5.9 2 <400 1 <150000 1 1.2-‐1.9 1 Apparato Cardiovascolare (Ipotensione) SNC (Glasgow
Coma Score) Creatininemia DOPA > 15
oppure > oppure DIURESI 5mg/dl <200ml/24h 4 4 NORA > 0.1 < 6 4 DOPA > 5 oppure 3 NORA <= 0.1 6-‐9 3 3.5-‐4.9 mg/dl oppure DIURESI <500ml/24h 3 DOPA <= 5 oppure 2 DOBU (any dose) 10-‐12 2 2-‐3.4 mg/dl 2 MAP > 70 mm/Hg 1 13-‐14 1 1.2-‐1.9 1 mg/dl
Tab.3.2 - Sofa Score:
Il SOFA Score (Sequential Organ Failure Assessment) è un punteggio clinico utilizzato per valutare lo stato del paziente durante il ricovero nella ICU. Esso determina l’estensione delle funzioni o dei danni degli organi del paziente. Il SOFA è dato dalla somma dei punteggi derivanti dall'analisi di 6 sistemi (respiratorio, cardiovascolare, epatico, coagulatorio, renale, neurologico) graduati da 0 a 4 in accordo col grado di disfunzione o danno del sistema