AGGIORNAMENTI IN RIPRODUZIONE
BOVINA E BUFALINA
Tesi di Dottorato di:
MICHELANGELO LA SPISA
Tutor:
Chiar.ma Prof.ssa: Antonina ZANGHI’
Anno accademico 2018 / 2019
UNIVERSITÀ DEGLI STUDI DI MESSINA DIPARTIMENTO DI SCIENZE VETERINARIE
INDICE
Abstract pag. 4
Linea di ricerca 1. Primi dati sulla MOET (Multiple Ovulation
and Embryo Transfer) nella bovina Modicana pag. 6
• Introduzione pag. 7
• Scopo dello studio pag. 33
• Materiali e metodi pag. 33
• Risultati pag. 52
• Discussioni pag. 55
Linea di ricerca 2. Monitoraggio di un caso di tumore a cellule
della granulosa: considerazioni cliniche ed ormonali pag. 59
• Caso clinico pag. 60
• Discussioni pag. 70
Linea di ricerca 3. Resynch in bufale siciliane: dati preliminari
pag. 80
• Introduzione pag. 81
• Materiali e metodi pag. 108
• Risultati pag. 113
• Discussioni pag. 116
Ringraziamenti pag. 122
ABSTRACT
This PhD thesis includes 3 lines of research. A first study was the optimization of the protocol of multiple ovulation and embryo transfer (MOET) in the Modicana breed, a minor italian cattle breed, autochthonous of Sicily. Our data suggested that a low dose of FSH is effective for MOET schedules in Modicana breed. Despite individual differences, Modicana breed is candidate to be a good embryo producer among dairy cattle breeds. A second line of research included the study of a long-standing granulosa cell tumour in a 6-year-old Holstein Friesian cow with irregular heats. The clinical findings underlined the effects on the genital tract caused by a prolonged exposition to E2, AMH and INH. Ultrasound, E2, INH and AMH evaluations were confirmed to be helpful for the diagnosis of GTCT. A third study was on an intense experience of resynchronization in Sicilian domestic buffalos. The reproductive efficiency of this species is often poor because of late sexual maturity, seasonal ovarian activity, prolonged postpartum anoestrus and consequent prolonged calving intervals. This study confirmed that Resynch may be applied in the buffalo breeding in Sicily. It may be useful to answer to the market demand of milk and “mozzarella” in the summer period, contrasting the spontaneous seasonality (short day breeders).
Linea di ricerca 1
PRIMI DATI SULLA MOET (MULTIPLE OVULATION
AND EMBRYO TRANSFER) NELLA BOVINA MODICANA
(La Spisa M; Marino G; Zanghì A; Chiofalo V (2018). First data of multiple ovulation and embryo transfer in Modicana cows. 72° Congress of the Italian Society of Veterinary Sciences (SISVet) & 16° Congress of the Italian Society of Animal Reproduction (SIRA), Turin 20-22 June 2018. ISBN: 978-8890909214 (p. 354).
INTRODUZIONE
La Multiple Ovulation Embryo Transfer (MOET) è una tecnica riproduttiva ampiamente diffusa nella specie bovina, praticata nelle aziende zootecniche da più di un quarantennio con lo scopo di ottenere un rapido miglioramento genetico ed un incremento della produttività. Una bovina generalmente genera 1 vitello l’anno e 4-5 in tutta la sua vita; con la MOET è potenzialmente in grado di generare 6-8 embrioni ogni 2 mesi, quindi potenzialmente anche 40-50 l’anno. Questa tecnica riproduttiva permette di prelevare gli embrioni da un soggetto definito “donatrice” e trasferirli ad altri soggetti “riceventi”. Tutte le operazioni possono essere effettuate direttamente in allevamento e il trasferimento degli embrioni nella ricevente può anche effettuarsi altrove, vista la possibilità di congelare gli embrioni prelevati.
La prima prova coronata da successo, che ha portato alla nascita di un vitello da una procedura di ET, ha avuto luogo nel 1951 (Willett et al 1951) e nel 1973 è nato il primo vitello in seguito al trasferimento di un embrione congelato (Wilmut e Rowson 1973). Nel 1976, con l’applicazione di tecniche non
chirurgiche per il prelievo degli embrioni, l’ET cominciò ad essere diffuso nelle razze da latte. Negli anni ‘90 la tecnica è stata affinata con il sessaggio embrionale e con lo splitting. Oggi le nuove frontiere sono l’utilizzo del seme sessato, la biopsia embrionale per la genomica e l’embryo therapy. Si calcola che ogni anno si effettuano nel mondo 100.000 flushing, la metà circa solo in Nord America, sia in razze da latte (57%) che da carne (43%). In Europa, solo l’Olanda e la Francia effettuano circa 6000 flushing l’anno, l’Italia 2000 (Fonti IETS: International Embryo Transfer Society).
L’ET si esplica attraverso diverse fasi:
• Selezione delle bovine donatrici e delle riceventi • Sincronizzazione dei cicli
• Superovulazione delle donatrici • Fecondazione
• Flushing
• Valutazione e stoccaggio degli embrioni • Trapianto embrionale nelle riceventi
Selezione donatrice e riceventi. Il vero fattore limitante
della MOET è la selezione della bovina donatrice. In uno studio effettuato su 2048 bovine da carne, in media venivano prodotti per ciascun trattamento 6,2 embrioni trasferibili; il 30% delle bovine produceva il 70% degli embrioni, mentre il 24% delle bovine non dava nessun embrione (Looney 1986). Dati simili sono stati riscontrati in un gruppo di 987 vacche da latte (Lerner et al 1986).
Indipendentemente dall’impiego dei criteri di selezione della donatrice (anamnesi riproduttiva, età e stato nutrizionale), una bovina verrà classificata come buona o cattiva donatrice solo quando verrà sottoposta a un trattamento di MOET.
La donatrice (vacca o manza) è scelta di concerto con l’allevatore sulla base delle caratteristiche genetiche (morfologia, incremento ponderale, produzione di latte); tuttavia, deve possedere dei requisiti minimi stabiliti dalla legge (D.M. 172/94). In particolare le donatrici devono: essere iscritte agli albi genealogici; essere rimaste nel territorio dello Stato nei 6 mesi precedenti; provenire da un allevamento ufficialmente indenne da leucosi bovina enzootica o che non abbiano presentato, negli
ultimi 3 anni, alcun segno clinico riferibile alla malattia; provenire da un allevamento le cui bovine non abbiano presentato, nell'anno precedente, alcun segno clinico riferibile a rinotracheite infettiva/vulvo vaginite pustolosa; aver soggiornato nei 6 mesi precedenti in non più di due diverse mandrie di stato sanitario inferiore; nel giorno della raccolta, essere in un’azienda non oggetto di misure di interdizione o quarantena e che non presenti segni clinici di malattia.
Con il fine di garantire lo stato di salute ottimale della donatrice e di ottimizzare la risposta superovulatoria, le bovine devono essere almeno a 80-90 giorni post-parto, con una body condition score (BCS) di circa 3,5 e a una distanza di almeno 60 giorni da una eventuale pregressa superovulazione. La bovina deve essere clinicamente sana, fertile e in bilancio energetico positivo. Non deve aver presentato condizioni patologiche quali complicazioni puerperali, ritenzioni placentari e infezioni uterine e deve aver manifestato almeno 2-3 calori con intervalli regolari. Inoltre i trattamenti antiparassitari e le vaccinazioni devono essere effettuate almeno 30 giorni prima (Guarneri 2013).
un’ondata follicolare ossia, in vacche da latte a 2 ondate, al giorno 0 o con maggiore frequenza al giorno 10. In tali giornate con un accurato esame ecografico è possibile valutare il pool follicolare mediante conta dei follicoli superiori a 2-3 mm di diametro e fare una previsione della risposta superovulatoria. È stato infatti dimostrato che il numero di follicoli antrali di 2-3 mm presenti in questo momento è correlato al numero di embrioni trasferibili (Singh et al 2004). Con lo stesso scopo è stato proposto il dosaggio dell’ormone antimülleriano (AMH), prodotto da tutti i follicoli antrali presenti sull’ovaio (Rico et al 2009; Abdel et al 2017; Hirayama et al 2017).
La bovina donatrice al momento della visita possiede un corpo luteo fisiologico, o in formazione (giorno 0) o diestrale (giorno 10). La dimensione del corpo luteo è correlata alla concentrazione di progesterone e le vacche con livelli di progesterone elevati, secondo alcuni Autori, risponderebbero meglio alla superovulazione (Kayacik et al 2005; Kudlàč et al 1991); tuttavia, secondo altri Autori, livelli di progesterone troppo alti potrebbero inibire l’ondata follicolare (Tamboura et al 1985). Livelli bassi di progesterone potrebbero determinare,
invece, follicoli grandi, anche anovulatori (El-Sherry et al 2010). Il trasferimento di embrioni viene effettuato su vacche o su manze, preventivamente selezionate sulla base dell’età, delle caratteristiche morfologiche (BCS) e riproduttive. In genere si selezionano manze cicliche, di 14–15 mesi di età che abbiano raggiunto un peso di almeno 350 kg al momento del trasferimento; è essenziale che la ricevente abbia una conformazione tale da garantire la nascita di vitelli di grandi dimensioni. Inoltre è fondamentale che la ricevente possieda il giorno del trapianto un corpo luteo di 7 giorni circa, dalle ottimali caratteristiche morfologiche (diametro >20 mm, sporgenza). Ciò si ottiene attraverso protocolli di sincronizzazione o sfruttando i calori naturali e attraverso uno specifico esame clinico dell’apparato genitale prima di procedere al trapianto, per valutare la qualità del corpo luteo.
Recentemente è stato studiato l’impiego dell’ecografia Doppler per selezionare le riceventi migliori (Kanazawa et al 2016; 2017). Secondo questi studi una buona ricevente deve avere un corpo luteo con un’area di perfusione superiore a 0,5 cm2 e la somministrazione di GnRH al 5° giorno potrebbe
migliorare la perfusione del corpo luteo e di conseguenza la sensibilità della rilevazione Doppler.
Sincronizzazione dei cicli delle donatrici e delle riceventi. Poiché il tasso di attecchimento dell’embrione
trasferito dipende dall’ambiente uterino cui sarà esposto (ricevente), che deve essere simile all’ambiente uterino di origine (donatrice), risulta necessario sincronizzare donatrici e riceventi. Se il flushing della donatrice ha luogo a 7 gg dal calore, la ricevente dovrebbe trovarsi anche a giorno 7. Un’asincronia minima è tollerata, tuttavia i migliori risultati si hanno con riceventi a 7-8 giorni (Rodrigues et al 2018). Qualsiasi protocollo può essere impiegato per sincronizzare donatrici e riceventi. Essendo per definizione animali ciclici s’impiegano essenzialmente prostaglandine.
Superovulazione donatrice. La superovulazione è una
tecnica che si basa sull’utilizzo di FSH (e LH), estratto dalle ipofisi ovine o porcine, per indurre lo sviluppo e l’ovulazione di più follicoli nella bovina donatrice. I due prodotti commerciali
approvati in Italia (Pluset e Folltropin) hanno differenti quantità di LH (ratio LH/FSH: 1 vs 0,12) ma danno risultati simili se analizzati in termini di embrioni trasferibili (Mikkola e Taponen 2017). Nonostante le indicazioni riportate nel foglietto illustrativo, la dose finale di FSH è aggiustata empiricamente in relazione all’attitudine, razza ed età. Negli animali da latte si dovrebbero impiegare 700 UI di Folltropin o 1000 UI di Pluset. Tendenzialmente sarebbe meglio usare dosi basse per limitare l’effetto deleterio dell’LH sullo sviluppo follicolare e sugli ovociti (Ferrè et al 2016; Mikkola e Taponen 2017), soprattutto utilizzando il Pluset. In uno studio, la dose totale di Folltropin e Pluset in bovine da latte Ayrshire e Holstein veniva utilizzato il 90% (630 UI di Folltropin) e l’85% (850 UI di Pluset) della dose raccomandata dal produttore (Kaimio et al 2013; Mikkola e Taponen 2017). Nelle manze, seguendo le indicazioni del Pluset, si dovrebbero impiegare 800 UI di FSH, mentre sempre 700 UI utilizzando il Folltropin, oppure rapportare la dose usata nelle vacche alla taglia della manza, riducendo in pratica la dose del 50-80% (Mikkola e Taponen 2017). Nelle bovine da carne si dovrebbero impiegare 800 UI (Pluset) o 700 UI (Folltropin),
sebbene in Angus sono descritte 1000 UI di FSH (Rodrigues et al 2018), ma nelle bovine Marchigiane sono state utilizzate solo 300 UI (Biancucci et al 2016).
Il dosaggio va poi distribuito in somministrazioni costanti o decrescenti ogni 12 h per 4-5 giorni, a causa della breve emivita dell’FSH. Prolungando il periodo di somministrazione (7 giorni) sono stati descritti miglioramenti della risposta superovulatoria (Garcìa Guerra et al 2015); soprattutto nelle bovine da carne, con temperamento nervoso, le punture giornaliere potrebbero arrecare stress e traumi. In questi casi si sta cercando, al contrario, un sistema a lento rilascio, effettuando somministrazioni sottocutanee o diluendo l’FSH in una matrice con acido ialuronico e riducendo i trattamenti ad 1-2 (Bò et al 1994; Biancucci et al 2016).
La superovulazione deve iniziare all’emergenza di una nuova ondata follicolare (in una bovina a 2 ondate follicolari l’emergenza si ha a giorno 0 e giorno 10). Se la superovulazione inizia dopo la selezione del follicolo dominante, i risultati finali sono inferiori (Guilbault et al 1991; Adams 1994; Bungartz e Niemann 1994; Baracaldo et al 2000; Shaw e Good 2000; Diaz et
al 2001; Kim et al 2001; Merton et al 2003).
Il follicolo cavitario di diametro superiore a 5 mm, con la produzione di inibina ed estradiolo, interferisce sul rilascio di FSH; pertanto, al fine di controllare l’ondata follicolare, è utile annullare l’effetto del follicolo dominante, aspirandolo con metodi meccanici per via transvaginale ecoguidata (Baracaldo et al 2000) o luteinizzandolo con farmaci come l’estradiolo, vietato in Europa, e sostituito non adeguatamente dal GnRH o dall’hCG (Bò et al 2008).
Al 3° o 4 giorno dal trattamento con FSH, deve essere somministrata la prostaglandina (2 dosi distanziate di 24h) e la bovina normalmente sarà in estro 36-48h dopo.
Fig. 1. Ovaie di una bovina superovulata.
Fig. 2. Ecografia ovarica in bovina superovulata prima e dopo l’ovulazione
con visualizzazione dei corpi lutei prodotti.
Fecondazione. Dopo aver applicato il protocollo di
superovulazione e la PGF2alpha, la bovina donatrice viene fecondata 2-3 volte, generalmente con seme congelato a 12, 24 e 36h dopo la comparsa dell’estro o 72, 84 e 96h dopo la PGF2alpha. Sebbene sia auspicabile l’uso del seme sessato, questo dà minori performance nella MOET (Seidel 2007; Kaimio et al 2013) ed alcune aziende produttrici non ne garantiscono l’efficacia.
L’utilizzo del seme sessato richiede almeno una doppia dose per depositare il seme (2 milioni spz) in ciascun corno.
Le manze sembrano rispondere meglio al seme sessato, non presentando differenze significative rispetto al seme convenzionale (Kaimio et al 2013).
L’intervallo di tempo è importantissimo perché influenza il rapporto morule/blastocisti recuperate.
Può essere utile effettuare un’anestesia epidurale nella donatrice. L’epidurale servirebbe a rallentare la defecazione, a immobilizzare la coda che può essere così protetta e legata fuori dal campo di lavoro; ridurrebbe inoltre le contrazioni uterine che potrebbero interferire con le operazioni di flushing (Castro Neto et al 2005; Guarneri 2013).
Dopo un’accurata pulizia del perineo e delle labbra vulvari, si passa all’inserimento di un catetere da flushing (catetere di Foley a 2 o 3 vie) attraverso la cervice. Un dilatatore cervicale può essere utile a tale scopo, soprattutto negli animali giovani. Il catetere ha tipicamente una via dedicata all’ingresso di aria o soluzione salina che dilata il palloncino localizzato all’estremità del catetere, in modo che resti bloccato a circa metà del corno uterino. Sebbene alcuni professionisti credano che il posizionamento profondo del palloncino renda il flushing più efficace, in uno studio comparativo, il posizionamento alla base del corno uterino ha aumentato le quantità di liquido necessario per il flushing, ma ha migliorato le percentuali di raccolta
(Sartori et al 2003). Altri Autori posizionano il palloncino caudalmente alla biforcazione, come nella cavalla (Castro Neto et al 2005).
Una seconda via del catetere o via principale ospita un mandrino di acciaio che, nella fase di introduzione, facilita la progressione del catetere attraverso la cervice e poi nel corno uterino, guidato mediante esplorazione rettale. Durante il flushing, la via principale è connessa con un raccordo a due vie con il contenitore contenente il medium, posto in alto, e con il filtro posto in basso (tecnica a 3 vie o per caduta o aperta). Nella tecnica a 2 vie o chiusa, la via principale è connessa direttamente con una siringa attraverso la quale vengono iniettati 30-50 ml di medium per volta. Il medium raccolto dopo ogni lavaggio, mediante un delicato massaggio del corno uterino, viene versato in un filtro; vengono impiegati circa 300-500 ml di medium per lavare ciascun corno uterino (Guarneri 2013). Il medium generalmente utilizzato per il flushing è una soluzione di tampone fosfato (PBS di Dulbecco), disponibile in commercio, addizionata con l’1-2% di FCS (siero fetale di vitello) e antibiotici/antimicotici.
Molti fattori possono influenzare la percentuale di raccolta degli embrioni: il muco, l’intrappolamento in pliche endometriali, una ritardata discesa dagli ovidutti (Alvarez et al 1999; Castro Neto et al 2005). Per migliorare la raccolta di un 30%, alcuni Autori ritengono utile ripetere il flushing dopo 24 h (Subramaniam et al 1991) o dopo 30 minuti (Castro Neto et al 2005).
Valutazione e stoccaggio degli embrioni. I filtri, dopo il
flushing, sono trasferiti in un laboratorio per la ricerca degli embrioni. Il laboratorio deve avere una temperatura di 18-22°C. Il contenuto dei filtri viene trasferito in una piastra di ricerca ed osservata allo stereomicroscopio per la ricerca e la valutazione degli embrioni, che va fatta a 50-100 ingrandimenti per apprezzare l’integrità della zona pellucida e la presenza di eventuali detriti cellulari adesi (Direttiva 89/556/CEE).
Gli embrioni vengono trasferiti dal medium di raccolta in un medium di mantenimento (holding), nel quale possono rimanere per diverse ore a temperatura ambiente o essere raffreddati e mantenuti in frigorifero per qualche giorno o congelati. Si
effettuano 10 lavaggi in holding; nel terzo bagno si inserisce per sicurezza sanitaria la tripsina all’1,5% (Stringfellow e Givens 2010). I ripetuti lavaggi con medium sterile sono utili per rimuovere eventuali contaminanti batterici o virali.
La valutazione degli embrioni, in accordo alle linee guida internazionali IETS, si basa su due punteggi: il codice di sviluppo da 1 a 9, il codice di qualità o grado da 1 a 4.
Le prime divisioni mitotiche dell’embrione avvengono in salpinge; dopo 4-5 giorni, allo stadio di 16 cellule, l’embrione arriva in utero; continuano le divisioni (32-64 cellule) e l’embrione viene detto morula. A 7-8 giorni si forma una piccola cavità (blastocele) e l’embrione è detto blastocisti precoce, blastocisti (7-9 gg), blastocisti espansa (8-10 gg). A 9 giorni comincia il dissolvimento della zona pellucida e la blastocisti protrude dalla breccia formando una blastocisti preimpianto (hatching), che ancora si espande nei giorni successivi. I codici di sviluppo degli embrioni prelevati sono 4 (morula compatta), 5 (blastocisti precoce), 6 (blastocisti) e 7 (blastocisti espansa). Gli embrioni di stadio inferiore a 4 sono immaturi o il loro sviluppo si è arrestato e sono generalmente considerati degenerati e non
trasferibili.
Un embrione di buona qualità deve avere dimensioni di almeno 150 micron, forma regolare e sferica (quelli ovali sono degenerati); i blastomeri devono essere simili, la tessitura omogenea, il colore né troppo chiaro né troppo scuro e non devono esserci vescicole o cellule estruse; lo spazio perivitellino deve essere vuoto e la zona pellucida deve essere integra, sferica, non raggrinzita o collassata. In particolare una morula deve possedere una superficie bozzellata (sculpture) ed un aspetto compatto (Stringfellow e Givens 2010).
Il grado 1 o eccellente è dato ad un embrione con massa embrionale simmetrica e sferica, con i singoli blastomeri di uguale dimensione, colore e densità. Le imperfezioni devono essere minime e almeno l’85% deve corrispondere alla massa embrionale vitale e intatta. Cioè, è ammesso che un 15% di cellule sia estruso nello spazio perivitellino. La zona pellucida deve essere inoltre liscia e intatta, priva di zone concave o piatte che farebbero aderire l’embrione alla piastra o alla paillette. Gli embrioni con zona pellucida non integra non garantiscono le condizioni sanitarie minime e, come tali, non possono essere
commercializzati negli scambi internazionali.
Il grado 2 o discreto è dato ad un embrione con minime imperfezioni ma che possiede almeno il 50% della massa embrionale intatto e non estruso nello spazio perivitellino.
Il grado 3 o scarso si dà se solo il 25% dell’embrione è intatto.
Il grado 4 (morto o degenerato) si dà quando la massa embrionaria è in degenerazione o per gli ovociti non fecondati o embrioni di 1 cellula. Generalmente, solo gli embrioni di grado 1 sono commercializzati (Stringfellow e Givens 2010).
Una volta valutati, gli embrioni possono essere confezionati e trapiantati a fresco, oppure possono essere congelati.
Il criocongelamento offre numerosi vantaggi: consente di conservare il materiale genetico per tempi illimitati, facilita lo scambio commerciale di embrioni a distanza, annulla la trasmissione di malattie infettive, evita di preparare le riceventi parallelamente alle donatrici. L’unico svantaggio è un lieve calo della percentuale di attecchimento, rispetto agli embrioni trapiantati a fresco.
embrioni di almeno 7 giorni, ma generalmente si cerca di congelare morule di grado 1.
Il criocongelamento può essere lento (0,3°C/min) o rapido (200°C/min detto vitrificazione). L’embrione deve subire una serie di processi osmotici che portano alla sostituzione dell’acqua con il crioprotettore, senza che si formino cristalli, responsabili della rottura delle membrane cellulari.
I crioprotettori più usati sono alcoli come il glicerolo (1,5-1,6M) (utilizzate paillette cristal 133 trasparenti) ed il glicole etilenico (1,4 M) (utilizzate paillette cristal 133 gialle). Entrambi possono essere associati ad uno zucchero crioprotettore che è il saccarosio, al quale l’embrione è assolutamente non permeabile, ma la sua presenza ne migliora la disidratazione. Il crioprotettore deve essere solubile in acqua, deve abbassare il punto crioscopico favorendo la disidratazione e deve essere poco tossico. Il glicole è più tossico e l’embrione dovrebbe essere esposto per un minimo di 3’ (tempo di equilibrio) e un massimo di 5-10’, secondo la temperatura del laboratorio. Tuttavia, per il suo basso peso molecolare, passa velocemente attraverso la zona pellucida e questo consente un congelamento/scongelamento
molto rapido. Il glicerolo è meno tossico, richiede almeno 10’ di esposizione o più se la temperatura ambiente è bassa, ma l’embrione può sostare anche per 15-30’. Il glicerolo avendo un peso molecolare maggiore, a differenza del glicole, passa lentamente attraverso la zona pellucida. Il glicole è sempre più usato perché fornisce paillettes ready to use, che allo scongelamento non richiedono ulteriori passaggi.
Il sistema di chiusura delle paillettes prevede, in genere, un jonc, dove va riportato il codice del gruppo di raccolta, la data di congelamento, il toro, la donatrice, lo stadio e la qualità dell’embrione (Stringfellow e Givens 2010).
In genere si fanno 5 colonne separate da 4 bolle d’aria così composte: thawing + glicole + glicole ed embrione + glicole + thawing. Al posto del thawing (soluzione di scongelamento, economica, prodotta dall’IMV) può essere utilizzato l’holding, oppure anche il glicole. Mettendo il glicole si può prolungare il tempo di permanenza nella camera del criocongelatore, stabilizzata ad una temperatura tra i -5°C e i -7°C, perché a queste temperature non congela, consentendo di lavorare anche gruppi numerosi di embrioni. Tendenzialmente il glicole è
proinfiammatorio nell’utero della ricevente, ma le quantità così piccole non danno differenze significative se confrontate con il thawing o l’holding. Con il glicerolo si fanno 3 colonne tutte di glicerolo con al centro l’embrione.
Un passaggio importante è il seeding che si realizza dopo meno di 1’. Il seeding, letteralmente mettere il seme, è l’innesco della cristallizzazione ottenuto mediante contatto tra una colonna della paillette con uno strumento sottile impregnato di azoto liquido. Il seeding innesca la cristallizzazione dell’acqua extracellulare, l’ambiente extracellulare diventa iperosmotico e ciò favorisce la disidratazione dell’embrione (Liebermann et al 2003).
Nel congelamento lento, la velocità ideale di discesa della temperatura è di -0.5°C/min, sebbene non ci siano differenze significative con velocità tra 0.1 e 0.8°C/min. Si calcola che a -22°C la disidratazione si sia completata e l’embrione possa essere immerso in azoto liquido, sebbene le curve di congelamento si fermino a -32/35°C, detta plunge temperature. Il tempo totale, tra raccolta e congelamento, deve essere da 1 a 3 ore, con una perdita di 10 punti percentuali ogni due ore in più.
La tecnica di scongelamento prevede, nel caso del glicole (one step), che la paillette sia lasciata 7’’ all’aria ruotandola, quindi a bagnomaria a 37°C per 20-30’’. Per il glicerolo è invece necessario effettuare 4 passaggi (multistep) in soluzioni decrescenti di glicerolo.
Trapianto embrionale nelle riceventi. Negli ultimi
decenni la tecnica di trasferimento degli embrioni non ha subìto grosse modifiche e innovazioni. La percentuale di attecchimento degli embrioni è generalmente di circa il 40% (Nabenishi et al 2018). Il motivo di questa percentuale relativamente bassa va ricercata in cause materne (sincronizzazione non ottimale, ambiente uterino non idoneo, livelli di progesterone insufficienti), cause tecniche legate al congelamento ed allo scongelamento e cause embrionali legate in genere a fattori genetici che causano una morte precoce dell’embrione. Un recente studio realizzato in bovine da carne, che spesso hanno un temperamento eccitabile e poco si prestano alle manipolazioni tipiche del trasferimento embrionale, ha dimostrato che la somministrazione di flunixin meglumine subito dopo il
trasferimento embrionale migliora la pregnancy rate, probabilmente per inibizione della sintesi di PGF2alpha (Kasimanickam et al 2018). L’uso di GnRH al 5° giorno in bovine riceventi causa un aumento della vascolarizzazione del corpo luteo, ma non un aumento della pregnancy rate (Kanazawa et al 2017). L’uso di progesterone (CIDR) postimpianto non influenza la pregnancy rate, ma migliora la sincronizzazione dei calori nelle riceventi vuote, che possono più facilmente essere fecondate o ritrapiantate (Purcell et al 2005; Monteiro et al 2009).
Un’altra innovazione nell’ambito della buiatria e dell’ET degli ultimi anni è l’utilizzo dell’ecografia Doppler per la misurazione della vascolarizzazione del corpo luteo. La vascolarizzazione consente infatti di predire il successo del trapianto già a 7 giorni ossia prima di effettuarlo, permettendo di escludere le bovine riceventi con un corpo luteo anche grande ma con insufficiente vascolarizzazione (Kanazawa et al 2016). Il Doppler consente anche di effettuare una diagnosi di non gravidanza a 21 giorni e persino a 14 giorni e di rimettere in riproduzione le bovine riceventi rimaste vuote, che altrimenti
verrebbero diagnosticate tali dopo circa 30-40 giorni, al tempo della diagnosi clinica di gravidanza (Utt et al 2009; Guimaraes et al 2015; Kanazawa et al 2016).
Bovina Modicana. La razza Modicana è una razza bovina
minore italiana a limitata diffusione, è autoctona della Sicilia e ha un’attitudine prevalentemente per il latte. Originaria dell'antica Contea di Modica, che si identifica con l'attuale provincia di Ragusa, si è in breve tempo diffusa in diverse parti della Sicilia, arrivando anche in Sardegna. Qui, agli inizi del 1900, grazie alla sua rustica frugalità e attitudine al lavoro, è stata incrociata con delle razze autoctone, dando così vita alla razza Sardo-Modicana. Il dibattito sul suo arrivo nell'isola sicula è ancora irrisolto: secondo alcuni è giunta dal Mediterraneo, secondo altri dall'Europa continentale, al seguito di Normanni e Angioini. Quando nel 1985 è stato istituito il Registro Anagrafico delle Popolazioni Bovine Autoctone e Gruppi Etnici a limitata diffusione, la razza Modicana è stata identificata come una delle razze da salvaguardare. Dagli anni ’60 si è registrato un calo drastico dei capi: dai 25000 di allora si è passati a circa 1800 di
oggi, che diventano 650 se si prendono in considerazione soltanto gli animali allevati nella culla di origine. Le cause della diminuzione del numero di questi esemplari sono da ricercare principalmente nell’introduzione dei mezzi meccanici, ma anche nella scarsa resa sia del latte che al macello.
La razza Modicana si riconosce per taglia e statura modesta, scheletro solido e forma angolosa. Il mantello è di colore uniforme rosso scuro, con sfumature sul nero nei tori, mentre nelle vacche tendenti al fromentino chiaro. Il colore nero sfumato si presenta prevalentemente nella parte anteriore e sulla faccia esterna delle cosce, mentre sono rigorosamente neri gli unghioni e il fiocco della coda. Le corna sono giallastre alla base, ma nere sulla punta. Il musello, invece, si presenta rosso scuro, le narici nero ardesia. La mammella è grande con i capezzoli lunghi, grossi e spesso disarmonici. Il maschio può arrivare a 160 cm al garrese per un peso di 900–1000 kg, mentre la femmina solitamente arriva ai 145 cm al garrese per un peso di 550–600 kg. Estremamente rustica, riesce a sopravvivere alle torride estati mediterranee, alimentandosi prevalentemente al pascolo, con un’integrazione in stalla nei periodi in cui questo scarseggia. La
razza Modicana si presenta come una razza a triplice attitudine. Si rilevano ottime caratteristiche per il lavoro, grazie agli arti e agli unghioni molto forti. La produzione di latte oscilla fra i 18 e i 22 kg al giorno in una lattazione di 200-220 giorni; il latte ha una percentuale di grasso di circa il 4% e da esso vengono prodotti formaggi tipici siciliani come il Ragusano DOP. La carne ha alta qualità e salubrità, grazie all’allevamento completamente brado, ma la sua commercializzazione non riscontra grande successo poiché risulta più difficile da trattare se non si individua il grado esatto di frollatura.
Fin dal 1994 l'Istituto Sperimentale Zootecnico per la Sicilia si è attivato per la conservazione e lo studio del germoplasma della razza Modicana; sono state prelevate 12000 dosi di seme che sono custodite presso il Centro Italiano Zootecnico (CIZ) e a disposizione degli allevatori tramite l’AIA.
Il 18 Gennaio 2018 è stato approvato, dal Ministero delle politiche agricole alimentari e forestali, il progetto “DUAL BREEDING” (le razze bovine a duplice attitudine: un modello alternativo di zootecnia eco-sostenibile), proposto dall’ANAPRI. Tale progetto è finalizzato alla caratterizzazione delle risorse
genetiche animali di interesse zootecnico e alla salvaguardia della biodiversità. Uno dei punti chiave è rappresentato dalla conservazione delle razze autoctone a limitata diffusione mediante un programma di raccolta di materiale biologico e germoplasma che si articola in: mantenimento/creazione banche del seme, riproduzione di specifici ceppi a rischio e produzione del seme in loco o presso centro tori. Il programma è attualmente in corso e prevede il congelamento di dosi di seme di almeno 6 tori Modicani.
Fig. 3. Toro di razza Modicana.
Sono stati realizzati studi relativi alla qualità del latte delle vacche Modicane. È stato dimostrato che diversi fattori, quali l’alimentazione e la razza, possono influenzare la percentuale di
sull’assetto cromosomico degli spermatozoi post scongelamento, ha evidenziato che il corredo cromosomico della razza Modicana, rispetto ad altre razze lattifere quali Bruna e Frisona, presenta una percentuale più alta di aneuploidia (Pauciullo et al 2012). A seguire, alcuni studi sul genoma della Modicana (Mastrangelo et al 2014; 2016; 2018) hanno confermato la presenza di un recente aumento di consanguineità in questa razza, indicando una sofferenza demografica importante.
SCOPO DELLO STUDIO
Scopo dello studio è stato l’applicazione della tecnica MOET nella razza Modicana ottimizzando un protocollo basato sull’uso di FSH/LH (Pluset, Bio 98), con lo scopo ultimo di valorizzare/preservare questa razza a limitata diffusione genetica.
MATERIALI E METODI
Sono state selezionate bovine di razza Modicana presso un’unica azienda di Ragusa (Azienda Mezzasalma, IT009RG292), caratterizzata da ottimi livelli di management,
sieroprevalenza di rinotraicheite infettiva del 5%.
Fig. 4. Alcuni capi dell’Azienda Mezzasalma, Ragusa.
I criteri di selezione delle donatrici sono stati: età 4-5 anni, 90-200 giorni post partum, BCS di circa 3.5, assenza di malattie soprattutto a carico dell’apparato genitale, ciclicità regolare.
I criteri di selezione delle riceventi sono stati: età di almeno 18 mesi, nullipare, BCS di almeno 3.5, assenza di malattie soprattutto a carico dell’apparato genitale, ciclicità regolare.
Lo studio è stato effettuato nel Settembre 2017-Giugno 2018.
Ciascuna donatrice veniva visitata 10 giorni dopo un calore manifesto. Si escludevano nuovamente alterazioni del tratto genitale esterno e interno. Ecograficamente (Draminski, 4vet mini, sonda lineare endocavitaria 7 MHz) veniva esclusa la
dei corni per la scelta successiva del catetere da utilizzare per il flushing in termini di lunghezza e diametro. A carico delle ovaie si valutava la presenza di un corpo luteo fisiologico. Con l’ecografo, venivano contati sul monitor i follicoli antrali di 2-3 mm per avere una stima della risposta superovulatoria. Se erano presenti 1 o 2 follicoli dominanti, questi venivano aspirati con una siringa aspiracisti.
Dopo 2 giorni veniva iniziato il protocollo di superovulazione da giorno 12 a giorno 16, con 9 somministrazioni decrescenti di FSH (Pluset, Bio98), per raggiungere una dose totale di 500 UI (gruppo sperimentale) o di 1000 UI (gruppo controllo). Il giorno 15 si effettuava una doppia somministrazione di cloprostenolo (Estrumate, MSD Animal Health) distanziate di 12h in concomitanza delle punture di FSH del 4° giorno, per indurre un calore la mattina del giorno 17.
Si effettuavano in totale 3 fecondazioni con seme congelato di tipo convenzionale, di cui la prima 12h dopo la comparsa del calore e a seguire la seconda dopo 6-8h e la terza dopo altre 6-8h. Dopo 7-7,5 giorni dalla prima fecondazione si effettuava il flushing, preceduto o seguito da una valutazione ecografica delle
ovaie per stimare il numero di corpi lutei.
Parallelamente venivano preparate le riceventi attraverso una prostaglandina alla cieca effettuata giorno 14 (un giorno prima della donatrice), per far andare le manze (cicli a 3 ondate follicolari) in calore giorno 17, lo stesso giorno della donatrice. Le riceventi che non mostravano il calore venivano escluse. Eventuali altre riceventi in calore spontaneo giorno 17 venivano aggiunte al gruppo. Poco prima o subito dopo il flushing le riceventi venivano visitate attentamente. Si attenzionavano le dimensioni dell’utero, la presenza di eventuali fluidi patologici nel lume, le dimensioni della cervice, la presenza del corpo luteo e la sua qualità (dimensione, consistenza). Le manze senza corpo luteo venivano escluse.
Veniva annotato con un tampone colorato il lato dell’ovaia contenente il corpo luteo, al fine di facilitare le successive operazioni di trapianto.
DONATRICE RICEVENTI Giorno 0 Calore rilevato
Giorno 10 Verificare presenza CL + conta follicoli di 2-3 mm + aspirazione follicoli dominanti >8 mm Giorno 12 FSH ore 7 - 3,5 ml im FSH ore 19 - 3 ml im Giorno 13 FSH ore 7 - 2,5 ml im FSH ore 19 – 2,5 ml im Giorno 14 FSH ore 7 - 2 ml im FSH ore 19 - 2 ml im 2,5 ml PG
Giorno 15 FSH ore 7 - 1,5 ml im+ 3,5 ml PG im
FSH ore 19 – 1,5 ml im + 3,5 ml PG im
Giorno 16 FSH ore 7 - 1,5 ml im
Giorno 17 Calore previsto mattina 12h dopo 1° FA
Calore riceventi
Giorno 18 8h dopo 2° FA 8h dopo 3° FA
Giorno 23 Valutazione numero CL
Giorno 24 Pomeriggio – flushing Controllo CL e trapianto
Tab 1. Protocollo della MOET in donatrici e riceventi.
Per il flushing, la donatrice veniva posta in un travaglio in piano o leggermente inclinato verso l’operatore, in un ambiente tranquillo privo di stress, al fine di facilitare la manipolazione
della stessa. La lettiera veniva mantenuta pulita ed una pedana era in genere posizionata per mantenere più sollevato l’operatore e staccato dalla lettiera. Se il posteriore della bovina era imbrattato di feci, si procedeva ad una pulizia preliminare con acqua tiepida.
Preliminarmente si riscaldava a bagnomaria almeno 1l di soluzione tampone di lavaggio, avendo cura, una volta estratto dal bagnomaria, di asciugare con carta assorbente le pareti esterne e di non contaminare il sito di prelievo della soluzione.
Si preparava il catetere più appropriato, inserendo il mandrino conforme alla misura del catetere, precedentemente lavato con passaggio a 2 step: isobetadine/alcol – soluzione fisiologica sterile. Il catetere veniva poi rivestito con una guaina trasparente morbida per FA e riposto in un guanto da esplorazione rettale, per essere trasportato sul sito del flushing.
Alla donatrice, veniva effettuata un’epidurale con 7,5 ml/animale di procaina/adrenalina (Aticain, Ati), previa tricotomia e scrub (alcool e isobetadine). Si utilizzava un ago rosa 18 G inserito a 45° nel I spazio intercoccigeo (C1-C2). Lo spazio intervertebrale era individuato effettuando dei movimenti
dorsoventrali della coda e palpando contestualmente un’area di depressione tra le rispettive vertebre (dove la coda sollevata sembra che si spezzi). Per essere certi di trovarsi nello spazio epidurale (oltre alla minima resistenza all’inoculazione), una goccia di lidocaina era posizionata sull’ago e aspirata dalla pressione negativa presente nel canale. Se condotta correttamente, si accertava la paralisi della coda dopo 1,5 minuti circa.
L’operatore, a questo punto, si posizionava sulla pedana e, con il braccio protetto da un guanto da esplorazione rettale, svuotava l’ampolla rettale e prendeva contatto con la cervice e le corna uterine. Grazie all’aiuto operatore, si realizzava una pulizia accurata del perineo e delle labbra vulvari, con passaggi alternati di acqua tiepida e isobetadine, avendo cura di rimuovere la totalità di isobetadine con un ultimo passaggio di acqua; quindi si terminava con un’accurata asciugatura dello sfintere anale, della vulva e del perineo, con carta assorbente effettuando singoli passaggi per ogni strappo.
Si dilatavano le labbra vulvari e si inseriva un catetere (IMV o Bioniche) a 2 vie, con un mandrino interno che lo rendeva
rigido, protetto da una camicia sanitaria a bustina (IMV). La camicia sanitaria si rompeva all’entrata della cervice e, una volta entrato il catetere in utero, si estraeva del tutto. Se la cervice era particolarmente difficile da attraversare, veniva dilatata con uno specifico dilatatore in acciaio. Si portava il catetere a circa metà del corno, quindi si estraeva il mandrino gradualmente con movimenti rotatori, cercando di far fare ancora al catetere qualche centimetro per seguire l’andamento curvilineo del corno uterino. Il mandrino estratto veniva posizionato in un guanto da esplorazione con qualche ml di tampone, per mantenerlo pulito, in caso di riutilizzo.
Un assistente innestava alla valvola di gonfiaggio del palloncino una siringa vuota, della capacità di 20 ml circa (con stantuffo tirato indietro fino a 15 ml), insufflando gradualmente 5 ml di aria per volta e, contemporaneamente, l’operatore monitorava il grado di insufflazione per via trans-rettale. L’obiettivo era quello di ottenere una dilatazione tale da garantire la perfetta adesione del palloncino con le pareti del corno uterino; pertanto tirando indietro il catetere si verificava che questo era ben aderente e che non tendeva a retrocedere; nel caso in cui
questo indietreggiava si procedeva con l’insufflazione di 1-2 ml di aria fino all’ottenimento di una perfetta adesione. La via del palloncino, se non provvista di valvola, veniva chiusa con una pinza atraumatica (in genere protetta da due tubicini di gomma per non danneggiare il catetere).
Attraverso la via principale (quella del mandrino) si collegava una siringa da 50 ml riempita dall’aiuto operatore con tampone preriscaldato (Embryo flush) e si effettuava il primo lavaggio, seguito dal primo recupero. L’instillazione era delicata mentre il recupero era energico, al fine di liberare gli embrioni intrappolati nel muco. In genere, il primo lavaggio non consentiva di recuperare molto liquido, in quanto questo si distribuiva nel corno; tuttavia in un buon flushing, per ogni lavaggio, la quantità di liquido instillata doveva essere recuperata. La fase di instillazione e scarico del fluido di lavaggio veniva attentamente monitorata dall’operatore, in modo tale da garantire un’espansione costante dell’intero corno, durante il riempimento; non appena il corno era sufficientemente teso e tonico alla palpazione, si procedeva con il recupero del liquido di lavaggio. Il recupero era facilitato dal massaggio del
corno dall’apice alla base, prendendo come punto di riferimento la posizione del palloncino insufflato. Il ripristino di una consistenza flaccida del corno indicava che il corno era sufficientemente svuotato. Si effettuavano 8-10 lavaggi (max 500 ml per corno) avendo cura, quando si sostituiva la siringa, di sigillare a monte il catetere con la pinza atraumatica. Per velocizzare la procedura, l’aiuto operatore preparava 3-4 siringhe che ciclicamente svuotava nel filtro e riempiva nuovamente col tampone. Il liquido di raccolta veniva messo in un filtro conico per embrioni, poggiando l’apice della siringa sulla parete per non creare schiuma. Il filtro conteneva già 1 cm circa di tampone di raccolta, non doveva mai andare a secco mentre, se troppo pieno, doveva essere svuotato da sotto dall’apposita valvola.
Si procedeva al lavaggio prima in un corno poi nell’altro. Per estrarre il catetere si sgonfiava il palloncino, si collegava la via principale con una siringa da 50 ml e si estraeva il catetere aspirando con la siringa il liquido residuo (sporco di muco), che veniva poi raccolto e osservato separatamente dal contenuto del filtro. Il catetere, se imbrattato di muco, veniva lavato con tampone e rimontato con mandrino e camicia sanitaria.
Fig. 5. Realizzazione del flushing in una bovina Modicana.
Terminate le operazioni, la donatrice veniva lasciata nel travaglio, per essere sottoposta ad un’eventuale nuovo flushing in caso di nessun recupero di embrioni; viceversa veniva trattata con prostaglandina.
Il filtro con il liquido di raccolta, proveniente dal lavaggio di entrambi i corni, veniva poi trasportato in laboratorio per la ricerca e la classificazione degli embrioni.
Il laboratorio veniva allestito in un ambiente adiacente al luogo del flushing e al suo interno era mantenuta una temperatura di 20-22°C, verificata con un termometro ambientale. Ciò, soprattutto nei mesi freddi, richiedeva l’utilizzo di un sistema di riscaldamento. Il laboratorio era fornito di uno
stereomicroscopio, una piastra riscaldante a 37°C su cui venivano posti piastre, capsule, liquidi di lavaggio, puntali e di un criocongelatore.
Il filtro conico veniva aperto e le pareti lavate con PBS mediante una siringa sterile, quindi il liquido di lavaggio veniva scaricato su una piastra di ricerca grigliata quadrata.
Dopo un periodo d’attesa necessario alla sedimentazione degli embrioni, si procedeva con l’osservazione diretta dell’intera piastra, soffermandosi su ciascun campo della stessa. Al fine di facilitare la ricerca, frustoli di muco e bolle d’aria erano eliminati con l’ausilio di una siringa sterile.
Le piastre si osservavano allo stereomicroscopio, l’ingrandimento ottimale è quello che consente di inquadrare un quadrato sotto il campo. Lo stereomicroscopio (Optika SZM2) era stato adattato all’uso con l’utilizzo di luce fredda a LED ed un sistema di riflessione della luce, realizzato con uno specchietto inclinato a 45°. Ciò consentiva di vedere gli embrioni scuri e leggermente tridimensionali.
Gli embrioni venivano raccolti con una pipetta automatica (10-20 microlitri) e trasferiti in capsule preriscaldate contenenti il
medium di mantenimento o holding (IMV). Gli embrioni venivano lavati 10 volte, ma non venivano tenuti più di 30-45’ in holding per evitare l’evaporazione.
La classificazione veniva effettuata impostando lo stereomicroscopio al massimo ingrandimento e consisteva nell’assegnazione di un punteggio allo stadio di sviluppo (S) e al grado di qualità (G), secondo le linee guida IETS.
Gli embrioni di grado 4 venivano scartati e processati per la ricerca di agenti patogeni, invece gli embrioni di ottima qualità (4.1 o 5.1) di preferenza erano avviati al processo di congelamento e stoccaggio in azoto liquido. I restanti venivano preferibilmente trasferiti a fresco.
Fig. 6. Differenti stadi di sviluppo degli embrioni: S1
ovocita/embrione non fertilizzato, S2 morula 2-16 cellule, S3 giovane morula, S4 morula, S5 giovane blastocisti, S6 blastocisti, S7 blastocisti espansa.
Fig. 7. Differenti gradi di qualità degli embrioni: A eccellente, massa
embrionaria compatta con blastomeri distinti, uniformi e con uguale densità; si ammette un 15% di cellule estruse nello spazio perivitellino. La zona pellucida intatta e regolare; B discreto, imperfezioni minime con il 50% della massa embrionale non estrusa; C scarso, solo il 25% della massa embrionale è intatta; D degenerato o ovociti non fecondati, massa embrionaria degenerata o embrioni a 1 sola cellula.
Fig. 8. Sopra, il filtro per il liquido raccolto mediante flushing.
Sotto, visualizzazione allo stereomicroscopio di diversi campi, ad ingrandimento ottimale, riportanti numerosi embrioni.
Fig. 9. Congelamento degli embrioni.
Gli embrioni da trapiantare a fresco venivano prontamente confezionati in paillettes trasparenti, per convenzione internazionale. Con apposito aspirapaillette (IMV) si creava una prima colonna di holding, poi una bolla d’aria, una seconda colonna di holding contenente l’embrione, una bolla d’aria ed infine una terza colonna contenente holding.
Gli embrioni migliori venivano invece processati per il congelamento. Per prima cosa si avviava il criocongelatore (Cryogenesis CL 8000) impostando un programma idoneo. Dopo aver introdotto l’azoto liquido nel bagno del congelatore, avendo cura di riempirlo fino a tre quarti della capienza dello stesso, si
procedeva con l’immersione molto lenta della camera. La temperatura della camera scendeva rapidamente per stabilizzarsi a –7°C .
A questo punto si trasferivano gli embrioni dall’holding al glicole, facendo attenzione a trasportare una quantità minima di holding (2-3 μl). A temperatura ambiente (TA) gli embrioni non dovevano superare un tempo di esposizione al glicole di 4-6 min. Se TA <20 °C, il tempo di esposizione poteva essere esteso a 5-10 min. Questi passaggi venivano effettuati sotto il controllo di un timer.
Considerando i tempi così stretti, il confezionamento degli embrioni cominciava subito dopo e non venivano processati più di 5-6 embrioni per volta, lasciando eventuali altri nell’holding.
Il confezionamento avveniva, per convenzione internazionale, in paillettes (gialle) da 0,25 ml, mediante aspirazione di colonne di holding o thawing, aria, glicole, aria, glicole con l’embrione, aria, glicole, holding o thawing. Ogni paillette veniva chiusa con il jonc precompilato e posta in un portapenne al contrario con il jonc verso il basso (in modo da far salire l’embrione nella colonna centrale).
Nel caso in cui gli embrioni sottoposti a congelamento erano più di 5, si procedeva al trasferimento degli embrioni, così confezionati e posti al contrario, a temperatura di refrigerazione (4°C) passando a confezionare un secondo o terzo gruppo. Tutti i gruppi venivano raccolti nel portapenne, avendo cura di asciugare l’eventuale condensa creata sulle pareti delle paillettes messe in frigo.
Se il numero di paillettes lo consentiva, prima di caricare la camera del criocongelatore, allo stereomicroscopio si verificava la posizione degli embrioni nella colonna centrale e, se necessario, si spostava l’embrione dai menischi, dando dei colpetti dal lato opposto. Se l’embrione rimaneva troppo alto, il seeding poteva essere comunque fatto in basso.
In caso di numerose paillettes, una volta messe al contrario, si presupponeva che, dopo averle caricate nella camera in posizione normale (jonc in alto), l’embrione cadesse dalla parte superiore alla parte centrale o bassa della colonna centrale, senza tuttavia raggiungere il menisco della stessa.
Questi accorgimenti erano necessari per evitare il contatto dell’embrione con i menischi (aria) e per effettuare il seeding
nella posizione più lontana dall’embrione.
Le paillettes venivano caricate in camera con i jonc in alto, e, dopo circa 1-2 minuti, si procedeva con il seeding. Questo veniva effettuato con un supporto in acciaio inox a punta fine o con l’ausilio di un cotton fioc. La sede del seeding era la colonna dell’holding più alta (sotto il jonc) o, eventualmente, quella più lontana rispetto alla posizione dell’embrione.
Sollevando le paillettes, una per volta, dal jonc e posizionando una luce dietro, si toccava la colonna dell’holding per circa 3 secondi, con il mandrino in acciaio stazionato qualche secondo in azoto liquido, fino a visualizzare una zona di cristallizzazione a becco di clarino della lunghezza di circa 5 mm.
Completato il seeding, si attendevano 3-5 minuti e si risollevavano, una alla volta, le paillettes per verificare che il seeding avesse avviato la cristallizzazione; in caso contrario, si ripeteva il seeding. Gli embrioni stavano così alla temperatura (T) di seeding per minimo 5’, mantenendo il programma di congelamento in pausa (tasto Hold). Solo dopo aver completato l’operazione e quindi sempre dopo 5-10’, si avviava il
programma (tasto Run).
Il programma di congelamento aveva una curva di discesa della temperatura di 0,3°C/min fino al raggiungimento di una temperatura pari a -32°C. In base alla temperatura ambiente (TA), era spesso necessario aggiungere dell’azoto liquido nella camera, avendo cura di non bagnare internamente gli alloggi delle paillettes.
Dopo aver raggiunto la temperatura finale, si attendevano ancora 5-10 minuti, quindi si estraevano le paillettes e si immergevano in un ampio dewar o un contenitore di polistirolo con azoto liquido (-196°C). Dopo stabilizzazione della temperatura, si inserivano negli appositi contenitori (cani o globet) del bidone criogenico.
La tecnica di scongelamento prevedeva: estrazione della paillette, asciugatura, permanenza all’aria per 10’’ con leggera rotazione, immersione in acqua a 25°C per 15’’.
La paillette, sia confezionata a fresco che congelata e scongelata, veniva caricata su una pistolette da embrioni (più lunga e più sottile rispetto a quelle da FA). Veniva impiegata una guaina da embrioni (IMV) e il tutto rivestito con una camicia
sanitaria.
Gli embrioni venivano trasferiti in manze Modicane, preventivamente selezionate in base alla qualità del corpo luteo (dimensione ed ecogenicità). La tecnica del trapianto era sovrapponibile a quella della FA, ma l’embrione veniva deposto distalmente sul corno omolaterale al corpo luteo. L’epidurale agevolava le manipolazioni sulle riceventi. Un dilatacervice metallico era impiegato nelle manze con cervice più stretta. L’igiene era massimizzata con una buona pulizia del perineo e, come detto, dall’utilizzo della camicia sanitaria.
I dati ricavati da questo studio venivano riportati come media e deviazione standard. Un test esatto di Fisher veniva impiegato per confronatre i due gruppi (1000 UI e 500 UI di FSH). La significatività veniva fissata al 5%.
RISULTATI
Ad oggi sono stati realizzati n. 15 flushing in 15 bovine, di cui n. 9, impiegando per la superovulazione, una dose totale di
500 UI (gruppo sperimentale) e n. 6, impiegando 1000 UI (gruppo controllo).
Attraverso un esame ecografico, venivano contati i follicoli antrali di 2-3 mm all’emergenza della seconda ondata follicolare (giorno 12) e questi risultavano in numero di 14±6 e 15±5 (p>0,05), rispettivamente nei gruppi sperimentale e controllo.
Il giorno prima del flushing, l’esame ecografico veniva ripetuto per valutare il numero di corpi lutei, che risultavano 12±3 nel gruppo sperimentale e 2±1 nel gruppo controllo (p=0,04). Nel gruppo controllo venivano invece riscontrati diversi follicoli cistici, ad entrambe le ovaie, e solo 1 o 2 strutture luteiniche. L’utero presentava, inoltre, un contenuto mucoso che interferiva con le procedure di flushing.
Infatti nessun embrione veniva recuperato nel gruppo controllo. Il dosaggio “tradizionale” veniva pertanto abbandonato per una mancata disponibilità del proprietario.
Nel gruppo sperimentale, veniva raccolto un totale di 70 embrioni, di cui 53 trasferibili (76%). Di questi, n. 18 sono stati trasferiti come freschi e n. 35 sono stati congelati.
Il numero di embrioni recuperati e trasferibili per vacca era di 10±1 e 8±1. Un’ottima correlazione lineare (R2=0,92) si
poteva ricavare dal confronto tra numero di follicoli, corpi lutei, embrioni recuperati ed embrioni trasferibili, come evidenziabile dal grafico 1.
Grafico 1. Correlazione lineare tra follicoli antrali, corpi lutei, embrioni
totali ed embrioni trasferibili rispettivamente nel gruppo controllo (GC) e nel gruppo sperimentale (GS).
Le blastocisti di primo grado (6.1) e le morule (4.1) erano gli embrioni più rappresentati (30 e 32%). Gli embrioni non trasferibili (24%) erano rappresentati principalmente da ovociti non fecondati (70%).
Grafico 2. Classificazione degli embrioni raccolti e ripartizione percentuale.
I tassi di gravidanza (42 giorni) delle riceventi erano del 50% per quelle trapiantate con embrioni freschi e del 48% per quelle trapiantate con embrioni congelati (p = 1).
DISCUSSIONI
Questo studio ha inteso mettere a punto e aggiornare, alla luce della recente letteratura, la tecnica della MOET nella bovina di razza Modicana.
La razza è, tra l’altro, caratterizzata da un impoverimento genetico importante (Pauciullo et al 2012; Mastrangelo et al 2014; 2016; 2018) che rende indispensabili programmi di recupero e conservazione del germoplasma.
Ancora oggi, l’unico seme congelato disponibile è quello immagazzinato nel 1994 dall'Istituto Sperimentale Zootecnico per la Sicilia, quindi un seme vecchio di 24 anni. Molte aziende, di conseguenza, utilizzano il toro aziendale incrementando ulteriormente i livelli di consanguineità.
I primi embryo transfer nella razza Modicana risalgono a qualche decennio fa ed erano basati sull’impiego di Pluset a dosaggio tradizionale e di glicerolo come crioprotettore. I risultati riferiti aneddoticamente non furono soddisfacenti (Lo Magno comm pers).
Grazie ad un progetto regionale, all’azione sinergica del gruppo raccolta embrioni Corfilcarni e di alcuni allevatori fiduciosi nel progetto di recupero, si è cercato di ripartire dalla superovulazione, sperimentando un dosaggio dimezzato di FSH.
L’ipotesi di lavoro nasceva dalla constatazione di una scarsa risposta al protocollo tradizionale (1000 UI) con lo sviluppo di troppi follicoli grandi anovulatori. Questi follicoli, oltre a non produrre ovociti e quindi embrioni recuperabili, erano probabilmente responsabili di una sovrastimolazione delle ghiandole endometriali con la produzione di abbondante muco
che impediva la raccolta dei pochi embrioni, presumibilmente prodotti.
Il basso dosaggio (500UI) successivamente utilizzato consentiva invece una buona stimolazione delle ovaie con risultati, in termini di embrioni trasferibili, sovrapponibili alla letteratura (Mikkola e Taponen 2017), anzi leggermente migliori, in termini di 1 embrione in più raccolto per flushing, ma soprattutto in termini di una minore percentuale di ovociti non fecondati (17% contro i 25% della letteratura).
Da un punto di vista pratico, la dose dimezzata ha due grandi vantaggi. Uno tecnico, nella preparazione della soluzione, poiché si realizza, sciogliendo in 10 ml, il contenuto liofilizzato di una delle due boccette di Pluset; rispetto ad altri dosaggi intermedi, evita errori tecnici nella preparazione della soluzione finale. Uno economico, poiché consente di preservare la seconda boccetta e di effettuare due flushing, anche in tempi diversi con un’unica confezione, considerato che il farmaco ha un costo abbastanza importante (138 euro).
Nel suo piccolo, questo studio ha confermato una forte correlazione tra conta dei follicoli antrali all’emergenza
dell’ondata follicolare e numero di embrioni trasferibili, che conferma come la prima possa essere impiegata come importante criterio per la selezione della donatrice, per poter predire la risposta alla MOET (Singh et al 2004).
In conclusione, i nostri dati, sebbene limitati numericamente poiché limitata è la disponibilità di donatrici in questa razza, suggeriscono che una bassa dose di FSH è efficace per i protocolli MOET nella razza Modicana.
La razza Modicana può pertanto essere considerata una buona produttrice di embrioni tra le razze bovine da latte.
Linea di ricerca 2
MONITORAGGIO DI UN CASO DI TUMORE A CELLULE DELLA GRANULOSA: CONSIDERAZIONI CLINICHE ED ORMONALI
(Marino G; Pruiti Ciarello F; La Spisa M; Zanghì A. (2016). Long-standing granulosa-theca cell tumour in a cow. Joint Meeting of the 20th Annual Conference of the European-Society-for-Domestic-Animal-Reproduction (ESDAR) / 13th Conference of the Spanish-Association-for-Animal-Reproduction (AERA), Lisbon, Portugal 27-30 October. Reproduction in Domestic Animals. Vol. 51 suppl 2, 113-114. ISSN: 0936-6768. DOI: 10.1111/rda.12801.
CASO CLINICO
Una bovina Frisona Holstein di 6 anni, 470 Kg, era monitorata da 20 a 780 giorni dopo il parto (pp). La mucca aveva avuto due precedenti gravidanze con parto normale e la ripresa dell'attività ovarica si era verificata intorno ai 30-35 giorni pp. Il terzo parto era stato regolare con l'espulsione della placenta dopo 8 ore. La bovina veniva esaminata di routine a 20 e 50 giorni mediante palpazione transrettale ed esame ecografico. Non si rinveniva alcun segno di infezione uterina o di involuzione tardiva; inoltre nessuna struttura funzionale era visibile alle ovaie. Il podometro confermava l'assenza di calori nel periodo indicato. Estendendo il periodo di attesa volontaria, la mucca veniva rivalutata a 90 giorni pp, quando l'ovaio sinistro apparve aumentato di volume (10x5x3 cm) per la presenza di alcune cavità cistiche, l'ovaio destro era inattivo e l'utero era moderatamente aumentato in tono. Con una presunta diagnosi di malattia ovarica cistica (COD), la bovina veniva trattata, ma senza successo. Considerando la buona produzione di latte (media 35 l al giorno), il proprietario decideva di interrompere qualsiasi ulteriore trattamento o
indagine sperando in una ripresa spontanea della funzione ovarica. Nei mesi successivi, il profilo del podometro mostrava l'assenza di regolari picchi di attività (calori), sebbene erano rilevati alcuni picchi moderati, di forma irregolare, durata e intervallo di presentazione, senza una diminuzione della produzione di latte e dell'assunzione di cibo. Quindi, a 270 giorni pp, la bovina veniva valutata nuovamente in maniera più approfondita. La palpazione transrettale rivelava l'ovaio sinistro aumentato di volume, ovoidale con superficie irregolare, per gravità caduto in cavità addominale e appena retraibile nel bacino, trascinando con sè tutto il tratto genitale interno. L'ovaio destro era piccolo, liscio e quasi impalpabile. L’utero era moderatamente aumentato di diametro e tono. All'ecografia (Draminski, Poland, Olsztyn - 4Vet mini, sonda lineare endorettale da 4-9 MHz), l'ovaio sinistro (15x8x7 cm) presentava una struttura complessa con numerose cavità, con contenuto anecoico (Figura 1). Una di queste strutture raggiungeva 3,5 cm di diametro. L'utero era pieno di liquido.
Fig. 1. Aspetto multicistico dell’ovaio aumentato di volume all’ecografia transrettale.
La vaginoscopia rinveniva uno scolo mucoso che proveniva da una cervice aperta e aumentata di volume. L'impedenziometria vaginale (Draminski, Poland, Olsztyn - Cow Estrous Detector) misurava un valore di 150 unità, compatibile con l'estro. I reperti clinici erano compatibili con un tumore stromale dell'ovaio associato a mucometra. Un campione di sangue veniva raccolto
dalla vena caudale per il profilo ematologico e biochimico e per valutare l'estradiolo 17-beta (E2), il progesterone (P4), il testosterone (T) (Biomerieux, France, Bruz – Vidas, enzyme-linked fluorescence assay), l'ormone antimülleriano (AMH) e l'inibina (INH) B (Adaltis, Italy, Milano - Personal lab, enzyme-linked immunosorbent assay). Il dosaggio ormonale rivelava un aumento dei livelli circolanti di E2 (32 pg/ml), AMH (57 ng/ml) e INH B (8 ng / ml), mentre P4 (0,5 ng / ml) e T (0,01 ng / ml) erano basali. I parametri ematici erano nel range di normalità ad eccezione di una lieve neutrofilia ed eosinopenia (5,9x103 / μl,
0x103 / μl). Veniva raccomandata un’ovariectomia unilaterale,
ma il proprietario, considerando la mancanza di manifestazioni di disagio da parte della bovina, l'età e la buona produzione di latte, non dava il consenso alla chirurgia. La bovina veniva, pertanto, monitorata ancora per più di un anno ad intervalli di 1-2 mesi. L'ovaio neoplastico raggiungeva la dimensione ultrasonografica di 17x10x8 cm a 370 giorni pp. A 780 giorni pp, la bovina presentava una significativa riduzione della produzione di latte (15 l) e veniva abbattuta. In sede di macellazione, la cavità addominale era ispezionata per escludere metastasi e il tratto
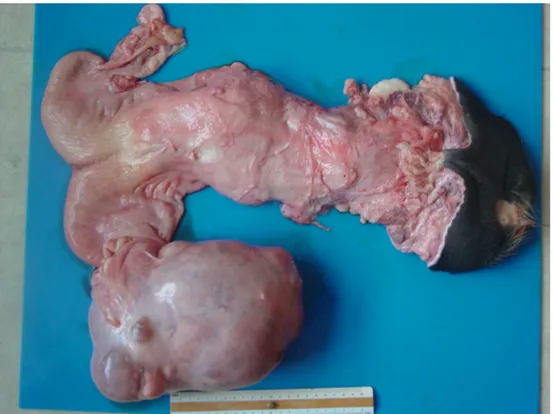
genitale era rimosso per l’esame patologico. Macroscopicamente, l'ovaio neoplastico sinistro, 22x15x12 cm e 2,5 kg, era a forma di ovoide con superficie irregolare (Figura 2).
Fig. 2. Aspetto macroscopico dell’apparato genitale interno.
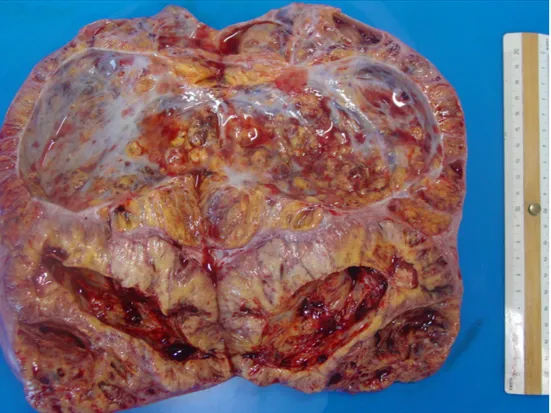
La superficie di taglio rivelava la struttura multicistica dell’ovaio comprendente 2 cisti grandi predominanti, rispettivamente di 5 e 10 cm contenenti fluido acquoso da giallastro a rosso bruno; aree solide giallastre erano interposte a strutture cavitarie (Figura 3). Il peduncolo ovarico mostrava vasi grandi fino a 10 mm di diametro.
Fig. 3. L’ovaio sinistro neoplastico alla superficie di taglio.
Dalle cavità cistiche veniva raccolto il liquido per testare gli steroidi sessuali, l’INH B e l’AMH; il dosaggio ormonale confermava un significativo accumulo di E2 (1301 pg/ml), P4 (43 ng/ml) e INH B (287 ng/ml), mentre T (1,25 ng/ml) e AMH (69 ng/ml) erano paragonabili ai livelli circolanti. L'ovaio destro era piccolo (4 x 1,5 x 0,4 cm) e appiattito, 3 g di peso, senza corpo luteo o follicoli apprezzabili. L'utero era debolmente aumentato di dimensioni (lunghezza del corpo uterino 3 cm,