INDICE
PARTE I :
INTRODUZIONE
PARTE II :
TERAPIA ANTIBIOTICA IN
AMBIENTE CRITICO
PARTE III : STUDIO CLINICO
•
Razionale dello Studio
•
Obiettivo dello Studio
•
Materiali e Metodi
•
Trattamento
•
Strategie di ottimizzazione del dosaggio
•
Analisi statistica
•
Risultati
PARTE IV : DISCUSSIONE
INTRODUZIONE
La teicoplanina è un antibiotico glicopeptidico prodotto da
Actinoplanes teichomyceticus. È simile alla vancomicina dal punto di
vista della struttura chimica, del meccanismo di azione, dello spettro di attività e della via di eliminazione (principalmente renale).
O O H O Cl O O NHR HO HO HOH2C O Cl HN N H O H O O O N H H N N H O H NH3 + HO HO O O O HOH2C HO HO NHCOCH3 H O -O HO O O OH CH2OH OH OH O O O O O TA2 - 1 TA2 - 2 TA2 - 3 TA2 - 4 TA2 - 5
Fig. 1 Struttura chimica della teicoplanina
È formata da due complessi molecolari: il primo è composto da cinque molecole strettamente correlate tra loro (nella figura da TA2-1
a TA2-5) il cui peso molecolare è compreso tra 1875 e 1891 Da; il secondo è una molecola più polare, teicoplanina TA-3, che ha peso molecolare di 1562 Da. I componenti del complesso TA-2 che costituiscono il 90-95% della molecola di teicoplanina differiscono dalla porzione acilica degli acidi grassi solo nella struttura della porzione N-acilglucosaminica. Come la vancomicina, la teicoplanina ha uno scheletro eptapeptidico a cui si legano residui di idrofenil-glicina, a formare una struttura tetraciclica. Nella struttura base ci sono tre sostituenti: D-mannosio, acetilglucosamina ed un residuo di N-acetilglucosamina, legato al gruppo arilico; a quest’ultimo residuo si legano i diversi acidi grassi che caratterizzano i cinque differenti gruppi del complesso teicoplanina.
Attività antimicrobica
L’attività battericida della teicoplanina si esplica nei confronti di batteri Gram-positivi, tramite l’inibizione della sintesi del peptidoglicano della parete cellulare: essa lega il residuo amino-acil-D-alanil-D-alanin terminale del muramilpentapeptide; questo legame previene il trasferimento dei precursori della parete cellulare dai
carriers lipidici di membrana ai siti di costruzione della parete cellulare.
Questo meccanismo non è efficace nei confronti dei batteri Gram-negativi perché la grande molecola polare di teicoplanina non può penetrare la loro membrana esterna ricca di lipidi.
Numerosi studi hanno messo in evidenza l’eccellente attività battericida della teicoplanina nei confronti di Staphylococcus aureus, incluse specie isolate resistenti a meticillina e oxacillina e in generale la sua equivalenza di attività rispetto alla vancomicina. Anche gli Streptococchi mantengono un’elevata suscettibilità nei confronti della teicoplanina, benché la sensibilità degli Stafilococchi coagulasi-negativi nei confronti di teicoplanina e vancomicina sia differente.
Recenti studi confermano che Clostridium difficile, C.
perfringens, Propionicbacterium acnes, Corynebacterium jeikeium ed
altri corinebatteri multi-resistenti di gruppo D2 sono sensibili a basse dosi di teicoplanina.
La concentrazione minima battericida (MBC) della teicoplanina è sempre maggiore della minima concentrazione inibente il 90% della crescita batterica (MIC90) per Streptococcus pneumoniae,
Staphylococcus aureus, Staphylococcus epidermidis e in alcuni studi
battericida in vitro della teicoplanina, come per la vancomicina, è lenta, ed è probabilmente legata alla frazione libera di farmaco.
L’aumento della quantità di unità formanti colonie (cfu) da 104 a 106 non ha un effetto significativo sul valore di MIC90 per numerosi Gram-positivi, ma l’aumento da 105 a 107 cfu causa un significativo aumento della MIC90. L’attività battericida di teicoplanina e vancomicina decresce molto in presenza di sangue umano e siero, mentre come accade per altri antibiotici glicopeptidici, è aumentata in presenza di espettorato di pazienti con fibrosi cistica. L’attività battericida di teicoplanina nei confronti di Staphylococcus epidermidis è ridotta quando il batterio è incorporato all’interno di complessi di fibrina.
La Teicoplanina e gli antibiotici aminoglicosidici mostrano sinergismo inibitorio nei confronti di stafilococchi coagulasi-negativi ed enterococchi in particolare Enterococcus faecalis e Staphylococcus
aureus.
La valutazione della suscettibilità di E. faecium nei confronti di alcuni antibiotici nello stesso ospedale per un periodo di 22 anni ha rivelato un incremento significativo nella resistenza nei confronti di penicillina G e gentamicina, ma una costante suscettibilità nei confronti di teicoplanina, vancomicina e ciprofloxacina (Fig. 2).
0 20 40 60 80 100 120 140 MIC90 (m g/l) Ciprofloxacina Ampicillina Vancomicina Teicoplanina
Principali valori di MIC90 di teicoplanina, vancomicina, ampicillina e ciprofloxacina per E. faecium isolato al Massachusetts General Hospital dal 1969 al 1988 e dal 1989
al 1990
1969-1988 1989-1990
Fig. 2
La resistenza agli antibiotici glicopeptidici può manifestarsi come singola, come nel caso di alcuni stafilococchi coagulasi-negativi resistenti a teicoplanina e suscettibili a vancomicina, o come nel caso di alcuni enterococchi resistenti a vancomicina ma suscettibili a teicoplanina, o doppia come nel caso di alcuni enterococchi altamente resistenti sia a teicoplanina che a vancomicina.
I meccanismi alla base del fenomeno di resistenza alla teicoplanina, osservato in alcuni ceppi di stafilococchi, non sono stati ancora identificati; tuttavia, anche in un ceppo batterico inizialmente sensibile si può sviluppare resistenza durante la terapia.
Il fenotipo Van A degli enterococchi resistenti alla vancomicina determina anche la resistenza alla teicoplanina. Il meccanismo è identico per entrambi i farmaci: un’alterazione del precursore della parete batterica che impedisce il legame con il glicopeptide.
I ceppi di enterococchi con fenotipo Van B sono invece spesso sensibili all’azione della teicoplanina poiché tale antibiotico è uno scarso induttore dell’enzima responsabile della modificazione della parete batterica.
Gli enterococchi appartenenti al fenotipo Van C, che non sono generalmente patogeni umani, sono sensibili alla teicoplanina.
In modelli animali di endocarditi stafilococciche, teicoplanina e vancomicina agiscono allo stesso modo nel ridurre la carica batterica all’interno delle vegetazioni esaminate qualche ora dopo la somministrazione del farmaco, ma teicoplanina esplica la sua azione più a lungo, potendosi dimostrare una sterilizzazione delle vegetazioni valvolari fino a 10 giorni dopo la fine del trattamento.
Proprietà farmacocinetiche
Una singola dose di 6 mg/kg di teicoplanina, somministrata per via intramuscolare o endovenosa, è associata a valori di
concentrazione massima (Cmax) plasmatica pari a 43 mg/L 30 minuti dopo la somministrazione del farmaco, per arrivare a 12 mg/L 4 ore dopo. Lo stato stazionario (steady-state) per teicoplanina, compreso tra 14 e 23mg/L, viene raggiunto dopo una dose di carico di 6-12 mg/kg/12 h per 2 dosi e poi ogni 24 h. L’assorbimento di teicoplanina per via intramuscolare è equivalente a quello per via endovenosa. Nei neonati e nei lattanti una dose carico di 15 mg/kg/12 h seguita da una dose giornaliera di 8 mg/kg sembra necessaria per mantenere una dose plasmatica maggiore di 10 mg/L. L’apparente volume di distribuzione in seguito a somministrazione endovenosa di una dose variabile tra 6 e 15mg/kg allo steady-state sembra variare fra 0,8 e 1,6 L/kg. Teicoplanina non penetra la barriera ematoencefalica, ma tramite iniezione intraventricolare di 20 mg/24-48 h, si possono ottenere all’interno del liquido cefalorachidiano concentrazioni >40 mg/L.
La clearance totale di teicoplanina dopo somministrazione in volontari sani di dosi comprese tra 3 e 30 mg/kg varia da 10 a 13 ml/h/kg . La clearance renale della teicoplanina negli stessi soggetti varia da 8 a 12 ml/h/kg, mettendo in evidenza che il filtro renale è il meccanismo preponderante nell’eliminazione di questo farmaco. La clearance totale e renale di teicoplanina sono correlate con la clearance della creatinina e sono ridotte in pazienti con alterata funzionalità
renale. Teicoplanina non viene rimossa dal circolo durante il trattamento dialitico. Nei pazienti tossicodipendenti, trattati con teicoplanina per la presenza di endocarditi batteriche, i valori di clearance totale e renale sono maggiori di quelli riportati nei volontari sani e i valori di eliminazione di teicoplanina sono quasi dimezzati.
I metodi disponibili per la valutazione delle concentrazioni di teicoplanina nei fluidi biologici includono il saggio microbiologico, le reazioni dei recettori per gli enzimi di fase solida, le tecniche di immunofluorescenza con polarizzazione (FPIA) e di cromatografia liquida ad elevate prestazioni (HPLC).
Il saggio microbiologico è stato il primo metodo utilizzato per quantificare le concentrazioni di teicoplanina nel siero, ma per la lunga durata della tecnica (circa 24 h), per la bassa specificità, per l’elevata quantità di siero necessaria durante l’analisi e per la elevata dipendenza dagli operatori, è stato abbandonato nella pratica routinaria.
Per l’utilizzo di routine anche l’HPLC, sebbene rappresenti la migliore tecnica in assoluto, grazie alle elevate doti di sensibilità, specificità e riproducibilità, risulta complicata da eseguire per diversi motivi e richiede lunghi tempi di svolgimento. Inoltre, sempre dal
punto di vista tecnico, la riproducibilità delle analisi, ovvero la variabilità, è significativamente inferiore a quella di altri metodi.
FPIA è stata designata come la tecnica di più rapida effettuazione per il dosaggio plasmatico di teicoplanina. Con questo metodo è presente un’interferenza limitata anche quando teicoplanina è dosata in presenza di altri antibiotici, benché questa tecnica non distingua la frazione libera di farmaco da quella legata alle proteine plasmatiche, soprattutto all’albumina, ne’ sia in grado di riconoscere le singole frazioni di teicoplanina presenti nella miscela come invece è possibile mediante cromatografia HPLC.
Assorbimento e concentrazione plasmatica
In un confronto tra valori plasmatici dopo somministrazione di una singola dose di 400 mg/3ml per via endovenosa ed intramuscolare di teicoplanina 6 mg/kg in 23 volontari sani, sono state raggiunte concentrazioni plasmatiche di picco (Cmax) di 43,2 mg/L dopo 0,5h e di 12,3 mg/L dopo 4h, in entrambe le modalità di somministrazione. L’assorbimento di teicoplanina dopo
somministrazione intramuscolare è quindi equivalente a quello dopo somministrazione endovenosa .
La somministrazione a 18 volontari sani di una singola dose endovenosa di teicoplanina di 15, 20 e 25 mg/kg ha prodotto Cmax di 194, 197 e 253 mg/L e concentrazione minima (Cmin) a 24 h di 10,5, 13,6 e 19,8 mg/L, con valori di area sottesa alla curva concentrazione/tempo (AUC) di 1444, 1756 e 2379 mg/L*h, rispettivamente. Questo dimostra come parametri farmacocinetici quali AUC e Cmax siano direttamente correlati alla dose di farmaco somministrata.
Lo stato stazionario di teicoplanina per valori di Cmin di 14 e 23 mg/L dopo infusione endovenosa di una dose di 6 e 12 mg/kg rispettivamente, per un periodo maggiore di 30 min, ogni 12 ore e poi ogni 24 ore è stato raggiunto in 6 volontari sani dopo 13 giorni di terapia .
In due gruppi di pazienti neutropenici trattati con teicoplanina alla dose di 6 mg/kg/die per via endovenosaa, lo
steady-state è stato raggiunto dopo 14 giorni. Dopo 1 ora la concentrazione
plasmatica era compresa tra 12,5 e 41 mg/L e lo steady-state dopo 3 ore era 22 mg/L. Bisogna comunque considerare una notevole
variabilità individuale nei parametri utilizzati nell’analisi farmacocinetica.
In 52 neonati, la maggior parte dei quali erano prematuri, il valore di Cmin dopo una dose di carico di 10 mg/kg era di 6,9 mg/L e dopo la quinta dose giornaliera di 6 mg/kg il valore di Cmin era di 8 mg/L. I valori di Cmin erano maggiori dopo una dose di carico di 15 mg/Kg (12,6 mg/L) e dopo una dose di mantenimento di 8 mg/kg per 5 giorni (14,5 mg/L) .
Distribuzione
L’apparente volume di distribuzione di teicoplanina quando si trova allo steady-state (Vdss) dopo somministrazione endovenosa di 6-15 mg/kg in volontari sani è intorno a 0,8-1,6 L/kg. Il Vdss dopo somministrazione endovenosa di teicoplanina 30 mg/kg era significativamente minore rispetto a dopo una dose compresa fra 3 e 12 mg/kg, nello studio di Smithers et al. (1992a), ma in quello di Del Favero et al. (1991) il Vdss era simile dopo somministrazione endovenosa di 15, 20 o 25 mgkg di teicoplanina.
La Teicoplanina penetra nel tessuto miocardico; in 32 pazienti sottoposti a bypass coronarico la concentrazione a livello del miocardio atriale, dopo iniezione endovenosa di teicoplanina 6 mg/kg al momento dell’induzione dell’anestesia, risulta essere di 70,6 mg/Kg, all’incirca 3,7 volte la concentrazione plasmatica . Allo stesso modo in 17 pazienti a cui è stata somministrata, per via endovenosa, teicoplanina 12 mg/kg, dopo 50 min dalla somministrazione a livello atriale si avevano concentrazioni di 140 mg/kg, all’incirca 2,8 volte la concentrazione plasmatica. In 17 pazienti a cui è stata somministrata per via endovenosa una dose di teicoplanina di 800 mg, dopo 4h, la concentrazione risultava a livello miocardico di 43 mg/kg, a livello pericardico di 26 mg/kg e a livello del grasso mediastinico di 3,2 mg/kg.
Teicoplanina si accumula anche a livello del tessuto mammario; in 21 pazienti a cui sono stati somministrati 400 mg di teicoplanina prima di un intervento chirurgico a livello della mammella, sono state valutate concentrazioni di 2,8 mg/kg, l’11% della concentrazione plasmatica.
La concentrazione a livello del liquor in pazienti con sintomi di infiammazione meningea dopo neurochirurgia, in seguito a somministrazione endovenosa di teicoplanina 400 mg, varia fra 0,5 e 1
mg/l, ma le concentrazioni di picco dopo somministrazione intraventricolare di teicoplanina 5 mg (bambini) o 20 mg ogni 24-48 ore risultano maggiori a 40 mg/l.
Il legame di teicoplanina con le proteine plasmatiche si aggira intorno al 90% ed è direttamente proporzionale fino ad una concentrazione di 300 mg/l. La proteina che principalmente lega la teicoplanina sembra essere l’albumina, seconda solamente ad una α1 -glicoproteina acida.
Eliminazione
I metaboliti derivano dall’idrossidazione del componente A2-3 della catena degli acidi grassi. I due metaboliti identificati Ω1 e Ω2 hanno simile spettro di attività battericida, ma considerevole minor attività (dall’ 1,5 al 12%) rispetto alla teicoplanina.
La clearance totale di teicoplanina dopo somministrazione endovenosa di 3-30 mg/kg in volontari sani varia fra 10 e 13 ml/h/kg e la clearance renale è compresa tra 8 e 12 ml/h/kg; questo indica come quello renale sia il meccanismo preponderante nell’eliminazione del
farmaco. L’eliminazione della teicoplanina per via renale avviene mediante filtrazione glomerulare.
Le proprietà farmacocinetiche dei singoli componenti di teicoplanina (A3-1, A2-1, A2-2, A2-3, A2-4, A2-5) sono stati studiati da Bernareggi et al. (1990), che hanno osservato che all’aumentare della lipofilia (da A2-1 a A2-5) la frazione libera, il Vdss, la clearance totale, la clearance renale e l’escrezione urinaria totale diminuivano, mentre il Vdss e la clearance renale di farmaco non legato aumentavano. Comunque le differenze tra i componenti individuali sono minime e nella pratica clinica teicoplanina può essere considerata come una singola molecola.
Effetti degli stati patologici sulla farmacocinetica
La farmacocinetica della teicoplanina è stata studiata in pazienti con insufficienza renale, in tossicodipendenti trattati per endocarditi batteriche e in pazienti ustionati.
La clearance renale e totale è correlata alla clearance della creatinina e diminuisce in pazienti con insufficienza renale con clearance della creatinina compresa tra 13 e 22 ml/min. In questi
pazienti, dopo somministrazione endovenosa di 3 mg/kg di teicoplanina, la clearance renale è stata valutata fra 1,1 e 4 ml/h/kg (all’incirca 0,07-0,28 l/h) con valori di t½β che variano tra 280 e 667 ore.
La Teicoplanina non è rimossa dal circolo mediante emodialisi qualunque membrana a basso o alto flusso venga utilizzata. In pazienti con storia di tossicodipendenza con abuso di droghe iniettate per via endovenosa, trattati per endocardite batterica con 10-15 mg/kg/12h per meno di 10 somministrazioni e 10-10-15 mg/kg/24h nelle somministrazioni successive, la clearance renale e la clearance totale sono maggiori e più variabili di quanto abitualmente riportato per i volontari sani. Il valore di t½β si riduce a 78 ore.
Efficacia terapeutica
Trials terapeutici condotti fin dalle prime sperimentazioni su teicoplanina hanno messo in evidenza l’efficacia di questo farmaco nel trattamento delle infezioni da batteri Gram-positivi e nella terapia empirica dei pazienti immunocompromessi con malattie ematologiche soggetti a chemioterapia aggressiva.
Studi sull’efficacia di teicoplanina nel trattamento di batteriemie in pazienti non neutropenici sono poco significativi e mal comparabili fra loro. In un recente studio comparativo fra teicoplanina, somministrata a dosi di 6mg/kg/24h, e vancomicina, somministrata a dosi di 15mg/kg/12h, in pazienti con batteriemia o infezione a livello vascolare, senza neutropenia, è stata messa in evidenza una sostanziale equivalenza tra i due trattamenti. Utilizzata in monoterapia, teicoplanina a dosi di 400-800 mg/kg risulta efficace nell’84-93% dei pazienti con batteriemia da Staphilococcus aureus e nel 90-100% dei pazienti con endocardite streptococcica o enterococcica.
La guarigione clinica in pazienti con infezioni dei tessuti molli causata da Staphilococcus aureus o epidermidis è stata osservata nell’89-100% dei casi, per dosaggi di teicoplanina per via intramuscolare di 200-800 mg/kg.
In pazienti con osteomielite acuta o cronica o artrite settica da Gram-positivi, trattati con dosi di 600 mg/kg per via endovenosa, è stata osservata una guarigione clinica dell’83-100% dei casi. In studi con un adeguato follow up la completa risoluzione del quadro di osteomielite acuta o cronica si è mantenuta per un periodo maggiore di 6 mesi nel 71-90% dei casi .
La combinazione terapeutica teicoplanina-ciprofloxacina risulta significativamente più efficace della monoterapia con ciprofloxacina o ceftriaxone nel trattamento delle infezioni delle basse vie respiratorie.
Nel trattamento della diarrea e della colite associata a Clostridium difficile la somministrazione orale di teicoplanina 100 mg/12 h e vancomicina 500 mg/6h risulta terapeutica nel 96-100% dei casi. L’infezione da Clostridium difficile tende a permanere maggiormente nei pazienti trattati con vancomicina, rispetto a quelli che hanno ricevuto teicoplanina.
Quando viene utilizzata nel trattamento dei pazienti neoplastici con neutropenia, la teicoplanina mostra efficacia simile a vancomicina, in associazione a piperacillina o tobramicina e a ceftazidime o amikacina. La Teicoplanina è associata ad una minore incidenza di superinfezioni da Candida ed è meglio tollerata, ponendo la teicoplanina come valida alternativa a vancomicina.
La Teicoplanina si è dimostrata efficace come antibiotico di seconda scelta nel trattamento di infezioni resistenti al trattamento empirico iniziale con ceftazidime utilizzato in monoterapia o in associazione con amikacina, piperacillina ed amikacina, o antibiotico β-lattamico e aminoglicoside.
In pazienti sottoposti ad intervento di introduzione o sostituzione di protesi di anca o di ginocchio, una singola somministrazione endovenosa di teicoplanina alla dose di 400 mg, somministrata all’induzione dell’anestesia, equivale alla somministrazione perioperatoria di 4 dosi di cefamandolo o di 5 dosi di cefazolina.
La profilassi antibiotica con teicoplanina è superiore al placebo nel ridurre l’incidenza di setticemie da Gram-positivi correlate all’inserzione del catetere di Hickman.
L’esperienza clinica nel trattamento con teicoplanina di infezioni da Gram-positivi in neonati, lattanti e bambini è molto limitata. Comunque i primi dati sul trattamento di setticemie, infezioni delle alte e basse vie respiratorie, infezioni cutanee e dei tessuti molli e di pazienti pediatrici neutropenici con febbre, suggeriscono che la teicoplanina è efficace nel trattamento di queste infezioni a dosi di 6-10 mg/kg/24h.
Batteriemie ed endocarditi
In un recente studio comparativo condotto su 39 pazienti con batteriemia e infezione intravascolare, compresa l’endocardite, teicoplanina 6 mg/kg/die dopo una dose di carico 6 mg/kg/12h e vancomicina 15 mg/kg/12h hanno dimostrato efficacia comparabile in pazienti con batteriemia causata da Staphilococcus aureus o altri cocchi Gram-positivi.
In 12 pazienti con endocardite o aneurisma micotico causato da Staphilococcus aureus, il 25% ed il 75% di pazienti trattati rispettivamente con teicoplanina e vancomicina risultavano guariti. Il basso risultato con teicoplanina può essere dovuto al dosaggio sub-ottimale nei pazienti con endocarditi del cuore sinistro con aneurisma micotico. In un altro studio comparativo in cui teicoplanina e vancomicina erano somministrate singolarmente nel trattamento di batteriemie dovute a Staphilococcus aureus e di altre gravi infezioni da Gram positivi, entrambi i farmaci erano ugualmente efficaci.
Usata in monoterapia, la teicoplanina a dosaggi di 400-800 mg/die raggiunge guarigione clinica e negativizzazione delle colture nell’84-93% dei pazienti con batteriemia da staphilococcus aureus.
In un piccolo gruppo di pazienti giapponesi, la teicoplanina 200-400 mg/die ha consentito guarigione clinica e negativizzazione delle colture nell’33-80% dei pazienti con batteriemie.
In alcuni studi non comparativi la teicoplanina a dosi di 10 mg/kg si è dimostrata efficace nel 90-100% dei pazienti affetti da endocardite streptococcica o enterococcica e nel 71-86% dei pazienti con endocardite da Staphilococcus aureus.
In un’analisi retrospettiva dell’efficacia di teicoplanina in monoterapia nel trattamento di 36 pazienti con endocardite, la guarigione clinica è stata raggiunta per tutti quanti i 18 pazienti con infezione streptococcica, per 3 su 5 con infezione da enterococcus faecalis, per 2 su 3 con infezione da staphilococchi coagulasi-negativi e per 5 su 10 con infezione da staphilococcus aureus.
Teicoplanina ha trattato 41 su 48 pazienti con batteriemia da staphilococcus aureus; il trattamento è fallito nei pazienti con batteriemia causata da staphilococcus aureus con dosi plasmatiche inferiori a 5 mg/kg.
Il dosaggio ottimale di teicoplanina nel trattamento delle batteriemie causate da staphilococcus aureus deve essere ancora stabilito .
Infezioni della pelle e dei tessuti molli
In studi condotti in un numero ridotto di pazienti con infezioni della pelle e dei tessuti molli, dopo terapia con teicoplanina 200-800 mg o 3,6-6,8mg/kg in monosomministrazione endovenosa o intramuscolare, l’efficacia del trattamento è stata osservata nell’89-100% dei casi
Le infezioni erano provocate per lo più da Staphilococcus aureus o da Staphilococcus epidermidis.
In uno studio non randomizzato tra somministrazione endovenosa e intramuscolare di teicoplanina 3 mg/kg, Staphilococcus aureus è stato eradicato nel 100% dei 18 i pazienti che avevano assunto il farmaco per via endovenosa, ma solo nel 56% dei 16 pazienti trattati con somministrazione intramuscolare.
Infezioni delle ossa e delle articolazioni
Studi condotti su pazienti con osteomielite acuta o cronica o con artrite settica, causata da batteri Gram-positivi, hanno
dimostrato guarigione clinica nell’83-100% dei pazienti trattati con teicoplanina 6 mg/kg.
In studi con un follow up adeguato, la completa risoluzione dell’osteomielite acuta o cronica si è mantenuta tale nel 71-90% dei casi dopo un periodo maggiore di 6 mesi dalla sospensione del trattamento. (Fig 3)
0% 10% 20% 30% 40% 50% 60% 70% 80% 90% 100% P a z ie n ti c o n r is o lu z io n e c li n ic a c o m p le ta Artrite settica Osteomielite acuta Osteomielite cronica
Risposta al trattamento con teicoplanina 6-12 mg/kg/die per una media di trattamento di 26 giorni, alla fine del trattamento e a 6
mesi in 90 pazienti con artrite settica, osteomielite acuta o cronica
Fine del trattamento
6 mesi dopo la fine del trattamento
Fig. 3
Infezioni delle basse vie respiratorie
Studi comparativi hanno valutato l’efficacia di teicoplanina somministrata insieme a ciprofloxacina rispetto alla somministrazione
singola di ciprofloxacina o ceftriaxone, in pazienti di età superiore a 65 anni, con polmonite nosocomiale da batteri Gram-positivi. In tutti gli studi è stata dimostrata una maggiore efficacia nei pazienti trattati con teicoplanina+ciprofloxacina rispetto a ciprofloxacina o ceftriaxone in monoterapia.
Dopo somministrazione parenterale di teicoplanina 200 o 400mg/die è stata dimostrata guarigione clinica nel 91-93% dei pazienti con polmonite, la maggior parte dei quali con patologia polmonare di base, compresa neoplasia. In questi pazienti è stata dimostrata anche negativizzazione degli esami colturali eseguiti su lavaggio bronco-alveolare; la negativizzazione è stata ottenuta nel 89% dei pazienti con infezione da Staphilococcus aureus e nel 100% dei pazienti con infezione streptococcica.
In due studi multicentrici , uno Europeo ed uno Italiano, la guarigione clinica in caso di polmonite da Gram-positivi è stata dimostrata nel 92% dei pazienti trattati con teicoplanina 200-400 mg/die.
Trattamento empirico dei pazienti neutropenici
La prevalenza di infezioni da Gram-positivi in pazienti neutropenici e neoplastici è aumentata negli ultimi anni e si considera appropriato instaurare una copertura antibiotica per Gram-positivi in questi pazienti. Benché siano stati eseguiti numerosi studi sull’efficacia di teicoplanina in questi pazienti, rimangono controversie riguardo alla reale necessità di somministrare antibiotici, riguardo all’antibiotico da somministrare e riguardo al timing di introduzione dell’antibiotico a regime empirico (Fig. 4).
0% 10% 20% 30% 40% 50% 60% 70% 80% 90% 100% Risposta complessiva Risposta in pazienti con batteriemie da Gram +
Risposta complessiva e risposta in pazienti con batteriemie da Gram+ nelle terapie empiriche con
teicoplanina/ceftazidime/amikacina o
vancomicina/ceftazidime/amikacina in 527 pazienti con neutropenia e febbre
Teicoplanina Vancomicina
Profilassi
Profilassi in chirurgia
In pazienti sottoposti a protesi di anca o ginocchio, una singola dose di teicoplanina 400 mg somministrata per via endovenosa al momento dell’induzione dell’anestesia ha dimostrato la stessa efficacia di cefamandolo 2 g al momento dell’induzione o 1g 6, 12 o 18 ore dopo l’intervento in 660 pazienti e di cefazolina 2 g in 439 pazienti.
Una dose singola di teicoplanina 6 mg/kg ev ha dimostrato avere la stessa efficacia di cefradine 1g associato a metronidazolo 1 g nel prevenire episodi settici dopo chirurgia vascolare.
In un recente studio è stato dimostrato che l’incidenza di batteriemia da Streptococco, isolato in emocolture raccolte uno o due minuti dopo estrazione dentaria, è significativamente ridotta in 40 pazienti dalla somministrazione di una singola dose endovenosa di 400 mg di teicoplanina somministrata dopo l’induzione dell’anestesia e che nello stesso numero di pazienti teicoplanina è più efficace di amoxicillina 1 g i.m. somministrata prima dell’intervento.
Profilassi nelle infezioni correlate all’uso di cateteri venosi centrali
L’efficacia di teicoplanina nel prevenire le infezioni CVC correlate da Gram-positivi o le infezioni dei tessuti molli è stata studiata in un numero esiguo di pazienti con leucemia e portatori di catetere di Hickman per la somministrazione della chemioterapia.
Comparata con il placebo, la somministrazione endovenosa di teicoplanina 400 mg 2 ore prima dell’inserimento del catetere è associata ad una diminuita incidenza (p<0,05) di infezioni da Gram-positivi correlate a catetere [7 su 40 (17,5%) vs 16 su 40 (40%)].
Le infezioni dei tessuti molli correlate a CVC sono presenti nel 33% dei pazienti a cui viene somministrata teicoplanina e nel 44% dei pazienti a cui viene somministrato placebo e la necessità di rimozione del CVC occorre in 1 e 3 pazienti trattati con teicoplanina e placebo rispettivamente.
In uno studio non comparativo , nessuno dei 30 pazienti ai quali è stata somministrata teicoplanina 400mg al momento dell’inserzione del catetere e 24 ore dopo, ha sviluppato infezione da batteri Gram-positivi nelle 2 settimane successive.
Da questi studi ricaviamo che la somministrazione profilattica di teicoplanina sembra ridurre lo sviluppo precoce di infezioni CVC correlate; questa profilassi può essere importante nei pazienti neutropenici, che hanno una elevata incidenza di questo tipo di infezioni, anche se persiste il dubbio riguardo all’insorgenza di resistenza a teicoplanina.
Utilizzo in neonati, lattanti e bambini
L’esperienza clinica con teicoplanina nei neonati, nei lattanti e nei bambini è limitata, ma dati iniziali suggeriscono che teicoplanina somministrata per via endovenosa o intramuscolare a dosi di 10 mg/kg/12h con 5 dosi di carico seguita dalla somministrazione di 6-10 mg/kg/24h è efficace nel trattamento delle infezioni da Gram-positivi.
La teicoplanina è stata utilizzata nel trattamento di pazienti pediatrici (inclusi i neonati) con infezioni gravi da batteri Gram-positivi. Un’alta percentuale di successo clinico (92%) è stata raggiunta in 61 bambini con infezione della cute e dei tessuti molli, 40% dei quali trattati a domicilio. La stessa risposta è stata riscontrata in altri 47 bambini con infezioni di cute e tessuti molli o di ossa e articolazioni: l’83% di questi bambini ha dimostrato guarigione clinica
e nel 17% dei casi è stata dimostrata negativizzazione all’esame colturale, con una eradicazione del patogeno nel 100% dei casi.
In uno studio comparativo tra dosaggi differenti di teicoplanina in 52 neonati prematuri, la guarigione clinica è stata raggiunta in 24 su 30 pazienti trattati con teicoplanina 10 mg/kg il primo giorno e 6 mg/kg nei giorni successivi, e in 18 su 22 pazienti trattati con teicoplanina 15 mg/kg il primo giorno e 8 mg/kg nei giorni successivi. In entrambi i gruppi è stata somministrata amikacina in associazione a teicoplanina. I patogeni (Staphilococchi coagulasi-negativi nell’80% dei casi) sono stati eradicati nell’83% e nell’86% dei pazienti trattati con bassi ed alti dosaggi rispettivamente.
Quando viene utilizzata empiricamente in combinazione con ceftriaxone 50 mg/kg/die, teicoplanina 10 mg/kg/die si è dimostrata efficace nel trattamento di 41 su 47 bambini affetti da leucemia linfatica acuta con febbre. La somministrazione profilattica per via endovenosa di teicoplanina 6 mg/kg al momento del posizionamento dei CVC, utilizzati in questi bambini per la somministrazione della chemioterapia, previene l’ insorgenza di infezioni da Gram-positivi catetere correlate.
Possiamo quindi concludere che la teicoplanina è un farmaco promettente nel trattamento delle infezioni da batteri
Gram-positivi nei bambini e nei neonati, ma studi comparativi sono necessari per chiarire la sua effettiva efficacia e tollerabilità nei pazienti pediatrici.
Tollerabilità
La buona tollerabilità da parte dei pazienti di teicoplanina è stata messa in evidenza da numerosi studi.
L’analisi di dati inerenti agli studi preclinici e di dati provenienti da studi effettuati dopo la commercializzazione del farmaco in Europa evidenziano che uno o più effetti collaterali o avversi sono stati riportati dal 10,3% di 3377 pazienti. Reazioni anafilattiche sono state segnalate nel 2,6% dei pazienti, reazioni di tipo locale nel 1,7%, alterazioni della funzionalità epatica e renale nell’1,7% e nello 0,6% dei casi rispettivamente, comparsa di febbre nello 0.8% ed ototossicità nello 0.3% dei casi.
L’incidenza o il tipo di reazione avversa non è influenzata dall’età del paziente o dalla dose del farmaco maggiore di 10 mg/kg, ma l’incidenza di febbre e rash cutanei aumenta con la dose di farmaco somministrata. La Teicoplanina meno frequentemente
rispetto alla vancomicina causa insufficienza renale, specie in associazione ad antibiotici aminoglicosidici, o reazioni anafilattiche tipo “red man syndrome”.
Reazioni anafilattiche
Queste reazioni sono state osservate saltuariamente nei pazienti trattati con teicoplanina. In volontari sani, una singola dose di vancomicina 15 mg/kg incrementa significativamente il rilascio di istamina e causa una “red man syndrome” in 11 su 12 pazienti, mentre la stessa dose di teicoplanina non dà effetti collaterali. Un simile effetto di vancomicina è stato dimostrato su volontari sani anche in altri studi, mentre né vancomicina, né teicoplanina causano reazioni di tipo anafilattico in pazienti trattati per batteriemie da Gram-positivi. Non è stata dimostrata correlazione tra i livelli plasmatici di istamina o tra l’AUC e la gravità della “red man syndrome” nei volontari sani. Reazioni di tipo allergico in seguito alla somministrazione di teicoplanina in pazienti già sottoposti a trattamento con vancomicina sono state riportate sporadicamente.
La significatività della cross-reazione tra vancomicina e teicoplanina rimane dubbia, ma reazioni di tipo allergico a vancomicina si sono manifestate in alcuni pazienti dopo la sostituzione di teicoplanina. In un paziente che ha presentato una reazione allergica a vancomicina, reazioni in vitro su basofili isolati dal siero del paziente dimostravano che il rilascio di istamina era mediato da IgE presenti sulla membrana cellulare dopo esposizione a vancomicina o teicoplanina indifferentemente.
Possiamo quindi concludere che molti pazienti che hanno presentato reazione anafilattica a vancomicina, non hanno problemi a tollerare una terapia con teicoplanina, mentre non è vero l’inverso.
Nefrotossicità
Teicoplanina ha dimostrato di non avere una alta potenzialità nel causare nefrotossicità quando è stata utilizzata in monoterapia nel trattamento o nella profilassi di infezioni da Gram-positivi, ma è stata segnalata l’insorgenza di nefrite interstiziale in paziente diabetici trattati con teicoplanina 1200 mg/die per un periodo di oltre 40 giorni.
Teicoplanina è associata ad un incremento della cretininemia > 40µmol/L dopo la prima settimana post-operatoria in pazienti sottoposti a cardiochirurgia trattati profilatticamente. Questo incremento è comunque meno frequente rispetto a quello riscontrato nei pazienti trattati in via profilattica con tobramicina e flucloxacillina. In uno studio comparativo riguardo l’impatto sulla funzionalità renale di teicoplanina e vancomicina si è messo in evidenza che la funzionalità renale diminuisce in maniera poco significativa nei pazienti trattati con teicoplanina o con ciclosporina A in associazione a teicoplanina o vancomicina, mentre diminuisce significativamente in pazienti trattati con vancomicina in monoterapia.
Un altro studio comparativo tra teicoplanina e vancomicina ha dimostrato che quando un altro farmaco viene somministrato assieme ad un antibiotico aminoglicosidico, l’incremento della cretininemia è inferiore se quell’antibiotico è la teicoplanina, mentre è maggiore se si somministra la vancomicina. Inoltre è stato dimostrato che la frequenza di nefrotossicità in 610 pazienti neutropenici è simile se somministriamo teicoplanina o vancomicina in associazione a amikacina o ceftazidime.
Tollerabilità nei pazienti pediatrici
Nella limitata esperienza riguardo all’utilizzo di teicoplanina nei bambini, reazioni avverse sono state riportate nell’8-14% di casi in 115 bambini in cui si sono presentati aumento delle transaminasi, broncospasmo e dispnea, esantemi, e problemi gastrointestinali; tutte queste rezioni si sono dimostrate passeggere e sono scomparse alla sospensione del farmaco.
Dose e modo di somministrazione
Teicoplanina viene somministrata per via endovenosa, solitamente in bolo, o per via intramuscolare.
Negli adulti con funzionalità renale normale si inizia la somministrazione con una dose di carico di 6 mg/kg/12h, seguita da una mono-somministrazione giornaliera della stessa dose. La somministrazione endovenosa e dosaggi più elevati sono raccomandabili in presenza di infezioni gravi.
Pazienti con artrite settica devono essere trattati con dose di mantenimento di 12 mg/kg/die.
In pazienti neutropenici con febbre il trattamento empirico delle complicanze infettive prevede una dose carico di 6-12 mg/kg/12h che deve essere seguita da una dose di mantenimento di 6 mg/kg/die.
In pazienti con endocardite da Staphilococcus aureus, le concentrazioni plasmatiche di teicoplanina devono essere superiori a 20 mg/L quando teicoplanina è utilizzata in monoterapia, benché in questi pazienti è consigliabile l’associazione di aminoglicosidi fino alla seconda settimana di trattamento.
Nei bambini con età inferiore a 12 anni, in base alla gravità dell’infezione, si raccomanda la somministrazione di una dose di carico di 10 mg/kg/12h, seguita da una dose di mantenimento di 6-10 mg/kg/die.
Nei neonati prematuri per mantenere la dose plasmatici al di sopra di 10 mg/L è utile somministrare una dose di carico di 16 mg/kg il primo giorno, seguito da una dose di mantenimento di 8 mg/kg/die.
Nei pazienti con insufficienza renale acuta o cronica la dose di 6 mg/kg utilizzata negli adulti con funzionalità renale normale deve essere somministrata nei primi tre giorni di trattamento; in seguito la
dose deve essere adattata in modo da mantenere una concentrazione plasmatica >10mg/L.
Il dosaggio plasmatico è utile anche nei pazienti con storia di abuso di sostanze stupefacenti per via endovenosa per assicurare una dose plasmatica efficace di teicoplanina.
Ruolo di teicoplanina nella terapia antibiotica
L’ emergere dei batteri Gram-positivi come potenziali patogeni in pazienti neutropenici con febbre è ormai riconosciuta. E’ ormai accettato che un antibiotico glicopeptidico serva nel trattamento delle infezioni in questi pazienti. E’ invece ancora controverso il momento in cui questi antibiotici debbano entrare nel regime di trattamento e se teicoplanina o un altro antibiotico glicopeptidico debbano essere scelti. Virtualmente tutti i cocchi Gram-positivi sono suscettibili sia a teicoplanina che a vancomicina, anche se questi antibiotici vengono utilizzati da più di 30 anni; la resistenza a questi farmaci è rara, anche se la sensibilità di alcuni ceppi di Staphilococchi coagulasi-negativi e di alcuni ceppi di enterococchi è diminuita.
Per la lunga esperienza nell’utilizzo di vancomicina, numerosi studi sono stati condotti sull’efficacia di questo farmaco nel trattamento delle infezioni da Gram-positivi e numerosi studi comparativi sono stati svolti anche tra teicoplanina e vancomicina; questi ultimi, pur includendo un numero limitato di pazienti, hanno dimostrato una sostanziale equivalenza di efficacia fra teicoplanina e vancomicina.
Nonostante la limitatezza dei dati raccolti, teicoplanina ha dimostrato minor incidenza nell’insorgenza di effetti collaterali, anche importanti, rispetto a vancomicina: teicoplanina ha infatti dimostrato una minore influenza sulla funzionalità renale e sulla insorgenza di red man syndrome, soprattutto se somministrata in associazione con un antibiotico aminoglicosidico.
La maneggevolezza nella somministrazione del farmaco è dimostrata dalla necessità di una singola dose giornaliera, dopo la dose di carico, e dal fatto che sia indifferente, nella maggior parte dei pazienti, la somministrazione per via endovenosa o intramuscolare.
Recenti studi sull’efficacia di teicoplanina nelle infezioni, documentate tramite isolati colturali, da batteri Gram-positivi, incluse le batteriemie, hanno dimostrato la reale negativizzazione delle colture. Di conseguenza teicoplanina è utilizzata anche nel trattamento
di seconda linea di pazienti neutropenici con febbre nei quali la terapia empirica con aminoglicosidi e β-lattamici non abbia funzionato.
Concludendo possiamo affermare che esistono numerose evidenze che possiamo preferire teicoplanina a vancomicina nel trattamento delle infezioni da batteri Gram-positivi documentate tramite isolamenti colturali, sia per la diminuita insorgenza di effetti collaterali sia per la maggiore maneggevolezza del farmaco. L’utilizzo di teicoplanina nei pazienti neutropenici con febbre e nei bambini deve ancora essere indagato tramite studi comparativi con altri antibiotici.
Parametri PK/PD e teicoplanina
L’analisi degli studi clinici e la valutazione dei risultati ottenuti in laboratorio, sia in vitro che in modelli animali di infezione, hanno mostrato che teicoplanina raggiunge la sua massima efficacia quando le concentrazioni plasmatiche (o nel mezzo di coltura) rimangono al di sopra dei valori di MIC dei microrganismi patogeni per tempi sufficientemente lunghi, a prescindere dalla via e dalle modalità di somministrazione. Infatti, teicoplanina, al pari altri farmaci inibitori
della sintesi e del rimaneggiamento della parete batterica, quali le betalattamine, e il più recente linezolid, appartenente alla classe degli oxazolidinoni, risulta particolarmente efficace quando le concentrazioni plasmatiche sono superiori ai valori di MIC del patogeno per almeno il 40-60% del tempo che intercorre tra due somministrazioni. Tale comportamento dipende dal fatto che, verosimilmente, per ottenere una sufficiente inibizione della sintesi della parete con conseguente riduzione della popolazione batterica presente nel sito d’infezione, è necessario far si che il maggior numero di microrganismi sia esposto al farmaco nel momento in cui essi vanno incontro a replicazione cellulare. Infatti, una delle cause di minor sensibilità ai chemioterapici inibitori della parete è rappresentata dallo stato di quiescenza del batterio. Approfondite analisi hanno quindi dimostrato che percentuali di tempo pari a quelle indicate sopra rappresentano un obiettivo importante ai fini della guarigione clinica del paziente in trattamento con teicoplanina.
Il tempo sopra i valori di MIC90 (espresso come t>MIC) rappresenta quindi il più importante parametro farmacocinetico che predice l’efficacia di un trattamento con teicoplanina. Pertanto, è necessario che la dose di teicoplanina sia tale affinché le
concentrazioni plasmatiche del farmaco rimangano superiori a quelle di MIC90 per tempi sufficientemente lunghi.
Più recentemente (Pea et al, 2003), è stato dimostrato che dosi di carico di teicoplanina (800 mg q12h) permettono di raggiungere concentrazioni plasmatiche minime (Cmin) in tempi più brevi rispetto ad un protocollo standard (800 mg q24). In tal modo la popolazione batterica è esposta a concentrazioni efficaci di teicoplanina in tempi minori, assicurando una migliore e più rapida guarigione clinica del paziente ed eventualmente eradicazione dell’infezione.
PARTE II
TERAPIA ANTIBIOTICA IN
AMBIENTE CRITICO
Principi
generali
per
una
appropriata
prescrizione di antibiotici nei pazienti di area critica
I pazienti critici, specialmente quelli ricoverati presso le unità di terapia intensiva, sono pazienti ad altissimo rischio di sviluppare una infezione di tipo nosocomiale, con una incidenza 5-10 volte maggiore rispetto a quelli ricoverati in altri reparti.
Nello studio EPIC (European prevalence of infections in intensive care) è stato dimostrato che la prevalenza di infezioni nosocomiali in UTI è del 20,6%, la metà delle quali (46,9%ca.) sono polmoniti.
Gli antibiotici rappresentano i farmaci più frequentemente e comunemente prescritti in UTI e bisogna quindi stabilire una politica appropriata nel managing di questi farmaci.
Non c’è niente di peggio che l’utilizzo di antibiotici inappropriati o a dosi inappropriate: questo può portare al fallimento della terapia e all’ insorgenza di resistenza nei confronti di quell’antibiotico da parte di alcuni ceppi batterici. Guardando al passato recente notiamo che la selezione di ceppi resistenti è avvenuta in seguito alla pressione antibiotica causata da un utilizzo sconsiderato degli stessi: questo è accaduto negli anni ’60 con l’insorgenza di ceppi di Staphilococcus aureus meticillina-resistenti, negli anni ’80 con la crescita di batteri Gram-negativi β-lattamasi-producenti e negli anni ’90 con lo sviluppo di ceppi di enterococchi vancomicina-resistenti. Negli ultimi anni è stata registrata una diminuzione nella sensibilità di Staphilococcus aureus nei confronti degli antibiotici glicopeptidici, una resistenza di Pseudomonas aeruginosa ai fluorochinoloni, concludendo con il recente isolamento di Staphilococcus aureus completamente vancomicina-resistente.
Fra le cause imputate nel fallimento di una terapia antibiotica possiamo includere un inadeguato spettro di attività nei confronti del microrganismo isolato, la presenza di immunodepressione da parte
dell’ ospite, una patologia di base molto severa, l’ insorgenza di reazioni avverse all’ antibiotico stesso, una inappropriata durata della terapia, la superinfezione da parte di altri patogeni.
La scelta dell’antibiotico appropriato all’ inizio sella terapia è diventata moralmente obbligatoria, soprattutto in seguito alla pubblicazione di numerosi studi che dimostrano che una iniziale scelta non adeguata può essere responsabile di un alto numero di fallimenti terapeutici e di un incremento della morbilità e mortalità nei pazienti di terapia intensiva. Con l’intento quindi di impostare una terapia empirica ad ampio spettro il più possibile efficace, sono stati proposti dei protocolli di trattamento basati su osservazioni riguardanti la fisiopatologia delle infezioni e i dati epidemiologici.
Caratteristiche generali degli antibiotici
Antibiotici idrofili Antibiotici lipofili • β-lattamici o Penicilline o Cefalosporine o Carbapenemici o Monobactam • Glicopeptidi • Aminoglicosidi • Macrolidi • Fluorochinoloni • Tetracicline • Cloramfenicolo • Rifampicina • Volume di distribuzione limitato
• Non attivi nei confronti dei patogeni intracellulari • Eliminazione per via
renale
• Grande volume di distribuzione
• Attivi nei confronti dei patogeni intracellulari • Metabolismo a livello
Influenza dei diversi meccanismi fisiopatologici
nell’ alterare la disponibilità degli antibiotici nel
paziente critico
Le variazioni a livello del contenuto dei fluidi extracellulari e/o a livello della funzione renale o epatica possono essere considerate il più frequente e rilevante meccanismo fisiopatologici responsabile delle alterazioni della disponibilità degli antibiotici nel paziente critico.
Gli antibiotici idrofili escreti per via renale devono essere considerati a più alto rischio di presentare variazioni sostanziali anche giornaliere nella concentrazione plasmatica, il che può richiedere un continuo aggiustamento della dose in base alle caratteristiche del paziente. Per esempio, per quanto riguarda il Volume di Distribuzione (Vd), è ormai noto che la presenza di edemi, ascite, versamenti pleurici, causando diluizione nel compartimento extracellulare, può diminuire la concentrazione dell’ antibiotico a livello tissutale o ematico. In accordo con l’idrofilia o la lipofilia dell’antibiotico stesso, l’effetto netto della diluizione può essere sostanziale o ininfluente. In effetti, poiché gli antibiotici idrofili hanno un volume di distribuzione
limitato allo spazio extracellulare (< 0.3-0.4 L/kg), la loro concentrazione a livello plasmatico o a livello interstiziale può diminuire drammaticamente a causa della formazione di essudati. D’altra parte, per quanto riguarda gli antibiotici lipofili, che presentano grandi volumi di distribuzione(>1L/Kg), la diluizione del liquido interstiziale può risultare poco rilevante in conseguenza delle maggiori concentrazioni intra- ed extracellulari. Variazioni significative delle concentrazioni plasmatiche e nei liquidi extracellulari degli antibiotici idrofili escreti per via renale possono verificarsi per i cambiamenti nella funzionalità renale, frequenti nel paziente critico. Al contrario, la disponibilità degli antibiotici lipofili cambia significativamente in base alla funzionalità epatica, anche se la metabolizzazione di questi farmaci è alterata solo in presenza di gravi alterazioni come per es. cirrosi o epatite acuta. Inoltre variazioni giornaliere della funzionalità epatica, tali da determinare alterazioni nella farmacocinetica degli antibiotici, sono rare anche nel paziente critico. I pazienti che hanno subito trapianto di fegato, nelle prime settimane dopo il trapianto, possono ovviamente rappresentare una eccezione a quanto detto fino ad adesso.
Quanto detto fino ad ora ci porta a concludere che gli antibiotici idrofili sono a più alto rischio di variazioni
farmacocinetiche giornaliere; devono quindi essere monitorati e la loro dose deve essere sempre messa in rapporto alle patologie di base, per evitare sotto- o sovra-esposizioni.
Condizioni fisiopatologiche che alterano la
farmacocinetica degli antibiotici nel paziente critico
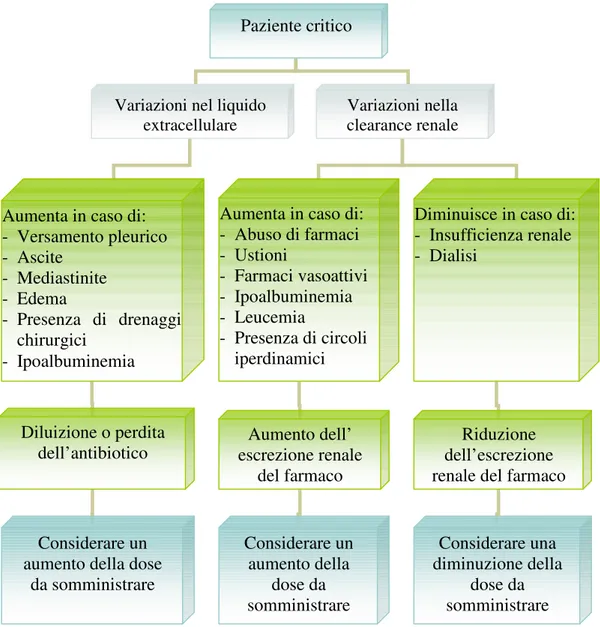
I pazienti critici spesso presentano particolari condizioni fisiopatologiche o iatrogene che possono influenzare la distribuzione e l’eliminazione degli antibiotici; la conoscenza di queste condizioni può essere fondamentale per ottimizzare la terapia in questi pazienti. (Fig. 5).
Fig. 5 Condizioni fisiopatologiche che alterano la farmacocinetica degli antibiotici nel paziente critico
I dati esposti supportano l’ipotesi in merito all’opportunità di adattare la terapia antibiotica in base alle necessità dei pazienti, soprattutto quelli critici, considerando la farmacocinetica di ogni farmaco. L’adattamento della terapia deve essere impostato mediante
Paziente critico
Variazioni nel liquido
extracellulare Variazioni nella clearance renale
Aumenta in caso di: - Versamento pleurico - Ascite - Mediastinite - Edema - Presenza di drenaggi chirurgici - Ipoalbuminemia Diluizione o perdita dell’antibiotico Considerare un aumento della dose
da somministrare
Aumenta in caso di: - Abuso di farmaci - Ustioni - Farmaci vasoattivi - Ipoalbuminemia - Leucemia - Presenza di circoli iperdinamici
Diminuisce in caso di: - Insufficienza renale - Dialisi Aumento dell’ escrezione renale del farmaco Considerare un aumento della dose da somministrare Riduzione dell’escrezione renale del farmaco
Considerare una diminuzione della
dose da somministrare
l’impiego di diverse figure specialistiche, compresi il microbiologo, l’infettivologo e il farmacologo clinico, a supporto dell’intensivista e di altri specialisti per impostare il miglior management possibile della terapia antibiotica nell’intero ospedale e diminuire così l’insorgenza di resistenze e i costi per l’antibioticoterapia.
PARTE III
STUDIO CLINICO
Razionale dello studio
In considerazione dei risultati degli studi riportati nei precedenti capitoli, è evidente che l’efficacia del trattamento con teicoplanina dipende da alcuni importanti fattori, come le caratteristiche del paziente, che possono influire sulla cinetica del farmaco (per esempio: edemi periferici, insufficienze d’organo, stati settici, etc) e i valori di MIC90 per teicoplanina del microrganismo responsabile dell’infezione. Al fine di ottimizzare il trattamento, è necessario considerare la possibilità di modificare il dosaggio in base a tali variabili, avvalendosi di due strumenti principali: un protocollo di monitoraggio terapeutico del farmaco (TDM) ed una strategia adattativa o bayesiana del dosaggio.
Il protocollo TDM è teso alla valutazione delle concentrazioni sieriche o plasmatiche minime di teicoplanina immediatamente prima della successiva somministrazione al fine di stabilire se la dose precedentemente somministrata è sufficiente a garantire valori di t>MIC adeguati ed efficaci. Nel caso in cui sia necessario un adeguamento del dosaggio, l’impiego di una strategia bayesiana assicura con notevole precisione il dosaggio da somministrare al paziente. Tale strategia si fonda sull’impiego di modelli farmacocinetici adattativi o bayesiani, ovvero di algoritmi che sulla base di alcuni parametri di input sono in grado di adattare le conoscenze farmacocinetiche di popolazione su teicoplanina al singolo paziente. In particolare, i dati iniziali sono rappresentati dalle caratteristiche farmacocinetiche di popolazione, dai dati del paziente (età, sesso, peso, altezza, clearance della creatinina) e dallo schema posologico di teicoplanina. Il modello, tramite l’ausilio di un software dedicato, disegna l’andamento previsto delle concentrazioni plasmatiche nel paziente. La successiva determinazione delle concentrazioni plasmatiche di teicoplanina e l’inserimento di questi risultati nel modello permette di “adattare” il modello stesso con i parametri farmacocinetici del paziente (Fig. 6).
Misurazione delle concentrazioni plasmatiche Dati del paziente Parametri farmacocinetici di popolazione Calcolo predittivo delle dosi successive Somministrazione della dose BAYES Concentrazioni plasmatiche desiderate Nuovi parametri farmacocinetici del paziente
Modelli adattativi o Bayesiani
La personalizzazione della terapia:
l’ottimizzazione del dosaggio
Fig.6 Ottimizzazione del dosaggio mediante modelli adattativi o bayesiani
Il processo di ottimizzazione delle dosi di farmaco può essere esteso sino alla fine del trattamento, includendo di volta in volta tutte le alterazioni dei parametri iniziali del modello stesso (es. variazioni della creatininemia).
Un aspetto importante di tale strategia è rappresentato dal fatto che per giudicare l’efficacia di un dosaggio di teicoplanina sulla base di una concentrazione minima plasmatica non è necessario eseguire il prelievo di sangue immediatamente prima della somministrazione. Così facendo, infatti non sarebbe materialmente possibile eseguire in tempi relativamente brevi la determinazione della concentrazione
plasmatica del farmaco per poter modificare la dose successiva. Al contrario, tali modelli bayesiani sono in grado di adattare i parametri farmacocinetici del paziente sulla base delle concentrazioni del farmaco di prelievi effettuati in qualsiasi momento dopo la somministrazione di teicoplanina. In tal modo, tra il prelievo e la successiva somministrazione intercorre un tempo sufficientemente lungo per poter eseguire le analisi di laboratorio, predire i valori di Cmin mediante l’algoritmo ed il software dedicato ed eventualmente stabilire la modificazione del dosaggio.
Obiettivo dello studio
Lo scopo del presente studio è stato quello di stabilire l’utilità di strategie di ottimizzazione del dosaggio di teicoplanina in pazienti affetti da gravi infezioni da batteri Gram-positivi in un reparto di rianimazione.
Materiali e Metodi
Tutti i pazienti ricoverati presso l’Unità di terapia Intensiva con infezione sospetta o documentata da batteri Gram positivi sottoposti a somministrazione endovenosa di teicoplanina 10mg/kg (peso ideale).
Criteri di esclusione: insufficienza renale acuta; ipersensibilità agli antibiotici glicopeptidici; gravidanza; età < 18 anni; ogni altra condizione che, a discrezione del medico, controindicava la somministrazione del farmaco.
Dosaggio delle concentrazioni sieriche di teicoplanina: il dosaggio della teicoplanina totale su siero è stato effettuato mediante immunodosaggio a fluorescenza polarizzata (FPIA), impiegando il sistema di test INNOFLUOR® TEICOPLANIN (Seradyn, Indianapolis, IN) su analizzatore TDxFLx® Abbott (Abbott, Abbott Park, IL).
Timing delle rilevazioni: al termine della terza somministrazione (dose carico) e prima della quarta somministrazione.
Trattamento
Lo schema terapeutico standard consisteva in 3 dosi di carico di 690 mg +/-144 somministrate in bolo endovenoso a distanza di 12 ore l’una dall’altra, seguite dopo 24 ore da dosi di mantenimento di uguale entità in bolo endovenoso. Le dosi successive erano somministrate ogni 24 ore. Affinché il trattamento fosse considerato efficace è stato ritenuto necessario che le concentrazioni plasmatiche minime di teicoplanina fossero uguali o superiori a 10 mg/L, o superiori a 20 mg/L in caso di infezioni gravi.
Strategie di ottimizzazione del dosaggio
A seguito della determinazione della concentrazione sierica di teicoplanina dopo le tre dosi di carico, le caratteristiche del paziente (età, sesso, peso, altezza, creatininemia) sono state analizzate dal programma MWPharm vers. 3.60 (Medi\Ware, Groeningen, Olanda) ed è stata prevista la concentrazione minima di teicoplanina nel siero di ciascun paziente. Successivamente, inserendo nel programma la
dose di mantenimento prestabilita di 10mg/kg è stata valutata nuovamente la Cmin. Nel caso in cui tale valore di concentrazione fosse risultato inferiore ai limiti stabiliti (10 mg/L o 20 mg/L) la dose è stata modificata sino a che il modello bayes non ha predetto concentrazioni di valle nel range di riferimento.
Il dosaggio della teicoplanina sierica era ripetuto nei giorni successivi, generalmente dopo la prima dose di mantenimento per confermare la previsione effettuata. Qualsiasi variazione dello stato di salute del paziente (principalmente di peso e di funzionalità renale) rendevano necessaria l’esecuzione di un ulteriore prelievo e valutazione delle concentrazioni sieriche di teicoplanina, con aggiornamento del modello farmacocinetico del farmaco del singolo paziente.
Analisi statistica
I risultati del presente studio sono riportati come valori medi, deviazione standard e valore mediano (Tabella 1).
Variabile N Media Deviazione standard Somma Valore minimo Valore massimo Peso 20 74,3 18,02659 1486 40,0 110,0 Dose 20 690 144,73206 1380014 400 1000 Creatininemia 20 1,4375 1,16251 28,75 0,47 4,79 Urea 20 65,85 47,34117 1317 13,0 173 Proteine plasmatiche 20 5,375 0,84969 107,5 3,60 7,0 Concentrazione sierica di teicopalnina 20 32.915 28,40764 658,30 8,70 117,90 Tabella 1
I valori ottenuti sono stati correlati tramite test di regressione lineare e verificati tramite test T di Student.
Risultati
In questo studio sono stati presi in considerazione i dati clinici e di laboratorio di 20 pazienti afferiti alla U.O. IV Anestesia e Rianimazione dal Novembre 2005 all’Ottobre 2006.
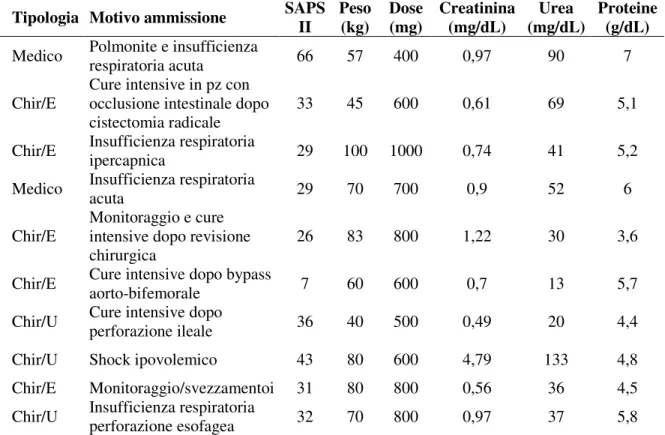
Nella tabella che segue sono riportate le caratteristiche principali dei pazienti, comprendenti la tipologia del paziente (chirurgico, medico o politrauma) ed il motivo dell’ammissione.
Inoltre, sono riportati alcuni dati necessari per stabilire il dosaggio di teicoplanina delle dosi di carico, ovvero la funzionalità renale, (creatinina, urea e clearance della teicoplanina), quella epatica (nel caso specifico, la concentrazione plasmatica delle proteine) ed il peso del paziente. Dalla lettura della tabella è possibile notare come l’età dei pazienti fosse avanzata, calcolando valori di età media e mediana pari a 66,1 e 70 anni rispettivamente.
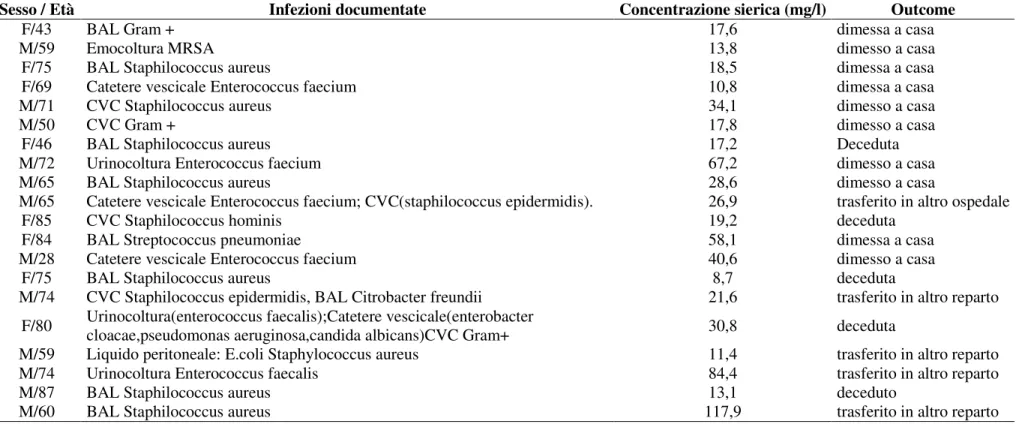
I 20 pazienti, sono stati trattati con dosi carico 10 mg/kg. Ai fini della determinazione della dose di carico di teicoplanina è possibile osservare come 6 pazienti mostrassero al momento del ricovero valori di cretininemia superiori a 1,4 g/dL. In tali soggetti, la dose di carico di teicoplanina è stata ridotta a 600 mg, ad eccezione di due pazienti che avevano un peso corporeo di 90 e 110 kg, nei quali non è stato effettuato alcun aggiustamento. Sono inoltre riportate le infezioni documentate in tutti i pazienti, il SAPS II e l’outcome ospedaliero.
Tabella 2: Caratteristiche dei pazienti esaminati nel presente studio
Sesso / Età Anamnesi Tipologia Motivo ammissione SAPS
II Peso (kg) Dose (mg) Creatinina (mg/dL) Urea (mg/dL) Proteine (g/dL)
F/43 LES con glomerulonefrite, Polimiosite Medico Polmonite e insufficienza respiratoria acuta 66 57 400 0,97 90 7 M/59 ETP vescica, BPCO, Vasculopatia periferica
e bypass aorto-bifemorale. Chir/E
Cure intensive in pz con occlusione intestinale dopo cistectomia radicale
33 45 600 0,61 69 5,1 F/75 BPCO, Ipertensione, Obesità, Miocardioangiosclerosi, DM tipo II, Gastrite. Chir/E Insufficienza respiratoria ipercapnica 29 100 1000 0,74 41 5,2 F/69 Asma, FA cronica Medico Insufficienza respiratoria acuta 29 70 700 0,9 52 6
M/71 Ndn Chir/E
Monitoraggio e cure intensive dopo revisione chirurgica
26 83 800 1,22 30 3,6 M/50 BPCO Chir/E Cure intensive dopo bypass aorto-bifemorale 7 60 600 0,7 13 5,7 F/46 Paraplegia, oligofrenia Chir/U Cure intensive dopo perforazione ileale 36 40 500 0,49 20 4,4 M/72 Vasculopatia cerebrale, Insuff. Renale Cronica moderata, TURP Chir/U Shock ipovolemico 43 80 600 4,79 133 4,8 M/65 Ictus, Vasculopatia periferica Chir/E Monitoraggio/svezzamentoi 31 80 800 0,56 36 4,5 M/65 HCV+, Etilismo cronico con epatomegalia, splenectomizzato Chir/U Insufficienza respiratoria perforazione esofagea 32 70 800 0,97 37 5,8
Nota: LES, lupus eritematoso sistemico; ETP, eteroplasia; BPCO, broncopneumopatia cronica ostruttiva; DM, diabete mellito; FA, fibrillazione striale; TURP, ; IRC, ; GMN, ; MRGE, ; SCC, scompenso cardiaco congestizio
Tabella2 : Caratteristiche dei pazienti esaminati nel presente studio (continua)
Sesso / Età Anamnesi Tipologia Motivo ammissione SAPS
II Peso (kg) Dose (mg) Creatinina (mg/dL) Urea (mg/dL) Proteine (g/dL) F/85
FA cronica, BPCO, Ipertensione, Obesità, SCC, IRC, Anemia, GMN con ipotiroidismo, Iperomocisteinemia, Poliartrosi, Erisipela, HCV +.
Medico Insufficienza respiratoria acuta ipercapnica 41 110 800 2,15 154 6,9 F/84 Ipertensione,BPCO, MRGE Chir/E Insufficienza respiratoria acuta 29 75 800 0,87 26 5,7
M/28 Negativa Politr Cure intensive 21 90 900 0,98 23 5,3
F/75 BPCO, Enfisema, FA cronica, Ipertensione, Demenza senile,Cardiopatia ischemica Medico Insufficienza respiratoria acuta 40 60 600 0,47 21 6 M/74 Rene sx funzionalmente escluso Chir/U Shock settico 34 74 600 1,64 82 4,3
F/80 Ipertensione, monorene chirurgico, DM
tipoII, Pancreatite litiasica recidivante. Chir/U
Acidosi metabolica per pancreatite e insufficienza respiratoria
42 68 600 2,19 99 5,6 M/59 Vasculopatia cerebrale, Obesità, DM tipo II, Ipertensione arteriosa Chir/U Monitoraggio/svezzamento 17 100 600 1,23 49 4,7 M/74
Cardiopatia ischemica, portatore di pace-maker per malattia aritmica dell' atrio, vasculopatia cerebrale, alterazione carotidea.
Chir/E Edema polmonare acuto 36 90 800 2,56 114 6,1 M/87 Rettocolite ulcerosa, Artrosi, Orticaria autoimmune, Dispnea, ETP gastrica Chir/E Insufficienza respiratoria 18 70 700 0,82 55 5,6 M/60 Vasculopatia periferica, BPCO, tabagismo. Chir/E Monitoraggio/svezzamento 21 64 600 3,89 173 5,2
Nota: LES, lupus eritematoso sistemico; ETP, eteroplasia; BPCO, broncopneumopatia cronica ostruttiva; DM, diabete mellito; FA, fibrillazione striale; TURP, ; IRC, ; GMN, ; MRGE, ; SCC, scompenso cardiaco congestizio