1
Indice
Introduzione
………..………2Malnutrizione ospedaliera ed area critica……….………3
La risposta metabolica allo stress
………..………..……….5Supporto nutrizionale
………..……….9Sorveglianza nutrizionale in terapia intensiva
………15Stratificazione del rischio nutrizionale……….15
Il bilancio azotato……….16
Il controllo glicemico………18
Altri indici di sorveglianza………..19
Formule predittive e calorimetria indiretta…………..………20
La nostra esperienza
………...……….……….26Caso clinico n°1……….………….32
Caso Clinico n°2……….35
Conclusioni e Discussione……….……….40
Introduzione
La comprensione che uno stato nutrizionale ottimale si associ ad un ridotto numero di giorni di degenza, minor incidenza di complicanze (con particolare riferimento a quelle di tipo infettivo) ed indici di mortalità più bassi, ha portato alla ricerca di strategie atte a ridurre lo sviluppo della malnutrizione ospedaliera. Una condizione questa di particolare interesse per i pazienti ricoverati in terapia intensiva.
La malnutrizione è una condizione clinica caratterizzata da una perdita di peso non prevista, atrofia muscolare, ridotta capacità di rigenerazione dei tessuti, diminuzione della sintesi proteica, deficit di vitamine ed alterazioni dello stato cognitivo (Soeters, 2008). I test di laboratorio eseguiti di routine supportano tale definizione, ma spesso non la rendono facilmente diagnosticabile.
L’International Consensus Guideline Commitee (ESPEN/A.S.P.E.N.), con lo scopo di definire la malnutrizione ospedaliera, ha introdotto il concetto di
etiology-based malnutrition in cui lo stato nutrizionale interagendo con la condizione
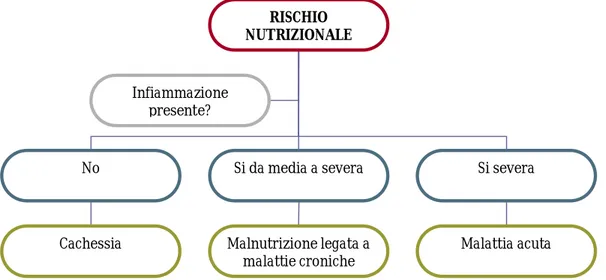
clinica di base ne condiziona l’outcome. La malnutrizione diventa così strettamente legata allo stato infiammatorio. (figura 1)
Figura 1 Adattato da JPEN 2009;33:710
RISCHIO NUTRIZIONALE
No Si da media a severa Si severa
Cachessia Malnutrizione legata a malattie croniche
Malattia acuta Infiammazione
3
Alla luce di questa considerazione, tutti i pazienti ritenuti a rischio nutrizionale dovrebbero essere sottoposti ad uno screening per la ricerca di uno stato infiammatorio di base. L’assenza di quest’ultimo suggerirebbe una condizione di cachessia cronica (come nell’anoressia nervosa), uno stato infiammatorio medio-severo si assocerebbe a patologie internistiche ad andamento cronico (come l’artrite reumatoide o le malattie oncologiche), mentre una stato infiammatorio grave sarebbe legato a condizioni ad insorgenza acuta (ad esempio sepsi, ustioni, traumi compreso il cranico) oppure a riacutizzazioni. Si deduce quindi che la selezione di un intervento nutrizionale dipende largamente dal trattamento della condizione eziologica di base, tenendo presente però che la condotta nutrizionale influenza durata, costi ed efficacia delle terapie.
Malnutrizione ospedaliera ed area critica
Una condizione di malnutrizione è presente all’ammissione in circa il 30% dei pazienti ospedalizzati. Non esistono dati che dimostrino una incidenza più alta nei reparti di area critica, dove però si è certi che risulta molto più alto il livello di “stress metabolico”: definito come una richiesta calorica che supera di circa il 150% i normali fabbisogni energetici.
Il vero marker del rischio nutrizionale è il debito energetico che spesso si viene a verificare già durante la prima settimana di degenza nelle aree critiche. Molti pazienti al momento del ricovero in ICU sono malnutriti e molti altri sono ad elevato rischio di sviluppare una condizione di malnutrizione conseguente all'ipercatabolismo etiology-based. Perciò garantire una nutrizione precoce ai pazienti critici è ritenuta una terapia a tutti gli effetti con lo scopo di ridurre la gravità della malattia e modulare la risposta immunitaria.
La farmaco nutrizione è già considerata da molti autori uno strumento efficace per la possibilità di modulare alcune risposte biologiche, fisiologiche e patologiche attraverso la somministrazione dei principi nutritivi. Questo tipo di intervento medico, oltre a nutrire precocemente il paziente, è rivolto, insieme a tutti gli altri atti terapeutici (sia chirurgici che medici), a correggere le alterazioni metaboliche; così da limitare il catabolismo primum movens delle
complicanze ampliamente descritte in letteratura e allo stesso tempo combattere lo stato infiammatorio.
Va pur detto però che, vista la difficoltà nella comprensione dei molti aspetti di questa tematica, nella definizione della posologia/metodologia di somministrazione e nella scelta delle varie miscele nutrizionali (già presenti in commercio o di prossima generazione), la farmaco nutrizione rappresenta anche una delle sfide future per la medicina di area critica.
5
La risposta metabolica allo stress
La risposta allo stress è un insieme di reazioni a catena che coinvolgono innanzitutto il sistema nervoso, il sistema endocrino e il sistema immunitario agendo di conseguenza su tutto l’organismo. Si tratta di sistemi che operano in stretta interdipendenza, come la neuroendocrinoimmunologia ha dimostrato, sotto il controllo del sistema nervoso centrale.
Determinante è l’asse ipotalamo-ipofisi-surrene (HPA): mentre in condizioni di non stress l’attività dell’asse HPA è organizzata in oscillazioni periodiche regolari, in condizioni di stress si verifica un’attivazione costante del sistema che continua con il perdurare dell’evento stressogeno. Lo scopo di tutti questi cambiamenti è uno solo: mettere l’individuo nella migliore "condizione di combattimento o fuga". L’evento fondamentale è la sovrapproduzione di cortisolo i cui livelli ematici possono salire fino a dieci volte i valori normali. Per condizione di stress, tipicamente presente nelle unità di terapia intensiva, è da intendere tutto quello che comporta una risposta infiammatoria: intervento chirurgico, ustioni, politrauma, patologie infettive od oncologiche. Questa alterazione funzionale, metabolica e strutturale è conseguente, come detto, alla modificazione dell’assetto ormonale (aumento dei livelli di cortisolo, glucagone e catecolamine) ma anche all'aumento della produzione e liberazione di citochine (fattore di necrosi tumorale, interleuchina-1, interleuchina-6) presenti nello stato infiammatorio. Da non sottovalutare poi che le conseguenze di questa cascata biochimica si sviluppano più rapidamente nel paziente critico. Nella fase acuta della malattia l’attivazione delle citochine pro infiammatorie (TNF, IL-1, IL-6) genera una iponutrizione spontanea nota come “anoressia da citochine”. L’adattamento metabolico alla nutrizione è dipendente dall’entità e dalla durata dello stimolo citochinico. Persistono quindi, fino alla risoluzione della noxa patogena, il catabolismo della massa proteica, la gluconeogenesi accentuata, l’aumento della richiesta energetica e la resistenza all’azione dell’insulina. La risposta biochimica al digiuno subisce poi alcuni cambiamenti con il perdurare dello stesso, sia in merito ai mediatori coinvolti, che alle
risposte a loro conseguenti (vedi tabella 1): questo rende necessario un supporto nutrizionale mirato ed attento a substrati calorici specifici superate le prime 24h.
DURATA ORMONI RISPOSTA
< 24h CATECOLAMINE CORTISOLO ALDOSTERONE
- Basal Metabolic Rate, Temperatura, VO2 - Output cardiaco, frequenza cardiaca, proteine fase acuta
- vasocostrizione 3-10 gg CATECOLAMINE
CORTISOLO GLUCAGONE INSULINA
- Basal Metabolic Rate. Temperatura, VO2 - bilancio azotato negativo
Tabella 1
Il metabolismo differisce molto nella condizione di digiuno/denutrizione lieve rispetto ad una condizione di stress prolungato. (tabella 2) Nel primo caso la richiesta energetica è relativamente modesta (1500 Kcal/die, uomo/donna normopeso) ed il quantitativo di degradazione di massa magra è piuttosto piccolo. La domanda di glucosio pari a circa 180 mg/die è soddisfatta principalmente dalla degradazione muscolare ed utilizzata dal sistema nervoso centrale e dal sistema ematopoietico. Gli acidi grassi per un quantitativo di circa 120 g/die sono a disposizione per tutto il resto.
DENUTRIZIONE SEMPLICE : Adattamento metabolico alla riduzione calorica - adattamento del cervello all’utilizzazione energetica dei lipidi
- riduzione ossidazione del glucosio - riduzione gluconeogenesi
- aumento chetogenesi del fegato - aumento lipolisi
- riduzione catabolismo delle proteine - RIDUZIONE SPESA ENERGETICA Tabella 2
Quando è presente uno stress prolungato nel tempo la richiesta metabolica sale enormemente. La spesa energetica può raddoppiare (3000 kcal/die), la richiesta di glucosio triplicare (fino a 450 g/die) per alimentare il sistema immunitario, rigenerare i tessuti e nutrire il sistema nervoso centrale. Incrementa anche la componente lipidica liberata (fino a 200 g/die) ma ad un livello minore rispetto
7
proteolisi muscolare (che può anche quadruplicare ed arrivare fino a 200 g/die) per ottenere i substrati per la gluconeogenesi.
Il cambiamento nella risposta metabolica ha l’unico obiettivo di rendere momentaneamente disponibili i substrati per le attività essenziali alla sopravvivenza. (vedi tabella 3)
EFFETTI DELLA RISPOSTA NEUROENDOCRINA ALLO STRESS (> 48h) - GLUCONEOGENESI
- PROTEOLISI nei tessuti periferici
- BILANCIO AZOTATO NEGATIVO: perdita amminoacidi essenziali (sintesi proteine di fase acuta nel fegato)
- RITENZIONE IDRICA
- MOBILIZZAZIONE DEI SUBSTRATI: glutamina, acidi grassi
- RESISTENZA INSULINICA ed ormone della crescita per assicurare una produzione continua di glucosio per endotelio, reni, cell immunitarie e SNC.
- INCREMENTO REE (spesa energetica a riposo) Tabella 3
In merito alla risposta metabolica parafisiologica allo stress, si deve distinguere tra i pazienti anamnesticamente sani rispetto a quelli affetti da una “riacutizzazione” (stato infiammatorio cronico complicato da un evento acuto), come descritto nel concetto di etiology based malnutrition.
Nelle malattie croniche, infatti, si ha una riduzione delle riserve funzionali anche in merito alla questione metabolica. L’attivazione infiammatoria cronicamente presente e correlata con l’attività della malattia, produce già in condizione basali anoressia e malnutrizione spontanea, resistenza all’azione insulinica, anemia, stato catabolico cronico con deplezione considerevole di massa proteica e lipidica. Si registra inoltre una riposta anabolizzante ridotta al supporto nutrizionale dovuta allo scarso livello ematico di ormoni anabolizzanti, per cui l’ipercatabolismo espone questi pazienti ad un elevatissimo rischio di
underfeeding ed alle sue conseguenze. Ciò è da tener ben presente nella
popolazione dei malati critici dove questo tipo di patologie sono cofattori o concause del ricovero in terapia intensiva. (nella tabella 4 ne sono elencati alcuni esempi)
MALATTIE CRONICHE: infiammazione ed implicazioni nutrizionali.
I Pazienti con patologia cronicaall’ingresso in Ospedale hanno(1): 1. minore massa magra (FFM) rispetto agli acuti
2. ridotta FFM (< 10° percentile nel 54%) anche in presenza di BMI normale
- Malattie infiammatorie intestinali (morbo di Chron (2)):
1. 29% ha valore ridotto di MAMC (arm muscle circumference) 2. 73,3% ha valore ridotto di HGS (hand grip strenght), indice
attendibile della funzione muscolare
- Artrite reumatoide e patologie articolari degenerative: ridotta FFM nel 26% (F) e 21% (M) dei pazienti (6) non correlata con il BMI - Insufficienza d’organo: cuore, polmone, fegato, reni :
1. Insufficienza renale cronica (dialisi) (3): 20-36% ha alterazione dei markers proteici correlati con aumento del rischio di mortalità.
2. Pazienti BPCO: ridotta FFM nel 41% delle donne e nel 44% degli uomini(4),presente anche nel 26% dei soggetti con BMI normale. la riduzione della FFM correla con la gravità della malattia e con la sopravvivenza (4,5)
- HIV/AIDS - Cancro
- Obesità e sindrome metabolica - Diabete
- Eta avanzata
1. Kyle UG, 2002; 2. Bin CM, 2009; 3. Aparicio M, 1994; 4.Vestbo J, 2006 ; 5.Elkan AC, 2009; 6. Schols AMWJ, 2005 Tabella 4
9
Supporto nutrizionale
L’obiettivo primario del supporto nutrizionale è quello di fornire una terapia aggiuntiva per ottimizzare la risposta allo stress, garantire nutrienti esogeni per ridurre le perdite dei depositi endogeni e la riduzione della massa magra, cercando di prevenire le conseguenze della PCM protein-calorie malnutrition: perdita di peso >10-15%, basso indice di massa corporea, intolleranza persistente alla nutrizione enterale.
Sebbene la nutrizione enterale (NE) e la nutrizione parenterale totale (NPT) siano comunemente utilizzate nelle unità di terapia intensiva, considerando le attuali evidenze cliniche a favore della NE ed i vantaggi ormai consolidati relativi a questa pratica, la scelta deve privilegiare quest'ultima, quando ne esistano le condizioni di fattibilità.
L'alimentazione enterale esercita un effetto trofico sulla mucosa intestinale che aiuta a mantenere l'integrità strutturale e funzionale, riducendo così l'incidenza di traslocazioni batteriche e di sepsi di origine intestinale. Una delle caratteristiche più importanti del tratto gastroenterico infatti è il ruolo dell'epitelio intestinale come barriera all'invasione di microorganismi patogeni. Tale funzione è mantenuta attraverso l'assunzione e l'elaborazione dei nutrienti lungo il tratto digerente. Una completa immobilità intestinale si accompagna ad una progressiva atrofia e rottura della mucosa, con accorciamento dei microvilli e danno dell'architettura di superficie. In assenza di controindicazioni quindi, la nutrizione enterale è indicata quando l'apporto di nutrienti per via orale è inadeguato da almeno 1/3 giorni e nei pazienti a rischio di traslocazione batterica. Ciononostante la NE non è sempre disponibile, realizzabile e sicura. Le controindicazioni all'impiego della nutrizione enterale e quindi le indicazioni assolute alla Nutrizione Parenterale Totale sono indicate nella tabella 5
CONTROINDICAZIONI ASSOLUTE NE/ INDICAZIONI NPT
- occlusione/subocclusione cronica intestinale di origine meccanica - ischemia intestinale
- fistole digiunali o ileali ad alta portata (output > 400 ml/die) - grave alterazione funzionale
Tabella 5
Recentemente è emersa l'importanza di un apporto calorico anche minimo per via enterale non a scopo nutrizionale ma trofico per l'enterocita (minimal
enteral feeding) utile ad esempio nelle seguenti condizioni:
- gastroparesi: è possibile l'infusione sottopilorica se non coesiste ostacolo più distale al transito
- ileo paralitico: l'infusione di nutrienti per via enterale a bassa velocità stimola la ripresa della peristalsi
- fistole enteriche a bassa portata (escluse quelle insorte su tessuto neoplastico o precedentemente irradiato): è documentato l'effetto positivo sulla loro chiusura da parte della NE
- fistole digestive alte (esofago, stomaco e pancreas): è possibile l'infusione in sede digiunale con riduzione dei tempi di chiusura della fistola
- resezioni intestinali massive: è molto difficile stabilire a priori la soglia della lunghezza dell'intestino residuo che consenta la NE, in quanto l'adattamento è altamente individuale. In questi casi è raccomandabile valutare empiricamente la tollerabilità alla NE; qualora ripetuti tentativi (anche con diete oligomeriche) non fossero fruttuosi, si deve porre l'indicazione alla nutrizione parenterale totale (NPT)
- anoressia con intestino funzionante (per insufficienza d'organo, irradiazione sovradiaframmatica)
- morbo di Crohn non responsivo alla terapia medica convenzionale e complicata dalla presenza di malnutrizione oppure condizionante un ritardo di crescita
L'accesso per la nutrizione enterale deve essere scelto considerando lo stato clinico del paziente, l'accessibilità, le capacità di assorbimento del suo apparato digerente ed infine la durata prevista del trattamento. Qualora la durata della nutrizione artificiale sia prevedibilmente breve (inferiore a 30 giorni), non vi sia rischio di aspirazione della miscela nelle vie aeree e non vi siano stenosi
11
Digiunale, Duodenale) può essere preferita ad una stomia. E' invece necessario procedere a confezionare una stomia (PEG, Digiunostomia) quando si preveda una lunga durata del trattamento (in genere superiore a quattro settimane), ed è obbligatorio quando si presuma che il paziente non possa più riprendere l'alimentazione orale.
Attualmente esistono in commercio formulazioni artificiali standard e specifiche con caratteristiche molto diverse, utili per le diverse condizioni cliniche. Nella tabella 6 ne sono riassunte le caratteristiche principali.
La nutrizione parenterale va riservata a quei pazienti in cui la via enterale è impraticabile o non consente la completa copertura dei fabbisogni giornalieri.
CLASSIFICAZIONE MISCELE NUTRIZIONALI PER NUTRIZIONE ENTERALE
In base al tipo di preparazione:
artigianali frullati o miscele preparati estemporaneamente con alimenti naturali freschi o preparati industrialmente (omogeneizzati o liofilizzati) SCONSIGLIATI PER LA MAGGIORE INCIDENZA DI COMPLICANZE
artificiali ottenute con l’impiego di prodotti industriali chimicamente definiti e specificatamente indicati, le componenti sono trattate secondo le pratiche industriali per alimenti destinati ad una lunga conservazione (pastorizzazione, trattamento UHT, liofilizzazioni); il loro impiego è obbligatorio con accesso duodenale o digiunale, garantiscono un apporto completo di micronutrienti e sono quilibrate dal punto di vista calorico/proteico;si presentano in forma liquida o in polvere, sono sterili fino al momento della somministrazione
In base al contenuto calorico:
Normocaloriche 1 Kcal/ml
Ipocaloriche 0,5-0,7 Kcal/ml
Ipercaloriche 1,5-2 Kcal/ml In base al grado di idrolisi dei nutrienti:
Polimeriche: sono somministrabili sia per sonda che per via orale, richiedono una capacità digestiva integra perché sono costituite da nutrienti intatti.
o componente proteica è costituita da polipeptidi o proteine complesse, o componente glucidica rappresentata da polisaccaridi, oligosaccaridi e
maltodestrine
o componente lipidica derivante da oli vegetali ricchi in acidi grassi essenziali quali il linoleico e il trilinoleico
Hanno osmolarità tra i 250-300 mOsm/l e contenuto calorico compreso tra 1-1,5 kCal /ml. Contengono micronutrienti in grado di coprire l’intero fabbisogno giornaliero, sono prive di lattosio e glutine, possono contenere fibre solubili ed insolubili. I principali prodotti presenti sul mercato sono distinti in
1. normocalorici/normoproteici (standard) 2. ipercalorici
3. iperproteci
Oligomeriche o Semielementari: contengono nutrienti in forma direttamente o facilmente utilizzabile, somministrabili solo per sonda. o la quota proteica deriva solitamente da idrolisati di proteine 12-30%
o carboidrati (soprattutto maltodestrine) e disaccaridi per il 48-55% o lipidi: oli vegetali LCT e MCT per il 25-40%
Sono normocaloriche, hanno osmolarità piuttosto elevata (300-500mOsm/l), è consigliabile introdurle gradualmente o a velocità ridotta o diluirle, sono a basso residuo di fibre o totalmente prive. Hanno micronutrienti in quantità tale da soddisfare il fabbisogno giornaliero, sono prive di lattosio e glutine.
INDICAZIONI CLINICHE: malassorbimento, intestino corto, malattie infiammatorie intestinali croniche, enteropatia da raggi)
Monomeriche o elementari: sono indicate in caso di capacità digestive o assorbitive molto ridotte.
o le proteine sono presenti in forma di aminoacidi singoli e piccoli peptidi o la quota glucidica è rappresentata da monosaccaridi e disaccaridi
o una quota variabile di lipidi sottoforma di trigliceridi a catena media-corta e/o acidi grassi essenziali
Hanno osmolarità molto alta (500-900 mOsm/l), sono scarsamente palatabili. Possiedono micronutrienti in quantità tale da soddisfare il fabbisogno giornaliero, sono prive di lattosio e glutine
Miscele enterali specifiche: formulazioni con aggiunta di particolari nutrienti e/o variazione nella composizione dei macronutrienti (iperproteiche, iperlipidiche,
ipoproteiche), sono più costose e meno maneggevoli, l’utilizzo va concordato fra medico specialista e TEAM NUTRIZIONALE. Sono somministrabili in caso di patologie particolari, con formulazioni enterali per:
o patologia epatica
o patologia renale cronica:
1. Il supporto nutrizionale nel pz con insufficienza renale ha lo scopo di modulare l’apporto proteico garantendo un adeguato apporto di proteine ad alto valore biologico
2. Esistono formulazioni per pz in fase pre-dialitica che contengono ridotte quantità proteiche con elevate quantità di aa essenziali mentre quelle per pazienti già in dialisi hanno un normale apporto proteico.
3. Entrambe sono ipercaloriche e con contenuto in elettroliti (P e K) compatibili con il trattamento conservativo o sostitutivo
o scompenso cardio-circolatorio
o insufficienza respiratoria : miscele ipoglucidiche e iperlipidiche in modo di ridurre la produzione di CO2
o patologie neoplastiche o immunomodulanti o pazienti diabetici: 1. Ipoglucidiche (31-51%) 2. Normo/iperproteiche (15-20%) 3. Normo/iperlipidiche (31-50%)
4. Apporto calorico variabile (0,75-1,2 Kcal/ml) 5. Presenza di fibre insolubili e solubili
6. Iso-osmolari o patologia gastrointestinale
o pazienti disfagici
Prodotti modulari: I prodotti modulari sono costituiti da singoli nutrienti vengono utilizzati per preparare miscele specifiche contengono in genere un solo nutriente e non sono quindi nutrizionalmente completi non è consigliabile aggiungere i nutrienti modulari alle miscele precostituite possono invece essere aggiunti a diete per os
Tabella 6
Benché la NP possa essere somministrata anche attraverso accessi venosi periferici, la somministrazione più efficace e più sicura richiede il
13
posizionamento di un accesso venoso centrale (CVC o PICC). Ciò permette di somministrare nutrienti ad alta osmolarità in volumi di liquidi inferiori.
Purtroppo l'inserzione di nessun catetere venoso centrale non è priva di rischi e non esiste nessun presidio ideale che sia provatamente associato ad un basso rischio di complicanze ed un massimo beneficio per tutte le categorie di pazienti. (vedi anche tabella 7)
Nutrizione parenterale: prodotti commerciali
- Soluzioni parenterali pronte all' uso in sacca a doppio e triplo comparto
- Emulsioni lipidiche a base di olio di soia ed olio di olia-Vitamine e oligoelementi - Soluzioni di aminoacidi
- Sacche vuote in EVA
La gamma delle soluzioni offerte in commercio è molto ampia e comprende soluzioni nutrizionali standard, come le soluzioni di aminoacidi e le emulsioni di lipidi a base di olio di soia, prodotti ad uso più specifico come le soluzioni di aminoacidi per pediatria, fino ad arrivare a soluzioni innovative come i preparati polivitaminici, le soluzioni di oligoelementi multipli e le emulsioni di lipidi a base di olio di oliva .Non ultima, la gamma delle soluzioni pronte all'uso, personalizzate e prodotte su prescrizione del medico, oppure standard in sacca a doppio comparto per l'apporto di aminoacidi e glucosio e a triplo comparto contenenti anche lipidi
Tabella 7
Oggi molti nuovi substrati sono entrati a far parte del pool dei farmaco nutrienti: gli amminoacidi a catena ramificata, la glutaminai, l'argininaii, i chetoacidi, gli acidi grassi Ω–3, i nucleotidi, i frutto–digosaccaridi (FOS) e le vitamine arricchiscono le preparazioni galeniche a disposizione dei medici nelle varie unita critiche. Ad oggi risulta molto discusso il ruolo dei probiotici.
Come già descritto in precedenza, nella determinazione qualitativa e quantitativa dei fabbisogni nutrizionali si deve tenere conto dello stato nutrizionale e metabolico del paziente, come pure della patologia di base e delle relative terapie. I microelementi, cioè le vitamine e gli oligoelementi, costituiscono un gruppo di nutrienti essenziali, in quanto partecipano a
i La glutamina è il substrato energetico principale per gli enterociti, fornisce energia al tenue cinque volte più del glucosio, previene la traslocazione batterica, riduce il rischio di endotossine mie, previene l’aumento della permeabilità intestinale, svolge un effetto trofico e protettivo sulla mucosa del tratto grastroenterico
ii L’arginina è essenziale per la sintesi di aminoacidi e proteine, stimola gli ormoni anabolizzanti (GH-insulina); è il precursore della sintesi di NO (vasodilatatore della mucosa intestinale, regola la sintesi proteica ed epatica, ha effetti antiinfiammatori, stimola la sintesi del collagene ed aumenta la proliferazione linfocitaria.)
numerosi processi metabolici come enzimi e cofattori, svolgendo un ruolo strutturale nei sistemi subcellulari oltre ad essere componenti del sistema di protezione dai radicali liberi.
In corso di nutrizione enterale i fabbisogni di microelementi corrispondono a quelli di una normale alimentazione e generalmente sono soddisfatti dalle miscele in commercio specifiche per le varie tipologie di paziente critico. Durante la terapia con nutrizione parenterale invece la FDA (Food and Drug
Administration) consiglia un supplemento aggiuntivo alle formulazioni a
disposizione (vedi tabella 8).
FABBISOGNI VITAMINICI GIORNALIERI IN CORSO DI NUTRIZIONE ARTIFICIALE
NE NP Tiamina, Vitamina B1 Riboflavina Niacina Acido Folico Acido pantotenico Vitamina B6 Vitamina B12 Biotina Colina Acido Ascorbico Vitamina A Vitamina D Vitamina E Vitamina K 1,2 mg 1,3 mg 16 mg 400 γ 5 mg 1,7 mg 2,4 γ 30 γ 550 mg 90 γ 900 γ 15 γ 15 mg 120 γ 3 mg 3,6 mg 40 mg 400 γ 15 mg 4 mg 5 γ 60 γ Non definita 100 mg 1000 γ 5 γ 10 mg 1 mg Tabella 8
E' tuttavia necessario ricordare che nei pazienti ipermetabolici il fabbisogno vitaminico quotidiano può essere considerevolmente aumentato rispetto a quello indicato nelle tabelle correttive. Spesso non è possibile valutare eventuali carenze di singoli microelementi sviluppatesi, infatti nei pazienti ospedalizzati sono stati osservati deficit di numerose vitamine, malgrado il reintegro quotidiano previsto nei regimi di supporto nutrizionale.
In ogni situazione clinica quindi la prescrizione di microelementi deve essere personalizzata al fine di evitare gli effetti dannosi sia degli stati carenziali sia dei livelli tossici; si devono inoltre considerare anche le alterazioni nella dinamica di nutrienti essenziali in corso di risposta di fase acuta allo stress.
15
Sorveglianza nutrizionale in terapia intensiva
Stratificazione del rischio nutrizionale: MUST e BMI
Il modello MUST (Malnutrition Universal Screening Tool), proposto dalla BAPEN
(The British Association for Parenteral and Enteral Nutrition) e pubblicato nel
novembre 2003, si prefigge di aiutare i professionisti dell’aria sanitaria (infermieri, medici o altri operatori adeguatamente preparati) ad identificare i soggetti adulti sottonutriti, i soggetti adulti a rischio di malnutrizione e i soggetti obesi. Ne riportiamo di seguito l’algoritmo.
BMI-(Body mass index): peso (kg) /altezza2 (m2): il suo valore normale è compreso tra i 18-25. Si parla di malnutrizione grave se <16, media se 16-17 e lieve se compreso tra 17-18. L’altra faccia della malnutrizione, rappresentata dall’obesità, viene suddivisa relativamente a questo indice in I grado se il valore
è compreso tra 25-29, II grado se 30-40, III grado se >40. Nel paziente con MOF
(Multi Organ Failure) il mantenimento di un certo livello di stato nutrizionale e
cioè BMI>85 percentile è correlato con l’outcome (Galanos, 1997).
Il bilancio azotato
g(N)introdotti/24h-g(N)persi/24h
La perdita giornaliera di azoto può essere classificata secondo la seguente tabella (9)
Perdita azoto G/die GRADO
<5 5 -10 10 -15 >15 Normale Lieve Moderato Grave Tabella 9
Le proteine (potere calorico = 4 kcal/g), composte da sequenze variabili di aminoacidi caratterizzate dalla presenza di azoto nella loro molecola, si adattano alla qualità e quantità di nutrienti disponibili nell'organismo, tramite un costante turnover, processo che consiste in una continua demolizione e sintesi. Durante questa riutilizzazione, che coinvolge una quantità quadrupla delle proteine introdotte, una quota di aminoacidi viene comunque giornalmente persa. Le proteine sono indispensabili per la funzione contrattile dei muscoli, per l’architettura del tessuto connettivo, per il trasporto nel plasma di molte molecole, per la coagulazione, per la formazione di ormoni, enzimi, anticorpi e molto altro. Rappresentano anche un substrato energetico importante (l’ossidazione degli aminoacidi serve al 20% dell’energia necessaria all’organismo), ma la loro funzione principale è quella plastica. Circa la metà delle proteine è presente a livello muscolare, tuttavia il muscolo non ne rappresenta il deposito dato che il catabolismo muscolare si accompagna a perdita di funzione. Ogni giorno vengono rinnovati circa 300 g di proteine;
17
l’apporto medio è di 80 g: la gran parte delle proteine degradate viene riutilizzata per la sintesi; questa quantità è legata all’entità dell’aggressione. La determinazione dell’apporto d’azoto: dipende dalla tolleranza del malato all’apporto proteico e dal valore del bilancio azotato. Nel soggetto denutrito, che deve ricostituire la massa magra e rilanciare la sintesi proteica, l’escrezione urinaria di azoto è bassa ed è possibile rendere il bilancio azotato positivo con apporti limitati. Nel paziente critico (traumatismo grave, sepsi) la perdita di azoto è considerevole; l’obiettivo è di limitare la perdita di massa magra diminuendo la proteolisi.
Nella pratica clinica il consumo di azoto viene ricavato dall’escrezione urinaria di azoto ureico, secondo la formula seguente:
[(UREAur+ ΔBUNpl*)×0,4665 ** ]+3***
*(Ureapl24h-Ureapl1h) ×X
X= 50% peso corporeo nell’uomo, 60% peso corporeo nella donna. L’urea è ubiquitaria e disciolta in grandi quantità di acqua, il quantitativo di quest’ultima differisce nei due sessi. **componente azotata dell’urea
***perdita di azoto per altre vie: diarrea, fistole, perdite cutanee…
Buona pratica clinica è calcolare il bilancio azotato nei pazienti critici almeno una volta alla settimana in modo da identificare uno stato ipercatabolico e correggere così l’apporto proteico (vedi tabella 10).
NORMALE AUMENTATO MOLTO AUMENTATO
AZOTO O,16 0,2-0,3 0,4-0,5
AMINOACIDI 1,2 1,5-2,0 3,0-3,5
PROTEINE 1 1,25-1,87 2,5-3,1
chirurgia media, neoplasie, malattie infiammatorie e malnutrizione sono esempi di fabbisogni aumentati; politrauma, sepsi e ustioni sono esempi di fabbisogni elevati
Tabella 10: esempi di fabbisogno proteico in g/kg/die
L'azoto rappresenta il 16% delle proteine, quindi moltiplicando per il fattore 6,25 la quantità di azoto in grammi contenuta in un prodotto possiamo ottenere la corrispondente quantità di proteine in grammi (viceversa possiamo ottenere la quantità di azoto dividendo la quantità di proteine per 6,25).
Schematizzando, il rapporto calorie non proteiche/g di azoto ottimale è: 180-200 kcal per g di azoto (catabolismo lieve)
120-150 kcal per g di azoto (catabolismo medio) 100-120 kcal per g di azoto (catabolismo elevato)
Controllo glicemico
L’evento acuto medico, chirurgico o traumatico scatena nell’individuo una risposta fisiologica allo stress; per cui si ha un aumento dell’attività del simpatico con inibizione della secrezione insulinica ed aumento della secrezione degli ormoni contro regolatori quali cortisolo e catecolamine.
La riduzione dell’uptake del glucosio da parte delle cellule muscolari, accompagnata ad una diminuzione del metabolismo (ossidativo e non) delle riserve di glucosio, caratterizza lo sviluppo dell’insulino-resistenza che viene considerato un marker dello stress metabolico ma i meccanismi che lo sottendono non sono ancora ben descrittiiii. L’iperglicemia, indipendentemente dalla causa che la provoca, peggiora la prognosi del paziente critico.
Il trattamento insulinico intensivo riduce mortalità e morbilità grazie al suo effetto ipoglicemizzante e ad altri effetti metabolici:
Migliora la dislipidemia Effetti anabolici
Effetti anti-infiammatori
Previene la disfunzione endoteliale e l’ipercoagulabilità Effetti anti-apoptosici
Il controllo della glicemia tramite stick glicemico in corso di nutrizione artificiale è raccomandato ogni 6/8 h od ogni 2/4 h in caso di cambio di terapie o di miscela nutritiva.
Esistono molti schemi di controllo utilizzati in terapia intensiva alcuni sono rappresentati nella tabella 11.
Schema Soluzione Target UI/h
MARKOWITZ (TRENCE) 1UI/ml 80-180 4 schemi
LEUVEN 1U/ml 80-110 1-4
19
YALE 1UI/ml 110-140 0,5-25
PORTLAND O,5UI/ml 100-150 O,5-8
DIGAMI 80UI/500 DW 5% 125-180 0,5->>
VAN DEN BERGHE 1UIml 80-110 2-4
Tabella 11
Altri indici di sorveglianza
Controllo a cadenza settimanale: o elettroliti urinari
o colesterolemia o trigliceridemia
o Prealbuminemia-(mg/gL) <22 malnutrizione lieve, <17 moderata, <10 grave
o transferrinemia-(mg/dL) <200 malnutrizione lieve, <150 moderata, <100 grave
o linfocitemia-(103/μL) <1500 lieve, < 1200 moderato, < grave Controllo a cadenza bisettimanale: elettroliti completi, funzionalità
epatica e renale, quadro proteico completo, esame urine completo
L’albuminemia ha scarso valore come marker nutrizionale perché ha una emivita molto lunga (circa 18g) ed inoltre il suo valore potrebbe risultare falsato da correzione. con miscele artificiali
Formule predittive e calorimetria indiretta
La richiesta energetica nei malati critici varia in funzione del motivo di ammissione in terapia intensiva, della sua gravità, dello stato nutrizionale e delle comorbidità eventualmente presenti (cause intrinseche). A questi si associano altri determinanti della spesa energetica come, ad esempio, la farmacoterapia, la ventilazione meccanica e la nutrizione (cause estrinseche). In caso di patologie severe, la spesa energetica può avere variabilità sia individuale che in funzione di certi parametri ed arrivare fino al 100%.
La febbre, l’agitazione, la tosse sono, fra gli altri, fattori che aumentano la spesa energetica; inoltre alcune situazioni patologiche sono ipermetabolizzanti in maniera evidente, come descritto in seguito:
chirurgia media non complicata: metabolismo basale più 10%
nel traumatizzato cranico la spesa energetica può aumentare del 30% nel politraumatizzato senza lesione cerebrale può variare dal 30 al 50% nei grandi ustionati si arriva fino all’80%
Inoltre numerose procedure terapeutiche possono influenzare (positivamente e negativamente) il dispendio energetico: ad esempio la sedazione profonda riduce il BEE (Basal Energy Expenditure) fino al 25%, mentre la ventilazione meccanica riduce le richieste caloriche del 10%.
Esistono inoltre molte situazioni tipiche di una terapia intensiva che non sono state ancora studiate dal punto di vista del loro impatto metabolico: ad esempio come varia il BEE in rapporto ai diversi protocolli di controllo glicemico, nelle tecniche di emodiafiltrazione e nelle numerose metodiche di ventilazione non invasiva. Oltre a queste considerazioni specifiche, a risultare difficile è la stima teorica del fabbisogno calorico nel singolo paziente critico dove per definizione si combinano molte variabili patologiche e terapeutiche, metabolicamente note e non.
Le raccomandazioni in merito al fabbisogno energetico, pubblicate negli ultimi 15 anni, hanno visto diminuire considerevolmente il quantitativo calorico totale
21
volto all’eliminazione degli effetti secondari dovuti all’ipernutrizione descritta in corso di nutrizione (soprattutto) parenterale di lunga durata.
RACCOMANDAZIONI NAZIONALI ED NTERNAZIONALI RIGUARDANTI L’APPORTO CALORICO IDEALE IN RIANIMAZIONE.
o 2002 SINPE Linee guida SINPE per la Nutrizione Artificiale Ospedaliera:
25-30Kcal/Kg //die
o 2006 ESPEN Linee guida nutrizione enterale - Intensive Care: in fase
acuta 20-25 Kcal/Kg//die, in fase di riabilitazione >35 Kcal/Kg//die. o 2009 ESPEN Linee guida per la nutrizione parenterale - Intensve care: in
fase acuta in assenza di calorimetria indiretta considerare 25 Kcal/Kg//die
o 2009 SCCM-ASPEN Linee guida per la previsione e la gestione della
terapia di supporto nutrizionale nel malato critico adulto – Society of Critical Care Medicine e Society fot Parenteral and Enteral Nutrition: il
fabbisogno calorico deve essere stimato (equazioni predittive) o calcolato (calorimetria ndiretta). Le equazioni predittive devono essere utilizzate con prudenza; in alternativa 25 Kcal/Kg//die.
Tabella 12
In medicina critica, un eccessivo apporto di glucosio esogeno, associato alla resistenza insulinica parafisiologica che si instaura in risposta allo stress, comporta a breve termine una iperglicemia difficile da controllare dalla sola terapia insulinica ed a medio termine una sovraproduzione di CO2 che può aggravare lo scambio gassoso tipicamente già compromesso in questa popolazione di pazienti (con particolare riferimento ai malati affetti da ARDS). Non solo il glucosio però presenta “effetti collaterali”, una infusione troppo rapida ed eccessiva di emulsioni lipidiche (trigliceridi a catena lunga -TCL- in particolare) comporta ipertrigliceridemia ed aumento dello shunt
intrapolmonare con conseguente peggioramento dell’edema alveolo-interstiziale. In più i TCL possono avere effetto immunosoppressore, perturbando il sistema reticolo-endoteliale, con rischio effettivo di aumento delle infezioni nosocomiali.
Anche i regimi di nutrizione ipocalorici hanno possibili effetti negativi in ICU. Esiste molta differenza tra il quantitativo di calorie predetto e quello effettivamente somministrato. Anche nei reparti in cui si esegue una stima delle richieste nutrizionali e lo sforzo terapeutico per correggere la malnutrizione è massimo, esistono comunque moltissime condizioni che portano
all’interruzione della nutrizione artificiale ed in particolare a quella enterale come le complicazioni sull’apparato digerente le procedure diagnostico/terapeutiche e non per ultima la necessità di gestione delle vie aeree. La riduzione importante dell’apporto energetico raccomandato può avere conseguenze gravi per la prognosi di questi pazienti.
Il deficit calorico quotidiano di ciascun malato critico è stato stimato tra le 400 ed 800 Kcal ed esiste inoltre una provata correlazione statistica positiva tra l’incidenza di infezioni nosocomiali e l’entità dell’ammanco calorico, da considerare inoltre che un bilancio energetico negativo si assocerebbe al rischio di insorgenza di nuove insufficienze d’organo in pazienti in cui le funzioni vitali sono, per definizione, già gravemente compromesse.
Risulta molto difficile determinare la richiesta energetica di un malato critico in un determinato momento e moltissime sono state le formule predittive sviluppate negli anni, alcune si basano su dati antropometrici (come quella di Harris-Benedict) o su alcuni specifici come i parametri ventilatori (Ireton-Jones), vedi tabella seguente (13).
FORMULE PREDITTIVE (BEE: basal Energy expenditure) 1919 Harris-Benedict
M: BEE = [66,5 + 13,75 peso(Kg) + 5 altezza(cm)] - 6,78 età(anni) F: BEE = [65,5 + 9,56 peso(Kg)+ 1,85 altezza(cm)] - 4,68età(anni)
1932 Kleiber
M: BEE = 71.2 ×peso (Kg)3/4 × (1 + 0.004 x (30-età(anni)) + 0.010 x (altezza(cm)-43.4)) F: BEE= 65.8×peso (Kg)3/4 × (1 + 0.004 x (30-età(anni)) + 0.010 x (altezza(cm)-43.4))
1984 Harris et Benedict modificato da Roza e Shizgal
M: 13,707 x peso(kg) + 492,3 x altezza(m) - 6,673 x età(anni) + 77, 607 F: 9;740 x peso(kg) + 172,9 x altezza(m) - 4,737 x età(anni) + 667, 051
1996 Black
M: Kcal = [1,083 x peso(kg)0,48 x altezza(m)0,50 x età(anni)-0,13] x (1000/4,1855) F: Kcal = [0,963 x peso(kg)0,48 x altezza(m)0,50 x età(anni)-0,13] x (1000/4,1855)
1990 Mifflin
M: BEE = 10 peso (Kg) + 6,25 altezza(cm) – 5età (anni) +5 F: BEE = 10 peso (Kg) + 6,25 altezza(cm) – 5età (anni) - 161
1995 Liu
BEE = 13,88 x peso(kg)0,48 +4,16 altezza(cm)-3,43 età(anni) -112 x(M:0;F:1) + 54,34
1995 Fusco
BEE =[ 11 peso(kg)0,48 +32 altezza(cm)-4 età(anni)]-983
1992 Ireton-Jones
Ventilazione meccanica: REE = 1925 – 10età(anni) + 5peso(Kg) + 281S(M:1;F:0) + 292 trauma (presente:1; assente:0) + 851 ustione (presente:1; assente:0)
1994 Psu
REE = 0,85 beehb* + 175temperatura(°C) + 33 volume-minuto(l) - 702 *reehb= basale calcolato con formula Harris-Benedict
23
In molti studi presenti in letteratura è stato dimostrato il livello di inaccuratezza delle formule predittive usate routinariamente in rianimazione per dedurre il fabbisogno energetico dei malati critici. Prendendo come target l’80-110% del valore ottenuto con la calorimetria indiretta in circa il 35% dei malati si registra una profonda discrepanza da questi limiti. Questo significa che più di un terzo dei malati ricoverati in terapia intensiva è in una condizione di malnutrizione (underfeeding) o di ipernutrizione (overfeeding).
L’unica strategia universalmente conosciuta come gold-standard per il calcolo del fabbisogno energetico è la calorimetria il cui valore può essere ottenuto con metodica diretta ed indiretta.
Buona parte dell’energia ricavata dall’ossidazione dei diversi substrati introdotti con la nutrizione lascia il corpo sotto forma di calore, con la calorimetria diretta (CD) è possibile misurare tale perdita di calore ed estrapolare quindi la richiesta di energia. Questa metodica prevede che il soggetto sia posto in una camera isolata con circolazione d’acqua attraverso le pareti. La perdita di calore è calcolata in base ai cambiamenti di temperatura dell’aria e dell’acqua in circolo: per la legge di conservazione dell’energia il cambiamento di temperatura sarà uguale alla quantità di energia aggiunta al sistema. Lo strumento è molto costoso ed ha delle limitazioni per l’utilizzo clinico di routine, inconvenienti che ne rendono praticamente impossibile l’utilizzo nelle aree critiche.
La calorimetria indiretta (CI), che fornisce valori molto vicini a quelli ottenuti con la CD, è molto più pratica e costituisce il metodo di scelta per le prove cliniche. I principi ed i metodi della CI sono stati definiti ed hanno trovato ampia applicazione sin dagli inizi del 1900. Mentre la CD misura direttamente il calore prodotto, la metodica indiretta calcola il dispendio energetico (EE – Energy
expenditure) utilizzando il consumo dell’ossigeno (VO2), il quantitativo di anidride carbonica prodotta (VCO2) e l’azoto eliminato (UN). Oltre alla misura dell’energia spesa, la calorimetria fornisce informazioni riguardo il substrato ossidato al momento della misurazione, cioè se carboidrati, lipidi o proteine sono utilizzati come substrato energetico. La calorimetria indiretta si basa sul presupposto che tutta l’energia prodotta dall’ossidazione dei substrati e la
quantità di O2 e CO2 scambiati siano costanti per ognuno di questi.iv Un litro di ossigeno consumato genera 3,9 Kcal, un litro di anidride carbonica prodotta genera 1,1 Kcal.
L’equazione di Weir è poi utilizzata per il calcolo della spesa energetica.
Equazioni per la calorimetria indiretta FORMULA DI WEIR
REE = [3,9×(VO2)+1,1×(VCO2)] ×1,44 – 2,17× UN
FORMULA DI WEIR abbreviata
REE = [3,9×(VO2)+1,1×(VCO2)] ×1,44
Se vengono raccolte le urine delle 24h relative al giorno in cui si esegue la misurazione della CI, la formula completa di Weir è utilizzata per ottenere la richiesta energetica a riposov. Tuttavia dato che la differenza tra il risultato della formula completa ed abbreviata è inferiore al 2%, molti clinici utilizzano unicamente la seconda a causa delle difficoltà pratiche che si riscontrano nella raccolta delle urine delle 24h.
In un paziente sveglio a riposo, in fase di digiuno, la richiesta energetica (EE) che otteniamo dalla calorimetria indiretta è il valore più vicino al REE (Resting
Energy Expenditure). Spesso REE e BEE (Basal Energy Expenditure) vengono
utilizzati come sinonimi anche se con quest’ultimo si definisce il minimo calore misurato dalle 12h alle 18h dopo ingestione di cibo in completo riposo. Una vera misurazione del BEE è raccolta durante il sonno, in condizione di termo neutralità e con il soggetto in posizione supina. Per definizione quindi, REE supera il BEE di una certa quota dovuta allo stato di vigilanza e all’effetto termico del cibo, tale quota si aggira intorno al 10%.
Anche se la formula di Harris-Benedict prevede il BEE, le condizioni alle quali si riferisce sono più rappresentative del REE.
iv Si è riscontrata una certa variabilità nello scambio gassoso e nei valori energetici dei diversi lipidi e proteine ma l’errore derivante dall’approssimazione è solitamente inferiore al 3%, praticamente trascurabile.
v Il metabolismo delle proteine può essere determinato misurando i grammi di azoto contenuti nel campione di urine delle 24h. Il 99,5% dell’azoto derivante dall’ossidazione delle proteine finisce nelle urine sotto forma di urea. Come descritto nei capitoli precedenti 100 grammi di
25
REE copre il 75% dell’energia totale spesa (TEE – Total Energy Expenditure) che
è influenzata dalla termogenesi della degradazione dei cibi, dal brivido, dall’attività fisica, dalla malattia e dal traumavi.
Il rapporto tra l’anidride carbonica prodotta e l’ossigeno consumato, noto come quoziente respiratorio (RQ) che si ricava dalla CI, indica quali sono i substrati in quel momento ossidati e può essere utilizzato come guida nel creare o modificare le miscele nutrizionali dei pazienti critici. Il valore del RQ dovrebbe essere entro i range fisiologici e concordare con l’anamnesi nutrizionale del malato.
Ad esempio: l’RQ dei carboidrati è 1, cioè tanta CO2 viene prodotta quanto O2 viene consumato. L’RQ delle proteine è 0,8 mentre quello dei lipidi è 0,7.
L’RQ lordo misurato grazie alla calorimetria indiretta viene denominato più correttamente rapporto fra gli scambi respiratori (RER – Respiratory Exchange
Ratio) ed è il risultato dell’attività metabolica globale del corpo. Il valore
ottenuto indica la miscela di substrati ossidati ed è normalmente 0,85 con oscillazione tra 0,75 ed 1. E’ necessaria molta attenzione quando si interpretano i valori forniti dal quoziente respiratorio. Esistono infatti moltissime condizioni metaboliche che causano un livello di RQ sotto 0,7 come l’ossidazione dell’etanolo, dei corpi chetonici, la lipolisi e chiaramente l’underfeeding.
Il diabete mellito, la chetoacidosi o l’elevata glicosuria possono accompagnarsi ad RQ basso. Anche le variazioni della modalità respiratorie come l’ipoventilazione o le difficoltà tecniche nella raccolta dei dati possono fornire valori di RQ < 0,7 ma che non riflettono un reale utilizzo di substrati energetici determinati.
Altre condizioni invece si accompagnano ad un valore del quoziente respiratorio superiore ad 1. Tra queste tipicamente troviamo un eccesso di produzione di anidride carbonica, lipogenesi ed overfeeding. RQ non riflette l’utilizzazione dei substrati in caso di iperventilazione, alcalosi metabolica, periodo postoperatorio (6-8 ore dopo anestesia generale) e in seguito a recenti cambiamenti nella tipologia di ventilazione.
vi Febbre =BEE x1,1 Stress moderato = BEE x 1,2 Stress di media entità =BEE x 1,4 Stress severo = BEE x 1,6
La nostra esperienza
Grazie alla collaborazione con la casa produttrice MedGraphics, durante i mesi di Ottobre e Novembre 2011, abbiamo avuto la possibilità di utilizzare un nuovo modello di calorimetro portatile CCM-Express nei pazienti critici ricoverati presso l’unità di Terapia Intensiva IV dell’Azienda Universitaria Pisana.
Lo strumento lavora in circuito aperto (pneumotocografo brevettato da Medgraphics – Tubo Di Pitot), il paziente inspira aria ed espira in un analizzatore di gas (flussimetro) che nel caso del respiro spontaneo veicola l’aria espirata nell’ambiente. La differenza tra le concentrazioni dei gas inspirati ed espirati è misurata per determinare la VO2, VCO2, RQ.
Lo strumento è molto versatile e può essere utilizzato bed-side in condizioni cliniche diverse. La richiesta energetica può essere misurata sia nei pazienti in respiro spontaneo (FiO2=21%) che nei pazienti in ventilazione meccanica con miscele arricchite in ossigenovii.
Nei pazienti in respiro spontaneo possono essere utilizzate diverse interfacce collegate al flussimetro di saggio per il calcolo del quoziente respiratorio: maschera facciale, maschera a tenda, canopy. Esistono vantaggi e svantaggi per ciascuno di questi strumenti che perciò dovrebbero essere scelti in base alle diverse condizioni cliniche.
Nelle maschere facciali i problemi principali sono stati legati alla scarsa aderenza, all’accumulo di saliva o delle secrezioni, al discomfort per la secchezza delle vie aeree, alcuni pazienti hanno lamentato dolorabilità e più spesso senso di claustrofobia.
L’utilizzo della canopy può essere utile nei malati non tracheostomizzati in respiro spontaneo che non richiedono miscele arricchite di ossigeno. La testa del malato è racchiusa in un pallone rigido e trasparente dove l’aria viene pompata a flusso costante. La canopy offre teoricamente dei vantaggi perché non altera in alcun modo il pattern ventilatorio del malato, è molto utile per i
27
bambini (non testati nella nostra esperienza) ma anche con questa metodica si possono avere problemi nei pazienti claustrofobici.
I pazienti in respiro spontaneo con supplemento di ossigeno non sono stati presi ad esempio per le limitazioni intrinseche del software che in questa condizione è in grado di estrapolare i valori solo per FiO2=21%.viii
La valutazione nutrizionale dei pazienti ventilati meccanicamente invece si esegue collegando il flussimetro al tubo oro o naso tracheale ed il raccordo ad Y del circuito respiratorio.
In passato, la raccolta dei dati in questo tipo di condizione è risultata molto difficile a causa della fluttuazione di FiO2 che molti ventilatori forniscono ad ogni inspirazione; condizione che potrebbe non essere risolta anche collegando un miscelatore esterno al ventilatore.
Il software brevettato ed utilizzato da questo strumento è invece in grado di rilevare le minime variazioni della percentuale di O2 nel circuito respiratorio misurando l’esatta FiO2 che il paziente sta ricevendo “breath by breath” durante la ventilazione meccanica.
Prima di eseguire ciascun test lo strumento necessita di un periodo di riscaldamento (dai 5 ai 20 minuti) durante il quale sono state raccolte ed inserite nel computer le informazioni relative al malato in esame. Ogni paziente è stato identificato con un codice alfanumerico e dati quali peso, altezza, età, cenni anamnestici sono stati immessi nel calcolatore.
Successivamente al riscaldamento, il calorimetro è stato calibrato prima di ogni misurazione grazie ad un sistema automatico che utilizza miscele a concentrazioni definite di O2 ed aria, contenute in bombole fornite dal costruttore.
Oltre alle regole base dell’analisi calorimetrica, riportate in tabella 14, prima di ogni misurazione sono state evitate, compatibilmente con le condizioni cliniche e gestionali di un ambiente critico, quelle condizioni che avrebbero influenzato la validità del test come:
La termogenesi temporanea associata all’introduzione intermittente di sostanze nutrienti (nutrizione orale, enterale in boli, parenterale
viii Il problema potrebbe essere risolto solo utilizzando la procedura per malati ventilati estrapolando manualmente i dati.
intermittente). L’infusione parenterale sicuramente aumenta l’REE ma se l’infusione è costante e stabile nelle sua composizione anche l’effetto termico è stabile nelle 24h
Le infusioni non nutrizionali dovrebbero essere costanti nelle 12h precedenti all’esecuzione del test
Nei pazienti in ventilazione meccanica i parametri del ventilatore non dovrebbero essere cambiati nei 90 minuti precedenti, la FiO2 dovrebbe essere stabile ed inferiore al 60% per le motivazioni precedentemente descritte
Per avere una misurazione accurata è fondamentale raggiungere lo steady stateix, misurazioni stabili si ottengono di solito in 15-20min
Condizioni ideali perla calorimetria indiretta
o Il paziente deve rimanere a riposo, possibilmente disteso, per almeno 30 minuti prima dell’esecuzione del test.
o I pazienti in dieta libera o artificiale intermittente devono essere a digiuno da almeno 2 ore.
o Le misurazioni vengono effettuate in ambiente calmo ed in condizioni di termo neutralità.
o I pazienti durante la misurazioni non devono presentare attività muscolare
o Non devono esserci perdite nel sistema
o Nei pazienti in respiro spontaneo non devono essere utilizzate fonti supplementari di ossigeno (cannule nasali, maschere, collari tracheotomici)
o Tutti dati utilizzati per ricavare RQ ed REE devono riferirsi a condizioni di equilibrio (steady-state)
Tabella 14
In ambiente critico deve essere posta particolare attenzione alla trasmissione ospedaliera delle infezioni. Le componenti dello strumento che vanno a contatto con secrezioni, pelle ed aria espirata devono essere sterilizzate. Nel nostro caso lo strumentario non monouso è stato trattato con soluzione battericida.
Una volta eseguita la misurazione lo strumento produce due diversi tipi di documenti, nel primo si ha una tabella con i soli valori numerici (due valori al
29
minuto), come secondo documento il software produce un grafico dal quale è possibile manualmente eliminare le prime fasi della misurazione (di routine si eliminano i primi 5 minuti del test non corrispondenti allo steady state) o gli artefatti (dovuti ad esempio ai movimenti del malato, tosse, perturbazioni esterne etc). Automaticamente il software utilizza per il calcolo del quoziente respiratorio e dei parametri derivati solo i dati considerati utili dall’operatore. Alcuni prototipi sono riportati in figura1 e 2). Nella tabella 15 è invece descritta la legenda delle misurazioni ricavate dal calorimetro.
Fig.2
VARIABILE
TIME Durata totale dell’esame
FIO2 Concentrazione di ossigeno media respirata dal paziente durante l’esame
REE (Kcal/die) Spesa energetica a riposo reale e predetta
RQ Quoziente respiratorio
REE/pred % Percentuale della spesa energetica di riposo rispetto al valore predetto
RR Frequenza respiratoria
31
VCO2 CO2 prodotta in media per atto respiratorio VO2 O2 consumato medio per atto respiratorio Urinary N2 (g/day) Produzione giornaliera di azoto urinario
CHO/REE (%) % carboidrati ossidati rispetto al valore di REE Fat/REE (%) % grassi ossidati rispetto al valore di REE Prot/REE (%)
REE_Covar (%)
% proteine ossidati rispetto al valore di REE Variabile di approssimazione
Tabella 15
In tutto sono state eseguite circa 40 misurazioni, comprendenti anche alcuni volontari sani il cui test è stato molto utile come training iniziale per l’utilizzo della macchina.
Il criterio di inclusione fondamentale per le rilevazioni è stato il ricovero in terapia intensiva IV universitaria che essendo una Rianimazione Polivalente ci ha fornito la possibilità di eseguire i nostri test in una popolazione molto varia di malati (postoperatori in elezione, postoperatori in urgenza, settici, internistici complicati, bariatrici) avendo così la possibilità di ottenere informazioni per condizioni cliniche piuttosto diverse. D’altro canto le caratteristiche di disomogeneità ed il numero (in senso assoluto) esiguo di rilevazioni non ci permettono di poter analizzare da un punto di vista statistico i nostri dati ma solo di poter descrivere alcuni esempi di particolare interesse, con la ferma speranza però di poter continuare in un futuro le misurazioni.
In particolare nel corso del mese di novembre 2011 abbiamo seguito:
10 pazienti sottoposti a chirurgia bariatrica: le misurazioni sono state effettuate il giorno dell’intervento e cioè a 24h di digiuno fino a 72 h di digiuno postoperatorio, seguendo tali pazienti anche in corsia
1 paziente lungodegente della rianimazione seguito dall’ingresso fino all’exitus
4 pazienti settici 1 paziente in ARDS 4 postoperatori
Il calorimetro CCM Express MedGraphics si è rilevato uno strumento di grande affidabilità e praticità, molto semplice nell’utilizzo grazie anche all’interfaccia touch-screen ed alla semplicità del software.
Caso clinico n°1.
Il signor Z.M. di anni 80 (in anamnesi ipertensione arteriosa, ipercolesterolemia e pregresso etp polmonare trattato con chirurgia e chemioterapia), viene ricoverato nel settembre 2011 nell’Unità di Terapia Intensiva IV per infezione da Clostridium tetani.
Il paziente proveniente dal pronto soccorso, giunge in terapia intensiva sedato curarizzato e ventilato meccanicamente. Si procede al monitoraggio ed alle cure del caso e tra gli altri presidi terapeutici, tra cui tracheotomia percutanea precoce in previsione del lungo periodo di ventilazione meccanica, viene iniziata fin dalle prime 24 h di ricovero la nutrizione enterale tramite sondino naso gastrico. Il paziente per tutta la durata della degenza è stato sottoposto a controlli calorimetrici con CCM Express.
Di seguito (grafico 1) riportiamo l’andamento nei giorni di ricovero del’anidride carbonica prodotta e del consumo dell’ossigeno e conseguentemente del quoziente respiratorio. VO2 VCO2 RQ 29-set 221,0 198,0 0,9 08-ott 220,0 219,0 1,0 09-ott 229,0 208,0 0,9 15-ott 183,0 175,0 1,0 22-ott 176,0 189,0 1,1 24-ott 422,0 351,0 0,8 02-nov 301,0 274,0 0,9 08-nov 201,0 192,0 1,0 12-nov 222 185 0,83 Z.M GENERALE 0,0 50,0 100,0 150,0 200,0 250,0 300,0 350,0 400,0 450,0
29-set 08-ott 09-ott 15-ott 22-ott 24-ott 02-nov 08-nov 12-nov SC A M B I 0,0 0,2 0,4 0,6 0,8 1,0 1,2 R Q VO2 VCO2 RQ graf.1
Il paziente Z.M. in data 22 ottobre ha cominciato a presentare i primi segni di sepsi (leucocitosi, rialzo febbrile, aumento della pro calcitonina e edegli altri indici di flogosi), si è scoperto nei giorni successivi, quando ormai il quadro clinico era volto verso lo shock settico che l’agente responsabile era rappresentato da un bacillo gram negativo multi resistente (Acinetobacter baumanii).
33
Il quadro clinico è stato affrontato applicando il protocollo di Rivers e sottoponendo il paziente a cicli di emodiafiltrazione. Nonostante un iniziale miglioramento, nei giorni successivi il paziente ha presentato un peggioramento delle condizioni cliniche. I dati microbiologici hanno rilevato una seconda infezione da Klebsiella pneumoniae carbapenemasi produttrice che lo ha condotto in pochi giorni all’exitus nonostante gli sforzi clinici.
Riportiamo di seguito (grafico 2) l’andamento della richiesta energetica durante la degenza:
pred
HB REE REE/pred% RQ VO2 VCO2 RQ CHO Fat KCAL eff 29-set 1614,0 1570,0 97,0 0,9 221,0 198,0 0,9 70,0 30,0 1440 08-ott 1614,0 1600,0 99,0 1,0 220,0 219,0 1,0 98,0 2,0 1440 09-ott 1614,0 1632,0 103,0 0,9 229,0 208,0 0,9 68,0 29,0 1440 15-ott 1614,0 1321,0 103,0 1,0 183,0 175,0 1,0 90,0 9,0 1440 22-ott 1614,0 1303,0 81,0 1,1 176,0 189,0 1,1 123,0 -23,0 1440 24-ott 1614,0 2954,0 184,0 0,8 422,0 351,0 0,8 44,0 55,0 1152 02-nov 1614,0 2147,0 133,0 0,9 301,0 274,0 0,9 71,0 29,0 1440 08-nov 1614,0 1445,0 88,0 1,0 201,0 192,0 1,0 87,0 15,0 1440 12-nov 1614,0 1557 96 0,8 222 185 0,83 45,0 55,0 1440
La linea blu nel grafico descrive la richiesta che avremmo dedotto in modo teorico utilizzando la formula di Harris-Benedict. La linea rosa descrive la reale necessità del paziente che abbiamo calcolato con la calorimetria indiretta.
z.m generale 0,0 500,0 1000,0 1500,0 2000,0 2500,0 3000,0 3500,0
29-set 08-ott 09-ott 15-ott 22-ott 24-ott 02-nov 08-nov 12-nov
k ca l/ d ie pred HB REE graf.2
Appare subito chiaro quali profonde discrepanze esistano tra i valori di REE teorici e reali man mano che il quadro clinico si è complicato. E’ importate inoltre sottolineare come le richieste energetiche aumentino con il conclamarsi dello stato settico (22-24 ottobre).
Di seguito invece (grafico 3) presentiamo le variabili precedentemente descritte confrontate con le calorie effettivamente fornite al paziente (linea rossa), inoltre nella parte superiore del grafico il quoziente respiratorio è confrontato con le soglie di underfeeeding ed overfeeding riportate come linee nere nel grafico.
z.m. generale 0,0 500,0 1000,0 1500,0 2000,0 2500,0 3000,0 3500,0
29-set 08-ott 09-ott 15-ott 22-ott 24-ott 02-nov 08-nov 12-nov
k ca l 0,0 0,2 0,4 0,6 0,8 1,0 1,2 R Q pred HB REE kcal effet RQ SOGLIA OVERFEED SOGLIA UNDERFEED graf.3
In questo caso clinico particolare le calorie effettivamente somministrate risultano sempre inferiori rispetto alle reali richieste, questo è in linea con le raccomandazioni della letteratura che indicano come ottimale un apporto calorico pari a circa l’80% del REE.
E’ molto probabile che si tratti di una coincidenza ma esattamente nel periodo precedente l’evento infettivo (22 ottobre) possiamo notare come le calorie somministrate superino le richieste ed i valore del quoziente respiratorio si porti conseguentemente sopra alla soglia (temuta proprio per l’aumento del rischio infettivo) dell’overfeeding.
35
diagnostiche quali broncoscopia o imaging) le reali calorie somministrate diminuiscono.
Il caso di Z.M. è emblematico su come l’utilizzo routinario della calorimetria possa guidare l’apporto calorico in un malato critico.
Caso clinico n°2.
L’utilizzo della calorimetria indiretta potrebbe risultare molto utile come guida per la formulazione delle miscele nutrizionali. Il calorimetro CCM express infatti ricava (dal quoziente respiratorio e dall’azoturia delle 24h) le i valori percentuali dei substrati energetici (carboidrati, proteine e lipidi) ossidati dal paziente al momento della misurazione.
L’esempio che riportiamo di seguito fa riferimento ad un gruppo di 10 pazienti bariatrici che per controllo dei parametri vitali postoperatori, in seguito ad intervento di by-pass gastrico laparoscopico (LGBP), sono afferiti all’Unità di Anestesia e Rianimazione IV nel periodo di prova del calorimetro CCM Express. A dispetto delle apparenze i pazienti bariatrici sono fortemente malnutriti e proprio per queste ragioni presentano un rischio di complicanze postoperatorie molto più alto rispetto ai controlli, tra queste ridotta capacità di rigenerazione dei tessuti, complicanze infettive e respiratorie sono le più frequenti. Sono pazienti molto delicati, devono essere seguiti necessariamente con un approccio multidisciplinare e mai come in questo caso è fondamentale una corretta gestione metabolica.
Come precedentemente descritto abbiamo condotto misurazioni con il calorimetro CCM-Express in 10 pazienti bariatrici una volta al giorno fino alle 72 h di digiuno postoperatorio.
Generalmente in seguito all’intervento il paziente viene estubato e trasferito in terapia intensiva dove trascorre la prima notte postoperatoria, salvo complicanze al mattino seguente viene trasferito nella corsia di provenienza. Oltre alla giornata operatoria di routine viene mantenuta anche in corsia una terapia idratante infusionale, a caduta, con soluzione elettrolitica bilanciata. (SEB 2000ml/300 kcal circa), fino a quando il paziente non ricomincia ad alimentarsi per os.
L’iter classico per i pazienti che sono sottoposti a LGBP (Laparoscopic Gastric
By-Pass) consiste nel rimanere a digiuno dalla mezzanotte che precede
l’intervento fino alla 3° giornata postoperatoria (96h) quando vengono sottoposti al controllo dell’anastomosi gastroenterica attraverso radiografia del tratto digerente con mezzo di contrasto idrosolubile.
Nei pazienti diabetici in corsia, di norma, si effettuano stick glicemici ogni 4h e qualora si reputi necessario viene somministrata insulina (boli o infusione continua). Al momento in corsia non si fa riferimento ad un protocollo specifico per il controllo della glicemia.
Di seguito riportiamo l’andamento del quoziente respiratorio in tutto il gruppo di riferimento espresso come valore medio, nella prima ed ultima rilevazione effettuata (24h e 72 h digiuno).
quoziente respiratorio - bariatrici
0,66 0,68 0,7 0,72 0,74 0,76 0,78 0,8 0,82 0,84 rq rq 0,82 0,72 24h 72h graf.4
Nei grafico 4 come lecito aspettarsi il valore medio del quoziente respiratorio si riduce in quasi tutti i casi confermando lo stato catabolico nel quale vengono a trovarsi i pazienti durante la degenza.
Altri dati molti interessanti sono stati raccolti confrontando le differenti richieste metaboliche prendendo come esempio una piccola sottopopolazione composta da 3 pazienti obese le cui caratteristiche sono riassunte nella tabella seguente. (tabella 16)
37 Pz Eta Peso (kg) Altezza (cm) Bmi (kg/m2) Anamnesi
a 32 142 168 50,3 -
b 44 157 162 59,8 Ipertensione arteriosa, diabete
mellito insulino dipendente
c 40 138 163 51,3 Iperinsulinemia, sindrome
dell’ovaio policistico, OSAS Tab.16
Di seguito, grafico 5, riportiamo i diversi valori di RQ nelle rilevazioni a 24h, 48h, 72h per queste tre pazienti.
quoziente respiratorio 0,78 0,8 0,75 0,76 0,69 0,6 0,83 1,05 0,72 0,00 0,20 0,40 0,60 0,80 1,00 1,20 24rq 48rq 72rq a b c graf.5
Nei grafico 6 e 7 invece vediamo come le differenti patologie in anamnesi influiscano molto nell’utilizzo dei singoli substrati energetici.
carboidrati 26 16 69 33 43 115 6 -10 -7 -20 0 20 40 60 80 100 120 140
cho24 cho48 cho72
a b c graf.6 lipidi 74 84 80 67 106 109 57 -14 94 -40 -20 0 20 40 60 80 100 120
fat24 fat48 fat72
a b c
graf.7
In questi 3 casi clinici vediamo come l’utilizzo dei substrati sia totalmente opposto. Analizziamo la paziente b, affetta da ipertensione arteriosa e diabete mellito, al momento dell’esame oltre alla terapia infusionale con soluzione elettrolitica bilanciata veniva somministrata insulina tramite pompa siringa (3UI/h), il valore della glicemia al momento della misurazione era pari a 150 mg/dL. Al momento della calorimetria alle 48h e 72h di digiuno la paziente b presenta RQ pari a 0,69 e 0,6 rispettivamente, con ossidazione praticamente totale del substrato lipidico. Nel diabetico grave, la capacità di bruciare carboidrati è notevolmente compromessa, il quoziente respiratorio risulta continuamente basso, da 0.7 a 0.8 e tende ad aumentare con l’assunzione di