CAPITOLO 1
Cenni Storici
Nei tempi antichi, l’artrosi d’anca detta “ Morbus coxae senilis” era considerata malattia non trattabile ed era ritenuta un evento ineluttabile legato alla vecchiaia.
Fin dall’inizio il principale problema era costituito dalla scelta dei materiali con cui costruire le protesi; la resistenza e soprattutto la biocompatibilità, erano problemi insormontabili per l’epoca e portarono al fallimento di tale tecnica chirurgica.
Nel 1840 Carnochan a New York usò, come tessuto da interporre tra femore e acetabolo, il legno e successivamente Verneuil usò il tessuto muscolare e nel 1900 Chlumsky usò l’argento.
Nel 1901 il Trattato di Ortopedia di Whitman dedicava non più di mezza pagina all’ artrosi dell’anca.
Nel 1923 Smith-Petersen dopo aver utilizzato il vetro, la bakelite e il pyrex giunse finalmente, nel 1938, alla lega cromo-cobalto (vitallium)
che mostrò migliore resistenza e minori reazioni dell’organismo.
Dopo l’avvento di questo materiale la chirurgia protesica ebbe nuova spinta di ricerca e sviluppo che portò, dopo la seconda guerra mondiale, alle
Judet, Mueller, McKee, Thompson sono solo alcuni dei grandi chirurghi ortopedici che negli anni ’50 diedero un grande impulso al disegno delle protesi e alle scelte dei materiali.
La svolta epocale si ebbe però all’inizio degli anni ’60 quando l’inglese Sir John Charnley mise a punto un materiale che avrebbe rivoluzionato i
risultati clinici delle protesi: egli introdusse il Polietilene (UMHWPE) per costruire la cupola e utilizzò il cemento (PMMA) per fissare la cupola e lo stelo all’osso.
Nacque così la chirurgia protesica moderna, con dei risultati clinici finalmente accettabili in termini di risoluzione del dolore e durata nel tempo.
Le protesi che utilizzavano il polietilene che si articolava con una testina in metallo giungevano a normale consumo nel coso di alcuni lustri
La grande svolta si ebbe negli anni ’80 con lo sviluppo delle protesi non cementate e l’utilizzo del titanio che diviene il principale materiale per costruire le protesi.
In questi ultimi anni è stato creato in laboratorio un nuovo materiale chiamato “OXINIUM” (zirconio ossidato). Il Prof. Viganò Direttore del Centro di Chirurgia dell’Ospedale Gaetano Pini di Milano è stato uno dei primi ad aver sperimentato il nuovo materiale su pazienti anche giovani.(1)
CAPITOLO 2
Epidemiologia
Nel 94° Congresso Nazionale della Società Italiana di Ortopedia e Traumatologia tenutosi a Milano dal 7 all’11 novembre 2010, sono stati diffusi i numeri che descrivono un settore, quello dell’ortopedia e della traumatologia in forte crescita.
L’Italia è tra i primi posti in Europa per il numero di protesi d’anca ( che sono circa l’80% di tutte le protesi articolari ) con circa 100 mila impianti l’anno, con un fattore di crescita del 5% annuo e una spesa per il Servizio Sanitario Nazionale pari a un miliardo e trecento milioni di euro per operazioni e ricoveri e 500 milioni di euro per la riabilitazione.
In testa fra le regioni italiane appaiono la Lombardia e l’Emilia Romagna, risultato però ottenuto per effetto della mobilità dei pazienti a livello regionale.
L’Italia è tra i paesi europei dove si effettua il maggior numero di protesi d’anca, su circa 700 mila interventi europei oltre 100 mila riguardano il nostro Paese, superato soltanto da Germania ( 250 mila ) e Francia ( 130 mila ).
Nel mondo si impiantano un milione e mezzo di protesi d’anca ogni anno, di cui 300 mila negli Stati Uniti.
L’uso della profilassi antimicrobica preoperatoria in ambiente chirurgico dotato di flusso d’aria laminare ha ridotto il rischio d’infezioni
intraoperatorie dell’1% dopo l’intervento chirurgico di artroplastica dell’anca e della spalla e del 2% dopo l’artroplastica del ginocchio. L’incidenza delle infezioni riportate da diversi autori sono descritte in tabella 1.(2)
Tabella 1: Incidenza delle Infezioni successive ad artroplastica
Autori
Anno
Interventi
Infezioni
Charnley
1969
190
9%
Eftekar
1976
800
1%
Preston
1978
49
4%
Andrews
1981
1746
3,8%
Mendenhall
1995
128000
1,1%
Hanssen
1998
30680
1,7%
I microrganismi isolati più comunemente sono gli stafilococchi coagulasi negativi e Staphylococcus aureus , streptococchi, bacilli gram-negative , enterococchi, anaerob, miceti e flora mista.
In alcuni casi le colture risultano negative nonostante la presenza di pus a livello dell’impianto.
Nel lavoro di A.Trampuz. sono riportate le percentuali di isolamento dei vari microrganismi.(3)
Tabella 2: Percentuali di isolamento microbico in pazienti sottoposti ad
artroplastica (Tramuz et al.)
MICRORGANISMI FREQUENZA
Stafilococchi coagulasi negativi 30 – 43 %
Staphylococcus aureus 12 – 23 %
Streptococcchi 9 – 10 %
Enterococchi 3 – 7 %
Batteri Gram - 3 – 6 %
Nonostante i tassi di infezione periprotesica siano diminuiti negli ultimi 30 anni, la complicanza settica resta la complicanza più temibile in questo tipo di chirurgia.
Le possibilità di trattamento attualmente prevedono la terapia antibiotica, il debridement artroscopico o a cielo aperto e la revisione in uno o due tempi chirurgici.
Analizzando i risultati ottenuti dalla Relazione del XXXVIII Congresso Nazionale AMCLI tenutosi a Rimini il 17-20 novembre 2009, si evince che i pazienti con infezione periprotesica di anca e di ginocchio, trattati con tecnica di revisione chirurgica in due tempi, hanno un outcome positivo in termini di miglioramento del quadro clinico.
In virtù di tali risultati ottenuti dopo il follow-up a medio termine, possiamo affermare, in accordo con la letteratura internazionale, che la tecnica chirurgica di revisione in due tempi delle infezioni periprotesiche di anca e di ginocchio è un’opzione ottimale nel trattamento di questo tipo di complicanza.(4)
CAPITOLO 3
Patogenesi
La patogenesi dell’infezione coinvolge l’interazione fra microorganismi, l’impianto e l’ospite.
Fig.1: Patogenesi dell’infezione
Ospite
Risposta infiammatoriaImpianto
Superficie caratteristicaMicrorganismi
formazione di biofilmSuperficie di adesione Virulenza sistema immunitario
Le infezioni associate ad impianti sono tipicamente causate da microrganismi che crescono in strutture conosciute come biofilms.(5)
Scanning Electron Micrograph of a Staphylococcus epidermidis Biofilm on Foreign Material.
Il Biofilm rappresenta un modello di comunità organizzata di batteri (quorum sensing ) che permette ai suoi costituenti di resistere ad
aggressioni da parte di elementi esterni ed interni come gli antibiotici e la risposta immunitaria.
La deplezione di metaboliti e l’accumulo di sostanze tossiche causano il passaggio dei microrganismi ad una fase di crescita molto lenta o
addirittura di non crescita ( fase stazionaria ) che rende i microrganismi più resistenti di quelli che vivono liberi ( planctonici ).
Inoltre i corpi estranei (protesi ) rimangono esclusi dal microcircolo, che è cruciale, sia per il rilascio delle molecole deputate alla difesa dell’ospite che per liberare gli antibiotici nella sede dell’infezione.(6)
Un Biofilm è una comunità strutturata di cellule batteriche racchiuse in una matrice polimerica autoprodotta ed adesa ad una superficie inerte o vivente. La letteratura scientifica continua a riportare la formazione di biofilm da parte di una serie sempre più ampia di specie microbiche: tutti i tipi di superficie, incluso le foglie di piante di prezzemolo, protesi, presidii medici e persino i recipienti di alluminio usati per conservare combustibile
nucleare spento, possono essere colonizzate da biofilm microbici.
Nei batteri Gram negativi, la comunicazione cellulare avviene attraverso l’attività delle molecole di omoserina lattone acetilata (AHLS).
Fig.2: Esempio di comunicazione cellulare
Figura tratta da Parsek M.R., Greenberg P.E., PNAS 97, 8789-8793, 2000
Queste piccole molecole segnale, dette autoinduttori, sono rilasciate dalle cellule e si accumulano nelle colture in funzione della densità cellulare.
Ad una densità di popolazione soglia, definita quorum, gli AHLS
accumulati possono interagire con i recettori situati sulla superficie della cellula del batterio che controllano l’espressione genica.
In questo modo l’espressione coordinata di gruppi di geni può essere ottenuta in funzione della densità di popolazione (quorum sensing). L’accumulo di AHLS in un biofilm in sviluppo, causa la trasformazione delle cellule da planctoniche al fenotipo tipico del biofilm e coordina il loro comportamento in modo tale da costruire le complesse strutture di
comunità multicellulari. Anche nei batteri Gram positivi è stato descritto il meccanismo di comunicazione cellulare e di regolazione dei geni definito quorum sensing; è diversa però la natura delle molecole autoinduttori, infatti in questo caso le molecole segnale sono dei piccoli peptidi.(7)
CAPITOLO 4
Classificazione delle infezioni relative ad
impianti ortopedici
Le infezioni connesse all’uso di protesi articolari possono essere classificate in:
PRECOCI:
quelle che si sviluppano nei 3 mesi dopo l’interventochirurgico e che sono acquisite prevalentemente durante l’impianto o nei giorni immediatamente successivi e causata da microrganismi molto virulenti (S. aureus e Batteri Gram negativi).
Le manifestazioni cliniche si presentano in forma acuta e sono caratterizzate da: dolore, febbre, arrossamento e tumefazione.
RITARDATE:
quelle che si sviluppano da 3 a 24 mesi dopo l’interventochirurgico, acquisita prevalentemente durante l’impianto e provocato da germi meno virulenti.(Stafilococchi coagulasi negativi e Propionibacterium acnes).
TARDIVE:
quelle che si sviluppano dopo 24 mesi dall’intervento chirurgico, acquisite di solito per via ematogena da foci infettivi distanti. (Cutanei, Respiratori, Dentari, Urinari).Le manifestazioni cliniche si presentano in forma acuta e sono caratterizzate da: dolore, febbre, arrossamenti e tumefazione.(8)
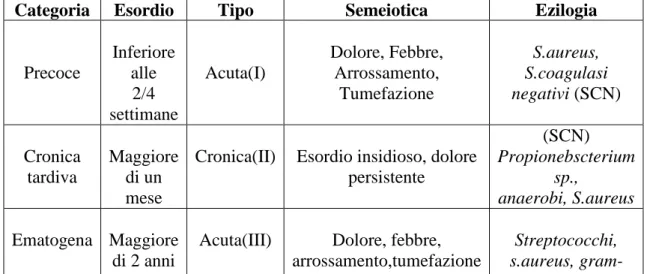
Tabella 3: Nomenclatura delle Infezioni relative ad impianti ortopedici
Categoria Esordio Tipo Semeiotica Ezilogia
Precoce Inferiore alle 2/4 settimane Acuta(I) Dolore, Febbre, Arrossamento, Tumefazione S.aureus, S.coagulasi negativi (SCN) Cronica tardiva Maggiore di un mese
Cronica(II) Esordio insidioso, dolore persistente (SCN) Propionebscterium sp., anaerobi, S.aureus Ematogena Maggiore di 2 anni
Acuta(III) Dolore, febbre, arrossamento,tumefazione
Streptococchi, s.aureus, gram-
Nel recente studio “ Management of infection associated with total hip arthoplasty according to a treatment algorithm” (Giulieri SG, Graber P, Ochsner PE, Zimmerli W.) Infection 2004 Volume 32, Number 4, 222-228) i 63 episodi infettivi associati a protesi d’anca in un periodo di 16 anni erano così suddivisi.(9)
- 29% early infection
- 41% delayed infection
CAPITOLO 5
Diagnostica per Immagini
Nella diagnosi di infezioni associate a protesi articolari intervengono:
RX CONVENZIONALE: come ruolo di screening, spesso non
diagnostico come in flogosi recenti, esclusivamente utilizzato per individuare il segmento e/o i segmenti ossei interessati dal processo flogistico e per escludere un altro tipo di patologia.
Nelle forme croniche l’esame radiologico tradizionale è il punto di partenza di tutte le altre indagini strumentali.
SCINTIGRAFIA OSSEA : tecnica di Imaging medico-nucleare che
fornisce una mappa funzionale delle lesioni scheletriche caratterizzata da elevata sensibilità rispetto alla radiologia tradizionale.
Dopo una radiografia in due proiezioni del segmento e/o dei segmenti ossei in cui si sospetta la lesione, la scintigrafia ossea è la successiva metodica di immagine.
Il radiocomposto oggi utilizzato è l’Indio 111 (111In) legato ai leucociti che migrano spontaneamente verso le aree di infezione.
L’esame è generalmente eseguito dopo 18-24 ore dalla somministrazione del radiofarmaco.
Il radiocomposto identifica sede, estensione ed attività di un focolaio settico, esso è utilizzato sia per valutare l’efficacia della terapia che per individuare eventuali riacutizzazioni.
TAC: utile per valutazione di tessuti molli, in flogosi primitive, limitata in
impianti metallici.
E’ l’unica metodica che permette di valutare l’osso corticale e le sue modificazioni nelle varie fasi della malattia.
Permette inoltre un bilancio della compromissione midollare e il
coinvolgimento dei tessuti molli vicini, soprattutto dopo l’utilizzazione di mezzo di contrasto.
RMN: valutazione di tessuti molli, edemi, non specifica e non utilizzabile
in pazienti con protesi.
E’ un esame estremamente sensibile nell’evidenziare i processi infiammatori.
E’ inoltre in grado di registrare le più modeste alterazioni dell’intensità di segnale nei tessuti molli e perciò di rilevare precoci segnali di flogosi od eventuali riprese di malattia.
FDP-PET (18Fluoro-2-desossi-D-Glucosio-Positron Emission
Tomography): il radiocomposto è costituito da una molecola di glucosio marcata con un isotopo del fluoro.
Nel corpo umano si comporta come fosse una normale molecola di glucosio, l’assorbimento, la distribuzione e l’accumulo dipendono dalle riserve di glicogeno.
Nell’osso il tracciante si raccoglie nel sistema reticolo endoteliale cioè nel midollo osseo rosso.
A tutt’oggi il ruolo di questa metodica nella diagnosi di infezione è
comunque limitata, poiché le altre metodiche di indagine come Scintigrafia, TC e RM hanno un elevato grado di accuratezza (circa il 90%).
ECOGRAFIA: grazie alla sua elevata risoluzione spaziale permette di
identificare le raccolte nelle parti molli, l’estensione nei compartimenti anatomici, la presenza di tragitti fistolosi.(10)
CAPITOLO 6
Ruolo del laboratorio nella diagnosi delle
infezioni di mezzi di sintesi e protesi articolari
su fratture chiuse
Non sono stati stabiliti criteri uniformi per la diagnosi d’infezione associata a protesi articolari, in numerosi studi l’infezione era diagnosticata se
almeno uno dei seguenti criteri era presente: (11-12-13-14)
1.
Sviluppo di batteri da liquido sinoviale o da tessuto
periprotesico
2.
Liquido sinoviale purulento o presenza di pus a livello
dell’impianto
3.
Presenza di cellule infiammatorie all’esame istopatologico del
tessuto periprotesico (sensibilità > 80% e specificità > 90%)
Il Laboratorio si avvale delle seguenti indagini nel rilevare l’infezione a livello dell’impianto:
1.
Esami Ematochimici
2.
Esame Microscopico con colorazione di Gram
3.
Microscopia in immunofluorescenza
4.
Esame Colturale
5.
PCR
CAPITOLO 6.1
Esami ematochimici
La conta dei globuli bianchi e la VES nel sangue non sono sufficientemente discriminativi per predire la presenza o l’assenza d’infezione.
In questo lavoro: Infection after Total Hip Arthroplasty. Tsukayama et al.Journal of Bone and Joint Surgery 1996, sono state riscontrate 106 infezioni in 97 pazienti, dove la conta dei globuli bianchi era aumentata in 17 pazienti ( 16% ) e la VES era aumentata in 67 pazienti ( 63% ).(15)
Nello studio pubblicato sul “Journal of Bone and Joint Surgery”, gli autori hanno valutato il ruolo di alcuni analiti di laboratorio nella diagnosi di infezione profonda in 78 pazienti ( 41 uomini e 37 donne ), dove è stato osservato che la Proteina C reattiva, L’interleuchina-6, la Procalcitonina e il TNF-α sono degli utili indicatori di infezione.
La proteina C reattiva e l’interleuchina 6 hanno la più alta sensibilità (0.95), l’interleuchina 6 è però meno specifica della proteina C reattiva (0.87 contro 0.96).
La Procalcitonina e TNF-α sono molto specifici (0,98 contro 0,94) ma hanno una bassa sensibilità (0,33 contro 0,43).
La combinazione di proteina C-reattiva con la misura dell’interleuchina 6, forniscono un mezzo di screening eccellente per la diagnosi di infezione in un innesto profondo.
Un indicatore altamente specifico come la procalcitonina è stata utile nell'identificazione dei pazienti con livelli elevati di proteina C reattiva e/o di interleuchina 6.(16)
Particolare utilità sembra avere la conta e la formula leucocitaria su liquido sinoviale, nel lavoro: “Synovial fluid leukocyte count and differential for the diagnosis of prosthetic knee infection Trampuz et al., Patel R.Am J Med 2004”, sono state riscontrate 99 infezioni in 34 pazienti, dove la conta dei leucociti nel liquido sinoviale superiore a 1700 mm3 o con una
percentuale di neutrofili superiore al 65% hanno una buona sensibilità del 94 e del 97% e specificità dell’88 e 98%, rispettivamente, in pazienti che non abbiano una sottostante malattia infiammatoria.(17)
CAPITOLO 6.2
Esame microscopico con colorazione di Gram
La colorazione di Gram del liquido sinoviale e del tessuto periprotesico hanno una bassa sensibilità (meno del 26%) ma un’alta specificità (maggiore del 97%) .(6)CAPITOLO 6.3
Esame microscopico in fluorescenza
L’utilizzo della microscopia in fluorescenza rappresenta un utile mezzo per la rilevazione dei batteri. Sono stati ad esempio utilizzati anticorpi
monoclonali specifici per Propionbacterium acnes e policlonali per Staphylococcus species.(18)
Examples of confocal laser scanning micrographs of bacteria in material removed by ultrasonication (sonicate) from culture-negative hip prostheses to illustrate coccoid cells present singly and in small
CAPITOLO 6.4
Esame colturale
Al momento è l’unico mezzo per una diagnosi eziologica che permetta lo studio della sensibilità agli antibiotici anche se non può essere considerato un “gold standard”.
La coltura dalla ferita superficiale o da un tragitto fistoloso risulta spesso positiva per la colonizzazione da parte della microflora della cute.
Negli aspirati di liquido sinoviale i patogeni possono essere isolati dal 45 al 100%
La coltura del tessuto periprotesico è il più affidabile strumento per l’isolamento dei patogeni ed è considerato il sistema di riferimento nelle infezioni associate a protesi con una sensibilità che varia dal 65 al 94%.(17) Almeno 3 campioni devono essere prelevati dal tessuto periprotesico
Notevoli precauzioni devono essere prese per evitare il rischio di
contaminazione durante il prelievo, trasporto e processazione dei materiali. Il prelievo dovrebbe essere eseguito prima di aver inziato la terapia
antibiotica. Nel caso in cui questo non è possibile si consiglia di eseguire le colture utilizzando flaconi per emocolture che sono addizionati di sostanze quali resine o carbone che neutralizzano l’attività degli antibiotici in modo da diminuire il rischio di falsi negativi da terapia e/o da presenza di
sostanze che inibiscono la crescita del germe.
La loro efficacia è stata ampiamente dimostrata in studi e lavori, del passato e recenti, verso un’ampia gamma di antibiotici.
Fig.4: Flaconi contenenti resine
CAPITOLO 6.5
PCR
Nel lavoro “Detection of prosthetic hip infection at revision arthroplasty by immunofluorescence microscopy and PCR amplification of the bacterial 16S rRNA gene.( J Clin Microbiol 1999), gli autori utilizzando la PCR hanno dimostrato la presenza di batteri nel 72% dei campioni rispetto al 22% tramite coltura convenzionale del materiale preventivamente
sottoposto a sonicazione.
Gli autori concludono che l’incidenza delle infezioni di protesi articolari è “grossly” sottostimata dai metodi colturali utilizzati correntemente.
L’utilizzo della PCR può essere un metodo complementare alla coltura e dovrebbe essere utilizzata in pazienti con forte sospetto d’infezione per i quali la coltura è risultata negativa, ed in casi di sospetta infezione mista (pazienti con fratture aperte o con ulcere da decubito) .
Le tecniche molecolari permettono di rilevare patogeni prima sconosciuti ed addirittura nuove specie batteriche.
Gli autori nella diagnosi d’infezione di protesi articolari suggeriscono il seguente algoritmo:(18)
CAPITOLO 7
Considerazioni conclusive
Le infezioni associate a biomateriali rappresentano un punto centrale dei programmi di controllo delle infezioni in ambito assistenziale.
La frequenza degli eventi è bassa ma il crescente utilizzo di questi materiali rende ragione dell’elevato numero assoluto di queste infezioni.
Le conseguenze sono spesso catastrofiche, quindi la corretta gestione e soprattutto la prevenzione sono elementi fondamentali del controllo.
Il rispetto delle misure di prevenzione delle infezioni in ambito chirurgico, una buona tecnica chirurgica, la rigorosa applicazione dei principi della profilassi antibiotica, la conoscenza della epidemiologia e delle modalità di diffusione dei germi interessati, l’utilizzo di materiali sempre più affidabili, sono i passaggi obbligati di questo percorso.
Il ruolo del laboratorio è importante per stabilire con indagini
ematochimiche ( PCR, VES, Conta dei globuli bianchi, Esame del liquido sinoviale ed altri analiti ) il sospetto d’infezione articolare ed è
insostituibile per la corretta identificazione dell’agente eziologico e relativo antibiogramma attraverso esami di microscopia diretta, colturali e PCR. Lo studio della sensibilità agli antibiotici è sicuramente un dato di estrema importanza in questo tipo d’infezione, per il sempre più frequente
isolamento di batteri multiresistenti e per le difficoltà degli antibiotici di raggiungere al livello della protesi infetta concentrazioni ottimali e
BIBLIOGRAFIA
1. History of articular prostheses from the arbori till now. J Bone Joint Surg Br, May 5, 2009; 93-B(5): 572 – 579.
2. The Epidemiology of Revision Total Hip Arthroplasty in the United States Kevin J. Bozic, Steven M. Kurtz, Edmund Lau, Kevin Ong, Thomas P. Vail and Daniel J. Berry J Bone Joint Surg Am.
2009;91:128-133. doi:10.2106/JBJS.H.00155.
3. Andrej Trampuz and Andreas F. Widmer Infections associated with orthopedic implants. Review. Current Opinion in Infectious Diseases 2006, 19:349–356.
4. Blasi E., Ardizzoni A.: I microarray proteici: una sfida da raccogliere, 38° Congresso Nazionale AMCLI, Rimini 17-20 Novembre 2009, Atti del XXXVIII Congresso.
5. Andrej Trampuz and Andreas F. Widmer Infections associated with orthopedic implants. Review. Current Opinion in Infectious Diseases 2006, 19:349–356.
7. Biofilms: Survival Mechanisms of Clinically Relevant
Microorganisms Rodney M. Donlan1* and J. William Costerton Centers for Disease Control and Prevention, Atlanta, Georgia 30333,1 and Center for Biofilm Engineering, Montana State University, Bozeman, Montana 597172 Clinical microbiology reviews, Apr. 2002, p. 167–193 Vol. 15,No. 2.
8. Gillespie WJ: Prevention and management of infection after total joint replacement. Clin Infect Dis 2001; 33 Suppl S 94.
9. “Management of infection associated with total hip arthroplasty according to a treatment algorithm”. Giulieri SG, Graber P, Ochsner PE, Zimmerli W.) Infection 2004
10. Ivancevic V, Perka C, Hasart O, Sandrock D, Munz DL, Ivaneeviae V. Imaging of low-grade bone infection with a technetium-99m labelled monoclonal anti-NCA-90 Fab' fragment in patients with previous joint surgery. Eur J Nucl Med Mol Imaging 2002;29:54751.
11. Berbari EF, Hanssen AD, Duffy MC, et al. Risk factors for prosthetic joint infection: case-control study. Clin Infect Dis 1998; 27:1247-54.
12. Meehan AM, Osmon DR, Duffy MC, Hanssen AD, Keating MR. Outcome of penicillin- susceptible streptococcal prosthetic joint infection treated with debridement and retention of the prosthesis.
13. Tattevin P, Cremieux AC, Pottier P, Huten D, Carbon C. Prosthetic joint infection: when can prosthesis salvage be considered? Clin Infect Dis 1999;29:292-5.
14. Brandt CM, Sistrunk WW, Duffy MC, et al. Staphylococcus aureus prosthetic joint infection treated with debridement and
prosthesisretention. Clin Infect Dis 1997;24:914-9.
15. Infection after Total Hip Arthroplasty. Tsukayama et al. Journal of Bone and Joint Surgery 1996.
16. Interleukin-6, procalcitonin and TNF-α markers of peri-prosthetic infection following total joint replacement F. Bottner; A. Wegner; W. Winkelmann; K. Becker; M. Erren and C. Götze Journal of Bone and Joint Surgery 1998.
17. Synovial fluid leukocyte count and differential for the diagnosis of prosthetic knee infection. Trampuz et al., Patel R.Am J Med 2004.
18. Detection of prosthetic hip infection at revision arthroplasty by immunofluorescence microscopy and PCR amplification of the bacterial 16S rRNA gene. Tunney MM, Patrick S, Curran MD,