1
INDICE
INTRODUZIONE ... 3
SCOPO DELLA TESI ... 29
PAZIENTI, MATERIALI E METODI ... 30
RISULTATI ... 32
DISCUSSIONE ... 38
CONCLUSIONI ... 43
3
INTRODUZIONE
La prima descrizione di melanoma come entità a sé stante si attribuisce a René Laennec che nel 1812 pubblicò un articolo su “ Le Melanosi”. Da allora fu chiaro che le neoplasie melanocitarie, siano esse benigne o maligne, presentano variazioni caleidoscopiche di fenotipo.
Purtroppo, l‟incidenza di melanoma nel mondo è in continuo aumento con un tasso medio di circa 15 nuovi casi l‟anno x 100.000 abitanti (Australia : 40 x 100.000), con un incremento di circa 5-7% l‟anno, negli ultimi decenni.
Secondo l‟ISPO (Istituto per lo Studio e la Prevenzione Oncologica) in Italia si riscontrano 6500 nuovi casi ogni anno e 3.5 ogni 100 nuovi tumori sono melanomi; 25000 casi prevalenti (a 5 anni); 1600 decessi/anno; 2 ogni 100 decessi per tumore. (1)
I fattori genetici, l‟esposizione al sole e le scottature solari, la latitudine, la familiarità per il numero di nevi nei parenti di primo grado, il fototipo chiaro, la crescita corporea e lo stimolo ormonale sono implicati nel loro sviluppo e nelle modificazioni tipiche.
E‟ inoltre importante ricordare che il rischio di melanoma è aumentato nei soggetti con nevi congeniti giganti, nevi displastici, xeroderma pigmentoso e immunosoppressione (2).
Conoscere gli aspetti clinici e dermatoscopici delle lesioni melanocitiche è di fondamentale ausilio per evitare escissioni chirurgiche inutili.
La dermatoscopia digitale è considerata fondamentale nel follow-up di lesioni melanocitiche (3).
Nevi melanocitici tipici e atipici
I nevi melanocitici sono proliferazioni benigne di un tipo di melanocita conosciuto anche come “cellula nevica”. Possono essere congeniti o acquisiti, classici o atipici (displastici). Esistono molte varianti dei nevi melanocitici, come il nevo blu, il nevo di Spitz, il nevo di Reed e il nevo con alone che presentano caratteristiche cliniche, istologiche e molecolari diverse.
4 I nevi congeniti sono presenti alla nascita o compaiono nella prima settimana di
vita; i nevi melanocitici acquisiti invece cominciano a comparire dopo i primi 6 mesi di vita e aumentano progressivamente di numero durante l‟infanzia e l‟adolescenza; presentano un picco durante la terza decade e poi progressivamente tendono a regredire con l‟età (4, 5). I nevi acquisiti comuni tendono ad avere dimensioni minori di 6-8 mm di diametro e ad essere simmetrici, omogenei, di forma ovalare o rotondeggiante con bordi regolari. L‟esposizione solare è il principale fattore ambientale che influenza la comparsa di tali lesioni (6).
A seconda della distribuzione del pigmento, i nevi sono classificati in giunzionali, intradermici o composti. Infatti, volendo descrivere tutte queste lesioni come facenti parte di un unico processo evolutivo, è possibile ricostruire la storia naturale della formazione di questi nevi affermando l‟esistenza di una progressiva migrazione dei melanociti dalla giunzione dermo-epidermica fino al derma; in tal modo, i nevi assumono una pigmentazione più o meno intensa.
I nevi atipici sono nevi melanocitici benigni, acquisiti, che presentano alcune caratteristiche tipiche del melanoma (asimmetria, bordi irregolari, colore variabile e diametro maggiore di 6 mm).
La tendenza a sviluppare nevi atipici ha una base genetica e la diagnosi di nevo displastico può essere valida per una serie di diverse espressioni fenotipiche che vanno da individui con nevi multipli atipici in assenza di storia personale o familiare di melanoma fino alla sindrome FAMM (Familial Atypical Mole and Melanoma) definita in questo modo: 1) melanoma in uno o più familiari di primo o secondo grado; 2) elevato numero di nevi melanocitici (da 50 a 100), alcuni dei quali atipici clinicamente e melanociti che dimostrano atipia istologica (2).
La prevalenza dei nevi clinicamente atipici in una popolazione di soggetti di pelle chiara è circa il 2-10%.
I nevi atipici in genere compaiono durante la pubertà e continuano a svilupparsi durante la vita. Un aumento del loro numero totale è il principale indice predittivo della presenza di nevi clinicamente atipici.
Il colore dei nevi atipici è spesso variegato (rosa, marrone chiaro e scuro). Spesso tali lesioni presentano componenti maculari o papulari. I bordi si presentano irregolari e le dimensioni sono in genere maggiori di 5 mm. I nevi atipici rappresentano un marker fenotipico di pazienti ad elevato rischio di melanoma. Studi recenti basati su analisi genetiche hanno dimostrato che soggetti con
5 sindrome FAMM hanno un rischio di sviluppare melanoma durante la vita circa
del 70% (10). I nevi acquisiti possono presentare 3 diverse strutture demoscopiche (globulare, omogeneo e reticolare) o la combinazione di queste tre caratteristiche. Il pattern del nevo sembra essere influenzato dall‟età del paziente (7): il pattern globulare è tipico dei bambini e rappresenta meno del 10% dei nevi dell‟età adulta, il pattern reticolare, omogeneo e reticolare-omogeneo è invece tipico dei soggetti con più di 15 anni.
Il comportamento da tenere di fronte a queste lesioni richiede considerazioni personali sulla base delle caratteristiche cliniche e dermoscopiche e l‟eventuale associazione a fattori di rischio per il melanoma. In caso di nevo acquisito comune benigno con pattern globulare non è richiesto alcun trattamento. Se invece un paziente presenta un numero elevato di nevi, con caratteristiche di atipia o dimensioni maggiori a 5 mm è richiesto un follow-up annuale.
La epiluminescenza
La epiluminescenza è una metodica diagnostica non invasiva, che permette di studiare in vivo le lesioni cutanee pigmentate dell‟epidermide sino ed oltre la giunzione dermo-epidermica. Le strutture pigmentate presenti in questo ambito si manifestano sulla superficie della cute con variazioni della sua pigmentazione e la visione dermoscopica consente un‟osservazione ingrandita di tali variazioni, differenziandosi quindi dall‟istologia, che permette l‟osservazione ingrandita di sezioni di cute perpendicolari alla superficie cutanea. All‟epiluminescenza gli accumuli di melanina nel corneo appaiono in superficie di colore nero, la melanina della parte più bassa dell‟epidermide ha in superficie un colore marrone, mentre la melanina del derma papillare ha un colore blu.
L‟osservazione viene fatta appoggiando sulla cute, precedentemente coperta da un sottile strato di olio, l‟obiettivo di un microscopio con un‟angolazione di 20° circa. Tale accorgimento consente di rendere traslucido lo strato corneo eliminando la luce riflessa dalla superficie cutanea.
L‟epiluminescenza può essere eseguita sia con un microscopio semplice sia con microscopio composto. Il dermatoscopio è uno strumento monoculare dotato di una lampada alogena (2,5-3,5 V) per l‟illuminazione e di una lente sferica acromatica, che fornisce un ingrandimento fino a 10 volte della lesione analizzata.
6 Questo strumento, in virtù delle piccole dimensioni che ne consentono
l‟utilizzazione anche in distretti cutanei normalmente poco accessibili, risulta estremamente maneggevole per un esame rapido e routinario delle lesioni pigmentate cutanee. Tuttavia non consentendo una variazione dell‟intensità di luce utilizzata e dell‟ingrandimento, risulta poco adatto alla visione di lesioni molto pigmentate e non consente l‟archiviazione delle immagini, fatto questo indispensabile per l‟analisi retrospettiva e per il follow-up.
Lo stereomicroscopio, microscopio a epiluminescenza, microscopio a luce riflessa o anche microscopio a luce di superficie, è uno strumento complesso, composto da un sistema di supporto dove sono inseriti dei tubi binoculari snodabili alla cui sommità è situato il sistema ottico, costituito da un obiettivo intercambiabile di 10 lunghezze focali da 100 millimetri a 400 millimetri e oculari con correttore di diottrie. Con questo apparecchio l‟immagine può essere ingrandita fino a 40 volte, l‟intensità luminosa può essere modulata ed è possibile collegarla ad un sistema fotografico e/o ad una videocamera per consentire l‟archiviazione. Tale registrazione consente, qualora la lesione non venga asportata, di seguirne l‟evoluzione nel tempo. Questa possibilità è particolarmente importante in quanto permette di rimandare interventi che per varie ragioni non possono essere effettuati immediatamente, e nello stesso tempo di acquisire conoscenze sulla evolutività della lesione in esame. Si utilizza apponendo una goccia di olio e un vetrino portaoggetti sulla lesione da esaminare e successivamente si procede alla visione. Pur costituendo uno dei sistemi più precisi di valutazione delle strutture dermoscopiche, il costo elevato dell‟attrezzatura e la scarsa maneggevolezza costituiscono dei chiari limiti al suo impiego routinario.
Il videodermatoscopio, infine, è un sistema costituito da una telecamera a colori ad alta risoluzione, collegata ad una sonda a fibre ottiche capace, tramite diversi obiettivi, di ingrandire l‟immagine captata. Tale immagine viene digitalizzata da un convertitore di immagini e trasferita ad un personal computer. Con questa tecnica le lesioni cutanee appaiono di colorito reale, tridimensionali, e si può procedere all‟archiviazione e/o alla stampa delle immagini captate. L‟uso di programmi sofisticati, realizzati allo scopo, consente, un valido follow-up, e le periodiche comparazioni nel tempo delle immagini archiviate (8).
7 Il primo ad usare la microscopia ad epiluminescenza per indagare le lesioni
pigmentate fu Leon Goldman nel 1949 (9, 10). Tale studio fu ripreso nel 1971 da Rona McKie (14).
Mentre Frish e Pechlaner (12, 13), nel 1981, descrissero per primi il reticolo pigmentario nelle lesioni melanocitarie e nel 1987 Pehamberger, Steiner e Wolff (14, 15) dopo aver esaminato più di 3.000 lesioni, proposero un modello per l‟analisi delle lesioni cutanee pigmentate. Nel 1989 numerosi ricercatori crearono una nuova terminologia che ha incontrato il consenso unanime degli studiosi del settore per definire i caratteri morfologici delle lesioni (16).
La dermoscopia è stata poco utilizzata in dermatologia pediatrica per la rarità del melanoma prima della pubertà (17).
Aspetto dermatoscopico della cute normale
La cute normale ha una pigmentazione melanica più o meno intensa e variabile secondo il fototipo e l‟intensità della fotoesposizione. Può trattarsi di una pigmentazione uniforme, ma nelle sedi fotoesposte e nei soggetti con fototipo scuro, la pigmentazione può assumere un aspetto reticolato, simile a quello che si osserva nei nevi giunzionali. La pigmentazione è interrotta da linee più chiare, confluenti a formare un disegno romboidale. Nelle zone con peli si evidenziano delle aree ipocromiche tondeggianti che circondano il pelo. A livello delle superfici palmo-plantari si osserva il disegno dermatoglifico a creste e solchi paralleli. Alla sommità delle creste si possono osservare dei punti bianchi che rappresentano lo sbocco dei dotti sudoripari. Sempre a livello palmare si apprezzano delle linee più scure che corrispondono ai solchi articolari; a livello delle unghie si osservano linee parallele.
Diagnosi dermatoscopica
Il primo passo per una diagnosi dermatoscopica consiste nel differenziare le lesioni melanocitiche da quelle non melanocitiche. A questo scopo nel Consensus Net Meeting è stata proposta l‟utilizzazione di un algoritmo modificato (18) in accordo con Stolz (19), Kreusch (20) e Menzies (21), che prevede la presenza di
8 alcuni criteri necessari per inquadrare le lesioni come melanocitiche o non
melanocitiche.
Per classificare la lesione come melanocitica deve essere presente almeno uno dei seguenti caratteri dermoscopici: reticolo pigmentario, pseudoreticolo, globuli-punti, strie-pseudopodi, pigmentazione blu omogenea, pattern parallelo.
Rete di pigmento
E‟ una rete regolare costituita da linee brunastre su un fondo marrone chiaro. Le linee più scure della rete hanno per corrispettivo istologico le creste epidermiche, mentre gli spazi marroni chiari corrispondono alle papille dermiche. La presenza di un reticolo pigmentario localizzato, in dermoscopia, è espressione di una lesione melanocitaria. Se il reticolo è tipico, costituito cioè da una rete a maglie strette e regolari, distribuite regolarmente su tutta la lesione e in genere più sottile e sfumata alla periferia, siamo di fronte ad una lesione benigna. Se invece il reticolo è atipico, costituito cioè da maglie irregolari, ispessite, distribuite in maniera non omogenea nella lesione e che si interrompe bruscamente alla periferia, esso è espressione di melanoma. Irregolarità della rete si possono riscontrare anche nei nevi congeniti.
9 Punti, globuli e zolle
Sono strutture pigmentate focali di varia dimensione (punti le più piccole, zolle le più grandi), che corrispondono ad accumuli di melanina. Il colore di questi accumuli di pigmento melanico dipende dalla loro profondità: la melanina nel corneo appare in superficie di colore nero, la melanina della parte più bassa dell‟epidermide appare di colore marrone, mentre infine la melanina presente nel derma papillare assume in superficie un colorito grigio-bluastro. Se i globuli sono distribuiti regolarmente, prevalendo spesso al centro, e hanno forma e dimensioni uniformi, essi sono espressione di un nevo; se invece i globuli sono distribuiti irregolarmente, alla periferia e non hanno forma e dimensioni uniformi, sono espressione di melanoma. Un‟irregolare distribuzione dei globuli si può osservare anche nei nevi congeniti molto estesi.
Strie
Le strie sono strutture lineari indipendenti dalle linee del reticolo pigmentario, più evidenti in periferia, apparentemente convergenti verso il centro; le strie più spesse prendono il nome di pseudopodi, ma hanno lo stesso significato delle strie.
10 Sono espressione di teche di melanociti giunzionali con probabile distribuzione
tubulare. Strie distribuite regolarmente, di forma e dimensioni uniformi sono tipiche del nevo a cellule fusate ed epitelioidi, pigmentato di Reed. Strie distribuite irregolarmente sono espressione di melanoma. Eccezionalmente si possono trovare strie canalicolari o strie facenti parte di un pattern polimorfo in caso di nevi nevocellulari congeniti.
Velo blu biancastro
E„ una pigmentazione diffusa, confluente, sfumata, di colore dal grigio-bluastro al blu-biancastro, che rende poco visibili le strutture sottostanti ed è associata a strutture caratteristiche delle lesioni melanocitiche come rete e/o punti e/o globuli. Il velo blu-biancastro si trova nel nevo di Reed nel melanoma.
Da un punto di vista istologico il velo blu-biancastro è la combinazione di due alterazioni, una epidermica e l‟altra dermica superficiale: quella epidermica consiste in un‟acantosi con ipercheratosi compatta ortocheratosica e ipergranulosi più o meno evidente, mentre quella dermica consiste di una sottostante vasta area contenente melanociti o cellule neviche intensamente pigmentate e ravvicinate.
11 Iperpigmentazione
Si tratta di un‟area ipercolorata, da marrone scuro a grigio-nero, localizzata o diffusa, che rende poco riconoscibili altre strutture dermoscopiche, come rete, globuli e strie; è legata ad un accumulo di melanina nell‟epidermide o nel derma superficiale. Più importante dell‟estensione è la sua distribuzione: se irregolare, può essere espressione di melanoma.
Ipopigmentazione
L‟ipopigmentazione consiste in un‟area di diminuita pigmentazione, diffusa localizzata: quest‟ultima può essere isolata o multifocale. Istologicamente corrisponde a un diminuito contenuto di melanina nell‟epidermide e/o nel derma superficiale. Il significato clinico è modesto: una ipopigmentazione multifocale peripilare si riscontra anche nella cute normale con fototipo scuro e nel bambino è più evidente nei nevi nevocellulari congeniti superficiali, spesso intorno a peli ipertrofici.
12 Aree bianche e blu
Isolate o spesso associate, sono strutture di regressione suggestive per melanoma. Le aree bianche sono più o meno estese e ricordano l‟aspetto di una cicatrice superficiale. Le aree blu sono focali aree punteggiate o diffuse color grigio-blu o grigio. Il corrispettivo istologico delle aree bianche è la fibrosi del derma superficiale da regressione di una preesistente lesione melanocitaria, mentre le aree blu sono dovute ad accumuli di melanina e melanofagi nel derma superficiale.
Le aree bianche e blu sono talora indistinguibili dal velo, peraltro caratterizzato dall‟aspetto fumoso. Queste aree rappresentano la regressione di lesioni melanocitarie con fibrosi e fagocitosi della melanina e si riscontrano più frequentemente nel melanoma, ma anche in nevi displastici; le aree blu si possono riscontrare anche nella cheratosi lichenoide benigne e nella cheratosi attinica pigmentata.
13 Strutture vascolari
All‟esame dermoscopico è possibile e utile riconoscere aspetti diversi della trama vascolare. Per poterli osservare bisogna esercitare la minima pressione con il dermoscopio sulla lesione in caso di visione con interposizione di liquido.
Pseudocisti cornee
Sono strutture tondeggianti, bianche o bianco-giallastre, rifrangenti, di dimensioni variabili. Istologicamente corrispondono a globuli di cheratina. Queste strutture si ritrovano nelle cheratosi seborroiche e più raramente nei nevi dermici papillomatosi: eccezionale la loro presenza nel melanoma.
14 Sbocchi similcomedonici
Sono strutture rotonde od ovalari, nettamente delimitate, color marrone-giallastro o marrone-nero. Corrispondono istologicamente a tappi di cheratina all‟interno di follicoli piliferi dilatati; il loro colore è simile a quello dei comedoni aperti o punti neri. Come le pseudocisti cornee, si trovano nelle cheratosi seborroiche e più raramente nei nevi dermici papillomatosi.
Lacune rosse
Sono aree tondeggianti od ovalari, nettamente delimitate, di colore rosso o rosso scuro. Il loro corrispettivo istologico sono spazi vascolari dilatati situati nel derma superficiale. Si riscontrano negli angiomi, angiocheratomi ed ematomi subungueali e subcornei.
15 Chiazza bianca centrale
E‟ un‟area bianco-porcellanacea, rotonda od ovalare, ben delimitata, iscritta all‟interno di una lesione pigmentata marrone. Al suo interno si possono talora osservare punti-globuli di colore marrone chiaro. Non è precisato ancora il corrispettivo istologico della chiazza bianca, che è comunque patognomonica del dermatofibroma.
Aree a foglia d’acero
Sono chiazze marroni, grigio-marroni o grigio-nerastre che ricordano vagamente una foglia d‟acero. Istologicamente corrispondono a isolotti di cellule basali più o meno pigmentate presenti nel derma superficiale. Sono patognomoniche di carcinoma basocellulare, specie se associate a vasi arborizzati; raramente possono trovarsi alla periferia di un melanoma (22).
16
Differenziazione tra lesioni benigne e maligne
Dopo aver inquadrato la lesione pigmentaria come melanocitica, bisogna stabilire la benignità o malignità. A tale scopo sono stati proposti diversi metodi di valutazione quali l‟analisi del pattern e gli algoritmi diagnostici (23, 24). L‟analisi di pattern descritta nel 1987 da Pehamberger e colleghi e successivamente modificata prevede l‟analisi, mediante una valutazione iniziale, delle caratteristiche globali della lesione.
Il pattern globale può essere reticolare (lentigo simplex, nevo di Clark, nevo di Spitz), globulare (nevo di Clark, nevo di Spitz), omogeneo (nevo blu, nevo di Clark, nevo di Spitz), acciottolato (nevo dermico), starbust (nevo di Spitz, nevo di Reed), parallelo (nevi acrali), multicomponente (melanoma), aspecifico (melanoma).
Che colore vediamo?
Con alcune eccezioni, le lesioni pigmentate presentano 1 o 2 dei seguenti colori: nero, marrone, grigio e blu. Il colore rappresenta la localizzazione delle cellule pigmentate nella pelle (25).
Inoltre, possiamo rilevare aree biancastre legate alla regressione (nel melanoma, nell‟halo nevus ma anche nella lichenoid keratosis e nelle cicatrici) e aree rossastre legate all‟incremento di vascolarizzazione.
In caso di sanguinamento e formazione di croste, il colore va da rosso-nerastro a blu-nerastro.
17
Analisi del pattern
Pattern reticolare
Il pattern reticolare è caratterizzato da un sottile reticolo marrone che circoscrive spazi più chiari, estendendosi per quasi tutta la lesione. E‟ il corrispettivo istologico dell‟alternarsi di creste epidermiche e di papille dermiche, di cui rappresenta la proiezione in superficie. La lesione è melanocitica, presumibilmente con intensa presenza di melanociti in sede giunzionale.
Questo pattern si ritrova nella maggior parte dei nevi nevocellulari pianeggianti che insorgono dopo la pubertà, nelle lentiggini, nella lentigo solare, nel nevo di Becker, nel melanoma sottile e alla periferia di molti dermatofibromi. Una variante del pattern reticolare è lo pseudo reticolo del volto, costituito da maglie tondeggianti di diametro uniforme, che corrispondono a follicoli piliferi ravvicinati in assenza di creste epidermiche regolarmente alternate a papille dermiche: si osserva nelle lentiggini solari e nei nevi congeniti.
Pattern globulare
Il pattern globulare è caratterizzato dalla presenza di strutture pigmentarie tondeggianti od ovalari di diametro variabile e di colore che oscilla tra il marrone ed il grigio-nerastro. E‟ il pattern più frequente nei nevi dell‟epoca prepuberale e in quelli congeniti. I globuli sono l‟espressione di aggregati di melanina nell‟epidermide e/o nel derma papillare: la melanina può essere contenuta in cheratinociti, melanociti, cellule neviche superficiali, melanofagi o libera nello spazio extracellulare.
18 Le dimensioni dei globuli dipendono dall‟estensione degli aggregati, mentre il
loro colore dipende dalla loro profondità nella cute.
Pattern a zolle
Differisce dal pattern globulare per le maggiori dimensioni degli aggregati pigmentari che lo fanno somigliare a un selciato di pietra, di qui il nome di pattern ad acciottolato. Si può trovare nei nevi congeniti e in quelli acquisiti dermici. Per quanto riguarda il suo significato, vale quanto detto per i globuli, cioè il loro diametro dipende dall‟estensione degli aggregati di melanina e il loro colore dalla sede più o meno profonda in cui sono localizzati.
Pattern omogeneo
E‟ caratterizzato da una pigmentazione diffusa a limiti abbastanza netti di colorito marrone, grigio-bluastro, grigio-nero o grigio-rossastro, in assenza di reticolo pigmentario o di altri parametri dermoscopici locali chiaramente identificabili. Il pattern omogeneo di colorito blu è caratteristico del nevo blu. Questo pattern si può trovare anche in nevi dermici, nel melanoma nodulare e metastatico, negli ematomi sub ungueali, negli angiomi trombizzati, nel carcinoma basocellulare pigmentato e nei tatuaggi.
19 Pattern ad esplosione stellare
Il pattern starbust è caratterizzato da strie pigmentate radiali alla periferia di una lesione pigmentata. Esso è caratteristico del nevo di Reed, ma anche il melanoma può assumere un aspetto simile. Le strie corrispondono a teche giunzionali di melanociti pigmentati. La forma allungata e lineare delle strie corrisponde probabilmente a teche giunzionali di melanociti pigmentati formanti strutture tubulari, parallele alla superficie della cute.
Pattern parallelo
Si trova esclusivamente nelle lesioni melanocitarie della regione palmo-plantare ed è dovuto al maggior spessore del corneo in queste sedi con accentuazione del disegno a solchi e rilievi, che costituiscono i dermatoglifi. In corrispondenza dei rilievi si vedono dei punti bianchi distribuiti in maniera lineare e separati da regolari intervalli che corrispondono allo sbocco dei pori sudoripari.
20 Pattern polimorfo
Il pattern polimorfo è caratterizzato dalla coesistenza di tre o più strutture demoscopiche diverse, come aree di reticolo, accumuli focali di globuli e aree di iper- o ipopigmentazione. Si trova facilmente nei nevi congeniti in età pediatrica, ma anche nei melanomi.
Pattern lacunare
Il pattern lacunare è caratterizzato dalla presenza di alcune strutture a limiti netti di colorito rosso ed è tipico degli angiocheratomi. Differenziare una struttura vascolare da una lesione melanocitaria è a volte difficile clinicamente, ma facile con l‟aiuto del dermatoscopio.
Pattern aspecifico
Una lesione pigmentata della cute presenta talora un profilo dermoscopico dominante che non è compreso in nessuno dei pattern precedenti: in questo caso si può parlare di pattern aspecifico. Esso può essere espressione di melanoma.
21
Algoritmi diagnostici
Algoritmo di Stolz
L‟algoritmo di Stolz è il più utilizzato. E‟ un algoritmo semiquantitativo introdotto nella pratica dermatoscopica al fine di semplificare la diagnosi differenziale tra lesioni benigne e maligne. Con tale metodo viene assegnato alle lesioni uno score in base al quale le lesioni sono classificate in benigne, sospette e maligne. Esso utilizza i seguenti criteri:
A: asimmetria,
B: bordi interrotti bruscamente, C: colore,
D: differenti strutture (reticolo, punti neri, globuli marroni, strie radiali, pigmentazione omogenea),
E: evoluzione.
In base a tale algoritmo si ottiene, mediante moltiplicazione dei punteggi parziali con fattori di correzione, un punteggio dermoscopico totale identificativo della natura della lesione. La sensibilità diagnostica di tale algoritmo è risultata del 92.8%, con un‟accuratezza diagnostica pari all‟80%.
Altri algoritmi recentemente descritti in letteratura sono invece caratterizzati dalla separazione a fini diagnostici tra caratteri dermoscopici maggiori e minori.
Algoritmo “seven point check list”
Secondo l‟algoritmo definito “seven point check list” sono da considerare criteri maggiori per la diagnosi demoscopica di melanoma i seguenti parametri: reticolo pigmentario atipico (cioè irregolare o prominente), aree grigio-blu e pattern vascolare atipico; a ciascuno di tali parametri viene attribuito un punteggio uguale a 2. I criteri minori (punteggio uguale a 1) sono estroflessioni raggiate (pseudopodi o strie radiali), pigmentazione diffusa a zolle distribuite irregolarmente, globuli o punti irregolari e pattern di regressione (area bianca similcicatriziale o peppering). Secondo questo algoritmo un punteggio
22 complessivo pari o superiore a 3 è indicativo di melanoma con una sensibilità del
95% e un‟accuratezza diagnostica del 64%.
Nell‟aprile 2011 tale Algoritmo “seven point check list” è stato rivisitato, attribuendo ad ogni criterio dermatoscopico un punteggio pari ad 1. In questo caso un punteggio complessivo pari a 1, non più a 3, è indicativo di melanoma.
E‟ comunque necessario correlare la diagnosi di nevi e melanomi all‟attuale contesto clinico, nel quale i pazienti potrebbero avere un melanoma nelle prime fasi di crescita, ma indistinguibili dalle altre lesioni benigne.
Tuttavia, per ottimizzare lo screening del melanoma, la diagnosi dovrebbe tener conto di diversi fattori\variabili, includendo le caratteristiche cliniche e dermatoscopiche, un approccio comparativo, ed il follow up dei pazienti. (26)
L‟impiego degli algoritmi diagnostici è da considerarsi vantaggioso rispetto all‟analisi dei pattern soprattutto nel caso di osservatori non molto esperti nella
CRITERI
PUNTEGGIO
RIVISITATO
Pattern vascolare atipico
2
1
Criteri minori
Strutture di regressione
1
1
Strie irregolari
1
1
Pigmentazione irregolare
1
1
Velo grigio/blu
2
1
Punti/globuli irregolari
1
1
Criteri maggiori
23 diagnosi dermoscopica del melanoma, risultando di più facile apprendimento
24
Melanoma maligno
Il melanoma cutaneo è una neoplasia maligna che prende origine dai melanociti della cute sana (80% del casi circa) o da quelli presenti in un nevo melanocitico (20% dei casi circa), congenito o acquisito (27).
Di conseguenza, i nevi melanocitici sono potenziali precursori del melanoma e rappresentano il più importante fattore di rischio per lo sviluppo di tale malattia tra i bambini e gli adulti (28; 29).
FATTORI DI RISCHIO
I fattori di rischio per lo sviluppo del melanoma possono essere di tipo individuale e di tipo ambientale.
Fattori di rischio di tipo individuale:
- storia familiare di melanoma: è stato riscontrato che nel 6-14 % dei casi di melanoma è dimostrabile una condizione di familiarità (definita come presenza della neoplasia in almeno 2 componenti delle ultime 3 generazioni) (30, 31) e che i geni coinvolti sono CDKN2A e CDK4;
- storia personale di melanoma;
- caratteri fenotipici della cute: il melanoma è più frequente nei soggetti con cute chiara, con capelli biondi o rossi, con occhi azzurri, con numerose efelidi e, pertanto, di fototipo I e II;
- lentiggini per ustioni solari, specie se contratte in età infantile; - nevi melanocitici connatali, quando di diametro superiore a 20 cm;
- nevi melanocitici clinicamente atipici (nevi displastici), quando in numero superiore a 5;
- nevi melanocitici comuni, quando molto numerosi (oltre 50); - xeroderma pigmentoso;
- immunosoppressione: il melanoma è più frequente nei trapiantati renali e, forse, nei soggetti con sindrome di immunodeficienza acquisita;
25 Fattori di rischio di tipo ambientale o legati agli stili di vita:
- esposizione al sole: soprattutto quella intensa e intermittente, che causa ustione, e non quella cronica (ad esempio, per ragioni professionali), con l‟eccezione verosimile della lentigo maligna;
- esposizione a sorgenti artificiali di radiazioni ultraviolette di tipo prevalentemente A (lampade e lettini solari);
- uso di creme fotoprotettive, quando ciò induce a prolungare i tempi di esposizione giornaliera al sole.
Relativamente a ormoni estrogeni e progestinici, dieta, vitamine, oligoelementi, farmaci e fumo, non ci sono dati sicuri.
Un cenno a parte meritano i dati riguardanti la correlazione dell‟incidenza del melanoma con l‟esposizione ai derivati del petrolio ed al benzene (32-34) e il dato dell‟ulteriore progressione nella storia clinica del melanoma a causa di oncogeni attivati da cancerogeni noti quali il benzene (35-37).
Per ultimo è stato riferito che le diossine, così come tutti gli agenti ipermetilanti, hanno ruolo di promozione della progressione tumorale in linee di melanoma, agendo probabilmente anche come agenti bloccanti la possibile reazione immunitaria dell‟ospite nei confronti del tumore (38-41).
I criteri da tener presente e che devono fare sospettare la presenza di una lesione potenzialmente maligna sono i seguenti: reticolo pigmentario irregolare, ispessito, slargato e bruscamente interrotto, strie radiali, pseudopodi ed estensioni irregolari, velo blu-biancastro, aree di regressione quali aree grigio-bluastre e aree biancastre di fibrosi, pattern vascolare atipico e pigmentazione irregolare (42).
In un report di Boddie, la più frequente manifestazione clinica del melanoma includeva un aumento delle dimensioni del nevo, il sanguinamento, il cambiamento di colore, la sensazione di prurito, la presenza di adenopatia locoregionale e la formazione di una massa palpabile sottocutanea (43).
In un altro studio di Saenz, l‟85% dei pazienti riferivano la recente crescita, il dolore, il sanguinamento, l‟ulcerazione e il cambiamento di colore (44).
26 Il melanoma cutaneo può insorgere sulla cute sana “de novo” (80% dei casi) o su
un nevo melanocitico preesistente, acquisito o congenito.
L‟aspetto clinico del melanoma è legato alla sua fase di sviluppo e, almeno in parte, al suo istotipo, e può variare significativamente durante la sua progressione. Tradizionalmente, e secondo l‟O.M.S., si distinguono 4 tipi principali di melanoma:
- melanoma a diffusione superficiale (Superficial Spreading Melanoma o SSM);
- melanoma nodulare (Nodular Melanoma o NM); - lentigo maligna melanoma (LMM);
- melanoma lentigginoso acrale (Acral Lentiginous Melanoma o ALM).
Melanoma a diffusione superficiale o SSM
Il melanoma a diffusione superficiale rappresenta circa il 70% dei melanomi nella razza caucasica, insorge su cute fotoesposta, più comunemente al dorso negli uomini e agli arti inferiori nella donna, durante la IV-V decade di vita.
Si presenta come una macchia, di colorito marrone o nerastro, spesso disomogenea, con margini netti ma irregolari, inizialmente non palpabile, le cui caratteristiche, al momento della diagnosi, corrispondono spesso a quelle indicate nell‟acronimo ABCDE (45).
La lesione si estende lentamente, centrifugamente (fase di crescita
orizzontale), diviene quindi palpabile e rilevata (fase di crescita verticale).
Melanoma nodulare o NM
Rappresenta circa il 25% di tutti i melanomi, è più frequente negli uomini, si localizza più comunemente al capo, al collo ed al tronco, durante la V-VI decade di vita.
Si presenta generalmente come una lesione papulo-nodulare, rilevata, simmetrica, di colorito omogeneo, nero o bluastro, talvolta rosso o del colorito della cute normale, di consistenza soda o carnosa (46).
La lesione evolve più rapidamente del melanoma a estensione superficiale, divenendo sempre più grande e rilevata (fase di crescita verticale, senza apparente fase di crescita orizzontale), ed assume spesso l‟aspetto di nodulo ulcero-crostoso.
27 In questa forma, l‟ABCDE non è utile; i criteri semeiologici della lesione nodulare
possono essere parzialmente riassunti con l‟acronimo inglese EFG: E = Elevated (rilevata);
F = Firm (soda);
G = Growing progressively (crescita progressiva).
Lentigo maligna melanoma
Rappresenta il 10-15% di tutti i melanomi cutanei; si localizza alle sedi fotoesposte, in particolare volto e collo, di soggetti anziani (70-80 anni).
Si presenta come una macchia di colorito marrone e/o nerastro, asimmetrica, a margini netti e contorni frastagliati, che si estende molto lentamente, sino a raggiungere diversi centimetri di diametro. Dopo 5-15 anni di crescita radiale, possono comparire lesioni papulose o nodulari, a superficie spesso erosa, espressione clinica di una fase di crescita verticale.
Melanoma lentigginoso acrale
È il più raro nella razza caucasica, con una prevalenza del 3-5%. Interessa le regioni palmo-plantari, con aspetti clinici molto simili al melanoma ad estensione superficiale ed alla lentigo maligna melanoma.
Si presenta quindi come una macula, di colorito variabile, dal roseo brunastro al grigio-nerastro, a bordi irregolari, che aumenta progressivamente di dimensioni e su cui possono nel tempo comparire papule e noduli, anche qui espressione di fase di crescita verticale.
Il melanoma subungueale (47), una variante del melanoma lentigginoso acrale, deriva dalla matrice ungueale e si manifesta come una banda longitudinale pigmentata, bruno-nerastra, che interessa tutta la lamina fino alla piega ungueale prossimale e alla cuticola (segno di Hutchinson). In fase avanzata, la lesione si ulcera e causa distrofia ungueale.
Melanoma desmoplastico
Non tutti i melanomi possono essere ricondotti a questa classificazione; esistono alcune rare varianti di difficile diagnosi clinica, tra cui ricordiamo brevemente il melanoma desmoplastico.
28 Il melanoma desmoplastico si presenta de novo o su una lentigo maligna come
una lesione nodulare, dura, di colorito roseo o della cute normale (melanoma amelanotico), localizzata prevalentemente nell‟area testa-collo, in soggetti di sesso maschile, dell‟età di 50-60 anni.
Melanoma su nevo melanocitico acquisito
La diagnosi in questi casi è difficile e si basa su modifiche di una preesistente lesione nevica, che vengono generalmente segnalate dal paziente. I segni cui prestare attenzione sono:
- rapido aumento di dimensioni;
- modificazioni del colore e della forma;
- comparsa di una lesione papulosa o nodulare nel contesto del nevo; - presenza di aree erosivo-crostose;
- prurito persistente.
Melanoma su nevo congenito
L‟associazione tra nevi congeniti e melanoma è controversa, in quanto non esistono dati statistici significativi relativi ai nevi congeniti di piccole e medie dimensioni. Nei pazienti affetti da nevi melanocitici congeniti giganti, invece, è certo l‟aumento di rischio (2-5%) di sviluppare melanoma, nel contesto o al di fuori del nevo stesso, nella prima decade di vita.
29
SCOPO DELLA TESI
Scopo del nostro studio è di correlare l‟incidenza del melanoma, nella Clinica Dermatologica di Pisa, con i vari istotipi al fine di verificare se la crescita dei tassi d‟incidenza osservata in questi ultimi anni sia legata alle forme a diffusione superficiale e non alle altre, e di valutarne il rapporto con il sito anatomico.
30 PAZIENTI, MATERIALI E METODI
Pazienti:
Sono stati inclusi nel nostro studio un totale di 165 lesioni con diagnosi istologica di melanoma, 88 maschi e 77 femmine, di età compresa tra 14-91 anni (età media 56,17 aa) giunti tra Gennaio 2006 e Maggio 2011 presso l‟Ambulatorio Chirurgico dell‟Unità Operativa di Dermatologia di Pisa.
Materiali e metodi:
Abbiamo condotto uno studio retrospettivo delle lesioni risultate essere, all‟esame istologico, dei melanomi.
I referti istologici del nostro studio, compresi tra il Gennaio 2006 ed il Maggio 2011, sono stati ripresi dagli archivi dell‟Unità Operativa di Dermatologia di Pisa. Ogni lesione era stata sottoposta a metodo analitico qualitativo (analisi di pattern); (48) .
I pazienti sono stati suddivisi in gruppi in base all‟età: <25 anni; 25-44 anni; 45-64 anni; >65 anni; in base al sito anatomico di comparsa della lesione: testa/collo, tronco, arti superiori, arti inferiori e sedi acrali.
Sono stati inoltre valutati in base alla diagnosi istologica: melanoma a diffusione superficiale a crescita verticale, a crescita radiale, melanoma nodulare, melanoma in situ, lentigo maligna melanoma.
Le diagnosi istologiche dei 165 casi arruolati nel nostro studio, compresi tra il Gennaio 2006 ed il Maggio 2011, sono stati ripresi dagli archivi dell‟ Istituto di Anatomia Patologica dell‟ Università di Pisa.
Abbiamo utilizzato sezioni, dello spessore di 5μ ottenute dai blocchetti in paraffina, sezioni che sono state colorate con Ematossilina-Eosina.
Sono state fatte ulteriori sezioni per reazioni immunoistochimiche con anticorpi contro la proteina S-100, anticorpi per HMB 45, Melan-A e Tirosinasi.
31 S-100 è una proteina che appartiene alla famiglia dei Calcium-binding protein
largamente presente nel SNC dei vertebrati, nei melanociti normali, cellule di Langerhans, istiociti, condrociti, lipociti, muscolo cardiaco e scheletrico, cellule di Schwann, cellule epiteliali e mioepiteliali della mammella, ghiandole salivari e sudoripare, e cellule gliali. Anche le neoplasie derivate da queste cellule esprimono proteina S100, sebbene in modo non uniforme. Un grande numero di tumori differenziati di ghiandola salivare, tessuto adiposo e cartilagineo e di neoplasie derivate dalle cellule Schwann esprimono proteina S100. Quasi tutti i nevi, i melanomi maligni e i casi di istiocitosi X sono positivi. Nonostante la proteina S100 sia una sostanza ubiquitaria, la sua presenza è di grande valore nell‟identificazione di diverse neoplasie ed in particolare per nevi e melanomi. l‟ HMB45 è una glicoproteina localizzata nei premelanosomi di conseguenza l‟ anticorpo è diretto verso i melanociti immaturi o attivati mentre si riscontra più raramente nelle cellule neviche, inizialmente si considerava un marker sicuro per il melanoma ma in seguito si è dimostrato presente in una varietà di lesioni melanocitarie benigne come nevo blu e melanosi intradermiche.
Melan-A è una proteina presente sulla membrana dei melanosomi .
Tirosinasi è un enzima implicato nella sintesi della melanina ed è quindi espressa specificamente nelle cellule che producono pigmento.
Le indicazioni all‟exeresi chirurgica si sono basati su criteri clinici e dermatoscopici come l‟aspetto di atipia o di lesione spitzoide, la rapidità di comparsa e/o di crescita, il sanguinamento, il dolore, il prurito, i nevi in sedi difficilmente monitorabili o l‟esposizione frequente al traumatismo (49).
La terapia chirurgica ha seguito le recenti linee guida (48) includendo 2 mm di margine di cute sana.
32
RISULTATI
Abbiamo valutato un totale di 165 lesioni in 165 pazienti, 88 maschi e 77 femmine, di età compresa tra 14 e 91 anni (età media 56,17 aa), asportate chirurgicamente.
Le lesioni erano localizzate al tronco in 84 casi (pari al 50,90%), agli arti superiori in 18 (10,90%), agli arti inferiori in 34 (20,60%), al capo e collo in 23 (13,93%), alle sedi acrali in 6 (3,63%). (Fig.1)
Tronco Arti superiori Arti inferiori Capo/collo Sedi acrali Figura 1
33 L‟esame istologico di tali lesioni evidenziava 87 melanomi a diffusione
superficiale e crescita verticale (52,72%), 19 melanomi a diffusione superficiale e crescita radiale (11,51%), 22 melanomi nodulari (13,33%), 12 melanomi in situ (7,27%), 12 lentigo Maligna Melanoma (7,27%), 4 melanomi desmoplastici (2,42%), 3 melanomi in regressione (1,81%), 4 metastasi di melanoma (2,42%) e 2 melanomi acrali lentigginosi (1,21%). (Fig.2)
0 10 20 30 40 50 60 70 80 90 N M ELA N OM I Tipi istologici Figura 2 M.diff.sup. a crescita verticale
M.diff.sup.a crescita radiale
M.nodulare
Lentigo Maligna Melanoma
M.in situ
M.acrale lentigginoso
34 In questa serie di 87 melanomi a diffusione superficiale a crescita verticale 54
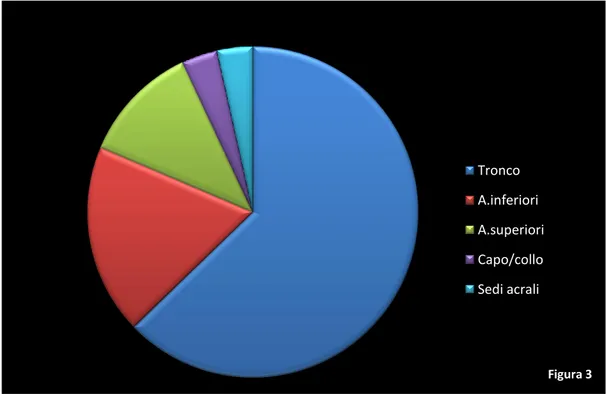
erano localizzati al tronco (pari al 62,06%), 16 agli arti inferiori (18,39%), 10 agli arti superiori (11,49%), 3 in sede acrale (3,44%) e 3 al capo/collo (3,44%) (Fig.3).
Figura 3 Tronco A.inferiori A.superiori Capo/collo Sedi acrali
35 Dei 19 melanomi a diffusione superficiale a crescita radiale 5 erano localizzati
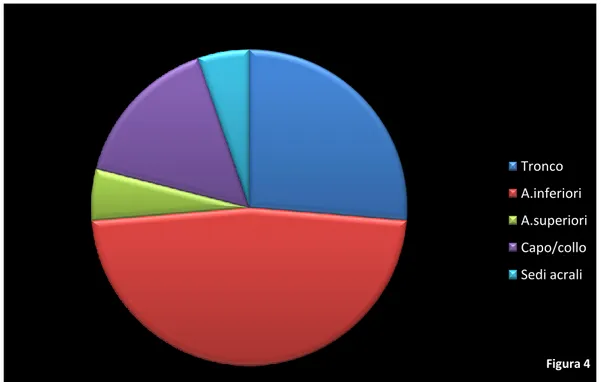
al tronco (26,31%), 9 agli arti inferiori (47,36%), 1 agli arti superiori (5,26%), 3 al capo/collo (15,78%) e 1 in sede acrale (5,26%). (Fig.4)
Dei 22 melanomi nodulari 5 risultavano localizzati al capo/collo (22,72%), 11 al tronco (50%), 2 agli arti superiori (9,09%) , 3 agli arti inferiori (13,63%) (Fig.5).
Figura 4 Tronco A.inferiori A.superiori Capo/collo Sedi acrali Figura 5 Tronco A.inferiori A.superiori Capo/collo Sedi acrali
36 Dei 12 melanomi in situ, 1 era localizzato al capo\collo (8,33%), 5 al tronco
(41,66%), 2 agli arti inferiori (16,66%), 3 agli arti superiori (25%) ed 1 in sede acrale (8,33%) (Fig.6).
Delle 12 Lentigo Maligna\Melanoma 10 erano localizzate al capo\collo (83,33%) e 2 agli arti superiori (16,66%) (Fig.7).
Figura 6 Tronco A.inferiori A.superiori Capo/collo Sedi acrali Figura 7 Tronco A.inferiori A.superiori Capo/collo Sedi acrali
37 La distribuzione delle diagnosi istologiche più frequenti e rilevanti correlate con i
differenti siti d‟insorgenza e al sesso sono riassunte nella TABELLA 1
La distribuzione dei siti d‟insorgenza e delle fasce d‟età più frequenti e rilevanti correlate al sesso sono riassunte nel Grafico 1
Grafico 1
Tipo
Frequenza, %
Sito
Maschi
Femmine
D.S.cr. verticale
52,72
Tronco
39
48
D.S.cr.radiale
11,51
Arti inferiori
9
10
Nodulare
13,33
Tronco
18
4
Lentigo maligna
melanoma
7,27
Capo/collo
7
5
In situ
7,27
Tronco
4
8
…altri…
38
DISCUSSIONE
I melanomi sono tumori maligni che si sviluppano dai melanociti.
Da diverso tempo l‟incidenza è in aumento, raddoppiando ogni 10 anni nelle nazioni che la rilevano.
La terapia del melanoma è l‟asportazione chirurgica e la diagnosi di certezza è meramente istologica (50).
Le interpretazioni istogenetiche del melanoma proposte da Wallace Clark e colleghi si uniformano alla teoria bifasica secondo la quale i melanomi evolvono in un primo tempo “orizzontalmente”, formando una lesione stratificata sopra la membrana basale (fase intradermica, senza rischio di metastasi), e quindi nel derma superficiale (fase microinvasiva); ed in un secondo tempo “verticalmente”, penetrando profondamente nel derma (fase invasiva, ad alto rischio metastatico) (51).
La ben nota e diffusa classificazione anatomo-clinica tenta di ricondurre l‟infinità dei profili evolutivi del melanoma a quattro grandi varietà di melanoma (50) tenendo conto dell‟istopatologia, della sede anatomica e del grado di danno solare:
- Melanoma a diffusione superficiale (SSM), - Lentigo maligna melanoma (ALM)
- Melanoma acrale lentigginoso (ALM)
- Melanoma nodulare (NM), per cui è stata proposta una categoria a parte perché non presenta una significativa fase di crescita radiale.
Il melanoma a diffusione superficiale è il più comune (70%) in persone di pelle bianca.
Sorge più di frequente sulla parte superiore della schiena e si presenta come una lesione moderata a lenta crescita per un periodo fino a 2 anni.
La crescita radiale porta clinicamente ad una macchia ben circoscritta con toni variegati del marrone, grigio e nero, in cui successivamente si sviluppa un nodulo (fase di crescita verticale, VGP).
Istopatologicamente il segno rivelatore di melanoma a diffusione superficiale è la presenza di melanociti allargati, spesso organizzati come piccoli aggregati o nidi, che mostrano una marcata dispersione verso l'alto all'interno dell'epidermide, un modello denominato "pagetoide", in quanto ricorda la diffusione
39 intraepidermica del tumore al seno nell'epidermide del capezzolo (malattia di
Paget). (52)
In accordo con i dati presenti in letteratura, anche nel nostro studio è risultato essere il melanoma di più frequente riscontro con 106 lesioni (87 melanomi a diffusione superficiale e crescita verticale, 52,72% del totale, e 19 melanomi a diffusione superficiale e crescita radiale, 11,51% del totale) pari al 64,23 % di tutte le lesioni maligne asportate.
I melanomi a diffusione superficiale e a crescita verticale interessano prevalentemente il tronco di entrambi i sessi ma mentre nei pazienti di sesso maschile è più frequente nel gruppo d‟età compresa tra i 45 e 64 anni, nei pazienti di sesso femminile tra i 25 e 64 anni.
I melanomi a diffusione superficiale e a crescita radiale mostrano, invece, come sito prevalente gli arti inferiori di 9 maschi (con picco tra 25 e 44 anni) e 10 femmine (tra 45 e 64 anni).
Il melanoma nodulare è secondo per frequenza, dopo il melanoma a crescita superficiale.
Compare in gran parte intorno ai 50 anni di età nelle persone con pelle bianca e, come il melanoma a diffusione superficiale in sedi anatomiche meno frequentemente esposte alle radiazioni solari.
Il tumore, fin dall‟inizio, è in fase di crescita verticale.
Si presenta come una lesione papulosa o nodulare, rilevata sul piano cutaneo, talora con aspetto polipoide.
Di colorito brunastro o nero-bluastro, ma il pigmento può essere in parte o del tutto assente (melanoma amelanotico).
E‟ l'unico tipo di melanoma primario che cresce molto rapidamente (12 mesi-2 anni) da cute normale o da un nevo melanocitico con crescita nodulare (verticale) senza una componente adiacente epidermica, come è sempre evidente nel melanoma a diffusione superficiale e nella lentigo maligna melanoma (52).
Questo è evidente anche nel nostro studio in cui i 22 melanomi nodulari (pari al 13,3% del totale) sono di più frequente riscontro in entrambi i sessi al tronco, con età superiore ai 45 anni, con andamento crescente in funzione dell‟età nel sesso maschile.
40 Le caratteristiche cliniche del melanoma in situ non sono sempre evidenti in
modo chiaro.
E‟ principalmente una definizione istopatologia, ed il termine è utilizzato quando le cellule del melanoma sono confinate nell‟epidermide, al di sopra della membrana basale; atipie melanocitiche delle cellule dello strato basale, iperplasia e diffusione avvengono sia in singole file di allineamento lungo la membrana basale o sono distribuite in tutta l'epidermide (distribuzione pagetoide). Ogni melanoma inizia come una lesione in situ, ma il Melanoma in situ è diagnosticabile solo quando la fase di crescita radiale è abbastanza lunga da diventare percepibile visibilmente.
Tali lesioni sono piatte, non palpabili, sono visibili con elevazione appena percettibile, con bordi irregolari; colore variegato, disomogeneo con aree di colorito marrone, brunastre e nere, ma con assenza di grigio o blu, indice di pigmento a livello dermico.
La distinzione clinica tra melanoma in situ e nevo atipico potrebbe non essere possibile (52).
Tra i dati in nostro possesso solo 12 lesioni maligne (pari al 7,27%) sono state diagnosticate come melanomi in situ, prevalentemente localizzati al tronco nel sesso maschile (con picco >45 anni) e nel sesso femminile (con due picchi: tra i 25 e i 44 anni e >65 anni).
La lentigo maligna melanoma, la meno comune dei 4 tipi di melanoma (<5%), compare in persone anziane ed in aree foto esposte come viso ed avambraccio. Il sole è il più importante fattore patogeno.
La lentigo maligna melanoma inizia sempre come lentigo maligna, che rappresenta una neoplasia intraepidermica maculare (un melanoma in situ). Non è quindi un precursore, ma una lesione in evoluzione.
Aree papulari e nodulari circoscritte segnano il passaggio da una fase di crescita radiale ad una fase di crescita verticale, per arrivare all'invasione nel derma; la lesione è ora chiamata lentigo maligna melanoma (52).
Tali dati sono in accordo con quanto da noi rilevato, in quanto abbiamo riscontrato tali lesioni in 12 casi pari al 7,27% del totale, con prevalente interessamento del capo di entrambi i sessi, ma, con evidente età superiore (>65 anni) nei soggetti di sesso maschile rispetto a quelli di sesso femminile (>45 anni).
41 Le cause potrebbero essere fatte risalire ad una maggior abitudine, da parte delle
donne, ad una foto esposizione non controllata fin da giovane età per motivi estetici e anche alla maggiore attenzione da parte del sesso femminile a eventuali neoformazioni localizzate al volto.
Il melanoma acrale lentigginoso è una presentazione speciale del melanoma cutaneo derivante dalla pianta, palmo, unghie o letto ungueale.
Si riscontra più spesso negli asiatici, africani sub-sahariani, e afro-americani, e comprende il 50-70% di tutti i melanomi in queste popolazioni.
Si verifica più spesso nei soggetti di sesso maschile di età avanzata e cresce lentamente in anni.
Il ritardo nello sviluppo del tumore è la ragione per cui queste lesioni sono frequentemente scoperte solo quando compaiono noduli o, nel caso di coinvolgimento ungueale, quando l‟unghia è caduta, la prognosi è infausta (52). Nel nostro lavoro abbiamo riscontrato una percentuale tanto bassa di questo tipo di lesioni da non renderla rilevante ai fini della discussione.(Tabella1 e Grafico 2).
42 Diversi sono gli studi di incidenza del melanoma cutaneo invasivo per sede
condotti in tutto il mondo, in periodi diversi, ed i nostri risultati mostrano che l‟attuale distribuzione anatomica del melanoma cutaneo appare simile agli altri paesi con predominanza di popolazione di pelle chiara (53).
Abbiamo notato come, nel corso degli anni presi in considerazione, l‟incidenza sito-specifica non sia cambiata per sedi tipiche come il tronco mentre ci sia una riduzione delle lesioni agli arti inferiori, con prevalenza nel sesso femminile, da attribuire ad una probabile maggiore informazione e compliance alle campagne di prevenzione secondaria (Tabella 2)
Da segnalare inoltre l‟importanza di una buona anamnesi in quanto gli usi e costumi della popolazione stanno cambiando, come la frequenza di vacanze in località esotiche durante tutto l‟arco dell‟anno, le tendenze di vestiario che mettono a nudo distretti che usualmente non venivano fotoesposti, la consuetudine all‟utilizzo di lampade solari fin dalla più giovane età, che è risultato essere un significativo fattore di rischio dose-dipendente per il melanoma, comportando anno dopo anno delle modifiche delle sedi a rischio, che il dermatologo accorto non deve sottovalutare (53).
Tabella 2
M F M F M F M F M F M F Testa/collo 3 3 5 - 2 1 1 1 1 - 3 1 Tronco 10 5 10 6 13 4 13 10 4 5 3 - Arti superiori 1 1 3 3 3 2 1 - 2 2 1 -Arti inferiori 1 9 2 4 - 1 1 2 1 3 2 1 Sedi acrali 1 1 - - 1 - - 1 - - - 1 2011 2008 2009 2010 SEDE 2006 2007
43
CONCLUSIONI
Concludendo, il melanoma rappresenta un gruppo di diversi tipi di malattia. Diversi sottotipi che stanno emergendo mostrano differenze nella loro distribuzione anatomica, età di insorgenza, rapporto alle radiazioni UV, e tipo di mutazioni somatiche.
Studi futuri dovranno affinare i confini tra questi sottotipi, e forse distinguere sottotipi supplementari e comprendere meglio il percorso di progressione da lesioni precursore al melanoma manifesto.
Anche se incompleti, i sottotipi delineati nel nostro studio possono già fornire una guida pratica per la gestione dei pazienti e per l'interpretazione dei risultati della ricerca.
A causa delle differenze sorprendenti tra alcuni dei sottotipi di melanoma appare ovvio che debbano essere considerate separatamente anche le linee guida o le raccomandazioni per la prevenzione, terapia e prognosi del melanoma, contrariamente a ciò che accade attualmente in cui il melanoma viene considerato come fosse un'entità singola di malattia (51).
La lotta al Melanoma si basa sulla prevenzione secondaria, enfatizzando i danni da esposizione a radiazioni UV (sia outdoor durante le vacanze sia indoor con lettini solari).
Sono importantissime le campagne nazionali e locali che si prefiggono lo scopo di diagnosticare precocemente ed asportare, se necessario, lesioni melanocitiche atipiche passibili di degenerazione e hanno inoltre l‟obiettivo di sensibilizzare l‟opinione pubblica sull‟importanza di controllare regolarmente le lesioni cutanee. I soggetti di sesso maschile in particolare dovrebbero essere incoraggiati a proteggersi dai danni dell‟esposizione solare.
Il continuo monitoraggio dei tassi di incidenza del melanoma cutaneo è fondamentale per evidenziarne futuri cambiamenti e guardare l‟efficacia del messaggio attuale di prevenzione.
Purtroppo rimangono delle mancanze nella registrazione del melanoma in Italia, come la poco accurata segnalazione delle lesioni correlate al loro sito, alla storia evolutiva della singola lesione, ai caratteri istologici e all‟esecuzione chirurgica impiegata, spesso dovute alla scarsa collaborazione tra anatomo-patologo, clinico e chirurgo.
44 Questa lacuna dovrebbe essere colmata per garantire un miglior servizio all‟utente
45
BIBLIOGRAFIA
1) Fonti ISPO - Istituto per lo Studio e la Prevenzione Oncologica.
2) Fishman C., Mihm M., Sober A. Diagnosis and menagement of nevi and cutaneous melanoma in infants and children. Clinics in dermatology 2002; 20:44-50.
3) Braun et al. The use of digital dermoscopy for the follow up of congenital nevi: a pilot study. Pediatr Dermatol 2001; 18(4):277-81.
4) Valiukeviciene S, Miseviciene I, Gollnick H. The prevalence of common acquired melanocytic nevi and the relationship with skin type charcteristics and sun exposure among children in Lithuania. Arch Dermatol 2005;141:579-586.
5) Whiteman Dc, Brown RM, Purdie DM, Hughes MC. Melanocytic nevi in very young children: the role of phenotype, sun exposure and sun protection. J Am Acad Dermatol 2005;52:40-47.
6) Schaffer JV, Bolognia JL. The biology of melanocytic nevi. Oxford UK: Blackwell Publishing;2006.pp.1092-1125.
7) Pho L, Grossman D, Leachman SA. Melanoma genetics: a review of genetics factors and clinical phenotypes in familial melanoma. Curr Opin Oncol 2006;18:173-179.
8) G. Fabrizi, G. Massi Nevi e melanomi nel bambino. Ed. Masson.
9) Leon Goldman. Some investigative studies of pigmented nevi with cutaneous microscopi. The Journal of Investigative Dermatology Vol.16, No.6, June 1951 pag. 407-427.
10) Leon Goldman. Direct Microscopy of Skin in Vivo as a Diagnostic Aid and Research Tool. Journal of Dermatology Surgery and Oncology 6:9 1980, pag. 744-746.
11) Rona M. MacKie. An aid to the preoperative assessment of pigmented lesions of the skin. British Journal of Dermatology Vol. 85, 1971, pag. 232-238. 12) P. Fritsch, R. Pechlaner. The Pigment Network: A New Tool for the Clinical
Diagnosis of Pigmented Lesions. Journal of Investigative Dermatology Vol. 74, No. 6, June 1980, pag.458.
13) P. Fritsch, R. Pechlaner. Differentiation of benign from malignant melanocytic lesions using incident light microscopy. In: Ackerman AB, Pathology of malignant melanoma, New York: Masson, 1981:301-312. 14) Pehamberger H,, Steiner A, Wolff K. In vivo epiluminescence microscopy of
pigmented skin lesions. I Pattern analysis of pigmented skin lesions. Journal of the American Academy of Dermatology Vol. 17, No 4, October 1987, pag.
46 571-583.
15) Steiner A, Pehamberger H, Wolff K. In vivo epiluminescence microscopy of pigmented skin lesions. II Diagnosis of small pigmented skin lesions and early detection of malignant melanoma. Journal of the American Academy of Dermatology Vol. 17, No. 4, October 1987, pag. 584-591.
16) Bahmer FA, Fritsch P, Kreusch J, Pehamberger H, Roherer Schindera I. Terminology in surface microscopy. Journal of the American Academy of Dermatology Vol. 23, No.6, pag. 1159-1162.
17) Bonifazi E, Bilancia M, Berloco A, e colleghi Malignant melanoma in children aged 0-12. Review of 289 cases of the literature. Eur. J. Pediat. Dermatol. 11, 157-75, 2001.
18) Soyer HP, Argenziano G, Cimenti S et al. Dermoscopy of pigmented skin lesions: an atlas based on the Consensus Net Meeting on Dermoscopy 2000. Milan: EDRA Medical Publishing and New Media, 2001.
19) Stolz W, Braun-Falco O, Bilek P et al. Color atlas of dermoscopy. Oxford, England: Blackwell Science Inc. 1994:3.
20) Kreusch J, Rassner G. Standardized epiluminescent microscopi for differentiating melenocytic and non melanocytic pigmented lesions. Hautarz 1991;42:77-83.
21) Menzies SW, Westerhoff K, Rabinovitz H et al. Surface microscopi of pigmented basal cell carcinoma. Arch Dermatol 2000;136:1012-6.
22) G. Fabrizi, G. Massi. Trattato di dermatologia pediatrica. Ed Masson
23) Grin CM, Friedman KP, Grant-Kels JM. Dermoscopy: a review. Dermatol Clin 2002;20:641-6 .
24) Johr RH. Dermoscopy:alternative melanocytic lgorithms-the ABCD rule of dermoscopy, Menzies scoring method and 7-point checklist. Clin Dermatol 2002;20:240-7.
25) Zalaudek I., Docimo G., Argenziano G. Using dermoscopic criteria and patient-related factors for the menagement of pigmented melanocytic nevi. Arch Dermatol vol.145, July 2009.
26) Argenziano G., Catricala`C., Ardigo M., Buccini P., De Simone P., Eibenschutz L., Ferrari A., Mariani G., Silipo V., Sperduti I. and I. Zalaudek Seven-point checklist of dermoscopy revisited. British Association of Dermatologists 2011 164, pp785–790 .
27) Arcangeli F.: „I nevi melanocitici‟. Prospettive in pediatria 2001;31:275-280. 28) Youl P, Aitken J, Hayward N, Hogg D, Liu L, Lassam N, Martin N, Green
A.: „Melanoma in adolescents: a case-control study of risk factors in Queensland, Australia‟. Int J Cancer 2002;98:92-98.
47 29) Schmid-Wendtner MH, Berking C, Baumert J, Schidt M, Sander CA, Plewig
G, Volkenandt M.: „Cutaneous melanoma in childhood and adolescence: an analysis of 36 patients‟. J Am Acad Dermatol 2002;46:874-879.
30) Ang CG, Kelly JW, Fritschi L et al.Characteristics of familial and non-familial melanoma in Australia. Melanoma Res 1998; 8:459.
31) Greene M, Fraumeni J. The hereditary variant of malignant melanoma. In: Human Malignant Melanoma. New York: Grune Stratton, 1979, pag. 139. 32) Mehlman MA. Causal relationship from exposure to chemicals in oil refining and
chemical industries and malignant melanoma. Ann NY Acad Sci 2006 Sep; 1076:822-8.
33) Sorahan T. Mortality of UK oil refinery and petroleum distribution workers, 1951- 2003. Occup Med (Lond) 2007 May; 57(3):177-85. Epub 2007 Jan 22.
34) Williams PR, Panko JM, Unice K, Brown JL, Paustenbach DJ. Occupational exposures associated with petroleum-derived products containing trace levels of benzene. J Occup Environ Hyg 2008 Sep; 5(9): 565-74.
35) Lujambio A, Calin GA, Villanueva A, Ropero S, Sànchez-Céspedes M, Blanco D, Montuenga LM, Rossi S, Nicoloso MS, Faller WJ, Gallagher WM, Eccles SA, Croce CM, Esteller M. A microRNA methylation signature for human cancer metastasis. Proc Natl Acad Sci USA 2008 Sep 9; 105(36): 13556-61. Epub 2008 Sep 3.
36) Felicetti F, Bottero L, Felli N, Mattia G, Labbaye C, Alvino E, Peschle C, Colombo MP, Caré A. Role of PLZF in melanoma progression. Oncogene 2004 Jun 3; 23(26):4567-76.
37) Felicetti F, Errico MC, Bottero L, Segnalini P, Stoppacciaro A, Biffoni M, Felli N, Mattia G, Petrini M, Colombo MP, Reschle C, Caré A. The promyelocytic
leukemia zinc finger-microRNA-221/-222 pathway controls melanoma
progression through multiple oncogenic mechanisms. Cancer Res 2008 Apr 15; 68(8):2745-54.
38) Villano CM, Murphy KA, Akintobi A, White LA. 2,3,7,8-tetrachlorodibenzo-pdioxin (TCDD) induces matrix metalloproteinase (MMP) expression and invasion
in A2058 melanoma cells. Toxicol Appl Pharmacol 2006 Feb 1; 210(3):212-24. 30 Edizione 2011.
39) Agostinelli E, Belli F, Molinari A, Condello M, Palmigiani P, Vedova LD, Marra M, Seiler N, Arancia G. Toxicity of enzymatic oxidation products of spermine to human melanoma cells (M14): sensitization by heat and MDL 72527. Biochim Biophys Acta 2006 Oct; 1763(10):1040-50. Epub 2006 Jul 31. 40) Sigalotti L, Coral S, Fratta E, Lamaj E, Danielli R, Di Giacomo AM,
Altomonte M, Maio M. Epigenetic modulation of solid tumors as a novel approach for cancer immunotherapy. Semin Oncol 2005 Oct; 32(5):473-8.
48 41) Sigalotti L, Fratta E, Coral S, Tanzarella S, Danielli R, Colizzi F, Fonsatti E,
Traversari C, Altomonte M, Maio M. Intratumor heterogeneity of cancer/testis antigens expression in human cutaneous melanoma is methylation-regulated and functionally reverse by 5-aza-2‟-deoxycytidine. Cancer Res 2004 Dec 15; 64(24):9167-71.
42) De Giorni V, Carli P.: „Dermoscopy and preoperative evaluation of melanoma thicknress‟. Clin Dermatol 2002;20:305-8.
43) Boddie Jr Aw, Smith Jr JL, McBride CM,: „Malignant melanoma in children and young adults: effect of diagnostic criteria on staging and results‟. South Med J 1978,71, 1074-1078.
44) Saenz NC, Saenz-Badillos J, Busam K, LaQuaglia MP, Corbally M, Brady MS.: „Childhood melanoma survival‟. Cancer 1999,85,750-754.
45) Liu W, Hill D, Gibbs AF, Tempany M, Howe C, Borland R et al. What features do patients notice that help to distinguish between benign
pigmented lesions and melanomas?: the ABCD(E) rule versus the sevenpoint checklist. Melanoma Res 2005; 15(6):549-54.
46) Chamberlain AJ, Fritschi L, Kelly JW. Nodular melanoma: patients‟ perceptions of presenting features and implications for earlier detection. J Am Acad Dermatol 2003; 48(5):694-701.
47) Braun RP, Baran R, Le Gal FA, Dalle S, Ronger S, Pandolfi R et al. Diagnosis and management of nail pigmentations. J Am Acad Dermatol 2007; 56(5):835-47.
48) Pellacani G. et Al. In vivo confocal microscopic and histopathologic correlations of dermoscopic features in 202 melanocytic lesions. Arch Dermotol, vol. 144, Dec 2008.
49) Zangari A. et Al. Indications for excision of nevi and melanoma diagnosed in a pediatric surgical unit. Journal of Pediatric Surgery (2007) 42, 1412-1416.
50) Jean-Hilaire Saurat et al. „ Dermatologia e malattie sessualmente trasmesse‟, Terza edizione 2006
51) The Melanomas: A synthesis of epidemiological, clinical, histopathological, genetic, and biological aspects, supporting distinct subtypes, causal pathways, and cells of origin. David C. Whiteman1, William J. Pavan2, Boris C. Bastian. 23 June 2011. 52) Fitzpatrick's Color Atlas & Synopsis of Clinical Dermatology.2010
53) S. C. Wallingford, R. D. Alston, J. M. Birch and A. C. Green. Increases in invasive melanoma in England, 1979-2006, by anatomic site. British Journal of Dermatology; 12 May 2011