Scuola di Ingegneria Industriale e dell’Informazione
Corso di Laurea Magistrale in Ingegneria Biomedica
CARATTERIZZAZIONE SPERIMENTALE E ANALISI
FLUIDODINAMICA PIV DI NUOVE PROTESI VALVOLARI
CARDIACHE POLIMERICHE
Relatore: Prof. Ing. Maria Laura COSTANTINO Correlatore: Dott. Ing. Francesco DE GAETANO
Tesi di Laurea Magistrale di:
Cecilia BACCHETTA Matr. 799482 Maria DAVALLI Matr. 799633
Ringraziamenti
Desideriamo sinceramente ringraziare la Prof.ssa Costantino che ci ha dato l’opportunità di partecipare a questo progetto.
Ringraziamo inoltre il Prof. Moggridge e il gruppo di ricerca dell’Università di Cambridge per averci accolto e supportato nel loro dipartimento.
Un ringraziamento particolare va a Francesco che, supportandoci e sopportandoci, ha reso meno gravoso il lavoro durante il progetto.
INDICE
Sommario ... I Abstract ... XI
Introduzione ... 1
Capitolo 1 Anatomia e Fisiologia del Muscolo Cardiaco ... 3
1.1 Anatomia del muscolo cardiaco ... 4
1.2 Il ciclo cardiaco ... 11
1.3 Il sistema cardiocircolatorio ... 13
Capitolo 2 Protesi Valvolari Cardiache ... 17
2.1 Le patologie valvolari ... 18
2.2 Trattamenti terapeutici ... 19
2.3 Protesi valvolari ... 20
2.4 Nuovi prototipi valvolari polimerici ... 22
2.4.1 Compression Moulding ... 26
2.4.2 Injection moulding ... 26
Capitolo 3 Stato dell’Arte ... 29
3.1 Banchi prova: cenni generali ... 30
3.2 Normative banchi prova ... 31
3.3 Stato dell’arte ... 32
3.3.3 Banco Prova Carro – De Gaetano ... 36
3.4 Banchi prova commerciali ... 37
3.4.1 ViVitro Pulse Duplicator ... 37
3.4.2 BCD-Labs duplicator ... 39
3.4.3 MP4 – Robotic Cardiovascular Pulse Duplicator ... 40
3.5 Particle Image Velocimetry (PIV) ... 41
3.5.1 Funzionamento ... 42
3.5.2 Parametri di prova ... 43
3.5.3 Applicazioni ... 44
3.5.4 Banco Prova Left Heart Simulator ... 44
Capitolo 4 Materiali e Metodi... 47
4.1 Introduzione ... 48
4.2 Prove in flusso continuo ... 48
Normativa ISO 5840 ... 48
Set up sperimentale ... 49
Protocollo di prova ... 54
4.3 Prove stazionarie di rigurgito ... 55
Normativa ISO 5840 ... 55
Set up sperimentale ... 56
Protocollo di prova ... 58
4.4 Prove in regime pulsatile ... 58
Normativa ISO 5840 ... 58
Set up sperimentale ... 61
Protocollo di prova ... 65
4.5 Prove in regime pulsatile per visualizzare il fenomeno di vena contratta ... 68
Set up sperimentale ... 69
Protocollo di prova ... 70
4.6 Prove in flusso continuo per la valutazione dei campi di velocità tramite PIV ... 70
Set up sperimentale ... 72
Protocollo di prova ... 76
Capitolo 5 Risultati ... 77
5.1 Introduzione ... 78
5.2 Prove pulsatili per evidenziare il fenomeno della vena contratta effettuate su Gruppo A ... 79
5.2.1 Gruppo SIBS 19 ... 79
5.2.2 Gruppo SIS 30 ... 85
5.3 Prove in flusso continuo e pulsatile delle valvole del Gruppo B... 91
5.3.1 Valvole di diametro 21 mm ... 91
Prove di flusso continuo ... 91
Prove stazionarie di rigurgito ... 95
5.3.2 Valvole di diametro 23 mm ... 99
Prove flusso continuo ... 99
Prove stazionarie di rigurgito ... 102
Prove pulsatili ... 106
5.4 Prove in flusso continuo e pulsatile delle valvole del Gruppo C... 107
Prove flusso continuo ... 107
Prove stazionarie di rigurgito ... 111
Prove pulsatili ... 114
Capitolo 6 Discussioni e Sviluppo Futuri ... 127
6.1 Introduzione ... 128
6.2 Analisi risultati del Gruppo A ... 128
6.3 Analisi risultati del Gruppo B diametro 21 mm ... 129
6.4 Analisi risultati del Gruppo B diametro 23 mm ... 130
6.5 Confronto valvole del Gruppo B ... 133
6.6 Analisi risultati del Gruppo C ... 139
6.7 Confronto valvole del Gruppo B e quelle del Gruppo C aventi lo stesso diametro (23 mm) ... 140
6.8 Analisi dei risultati delle prove in PIV ... 146
6.9 Conclusioni e sviluppi futuri ... 148
Bibliografia ... 151
Appendice A ... 155
SOMMARIO
I. Introduzione
Questo lavoro si inserisce in un progetto nato dalla collaborazione fra il Dipartimento di Chimica e Biotecnologie dell’Università di Cambridge e il Laboratorio di Meccanica delle Strutture Biologiche (LaBS) del Politecnico di Milano con l’obiettivo di sviluppare prototipi valvolari biomorfi polimerici, in grado di unire i vantaggi sia delle protesi valvolari meccaniche (elevate performance a lungo termine) sia delle biologiche (fluidodinamica simile alle valvole naturali) attualmente sul mercato e ne minimizzino i punti deboli. Sono state, infatti, create diverse tipologie di protesi valvolari polimeriche, che si differenziano per materiale usato e tecnica di fabbricazione.
In questo progetto di tesi, presso il LaBS di Milano, sono state effettuate diverse prove per mettere in evidenza altri aspetti del comportamento di protesi valvolari di vecchia generazione già caratterizzate in un precedente progetto di tesi. Sono stati, inoltre, caratterizzati due nuovi gruppi di protesi valvolari in regime continuo e pulsatile, utilizzando un banco prova costruito ad hoc, seguendo le direttive imposte dalla norma ISO 5840.
Infine, presso l’Università di Cambridge, sono state effettuate analisi fluidodinamiche PIV su sei valvole polimeriche di due gruppi differenti, una valvola biologica di pericardio bovino e una valvola meccanica tilting disc.
II. Materiali e Metodi
II.a Prototipi di Valvole Biomorfe Polimeriche
Le protesi valvolari sottoposte a test in questo progetto di tesi sono state divise in quattro gruppi in base al materiale di cui sono costituite e alla tecnica utilizzata per realizzarle. Il primo gruppo, chiamato Gruppo A, è formato da cinque prototipi valvolari in
Stirene-prototipi valvolari in Stirene-Isoprene-Stirene (SIS) con una percentuale di stirene pari al 30%. Tutte e dieci le valvole sono state realizzate mediante compression moulding con temperatura di stampaggio di 150°C, hanno domini orientati e hanno diametro interno di 22 mm. Tali valvole sono state sottoposte a test in regime pulsatile per cercare di mettere in evidenza il fenomeno della vena contratta, utile per valutare l’insufficienza o la stenosi di una valvola. Quattro di queste valvole sono state sottoposte anche ad analisi fluidodinamica PIV.
Il Gruppo B è composto da tre valvole di diametro interno di 21 mm e tre valvole di diametro interno di 23 mm, realizzate in Stirene-Etilene-Polipropilene-Stirene (SEPS) con una percentuale di stirene del 22%. Tutte le valvole sono state realizzate tramite injection
moulding con temperatura del mould pari a 170°C e velocità di iniezione del polimero pari
a 0,5 mm/s. Questo gruppo è stato considerato come un primo prototipo di fabbricazione della nuova generazione di valvole, e per questo motivo presenta difetti che sono poi stati migliorati nel Gruppo C. Il Gruppo C è composto da tre valvole di diametro interno di 23 mm realizzate in SEPS con una percentuale di stirene del 22%. Tutte le valvole sono state realizzate tramite injection moulding con temperatura del mould pari a 155°C e velocità di iniezione del polimero pari a 0,4 mm/s. Tali valvole sono state caratterizzate in regime continuo e pulsatile (Fig.1).
Il Gruppo D, invece, è composto da una valvola in SEPS di diametro interno di 23 mm, realizzata tramite injection moulding con temperatura del mould di 155°C e velocità di iniezione pari a 0,1 mm/s e da una valvola in SEPS di diametro interno di 23 mm, temperatura del mould 155°C e velocità di iniezione di 0,2 mm/s. Tali valvole sono state sottoposte ad analisi fluidodinamica PIV.
a) b)
II.b Prove in Flusso Continuo
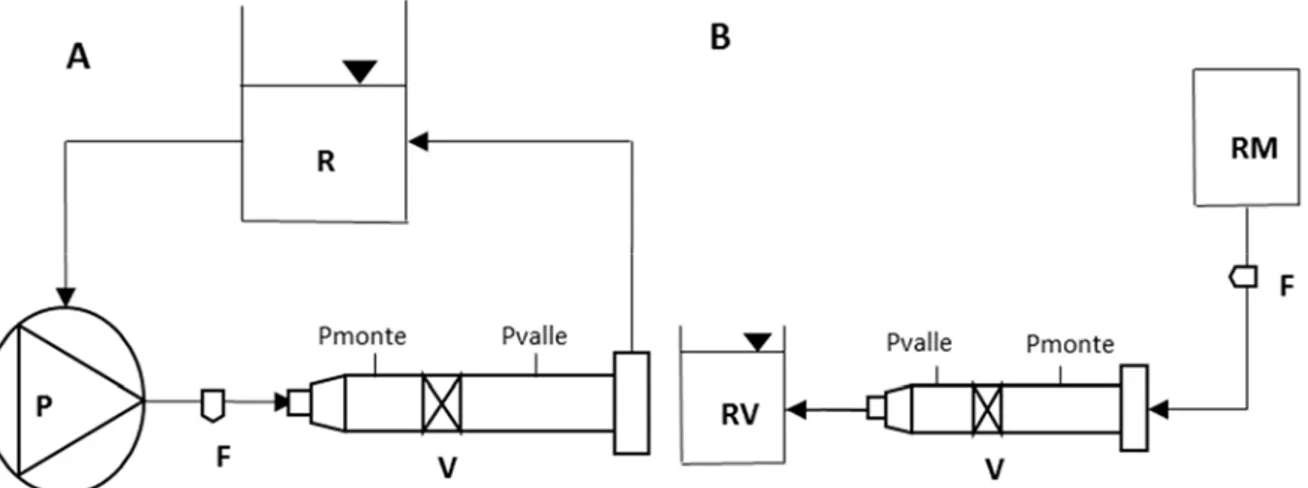
Per le prove in flusso continuo è stato utilizzato un set-up sperimentale, mostrato in Fig. 2.A, composto da una pompa centrifuga (DelphinTM Sarns®, Terumo Cardiovascular
Group, Michigan, USA), una riserva a pelo libero e un alloggiamento valvolare, necessario per fissare la valvola e progettato secondo le direttive della norma ISO 5840.
Le valvole sono state sottoposte ad un range di portata compreso tra 0 e 10 l/min, con incrementi di 0,5 l/min. Per ogni livello di misura è stato registrato il gradiente pressorio a cavallo della valvola (ΔP).
II.c Prove Stazionarie di Rigurgito
Per le prove stazionarie di rigurgito è stato utilizzato un set-up sperimentale, mostrato in Fig. 2.B, composto da una riserva a pelo libero a valle della valvola, una riserva di monte in pressione e un alloggiamento valvolare, necessario per fissare la valvola e progettato secondo le direttive della norma ISO 5840.
Durante la prova è stata variata la pressione di monte in un intervallo compreso fra 23 e 140 mmHg mantenendo costante la pressione di valle. Per ogni valore di pressione di monte diverso è stato misurato il flusso di rigurgito attraverso la valvola chiusa.
Fig. 2: Schema del set up sperimentale per le prove in flusso continuo (A) e le prove di rigurgito (B). Sono rappresentati: la pompa centrifuga (P), la riserva (R), la valvola da caratterizzare (V), e la sonda del flussimetro (F) attraverso la quale viene misurata la portata, la riserva monte (RM) e la riserva valle (RV)
II.d Prove in Regime Pulsatile
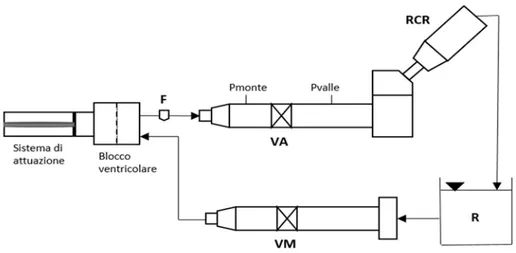
Le prove in regime pulsatile sono state svolte utilizzando un set-up costruito ad hoc in un precedente lavoro di tesi e mostrato in Fig. 3. Tale set-up è composto da: un sistema di attuazione pompa-pistone, un blocco ventricolare che simula il ventricolo sinistro, un alloggiamento valvolare aortico, un blocco che simula la resistenza aortica, la compliance e la resistenza periferica, un reservoir che simula l’atrio sinistro ed un alloggiamento valvolare mitralico.
Il protocollo di prova prevede la misura delle perdite di carico a cavallo della valvola e del volume di rigurgito attraverso di essa per una portata di 5 l/min, frequenza 70 bpm e pressione arteriosa media di 100 mmHg.
Tramite il suddetto set-up, salvo per un’ulteriore presa di pressione posta a 11 mm a valle della valvola, e mediante lo stesso protocollo di prova, sono state svolte anche le prove per cercare di misurare il fenomeno della vena contratta.
Fig. 3: Schema del set up pulsatile. Sono rappresentati: la sonda del flussimetro (F) attraverso la quale viene misurata la portata, l’alloggiamento della valvola aortica (VA), il componente RCR, il reservoir (R) e l’alloggiamento della valvola mitrale (VM). Pmonte e Pvalle rappresentano i punti in cui vengono
rilevate le pressioni.
II.e Prove in Flusso Continuo per la Valutazione dei Campi di Velocità
tramite Particle Image Velocimetry (PIV)
Per la valutazione dei campi di velocità in flusso continuo mediante PIV è stato utilizzato il set-up sperimentale, mostrato in Fig. 4, composto da: una pompa volumetrica (0.75 hp,
Lowara SGM7, Direct Industry,), una riserva a pelo libero, un alloggiamento valvolare realizzato ad hoc cercando di riprodurre il sito anatomico naturale e dimensionato seconde le pubblicazioni di American Heart Association (AHA), un laser Nd:Yag (Twins Ultra, Quantel, France) e una fotocamera ad alta frequenza di acquisizione (PCO SensiCam, Germany).
Nel liquido di prova costituito da una soluzione di glicerolo e acqua in una proporzione di 43% v/v (ρ = 1060 kg/m3, µ = 0,003 Pa∙s) sono state aggiunte particelle sferiche traccianti
rivestite d’argento (10 μm).
Le valvole sono state sottoposte a quattro portate stazionarie: 5 l/min, 10 l/min, 15 l/min e 20 l/min. Per ciascuna delle valvole sono state acquisite 20 coppie di immagini ad ogni portata. Il software è in grado di confrontare le due immagini e di ottenere la traiettoria delle particelle tracciate dalla quale è possibile ottenere il vettore velocità di una singola particella dividendo tale valore per il tempo trascorso tra una immagine e quella seguente, definito pulse time.
Fig. 4: Schema del set up sperimentale. Sono rappresentati: la pompa (P), la valvola (V), la riserva (R), la fotocamera (C), il laser (L).
III. Risultati e Discussione
III.a Prove in Regime Pulsatile per Visualizzare il Fenomeno di Vena
Contratta
Per analizzare il fenomeno della vena contratta sono state rilevate le perdite di carico ai capi delle valvole del Gruppo A. La pressione di monte è stata rilevata sempre un diametro a monte (Pm) della valvola mentre la pressione a valle è stata rilevata a 11 mm (Pv1)e 102
mm (Pv2) a valle. Quando Pm- Pv1 è superiore a Pm- Pv2, la pressione a 11 mm a valle è
minore di quella a 102 mm e quindi la velocità è maggiore, indice del fatto che proprio a questa distanza possa esserci il fenomeno di vena contratta. Il caso contrario, però, non esclude che il fenomeno sia comunque presente ad un’altra distanza e quindi non individuato durante la prova.
Ogni valvola, a causa dei diversi spessori dei leaflets, è stata sottoposta a tre prove, ruotando di 120° la valvola tra una prova e l’altra. In questo modo è stato possibile analizzare come la posizione potesse influenzare il fenomeno della vena contratta. Tale fenomeno, infatti, è risultato dipendente dal posizionamento della valvola nel set-up in quanto sono stati registrati valori differenti di perdite di carico in quattro valvole sulle dieci analizzate.
III.b Prove in Flusso Continuo
I risultati relativi alle valvole analizzate dei Gruppi B e C sono riassunti in Fig. 5.
Si osserva che le valvole del gruppo B di diametro 21 mm presentano perdite di carico medie massime e alla portata massima maggiori di quelle di diametro 23 mm del gruppo B e C; questo però è dovuto al fatto che orifizi di diametro inferiore oppongono maggiore resistenza al fluido e di conseguenza causano perdite di carico più elevate. Le valvole del gruppo C sono, invece, quelle che presentano perdite di carico inferiori a parità di portata.
Fig. 5: Valori medi di perdite di carico massime e perdite di carico alla portata massima per i tre gruppi di valvole con intervallo di confidenza al 95%.
III.c Prove Stazionarie di Rigurgito
I risultati relativi alle valvole analizzate dei Gruppi B e C sono riassunti in Fig. 6.
Fig. 6: Valori medi di portata di rigurgito per i tre gruppi di valvole con intervallo di confidenza al 95%.
Le valvole del Gruppo C, invece, presentano un valore di rigurgito medio di molto inferiore a quelle del Gruppo B, ma anche in questo caso il valore dell’intervallo di confidenza al 95% è abbastanza elevato per il medesimo motivo delle valvole del Gruppo B.
III.d Prove in Regime Pulsatile
Questa tipologia di prove è stata effettuata solo sulle valvole del gruppo B e del gruppo C di diametro 23 mm. I valori tenuti in considerazione per l’analisi sono l’EOA medio e il volume di rigurgito percentuale, indicati in Tab. 1.
Tab. 1. Valori medi mediati sulle tre valvole di EOA e rapporto percentuale fra rigurgito medio e stroke volume medio.
Gruppo B
Diametro 23 Diametro 23 Gruppo C EOA medio [cm2] 1,4168 1,59128
Rigurgito
percentuale (%) 13,26893 8,71041
La norma ISO 5840 impone un EOA medio ≥ 1 cm2 per le valvole di diametro 23 mm ed
entrambi i gruppi soddisfano tale requisito, ma quelle del gruppo C mostrano un EOA medio più elevato quindi migliore perché le valvole offrono un’area di passaggio maggiore al fluido. Per quanto riguarda il rigurgito percentuale la norma impone che esso debba essere inferiore al 10 % e solo le valvole del gruppo C soddisfano tale requisito.
III.e Prove in Flusso Continuo per la Valutazione dei Campi di Velocità
tramite Particle Image Velocimetry (PIV)
Nell’analisi dei risultati di queste prove si è deciso di utilizzare come riferimento per i confronti la valvola biologica, in quanto viene considerata in letteratura come valvola con la fluidodinamica migliore rispetto alle altre tipologie di protesi valvolari e con il comportamento più simile alle valvole naturali (Fig. 7.A).
Per la portata di 5 l/min le valvole che presentano una fluidodinamica paragonabile alla valvola biologica sottoposta a test sono la valvola del Gruppo A 3 SIS30 e la valvola del Gruppo D con velocità di iniezione di 0,2 mm/s. Infatti, non solo le velocità medie sono paragonabili, ma i vettori velocità nel condotto sono paralleli alla direzione di avanzamento del fluido, indice di flusso rettilineo privo di ricircoli. Inoltre, all’interno del seno aortico non si vengono a creare fenomeni di turbolenza di entità elevata.
Fig. 7: Profili di velocità a 20 l/min della valvlola biologica (A), della valvola del gruppo D velocità di iniezione 0,1 mm/s (B) e delle valvola del gruppo A 7 SIBS 19 (C).
Per la portata di 20 l/min le valvole che presentano una fluidodinamica paragonabile alla valvola biologica sottoposta a test sono la valvola del Gruppo A 4 SIBS19 e la valvola del Gruppo D con velocità di iniezione di 0,1 mm/s. Infatti le velocità medie sono paragonabili e il flusso nel condotto è rettilineo e privo di ricircoli. Inoltre, non sono presenti fenomeni di turbolenza nel seno aortico.
Di ogni valvola è stata anche calcolata l’area di flusso percentuale, cioè il rapporto fra il diametro di effettivo passaggio del fluido e il diametro interno della valvola.
IV. Conclusioni
I risultati ottenuti dalle prove in regime continuo evidenziano che le differenze in diametro fra le diverse famiglie di protesi valvolari non influiscono sul comportamento delle stesse, in quanto i valori di rigurgito medio sono molto simili fra le valvole di diametro 21 mm e quelle di diametro 23 mm, mentre le differenze di perdite di carico tranvalvolari sono basse e dovute al fatto che orifizi di diametri diversi oppongono al passaggio del fluido resistenze diverse. Le differenze di fabbricazione, invece, in particolare di velocità di iniezione e di temperatura del mould, influiscono sul comportamento delle valvole di stesso diametro. Per quanto riguarda le protesi valvolari di diametro 23 mm, una diminuzione sia della temperatura sia della velocità di iniezione influisce sulla rigidezza delle valvole e sul volume di rigurgito. Inoltre, dalle prove in regime pulsatile, si evince che le valvole del Gruppo C hanno un EOA medio più elevato a parità di portata, indice di minore rigidezza, e un valore di rigurgito percentuale più basso di quelle del Gruppo B e, soprattutto, inferiore al valore massimo stabilito dalla norma.
Le analisi fluidodinamiche in PIV mostrano che le valvole del Gruppo A si dimostrano più rigide, con un’area di flusso percentuale inferiore alla valvola biologica, utilizzata come riferimento, e alle valvole polimeriche del Gruppo D, di più recente fabbricazione, che invece hanno un’area di flusso più ampia e un profilo di velocità più simile alla valvola biologica.
In conclusione, le valvole caratterizzate che hanno un comportamento migliore sono quelle del Gruppo C. Per questo possibili sviluppi futuri sono l’aumento del numero di prototipi da analizzare, per poter attuare un’analisi statistica vera e propria, e la modifica dei parametri di lavorazione dell’injection moulding, soffermandosi sui cambiamenti nella velocità di iniezione che possono quindi influire sulle proprietà dei prototipi valvolari. Un ulteriore sviluppo futuro è l’analisi fluidodinamica PIV in regime pulsatile mediante il banco prova utilizzato per la caratterizzazione in flusso pulsatile.
ABSTRACT
I. Introduction
This thesis is part of a joint project between the Department of Chemical Engineering and Biotechnologies at the University of Cambridge (UK) and the Laboratory of Biological Structure Mechanics (LaBS) at the Politecnico di Milano. The aim of the this project is to develop a new prototype of Biomorphic Polymeric Heart Valve (BPHV) which combines the advantages of both mechanical and biological cardiac prosthesis currently on the market, that are long term durability and fluid dynamics similar to the physiological one, and at the same time minimizes their weak points. Indeed, some BPHV prototypes were created, using different materials and manufacturing.
In this thesis, additional characteristics of polymeric cardiac prosthesis previously characterized in another project were investigated. Moreover, two new families of BPHVs were tested in steady and pulsatile flow at the LaBS using a set-up, in agreement with the guidelines of ISO 5840.
Finally, Particle Image Velocimetry (PIV) fluid dynamic analysis were carried out at the University of Cambridge on six BPHVs of two different groups, on a bovine pericardium biological valve and on a mechanical tilting disc valve.
II. Materials and Methods
II.a Biomorphic Polymeric Heart Valves Prototypes
The cardiac prosthesis tested in this project were divided in four groups depending on the material and on the manufacture. The first Group (A) includes five prototypes made of Styrene-Isoprene-Butadiene-Styrene (SIBS) with a styrene fraction of 19% and five prototypes made of Styrene-Isoprene-Styrene (SIS) with a styrene fraction of 30%. All prototypes were made by compression moulding with a mould temperature of 150°C and
tested in pulsatile flow to investigate the vena contracta phenomenon. Four of them were also tested with fluid dynamic analysis (PIV).
Group B includes three valves with internal diameter of 21 mm and three valves of internal diameter of 23 mm made of Styrene-Ethylene-Polypropylene-Styrene (SEPS) with a styrene fraction of 22%. All prototypes were made by injection moulding with a mould temperature of 170°C and injection velocity of 0,5 mm/s. This group was considered as a manufacturing prototype, indeed it presents some defects which were improved in Group C. Group C includes three valves with internal diameter of 23 mm made of SEPS with a styrene fraction of 22%. All the prototypes were made by injection moulding with a mould temperature of 155°C and injection velocity of 0,4 mm/s. These prototypes were tested in steady and pulsatile flow (Fig. 1).
The last Group (D) includes one valve with internal diameter of 23 mm made of SEPS by injection moulding with a mould temperature of 155°C and injection velocity of 0,1 mm/s and one valve with internal diameter of 23 mm made of SEPS by injection moulding with a mould temperature of 155°C and injection velocity of 0,2 mm/s. These prototypes were tested with fluid dynamic analysis (PIV).
a) b)
Fig. 1: The front (a) and the back (b) of the prototypes of BPHVs made in SEPS.
II.b Continuous Flow Tests
The experimental set-up used for the continuous flow tests (Fig. 2.A) is composed of a centrifugal pump (DelphinTM Sarns®, Terumo Cardiovascular Group, Michigan, USA), a
free surface reservoir and a valve housing necessary to fix the valve and which follows the guidelines of ISO 5840.
The valves were subjected to a flow rate from 0 to 10 l/min with increments of 0,5 l/min. The pressure gradient across the valves (ΔP) was recorded for each level of measurement.
II.c Static Regurgitation Tests
The experimental set-up used for the static regurgitation tests (Fig. 2.B) is composed of a free surface reservoir (downstream), a closed reservoir (upstream) and a valve housing necessary to fix the valve in agreement with the guidelines of ISO 5840.
The valves were subjected to a backpressure from 23 to 140 mmHg and to a constant upstream pressure. The regurgitation through the valves was measured for each pressure.
Fig. 2: Outline of the experimental set-up for continuous flow (A) and static regurgitation (B) flow. You can observe the centrifugal pump (P), the reservoir (R), the valve (V), the flow probe (F), which measures the flow, the upstream reservoir (UR) and the downstream reservoir (DR). Pupstream and Pdownstream are the pressure
gauges.
II.d Pulsatile Flow Rate Tests
The experimental set-up used for the pulsatile flow rate tests (Fig. 3) is composed of a piston pump implementation system, a ventricular block simulating the left ventricle, an aortic valve housing, a Resistance-Compliance-Resistance (RCR) analogue to replicate the compliance and resistance (aortic and peripheral) of the cardiovascular system, a free
Following the guidelines of ISO 5840, the pressure gradient across the valves and the regurgitation through the valves were measured for a flow rate of 5 l/min, a frequency of 70 bpm and a mean aortic pressure of 100 mmHg.
The same set-up was used to investigate the vena contracta phenomenon but the aortic valve housing had an additional downstream pressure gauge at 11 mm downstream.
Fig. 3: Outline of the experimental set-up where you can observe: the reservoir (R), the aortic valve (VA), the mitral valve (VM), the flow probe (F) and the RCR analogue. Pupstream and Pdownstream are the
pressure gauges.
II.e Continuous Flow Tests to Evaluate the Velocity Fields with the
Particle Image Velocimetry (PIV)
The experimental set-up used for the continuous flow tests with PIV (Fig.4) is composed of a volumetric pump (0.75 hp, Lowara SGM7, Direct Industry), a free surface reservoir, a valve housing modeled following the publications made by the American Heart Association (AHA), an Nd:Yag pulsed laser generator (Twins Ultra, Quantel, France) and a camera (PCO SensiCam, Germany).
The neutrally buoyant silver-coated seed particles were placed inside the liquid used in the system, which is a mixture of glycerol and water in a 43% v/v ratio (ρ = 1060 kg/m3, µ =
0,003 Pa∙s).
The valves were subjected to four steady flow rates: 5 l/min, 10 l/min, 15 l/min and 20 l/min. Twenty image pairs were taken for each heart valve at each flow rate.
The PIV analysis program compares the two images and provides a displacement of the seed particles while the pulse distance provides the time component of the velocity.
Fig. 4: Outline of the experimental set-up where you can observe: the pump (P), the reservoir (R), the valve (V), the camera (C) and the laser (L).
III. Results and Discussion
III.a Pulsatile Flow Rate Tests to Investigate the Vena Contracta
Phenomenon
To investigate the vena contracta phenomenon the pressure drops across the valves were measured. The upstream pressure gauge was at one diameter before the valve (Pm), while the downstream pressure gauges were at 11 mm (Pv1) and 102 mm (Pv2) after the valve.
When Pm-Pv1 is higher than Pm- Pv2, the pressure at 11 mm is smaller than the one at 102
mm and the velocity is higher, thus the vena contracta phenomenon could be shown. Otherwise vena contracta phenomenon could exist but in another position of the housing. Each valve was tested three times rotating a different leaflet to the higher part of the housing because each leaflet has a different thickness. Four out of ten Group A valves showed the phenomenon but only with one, or maximum two, different leaflets’ configurations.
III.b Continuous Flow Tests
The results for the Group A valves analyzed are summarized in Fig.5.
Fig. 5: Mean values of the peak pressure drop and of the pressure drop at the highest flow rate for the three valves’ group with confidence interval of 95%.
Group B valves with internal diameter of 21 mm have a mean peak pressure drop and a pressure drop at the highest flow rate higher than Group B and C valves with internal diameter of 23 mm. The pressure drop’s differences are due to the different diameter: the smaller the diameter, the higher the pressure drop. Group C valves have a mean pressure drop lower at same flow rate.
III.c Static Regurgitation Tests
The results for the three groups of valves analyzed are summarized in Fig.6.
Group B valves have a similar mean regurgitation but the confidence interval of 95% is high due to the behavior of one prosthesis in each family, which is far from the mean value.
Group C valves instead have a mean regurgitation lower than Group B valves but even they have a high confidence interval of 95% due to the behavior of one prosthesis.
Fig. 6: Mean values of the regurgitation for the three valves’ group with confidence interval of 95%.
III.d Pulsatile Flow Rate Tests
Only Group B and Group C valves with internal diameter of 23 mm were tested in pulsatile flow. The mean Effective Orifice Area (EOA) and the percent regurgitation are shown in Tab. 1.
Tab. 1. EOA and percent regurgitation averaged over three valves.
Group B Diameter 23 Group C Diameter 23 Mean EOA [cm2] 1,42 1,59
Percent Regurgitation
(%) 13,27 8,71
Following the guidelines of ISO 5840, both the valves’ groups with an internal diameter of 23 mm meet the minimum requirement for the EOA ( ≥ 1 cm2). The Group C valves’ EOA
is higher and therefore better because it improves the valves’ behavior.
On the other hand, only Group C valves meet the minimum requirement for the percent regurgitation (< 10%).
III.e Continuous Flow Tests to Evaluate the Velocity Fields with the
Particle Image Velocimetry (PIV)
The biological valve has acted as a guide in determining flow patterns expected for an optimal valve (Fig.7.A).
Fig. 7: Flow patterns at a flow rate of 8 l/min for the biological valve (A), the Group D valve with injection velocity of 0,1 mm/s (B) and the Group A 4 SIBS 19 valve (C).
Group A 3 SIS 30 and Group D with injection velocity of 0,2 mm/s flow patterns are comparable to the biological flow pattern at a flow rate of 5 l/min. Indeed, not only the mean velocities are comparable but also the velocity vectors inside the duct are parallel to the fluid’s direction, which means linear flow without recirculation. Moreover, vorticity is not shown inside the aortic sinus.
Group A 4 SIBS 19 and Group D with injection velocity of 0,1 mm/s flow patterns are comparable to the biological flow pattern at a flow rate of 20 l/min. Indeed, the mean velocities are comparable and the flow in the duct is straight and it does not show recirculation. Moreover, vorticity is not shown inside the aortic sinus.
For each valve the flow area percentage, which is the ratio between the effective flow diameter and the valve internal diameter, was calculated.
IV. Conclusions
The steady flow tests showed that the diameter’s diversities between the prosthesis do not affect their behavior. The mean regurgitation of the valves with internal diameter of 21 mm and of 23 mm are similar and the pressure drop’s differences are due to the difference in diameter. The manufacturing diversities (injection velocity and mould temperature) affect the behavior of the valves with the same internal diameter. For the valves with internal diameter of 23 mm, a lower temperature and a lower injection velocity influence the valves’ stiffness and the regurgitation, as shown in continuous flow tests. Moreover, the pulsatile flow tests show that Group C valves have a higher EOA at a same flow rate, which means they are less stiff, and a smaller percent regurgitation than Group B valves. These two parameters meet, for the Group C, the minimum requirements of performance required by the ISO 5840.
The PIV fluid dynamic analysis showed that Group A valves are stiffer and have a percent area smaller than the biological valve. They are stiffer also than the more recent Group D valves. Indeed, Group D valves have a percent area and a flow pattern similar to the biological valve.
In conclusion, the valves characterized which show a better behavior are the ones of Group C. For this reason, next possible developments are the increase of samples to allow a real statistical analysis and the change of injection moulding parameters, especially focusing on injection velocity changes, which could affect the properties of BPHV prototypes. An additional advancement is the PIV fluid dynamic analysis in pulsatile flow through the set-up used for the pulsatile flow tests carried out in this project.
Introduzione
Le protesi valvolari cardiache sono dispositivi utilizzati in cardiochirurgia per la sostituzione di valvole affette da patologie, quali la stenosi o il rigurgito. Attualmente sono presenti sul mercato ed utilizzate in ambito clinico due tipi di valvole cardiache: meccaniche e biologiche. Le prime possiedono il grande vantaggio di garantire una lunga durata nel tempo, ma necessitano di una terapia farmacologica per impedire la coagulazione e la formazione di trombi durante tutta la durata della vita del paziente. Le seconde, invece, non producono fenomeni di trombosi essendo realizzate in materiale biologico compatibile con il corpo umano, hanno un’ottima fluidodinamica, ma hanno una durata inferiore nel tempo poiché perdono le loro proprietà meccaniche e vanno incontro a fallimento.
Negli ultimi anni, però, sono stati creati nuovi dispositivi polimerici con l’intento di unire i pregi di valvole meccaniche e biologiche e avere, quindi, una elevata affidabilità nel tempo insieme ad una fluidodinamica simile a quella delle valvole naturali.
Questo lavoro di tesi, grazie alla collaborazione tra il Dipartimento di Chimica, Materiali e Ingegneria Chimica “Giulio Natta” (Laboratorio di Meccanica delle Strutture Biologiche, LaBS) del Politecnico di Milano ed il Dipartimento di Ingegneria Chimica e Biotecnologie dell’Università di Cambridge (UK), si pone come obiettivo il creare una protesi valvolare biomorfa che sia il più simile possibile ad una valvola naturale, per forma, geometria, caratteristiche meccaniche e comportamento durante il ciclo cardiaco. Per tale fine sono stati scelti particolari materiali, i polimeri a blocchi SEPS (poli[Stirene-Etilene-Polipropilene-Stirene]lineare) con una percentuale di stirene del 22%, che garantiscono un’ottima resistenza a corrosione e idrolisi in vivo, non creano trombosi e, grazie alla loro struttura, assicurano maggiore resistenza meccanica nelle zone sottoposte a maggiori sollecitazioni.
Servendosi di un simulatore cardiovascolare già esistente e progettato ad hoc, è stato possibile caratterizzare tali dispositivi a differenti condizioni di pressione e portata, in regime continuo e pulsatile.
Chimica e Biotecnologie dell’Università di Cambridge (UK), e del confronto dei dati ottenuti con i risultati di altre protesi valvolari.
Questo lavoro di tesi è articolato in capitoli, di cui:
nel Capitolo 1 viene presentato un breve accenno all’anatomia e al funzionamento del muscolo cardiaco;
nel Capitolo 2 vengono presentate le possibili patologie valvolari con i relativi interventi, vengono descritte e confrontate le differenti tipologie di protesi valvolari cardiache esistenti e viene presentata nel dettaglio la progettazione delle valvole biomorfe polimeriche oggetto di studio;
nel Capitolo 3 si delinea lo stato dell’arte relativo ai simulatori cardiovascolari e una breve descrizione della tecnica di misurazione chiamata Particle Image Velocimetry (PIV);
nel Capitolo 4 vengono descritti la normativa ISO 5840, il set-up sperimentale con gli strumenti di misura e il protocollo di prova relativi alle prove di caratterizzazione eseguite in flusso continuo, in flusso pulsatile e in flusso continuo per la valutazione dei campi di velocità tramite PIV;
nel Capitolo 5 vengono presentati i risultati relativi alle suddette prove;
nel Capitolo 6 viene illustrata la discussione del lavoro con relative conclusioni e possibili sviluppi futuri.
CAPITOLO 1
Anatomia e fisiologia del muscolo
cardiaco
1.1 Anatomia del muscolo cardiaco
Il cuore è un organo di natura muscolare della grandezza di un pugno chiuso, situato nella parte mediana della cavità toracica, dietro allo sterno e tra i due polmoni, in una zona centrale denominata mediastino (Fig. 1.1). La sua forma ricorda quella di un cono appiattito con la base rivolta verso l’alto e a destra e l’apice spostato verso sinistra, in modo da risultare leggermente asimmetrico all’interno della gabbia toracica.
Il suo volume varia a seconda di alcuni parametri, quali l’età, il sesso e le condizioni del soggetto: il suo peso raggiunge circa 300 grammi negli uomini adulti e 250 grammi nelle donne.
Esternamente il cuore è interamente rivestito da una sottile membrana sierosa, chiamata epicardio, ed è collegato da un’altra membrana sierosa allo sterno e al diaframma, un muscolo che ha la funzione di mantenere il cuore in posizione nel torace. Le due membrane insieme costituiscono il pericardio e sono separate tra loro da un sottile strato di liquido che funziona da lubrificante (Fig. 1.1).
Fig. 1.1: Configurazione esterna del cuore: (a) esposizione anteriore; (b) esposizione trasversale (Hansen, 2010).
Internamente, invece, il cuore è diviso in due parti distinte: il cuore destro, che pompa il sangue attraverso i polmoni permettendo lo scambio gassoso tra ossigeno e anidride carbonica (“piccola circolazione” o “circolazione polmonare”), e il cuore sinistro, che spinge il sangue attraverso tutti gli altri organi e tessuti (“grande circolazione” o “circolazione sistemica”). Ciascuna di queste due parti del cuore è a sua volta divisa in due camere: un atrio e un ventricolo.
Gli atri presentano lo strato muscolare che forma la vera struttura della parete, il miocardio, più sottile, ad eccezione della porzione in corrispondenza dell’auricola, dove è presente un ispessimento dovuto ai numerosi rilievi muscolari. Essi svolgono la funzione di raccolta del sangue e di via di accesso ai ventricoli. Inoltre, la loro contrazione facilita il passaggio del sangue dagli atri stessi ai ventricoli.
I ventricoli, invece, sono caratterizzati da pareti più spesse perché devono fornire con la loro contrazione quasi tutta l’energia per spingere il sangue ai polmoni e a tutti gli altri distretti corporei. Inoltre, le pareti del ventricolo sinistro sono più spesse di quelle del ventricolo destro, in quanto il sangue richiede una pressione maggiore per percorrere la “circolazione sistemica” rispetto alla pressione richiesta per percorrere la “circolazione polmonare”.
Ciascun atrio è posto in comunicazione con il sottostante ventricolo attraverso un orifizio atrioventricolare o ostio venoso, dotato di una valvola atrioventricolare (tricuspide a destra e mitrale a sinistra) che consente il passaggio del sangue dalla zona atriale a quella ventricolare ed ostacola il reflusso in direzione opposta.
Da ciascun ventricolo, invece, si diparte un grosso vaso arterioso (tronco polmonare o aorta) a partire dai due orifizi, gli osti arteriosi, muniti di una valvola semilunare ciascuno. Il sangue proveniente dalle vene cave, superiore e inferiore, e dal seno coronarico, ovvero la grossa vena che raccoglie il sangue refluo dalle pareti del cuore, raggiunge l’atrio destro (Fig. 1.2) e si sposta nel ventricolo destro (Fig. 1.2) passando attraverso l’ostio venoso destro. Tale orifizio ha un contorno ovale, dal diametro medio di 38 mm, ed è dotato di una valvola atrioventricolare destra o tricuspide.
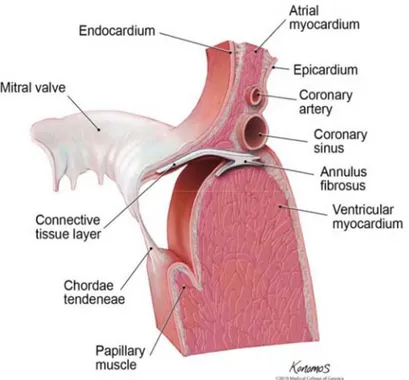
La valvola tricuspide è costituita da tre lembi o cuspidi valvolari (settale o mediale, anteriore e posteriore) fissati ad un anello fibroso posto in corrispondenza dell’orifizio atrioventricolare. I lembi della valvola si inseriscono tramite le corde tendinee ai tre muscoli papillari, parte integrante della parete ventricolare destra. I muscoli papillari (Fig. 1.3) si contraggono simultaneamente alle pareti ventricolari, ma la loro funzione principale è impedire ai lembi delle valvole atrioventricolari di prolassare durante la sistole ventricolare. Tale scopo è raggiunto tirando i lembi internamente verso i ventricoli durante la sistole al fine di prevenire un rigonfiamento troppo consistente verso gli atri (Guyton e Hall, 1999).
Fig. 1.3: Sezione del cuore sinistro dove vengono messi in evidenza la valvola mitrale, le corde tendinee e i muscoli papillari (Hansen, 2010).
Durante il ciclo cardiaco, il sangue si sposta dal ventricolo destro al circolo polmonare passando attraverso l'ostio arterioso destro. Tale orifizio ha un contorno circolare di diametro medio di 22 mm, ed è dotato di una valvola semilunare.
Le valvole semilunari sono pieghe membranose a forma di “nido di rondine”. Tale valvola presenta un margine aderente che si impianta su un anello fibroso situato sul contorno
dell’ostio arterioso e un margine libero che sporge nel lume del vaso dell’arteria polmonare.
Il sangue, una volta ossigenato, si sposta dal circolo polmonare al cuore sinistro attraverso le quattro vene polmonari che confluiscono nei rispettivi orifizi, privi di valvole, posizionati nella parete superiore dell’atrio sinistro. Una volta raggiunto l’atrio sinistro (Fig. 1.4), il sangue si sposta nel ventricolo sinistro (Fig. 1.4) passando attraverso l’ostio atrioventricolare sinistro o ostio mitralico. Tale orifizio ha un contorno ovale, dal diametro medio di 32 mm, ed è dotato di una valvola atrioventricolare sinistra o mitrale.
Fig. 1.4: Vista interna dell’atrio sinistro (a) e del ventricolo sinistro (b) (Hansen, 2010).
La valvola mitrale è costituita da due lembi o cuspidi valvolari (anteriore e posteriore) e deve il suo nome alla somiglianza alla Mitra Papale. Le cuspidi si attaccano all’anello fibroso con la base, mentre i magrini liberi e le facce ventricolari dei lembi mitralici sono trattenuti dalle corde tendinee.
medio di 22 mm, ed è dotato di una valvola semilunare, con struttura e modalità di inserzione simile alla valvola del tronco polmonare.
Le quattro valvole sopra descritte sono mostrate nella figura sottostante (Fig. 1.5).
Fig. 1.5: Valvole atrio-ventricolari e semilunari (Hansen, 2010).
I sottili lembi delle valvole atrioventricolari non necessitano di una contropressione elevata per la loro chiusura, mentre le più spesse valvole semilunari hanno bisogno di una maggiore contropressione per chiudersi.
Le valvole semilunari funzionano in maniera completamente diversa da quelle atrioventricolari. Innanzitutto, gli alti valori pressori presenti nelle arterie al termine della sistole ventricolare fanno sì che tali valvole si chiudano di scatto. Inoltre, a causa delle dimensioni ridotte, la velocità di eiezione del sangue è molto più alta rispetto a quella presente nelle valvole atrioventricolari. Per questi due motivi (rapida chiusura e rapida eiezione), i margini delle valvole semilunari sono sottoposti ad una ingente abrasione meccanica. Infine, le valvole atrioventricolari sono sostenute dalle corde tendinee, mentre ciò non avviene per quelle semilunari. Appare ovvio che le valvole semilunari debbano presentare una struttura anatomica atta a resistere a sollecitazioni meccaniche anche di elevata entità (Guyton e Hall, 1999).
1.2 Il ciclo cardiaco
Il cuore viene considerato come una pompa che sposta il sangue attraverso il sistema cardiovascolare. Ogni battito cardiaco corrisponde ad un ciclo cardiaco, ovvero ad una sequenza di eventi elettrici e meccanici che si susseguono tra di loro. Tale sequenza viene riassunta nel diagramma di Wiggers (Wiggers, 1952) che mostra su un unico grafico i tracciati di elettrocardiogramma (ECG), la pressione delle cavità cardiache e dell’aorta, il volume del ventricolo, i rumori o i toni cardiaci (Fig. 1.6).
L’ECG è molto utile in quanto costituisce un riferimento temporale: l’onda P rappresenta l’eccitazione degli atri, mentre il complesso QRS indica l’attivazione del muscolo ventricolare.
Fig. 1.6: Diagramma di Wiggers (Wiggers, 1952).
Il ciclo cardiaco può essere diviso in quattro fasi:
Riempimento ventricolare: il sangue, fluito nell’atrio, determina un battente pressorio tale da causare l’apertura della valvola atrioventricolare e, quindi, il passaggio del sangue dall’atrio al ventricolo. La valvola di uscita (aortica o polmonare) non si apre poiché la pressione sul lato arterioso è maggiore della pressione nel ventricolo. Il miocardio inizia a contrarsi, durante la sistole atriale, fino a quando la pressione ventricolare supera quella atriale e la valvola atrioventricolare si chiude, in corrispondenza del primo tono cardiaco;
Contrazione isovolumetrica: il cuore continua a contrarsi, mantenendo entrambe le valvole chiuse, per una durata di circa 0,01-0,02 secondi. Il volume del ventricolo
rimane invariato nonostante la contrazione aumenti. Per tale motivo la pressione nei ventricoli aumenta fino a quando supera la pressione nell’arteria e le valvole di uscita si aprono;
Eiezione: nel cuore sinistro, dopo l’apertura della valvola aortica, il sangue viene espulso rapidamente nell’aorta. Alla fine dell’eiezione, il ventricolo si rilascia rapidamente e la pressione diminuisce fino a quando scende sotto il valore della pressione arteriosa causando la chiusura della valvola aortica in corrispondenza del secondo tono cardiaco;
Rilasciamento isovolumetrico: il ventricolo continua a rilasciarsi per altri 0,03-0,06 secondi senza che il suo volume vari. Quando la pressone ventricolare raggiunge un valore inferiore alla pressione nell’atrio, si apre la valvola atrioventricolare ed inizia un nuovo ciclo.
1.3 Il sistema cardiocircolatorio
Il sistema cardiocircolatorio è un circuito chiuso nel quale il sangue viene spinto da una pompa, il cuore, all’interno delle arterie che, ramificandosi e riducendosi gradualmente di calibro, si riducono a capillari a livello degli organi periferici. A partire dai capillari, il sangue ritorna per confluenza al cuore all’interno dei vasi, chiamati vene.
Dalla pompa cardiaca si dipartono due diverse circolazioni: la circolazione sistemica, che inizia nel ventricolo sinistro, passando attraverso l’aorta, porta il sangue ossigenato ai tessuti e ritorna all’atrio destro del cuore attraverso le vene cave, e la circolazione polmonare, che inizia nel ventricolo destro, si biforca nelle arterie polmonari destra e sinistra per portare il sangue ai polmoni e ritorna all’atrio sinistro tramite le vene polmonari.
Il sistema cardiocircolatorio può essere schematizzato tramite un equivalente elettrico (Fig. 1.7): i ventricoli destro e sinistro sono rappresentati come due pompe poste in serie e i diversi organi come delle resistenze.
Fig. 1.7: Equivalente elettrico del sistema cardiocircolatorio.
Il circolo sistemico è rappresentato come una resistenza in serie tra le due pompe. Tale resistenza è il risultato del parallelo di diverse resistenze: i vari organi sono, infatti, posti tutti in parallelo al sistema cuore-polmoni (Fig. 1.8), compreso il circolo coronarico che parte dall’aorta e termina in atrio destro.
Fig. 1.8: Schematizzazione della circolazione sistemica.
L’unica resistenza che costituisce un’eccezione è il circolo bronchiale che parte dall’arteria bronchiale e sfocia nell’atrio sinistro e viene, quindi, considerato in parallelo alla sola pompa sinistra. Tuttavia, questo circolo rappresenta solo l’1% della circolazione totale. Il circolo polmonare, invece, è rappresentato sempre come una resistenza in serie tra le due pompe.
CAPITOLO 2
2.1 Le patologie valvolari
Uno dei più importanti disturbi del sistema cardiovascolare è il malfunzionamento delle valvole cardiache che è generalmente dovuto a difetti congeniti, all’invecchiamento o a malattie quali la febbre reumatica. Tali complicazioni possono arrivare a compromettere la funzionalità delle valvole, diminuendo il movimento dei foglietti valvolari o danneggiandone la struttura. In casi come questi è possibile che si verifichino fenomeni quali la stenosi (irrigidimento dei foglietti valvolari associato ad un restringimento del diametro della valvola che causa grande resistenza al flusso sanguigno e produce un elevato gradiente pressorio a cavallo della valvola) o il rigurgito (non completa chiusura dei foglietti valvolari). Tali fenomeni portano al fallimento della valvola naturale e, talvolta, richiedono la sostituzione della stessa con una protesi valvolare (Dasi et al., 2009). Una valvola si definisce stenotica quando, al suo massimo grado di apertura, presenta un orifizio di dimensioni minori di quelle fisiologiche. In presenza di una stenosi valvolare, affinché possa circolare la portata di sangue necessaria per il benessere fisiologico, il cuore deve fornire un’energia maggiore di quella richiesta in assenza di stenosi e, quindi, deve produrre un lavoro maggiore. A tale scopo, le pareti cardiache subiscono alcune modifiche strutturali tali da consentire alle fibre che le compongono di aumentare la pressione sistolica ventricolare in modo opportuno. In particolare, si può verificare un ispessimento delle pareti cardiache (ipertrofia) e una sfericizzazione del ventricolo. Oltre un certo limite, la capacità del cuore di produrre un lavoro maggiore viene meno, subentra lo scompenso cardiaco ed, infine, l’insufficienza cardiaca causa il decesso in tempi brevi.
Una valvola cardiaca si definisce, invece, insufficiente o incompetente quando i suoi lembi valvolari non si chiudono più completamente. Si crea, quindi, un orifizio residuo che provoca un reflusso ematico dalle arterie ai ventricoli (insufficienza delle valvole semilunari) o dai ventricoli negli atri (insufficienza delle valvole atrioventricolari), come mostrato nella figura sottostante (Fig. 2.1) per la valvola aortica.
A B
Fig. 2.1: Valvola aortica in fase di chiusura sana (A) e a destra incompetente (B)
2.2 Trattamenti terapeutici
Un problema valvolare ha diverse possibilità di trattamento: riparazione valvolare, terapia farmacologica e/o sostituzione della valvola cardiaca. La riparazione chirurgica è il metodo generalmente preferito per il trattamento di una patologia valvolare. Purtroppo, alcuni pazienti non sono ritenuti idonei alla cardiochirurgia valvolare riparativa, ad esempio perché le loro valvole cardiache sono eccessivamente danneggiate. In tal caso, la valvola viene generalmente sostituita.
Durante un intervento di riparazione valvolare, la valvola cardiaca può essere ridimensionata con procedura di anuloplastica, nella quale viene inserito un dispositivo destinato a ripristinare la conformazione della valvola e fornirle sostegno e viene rimosso anche il tessuto in esubero. Alternativamente il chirurgo può riparare i lembi valvolari danneggiati da depositi di calcio, con annessa rimozione di tali depositi, o rimuovere un eventuale esubero di tessuto sui lembi (valvuloplastica) (Jensen, 2015).
I dispositivi per anuloplastica, progettati per mantenere la forma, il movimento e la flessibilità naturale dell’anello valvolare, possiedono anche un marcatore che ne consente la visualizzazione radiografica (Fig.2.2).
Fig. 2.2: Dispositivo di anuloplastica e tecnica di impianto.
2.3 Protesi valvolari
I dispositivi attualmente impiantabili in ambito clinico per la sostituzione delle valvole cardiache sono protesi meccaniche e biologiche. Le prime garantiscono una lunga durata nel tempo, ma necessitano di una fondamentale e costante terapia farmacologica per impedire la coagulazione e la conseguente formazione di trombi. Le seconde, invece, essendo costituite da materiale biologico, non provocano una reazione del sistema immunitario e, inoltre, avendo una fluidodinamica migliore, non generano trombosi, ma sono molto meno resistenti nel tempo: perdono progressivamente le loro proprietà meccaniche e devono, quindi, essere sostituite dopo breve tempo prima che vadano incontro a fallimento.
A partire dagli anni ‘60 però sono stati creati dei nuovi dispositivi polimerici con l’intento di unire i pregi delle due tipologie precedentemente descritte, che abbiano, quindi, una elevata affidabilità ma anche un’eccellente biocompatibilità. Inoltre, l’uso di materiale polimerico in generale permette una più facile fabbricazione: in questo modo è molto più semplice controllare la geometria finale della valvola e anche la disposizione delle catene polimeriche per impostare in modo più preciso le proprietà meccaniche del prodotto finale. In passato sono stati utilizzati polimeri come gomme siliconiche, Teflon® e poliuretani. Si è scoperto, però, nel tempo che tutti questi polimeri una volta impiantati nel corpo umano
vanno incontro a degradazione, scatenando infiammazione e creazione di capsule fibrotiche. Analizzando i meccanismi di degradazione di questi materiali si è capito che per ottenere una elevata stabilità a lungo termine in tessuti viventi è necessario avere polimeri che non abbiano nella struttura gruppi favorevoli all’ossidazione, all’idrolisi o alla scissione enzimatica, come per esempio i gruppi estere, urea, etere o ammide (Pinchuk et al., 2008). In questo modo si è giunti alla creazione di una nuova famiglia di polimeri, i polimeri a blocchi Stirene-Isobutilene-Stirene (SIBS) (Fig. 2.3): sono elastomeri termoplastici ottenibili per sintesi chimica e lavorabili mediante injection moulding o stampaggio a compressione. Le loro proprietà sono intermedie fra quelle dei siliconi e quelle dei poliuretani, ma hanno una resistenza ossidativa ben maggiore, dimostrata da test di stabilità ottenuti mediante l’immersione in acido nitrico al 65% bollente (Pinchuk, 1998).
Fig. 1.3: Schema del poli(styrene-block-isobutylene-block-styrene), dove N/(M+N) per applicazioni biomedicali è generalmente 0.05-0.50 (Pinchuk et al., 2008).
Un particolare tipo di SIBS è stato creato dall’azienda Innovia LLC di Miami (FL) per essere usato nella creazione di una valvola trileaflet (Fig. 2.4) (Gallocher et al., 2006). In questo caso il polimero è stato rinforzato con fibre di PP (Polipropilene), per aumentare le proprietà meccaniche senza ridurne la stabilità chimica. Il materiale è stato testato a fatica tensionale e flessionale dimostrando ottime caratteristiche, ben superiori a quelle dei precedenti poliuretani, ed è stato anche sottoposto a prove di flusso per testarne la compatibilità ematica, confermando la non trombogenicità.
Fig. 2.4: Protesi valvolare aortica in SIBS. I leaflets sono stati rinforzati in PET per aumentare la resistenza meccanica (Pinchuk et al., 2008).
2.4 Nuovi prototipi valvolari polimerici
Proprio con l’intento di creare un nuovo prototipo valvolare polimerico è nato il progetto in cui si inserisce questo lavoro di tesi, voluto dalla collaborazione fra il Dipartimento di Chimica, Materiali e Ingegneria Chimica “Giulio Natta” (Laboratorio di Meccanica delle Strutture Biologiche, LaBS) del Politecnico di Milano e il Dipartimento di Ingegneria Chimica e Biotecnologie dell’Università di Cambridge (UK). Lo scopo di questa collaborazione è quello di creare una protesi valvolare biomorfa, in grado di imitare non solo la morfologia, ma anche le proprietà meccaniche e strutturali.
Per creare questa protesi innovativa sono stati scelti dei particolari materiali, i polimeri a blocchi, che, come detto precedentemente, presentano un’ottima resistenza a corrosione e resistenza a idrolisi in vivo, evitando la formazione di trombi. Inoltre, grazie proprio alla loro struttura sono caratterizzate da una matrice flessibile ma con micro-catene più rigide che assicurano maggiore resistenza meccanica nelle zone sottoposte a maggiori sollecitazioni (Pinchuk et al., 2008).
In un precedente lavoro di tesi (Carro e De Gaetano, 2012) sono stati creati mediante
compression moulding sette prototipi, di cui sei in SIBS
(poli-[Stirene-Isoprene-Butadiene-Stirene]) con differenti percentuali di polistirene e diverse temperature di stampaggio, e una in SIS (poli [Stirene-Isoprene-Stirene]); inoltre, solo tre di esse sono state create con catene polimeriche orientate (Fig. 2.5).
Dai risultati ottenuti si è osservato che:
Le valvole con struttura anisotropa orientata resistono meglio alle sollecitazioni; Tramite le prove in flusso pulsatile risulta che le valvole con percentuale maggiore
di polistirene sono quelle più stenotiche;
Dalle prove in flusso continuo si è osservato, per portate elevate, il cambiamento di curvatura di un lembo valvolare che comporta un brusco abbassamento di pressione a cavallo della valvola.
Fig. 2.5: Prime otto valvole create e poi sottoposte a test.
Considerando questi risultati sono stati creati dall’Università di Cambridge due nuovi gruppi di valvole, con l’intento di unire i pregi delle prime sette valvole ed eliminarne i difetti. Per questo motivo è stata scelta una percentuale di stirene pari al 19% per tutte le valvole in SIBS, in quanto le valvole create in questo modo mostravano risultati migliori, mentre è stata scelta una percentuale di polistirene pari al 30% per le valvole in SIS, vista la cedevolezza delle precedenti SIS con frazione del 19%. Inoltre, tutte hanno domini orientati, viste le perdite di carico minori mostrate dalle valvole con catene polimeriche orientate. I due gruppi sono (Fig. 2.6):
SIBS 19: Kraton D1171 P (poli [Stirene-Isoprene-Butadiene-Stirene] lineare) con frazione di polistirene pari al 19%, struttura a domini orientati e temperatura di stampaggio 150°C;
SIS 30: Kraton D1124 P (poli[Stirene-Isoprene-Stirene] radiale) con frazione di polistirene pari al 30%, struttura a domini orientati e temperatura di stampaggio a 150°C.
Per quanto riguarda invece le dimensioni, entrambi i nuovi gruppi hanno le seguenti caratteristiche:
Diametro interno = 22 mm; Diametro esterno = 28 mm; Altezza Leaflet ~ 10.7 ÷ 10.9 mm; Spessore Leaflet ~ 0.36 ÷ 0.42 mm.
Questo secondo gruppo di valvole, oggetto di test in un progetto di tesi precedente (Cavallo e Ielapi, 2013), è stato sottoposto a test anche in questo progetto per mettere in evidenza altri aspetti del comportamento delle protesi, come per esempio se fosse possibile individuare la vena contratta mediante misurazioni di pressione in punti differenti del circuito rispetto a quelli della tesi precedente.
In seguito una nuova generazione di valvole è stata creata con una tecnica di produzione del polimero, l’injection moulding, che permette un migliore controllo dei parametri di lavorazione e soprattutto una produzione a livello industriale delle protesi valvolari.
Il materiale utilizzato per i nuovi prototipi valvolari è il copolimero SEPS (poli[Stirene-Etilene-Polipropilene-Stirene]lineare) con una percentuale di stirene del 22%. A tale gruppo appartengono diverse famiglie che si differenziano tra loro per la temperatura del mould, che varia tra 155°C e 170°C, e per la velocità di iniezione, che assume valori di 0.1 mm/s, 0.2 mm/s, 0.4 mm/s e 0.5 mm/s.
Per quanto riguarda, invece, le dimensioni, i nuovi prototipi valvolari hanno diametro interno di 21 o 23 mm e forma dell’anulus esterno non più circolare, ma poligonale (Fig. 2.7).
a) b)
Fig. 2.7: Esempi fronte (a) e retro (b) di valvole in SEPS.
Lo spessore dei leaflets non è omogeneo sia tra diverse valvole sia tra leaflets diversi della stessa valvola, per quanto l’ordine di grandezza rimanga nell’intorno degli 0.3 mm. Tale non omogeneità dipende dalla difficoltà di controllare pressioni e velocità durante l’iniezione del polimero nello stampo, soprattutto per componenti inferiori al millimetro di grandezza.
2.4.1 Compression Moulding
Il compression moulding è una metodo di formatura dei polimeri largamente utilizzato, che prevede l’introduzione della materia plastica sotto forma di granuli, polvere o pastiglie in uno stampo riscaldato dove viene fuso e modellato secondo la forma dello stampo nel momento in cui un controstampo attua un’elevata pressione (Tanzi, 2010). Lo stampo è generalmente costruito in acciaio inossidabile e riscaldato mediante gas, vapore o resistenze elettriche: in esso il polimero si ammorbidisce e, sotto l’azione della pressione, riempie completamente la cavità e ne assume la forma. In seguito avviene il raffreddamento, l’apertura dello stampo e l’espulsione dell’oggetto finale (Fig. 2.8).
Fig.2.8: Esempio di funzionamento del processo di compression moulding (www.sinotech.com).
Questo processo è molto meno costoso rispetto ad altri come lo stampaggio a iniezione o a colata e, inoltre, garantisce un minore spreco di materie di prime. Permette la creazione di pezzi anche di grandi dimensioni e deteriora meno le fibre del materiale. Come aspetti negativi invece si annoverano la bassa consistenza del prodotto finale, la presenza di sbavature, il fatto che non si possono ottenere forme troppo complesse, la difficoltà nell’eliminare completamente la presenza di aria nello stampo e la difficoltà nel controllare l’orientamento delle catene del materiale (www.efunda.com).
2.4.2 Injection moulding
L’injection moulding è un processo industriale di formazione dei materiali termoplastici. Tale tecnica prevede l’utilizzo di un macchinario che surriscalda il polimero fino a fusione
per poi iniettarlo tramite pressioni elevate all’interno di uno stampo (Fig. 2.9) (Tanzi, 2010).
Il polimero, sotto forma di granuli, viene inserito in un cilindro dove viene scaldato fino a fusione mediante una serie di resistenze elettriche. A questo punto sul polimero viene applicata una pressione elevata, grazie ad una vite mobile o ad un pistone, per inserirlo nello stampo finale. Quest’ultimo viene tenuto in posizione da un gruppo di chiusura che deve contrastare l’elevata pressione che si genera. Controllando la velocità di avanzamento della vite e le pressioni è possibile controllare l’orientamento delle catene e, di conseguenza, le caratteristiche meccaniche del pezzo finale (Tanzi, 2010).
Fig. 2.9: Esempio di funzionamento del processo di injection moulding: controllore (RAM), cilindro e vite mobile (barrel e screw), resistenze elettriche (heaters), ugello (nozzle) e stampo (mold).
(www.vivitrolabs.com).
È un processo che permette di ottenere una lavorazione molto precisa, ma è anche costoso, in quanto sono necessarie elevate temperature ma soprattutto una elevata precisione del software che gestisce il macchinario; i costi, inoltre, aumentano ovviamente in base al numero di cavità in cui viene fuso il materiale e alla complessità del prodotto che si vuole ottenere, dovuta alla possibile presenza di tolleranze, rifiniture superficiali o filettature interne o esterne (www.advancedrubberproducts.com).
CAPITOLO 3
3.1 Banchi prova: cenni generali
Un banco prova per protesi valvolari è un dispositivo che permette di simulare l’ambiente di lavoro in vivo, ricreando le condizioni di pressione, flusso e volumi del cuore. Per fare questo i banchi prova necessitano di elementi che simulino sia il cuore o il ventricolo sia la circolazione periferica.
I simulatori esistenti possono essere divisi in base ai sistemi di attuazione che vengono usati. Una prima tipologia è quella che prevede un pistone che mette in movimento il liquido di prova direttamente all’interno del circuito, mentre una seconda tipologia è quella che utilizza una pompa che comprime un fluido di servizio il quale a sua volta mette in movimento il liquido di utilizzo posto all’interno di una sacca collassabile che simula il ventricolo.
Un’ulteriore suddivisione dei banchi prova si basa sugli elementi utilizzati per simulare le impedenze sistemiche. La circolazione sistemica è caratterizzata da resistenze, inertanze e compliance, ma la progettazione del numero di parametri da utilizzare e la loro tipologia dipende dalle scelte operate per il singolo banco prova, in base a ciò su cui si desidera focalizzarsi nell’analisi delle protesi valvolari da testare. Per decidere quali e quanti parametri usare è necessario effettuare prima una progettazione a parametri concentrati, che prevede la simulazione del comportamento fluidodinamico del circuito mediante l’analogia con i modelli elettrici. Le analogie fra grandezze idrauliche ed elettriche sono indicate in tabella 3.1, mentre le relazioni fondamentali che legano le grandezze del circuito sono:
; (3.1)
; (3.2)
Tabella 3.1: Analogie fra grandezze idrauliche ed elettriche.
Grandezze Idrauliche Grandezze Elettriche
Pressione Tensione Portata Corrente Resistenza idraulica Resistenza elettrica
Inertanza Induttanza Compliance Capacità
Modelli con un maggior numero di parametri permettono una migliore simulazione del comportamento reale del circuito, ma anche un costo maggiore in termini economici dovuto all’aumento dei componenti fisici del circuito stesso. Un numero minore di parametri invece permette di avere un circuito più semplice in termini di realizzazione e set-up, riducendo ingombri e pesi. Un esempio di circuito è quello a tre parametri utilizzato anche nel banco prova usato in questo progetto di tesi: questo modello, infatti, riproduce in modo adeguato sia le impedenze sia le curve di portata fisiologiche ed è competitivo rispetto al modello a quattro parametri o al modello a cinque parametri.
3.2 Normative banchi prova
La norma UNI EN ISO 5840 definisce le tipologie di test a cui devono essere sottoposti tutti i dispositivi impiantabili nel cuore umano, come le valvole cardiache sostitutive, e i requisiti che tali dispositivi devono possedere per definirsi impiantabili (UNI EN ISO 5840, 2005). Tale norma è la versione europea della norma ISO 5840 applicabile in tutto il mondo, emanata nel 2005.
In primo luogo, la norma definisce le specifiche di progetto che devono essere rispettate nella progettazione di una valvola cardiaca artificiale: essa deve garantire il flusso del sangue senza provocare elevati gradienti pressori, essere biocompatibile (non deve cioè provocare emolisi, trombosi o embolie), mantenere le proprie caratteristiche meccaniche per almeno 400 milioni di cicli, essere impiantabile in tutta la popolazione target ed essere compatibile con i metodi di diagnostica clinica.