CAPITOLO 1
IL SISTEMA CITOCROMO P450
1.1 Proprietà e struttura del citocromo P450
Il sistema monossigenasico citocromo P450 dipendente è noto anche come sistema ossidasico a funzione mista (Mixed Function Oxidase System, o M.F.O.S.), ed è il complesso enzimatico più versatile esistente in natura.
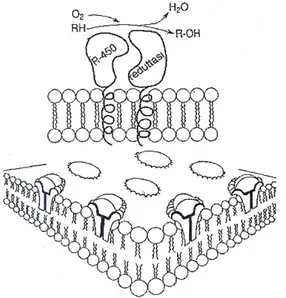
Nei procarioti questi enzimi si trovano liberi nel citosol, mentre negli eucarioti sono associati alla matrice fosfolipidica del reticolo endoplasmatico liscio (Fig. 1) ed alla membrana mitocondriale interna. La presenza dei fosfolipidi favorisce l'interazione tra gli enzimi costituenti il complesso e l'accessibiltà del substrato al sistema enzimatico attivo.
Fig. 1: Disposizione del sistema monossigenasico nel reticolo endoplasmatico liscio delle cellule eucariotiche.
Il nome citocromo P450 (CYP) deriva dalle caratteristiche spettrali di questa superfamiglia di enzimi che, nella loro forma ridotta e coniugata con il monossido di carbonio, presentano un massimo di assorbimento alla lunghezza d'onda di 450 nm, anziché a 420 nm come avviene per tutte le altre emoproteine.
Il sistema ossidativo è un complesso multienzimatico composto essenzialmente da:
emoproteine;
• una reduttasi, necessaria affinché avvenga la reazione monossigenasica, per il trasferimento degli equivalenti riducenti al sito catalitico dell'enzima.
Negli eucarioti gli elettroni sono forniti dal NADPH, mentre nei sistemi batterico e mitocondriale il donatore di elettroni è rappresentato dal NADH.
A seconda di come gli elettroni vengono trasportati dal donatore al sito catalitico dell'enzima, i CYP vengono classificati in quattro diverse classi:
¾ Classe I: sono enzimi che richiedono due enzimi per il trasporto degli elettroni, una
proteina Fe/S, detta ferredoxina, ed una flavoproteina contenente il FAD come gruppo prostetico, detta ferredoxina reduttasi. Gli equivalenti riducenti vengono trasferiti dal NADH alla ferredoxina reduttasi, che a sua volta li trasferisce alla ferredoxina, dalla quale fluiscono al citocromo P450. Questi enzimi si trovano nelle cellule procariotiche e nella membrana mitocondriale interna delle cellule eucariotiche.
¾ Classe II: sono enzimi che necessitano esclusivamente della presenza di una
flavoproteina, contenente sia il FAD (flavina adenin dinucleotide) che la FMN (flavina mononucleotide) come gruppi prostetici, chiamata NADPH-citocromo P450-reduttasi. Le due flavine sono legate alla reduttasi per mezzo di un dominio idrofilico carbossiterminale, mentre un dominio idrofobico amminoterminale permette alla reduttasi di ancorarsi alla membrana e interagire con il citocromo. Sono i più comuni nelle cellule eucariotiche, localizzati nella membrana del reticolo endoplasmatico liscio.
¾ Classe III: sono enzimi che, a differenza di quelli di classe I e II, non richiedono
alcun donatore di elettroni né di ossigeno.
¾ Classe IV: sono quelli che ricevono elettroni direttamente dal NADH. Questi
enzimi sono stati trovati esclusivamente nei funghi dove riducono l'NO a N2O.
Per completare la reazione monossigenasica mediante il trasferimento di un secondo elettrone, alcune isoforme di P450 (ad esempio il CYP2E1), oltre alla NADPH-citocromo
Negli animali il sistema citocromo P450 è particolarmente abbondante a livello epatico, dove, ad oggi, sono state identificate più di 200 isoforme diverse. E' interessante notare che, pur appartenendo ad un'unica superfamiglia genica, le varie isoforme di CYP differiscono per struttura primaria, peso molecolare, specificità di substrato, chimica e stereochimica dei prodotti, proprietà spettrali.
Inoltre esse possono essere espresse costitutivamente o essere indotte da varie molecole naturali o di sintesi. Possono essere specie-specifiche, sesso-specifiche e tessuto-specifiche, e possono anche essere up-regolate in condizioni fisiologiche o patologiche (ad esempio digiuno o diabete).
Ulteriori differenze si notano nella regolazione della loro espressione che può avvenire a molteplici livelli: per modulazione trascrizionale o traduzionale, ma anche a livello post-trascrizionale o post-traduzionale, per processi di stabilizzazione dell'mRNA (come accade, ad esempio per il CYP1B1) o della stessa proteina (come, ad esempio, per il CYP2E1) (Kato and Yamazoe, 1992; Ryan and Lewin, 1990).
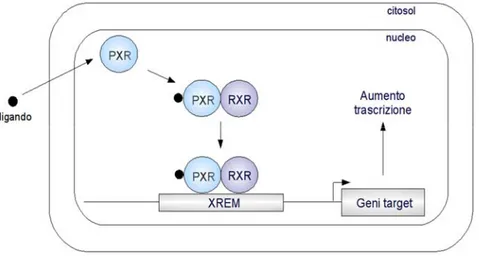
La regolazione a livello trascrizionale avviene attraverso l'azione di recettori nucleari, con il seguente schema generale: lo xenobiotico si lega, o attiva indirettamente, il recettore nucleare che si trova, inizialmente, nel citosol. A seguito di questa attivazione, tale recettore trasloca nel nucleo della cellula, dove eterodimerizza con un secondo fattore. Infine, il dimero attiva la trascrizione legandosi a specifiche sequenze “enhancer” presenti nella regione regolatoria dei geni.
Fig. 2: Meccanismo di attivazione di PXR (RXR: retinoic acid receptor, XREM: xenobiotic responsive element).
Questo schema generale, come mostrato in figura 2, si adatta, ad esempio, all'azione esplicata dal recettore nucleare pregnane X receptor (PXR), responsabile dell'induzione mediata da xenobiotici di una serie di geni, tra cui i citocromi P450 delle sottofamiglie 3A, 2C e 2B.
Particolarmente significativo è il fatto che, nonostante le differenze nella sequenza amminoacidica e nell'attività catalitica derivanti dal processo evolutivo, la struttura tridimensionale e l'assetto funzionale dei CYP450 siano rimasti pressoché inalterati. In particolare, risultano altamente conservati la regione legante l'eme, il sito di trasferimento degli elettroni tra la reduttasi ed il citocromo, e la regione che lega l'ossigeno.
Studi sulla struttura primaria di vari citocromi P450 hanno portato a concludere che questi enzimi sono tutti prodotti genici distinti, costituiti da una singola catena polipeptidica contenente una componente eminica, ed un peso molecolare tra 48 e 57 kDa (corrispondente a circa 500 residui amminoacidici).
La catena polipeptidica, nonostante la diversità nella sequenza degli amminoacidi, presenta sempre una regione idrofobica all'estremità amminoterminale, di circa 10-15 amminoacidi, che è responsabile, negli eucarioti, dell'ancoraggio del citocromo alla membrana. A questa regione seguono una breve sequenza cationica ed una serie di proline. La restante parte della catena è rivolta verso il citosol e presenta tratti di sequenza idrofobici alternati a tratti idrofilici (Backes, 1993; Ryan and Lewin, 1990).
Analizzando, invece, la struttura secondaria con specifiche tecniche è stato evidenziato che nell'enzima sono presenti tratti amminoacidici ripiegati a formare sia α-eliche che foglietti-β (foglietti-β1-β5).
Per quanto riguarda la struttura tridimensionale, sono disponibili immagini ai raggi X e modelli computazionali di alcuni citocromi idrosolubili. Si tratta, per lo più, di CYP450 batterici, poiché negli eucarioti si trovano immersi nella membrana fosfolipidica, risultando, quindi, di difficile cristallizzazione.
Dallo studio delle proteine cristallizzate, e dalla successiva comparazione con le sequenze dei CYP450 noti, è emerso che la regione maggiormente conservata è quella che circonda l'eme, detta “core”. Essa è implicata nel legame con l'ossigeno e nel trasferimento degli equivalenti riducenti tra la reduttasi ed il citocromo stesso.
X-Arg, completamente conservato in tutte le isoforme e probabilmente indispensabile per la stabilizzazione del core stesso.
Le regioni che presentano la sequenza meno conservata sono, invece, rappresentate dal sito di riconoscimento del substrato e dalla regione amminoterminale.
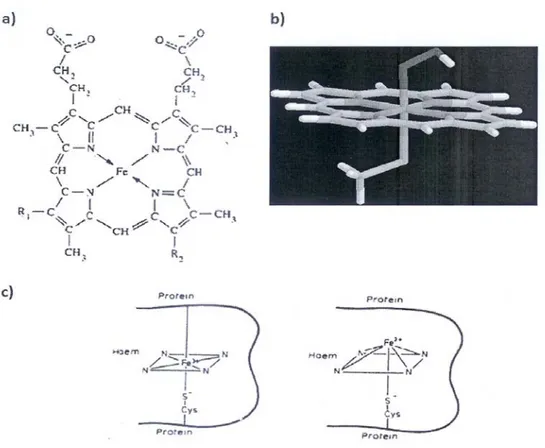
In quanto emoproteina, ogni citocromo P450 presenta come gruppo prostetico una ferroprotoporfirina IX che si trova a livello del core, inserito in una tasca idrofobica. In seno a questa tasca, oltre ad interazioni idrofobiche ed attrazioni coulombiane, si stabilisce un legame di coordinazione fra il ferro dell'eme, al centro dell'anello tetrapirrolico, ed una cisteina dell'apoproteina (Poulos, 1991), come illustrato in figura 3.
Fig. 3: a) Schema del gruppo prostetico del citocromo P450; b) modello tridimensionale; c) a sinistra, ferro esacoordinato nel piano dell'eme; a destra, ferro pentacoordinato fuori dal piano dell'eme. L'atomo di ferro forma inoltre quattro legami planari con gli atomi d'azoto dello stesso anello tetrapirrolico. Potendo essere sia esa- che penta-coordinato, esso può stabilire un sesto legame labile con un ligando, come ad esempio un atomo di ossigeno di una molecola d'acqua o, nelle cellule eucariotiche, con l'ossigeno dell'acido oleico appartenente
alla componente lipidica del reticolo endoplasmatico.
Quando l'atomo di ferro viene ridotto allo stato ferroso (Fe2+), si stabilisce il sesto legame con l'ossigeno molecolare.
1.2 La reazione monossigenasica
Il meccanismo della reazione monossigenasica sembra essere lo stesso per tutte le isoforme di CYP450, da quelle batteriche a quelle di mammifero, e questo si verifica nonostante la grande varietà di substrati che l'enzima è in grado di metabolizzare (Porter and Coon, 1991).
La reazione può essere schematizzata nel seguente modo:
RH + O2 + NADPH + H+ → ROH + H2O + NADP+
dove con RH si indica il substrato e con ROH il substrato idrossilato.
Un atomo dell'ossigeno molecolare viene, così, ridotto ad acqua, mentre l'altro atomo di ossigeno viene inserito nel substrato.
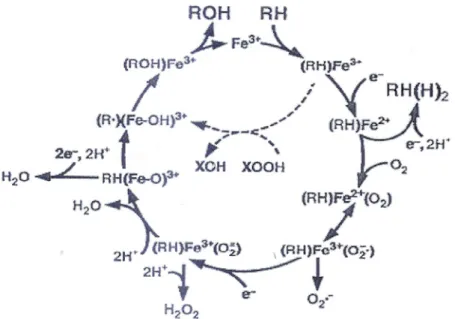
In figura 4 è illustrato il ciclo monossigenasico con i suoi sette passaggi fondamentali:
1. A livello del sito attivo del citocromo P450 si verifica l'interazione tra il substrato ed il ferro dell'eme, che si trova nello stato ossidato (Fe3+). Prima del legame del
substrato, il ferro è in uno stato di low spin, ossia con un solo elettrone spaiato negli orbitali 3d, ed è legato con un legame di coordinazione ad una molecola d'acqua. La presenza del substrato determina la rottura del legame tra il ferro e l'acqua, provocando la fuoriuscita dell'atomo di ferro dal piano dell'eme. Questo evento causa variazioni energetiche negli orbitali molecolari del ferro, che passa dallo stato di low a quello di high spin.
Fig. 4: Ciclo catalitico del citocromo P450. Con Fe è indicato l'atomo di ferro dell'eme, con RH il substrato e con ROH il prodotto della reazione monossigenasica.
3. Il ferro ridotto (Fe2+) lega l'ossigeno molecolare a livello del sesto legame di coordinazione, lasciato libero dall'acqua.
4. La molecola di ossigeno viene attivata dal trasferimento di un secondo equivalente riducente, proveniente sempre dal NADPH o dal NADH.
5. Si verifica la rottura emolitica del legame O-O con la produzione di una molecola di acqua e la formazione del complesso elettrofilo (FeO3+).
6. L'ossigeno viene trasferito dal complesso elettrofilo al substrato, che diventa più polare e meno affine per l'enzima.
7. Il prodotto della reazione monossigenasica viene rilasciato dal sito attivo del citocromo P450 che torna allo stato iniziale, disponibile per un nuovo ciclo catalitico.
Nel caso in cui il ciclo catalitico venga interrotto prima del suo completamento, si può avere la formazione di specie reattive dell'ossigeno, quali l'anione superossido ed il
perossido di idrogeno (Fig 4).
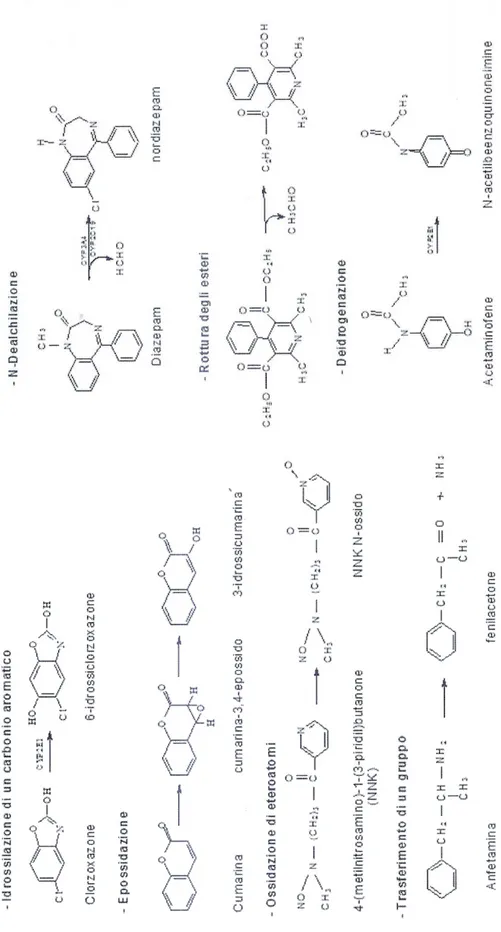
Secondo lo schema appena descritto le isoforme di citocromo P450 possono essere coinvolte in numerosi tipi di reazioni, sia ossidative che riduttive, quali idrossilazioni, epossidazioni, perossidazioni, idrolisi, dealchilazione di gruppi alchilici legati ad eteroatomi, rottura degli esteri, deidrogenazioni, agendo su un'enorme varietà di substrati. In base al substrato ed alla reazione catalizzata, il citocromo P450 può agire come detossificante, rendendo più idrosolubili molecole lipofile, o come bioattivatore, generando metaboliti reattivi da molecole inerti.
1.3 Evoluzione del citocromo P450
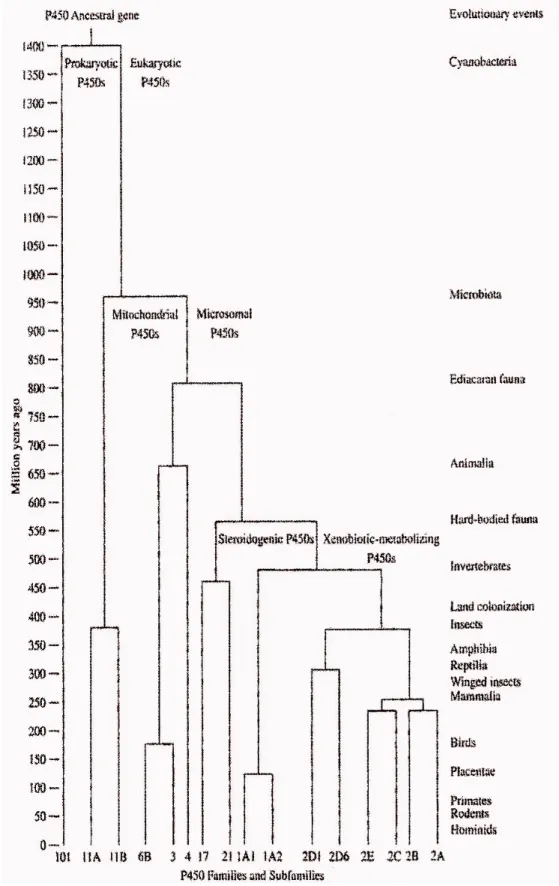
Geni che codificano per i citocromi P450 sono stati rinvenuti in tutti e cinque i regni biologici. Essi sono stati riscontrati anche negli archebatteri, che sono tra gli organismi conosciuti più antichi, ma non in alcuni procarioti più primitivi; questo ci permette di ipotizzare che il primo gene ancestrale per questi enzimi si sia evoluto circa 3,5 miliardi di anni fa, quando l'atmosfera era ancora povera di ossigeno.
Il ruolo del P450 ancestrale, presente in microrganismi anaerobi, era di ridurre i nitrocomposti, reazione peraltro inibita dall'ossigeno (Nakahara et al., 1993).
Quando comparvero i cianobatteri e le alghe azzurre si ebbe un notevole aumento del contenuto di ossigeno atmosferico e questo avrebbe determinato l'evoluzione del citocromo P450 in un enzima capace di legare e ridurre l'ossigeno a ione superossido e, successivamente, a perossido di idrogeno.
Questa capacità, acquisita dal citocromo P450 circa 2 miliardi di anni fa, rese possibile la sua ulteriore evoluzione. Si verificarono altre mutazioni che permisero a questi enzimi di funzionare da monossigenasi, e quindi di metabolizzare molecole organiche endogene come gli steroidi, gli acidi grassi e gli eicosanoidi.
Quando cominciò la separazione tra animali e piante, circa 1 miliardo di anni fa (figura 5), i primi iniziarono ad utilizzare i citocromi P450 per proteggersi dalle sostanze tossiche
Negli ultimi 400 milioni di anni, con la comparsa, nel Cambriano, dei vertebrati, si è verificata un'esplosione di nuove isoforme che si sarebbero generate tramite processi di conversione genica, duplicazioni, amplificazioni e perdita di geni. Tale processo si è ulteriormente espanso con la comparsa dei mammiferi, circa 120-130 milioni di anni fa, e da allora le diverse specie animali, colonizzanti le più varie nicchie ecologiche, continuano ad aumentare la quantità e le capacità dei CYP.
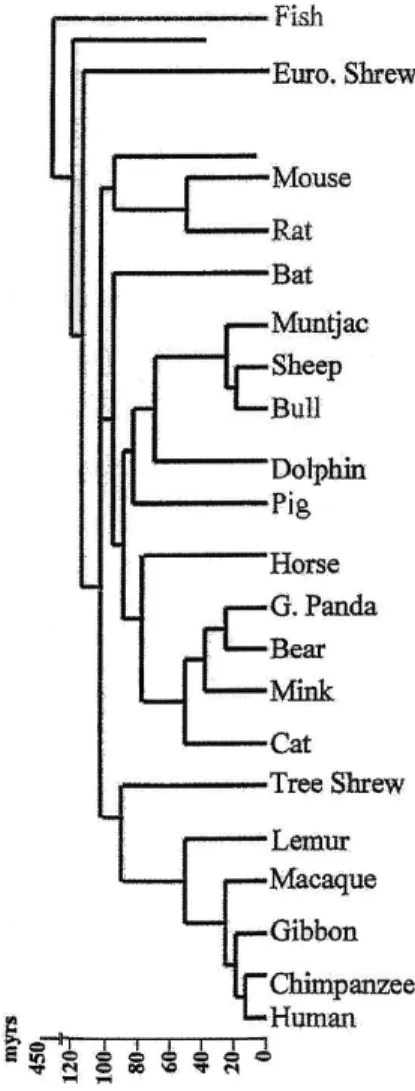
In figura 6 è possibile osservare come sia avvenuta l'evoluzione delle varie specie di vertebrati. E' da notare che il suino è rimasto immutato, dal punto di vista filogenetico, da più di 80 milioni di anni, mentre il topo ed il ratto risalgono a circa 40 milioni di anni fa. L'uomo, la specie più recente, risale a 10 milioni da anni fa.
1.4 Ruolo del citocromo P450
Tra i sistemi enzimatici esistenti in natura il sistema monossigenasico citocromo P450 dipendente ha un ruolo predominante nel metabolismo sia di composti esogeni, con azione di bioattivazione o di detossificazione, che endogeni, con la formazione di molecole coinvolte in importanti vie fisiologiche, ad esempio acidi grassi, steroidi, acidi biliari (Ryan et al., 1990).
Importanti caratteristiche del sistema del citocromo P450 sono il grande numero e l'ampia varietà di classi strutturali dei suoi substrati, la diversità delle reazioni e, in generale, la loro selettività ed, in alcuni casi, perfino specificità, dei substrati. Questo è specialmente vero per i CYP presenti in preparati microsomiali di mammifero associati con il metabolismo ossidativo di farmaci ed altri composti esogeni.
Tutti gli organismi sono costantemente esposti a sostanze chimiche esterne (xenobiotici), sia di origine naturale, come ad esempio le tossine prodotte da muffe, piante ed animali, i prodotti di pirolisi presenti nei cibi cotti e gli alcaloidi, sia di origine sintetica, come i pesticidi, i solventi, gli inquinanti ambientali ed i farmaci.
Le caratteristiche lipofiliche di queste sostanze ne permettono l'assorbimento attraverso la pelle, il tratto gastro-intestinale ed i polmoni, ma allo stesso tempo ne ostacolano l'eliminazione, che dipende principalmente dalla loro conversione in composti idrosolubili attraverso un processo di biotrasformazione che avviene prevalentemente nel fegato.
Se tale processo non avvenisse, gli xenobiotici sarebbero eliminati molto lentamente, così da divenire tossici per l'organismo; nonostante ciò, durante la biotrasformazione, spesso si formano delle specie reattive dell'ossigeno altamente instabili e capaci di interagire con le macromolecole cellulari, con conseguente effetto tossico e cancerogeno.
Talvolta, inoltre, può accadere che i farmaci vengano metabolizzati, ed inattivati, troppo rapidamente dai CYP, e che non riescano ad espletare la loro azione terapeutica, mentre altri possono venire trasformati in metaboliti tossici con pericolose conseguenze per l'organismo.
Infine, alcuni composti sono in grado di inibire o indurre l'attività di particolari isoforme di citocromo P450, determinando alterazioni che possono causare, ad esempio, interazioni tra farmaci.
reazioni di fase 1 e di fase 2. Le reazioni di fase 1, dette anche di funzionalizzazione, consistono in idrolisi, riduzione o ossidazione delle sostanze esogene, con il compito di introdurre un gruppo funzionale che ne aumenti l'idrofilicità. Le reazioni di fase 2 includono glucuronidazione, solfonazione, acetilazione, metilazione e coniugazione con il glutatione o con amminoacidi, ed hanno il compito di rendere i composti facilmente eliminabili.
Tra gli enzimi di fase 1, il sistema citocromo P450 svolge un ruolo predominante nella biotrasformazione degli xenobiotici, catalizzando numerosi tipi di reazioni, i cui esempi sono riportati in figura 7:
− idrossilazione di un carbonio alifatico o aromatico; − epossidazione di un doppio legame;
− ossidazione di eteroatomi (S-, N-, I-) e N-idrossilazione; − dealchilazione di eteroatomi (O-, S-, N-);
− trasferimento di un gruppo ossidativo; − rottura di esteri;
− deidrogenazione.
Molti CYP sono in grado di compiere reazioni di riduzione di composti esogeni, e la capacità di compiere tali reazioni può essere chiarita analizzando il ciclo catalitico del citocromo P450. Durante questo ciclo, in condizioni aerobiche, la riduzione dell'atomo di ferro dell'eme permette il legame dell'ossigeno; in condizioni anaerobie, però, il ciclo si interrompe, ed è a questo punto che il P450 diventa capace di ridurre il substrato. In questo modo il CYP può catalizzare reazioni di riduzione quali l'azo- e la nitro-riduzione, e la dealogenazione riduttiva in condizioni di bassa tensione di ossigeno.
1.5 Nomenclatura del citocromo P450
Al citocromo P450 non è applicabile la classica nomenclatura enzimatica, poiché ogni isoenzima può catalizzare più di una reazione.
Per le varie isoforme di P450 viene utilizzata, quindi, una nomenclatura basata sull'omologia della sequenza amminoacidica. Questo tipo di classificazione permette di identificare in maniera univoca un isoenzima, ma non dà alcuna informazione sulle proprietà catalitiche; due proteine che appartengono alla stessa famiglia possono essere regolate in modo diverso e possedere una differente specificità di substrato.
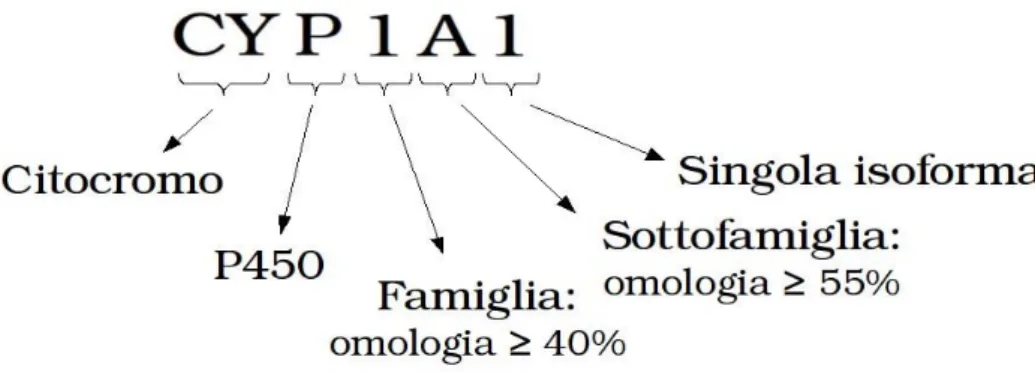
La superfamiglia dei P450 è suddivisa in famiglie, sottofamiglie e singole isoforme.
Appartengono alla stessa famiglia (indicata con un numero arabo) le isoforme che mostrano un'omologia di sequenza superiore al 40%; quelle con identità maggiore del 55% fanno parte della medesima sottofamiglia (indicata con una lettera maiuscola); le singole isoforme della sottofamiglia, infine, vengono indicate con un numero arabo (Fig. 8).
Fig. 8: Classificazione delle isoforme di citocromo P450.
Per una stessa isoforma di citocromo P450 possono esistere più varianti alleliche. Si considerano alleli diversi di uno stesso gene le sequenze nucleotidiche che danno origine a proteine con sequenza amminoacidica divergente per meno del 3% (Nelson et al., 1996). Le famiglie indicate con un numero che va da 1 a 51 sono proprie degli animali, quelle da 51 a 70 dei funghi, da 71 a 99 si ritrovano nelle piante, mentre la famiglia 100 e le superiori sono specifiche dei batteri.
diverse isoforme: nel genoma di ratto sono stati identificati e sequenziati 84 geni, 103 nel topo e 57 nell'uomo (http://drnelson.utmem.edu/CytochromeP450.html).
Le famiglie maggiormente studiate fino ad ora nei mammiferi sono le prime quattro: le famiglie 1, 2 e 3 sono implicate soprattutto nel metabolismo degli xenobiotici, ma partecipano anche al metabolismo di substrati endogeni; la famiglia 4 metabolizza sia sostanze esogene che endogene. Le altre famiglie, indicate con un numero superiore a 4, metabolizzano soprattutto molecole endogene.
Di seguito sono descritte alcune caratteristiche generali per i membri delle prime quattro famiglie.
¾ Famiglia 1
Questa famiglia comprende i CYP1A1, CYP1A2 e CYP1B1, che sono altamente inducibili da idrocarburi policiclici aromatici (PAHs) come il 3-metilcolantrene o il benzo[a]pirene (presenti, ad esempio, nel fumo di sigaretta), dai flavonoidi come il β-naftoflavone (β-NF) (presente nelle piante), e da idrocarburi aromatici polialogenati come la diossina (TCDD). Le prime due isoforme sopra citate sono attivate da queste sostanze, e le metabolizzano in composti cancerogeni. Ad esempio alti livelli di CYP1A2 sono correlati con un aumento di rischio di comparsa del cancro al colon e, poiché questo isoenzima è fortemente indotto dal fumo di sigaretta, è stato possibile tracciare una correlazione diretta tra il fumo e questo tipo di cancro.
Il CYP1B1 è l'unico costituente della sottofamiglia 1B, e svolge un importante ruolo fisiologico dal momento che mutazioni a livello di questo gene possono determinare lo sviluppo di un glaucoma congenito. Inoltre, la presenza di questa proteina è stata riscontrata in numerosi tessuti colpiti da tumore.
Il meccanismo di regolazione dell'espressione di questi geni è noto: gli specifici ligandi si legano al recettore citoplasmatico AhR (Aryl hydrocarbon Receptor), che trasloca nel nucleo ed eterodimerizza con ARNT, il trasportatore nucleare del recettore Ah. L'eterodimero AhR-ARNT si lega, poi, sul DNA a specifiche sequenze presenti nella regione regolatoria a monte dei geni, chiamate XREs (Xenobiotic Responsive Elements), che ne stimolano la trascrizione.
Per il CYP1A2, tuttavia, ci sono ancora dei dubbi riguardo alla sua modulazione, e comunque è noto che i CYP1A1 e CYP1A2 differiscono nel pattern di induzione, nel numero e nella localizzazione delle sequenze XRE e nella funzione. Entrambi i geni contengono 7 esoni ed hanno un'identità di sequenza del 70%, ma l'induzione del CYP1A2 avviene a dosi più basse rispetto al CYP1A1, richiede fattori epato-specifici, e spesso coinvolge meccanismi di stabilizzazione dell'mRNA e della proteina dalla degradazione. Il citocromo P450 1A2, inoltre, è molto espresso a livello epatico, a differenza del CYP1A1 che è presente nel fegato fetale ma si riscontra solo a bassi livelli in quello dell'adulto. Il CYP1A1 è, invece, presente soprattutto a livello extraepatico, ad esempio nei polmoni, nell'intestino, nella pelle, nei linfociti e nella placenta (particolarmente nei soggetti fumatori).
Esistono anche differenze specie-specifiche nell'affinità del CYP1A2 per alcuni xenobiotici, ad esempio la furafillina è un potente inibitore di questa isoforma nell'uomo mentre nel ratto ha un effetto molto debole.
Sebbene i livelli di espressione del CYP1A2 siano estremamente variabili tra gli individui, i difetti genici sono molto rari (<1%).
A differenza dei due isoenzimi descritti sopra, il CYP1B1 presenta solo 3 esoni ed è localizzato sul cromosoma 2 anziché sul 15. Nell'uomo risulta poco espresso nel fegato ma molto rappresentato negli organi extraepatici. Questa isoforma è coinvolta nella formazione di molte forme di cancro, inclusi i tumori estrogeno-dipendenti poiché catalizza l'idrossilazione del β-estradiolo in 4-idrossiestradiolo, il quale si ossida facilmente ad O-chinone che può legarsi al DNA.
¾ Famiglia 2
La famiglia 2 è costituita da ben 13 sottofamiglie: 2A, 2B, 2C, 2D, 2E, 2F, 2G, 2J, 2R, 2S, 2T, 2U e 2W. Circa 1/3 delle isoforme umane di citocromo P450 appartengono a questa famiglia.
Per quanto riguarda i meccanismi di regolazione dell'espressione, sono particolarmente interessanti quelli relativi alle sottofamiglie 2B e 2E. Nel fegato, il fenobarbital ed i composti analoghi, determinano un'induzione dell'espressione dei CYP2B1/2 controllata dal recettore orfano nucleare CAR (Constitutive Androstane Receptor). E' stato anche dimostrato che, in vitro (nella linea cellulare immortalizzata HepG2), il CAR, se presente nel nucleo, è capace di attivare costitutivamente la trascrizione dei geni 2B e di altri geni anche in assenza di ligandi specifici. In vivo, invece, il CAR non è costitutivamente attivo perché trattenuto nel citoplasma da una serie di proteine, quali le proteine heat-shock, con le quali forma complessi multiproteici. Il fenobarbital, attraverso una cascata di trasduzione del segnale, defosforila CAR che può quindi essere traslocato nel nucleo, dove eterodimerizza con RXR (Retinoid X Receptor). L'eterodimero CAR-RXR si lega a specifiche sequenze “enhancer” presenti nel promotore distale dei geni 2B, chiamate PBRE, attivandone la trascrizione.
L'espressione dei citocromi P450 della sottofamiglia 2B può anche essere modulata da ormoni, ed in particolare dall'ormone della crescita, dall'insulina e dagli ormoni tiroidei, tutti con effetto inibitorio sull'espressione di questi geni.
La regolazione dell'espressione del CYP2E1 è complessa in quanto presente sia a livello trascrizionale che post-trascrizionale, e si diversifica nelle varie specie e nei vari tessuti. Generalmente, l'induzione del CYP2E1 da parte degli xenobiotici si esplica con la modalità post-trascrizionale, per mezzo dell'induzione della traduzione o attraverso una stabilizzazione della proteina.
Alcune condizioni fisiopatologiche, quali il diabete o il digiuno, modulano l'espressione del CYP2E1 a livello trascrizionale, rispettivamente stabilizzando l'mRNA o aumentando la trascrizione stessa.
La sottofamiglia 2C è la più ampia, e l'espressione dei suoi membri può essere modulata da xenobiotici (tramite PXR) e da ormoni.
I membri della sottofamiglia 2D hanno come substrati sostanze xenobiotiche, ma non vengono modulati da essi.
Il CYP2G1 è noto per essere presente soltanto nell'epitelio olfattivo di varie specie di mammiferi, mentre la sottofamiglia 2F è particolarmente espressa nel polmone.
Il citocromo P450 2U1, clonato recentemente nel timo umano, presenta soltanto 5 esoni, a differenza di tutti gli altri membri della famiglia 2 che ne hanno 9. Studi metabolici hanno
dimostrato che il CYP2U1 è capace di biotrasformare acidi grassi saturi e insaturi a catena lunga come l'acido arachidonico, ma non quelli a catena corta come l'acido laurico. Questa isoforma è prevalentemente espressa nel timo e nel cervello dove, verosimilmente, svolge un ruolo importante nel metabolismo endogeno.
Il CYP2S1, isoforma recentemente scoperta nel topo e nell'uomo, appare essere l'unico componente della nuova sottofamiglia 2S. E' localizzato in un cluster di membri della famiglia 2 sul cromosoma 19q umano e, pur appartenendo alla famiglia 2 per l'alta omologia, esibisce caratteristiche tipiche della famiglia 1, come ad esempio l'inducibilità da diossina mediata da AhR. Inoltre, il pattern di espressione di questa isoforma presenta similitudini con quello del CYP1B1: il CYP2S1, prevalentemente extraepatico, mostra i più alti livelli di espressione nei tessuti epiteliali esposti frequentemente agli xenobiotici, quali gli epiteli respiratorio, gastrointestinale, urogenitale e della pelle, ma è fortemente espresso anche nei tessuti che si sono sviluppati come invaginazioni della superficie epiteliale durante l'embriogenesi (quali i reni, le ghiandole surrenali ed il pancreas). L'espressione relativamente alta osservata nei linfociti e nella milza suggerisce che il CYP2S1 possa avere un ruolo importante nella risposta immunitaria. Inoltre, è stato riscontrato anche in molti tumori di origine epiteliale. Il CYP2S1 metabolizza composti endogeni come l'all-trans acido retinoico, ma anche xenobiotici quali la naftalina. Sono stati identificati diversi polimorfismi genici per questa isoforma, il cui ruolo, però, non è ancora noto.
¾ Famiglia 3
Rappresenta una famiglia di enzimi estremamente importante per il metabolismo di molti xenobiotici, ma anche di ormoni steroidei, e comprende una sola sottofamiglia, la P4503A. Nell'uomo i membri di questa famiglia costituiscono circa il 40% delle isoforme totali di P450, e sono in grado di metabolizzare oltre il 60% dei farmaci a medio ed alto peso molecolare.
La sottofamiglia 3A è coinvolta anche nella bioattivazione di alcuni xenobiotici a mutageni e/o cancerogeni. Ad esempio, l'acetaminofene viene convertito dal CYP3A4 umano in un intermedio altamente tossico che, interagendo con le macromolecole cellulari, può portare a necrosi cellulare.
Ormoni steroidei, antibiotici e vari xenobiotici inclusi i barbiturici, modulano l'espressione dei CYP3A a livello trascrizionale tramite un recettore nucleare chiamato pregnane X receptor (PXR). Tale recettore rappresenta un fattore di trascrizione costituito da un dominio di legame al DNA (DBD) ed un dominio di legame al ligando (LBD). Una volta che PXR si è legato all'induttore eterodimerizza con il recettore dell'acido retinoico (RXR), e attiva la trascrizione dei CYP3A legandosi a sequenze “enhancer” presenti nelle regioni regolatorie di tali geni.
Per questa sottofamiglia sono stati identificati molti tipi di induttori che possiedono caratteristiche strutturali anche molto diverse tra loro. Questo è spiegabile con la presenza, a livello del LBD, di un loop flessibile che permette di espandere il sito di legame al ligando, e adattarlo così a molti tipi di molecole. Inoltre, poiché l'LBD presenta un basso grado di omologia fra specie diverse (con soltanto il 76% di omologia tra uomo e ratto), si spiega perché siano state riscontrate differenze tra gli induttori specie-specifici dei CYP3A. E' noto, infatti, che la rifampicina, il clotrimazolo ed il troglitazone inducono il PXR in uomo e coniglio ma non nel ratto, mentre il PCN attiva il PXR nel ratto ma nell'uomo e nel coniglio risulta essere un debole induttore.
Tra gli inibitori dei CYP3A sono inclusi il chetoconazolo, la troleandomicina ed alcuni flavoni presenti nel succo di pompelmo.
¾ Famiglia 4
La famiglia 4 comprende 3 sottofamiglie: 4A, 4B e 4F.
Nel ratto sono state identificate le isoforme 4A1, 4A2, 4A3 e 4A8, mentre nell'uomo è stato trovato soltanto il CYP4A11.
I membri della sottofamiglia 4A sono coinvolti nel metabolismo di molti farmaci a carattere acido, degli acidi grassi a catena lunga e media (che vengono idrossilati nelle posizioni ω e ω-1) e nel metabolismo degli eicosanoidi. Con l'ossidazione degli acidi grassi
in posizione terminale si rende accessibile la molecola alla β-ossidazione, favorendo la formazione di prodotti intermedi del metabolismo.
Le isoforme della sottofamiglia 4A sono, di solito, inducibili da sostanze definite “proliferatori dei perossisomi” (PP) che includono farmaci ipolipidemici della classe dei fibrati (ad esempio clofibrati e fenofibrati), agenti plastificanti, esteri dello ftalato e alcuni erbicidi a base di acido benzoico, oltre che da alcuni acidi grassi endogeni. Tutte queste sostanze attivano il recettore nucleare PPARα (Peroxisome Proliferator Acid Receptor α), che eterodimerizza con il recettore RXR e si lega a particolari sequenze sul DNA chiamate PPREs (PP Responsive Elements), a monte del promotore dei geni target.
Nel fegato di ratto è stato dimostrato che, oltre ai PP, anche condizioni fisiopatologiche come il diabete o il digiuno determinano, tramite l'attivazione di PPARα, un'induzione dei CYP4A e di altri geni coinvolti nel metabolismo degli acidi grassi.
Le isoforme della sottofamiglia 4B, invece, sono implicate nel metabolismo di xenobiotici, ed in particolare di composti amminoaromatici e furanici.
La famiglia 4 rappresenta la transizione tra gli isoenzimi che agiscono sulle sostanze esogene e quelli che sono coinvolti esclusivamente nel metabolismo endogeno.
CAPITOLO 2
IL SUINO COME MODELLO SPERIMENTALE
La scelta del suino come modello animale per questo lavoro di tesi è principalmente dovuta al fatto che, sebbene sia stata proposta come nuovo modello per gli studi di farmacologia e tossicologia a causa della sua somiglianza anatomica e fisiologica con l'uomo, questa specie è stata scarsamente studiata dal punto di vista metabolico.
A supporto dell'utilizzo del suino come modello sperimentale, dai pochi lavori presenti in letteratura sull'argomento, sembra emergere che, a livello epatico, i principali enzimi coinvolti nelle biotrasformazioni degli xenobiotici siano presenti in quantità e livelli di attività paragonabili ai loro corrispettivi umani (Soucek et al., 1997, 2001; Chirulli et al., 2007; Nannelli et al., 2008).
Lo studio degli enzimi metabolici nel suino risulta importante anche per il fatto che, negli ultimi anni, organi e tessuti di questa specie sono stati presi in considerazione per potenziali xenotrapianti. In particolare, il fegato, o gli epatociti da esso isolati, potrebbero essere impiegati per la costruzione di sistemi artificiali (detti bioreattori) progettati per sopperire alla carenza di organi umani destinati ai trapianti e collegati, tramite circolazione extracorporea, a pazienti in attesa di trapianto epatico (Donato et al., 1999).
E' da considerare anche, dal punto di vista pratico, che le grandi dimensioni di questo animale permettono di ricavare quantità di tessuto nettamente maggiori rispetto a quelle che si possono ottenere dal sacrificio degli animali utilizzati più comunemente in laboratorio (topi, ratti, conigli, cavie), aumentando notevolmente il numero di esperimenti eseguibili su ogni singolo animale.
Infine, l'impiego del suino, essendo un animale da allevamento utilizzato per la nutrizione umana, comporta meno problematiche di natura etica, se comparato con l'utilizzo di altre grandi specie quali le scimmie, i cani ed i gatti.
CAPITOLO 3
IL CITOCROMO P450 NEL SUINO
Nonostante il suino sia stato proposto come modello animale per gli studi di farmacologia e tossicologia, le conoscenze sull'espressione e sull'inducibilità delle isoforme di citocromo P450 in questa specie sono piuttosto limitate.
Isoforma Codice d'accesso
CYP1A1 NM 214412 CYP2A19 NM 214417 CYP2B22 NM 214413 CYP2C32 U35733 CYP2C33 NM 214414 CYP2C34 U35840 CYP2C35 U35844 CYP2C36 U35845 CYP2C42 Z93098 CYP2C49 NM 214420 CYP2D21* D89502 CYP2D25 NM 214394 CYP2E1 NM 214421 CYP3A22* AB006010 CYP3A29 NM 214423 CYP3A39 NM 214422 CYP3A46 AB052266 CYP4A21 NM 214425 CYP4A24 NM 214424 CYP8B1 NM 214426 CYP11A1 NM 214427 CYP11B D38590 CYP17A1 NM 214428 CYP19A1 NM 214429 CYP19A2 NM 214430 CYP19A3 NM 214431 CYP21A1 NM 214433 CYP24A1 NM 214075 CYP27B1 NM 213995 CYP51A1 NM 214432
Sebbene le conoscenze sulle capacità metaboliche del suino siano scarse, alcuni studi suggeriscono che vi siano forti somiglianze, almeno a livello epatico, tra i sistemi metabolici del suino e dell'uomo (Soucek et al., 2001).
In tabella 1 sono riportati, con il rispettivo numero di accesso, i CYP le cui sequenze nucleotidiche, complete o parziali, sono disponibili in banca dati. Il genoma del suino non è ancora stato sequenziato completamente, ed è verosimile che non siano ancora note tutte le sequenze dei citocromi P450 espressi in questa specie poiché nelle altre specie di mammifero il loro numero è molto maggiore (nell'uomo si contano 57 isoforme mentre nel topo ben 103).
Il contenuto totale di citocromo P450 nel fegato di suino varia a seconda della razza considerata, ma anche dell'età e del sesso, oscillando tra 0,20 e 0,57 nmol/mg proteine. Questa situazione è del tutto analoga a quella riscontrata nell'uomo; infatti, nei Caucasici, il contenuto totale medio di P450 è 0,43 nmol/mg proteine, mentre nei Giapponesi è 0,26 nmol/mg proteine (Skaanild, 2006).
Nei prossimi capitoli sono riportate le informazioni disponibili in letteratura sulle sottofamiglie del citocromo P450 studiate in questo lavoro di tesi.
CAPITOLO 4
LA SOTTOFAMIGLIA 2C
4.1 I citocromi P450 2C nell'uomo
La sottofamiglia 2C del citocromo P450 è una delle più importanti classi di enzimi essendo responsabile del metabolismo di una serie di substrati endogeni e di circa il 20% dei farmaci prescritti in clinica.
Nell'uomo questa sottofamiglia è composta da almeno quattro membri (CYP2C8, CYP2C9, CYP2C18 e CYP2C19) i cui geni sono localizzati in un singolo locus sul cromosoma 10 (Ferguson et al., 2005).
Nel fegato sono espressi ad alti livelli costituendo da soli il 10-20% del contenuto proteico totale di P450 ritrovato in quest'organo (Raucy et al., 2002), ma è stata riscontrata la loro espressione anche in vari tessuti extraepatici.
I CYP2C sono tutti polimorfici e mostrano una significativa omologia di sequenza; tuttavia, presentano importanti differenze riguardo alla localizzazione nell'organismo, ai livelli di espressione della proteina ed ai tipi di substrati riconosciuti (Totah and Rettie, 2005).
Di seguito sono riportate le informazioni presenti in letteratura riguardo alle quattro isoforme di CYP2C umane sopra citate.
CYP2C8
Il citocromo P450 2C8 è un importante membro della sottofamiglia 2C in grado di metabolizzare sia composti endogeni, ad esempio l'acido arachidonico e l'acido retinoico, sia xenobiotici, ad esempio il paclitaxel. Rappresenta uno dei maggiori CYP epatici, costituendo circa il 7% del contenuto microsomiale totale nel fegato.
riconoscere e metabolizzare una gran quantità di substrati di natura diversa (leggermente acidi, neutri o basici). Tra i substrati che è in grado di metabolizzare sono presenti molti farmaci quali ad esempio gli antidiabetici rosiglitazone e repaglinide, l'antitumorale paclitaxel, l'abbassatore del colesterolo cerivastatina e gli antimalarici amodiaquina e cloroquina (Totah and Rettie, 2005).
Il CYP2C8 è il membro della sottofamiglia 2C maggiormente inducibile nel fegato ed in epatociti primari umani, anche se il meccanismo di induzione da parte degli xenobiotici non è ancora del tutto chiarito (Gerbal-Chaloin et al., 2001; Raucy et al., 2002; Madan et al., 2003). Così come il CYP2C9, il CYP2C8 è up-regolato dalla rifampicina, dal fenobarbital e da basse concentrazioni di desametazone. Essendo tutti questi composti ligandi e/o attivatori dei recettori nucleari pregnane X receptor (PXR), constitutive androstane receptor (CAR) e glucocorticoid receptor (GR), questi tre recettori sono probabilmente coinvolti nella sua regolazione. Infatti sono stati identificati nel promotore del gene un sito di legame distale per PXR/CAR che gli conferisce inducibilità da rifampicina (ligando di PXR) e da CITCO (un ligando specifico di CAR nell'uomo), ed un sito di legame GRE (glucocorticoid-responsive element) che media l'induzione da desametazone attraverso il GR (Ferguson et al., 2005). Inoltre è stato identificato nel promotore anche un sito di legame per HNF4α, indicando che anche questo recettore nucleare è in grado di partecipare alla regolazione di questa isoforma. Analisi comparative tra le regioni regolatorie a monte dei geni dei CYP2C8 e CYP2C9 hanno rivelato che il CYP2C8 contiene due siti per i fattori di trascrizione C/EBP e HPF-1, forse implicati nella regolazione dell'espressione epatica (Ferguson et al., 1999).
Il CYP2C8 è stato inizialmente purificato da campioni di fegato, ma attualmente è noto essere espresso anche in vari tessuti extraepatici quali il rene, la ghiandola surrenale, il cervello, l'utero, la ghiandola mammaria, le ovaie ed il duodeno, oltre che, in modo variabile, nel polmone (Ferguson et al., 1999). Nel rene è bene espresso e potrebbe costituire uno dei principali citocromi P450 costitutivi. A causa dell'espressione significativa del CYP2C8 in diversi tessuti extraepatici, questo enzima potrebbe giocare un ruolo importante nella regolazione di meccanismi endogeni; infatti i CYP2C8 e CYP2C9 sono stati proposti come sintetasi di fattori iperpolarizzanti endotelio-derivati, e si pensa che possano essere espressi nelle pareti delle arterie (Bauersachs et al., 2002).
CYP2C9 e CYP2C19, esibendo un'attività enzimatica relativamente bassa verso i substrati noti degli altri CYP2C. Anche se CYP2C8 e CYP2C9 presentano un'omologia di sequenza del 70% sono pochi i substrati metabolizzati da entrambi; al contrario il CYP2C8 dimostra più substrati in comune con il CYP3A4 a dispetto della bassa omologia di sequenza (25%), anche se i prodotti di ossidazione generati sono di solito differenti. Questo potrebbe essere dovuto al sito di legame del CYP2C8, che è simile per dimensioni a quello del CYP3A4 (1386 Å); tuttavia i substrati comuni si legano in maniera diversa nei due siti attivi (Totah and Rettie, 2005).
Sono stati identificati e studiati diversi polimorfismi, sia nella regione codificante che nella regione regolatoria a monte del gene; tali polimorfismi sono talvolta associati con un abbassamento del livello di espressione dell'enzima o con la diminuita capacità di metabolizzare specifiche sostanze (ad esempio il paclitaxel). Tuttavia in vivo gli effetti dei polimorfismi sono compensati, almeno in parte, dal contributo di altre isoforme (ad esempio il CYP3A4, che è in grado di metabolizzare il taxolo).
I dati disponibili in letteratura suggeriscono che il CYP2C8 è inibito da alte concentrazioni dei flavonoidi naturali quercetina, naringenina e kaempferolo, e dal sintetico α-naftoflavone, anche se l'inibizione attesa in vivo è bassa.
CYP2C9
Il citocromo P450 2C9 è uno dei maggiori enzimi coinvolti nel metabolismo dei farmaci. Si tratta primariamente di un citocromo epatico, ed il suo livello di espressione è probabilmente, in media, il più alto, fatta eccezione per il CYP3A4. E' espresso anche in molti organi extraepatici, quali rene, testicolo, ghiandola surrenale, prostata, ovaio e duodeno (Klose et al., 1999).
Il CYP2C9 è capace di metabolizzare, oltre ad una serie di xenobiotici, diversi composti endogeni, come ad esempio l'acido linoleico (epossidazione) e la vitamina A (4-idrossilazione), anche se, probabilmente, non svolge una funzione critica nella normale fisiologia dell'organismo. Tra le sostanze esogene che è in grado di riconoscere si ricordano
sulfametazolo, l'ibuprofene, l'omeprazolo e la benzodiazepina diazepam (Raucy et al., 2002; Gerbal-Chaloin et al., 2001). Il CYP2C9 è, inoltre, il maggior catalizzatore della 4-idrossilazione dell'antiepilettico fenitoina.
Il CYP2C9 è l'unico enzima della sottofamiglia 2C ad essere espresso a livelli significativi in epatociti primari umani non trattati (Raucy et al., 2002), e la sua espressione è indotta da rifampicina, desametazone e fenobarbital nel fegato ed in epatociti primari umani (Raucy et al., 2002; Madan et al., 2002; Gerbal-Chaloin et al., 2001).
La regione codificante per questa isoforma occupa più di 39 kb, ed a monte di essa sono stati identificati diversi siti di legame per fattori di trascrizione coinvolti nell'induzione dell'enzima: un sito per CAR e PXR, mediante il quale il CYP2C9 è direttamente regolato da questi due recettori nucleari (Ferguson et al., 2002; Chen et al., 2003, 2004), un sito di legame per HNF4α (Ibeanu and Goldstein, 1995) ed un glucocorticoid-responsive element (GRE) che media l'induzione da desametazone attraverso il GR (Gerbal-Chaloin et al., 2001; Chen et al., 2003). Un altro fattore di trascrizione coinvolto nella regolazione del CYP2C9 è C/EBPα.
Esistono diversi fattori che sono in grado di modulare l'attività catalitica del CYP2C9: uno di questi è costituito dall'effetto dei solventi, come ad esempio l'acetonitrile, che, ad una concentrazione del 2-4% (v/v), aumenta l'attività dell'enzima (Palamanda et al., 1999). Un altro fattore è il citocromo b5 o apo-b5 (privo di eme), che migliora alcune reazioni
catalizzate da questa isoforma. Il dapsone ed alcuni analoghi aumentano la 4-idrossilazione del diclofenac. Anche altri citocromi P450 possono aumentare la velocità di alcune reazioni catalizzate dal CYP2C9, pur non partecipandovi. L'interpretazione secondo cui il CYP2C9 userebbe due diversi siti di legame in queste interazioni è probabilmente valida, ma il meccanismo, così come l'esatta natura del legame, restano da spiegare. Studi con la cumarina hanno suggerito la presenza di due siti, uno per il “π-stacking” degli anelli aromatici, ed un sito di legame ionico per gli anioni organici (molti ligandi del CYP2C9 hanno carica anionica).
Il sulfafenazolo è stato identificato essere un inibitore selettivo e competitivo del CYP2C9, mentre mostra bassa affinità per gli altri membri della sottofamiglia 2C. Anche l'acido tienilico è un inibitore; esso può essere S-ossigenato dal CYP2C9, ed il prodotto di reazione è instabile e può reagire con l'enzima inattivandolo. Questo meccanismo potrebbe essere coinvolto nella patogenesi di epatiti autoimmuni in individui che usano l'acido
tienilico, poiché in conseguenza di questa reazione possono svilupparsi, in alcuni individui, anticorpi autoimmuni che riconoscono il CYP2C9 non modificato.
I polimorfismi del CYP2C9 sono stati studiati, e la loro rilevanza clinica riguarda la tossicità e le possibili interazioni tra farmaci, in quanto hanno l'effetto di attenuare l'espressione dell'enzima o la sua attività catalitica. Sebbene le conseguenze di questi polimorfismi non siano drammatiche come nel caso del CYP2C19, la grande quantità di enzima presente, soprattutto a livello epatico, ne amplia gli effetti.
CYP2C18
Dei quattro membri della sottofamiglia 2C umani, il CYP2C18 è quello che presenta il livello di espressione epatica più basso, sia dal punto di vista dell'mRNA, sia riguardo alla presenza della proteina. L'mRNA codificante per questa isoforma è stato ritrovato in molti tessuti, inclusi cervello, utero, rene, duodeno, e ghiandola mammaria, ma la rispettiva proteina è poi risultata essere assente (Totah and Rettie, 2005). Tuttavia, l'espressione riscontrata nell'epidermide appare essere significativa (Zaphiropoulos, 1997).
Rae et al. (2001) ha riportato che il CYP2C18 non è inducibile da rifampicina in epatociti umani, al contrario dei CYP2C8 e CYP2C9.
Sono stati identificati diversi polimorfismi di questa isoforma, ma i loro effetti sull'espressione e sull'attività catalitica non sono ben caratterizzati.
Il CYP2C18 è capace di idrossilare la fenitoina in posizione 4 e possiede bassa attività catalitica nell'idrossilazione della tolbutammide, ma probabilmente non contribuisce in generale al metabolismo dei farmaci, anche a causa dei suoi bassissimi livelli di espressione.
Attualmente non si conoscono inibitori selettivi del CYP2C18 (Totah and Rettie, 2005). Tutte queste caratteristiche rendono l'interesse per questa isoforma trascurabile rispetto agli altri membri della sottofamiglia presa in esame.
CYP2C19
Il citocromo P450 2C19 è espresso a livelli significativi solo nel fegato, costituendo fino al 5% del P450 totale in quest'organo. Tuttavia, l'mRNA codificante per questa isoforma e la rispettiva proteina sono stati riscontrati anche nel duodeno (Klose et al., 1999; Totah and Rettie, 2005).
Così come gli altri membri della sottofamiglia 2C, anche il CYP2C19 non sembra presentare differenze legate al genere.
La (S)-mefenitoina 4'-idrossilazione è la reazione classica attribuita al CYP2C19, ma questa isoforma è in grado di metabolizzare molti altri xenobiotici, come l'omeprazolo, la warfarina, la talidomide (un vecchio farmaco noto per gli effetti teratogenici), il diazepam, l'imipramina, la moclobemide e diversi steroidi, inclusi progesterone e testosterone (Gerbal-Chaloin et al., 2001). Il CYP2C19 è, inoltre, in grado di attivare a livello epatico l'insetticida organofosfato diazinone.
Così come altri membri della sottofamiglia 2C, anche l'attività del CYP2C19 è stimolata dal citocromo b5. In questo caso la stimolazione non è dipendente dall'eme del citocromo
b5, perciò il trasferimento di elettroni non può essere coinvolto.
Studi con epatociti primari umani hanno dimostrato che la rifampicina ed il fenobarbital sono potenti induttori del CYP2C19, sia a livello trascrizionale, sia a livello proteico (Raucy et al., 2002; Gerbal-Chaloin et al., 2001; Madan et al., 2002). Anche il desametazone si è dimostrato essere un induttore, seppure più blando, di questo isoenzima, sempre in colture di epatociti primari (Raucy et al., 2002).
I recettori nucleari CAR e PXR regolano direttamente l'espressione del CYP2C19 (Ferguson et al., 2002; Chen et al., 2003,2004). Nella regione regolatoria a monte del gene è stato, inoltre, identificato un sito di legame per il GR, necessario per l'induzione da desametazone (Gerbal-Chaloin et al., 2001; Chen et al., 2003).
La caratteristica più importante riguardante il CYP2C19 risiede nel metabolismo polimorfico della (S)-mefenitoina, che classifica gli individui come “poor metabolizers” (PM), “intermediate metabolizers” (IM) o “extensive metabolizers” (EM). Si tratta del polimorfismo studiato maggiore dopo quello del CYP2D6, ed oggi risulta essere ben compreso. L'incidenza del fenotipo PM nei Caucasici è, generalmente, del 3-5% mentre negli Asiatici è circa del 20%. In alcune isole del Pacifico tale incidenza arriva addirittura
ad essere del 75%. Il difetto genico maggiore nelle popolazioni Caucasiche e nei Giapponesi fu identificato in una mutazione dell'esone 5 , la quale introduce un sito di splicing aberrante che produce una proteina tronca (de Morais et al., 1994). Tuttavia, sono stati identificati molti altri polimorfismi di varia natura (tanto che al fenotipo PM sono stati associati almeno 8 alleli diversi), che includono, fra le altre, una mutazione del codone iniziale che determina alterate proprietà enzimatiche. Questi polimorfismi possono avere rilevanti conseguenze cliniche, ad esempio individui con bassa attività enzimatica hanno mostrato una migliore risposta al trattamento dell'ulcera peptica con l'inibitore della pompa protonica omeprazolo.
Il fatto che il CYP2C19 sia fortemente polimorfico in natura può facilmente spiegare il motivo per cui, spesso, i dati riguardanti la presenza e l'attività enzimatica di questa isoforma siano altamente variabili o, addirittura, contraddittori.
4.2 I citocromi P450 2C nel ratto
Tra le sottofamiglie di citocromo P450 presenti nel ratto la più importante è la sottofamiglia 2C, che costituisce da sola circa l'80% del contenuto totale di citocromo P450 epatico. Essa comprende almeno 8 diverse isoforme (CYP2C6, CYP2C7, CYP2C11, CYP2C12, CYP2C13, CYP2C22, CYP2C23 e CYP2C24), che sono prevalentemente coinvolte nel metabolismo endogeno di steroidi, retinoidi ed acido arachidonico, ma sono in grado di metabolizzare anche moltissimi xenobiotici.
Alcune di queste isoforme hanno la proprietà di essere sesso-specifiche, una caratteristica tipica dei P450 del ratto ma non dell'uomo. Il CYP2C12 è un isoenzima specificatamente femminile, mentre i CYP2C11 e CYP2C13 sono espressi soltanto in ratti maschi. Altri, come i CYP2C6 e CYP2C7, sono citocromi P450 prevalentemente femminili, ma sono presenti, a livelli più bassi, anche nei maschi (Agrawal and Shapiro, 2003).
Il CYP2C6 di ratto ha molte caratteristiche in comune con il CYP2C9 umano, poiché entrambi catalizzano la 4-idrossilazione del diclofenac e della fenitoina, e la
7-reazioni catalizzate dal CYP2C6 sono la 7-N-demetilazione della caffeina, la O-deetilazione della 7-etossiresorufuna e l'1-idrossilazione del bufurarolo (Kot and Daniel, 2008; Kobayashi et al., 2002). Recenti esperimenti di immunoblotting su campioni di intestino di ratto, sia maschio che femmina, hanno evidenziato la presenza, a livelli relativamente bassi, del CYP2C6 in questo tessuto, sebbene con ampie variazioni interindividuali (Mitschke et al., 2008). Studi effettuati in vivo hanno, inoltre, dimostrato che il CYP2C6 è up-regolato (almeno a livello trascrizionale) in condizioni di ischemia-riperfusione, e che il conseguente aumento dell'attività epossigenasica potrebbe avere un ruolo nel danno miocardico da riperfusione. Al contrario, un'inibizione dell'attività epossigenasica potrebbe avere un ruolo protettivo contro il danno cardiaco post-ischemico (Ao et al., 2008). L'attività enzimatica del CYP2C6 è inibita dal β-naftoflavone (Kot and Daniel, 2007).
Il CYP2C7 è in grado di idrossilare il testosterone e l'acido retinoico, e prende parte al metabolismo della para-toluene-sulfonamide (PTS) (Zhou et al., 2006; Fan et al., 2004). Si tratta di un'isoforma costitutiva prevalentemente femminile che esibisce livelli di mRNA e proteina almeno doppi nelle femmine rispetto ai maschi. Da sola costituisce circa il 20% del contenuto totale epatico di P450 nelle femmine, e circa il 6% nei maschi (Agrawal and Shapiro, 2003).
Il CYP2C11 è in grado di metabolizzare molti substrati, tra i quali si ricordano il testosterone (2α-idrossilazione), la caffeina (demetilazione nelle posizioni 3-N e, soprattutto, 7-N), e l'anestetico locale bupivacaina (3'-idrossilazione) (Kot and Daniel, 2007, 2008; Saito et al., 2006). La sua attività è inibita dal β-naftoflavone e dal pregnenolone-16α-carbonitrile (Kot and Daniel, 2007).
Esperimenti di immunoblotting su campioni di intestino di ratto, sia maschio che femmina, non hanno rilevato la presenza del CYP2C11 in questo tessuto (Mitschke et al., 2008). Il CYP2C12 è un isoenzima esclusivamente femminile che costituisce circa il 40% del contenuto totale epatico di P450 nei ratti femmina, mentre risulta assente nei maschi di tutte le età (Agrawal and Shapiro, 2003).
Il gene codificante per il CYP2C13 occupa più di 50 kb ed esiste in due forme alleliche ben identificate (Eguchi et al., 1991).
Il CYP2C23 è coinvolto nella produzione di acidi epossieicosatrienoici (EET) dall'acido arachidonico, e presenta proprietà catalitiche simili ai CYP2C9 e CYP2C19 umani.
L'mRNA codificante per questa isoforma è stato riscontrato in vari organi di ratto, quali fegato, polmone, rene, milza, cuore, cervello e testicolo. Così come il CYP2C9 nell'uomo, il CYP2C23 è l'isoforma della sottofamiglia 2C maggiormente espressa nel rene, dove gli EET da essa prodotti contribuiscono a regolare la funzione renale agendo sui processi di trasporto tubulare e sul mantenimento del tono vascolare. In ratti ipertesi, l'espressione del CYP2C23 nei tubuli renali è diminuita, in concomitanza con la diminuzione della produzione di EET, confermando il suo importante ruolo nella funzione renale (Imaoka et al., 2005).
L'mRNA codificante per il CYP2C24 è stato inizialmente identificato da uno screening di cDNA di prostata di ratto; in seguito, però, esperimenti di Northern blotting hanno rilevato tale mRNA anche in campioni di fegato e rene. In ratti maturi questa isoforma è presente nei vari organi a livelli paragonabili nei due sessi, con l'eccezione del rene femminile, in cui non è espressa (Zaphiropoulos, 1991).
Numerosi studi hanno suggerito una relazione inversa tra l'età degli animali e l'attività catalitica di molti enzimi della superfamiglia del citocromo P450; in particolare è stato proposto che, mentre i livelli degli enzimi specificatamente maschili diminuiscono con l'avanzare dell'età, i livelli delle isoforme femminili rimangono costanti nelle femmine ed aumentano nel fegato dei maschi. Ad esempio il CYP2C11, isoforma specificatamente maschile diminuisce nei ratti maschi senescenti, mentre il CYP2C12, isoenzima prettamente femminile, risulta indotto negli stessi animali, indicando un processo di demascolinizzazione associato ad una femminilizzazione (Wauthier et al., 2007). Tuttavia, Agrawal and Shapiro (2003) hanno, invece, dimostrato che, con l'eccezione del CYP2C11, la cui espressione diminuisce sensibilmente (~70%) in ratti maschi senescenti, i livelli di CYP2C6, CYP2C7, CYP2C12 e CYP2C13 non si abbassano significativamente in ratti di età avanzata né maschi, né femmine. Inoltre l'età non ha effetto neanche sui livelli di induzione di queste isoforme da parte del fenobarbital.
La regolazione di questi citocromi P450 avviene prevalentemente a livello trascrizionale, ma poche informazioni sono disponibili sugli elementi regolatori importanti per la trascrizione, sia basale che indotta da ormoni o altri fattori regolanti l'espressione di questi geni (Ström et al., 1995). Nella regione regolatoria a monte del sito di inizio della
OTF-1 (Eguchi et al., 1991). I CYP2C7, CYP2C11, CYP2C12 e CYP2C13 sono regolati dall'ormone della crescita (GH) a livello trascrizionale, ma i rispettivi elementi regolatori non sono ancora stati identificati. Inoltre, studi hanno dimostrato che HNF-4 non è uno dei principali trans-attivatori per nessuna di queste isoforme (Ström et al., 1995).
Da un confronto fra umani e roditori, è emerso che il numero dei membri della sottofamiglia 2C è diverso, e che nessuna delle isoforme umane sembra avere un ortologo certo nei roditori, suggerendo che i dati riguardanti questi ultimi devono essere interpretati con cautela se estrapolati per gli umani (Uno et al., 2006).
4.3 I citocromi P450 2C nella scimmia
Le scimmie sono largamente impiegate come modello per gli studi di farmacologia, poiché generalmente presentano un pattern metabolico simile all'uomo. Tuttavia, le informazioni sul sistema P450 in questi animali sono ancora scarse, soprattutto a livello molecolare, e fondamentalmente derivano da studi su piccoli primati.
In Macaca fascicularis (cynomolgus monkey) e Macaca mulatta (rhesus monkey), due scimmie del Vecchio Mondo, sono stati identificati diversi membri appartenenti alla sottofamiglia 2C: CYP2C20 (precedentemente chiamato CYP2C74), CYP2C43, CYP2C75 e CYP2C76, tutti prevalentemente espressi a livello epatico (Uno et al., 2006).
Il CYP2C20 presenta un grado di omologia molto alto (circa il 95%) con l'umano CYP2C8, e, così come quest'ultimo, è coinvolto nel metabolismo del paclitaxel.
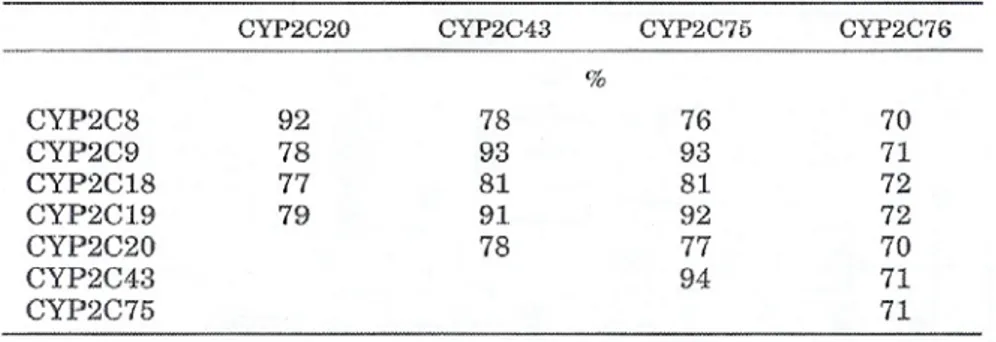
I CYP2C43 e CYP2C75 presentano un alto grado di omologia (91-93% di identità della sequenza amminoacidica) con entrambe le isoforme umane CYP2C9 e CYP2C19 (Tabella 2). Mentre il CYP2C43 metabolizza la (S)mefenitoina (substrato specifico del CYP2C19), il CYP2C75 è in grado di metabolizzare sia la (S)mefenitoina che la tolbutamide (substrato del CYP2C9 umano) (Uno et al., 2006). Inoltre, il CYP2C43 ha mostrato alte attività testosterone 17-ossidasi e progesterone 21-idrossilasi, che sono state osservate anche per il CYP2C19 umano, indicando una somiglianza catalitica tra queste due isoforme (Mitsuda et al., 2006).
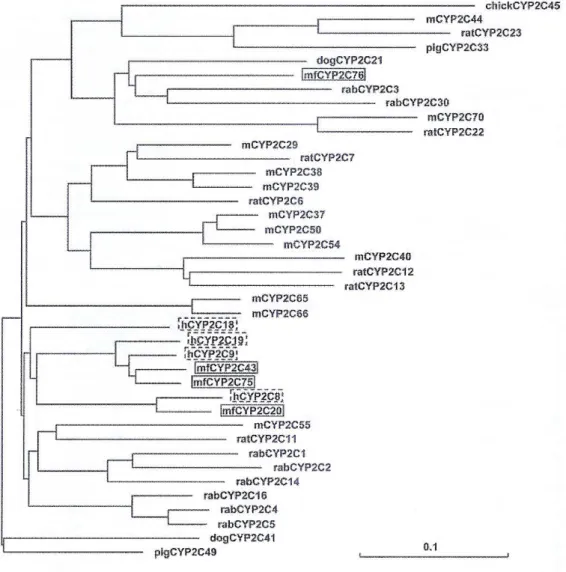
Tab. 2: Percentuali di identità della sequenza amminoacidica tra i CYP2C umani e di scimmia. Tra questi isoenzimi, il CYP2C76 è quello che presenta l'espressione più alta, costituendo il maggior rappresentante della sua sottofamiglia nel fegato di scimmia. Il CYP2C76, pur metabolizzando la tolbutamide, presenta un profilo metabolico caratteristico differente da quello degli altri CYP2C, e mostra un'omologia più bassa con i CYP2C umani rispetto agli altri CYP2C presenti in questo tipo di scimmie. Questo, insieme ad uno studio filogenetico effettuato comparando le sequenze amminoacidiche dei CYP2C di diversi animali (Fig. 9), indica la possibilità che il CYP2C76 sia un'isoforma specie-specifica che contribuisce alla diversità occasionalmente osservata tra le scimmie e l'uomo. Infatti, nelle scimmie, il gene che codifica per questo isoenzima si trova alla fine del cluster genico dei CYP2C, nella parte che corrisponde alla regione intergenica adiacente al cluster dei CYP2C nel genoma umano, suggerendo fortemente che il CYP2C76 non abbia un ortologo nell'uomo. Inoltre, tramite esperimenti di immunoblotting, l'espressione della proteina del CYP2C76 è stata confermata nel fegato di Macaca fascicularis e Macaca mulatta, ma non in quello dei grandi primati (scimmie antropomorfe) o dell'uomo (Uno et al., 2006).
Lo stesso gruppo di ricerca, nel 2007, ha analizzato altri 11 CYP di Macaca fascicularis appartenenti alle famiglie 2, 3 e 4, e tutti sono risultati essere strettamente correlati con i CYP umani. Di conseguenza, il CYP2C76, potrebbe essere l'unico CYP specie-specifico espresso a livelli significativi nel fegato di questa scimmia.
Uno studio effettuato utilizzando come modello animale Macaca mulatta, ha dimostrato che il trattamento di colture di epatociti di scimmia con rifampicina aumenta marcatamente la formazione del metabolita idrossilato del diclofenac. Tuttavia, tale aumento del metabolismo del diclofenac non è stato riscontrato in vivo. È, perciò, stato proposto che questa apparente discrepanza possa essere dovuta al fatto che il metabolismo ossidativo del
diclofenac sarebbe, invece, la glucoronidazione diretta (Prueksaritanont et al., 2006).
Fig. 9: Albero filogenetico della sequenza amminoacidica dei CYP2C di Macaca fascicularis (mf), umani (h), di suino (pig), di cane (dog), di coniglio (rab), di ratto (rat), di topo (m) e di pollo (chick). I CYP2C di scimmia e umani sono evidenziati con i riquadri a linea piena e tratteggiata, rispettivamente.
Uno studio di Jones et al. (1992) ha dimostrato con esperimenti di immunoblotting che, in due specie di primati non umani (Macaca fascicularis ed Erythrocebus patas), l'espressione di uno o più membri della sottofamiglia 2C è indotta dal trattamento con fenobarbital, anche se a livelli diversi (l'induzione in Macaca fascicularis è risultata essere più pronunciata che in Erythrocebus patas). Non sono state osservate differenze legate al sesso nelle attività enzimatiche P450-dipendenti, né in animali di controllo né nei campioni di animali trattati.
Esperimenti condotti successivamente su microsomi epatici di scimmia del genere
Callithrix (scimmie del Nuovo Mondo), utilizzando anticorpi anti-CYP umani, hanno
rivelato la presenza di almeno due isoforme di CYP2C, di cui una inducibile da fenobarbital e l'altra inducibile da rifampicina (Schulz et al., 2001).
Nel 2006 il gruppo di ricerca di Narimatsu ha clonato dal fegato di scimmie Callithrix un enzima della sottofamiglia 2C utilizzando una coppia di primer disegnata sulla sequenza del CYP2C20 di Macaca fascicularis, e l'ha espresso nel lievito per caratterizzarne le funzioni enzimatiche. Tale enzima, che presenta una sequenza amminoacidica simile ai CYP2C umani (corrispondente all'87, 78 e 77% rispettivamente ai CYP2C8, CYP2C9 e CYP2C19) è risultato essere il maggior catalizzatore dell'idrossilazione della tolbutamide (metabolizzata da tutti e tre gli enzimi ricombinanti CYP2C8, CYP2C9 e CYP2C19) nel fegato di questo genere di scimmie, con un profilo cinetico simile a quello del CYP2C8 umano. Questa nuova isoforma, chiamata P450 M-2C, è inoltre inibita significativamente dalla quercetina, un inibitore del CYP2C8, ma non metabolizza il paclitaxel, probabilmente a causa delle ridotte dimensioni del sito attivo.
4.4 I citocromi P450 2C nel suino
Le informazioni presenti in letteratura sulla sottofamiglia 2C del citocromo P450 nel suino sono estremamente scarse.
Nel 1995 Zaphiropoulos et al. usarono dei primer disegnati su due regioni conservate della sottofamiglia genica 2C di ratto per effettuare esperimenti di RT-PCR su campioni di ovaio di suino. Furono isolati 5 cloni distinti dai follicoli preovulatori (che furono chiamati PF1, PF11, PF13, PF14 e PF15), e sei cloni dal corpo luteo (chiamati CL1, CL6, CL7, CL8, CL12 e CL13). Otto di questi cloni (PF11, PF13, PF14, PF15, CL1, CL6, CL12 e CL13) si dimostrarono strutturalmente molto simili ai CYP2C umani noti, mentre i rimanenti mostravano un'alta similitudine con il CYP2C23 di ratto. Successivamente tutti questi cloni vennero classificati come CYP2C32, CYP2C33, CYP2C34, CYP2C35, CYP2C36 ed
epatici di minipig, dell'attività tolbutamide idrossilasi, già usata come marker per i CYP2C umani, sebbene a livelli più bassi di quelli riscontrati nell'uomo.
Nel 1998 Nissen et al. isolarono tre cloni da una libreria di cDNA di intestino tenue di suino, e per due di questi fu riscontrata un'alta omologia di sequenza con i geni della sottofamiglia 2C. Uno di questi cloni si rivelò tronco, mancante di una parte all'estremità 5' della regione codificante, mentre l'altro codificava per un putativo pseudogene, che fu poi mappato geneticamente sul cromosoma 14 di suino. Questi due cloni vennero classificati rispettivamente come CYP2C42P1 e CYP2C42.
Nel tessuto endoteliale coronarico di suino l'espressione di membri, non meglio identificati, della sottofamiglia 2C è risultata aumentata in conseguenza di un trattamento a lungo termine con cortisolo (Bauersachs et al., 2002). Questo risultato è concordante con la teoria secondo cui metaboliti derivanti da epossigenasi dell'acido arachidonico, in omologia ai CYP2C8/9, giocherebbero un ruolo cruciale nella generazione della risposta dell'endotelio coronarico mediata da fattori iperpolarizzanti endotelio-derivati.
Attualmente, in banca dati, sono presenti sette sequenze della sottofamiglia 2C (putativi geni, varianti alleliche o pseudogeni) per il suino: CYP2C32, CYP2C33, CYP2C34, CYP2C35, CYP2C36, CYP2C42 e CYP2C49 (http://drnelson.utmem.edu/CytochromeP450.html). In questo lavoro di tesi sono state studiate l'espressione e l'inducibilità da rifampicina di tre di queste isoforme, i CYP2C33, CYP2C42 e CYP2C49, in diversi organi di suino.
CAPITOLO 5
LA SOTTOFAMIGLIA 2A
5.1 Il citocromo P450 2A6 umano
Nell'uomo sono stati identificati tre membri della sottofamiglia 2A, i CYP2A6, CYP2A7 (fetale) e CYP2A13, i cui geni si trovano raggruppati in una regione di 350 kb sul braccio lungo del cromosoma 19.
Il CYP2A6 è l'enzima di questa sottofamiglia meglio caratterizzato. Esso catalizza l'attivazione metabolica di numerosi pro-cancerogeni, incluse molte nitrosammine, dell'aflatossina B1 e dell'1,3-butadiene. I farmaci metabolizzati dal CYP2A6 includono la
cumarina, i chemioterapici tegafur e fadrozolo, l'anestetico metossiflurano e l'agonista del fattore attivante le piastrine SM-12502 (Kimura et al., 2005; Koskela et al., 1999). Il CYP2A6 è anche il maggior catalizzatore nel metabolismo ossidativo della nicotina e della cotinina (Koskela et al., 1999). Questa isoforma costituisce, infine, il principale enzima coinvolto nell'idrossilazione della 1,7-dimetilxantina, uno dei principali metaboliti della caffeina nell'uomo (Kimura et al., 2005).
Il CYP2A6 è espresso nel fegato a livelli relativamente alti. Il trascritto è stato, inoltre, riscontrato in campioni di mucosa nasale, seppur a livelli molto bassi. Diversamente, in questo tessuto il CYP2A13 è espresso a livelli molto alti. Sebbene alcuni studi avessero suggerito un ruolo del CYP2A6 nel polmone come bioattivatore ad alta affinità delle nitrosammine specifiche del tabacco, la sua espressione in questo tessuto non è stata rilevata. Malgrado il trascritto del CYP2A6 sia stato riscontrato con esperimenti di RT-PCR nella mucosa bronchiale umana, la corrispondente proteina non è stata rinvenuta. E' stata notata, nell'uomo, una forte variazione interindividuale nell'attività del CYP2A6; tali variazioni sono, almeno in parte, spiegabili con i polimorfismi genetici identificati per questa isoforma, i quali permettono di classificare gli individui come “poor metabolizers”, “intermediate metabolizers” o “extensive metabolizers”, a seconda del genotipo che presentano. Ad oggi sono state riportate numerose varianti alleliche di questo gene, incluse
dell'attività enzimatica (Kimura et al., 2005).
Esperimenti effettuati con colture di epatociti primari umani hanno evidenziato che il trattamento con β-naftoflavone tende a diminuire l'attività del CYP2A6, mentre trattamenti con fenobarbital o rifampicina tendono ad aumentarla (Madan et al., 2002).
5.2 Il citocromo P450 2A19 suino
Nel suino l'unico citocromo P450 della sottofamiglia 2A attualmente noto è il CYP2A19, ortologo dell'umano CYP2A6, e corrispondente ad esso per l'87%.
Come per il CYP2A6, è possibile utilizzare anche per il CYP2A19 l'attività marker specifica cumarina 7-idrossilasi (Skaanild and Friis, 2005; Myers et al., 2001).
Oltre che nel fegato e nel rene, attività CYP2A-dipendenti sono state rilevate anche nella mucosa nasale di suino, ed in particolare nella mucosa olfattiva dove i livelli di attività sono anche più alti di quelli riscontrati nel fegato (Marini et al., 1998). Il trascritto codificante per il CYP2A19 è risultato non rilevabile in campioni di milza, timo, polmone, muscolo, intestino tenue, cuore ed ovaio (Lin et al., 2004), anche se i risultati del presente lavoro di tesi indicano, al contrario, l'espressione di questa isoforma nel cuore e nel polmone.
Studi su tre diversi polimorfismi identificati per il CYP2A19 hanno rivelato che, diversamente da quanto accade per il CYP2A6 umano (Kimura et al., 2005), le differenze nell'attività del CYP2A19 non sono dovute ai polimorfismi genici, bensì ad una diversa regolazione trascrizionale (Skaanild and Friis, 2005).
Tuttavia, poco è noto a proposito dei meccanismi regolatori del CYP2A19.
In colture primarie di epatociti di suino l'attività CYP2A dipendente è significativamente aumentata dal fenobarbital, un attivatore indiretto del CAR, e dal CITCO, un ligando di CAR nell'uomo. Questi risultati in coltura mostrano un profilo di induzione del CYP2A19 simile a quello riscontrato per i CYP umani regolati da CAR, indicando un coinvolgimento di questo recettore nella regolazione del CYP2A nel suino (Gillberg et al., 2006).
Nei minipig, l'espressione del citocromo P450 2A è altamente dipendente dal genere, con le attività più elevate nelle femmine. Esperimenti di Gillberg et al. (2006) hanno dimostrato
che, nel suino, il CYP2A è fortemente ma reversibilmente inibito in vivo dagli androgeni su base trascrizionale.
Uno studio di Myers et al. del 2001 ha dimostrato che un cocktail di induzione contenente β-naftoflavone, fenobarbital e desametazone è in grado di aumentare l'attività specifica del CYP2A19, ma non di indurne l'espressione.
Il CYP2A19 è inibito dall'8-metossipsoralene e dal dietilditiocarbamato. Studi effettuati su colture primarie di epatociti di suino, impiegando questi due inibitori, hanno dimostrato che il CYP2A, a differenza del CYP2E1, ha un ruolo di scarsa rilevanza nel metabolismo del 3-metilindolo (3MI), uno dei composti il cui accumulo nel tessuto adiposo è responsabile del cattivo odore della carne del 10-15% di suini maschi non castrati (Terner et al., 2006). Risultati contrastanti sono, invece, stati ottenuti da Lin et al. (2004), i quali hanno dimostrato che una particolare delezione genica di una singola base, che determina uno spostamento del modulo di lettura e la produzione di una proteina non funzionante, è associata con alti livelli di 3-metilindolo, indicando la mancanza del metabolismo di questo prodotto da parte del CYP2A19.
CAPITOLO 6
SCOPO DELLA TESI
Il presente lavoro di tesi ha avuto come obbiettivi principali:1. la caratterizzazione, mediante lo studio dei trascritti e dell'attività enzimatica, dell'espressione basale di varie isoforme P450 della sottofamiglia 2C (CYP2C33, CYP2C42 e CYP2C49) e del CYP2A19 nel fegato ed in vari tessuti extraepatici di suino (rene, mucosa nasale respiratoria, polmone, cuore, corteccia cerebrale);
2. la valutazione degli effetti induttivi sulle suddette isoforme in seguito a trattamento in
vivo con rifampicina (RIF), sia nel fegato che negli altri tessuti extraepatici di suino
considerati.
Inoltre, è stato valutato, effettuando diversi saggi di attività enzimatica, l'effetto del trattamento in vivo con β-naftoflavone (β-NF) sull'attività dei CYP2C e CYP2A19 nel fegato e nel rene di suino.
Il suino, negli ultimi anni, si è sempre più affermato come possibile modello animale per gli studi di farmacologia e tossicologia a causa della sua somiglianza anatomica e fisiologica con l'uomo, oltre che per le potenziali importanti applicazioni cliniche, quali gli xenotrapianti e l'uso del fegato per il metabolismo extracorporeo di pazienti in attesa di trapianto epatico. Risulta quindi evidente l'importanza della conoscenza delle capacità metaboliche e della loro regolazione in questa specie. Tuttavia, come già accennato nei capitoli precedenti, i dati presenti in letteratura sull'argomento sono molto scarsi. In particolare, i dati relativi alla sottofamiglia 2C sono limitati all'identificazione, negli anni '90, di alcune sequenze isolate da librerie di cDNA di intestino tenue e di ovaio di suino.