ALMA MATER STUDIORUM - UNIVERSITA' DI BOLOGNA
FACOLTÁ DI CHIMICA INDUSTRIALE
Corso di laurea specialistica in CHIMICA INDUSTRIALE
Dipartimento di Chimica Industriale e dei Materiali
Sintesi e caratterizzazione di polimeri
coniugati per l'ottenimento di piste conduttive
mediante tracciatura laser
Elaborato Finale in
Scienza dei Polimeri
Presentato da
Francesco Paolo Di Nicola
Relatore
Dott. Massimiliano Lanzi
Correlatore
Dott.ssa Luisa Paganin
P.I. Italo Manenti
II Sessione
Indice I
- Indice -
CAPITOLO 1 - Introduzione ... 1
1.1 POLIMERI CONDUTTORI ... 1 1.2 IL POLIACETILENE (PA) ... 41.2.1 Preparazione con il metodo di Shirakawa ... 4
1.2.2 Uso di prepolimeri ... 5
1.2.2.1 Ring opening metathesis polymerization (ROMP) ... 6
1.2.3 Poliacetileni sostituiti ... 7
1.3 POLITIOFENE E POLIALCHILTIOFENI (PATs) ... 7
1.3.1 Poli (3-alchiltiofeni): isomeria strutturale ... 8
1.4 POLI(3-ALCHILTIOFENI): PRINCIPALI METODI DI SINTESI ... 10
1.4.1 Sintesi elettrochimica ... 10
1.4.2 Sintesi chimiche non regiospecifiche ... 12
1.4.2.1 Sintesi dealogenativa ... 12
1.4.2.2 Sintesi ossidativa con tricloruro ferrico ... 13
1.4.3 Sintesi chimiche regiospecifiche ... 14
CAPITOLO 2 – ANALISI E DISCUSSIONE DEI RISULTATI ... 17
2.1 PREMESSA ... 17
2.2 SCOPO ... 19
2.3 TRACCIATURE LASER PATAC-Me ... 19
2.4 SOSTITUZIONE PATAC-Me CON POLITIOFENI ... 31
2.4.1 Poli (3-metiltio)tiofene ... 31
2.4.2 Poli (3-butiltio)tiofene ... 34
2.5 CARATTERIZZAZIONE FT-IR ... 37
2.6 CARATTERIZZAZIONE 1H-NMR E 13C-NMR ... 39
2.7 CARATTERIZZAZIONE UV-VIS E SOLVATOCROMISMO ... 44
2.8 CONDUCIBILITÀ ELETTRICA ... 47
2.9 ANALISI SUPERFICIALI ... 48
2.10 ANALISI TERMICHE ... 53
Indice
II
CAPITOLO 3 – PARTE SPERIMENTALE ... 57
3.1 SINTESI DEL POLIMERO: POLI(3-METILTIO)TIOFENE ... 57
3.2 SINTESI DEL 3-BUTILTIO TIOFENE ... 57
3.3 SINTESI DEL 2,5-DIBROMO-3-BUTILTIO TIOFENE ... 58
3.4 SINTESI DEL POLIMERO: POLI(3-BUTILTIO)TIOFENE ... 59
3.4.1 Poli (3-butiltio)tiofene da polimerizzazione ossidativa ... 59
3.4.2 Poli (3-butiltio)tiofene con metodo di McCullough ... 60
Strumentazione utilizzata ... 62
Bibliografia ... 63
Capitolo 1 Introduzione
1
CAPITOLO 1
- Introduzione -
1.1 POLIMERI CONDUTTORI
Gli studi su polimeri come possibili materiali conduttori di elettricità iniziarono ad avere particolare interesse quando nel 1977 i professori Heeger, McDiarmid e Shirakawa scoprirono nel poliacetilene, opportunamente trattato, peculiari caratteristiche di conducibilità 1. Studi successivi hanno reso il settore dei polimeri conduttori un’importante realtà commerciale specialmente in ambito tecnologico, grazie alle particolari caratteristiche e proprietà di questi nuovi materiali.
I polimeri conduttori sono essenzialmente materiali plastici in grado di condurre la corrente elettrica. In particolare, negli Intrinsically Conductive Polymers (ICPs) tale proprietà deriva dalla presenza di un sistema di doppi legami π coniugati lungo il backbone della macromolecola, generando una delocalizzazione elettronica, essenziale per la conducibilità del materiale. La conducibilità elettrica raggiunta in questi polimeri garantisce loro proprietà sia di semiconduttori, nel caso siano allo stato neutro, sia di conduttori (simil metalli) nel caso siano allo stato drogato. Gli ICPs hanno quindi il vantaggio di poter combinare l’alta conduttività, normalmente riservata ai metalli, con le proprietà meccaniche intrinseche dei polimeri, specie la leggerezza, la flessibilità, la filmabilità e la processabilità.
Principali esempi di ICPs sono il poliparafenilene (PPP), il poliparafenilensolfuro (PPS), il poliparafenilenvinilene (PPV), la polianilina (PANI), il politiofene (PT), il polipirrolo (PPy), il poliisotianaftene (PITN) ed il polietilendiossitiofene (PEDOT). Le relative strutture sono riportate nella figura 1.
Capitolo 1 Introduzione
2
Figura 1. Struttura dei principali ICPs.
Tra i principali ICPs, è opportuno ricordare anche il poliacetilene, che mostra la conducibilità più elevata. Esso tuttavia, se non opportunamente funzionalizzato, è insolubile e instabile all’aria e agli agenti atmosferici e pertanto risulta scarsamente utilizzabile in ambito pratico.
Il fenomeno della conducibilità elettrica nei polimeri può essere spiegato tramite il “modello a bande” sviluppato per i semiconduttori inorganici. La principale caratteristica dei polimeri conduttori, come citato in precedenza, è la presenza di un sistema di doppi legami coniugati che determina la formazione di orbitali π delocalizzati lungo la catena delle macromolecole. Gli orbitali molecolari π, risultanti dall’interazione tra gli orbitali pz di atomi di carbonio adiacenti, generano due bande, una di “valenza” ed una di
“conduzione”: quella di valenza è costituita dagli orbitali π (di legame) mentre quella di conduzione dagli orbitali π* (di antilegame). L’ampiezza del gap energetico Egap(π) che
si origina, tende asintoticamente ad un valore limite e determina le proprietà elettriche intrinseche del materiale; in particolare il valore tipico di tale gap energetico è di circa 1-4 eV per i polimeri conduttori.
Nella figura 2 è schematizzata la formazione delle bande di valenza e di conduzione (N=) attraverso l’evoluzione dei livelli elettronici all’aumentare del numero di doppi legami coniugati.
Capitolo 1 Introduzione
3
Figura 2. Schematizzazione del "modello a bande".
Per ottenere alti valori di conducibilità il polimero deve essere drogato mediante trasferimento di carica con opportune specie chimiche. Nel caso in cui il polimero venga addizionato con sostanze elettron-accettrici, come ad esempio acidi di Lewis quali FeCl3,
I2, AlCl3, si parla di drogaggio “p” (positivo): il polimero tende a cedere elettroni
generando cariche positive lungo la macromolecola. Si originano in questo modo bipolaroni dicationici promotori di ulteriore delocalizzazione e si assiste alla formazione di livelli energetici che si collocano tra la banda di valenza e quella di conduzione. Questo stati sono i veri responsabili della conducibilità nei polimeri coniugati.
Invece, nel caso in cui il polimero venga addizionato con sostanze elettron-donatrici, come ad esempio metalli alcalini in fase vapore e ammonica liquida, si parla di drogaggio “n” (negativo), caratterizzato dalla formazione di sistemi bipolaronici dianionici.
Capitolo 1 Introduzione
4
Figura 3. Schematizzazione della formazione di livelli elettronici
negli ICPs a seconda dell’entità del drogaggio.
Nel caso di un comune polimero non conduttore le transizioni elettroniche possibili sono solo di tipo σ e il conseguente gap energetico tra i livelli di legame ed antilegame, Egap(σ), risulta talmente elevato da impedire la conducibilità elettrica nel materiale.
1.2 IL POLIACETILENE (PA)
Il poliacetilene è il polimero coniugato dalla struttura chimica più semplice. Può essere rappresentato nel seguente modo:
(CH=CH)n
o più brevemente:
(CH)n
1.2.1 Preparazione con il metodo di Shirakawa
E’ il metodo più comunemente utilizzato; prevede l’impiego di un catalizzatore di Ziegler-Natta e permette l’ottenimento di film polimerici omogenei.
La polimerizzazione è condotta in un solvente inerte (generalmente un alcano) e viene iniziata usando una soluzione dell’iniziatore con cui si bagnano le pareti del reattore.
Capitolo 1 Introduzione
5
CHCH
Al(Et)3/Ti(OBu)4 Ta, atm.inerte
In questo modo si ottiene prevalentemente il PA cis, insolubile nei comuni solventi organici, che può essere facilmente isomerizzato alla configurazione trans per riscaldamento a 100-150°C:
PA cis PA trans
Il PA trans è quindi il prodotto termodinamico ed è anche quello più conduttivo.
Le condizioni di polimerizzazione (rapporto Al/Ti, solvente, tempo, temperatura, ecc.) hanno un profondo effetto sulle proprietà e sulla morfologia del film prodotto, ovvero su:
- rapporto isomero cis/isomero trans;
- facilità di stiro del film;
- valore di conducibilità elettrica specifica dopo drogaggio (fino a 105 S cm-1, livello del Cu!!!);
- concentrazione di C sp3 (difetti);
- peso molecolare.
1.2.2 Uso di prepolimeri
L’insolubilità e infusibilità del PA, assieme alla sua sensibilità all’aria, ha portato a ricercare polimeri facilmente lavorabili da cui il poliacetilene potesse essere ottenuto per conversione termica (formazione di PA + prodotti volatili). Il tipo e le reazioni di conversione termica di questi precursori sono altamente sofisticati ed in genere si hanno
Capitolo 1 Introduzione
6
problemi o di insufficiente o di eccessiva stabilità termica. L’uso di prepolimeri porta tuttavia ad un maggiore controllo della morfologia e dell’ordine relativo: il prepolimero è filmabile e stirabile prima e durante la conversione, fornendo un film finale di PA altamente orientato.
1.2.2.1 Ring opening metathesis polymerization (ROMP)
E’ un metodo innovativo che consente di ottenere PA trans con buone rese ed elevato grado di purezza. La sintesi è di per sé molto raffinata ed i materiali di partenza sono molto costosi. PA cis PA trans CF3 F3C WCl6 or MoCl5 ROMP CF3 F3C n CF3 CF3
retro Diels Alder
Il substrato di partenza viene sintetizzato tramite la reazione di Durham:
F3C CC CF3 +
CF3 F3C
Capitolo 1 Introduzione
7
1.2.3 Poliacetileni sostituiti
Vengono sintetizzati analogamente al PA tuttavia sono maggiormente solubili.
(CH=CR)n
Presentano generalmente conducibilità elettrica specifica più bassa di quella del PA, a causa della diminuzione di coniugazione dovuta riduzione della planarità indotta dalla repulsione sterica dei gruppi laterali:
H R H R H R
In questi polimeri sono anche alti i difetti dovuti alla presenza di carboni ibridati sp3.
H
H H
H H H
Possono essere monosostituiti (polialchilacetileni) o disostituiti (polibisalchilacetileni).
1.3 POLITIOFENE E POLIALCHILTIOFENI (PATs)
Il politiofene (PT) è uno dei polimeri intrinsecamente conduttori maggiormente studiati ed analizzati a causa delle sue particolari proprietà, in particolare l’alta conducibilità raggiungibile (10-100 S/cm) e l’elevata stabilità dovuta all’alto potenziale redox. Tale polimero allo stato neutro risulta infatti stabile all’aria fino a 350°C e fino a 900°C in atmosfera inerte. Tuttavia, non risulta un materiale particolarmente adatto ad essere processato e formato a causa della sua insolubilità nei comuni solventi organici e della temperatura di degradazione che precede quella di fusione. Sembrerebbe preferibile, quindi, utilizzare differenti ICPs per scopi industriali; tuttavia alcuni recenti studi hanno mostrato l’esistenza di accorgimenti atti a sopperire alla scarsa lavorabilità del politiofene. In particolare, si è scoperto che attraverso l’aggiunta di determinati
Capitolo 1 Introduzione
8
sostituenti in posizione 3 dell’anello tiofenico, il polimero che si ottiene risulta solubile, filmabile e fusibile rendendolo quindi lavorabile e caratterizzabile.
Nel caso in cui il sostituente sia una catena alchilica, si ottiene un poli(3-alchiltiofene), indicato come P3AT; la catena laterale funge da plastificante interno, ovvero diminuisce l’impaccamento allo stato solido dovuto al π-stacking degli anelli aromatici, rendendo così il polimero solubile e ben filmabile. In questo modo, però, si riduce la coplanarità degli anelli aromatici a causa dell’ingombro sterico introdotto dalla catena alchilica stessa; ciò influisce negativamente sulla delocalizzazione di carica lungo le catene polimeriche e sulla relativa conducibilità finale. Risulta quindi di notevole importanza la lunghezza del sostituente alchilico in termini di numeri di atomi di carbonio: una catena oligometilenica troppo ridotta non darebbe un adeguato effetto plastificante, mentre una eccessivamente estesa limiterebbe nuovamente la solubilità del polimero, a causa delle interazioni che andrebbero ad instaurarsi tra le catene alchiliche delle diverse macromolecole presenti, influenzando negativamente anche la delocalizzazione elettronica.
Diversi studi hanno dimostrato che una lunghezza della catena alchilica pari a 4-6 atomi di carbonio garantisce la solubilità del polimero finale, senza disturbare troppo la planarità dello scheletro politiofenico.
1.3.1 Poli(3-alchiltiofeni): isomeria strutturale
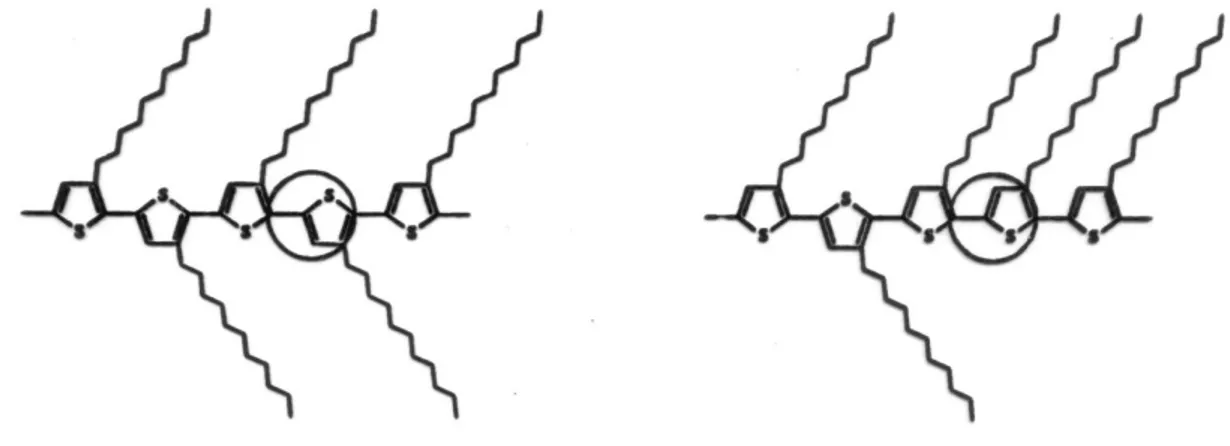
Nel caso di un polialchiltiofene, l’introduzione di un sostituente nella posizione 3 dell’anello tiofenico comporta la perdita di simmetria nell’unità monomerica, dando origine nel polimero a una regioisomeria strutturale in base al tipo di concatenamento tra le due unità ripetenti adiacenti. Le tre differenti possibili diadi, ovvero testa-coda HT (2-5’), coda coda TT (5-5’) e testa-testa HH (2-2’) sono riportate nella figura 4, considerando i due anelli tiofenici sostituiti rispettivamente nelle posizioni 3 e 3’.
Capitolo 1 Introduzione 9 S S R R S S R R S S R R HT TT HH
Figura 4. Diadi tipiche in un poli(3-alchiltiofene).
L’isomeria strutturale determina essenzialmente problemi legati all’estensione della coniugazione media nella catena polimerica, in quanto da essa derivano le proprietà elettroniche e le performance del PAT. Infatti, come è verificabile nella figura 4, un concatenamento TT o HH comporta deviazioni dalla co-planarità tra due unità monomeriche adiacenti a causa dell’ingombro sterico indotto dalle catene alchiliche laterali. Tale situazione implica una minor estensione della coniugazione media lungo la catena e, di conseguenza, una peggiore delocalizzazione elettronica. Viceversa, un concatenamento prevalente di tipo HT (P3ATs regioregolari) permette di evitare il precedente problema in quanto le catene laterali subiscono minori repulsioni e facilitano il mantenimento della co-planarità tra le unità ripetenti. Questo comporta una maggior delocalizzazione degli elettroni lungo le catene polimeriche con conseguenti migliori proprietà elettroniche finali.
Il discorso fatto per le diadi, è valido anche per le triadi che si vengono a formare nel polimero. In questo caso il tipo di concatenamento più favorevole per la planarità è quello HT-HT riportato nella figura 5, mentre il concatenamento HH-TT è quello che determina la maggiore repulsione sterica tra le catene; esso è riportato nella figura 6.
Capitolo 1 Introduzione
10
Figura 6. Concatenamento HH-TT: repulsioni steriche tra le catene laterali (anche non contigue), libera
rotazione impedita.
La percentuale di concatenamenti HT è considerata come indice della regioregolarità del polimero ed è direttamente riscontrabile e quantificabile dal suo spettro 1H-NMR.
1.4 POLI(3-ALCHILTIOFENI): PRINCIPALI METODI DI SINTESI
Le principali metodologie di sintesi attuabili e conosciute del politiofene e dei relativi derivati come i PATs, mirano ad ottenere un polimero in cui gli anelli tiofenici siano legati tra loro tramite le posizioni α, in modo da garantire la delocalizzazione elettronica lungo le macromolecole presenti. Inoltre, i metodi di sintesi dei politiofeni 3-alchil funzionalizzati, sono classificabili in modo molto generale sulla base della loro tipologia, ovvero chimica o elettrochimica
A sua volta, la sintesi chimica può essere effettuata sia attraverso una polimerizzazione di tipo ossidativo, sia attraverso particolari procedure di sintesi come quelle utilizzate per l’ottenimento di PATs regioregolari, che coinvolgono la policondensazione catalizzata da complessi di metalli di transizione di derivati tiofenici organometallici.
1.4.1 Sintesi elettrochimica
Questa tipologia di sintesi, generalmente adottata per la preparazione del politiofene non sostituito, può essere anche utilizzata per polimerizzare monomeri tiofenici sostituiti ma
Capitolo 1 Introduzione
11
richiede di analizzare preliminarmente il comportamento del monomero tramite voltammetria ciclica al fine di determinarne il corretto potenziale di ossidazione.
È possibile effettuare una polimerizzazione sia catodica che anodica, sebbene la prima non sia particolarmente indicata in quanto il polimero finale si presenta allo stato neutro passivando così l’elettrodo, con conseguente formazione di film di spessore mai superiore ai 100 nm.
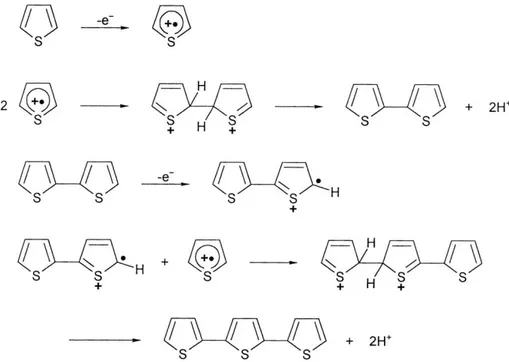
Al contrario, la polimerizzazione anodica risulta maggiormente versatile in quanto il polimero viene prodotto allo stato drogato e lo spessore del film è agevolmente controllabile. Il meccanismo della reazione inizia con l’ossidazione del monomero a radical-catione con conseguente formazione di specie cariche sulla superficie dell’elettrodo (anodo), in prossimità del quale si mantiene un’alta concentrazione di radicali. Questo particolare è dovuto al fatto che la reazione di trasferimento elettronico è più veloce della diffusione del monomero dalla soluzione. A seguito del coupling tra due radicali si forma un diidro dimero dicationico che, riaromatizzando, evolve a dimero con perdita di due protoni. Questo step costituisce la driving-force del processo che si sviluppa come mostrato nella figura 7 e termina quando l’oligomero, risultando insolubile, precipita sulla superficie dell’elettrodo.
Capitolo 1 Introduzione
12
In conclusione la polimerizzazione elettrochimica dei P3ATs risulta particolarmente interessante per la possibilità di ricoprire materiali conduttori, che fungono da elettrodo, con uno strato di polimero di spessore controllato. Questa procedura presenta tuttavia alcuni svantaggi, come ad esempio l’impossibilità di essere utilizzata per produzioni in massa del materiale, a causa dell’irrisoria quantità di polimero sintetizzabile, i minori pesi molecolari e la minore regioregolarità ottenibile rispetto alla sintesi per via chimica. E’ inoltre indispensabile rispettare alcuni vincoli, come l’impiego di particolari elettrodi e l’uso di solventi esclusivamente anidri, aprotici, con alta costante dielettrica e stabili ai potenziali impiegati (es. propilene carbonato, acetonitrile, benzonitrile, nitrometano).
1.4.2 Sintesi chimiche non regiospecifiche
1.4.2.1 Sintesi dealogenativa S S n S S n + Ni(II)cod2X2 X X Ni(0)cod2
Figura 8. Schema della sintesi dealogenativa.
E’ una policondensazione che utilizza complessi di Ni(0), quali il complesso con il cicloottadiene, come agenti dealogenanti. Partendo da 2,5 dialogeno (generalmente dibromo) tiofeni permette di ottenere facilmente polimeri con buona resa e soddisfacenti pesi molecolari. Nel caso si parta da 3-alchiltiofeni, il polimero che si ottiene è regiorandom. In questo modo, Miyazaki2 ottenne poltiofeni solubili contenenti catene esiliche, ottiliche e dodeciliche.
Capitolo 1 Introduzione
13
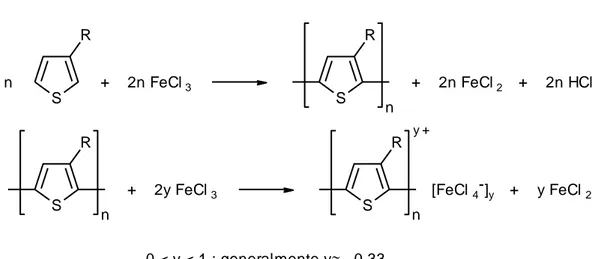
1.4.2.2 Sintesi ossidativa con tricloruro ferrico
n S R + 2n FeCl 3 S R n + 2n FeCl 2 + 2n HCl S R n + 2y FeCl 3 S R n [FeCl 4 ]y y FeCl 2 y + + 0 < y < 1 ; generalmente y 0.33
Figura 9. Schema della sintesi ossidativa con FeCl3.
Questa reazione, molto semplice e largamente utilizzata, necessita però di particolari condizioni operative. In pratica:
- si impiega FeCl3 in mezzi di reazione anidri e in cui l’ossidante sia insolubile (es.
CCl4, CHCl3, ecc.), in modo da mantenere attive le sue lacune di coordinazione
che gli conferiscono il carattere di acido di Lewis;
- si utilizza un forte eccesso di ossidante (4 volte le moli del monomero) in quanto esso viene consumato per dare il polimero ossidato e per dare HFeCl4 per
reazione coll’HCl che si svolge durante la reazione;
- si lavora in atmosfera inerte in quanto l’ossigeno dell’aria potrebbe interferire col meccanismo radical-cationico della polimerizzazione. In pratica, si gorgoglia nel reattore un vigoroso flusso di azoto (o argon) che allo stesso tempo porta via l’HCl che potrebbe degradare il prodotto voluto.
Capitolo 1 Introduzione
14
Figura 10. Meccanismo della polimerizzazione ossidativa con FeCl3.
Questo tipo di polimerizzazione chimica presenta comunque innegabili vantaggi:
- fornisce il polimero direttamente nella sua forma maggiormente elettroconduttrice;
- garantisce buone rese e pesi molecolari molto elevati;
- è una sintesi regioselettiva: la regioregolarità del polimero finale è sempre attorno al 75%, nel caso dei comuni poli(3-alchiltiofeni) 3;
- è di elevata semplicità, applicabilità e bassi costi, caratteristiche che rendono questo metodo di polimerizzazione il più adatto per uso industriale su vasta scala;
- il reagente di partenza (ossidante) è economico e non tossico.
1.4.3 Sintesi chimiche regiospecifiche
Attraverso derivati organometallici di 3-alchiltiofeni e con accoppiamenti catalizzati da complessi di Ni o Pd, si ottengono politiofeni sostituiti altamente regioregolari (quasi 100% HT). Le sintesi più utilizzate per questo scopo sono quella di McCullogh 4, che prevede la bromurazione selettiva del 3-alchiltiofene nella posizione 2, la successiva
Capitolo 1 Introduzione
15
metallazione in 5 e il coupling con un catalizzatore a base di Ni(II) (nella figura 11) e quella di Rieke-Chen 5, che parte invece dal 2,5-dibromoderivato tiofenico e contempla la successiva reazione con zinco attivato ed il coupling finale catalizzato da un complesso di nickel o palladio come riportato nella figura 12.
Figura 11. Schema di sintesi regiospecifica con metodo di McCullough.
Capitolo 1 Introduzione
16
Una variante della sintesi di McCullough sviluppata recentemente 6 prevede lo scambio del Mg in 5 all’anello tiofenico con metilmagnesiobromuro (metatesi del reattivo di Grignard) con formazione di un intermedio strategicamente derivatizzato in un’unica posizione dell’anello aromatico (figura 13):
n S R S R n Br Br n S R BrMg Br CH3MgBr THF Ni" - MgBr 1 h riflusso
Figura 13. Schema di polimerizzazione regiospecifica con metilmagnesiobromuro.
L’innegabile vantaggio di questa sintesi è che non deve essere condotta a basse temperature.
Le proprietà elettriche, ottiche, la cristallinità, ecc. di questi materiali sono ovviamente superiori a quelle dei polimeri ottenuti con i metodi precedenti e ne giustificano la maggiore complessità di sintesi e quindi il maggior costo a livello commerciale.
Capitolo 2 Analisi e discussione dei risultati
17
CAPITOLO 2
- Analisi e discussione dei risultati -
2.1 PREMESSA
Il capostipite dei polimeri conduttori è senz’altro il poliacetilene (PA) che venne sintetizzato nel 1977 da A. J. Heeger partendo da acetilene e utilizzando un catalizzatore Ziegler-Natta modificato termicamente in modo da ridurre il contenuto di carboni sp3 nel
polimero finale 7. Questo materiale, drogato con sostanze elettron-accettrici come I2, è in
grado di aumentare la sua conducibilità elettrica specifica di ben 12 ordini di grandezza (da 10-9 a 103 S×cm-1) raggiungendo valori confrontabili con quelli dei materiali metallici.
Dal punto di vista chimico, la formula del polimero drogato elettroconduttivo è la seguente:
e nel caso del drogante I2:
Il PA drogato è poco stabile all’aria, sensibile all’umidità e alle temperature elevate e queste proprietà negative ne hanno compromesso l’utilizzo su larga scala.
Infatti, per poter essere applicabile a livello industriale, un polimero organico deve soddisfare i seguenti requisiti:
essere ben solubile nei comuni solventi organici e formare film sottili ed omogenei su differenti substrati;
essere stabile, possibilmente senza aggiunta di additivi, nei confronti dell’ossigeno, dell’umidità, della luce solare ed eventualmente dei gas corrosivi.
Questi requisiti sono soddisfatti da alcuni poliacetileni modificati, denominati generalmente PATAC, poly(bis-alkylthio acetylenes). Questi polimeri sono facilmente solubilizzabili in solventi alogenati ed in idrocarburi aromatici dai quali possono essere agevolmente filmati su vetro, silicio, germanio, ceramica, metallo ed anche superfici polimeriche per spin-coating, doctor blading o semplice drop-casting 8. Il più studiato tra
Capitolo 2 Analisi e discussione dei risultati
18
i PATAC è il poli (bis-metiltio acetilene) (PATAC-Me) che viene sintetizzato con ottime rese dal dimetiltioacetilene in THF utilizzando come catalizzatore (PPh3)NiBr2 per 72h a
20°C con un rapporto molare monomero/catalizzatore 70:1 9. La polimerizzazione dei poliacetileni a bassa temperatura conduce ad una prevalenza dell’isomero cis che, a più alte temperature, tende a convertirsi nell’isomero trans, termodinamicamente più stabile. Questo vale anche nel caso dei poliacetileni sostituiti con gruppi tioalchilici purché non contenenti residui alchilici troppo ingombranti [es. poli (terbutil acetilene)] 10, nel qual caso durante la polimerizzazione si ottiene subito una prevalenza dell’isomero trans 11.
I poliacetileni disostituiti con gruppi tioalchilici presentano una interessante caratteristica, ovvero quella di essere sensibili alla radiazione visibile e ultravioletta. Se i film di questi polimeri vengono irradiati con luce laser a queste lunghezze d’onda, possono essere facilmente convertiti dalla forma isolante a quella conduttrice, mantenendo una elevata conducibilità elettrica per tempi molto lunghi (mesi o anni) e anche in presenza di ossigeno, umidità e atmosfere corrosive.
Il PATAC-Me e il PATAC-Et, irradiati con laser ad eccimeri (351 nm) o ad Argon (488 nm), aumentano la loro conducibilità elettrica da 10-14 S×cm-1 fino a 102 S×cm-1 (ben 16 ordini di grandezza) a condizione che il laser sia correttamente focalizzato sulla superficie e sia della giusta potenza 12.
Una radiazione laser troppo intensa determina infatti la pirolisi del polimero con conseguente formazione di residui carboniosi non conduttori, mentre se l’intensità della radiazione è troppo debole (o la velocità di tracciatura troppo elevata) non si ha la trasformazione del PATAC nella forma conduttiva. Le condizioni migliori di tracciatura sono: 200 mW di potenza laser (Ar+ laser) e velocità di scansione di 13 mm/s per il PATAC-Et, fornendo tracce di 2 S×cm-1 di conducibilità elettrica specifica, mentre per il PATAC-Me si ottengono tracce di 4 S×cm-1 operando con un laser ad Argon di 300 mW e con una velocità di scansione pari a 15 mm/s 13.
Durante la tracciatura, il colore e la morfologia del PATAC cambiano notevolmente, passando dal colore giallo-bruno del polimero non tracciato ad un colore blu-nero, con una superficie irregolare e porosa, determinata probabilmente dalla fuoriuscita dei prodotti gassosi di reazione.
Capitolo 2 Analisi e discussione dei risultati
19
L’inizio della conversione del polimero è accompagnato dalla generazione di radicali liberi: studi ESR hanno evidenziato un aumento della concentrazione di spins da 41014 spins/g a 51017 spins/g nel caso del PATAC-Et durante la tracciatura. Questa concentrazione di specie paramagnetiche raggiunge un plateau dopodiché resta pressoché costante 14. Il processo di conversione del PATAC-Et non è dunque un processo di grafitizzazione del polimero, bensì un processo di pirolisi fotoindotta che conduce alla formazione di strutture insature con un esteso sistema π-coniugato principalmente composto da atomi di carbonio ibridati sp2 parzialmente legati chimicamente con atomi
di zolfo. Studi condotti sulle tracce effettuate con laser Ar+ tramite analisi elementare (microsonda a raggi X) hanno evidenziato una netta diminuzione del contenuto di S nelle tracce stesse, mentre l’analisi dei gas sviluppati durante il trattamento laser del polimero (PATAC-Et) ha rivelato la presenza di dietildisolfuro, dietilsolfuro ed etilmercaptano. Tenendo conto del fatto che il polimero esposto al laser diventa insolubile si può quindi concludere che il laser determini la parziale rottura omolitica dei legami C-S tra il backbone polimerico e i gruppi laterali con parziale reticolazione inter o intracatena. Tale reticolazione ridurrebbe la mobilità conformazionale dello scheletro polimerico che, parzialmente privato dell’ingombro sterico dei gruppi laterali, sarebbe in grado di assumere conformazioni maggiormente planari e con una più estesa delocalizzazione elettronica, a tutto vantaggio della mobilità delle cariche e della conducibilità elettrica.
2.2 SCOPO
Lo scopo di questo lavoro di tesi consiste nella individuazione delle migliori condizioni operative per la tracciatura dei campioni di PATAC-Me in film, utilizzando lasar a diodo commerciali portatili a basso costo e di bassa potenza. Si cercherà inoltre di sostituire il derivato poliacetilenico con un polimero appartenente alla classe dei politiofeni, più facilmente sintetizzabili e con migliori proprietà di solubilità, lavorabilità e filmabilità.
2.3 TRACCIATURE LASER PATAC-Me
Il primo polimero utilizzato per le prove di tracciatura laser è stato il PATAC-Me, poli (bis-metiltio-acetilene) che è stato acquistato dalla Aldrich Chemical Co.
Capitolo 2 Analisi e discussione dei risultati
20
Questo polimero ha un peso molecolare medio numerale ( ) di circa 4000 g mol-1 ed un grado di polidispersità di 1,15. Ogni catena è quindi mediamente composta da circa 34 unità ripetitive. Lo spettro 1H-NMR (in CDCl3) del PATAC-Me utilizzato è riportato
nella figura 14.
Figura 14. Spettro 1H-NMR del PATAC-Me utilizzato.
Si nota la presenza di un unico segnale, piuttosto allargato, centrato a 2.50 ppm ed attribuibile ai metili dei gruppi tiometilici presenti in catena laterale. L’allargamento del segnale è imputabile al fatto che l’intorno chimico dei protoni metilici non è sempre il medesimo, in quanto il PATAC-Me commerciale è presente come miscela di stereoisomeri cis-trans. L’analisi elementare del polimero è in accordo con la struttura attesa ([C4H6S2]n; teorico: C% 40.64; H% 5.12; S%: 54.24; trovato: C% 41.22; H% 4.98;
S%: 53.80).
Nella figura 15 e 16 sono rappresentati gli spettri FT-IR del PATAC-Me in film sottile da cloroformio su disco di Ge, prima e dopo la tracciatura laser con λ=445 nm (blu).
Capitolo 2 Analisi e discussione dei risultati
21
Figura 15. Spettro FT-IR del PATAC-Me in film prima della tracciatura laser.
Capitolo 2 Analisi e discussione dei risultati
22
Nello spettro del polimero non sottoposto a trattamento laser sono chiaramente visibili i segnali tipici della sua struttura:
2984 e 2916 cm-1 (νantis e νsimm dei CH3); 1664 cm-1 (C=C stretching);
1430 cm-1 (deformazione antisimmetrica CH3); 1308 cm-1(deformazione simmetrica CH3); 645 cm-1 (S-CH3 stretching).
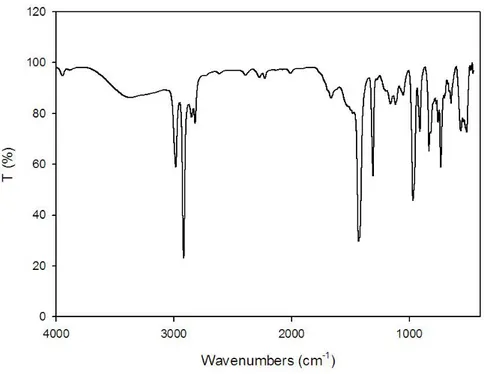
Proprio l’evoluzione di quest’ultimo segnale, che può variare nel range 715-620 cm-115
, è interessante in quanto esso diminuisce notevolmente di intensità dopo la tracciatura laser, confermando il meccanismo di fotopirolisi citato precedentemente (riportato nella figura 17, a: polimero pristino; b: dopo la tracciatura laser).
Figura 17. Confronto degli spettri IR del PATAC-Me prima (a) e dopo (b) la tracciatura laser.
Lo spettro UV-Vis del PATAC-Me ottenuto da un film su vetrino di quarzo, mostra un profilo non strutturato, con un massimo di assorbimento a 315 nm; lo spettro è mostrato nella figura 18.
Capitolo 2 Analisi e discussione dei risultati
23
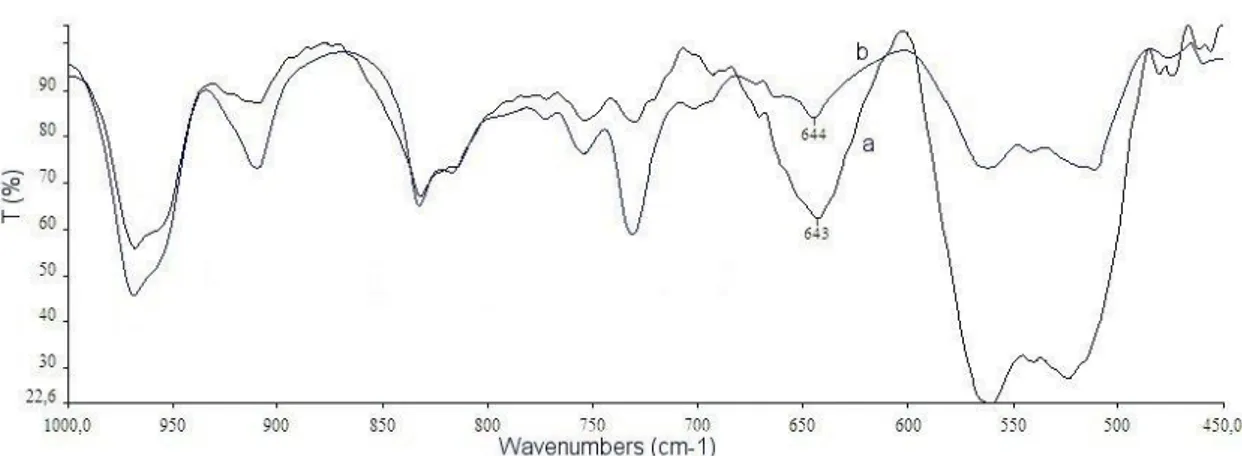
Figura 18. Spettro UV-Vis del PATAC-Me in film su vetrino di quarzo, prima e dopo la tracciatura laser.
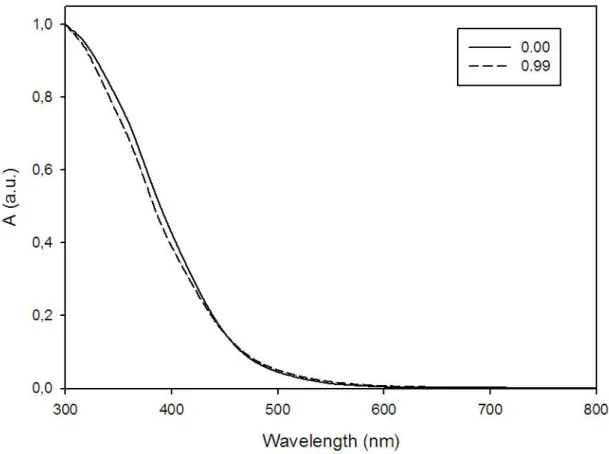
Tale film, omogeneo e privo di macroscopici aggregati, è stato ottenuto sciogliendo il polimero in clorobenzene. L’assenza di massimi di assorbimento alle basse energie indica che il PATAC-Me possiede un elevato Energy gap, determinato dalla sua ridotta estensione di coniugazione causata dalla presenza dei sostituenti tiometilici che agiscono negativamente sulla planarità dello scheletro polimerico. La situazione cambia leggermente dopo la tracciatura laser: si osserva infatti una riduzione dell’inhomogeneous broadening del profilo spettrale, che appare meno allargato, ed un lieve aumento dell’assorbimento alle più basse energie. Il comportamento solvatocromico del PATAC-Me pristino è stato studiato nel sistema cloroformio/metanolo. Nella figura 19 sono riportati gli spettri del polimero in cloroformio puro (frazione molare di metanolo: 0.00) e alla massima concentrazione di metanolo raggiunta prima della precipitazione del polimero (frazione molare di metanolo: 0.99). Il polimero è risultato completamente insensibile alle aggiunte di non solvente, dimostrando come la presenza dei sostituenti laterali determini un persistente
Capitolo 2 Analisi e discussione dei risultati
24
ingombro sterico che impedisce la libera rotazione dello scheletro polimerico anche quando esso si trova desolvatato dalle molecole di solvente. Ovviamente non è stato possibile esaminare il comportamento solvatocromico del PATAC-Me dopo trattamento laser in quanto esso diviene insolubile nei comuni solventi organici.
Figura 19. Spettri UV-Vis del PATAC-Me in CHCl3 e MeOH a differenti frazioni molari di non-solvente (effetto solvatocromico).
Vista l’ottima filmabilità del PATAC-Me da clorobenzene, esso è stato anche scelto come solvente per l’ottenimento dei film da sottoporre a tracciatura laser.
A questo proposito, si è preparata una soluzione di 5 mg di polimero in 2 ml di clorobenzene. Tale soluzione è stata posta in sonicatore per 30 minuti e, tramite l’utilizzo di una pipetta pasteur, è stata deposta su vetrini da microscopio di 10×2.5 cm. I vetrini sono stati asciugati in stufa a 80°C quindi raffreddati a temperatura ambiente prima dell’utilizzo. Il sistema di tracciatura laser era composto da un banco ottico THOR LABS che consentiva il corretto posizionamento del campione e il suo movimento, a velocità regolabile, nelle tre direzioni x-y-z. I laser impiegati sono stati i modelli Artic (1 W di potenza di picco a λ=445 nm, blu) e Krypton (1 W di potenza di picco a λ=532 nm,
Capitolo 2 Analisi e discussione dei risultati
25
verde) della Wicked Laser. La corretta messa a fuoco del laser rispetto al piano del campione è stata verificata con l’utilizzo di un Power Meter della Coherent. Il fascio laser risultava correttamente a fuoco ad una distanza di 3,7 cm dall’estremità della lente al campione.
Sono state provate differenti velocità di tracciatura dei campioni muovendo gli stessi nel piano xy, da sinistra verso destra, creando una serie di tracce parallele contigue di una lunghezza pari a 10 cm. Il sistema era regolato in modo che il fascio laser non passasse mai due volte sulla stessa traccia.
Lo spessore del film variava da 1 a 10 μm a seconda delle condizioni di deposizione (quantità di soluzione di polimero depositata e possibilità di deposizioni multiple) e si è osservato che, a parità di potenza del raggio laser e di velocità di scansione, il laser blu riusciva più efficacemente a tracciare spessori elevati di PATAC-Me rispetto a quello verde, arrivando a generare tracce visibili anche dal rovescio del provino. Questo fatto è probabilmente da attribuirsi alla maggiore assorbanza che il polimero possiede a 445 nm piuttosto che a 532 nm.
Le condizioni più performanti per la tracciatura dei campioni con il laser blu si sono avute utilizzando una velocità di scansione di 5 cm×s-1 ed una potenza del laser effettiva di 600 mW.
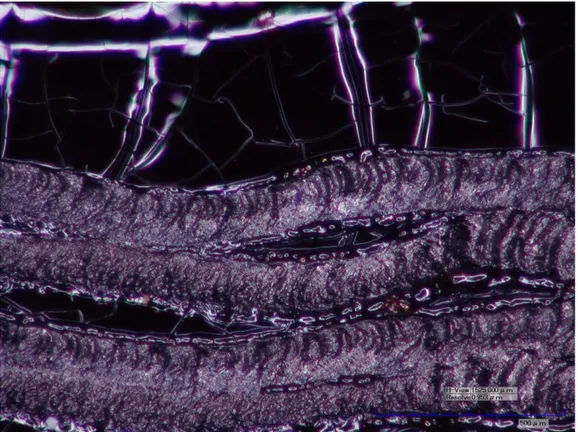
Nella figura 20 è riportata la foto al microscopio di un film di PATAC-Me parzialmente tracciato. Nella parte inferiore del campione sono chiaramente visibili le piste ottenute con il laser. La morfologia del polimero cambia notevolmente, passando da liscia, lucida ed omogenea a scabra ed opaca, dall’aspetto quasi vellutato.
Capitolo 2 Analisi e discussione dei risultati
26
Figura 20. Fotografia al microscopio di un provino di PATAC-Me tracciato con laser blu (50x).
Lavorando nelle condizioni ottimali, con una decina di tracce contigue, operando su un campione di 10 cm di lunghezza e di 2 cm di larghezza, collegando le piste ottenute alle estremità con una goccia di vernice a base di Ag, si sono ottenute resistenze superficiali di circa 104 Ω/sq pari a una conducibilità elettrica specifica per l’intera traccia di 40 S×cm-1, in analogia con quanto riportato in letteratura 16.
Si sono quindi preparati campioni di PATAC-Me delle stesse dimensioni del precedente, ma contenenti un numero inferiore di tracce, al fine di determinare quale fosse il numero minimo di linee da tracciare per avere una conducibilità elettrica soddisfacente. Nella tabella 1 sono riportati i risultati ottenuti operando con film di PATAC-Me su vetro. Le tracce avevano una lunghezza di 10 cm, una larghezza di 50 m ed una profondità media di 3 m mentre i film di polimero presentavano una lunghezza di 10 cm, una larghezza di 2 cm ed uno spessore di circa 5 m.
Capitolo 2 Analisi e discussione dei risultati
27
Tabella 1. Campioni di PATAC-Me su vetro. Lunghezza: 10cm. Larghezza: 2cm. Spessore: 5μm.
N° tracce Resistenza superficiale (103 Ω/sq) Conducibilità elettrica specifica (S×cm-1) 1 50 80 2 42 48 3 38 35 4 35 29 5 25 32 6 20 33 7 12 47 8 10 50 9 10 44 10 10 40
La resistenza superficiale del campione diminuisce all’aumentare della densità delle tracce, raggiungendo il valore minimo con 8 tracce su 2 cm, ovvero con 4 tracce per cm mentre la conducibilità elettrica specifica del materiale si attesta su di un valore medio di 44 S×cm-1. Piccole variazioni di conducibilità elettrica sono possibili, tenendo conto della non perfetta omogeneità del film di polimero, che è stato deposto per drop-casting in quanto con lo spin coating o con il doctor blade si ottenevano spessori troppo bassi, dell’ordine delle decine di nanometri. Anche la larghezza delle tracce non è rigorosamente costante, attestandosi sui 30-60 μm a seconda della focalizzazione del raggio laser. È comunque interessante considerare che il polimero non tracciato presenta una conducibilità elettrica specifica pari a 10-14 S cm-117 ma è sufficiente una sola traccia per aumentarne il valore a 80 S cm-1, evidenziando senza ombra di dubbio la validità di questo materiale per la creazione di tracce conduttive tramite tracciatura laser.
Nelle figure 21 e 22 sono rappresentati gli spettri Raman di un film di PATAC-Me prima e dopo la tracciatura laser.
Capitolo 2 Analisi e discussione dei risultati
28
Figura 21. Spettro Raman di un film di PATAC-Me prima della tracciatura laser.
.
Capitolo 2 Analisi e discussione dei risultati
29
Lo spettro del polimero prima della tracciatura presenta una baseline poco lineare, a causa delle riflessioni che il polimero pristino determina sul laser rosso (785 nm) utilizzato per ricavare lo spettro. Il PATAC-Me pristino, infatti, ha una superfice liscia e di aspetto vetroso, che tende a dare scattering. L’aspetto cambia radicalmente dopo la tracciatura: il polimero, infatti, assume un aspetto meno compatto, opaco e poroso, probabilmente a causa della fuoriuscita dei sottoprodotti gassosi determinati dall’effetto del laser tracciante.
Lo spettro del polimero non tracciato presenta due evidenti massimi a 1554 e 708 cm-1, mentre quello laserato a 1550 e 1304 cm-1. L’origine del primo segnale è spiegabile tenendo conto del fatto che i polieni mostrano una intensa banda tra 1600-1500 cm-1 che corrisponde alla vibrazione in fase dei doppi legami C=C attraverso l’intera catena, la cui intensità può anche essere correlata alla estensione della coniugazione 18. La banda attorno a 1300 cm-1 può essere attribuita alla vibrazione in fase dei legami C-C della catena polimerica mentre quella attorno a 700 cm-1, presente nei campioni non tracciati, allo stretching del legame C-S del gruppo tiometilico in catena laterale.
I risultati ottenuti dall’analisi Raman dei campioni sono confermati dall’analisi SEM con microsonda per l’analisi elementare.
Nella figura 23 è rappresentata la microfotografia SEM del film di PATAC-Me sottoposto a tracciatura laser.
Capitolo 2 Analisi e discussione dei risultati
30
A sinistra, è evidente la zona del campione tracciata mentre la zona di destra non è stata laserata.
Nelle figure 24 e 25 sono rappresentate le microanalisi elementari topografiche del campione relativamente al C e allo S. La concentrazione dell’elemento è proporzionale all’intensità del colore bianco.
Figura 24. Microanalisi elementare topografica relativa al carbonio.
Capitolo 2 Analisi e discussione dei risultati
31
Si nota come nelle tracce sia elevato il contenuto di C mentre diminuisca quello di S. Passando dal polimero non tracciato a quello tracciato, le percentuali di carbonio variano dal 41% al 75%, mentre la percentuale di zolfo passa dal 54% al 20%, confermando la perdita dei gruppi laterali.
2.4 SOSTITUZIONE PATAC-Me CON POLITIOFENI
Il PATAC-Me si è quindi rivelato un ottimo candidato polimerico per la creazione di piste elettroconduttive ma un suo difetto consiste nella sua non completa solubilità nei comuni solventi organici; soluzioni concentrate si riescono ad ottenere infatti solamente utilizzando solventi alogenati o aromatici piuttosto altobollenti, come ad esempio il clorobenzene o l’o-diclorobenzene.
I film ottenuti da questi solventi sono abbastanza omogenei anche se spesso si notano degli aggregati soprattutto nelle zone centrali, determinati dalla evaporazione troppo lenta del solvente. Il PATAC-Me, inoltre, non può essere deposto su supporti polimerici trasparenti (es. PET, acetato di cellulosa, PVC…) in quanto il solvente tende ad intaccare il substrato ed inoltre il film che si otterrebbe sarebbe troppo duro e fragile per poter aderire permanentemente su un supporto flessibile.
Per ovviare a questi inconvenienti, si è deciso di sintetizzare un nuovo polimero che, come il PATAC-Me, fosse coniugato e contenesse in catena laterale dei gruppi funzionali sensibili alla radiazione laser (photo/laser sensitive groups).
2.4.1 Poli (3-metiltio)tiofene
La scelta è caduta in prima istanza sul poli (3-metiltio)tiofene (PSMe) in quanto possiede uno scheletro politiofenico coniugato e un gruppo –SMe in catena laterale in analogia al PATAC-Me.
Il monomero 3-metiltiotiofene è stato acquistato dalla Atlantic Co. ed è stato sottoposto ad una procedura di polimerizzazione ossidativa con FeCl3 in emulsione, impiegando
H2O2, FeCl3, come mezzo di reazione acqua distillata e come tensioattivo
Capitolo 2 Analisi e discussione dei risultati
32
Già durante i primi istanti della reazione si osservava un notevole imbrunimento dell’emulsione con formazione di goccioline sempre più scure di polimero. Particolarmente difficoltosa è risultata la separazione del polimero dal tensioattivo in quanto, anche estraendo più volte la fase acquosa con solventi alogenati, il SDS tendeva a ripartirsi tra le fasi. Buoni risultati si sono ottenuti ponendo il contenuto del reattore in una membrana semipermeabile da dialisi e inserendo poi la membrana in un beaker colmo di acqua distillata, sotto debole agitazione. L’acqua di lavaggio veniva cambiata giornalmente e, dopo tre settimane, la soluzione acquosa contenente il polimero era completamente priva di SDS, tracce di FeCl3 e monomero non reagito. Il polimero
ottenuto, però, probabilmente a causa del sostituente corto, risultava scarsamente solubile in tutti i solventi organici, dando films piuttosto disomogenei e fragili, a dispetto del suo peso molecolare non particolarmente elevato, come dimostrato dallo spettro 1H-NMR (riportato nella figura 26) ove sono chiaramente visibili i segnali attribuibili ai protoni terminali di catena.
Figura 26. Spettro 1H-NMR del PSMe.
Lo spettro 1H-NMR del PSMe, registrato in CDCl3, presenta un unico segnale nella zona
dei protoni alifatici, ovvero un singoletto a 2.65 ppm attribuibile ai protoni del metile in catena laterale. La zona dei protoni aromatici è più complessa ed evidenzia quattro
Capitolo 2 Analisi e discussione dei risultati
33
multipletti, tre dei quali assegnabili ai protoni degli anelli tiofenici terminali (6.97 ppm H4; 7.03 ppm H2; 7.37 ppm H5 19) mentre quello a 7.25 ppm corrisponde al protone in del tiofene non terminale delle catene polimeriche.
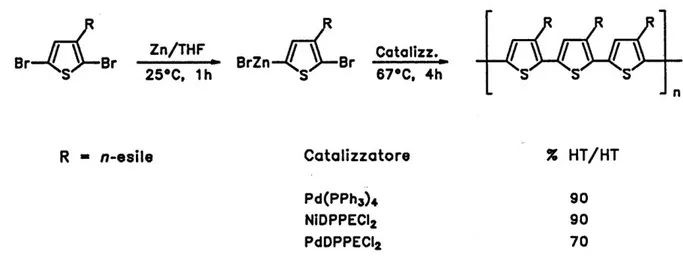
L’analisi FT-IR del PSMe in film su disco di Ge (figura 27) è in accordo con la struttura attesa, evidenziando i seguenti segnali (in cm-1): 3059 ( C-H dell’anello tiofenico); 2927 (as CH3); 2853 (s CH3); 1511 (as C=C); 1462 (s C=C); 1369 (deformazione
simmetrica CH3); 1014 (rocking CH3); 826 ( C-H tiofene 2,3,5-trisostituito), 648 (
C-S).
Figura 27. Spettro FT-IR del PSMe in film su disco di Ge.
L’analisi UV-Vis (spettro riportato nella figura 28) evidenzia che il polimero presenta una ridotta estensione di coniugazione, a causa dell’ingombro sterico del sostituente tiometilico causato dalla presenza di concatenamenti HH, o del peso molecolare ridotto della frazione solubile. Infatti, pur dando uno shift batocromico di 121 nm passando da
Capitolo 2 Analisi e discussione dei risultati
34
soluzione a film, lo spettro UV-Vis del polimero in stato solido presenta una max tipica
di oligotiofeni (332 nm).
Figura 28. Spettro UV-Vis del PSMe in film e in soluzione di THF.
Risultati analoghi ai precedenti si sono ottenuti cambiando la metodologia di polimerizzazione, utilizzando come mezzo il cloroformio e come unico ossidante il FeCl3
in eccesso e non più in quantità catalitica 20. In questo caso non si sono avuti problemi di purificazione del polimero, che è stato recuperato per filtrazione e lavato più volte con metanolo acido, ma lo stesso risultava comunque insolubile nei comuni solventi organici.
2.4.2 Poli (3-butiltio)tiofene
Si è così deciso di sintetizzare un ulteriore polimero, il poli (3-butiltio)tiofene (PSBu) che avrebbe dovuto possedere una migliore solubilità e filmabilità grazie alla maggiore lunghezza del sostituente alchilico plastificante. Il monomero (3-butiltiotiofene, TSBu) è stato preparato seguendo le indicazioni riportate in letteratura 21, utilizzando una sintesi
Capitolo 2 Analisi e discussione dei risultati
35
“one pot”. In pratica, si parte dal 3-bromotiofene che viene fatto reagire con butil litio in etere etilico anidro per 30 minuti a -78°C, trasformandolo così nel sintone nucleofilo 3-litiotiofene. Quest’ultimo viene quindi fatto reagire con zolfo elementare per 40 minuti sempre a -78°C poi la temperatura viene lentamente alzata e la reazione lasciata per 5 minuti a 20°C. A questo punto viene sgocciolato il bromo butano e la reazione viene lasciata procedere per tutta la notte a temperatura ambiente (vedi schema nella figura 29). Il TSBu viene purificato per cromatografia su colonna (SiO2 6 nm, n-pentano/n-eptano
1:1). S S Br nBuLi Et2O SS Li S8 Et2O SS SLi Br(CH2)3CH3 Et2O SS S(CH2)3CH3 TSBu
Figura 29. Schema di sintesi del TSBu.
Mantenendo l’ambiente anidro durante tutto il corso della reazione ed avendo un accurato controllo delle temperature e dei tempi di aggiunta dei reagenti si ottiene una resa finale in TSBu del 40%.
Il monomero è stato quindi sottoposto ad un procedura di polimerizzazione ossidativa con FeCl3 dapprima in miscela CH3NO2/CHCl3, che avrebbe dovuto garantire un ottimo
controllo dei pesi molecolari unitamente ad una bassa polidispersità 22, poi in solo CHCl3,
che avrebbe dovuto condurre a pesi molecolari più elevati 23. In entrambi i casi, invece, si sono ottenuti solamente corti oligomeri probabilmente a causa del basso potenziale di ossidazione del monomero che favoriva la formazione di specie stabili a basso peso molecolare 24.
Si è quindi deciso di polimerizzare il TSBu con la procedura di McCullough, una procedura regiospecifica che prevede il coupling Ni(II) catalizzato del reattivo di Grignard ottenuto dal 2,5-dibromo derivato dell’alchiltiofene per reazione di metatesi con un alogenuro del metilmagnesio; lo schema di reazione è riportato nella figura 30.
Capitolo 2 Analisi e discussione dei risultati 36 S S S(CH2)3CH3 NBS DMF SS S(CH2)3CH3 CH3MgBr THF Br Br 2,5BTSBu NiDPPPCl 2 THF SS S(CH2)3CH3 PSBu n
Figura 30. Schema di sintesi del PSBu regioregolare con procedura di McCullough.
Nel nostro caso, l’applicazione di questa metodologia ha previsto la preparazione del 2,5-dibromo-3-butiltiotiofene (2,5BTSBu) partendo dal TSBu precedentemente sintetizzato e facendolo reagire con N-bromosuccinimmide in N,N-dimetilformammide anidra. La reazione è stata condotta in condizioni controllate, in due step successivi al fine di evitare la tribromurazione dell’anello tiofenico o l’alogenazione della catena laterale. In pratica, il TSBu è stato fatto reagire con 1 equivalente di NBS per 6 ore a temperatura ambiente, poi è stata aggiunta la seconda aliquota di NBS (1.5 eq) lasciando reagire per 24 h a temperatura ambiente. In questo modo si è ottenuta una resa in 2,5BTSBu del 70% dopo purificazione per cromatografia (SiO2/n-eptano).
Il 2,5BTSBu è stato quindi fatto reagire con 1 equivalente di CH3MgBr in THF anidro, a
riflusso ed in atmosfera inerte, per 2 ore. E’ stato quindi aggiunto il catalizzatore di coupling (NiDPPPCl2) e la reazione protratta per 1 ora sempre a riflusso. Al termine, il
polimero grezzo è stato recuperato per filtrazione previa aggiunta alla miscela di reazione di un eccesso di metanolo.
Il polimero grezzo (resa in grezzo: 75%) è stato quindi frazionato per dissoluzione nella minima quantità di cloroformio e successiva precipitazione in eccesso di metanolo (resa in frazionato: 57%). Questa volta il PSBu ottenuto si presentava come un solido di colore rosso scuro, ben solubile nei comuni solventi organici da cui forniva film omogenei, spessi ed auto consistenti nonostante il suo peso molecolare non fosse particolarmente elevato (Mn=11.000; PDI=1.4). L’analisi elementare è in accordo con la struttura attesa ([C8H10S2]n; teorico: C% 56.42; H% 5.92; S%: 37.66; trovato: C% 57.03; H% 5.55; S%:
Capitolo 2 Analisi e discussione dei risultati
37
2.5 CARATTERIZZAZIONE FT-IR
Nella figura 31 è riportato lo spettro FT-IR del TSBu (goccia su disco di Ge).
Figura 31. Spettro FT-IR del TSBu su disco di Ge.
Si evidenziano i seguenti segnali (in cm-1): 3103 ( C-H dell’anello tiofenico); 3059, flesso, ( C-H dell’anello tiofenico); 2953 (as CH3); 2928 (as –CH2-); 2871 (s CH3 +
–CH2-); 1492 (as C=C); 1464 (s C=C); 1350 (deformazione simmetrica CH3); 773 (
C-H tiofene 3-sostituito); 754 (rocking metileni), 686 ( C-S).
Lo spettro FT-IR del PSBu, riportato nella figura 32, mostra i seguenti assorbimenti principali (in cm-1): 3101 ( C-H dell’anello tiofenico); 3057 ( C-H dell’anello tiofenico); 2956 (as CH3); 2927 (as –CH2-); 2870 (s CH3 + –CH2-); 1501 (as C=C);
1463 (s C=C); 1378 (deformazione simmetrica CH3); 826 ( C-H tiofene
Capitolo 2 Analisi e discussione dei risultati
38
Figura 32. Spettro FT-IR del PSBu su disco di Ge.
L’assenza del segnale a 773 cm-1
e la presenza di quello a 826 cm-1 conferma l’avvenuta polimerizzazione anche se il segnale a 3101 cm-1 denuncia l’ottenimento di pesi molecolari non molto elevati. E’ infine da notare come il segnale attribuibile allo stretching del legame C-S passi da 686 cm-1 nel TSBu a 714 cm-1 nel PSBu evidenziando la sensibilità di questa deformazione all’intorno chimico del materiale.
Capitolo 2 Analisi e discussione dei risultati
39
2.6 CARATTERIZZAZIONE 1H-NMR E 13C-NMR
Nella figura 33 è riportato lo spettro 1H-NMR del TSBu.
Figura 33. Spettro 1H-NMR del TSBu.
Lo spettro ottenuto è in accordo con la struttura attesa; infatti nella zona alifatica sono presenti un tripletto a 0.93 ppm (CH3), un sestupletto a 1.43 ppm (CH2), un quintetto a
1.60 ppm (CH2) ed un tripletto a 2.82 ppm (CH2) mentre nella zona aromatica si
osservano tre multipletti (7.00 ppm H4, 7.11 ppm H2 e 7.32 ppm H5). Anche l’analisi
13
Capitolo 2 Analisi e discussione dei risultati
40
Figura 34. Spettro 13C-NMR del TSBu.
Si notano infatti quattro segnali nella zona alifatica (13.6 ppm CH3, 21.8 ppm CH2; 31.5
ppm CH2; 35.0 CH2) e quattro anche nella zona dei carboni aromatici (122.8 ppm C2;
126.0 ppm C5; 129.7 ppm C4 e 132.3 ppm C3) 25.
Il TSBu è stato quindi convertito nel 2,5BTSBu, il cui spettro 1H-NMR è riportato nella figura 35.
Capitolo 2 Analisi e discussione dei risultati
41
Figura 35. Spettro 1H-NMR del 2,5-BTSBu
Lo spettro conferma l’ottenimento del prodotto voluto; si nota infatti la presenza di un unico segnale nella zona dei protoni aromatici (6.91 ppm, H4) ad indicare la sostituzione da parte del bromo delle posizioni 2,5 del tiofene, mentre la zona dei protoni alifatici resta pressoché immutata rispetto al TSBu, mostrando segnali a 0.93 ppm (CH3), 1.44
ppm (CH2), 1.56 ppm (CH2) e 2.81 ppm (CH2). Anche lo spettro 13C-NMR, riportato
Capitolo 2 Analisi e discussione dei risultati
42
Figura 36. Spettro 13C-NMR del 2,5BTSBu.
Si osservano quattro segnali nella zona aromatica attribuibili ai C del tiofene (111.6 ppm C2; 113.5 ppm C5; 133.0 ppm C4 e 134.7 ppm C3) e quattro nella zona alifatica assegnabili ai C del sostituente tiobutilico (14.3 ppm CH3, 22.4 ppm CH2; 32.3 ppm CH2; 35.7 CH2) 26.
Passando dal monomero 2,5BTSBu al corrispondente polimero PSBu si osserva, all’1 H-NMR (figura 37), un singoletto prevalente nella zona aromatica, a 7.37 ppm, piuttosto deschermato rispetto al corrispondente segnale del monomero (6.91 ppm) e del PSMe precedentemente analizzato (7.25 ppm). La presenza di un unico segnale prevalente nella zona dei protoni aromatici indica la presenza di un polimero con una netta prevalenza di concatenamenti HT. I deboli segnali a 7.28, 7.31 e 7.40 sono probabilmente da attribuirsi ai protoni tiofenici in e delle catene più corte, in accordo con il peso molecolare del polimero non particolarmente elevato (DPn=65).
Capitolo 2 Analisi e discussione dei risultati
43
Figura 37. Spettro 1H-NMR del PSBu ottenuto con polimerizzazione di McCullough.
La presenza, al 13C-NMR (mostrato nella figura 38), di solo quattro segnali ascrivibili ai C aromatici, conferma la presenza di una unica triade configurazionale, e quindi di un elevato grado di regioregolarità del polimero ottenuto 27. Si notano infatti solamente quattro segnali nella zona aromatica attribuibili ai C del tiofene (129.0 ppm C3; 130.2 ppm C4; 132.3 ppm C2 e 134.0 ppm C5 28) e quattro nella zona alifatica assegnabili ai C del sostituente tiobutilico (13.6 ppm CH3, 21.7 ppm CH2; 31.6 ppm CH2; 35.0 CH2),
Capitolo 2 Analisi e discussione dei risultati
44
Figura 38. Spettro 13C-NMR del PSBu ottenuto con polimerizzazione di McCullough.
2.7 CARATTERIZZAZIONE UV-VIS E SOLVATOCROMISMO
Vista la buona solubilità del PSBu nei comuni solventi organici, a differenza del PATAC-Me e del PSMe, si è deciso di indagarne il comportamento solvatocromico in differenti miscele di solvente/non-solvente.
Nelle figure 39 e 40 vengono riportati i comportamenti cromici del PSBu in due miscele solvente/antisolvente. In particolare sono stati utilizati: DMPU (dimetilpropilen urea)/Metanolo e THF (tetraidrofurano)/Metanolo. Vengono quindi riportati gli spettri UV-Vis delle varie miscele in funzione della frazione molare di non-solvente (MeOH).
Capitolo 2 Analisi e discussione dei risultati
45
Figura 39. Effetto solvatocromico del PSBu in miscele di DMPU/MeOH, al variare della frazione molare
di metanolo.
Figura 40. Effetto solvatocromico del PSBu in miscele di THF/MeOH, al variare della frazione molare di
Capitolo 2 Analisi e discussione dei risultati
46
L’effetto solvatocromico del PSBu in entrambi i sistemi è di scarsa entità (max 26 nm,
da 501 a 527 nm in DMPU/MeOH e max 17 nm, da 505 a 522 nm in THF/MeOH) in
quanto già nel solvente puro le macromolecole si trovano in una conformazione planare e ordinata. Questo è evidenziato dalla max nei solventi puri sempre superiore a 500 nm, a
indicare una elevata lunghezza media di coniugazione. Inoltre, già in DMPU e in THF puri, si nota la presenza di una evidente strutturazione (transizione elettronica pura E0-0 a
603 nm in DMPU e 604 nm in THF), a indicare la presenza di stati conformazionali ad elevato ordine. In questo polimero probabilmente le catene laterali hanno una forte propensione ad auto-assemblarsi, evitando la completa solvatazione da parte delle molecole di solvente che inevitabilmente condurrebbe la macromolecola all’assunzione di una conformazione disordinata a gomitolo statistico.
Lo spettro del PSBu in film (riportato nella figura 41) è molto simile a quello nei solventi puri, pur possedendo un massimo di assorbimento a lunghezze d’onda più elevate (538 nm) ma una E0-0 solo debolmente spostata verso il rosso (605 nm), ad indicare la
presenza dello stesso conformero in soluzione di solvente puro ed in stato solido.
Capitolo 2 Analisi e discussione dei risultati
47
2.8 CONDUCIBILITA’ ELETTRICA
Sono stati preparati film di PSBu su vetrini da microscopio rettangolari (10×2.5 cm) depositando il polimero per drop casting, utilizzando qualche goccia di una soluzione di 5 mg di polimero in 2 ml di tetraidrofurano. I vetrini sono stati asciugati in stufa a 80°C quindi raffreddati a temperatura ambiente prima dell’utilizzo
Utilizzando lo stesso sistema impiegato per il PATAC-Me, sono state provate differenti velocità di tracciatura dei campioni muovendo gli stessi nel piano xy, da sinistra verso destra, creando una serie di tracce parallele contigue di una lunghezza pari a 10 cm. Il sistema era regolato in modo che il fascio laser non passasse mai due volte sulla stessa traccia.
Lo spessore del film variava da 5 a 10 μm a seconda delle condizioni di deposizione (quantità di soluzione di polimero depositata e velocità di asciugatura) dando film più omogenei che nel caso del PATAC-Me. Questa volta, a parità di potenza del raggio laser e di velocità di scansione, era il laser verde che riusciva più efficacemente a tracciare il PSBu, probabilmente a causa del fatto che il polimero possiede una assorbanza superiore a 532 nm piuttosto che a 440 nm. Il massimo di assorbimento del PSBu in stato solido, infatti, è a 538 nm.
Le condizioni migliori per la tracciatura dei campioni con il laser verde si sono avute utilizzando una velocità di scansione di 3 cm×s-1 ed una potenza del laser effettiva di 600 mW. La velocità di tracciatura richiesta per avere la massima conducibilità è più lenta nel caso del PSBu che del PATAC-Me, forse a causa della maggiore lunghezza del sostituente laterale, che viene eliminato più difficilmente dal substrato polimerico.
E’ da notare come i film di PSBu forniscano valori di conducibilità elettrica che sono essenzialmente indipendenti dal numero di tracce collegate, probabilmente grazie alla migliore omogeneità dei film stessi rispetto agli analoghi preparati con il PATAC-Me. I valori di conducibilità elettrica specifica ottenuti dopo tracciatura nelle condizioni precedentemente elencate si attestano su 5×10-2 S×cm-1. Il valore ottenuto, anche se inferiore a quello massimo ottenuto impiegando il polimero a base acetilenica, è particolarmente interessante in quanto il polimero a base tiofenica è senza dubbio più semplice da preparare e da filmare. Il PSBu per effetto del trattamento laser è in grado di aumentare la sua conducibilità elettrica di 8 ordini di grandezza, raggiungendo valori di
Capitolo 2 Analisi e discussione dei risultati
48
conducibilità confrontabili con quelli dei migliori derivati politiofenici drogati con specie ossidanti 29, senza però avere gli stessi problemi di stabilità all’aria e all’umidità anche per tempi lunghi. Il PSBu dà film essenzialmente amorfi (vedi sezione 2.9, Analisi Termiche) e flessibili e può quindi essere efficacemente applicato su supporti deformabili, come lastrine di PET, acetato di cellulosa, polivinilalcool, PVC, ecc.
2.9 ANALISI SUPERFICIALI
Nella figura 42 è riportata l’immagine al microscopio ottico di un film di PSBu sottoposto a tracciatura laser.
Figura 42. Fotografia al microscopio ottico di un film di PSBu sottoposto a tracciatura laser (50x).
In questa immagine, ottenuta con un ingrandimento di 50X, sono chiaramente visibili a sinistra il polimero non laserato, al centro due tracce sottili ottenute con il laser verde a bassa potenza (60 mW) e a destra altre due tracce, ottenute con il laser a piena potenza (600 mW). La velocità di tracciatura è stata mantenuta a 3 cm/s.
Capitolo 2 Analisi e discussione dei risultati
49
Figura 43. Fotografia al microscopio ottico di un film laserato di PSBu (400x).
Le stesse immagini sono state ottenute in 3D spostando in maniera automatica la testa del microscopio lungo l’asse z. Nella foto riportata nella figura 44 (ingrandimento 50X) si notano bene i solchi scavati dal laser.
Figura 44. Immagine 3D di un film laserato di PSBu, ingrandimento 50x.
Nella figura 45, invece (ingrandimento 400X) si ha una vista ravvicinata sui solchi tracciati a piena potenza.
Capitolo 2 Analisi e discussione dei risultati
50
Figura 45. Immagine 3D di un film laserato di PSBU, ingrandimento 400x.
Nella figura 46 è riportata la microfotografia SEM di un film di PSBu sottoposto a tracciatura laser.
Capitolo 2 Analisi e discussione dei risultati
51
L’immagine copre un’area di circa 2x4 mm; sono visibili 5 piste parallele tracciate con il laser nelle condizioni ottimali precedentemente elencate. Il contenuto di S cala drasticamente nelle tracce, pur restando elevato nelle zone tra le tracce (colore bianco, come mostrato nella figura 47).
Figura 47. Microanalisi elementare topografica relativa al contenuto di S in un film di PSBu laserato.
La percentuale in peso di S, passando dal polimero non tracciato a quello tracciato, varia dal 37 al 21% confermando la perdita dei gruppi laterali.
Capitolo 2 Analisi e discussione dei risultati
52
Figura 48. Spettro FT-IR di un campione di PSBu dopo tracciatura laser.
Alcuni degli assorbimenti principali sono i medesimi del polimero non tracciato (figura 32). In dettaglio (in cm-1): 3050 ( C-H dell’anello tiofenico); 2927 (as –CH2-+ CH3);
2853 (s CH3 + –CH2-); 1515 (as C=C); 1462 (s C=C); 825 ( C-H tiofene
2,3,5-trisostituito), 751 (rocking metileni).
Risulta non rivelabile la banda a 714 cm-1 ( C-S), a conferma della parziale perdita della catena laterale in seguito al processo di fotopirolisi, come visibile dal confronto degli spettri IR del polimero non laserato (a) e laserato (b), riportati nella figura 49 .
Capitolo 2 Analisi e discussione dei risultati
53
2.10 ANALISI TERMICHE
Il comportamento termico del PATAC-Me e del PSBu non tracciati è stato esaminato tramite DSC in azoto, operando con una velocità di scansione di 10°C/min. I termogrammi dei due polimeri sono riportati nelle figure 50 per il PATAC-Me e 51 per il PSBu.
Figura 50. Termogramma DSC del PATAC-
e.
Capitolo 2 Analisi e discussione dei risultati
54
Nessuno dei due polimeri evidenzia delle transizioni di fase particolarmente intense, anche se per entrambi sono rinvenibili dei segnali assegnabili a transizioni del II ordine (Tg), 42°C per il PATAC-Me e 80°C per il PSBu, ed anche a transizioni del primo ordine (Tm), 131°C per il PATAC-Me e 166°C per il PSBu. Oltre i 250°C cominciano ad intervenire fenomeni degradativi per entrambi i materiali.
Le analisi TGA del PATAC-Me e del PSBu sono state condotte riscaldando i campioni da 25 a 600°C, con una velocità di 10°C/min, in atmosfera ossidante (aria).
Il termogramma del PATAC-Me, riportato nella figura 52 mostra una perdita di peso a due fasi: la prima, a più basse temperature ma comunque superiori a 200°C, è compatibile con la perdita di un gruppo metilico e di uno tiometilico mentre la seconda, oltre i 400°C, comporta l’ossidazione pressoché completa della porzione residua di polimero.