Università degli studi di Pisa
Facoltà di Scienze Matematiche, Fisiche e Naturali
Corso di Laurea in Scienze Ambientali
Anno accademico 2005/2006 Sessione Autunnale
Tesi di Laurea
Il bioaccumulo di metalli pesanti: confronto tra organismi del polichete Hediste
diversicolor (O.F. Müller, 1776) provenienti da tre siti diversi di prelievo.
Relatori: Candidato Prof. Stefano De Ranieri Francesco Guidi Dott.ssa Ludmila Konzikova
INDICE
CAPITOLO 1: INTRODUZIONE 5
1.1 I test di tossicità sul sedimento 6
1.2 Il bioaccumulo 8
1.3 La biodisponibilità dei metalli pesanti nell’ambiente marino 10 1.4 Principali caratteristiche del polichete Hediste diversicolor
(O.F. Müller, 1776) 17
1.4.a L’ambiente 18
1.4.b Il ruolo di bioaccumulatore 21
1.4.c I meccanismi di assunzione dei metalli 23
1.4 Caratteristiche dei metalli esaminati 25
1.5.a Il cadmio 25 1.5.b Il mercurio 26 1.5.c Il cromo 27 1.5.d Il piombo 28 1.5.e Il vanadio 28
1.5.g Lo zinco 30
1.5.h Il nichel 30
CAPITOLO 2: MATERIALI E METODI 31
2.1 Inquadramento geografico dei siti di prelievo 32
2.1.a Il Magra 32
2.1.b Il Serchio 34
2.1.c Lo Scolmatore dell’Arno 35
2.2 Prelievo e trattamento degli organismi 37
2.3 Allestimento del test di bioaccumulo 38
2.5 Analisi chimiche 41
2.6 Analisi granulometriche 46
CAPITOLO 3: RISULTATI 47
3.1 Parametri del test di bioacccumulo 48
3.3 Concentrazioni di metalli nel sedimento e negli organismi 52 3.4 Bioaccumulo di Cd 55 3.5 Bioaccumulo di Ni 58 3.6 Bioaccumulo di Hg 61 3.7 Bioaccumulo di Pb 64 3.8 Bioaccumulo di Cu 67 3.9 Bioaccumulo di Cr 70 3.10 Bioaccumulo di Zn 73 3.11 Bioaccumulo di V 76 CAPITOLO 4: DISCUSSIONE 79 CAPITOLO 5: CONCLUSIONI 85 BIBLIOGRAFIA 88
C
apitolo
U
no
1.1 I test di tossicità sul sedimento
Il problema delle sostanze inquinanti associate al sedimento ha cominciato ad assumere una dimensione rilevante alla fine degli anni settanta. (USACOE, 1977).
A partire da quegli anni si sono diffuse le ricerche e gli studi su questo problema ed è emerso che numerose aree costiere densamente abitate e industrializzate, presentano sedimenti contaminati da un numero rilevante di sostanze inquinanti (Alden e Young, 1982, Chapman et al., 1987).
Le attività antropiche hanno determinato l’incremento degli inquinanti nell’ambiente marino e contribuito ad aumentarne il contenuto nelle acque marine e la successiva concentrazione di questi nel sedimento. Le cause più rilevanti di contaminazione sono l’attività mineraria e il trasporto delle acque di drenaggio al mare attraverso i corsi d’acqua, i reflui civili ed industriali, il dilavamento dei suoli agricoli
Le prime valutazioni sulla qualità di un sedimento consistevano essenzialmente in analisi di tipo chimico che, pur evidenziando la presenza di determinati composti, (metalli pesanti, pesticidi, composti aromatici e cloro organici) non fornivano informazioni sull’importanza ambientale e sugli impatti che tali sostanze possono esercitare.
La presenza di una sostanza non è necessariamente motivo di danno biologico agli organismi perché la porzione biodisponibile può variare fortemente ed è influenzata da una vasta gamma di fattori che un’analisi di tipo chimico può evidenziare ma non è in grado di porre in relazione agli effetti tossici (Rodgers et al.,1984).
L’incompletezza della sola analisi di tipo chimico ai fini della valutazione dei possibili effetti sugli organismi, ha portato allo sviluppo di saggi di tossicità sul sedimento tramite l’utilizzo di numerosi tipi di organismi.
Queste metodologie si sono affermate a partire dai primi anni novanta, rivelandosi uno strumento diretto e abbastanza completo per valutare la pericolosità di un sedimento (Burton et al.,1991).
La varietà di specie utilizzabili nei saggi biologici è relativamente ampia così come la durata dei test che può variare da alcuni minuti per i saggi con batteri luminescenti, ad alcuni giorni per i saggi con alghe ed anfipodi fino a diverse settimane nei test di bioaccumulo con pesci e policheti ( Viganò et al., 2001).
La nicchia occupata da una certa specie determina i rapporti che essa instaura con il sedimento, stabilendo la principale via di esposizione ai contaminanti oltre che il risultato finale dell’esposizione (Harkley et al., 1994). Questo aspetto, unito alla sensibilità propria dell’organismo in esame, può influenzare in maniera marcata il risultato finale della condizione espositiva. Le difficoltà di interpretazione sono maggiori per aree moderatamente contaminate per le quali la scelta delle specie da utilizzare può influenzare ampiamente i risultati dell’indagine.
Il presente lavoro nasce dalle esigenze pratiche di laboratorio, riguardo il test di bioaccumulo con il polichete Hediste diversicolor (O.F. Müller, 1776). La disponibilità di questi organismi nei siti di prelievo, che presentano diversi gradi di contaminazione, non è costante. L’utilizzo degli organismi aventi una diversa provenienza e la loro precedente permanenza sui sedimenti nativi può influenzare il risultato del test di bioaccumulo.
1.2 IL BIOACCUMULO
Il processo mediante il quale alcuni organismi riescono ad incorporare sostanze estranee nei loro tessuti prendendole dall’ambiente acquoso e con l’alimentazione, si definisce bioaccumulo (U.S EPA, 2000) ed è un processo di equilibrio dinamico tra assunzione, accumulo, eliminazione.
L’entità dell’accumulo di una sostanza in un organismo dipende dal tasso con cui viene assimilata dalla fonte e dalla velocità con cui viene eliminata.
Se all’inizio non è presente alcuna sostanza il tasso di eliminazione è nullo e la concentrazione aumenterà unicamente con l’ingestione della sostanza; con l’incremento della sua concentrazione nell’organismo anche la velocità di eliminazione aumenta ed il processo va avanti fino a quando si giunge in uno stato stazionario in cui l’eliminazione uguaglia l’assunzione.
L’esposizione ad elevate concentrazioni di sostanze può sbilanciare questo processo di equilibrio e provocare danni ad un organismo se la sostanza è tossica. Tuttavia se la concentrazione nell’ambiente diminuisce, anche quella all’interno dell’organismo si abbassa e si può giungere alla sua eliminazione nel tempo ( Baird, 2000).
Il parametro che viene utilizzato per stimare il bioaccumulo nell’ambiente acquatico è il fattore di bioaccumulo (BAF) definito come il rapporto tra la concentrazione della sostanza nei tessuti dell’organismo e la sua concentrazione nell’ambiente acquatico, dove sia l’organismo che il suo cibo sono esposti alla sostanza ed il loro rapporto non cambia nel tempo (U.S. EPA, 2000).
Il bioaccumulo è un fenomeno molto variabile tra le varie specie, e può dipendere dal contenuto di lipidi dell’individuo, dalla taglia (Landrum et al., 1992), dalla dieta e dalle condizioni chimico fisiche dell’ambiente circostante. La temperatura e l’ossigeno
da questi parametri. Un aumento della temperatura, è potenzialmente in grado di aumentare la velocità delle reazioni biochimiche degli organismi, di conseguenza può aumentare l’assunzione di sostanze tossiche anche se questo non sempre si verifica perché vengono velocizzate anche le reazioni di escrezione (Luoma 1983).
Inoltre basse concentrazioni di ossigeno determinano un aumento del tasso di ventilazione di alcuni organismi acquatici che, in questo modo, possono assumere maggiori quantità di sostanze tossiche (Connel and Milller, 1984).
Le sostanze tossiche assunte possono seguire destini diversi perché vi sono organismi regolatori, caratterizzati da efficienti meccanismi di escrezione ed organismi non regolatori, che riescono ad immagazzinare i composti nocivi in forme detossificate, come fanno alcuni invertebrati marini, i quali accumulano i metalli pesanti legandoli a particolari proteine ricche di gruppi sulfidrilici dette metallotioneine (Depledge and Rainbow, 1990).
1.3 LA BIODISPONIBILITA’ DEI METALLI PESANTI NELL’
AMBIENTE MARINO
I metalli pesanti appartengono agli elementi di transizione, occupano il quarto, quinto e sesto periodo della tavola periodica.
Sono caratterizzati da bassi valori dei potenziali di ionizzazione, compresi tra 6 e 9 volt, e dall’elettronegatività che può assumere valori compresi tra 1,4 e 2,2.
Questi elementi hanno la tendenza a formare ioni complessi, composti in cui lo ione metallico lega direttamente a sé un certo numero di molecole neutre o ioni negativi detti ligandi (Araneo 1987).
Da un punto di vista biologico, i metalli pesanti, possono essere classificati in essenziali e non essenziali.
I primi comprendono ferro, rame, zinco, cromo, cobalto, nichel e sono richiesti dagli organismi in quantità minime in quanto costituenti importanti degli enzimi.
Ci sono delle concentrazioni ottimali al di sotto delle quali l’organismo entra in sofferenza, tuttavia se la quantità di questi elementi diventa eccessiva può risultare dannosa (fig. 1.1 a).
Gli elementi non essenziali come mercurio, cadmio, piombo, non avendo alcuna funzione biologica possono essere tollerati dagli organismi entro determinate concentrazioni, (fig. 1.1 b) oltre le quali possono diventare tossici (Cognetti et al., 1999).
Figura 1.1. Crescita di un organismo con metalli essenziali (a) e non essenziali (b)
Il meccanismo dell’azione tossica dei metalli pesanti deriva dall’affinità dei cationi metallici per lo zolfo. I gruppi sulfidrilici –SH normalmente presenti negli enzimi che controllano la velocità delle reazioni metaboliche si legano facilmente ai cationi dei metalli pesanti o alle molecole che contengono tali metalli.
Dato che il complesso metallo-zolfo interessa tutto l’enzima, questo non può svolgere la sua funzione normalmente e di conseguenza può provocare danni per la salute dell’organismo (Baird, 2000).
I metalli che vengono dispersi in ambiente marino si possono distribuire tra acqua, materiale sospeso, sedimento, acqua interstiziale (fig. 1.2).
In questo modo possono interagire con gli organismi viventi ed attraverso la catena alimentare raggiungere l’uomo (Salomons and Forstner, 1988).
Figura 1.2. Interrelazioni dei metalli nell’ambiente marino
La frazione disciolta è composta dai metalli in soluzione.(Elder 1989). Nelle condizioni naturali molti idrossidi minerali hanno una bassa solubilità, che aumenta con la diminuzione del pH (fig 1.3).
Un ambiente con pH basso può favorire una maggiore disponibilità dei metalli pesanti per gli organismi (Salomons, 1995).
Figura 1.3. Solubilità degli ioni cadmio e zinco in acqua di mare a diversi pH
materiale particolato disponibile. L’assorbimento dei metalli in tracce da parte degli ossidi di ferro e manganese aumenta con l’aumentare del pH e quindi in ambienti a pH basso può verificarsi il rilascio dei metalli assorbiti.
La reversibilità dei processi di assorbimento - rilascio è stata osservata per zinco, cadmio e rame mentre nel caso del piombo il rilascio avviene con minore intensità (Tipping et al., 1988).
In tabella 1.1 viene riassunta la mobilità dei metalli nell’ambiente marino (Salomons, 1995).
Tabella 1.1. Ripartizione dei metalli in ambiente marino e relativa mobilità
METAL SPECIES AND
ASSOCIATIONS MOBILITY
Exchangeable dissolved
cations High.Changes in major cationic composition (es. Estuarine enviroment) may cause a relase due to ion exange. Metal associated with
Fe-Mn oxides
Medium. Changes in redox conditions may cause a relase but some metals precipitate if sulfide minerals present is
insoluble. Metal associated with
organic matter Medium-hight. With time,decomposition oxidation of organic matter occours. Metal asociated with
sulfide minerals
Strongly dependent on enviromental condition.Under oxigen rich conditions,oxidation of sulfide minerals leads a
relase of metals. Metals fixed in crystalline
phase Low. Only avilable after weathering or decomposition.
La concentrazione maggiore degli elementi in traccia nell’acqua di mare, è associata al materiale particolato sospeso.
Cadmio, cromo, nichel, e zinco sono coinvolti nei cicli del materiale particolato proveniente dall’attività biologica; la loro concentrazioni sono modeste nelle acque superficiali ed aumentano con la profondità.
Gli elementi come cobalto, piombo e mercurio sono caratterizzati da bassi periodi di residenza nelle acque a causa delle forti interazioni con il materiale particolato presente (Withfield and Turner, 1987).
Gli estuari costituiscono ambienti dove i metalli pesanti tendono ad essere intrappolati. Quando un fiume giunge in prossimità della foce, la sua corrente si riduce e le particelle sospese vengono depositate. Contemporaneamente le variazioni di pH e salinità dovute al mescolamento di acque di diversa origine comportano la flocculazione degli ossidi di ferro insieme alle sostanze umiche ed al materiale colloidale come le argille. L’insieme di questi processi determina la rimozione dei metalli in soluzione e la loro deposizione nel sedimento dove assumono concentrazioni molto più marcate rispetto alla colonna d’acqua e possono interagire con gli organismi bentonici (Bryan et al., 1980).
La concentrazione e la biodisponibilità dei metalli nelle aree di foce dipende dalla speciazione chimica dei metalli, dall’influenza della bioturbazione, condizioni redox, pH, salinità e dalla presenza di processi di metilazione (Bryan and Langston, 1992). Il sedimento è una matrice ambientale tipicamente eterogenea nelle sue caratteristiche chimiche, fisiche e biologiche; comprende materia organica in vari gradi di decomposizione o sintesi, materiale derivante dalla degradazione dei minerali e materia inorganica di origine biogena (Knezovich et. al., 1987).
L’acqua interstiziale ed il materiale inorganico occupano gran parte del volume nell’ambito del sedimento.
La materia organica occupa una porzione minore ma è ugualmente importante perché la sua presenza controlla l’assorbimento e la biodisponibilità di molti metalli pesanti, infatti gli acidi umici e fulvici in essa presenti tendono a formare complessi con gli ioni metallici.
Generalmente all’interno del sedimento, i fluidi interstiziali formano un ambiente riducente che favorisce la trasformazione di solfati in solfuri e di conseguenza, molti metalli possono precipitare sotto forma di solfuri insolubili e trasformarsi in non disponibili per gli organismi viventi. Durante la diagenesi dei minerali, vari metalli tossici, che non sono legati alla porzione silicatica, quali arsenico, rame, cadmio, mercurio, piombo e zinco possono precipitare insieme alla pirite sotto forma di solfuri insolubili non disponibili per gli organismi viventi (Morse, 1994).
Eventuali intrusioni di acque ossigenate al suo interno, dovute a fenomeni stagionali, possono dare luogo a reazioni di ossidazione e determinare un rilascio dei metalli presenti.
A livello dei sedimenti fini, i processi di metilazione e demetilazione svolgono un ruolo essenziale per la mobilità di zinco, cadmio e mercurio.
La metilazione del mercurio avviene grazie all’azione di batteri, in condizioni sia aerobiche che anaerobiche ed a pH moderatamente acido. Questo processo riveste una particolare importanza in quanto tale metallo pur essendo tossico in forma cationica è ancora di più tossico se viene metilato (Summers, 1978).
In questa forma diventa solubile nei tessuti adiposi degli animali e può essere bioaccumulato. I fenomeni di turbolenza e bioturbazione che provocano un mescolamento degli strati superficiali di acqua partecipano con il tasso di sedimentazione attraverso il quale il sedimento contaminato viene seppellito.
I processi di diffusione influenzano la mobilità dei metalli associati al sedimento e sono regolati dai gradienti di concentrazione che si stabiliscono tra l’acqua interstiziale e la colonna d’acqua soprastante (US EPA 2000).
Lo schema seguente (fig1.4), riassume le relazioni che si stabiliscono tra le varie forme in cui possono trovarsi i metalli nell’ambiente marino (Ohman and Sjoberg, 1988).
1.4 PRINCIPALI CARATTERISTICHE DEL POLICHETE
HEDISTE DIVERSICOLOR (O.F. Müller, 1776)
1.4.a L’ambiente
Il polichete Hediste diversicolor popola i sedimenti degli estuari in diverse regioni geografiche, compresa l’Europa.
L’azione delle maree influenza fortemente l’estuario, mescolando l’acqua di mare con l’acqua dolce proveniente dal bacino fluviale.
Il mescolamento delle acque marine con quelle continentali determina condizioni di una certa instabilità dei parametri chimico-fisici, in particolare della salinità che può assumere valori molto variabili.
Se la corrente fluviale prevale sull’azione della marea si verifica un modello di circolazione a cuneo salino (fig.1.7).
L’acqua dolce tende a galleggiare sull’acqua di mare che risulta più pesante e forma perciò un cuneo salino che si estende sul fondo, e si spinge verso l’interno anche per distanze considerevoli.
Un estuario moderatamente stratificato con bassa salinità si viene a creare quando la corrente del fiume e l’azione della marea sono pressoché equivalenti.
Una forte intensità delle maree e la prevalenza di questo tipo di fenomeno, determinano il mescolamento delle acque dalla superficie al fondo ed una salinità che si avvicina a quella del mare aperto (Odum ,1971).
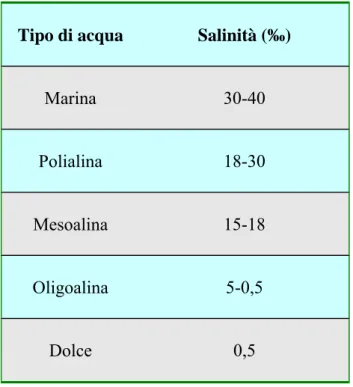
La classificazione di queste acque, soprattutto per quanto riguarda il Mediterraneo, si basa sul sistema di Venezia, risalente ad un congresso sugli ambienti salmastri svoltosi in questa città nel 1958 e opera una distinzione dei vari tipi di acque in rapporto alla concentrazione di sali presenti (tabella 1.2).
Tabella 1.2. Classificazione delle acque salmastre in base al sistema di Venezia
Tipo di acqua Salinità (‰)
Marina 30-40
Polialina 18-30
Mesoalina 15-18
Oligoalina 5-0,5
Dolce 0,5
La grande variazione di salinità può influire sui possibili effetti tossici dei composti chimici sugli organismi viventi. Infatti la tossicità di alcuni metalli tra cui rame, cadmio, zinco,nichel e mercurio aumenta con la diminuzione della salinità, in conseguenza di ciò
1995). Sul fondo degli estuari si depositano i sedimenti trasportati dai fiumi, composti in prevalenza da limo e argilla. Inoltre si accumula anche una notevole quantità di materiale di origine organica dovuto all’elevata mortalità degli organismi trasportati dal mare e dalle acque dolci, che si trovano nelle condizioni ambientali diverse da quelle originali. La ritenzione dell’acqua insieme all’elevato popolamento batterico del sedimento provocano la scomparsa dell’ossigeno già ad una profondità di pochi centimetri dalla superficie. Di conseguenza all’interno del sedimento tendono a prevalere condizioni anaerobiche che danno luogo ad un ambiente riducente. La parte più superficiale del sedimento, aerobica, è caratterizzata da un colore bruno giallastro mentre lo strato sottostante anaerobico, è nero. Tra i due strati si trova un piano grigiastro chiamato zona di discontinuità del potenziale redox (fig.1.8). In questo strato si verifica un brusco cambiamento del potenziale redox dai valori negativi dello strato anaerobico a quelli positivi dello strato aerobico (Cognetti et al., 1999).
Questo aspetto è importante perché i composti ridotti che si diffondono dal basso verso l’alto vengono ossidati quando l’ossigeno è disponibile.
Tali fenomeni si possono verificare nelle condizioni di elevato idrodinamismo o in presenza di moti turbolenti nelle acque.
Tuttavia anche attività antropiche come i dragaggi, possono provocare il mescolamento dei sedimenti anossici causando l’ossidazione e la variazione della biodisponibilità dei metalli in tracce.
Condizioni ossidanti possono inoltre generare bassi valori di pH all’interno del sedimento perché l’ossidazione della materia organica ed inorganica in esso presente determina la produzione di ioni idrogeno che danno luogo ad un ambiente acido (Hong et al., 1991).
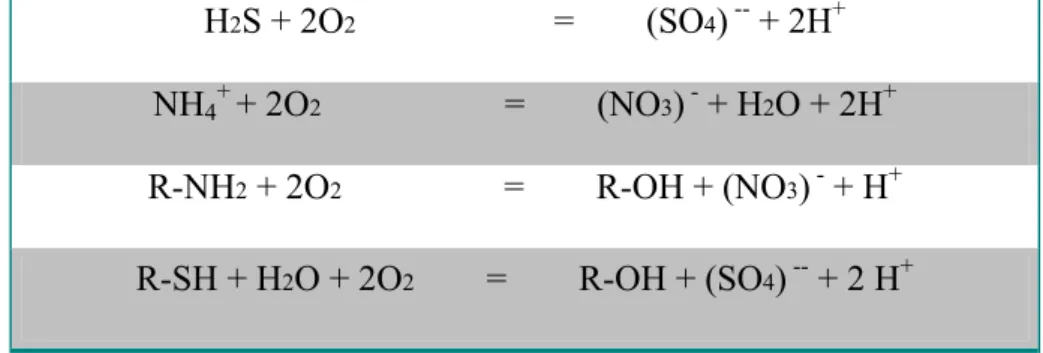
La tabella seguente illustra alcune delle principali reazioni che possono verificarsi nei sistemi acqua-sedimento.
Tabella 1.3. Principali reazioni di ossidazione nei sistemi acqua-sedimento
H2S + 2O2 = (SO4) -- + 2H+
NH4+ + 2O2 = (NO3) - + H2O + 2H+
R-NH2 + 2O2 = R-OH + (NO3) - + H+
1.4 b IL RUOLO DI BIOACCUMULATORE
La misura della concentrazione di una sostanza tossica all’interno di un organismo può essere effettuata sull’intero individuo, su una sua parte oppure su un singolo tessuto (Phillips, 1977). La scelta delle specie da utilizzare può avere un’ampia influenza sul successo, il significato ecologico e l’interpretabilità del test di bioaccumulo.
Vista la grande varietà di situazioni ambientali esistenti non c’è una specie particolare che deve essere scelta ma piuttosto dei requisiti che tale specie deve possedere.
L’organismo utilizzato deve ingerire particelle di sedimento durante l’alimentazione e deve essere sufficientemente resistente all’inquinamento per sopravvivere durante il periodo di esposizione del test con il minimo livello di mortalità. Inoltre deve poter tollerare le condizioni di laboratorio, una vasta gamma di tipi diversi di sedimento e ricoprire un ruolo ecologico importante (Boese et al., 1989).
Hediste diversicolor, (fig 1.7 e fig.1.8) è una specie chiave nell’ambito delle comunità bentoniche dei fondi molli e si presta bene ad essere utilizzato come bioaccumulatore per la contaminazione dei sedimenti (Pocklington and Wells, 1992).
Questo polichete è una specie onnivora ed opportunistica, che si nutre per predazione o raccogliendo il materiale organico ed il detrito depositati sulla superficie del sedimento (Olivier et al., 1996).
Presenta un ciclo vitale abbastanza lungo, da uno a tre anni, riproducendosi una sola volta nell’arco della propria vita.
Ha un ampio areale di distribuzione in tutta Europa e tollera ampie variazioni di salinità e temperatura, può sopravvivere in ipossia e di conseguenza è capace di stabilirsi in ambienti caratterizzati da situazioni di naturale instabilità come sono appunto le porzioni terminali dei fiumi.
Figura 1.7. Hediste diversicolor
1.4 c I MECCANISMI DI ASSUNZIONE DEI METALLI
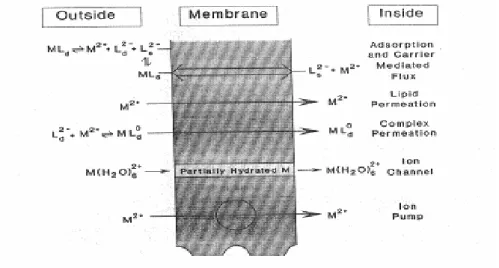
Hediste diversicolor può assumere i metalli attraverso la superficie corporea o tramite l’ingestione di particelle di sedimento.
L’assunzione dall’ambiente acquoso dipende dalla quantità di ioni metallici in soluzione ed avviene principalmente tramite meccanismi di trasporto passivo (Nieboer and Richardson, 1980). Talvolta sono presenti anche fenomeni di trasporto attivo, come nel caso del cadmio che, avendo un raggio atomico simile al calcio, può essere trasportato dalle proteine canale specifiche per questo elemento (Wang and Fisher, 1999).
L’attraversamento della membrana lipidica da parte dei metalli può essere favorita dalla loro reazione con ligandi disciolti per formare ioni complessi a carica neutra (fig.1.9) ed è inoltre influenzata dalla sfera di idratazione che avvolge lo ione metallico (Simkiss and Taylor, 1989).
L’ingestione di particelle di sedimento svolge un ruolo fondamentale perché qui i metalli possono essere molto più concentrati rispetto alla colonna d’acqua soprastante.
La granulometria di un sedimento dipende dal tipo di particelle minerali che lo compongono.
Le frazioni più grossolane sono generalmente costituite da materia inorganica stabile e non sono in genere associate a contaminazione (Foth, 1982).
La frazione più fine riveste invece una grande importanza perché è quella ingerita dall’animale, che contiene il particolato organico, ed avendo un elevato rapporto superficie-volume, possiede una maggiore capacità di adsorbimento dei metalli tossici (Power and Chapman, 1992).
1.5 CARATTERISTICHE DEI METALLI ESAMINATI
1.5.a Il cadmio
Il cadmio è un metallo altamente tossico che viene utilizzato nella produzione di batterie, pigmenti e materie plastiche ed è coinvolto nei processi industriali di fusione dello zinco. La forma predominante con cui il cadmio si trova nell’ambiente è lo ione (Cd++). Nell’ambito marino il potenziale redox del sistema acqua-sedimento funziona come un meccanismo di controllo nell’associazione del metallo con il materiale particolato mentre pH e salinità ne influenzano la stabilità delle sue varie forme.
In condizioni anaerobiche, quasi tutto il cadmio risulta immobile perché viene legato dalla materia organica oppure dai solfuri.
L’aumento della concentrazione di ossigeno all’interno del sedimento può determinare il rilascio del cadmio legato ai solfuri minerali, attraverso la formazione di composti più mobili. (Kersten, 1988).
Quantità elevate di cloruri favoriscono la formazione di ioni complessi determinando una riduzione della capacità di assorbimento del cadmio da parte del sedimento (Bourg, 1988).
1.5.b Il mercurio
Le principali fonti di contaminazione da mercurio sono dovute alla combustione del carbone fossile e degli oli combustibili che spesso contengono tracce dell’elemento e dal processo industriale cloro-soda. Il mercurio si presenta principalmente in forma di ione bivalente (Hg++), ed in condizioni di anossia in forma metallica (Hg).
Lo ione (Hg++) può essere soggetto della metilazione ad opera di batteri, sia in
condizioni aerobiche che anaerobiche, formando (CH3)2Hg e CH3Hg+ (fig 1.9).
Questi composti sono caratterizzati da un elevata tossicità, tendono ad essere rilasciati rapidamente dalle particelle di sedimento e passando in soluzione, diventano disponibili per gli organismi che vivono nella colonna d’acqua.
Nonostante che i livelli di metilmercurio disciolti nell’acqua siano estremamente bassi, la biomagnificazione che avviene all’interno della catena alimentare, può portare a concentrazioni talvolta rilevanti nei tessuti dei pesci (Baird, 2000).
Il processo di metilazione è inibito da alte concentrazioni di solfuri perché lo ione Hg++
, precipita sotto forma di solfuri insolubili.
Il mercurio tende, in ambiente acquatico, ad essere associato con le sostanze umiche, gli ossidi minerali ed i solfuri (Luoma 1989).
1.5.c Il cromo
Il cromo in natura si presenta prevalentemente in due stati di ossidazione: trivalente ed esavalente. Le due forme si comportano in maniera completamente diversa perché il cromo(III) è un micronutriente essenziale per l’uomo e molti mammiferi mentre il cromo(VI) risulta altamente tossico in quanto è un forte agente ossidante. La forma trivalente è praticamente insolubile ai valori di pH dell’acqua marina ed ha la tendenza a precipitare come idrossido insolubile concentrandosi nel sedimento (Richard and Bourg, 1991) specialmente in presenza di condizioni anossiche. La sua solubilità aumenta solo a pH inferiore a 5,5 ed in condizioni di buona ossigenazione. Il cromo esavalente è solubile e potenzialmente molto disponibile. Questa specie chimica può crearsi negli ambienti ben ossigenati, come prodotto dell’ossidazione del cromo trivalente o tramite la sua reazione con gli ossidi di ferro e manganese costituenti il materiale particolato (Zhang and Bartlett, 1999).
Le contaminazioni da cromo sono molto frequenti a causa dell’utilizzo di questo metallo nell’industria chimica, siderurgica, galvanica e conciaria.
1.5.d Il piombo
La maggior parte delle fonti di inquinamento da piombo nel sistema acquatico proviene dalle emissioni veicolari e dagli scarichi derivanti dall’attività mineraria (Prosi, 1989). Questo metallo, tende a precipitare sotto forma di solfati e carbonati ed è inoltre in grado di formare complessi con la materia organica ed il materiale particolato.
La sua solubilità nelle acque è maggiore a pH moderatamente acido ed è poco influenzata dal potenziale di ossido-riduzione.
Il piombo, in ambienti riducenti, è saldamente legato ai solfuri minerali e tende a formare ioni complessi con la materia organica insolubile mentre, negli ambienti ben ossigenati, è incorporato negli ossidi di ferro (Gambrell et al., 1991).
Negli organismi marini il tempo di semivita risulta più breve rispetto a quello di altri metalli pesanti. Il tasso di depurazione dipende dalle concentrazioni iniziali a cui l’organismo è esposto e coinvolge meccanismi di detossificazione (UNEP, 1985).
1.5.e Il vanadio
Le principali fonti attraverso le quali il vanadio viene immesso nell’ambiente risultano l’industria siderurgica e le raffinerie poiché questo elemento fa parte del petrolio, associato alla frazione pesante.
Questo metallo possiede stati di ossidazione da -1 a +5. I più comuni che compaiono sono +3, +4, +5. Allo stato pentavalente il vanadio risulta stabile in soluzione acquosa per un ampio intervallo di pH.
La maggior parte del vanadio che entra nell’acqua marina appare in sospensione o viene assorbito sui colloidi, passando meccanicamente attraverso l’acqua senza reagire.
Solo una piccola parte si presenta in forma solubile mentre la maggior parte tende a concentrarsi nei sedimenti.
Le basse concentrazioni di vanadio nell’acqua marina indicano che questo metallo viene continuamente rimosso dall’acqua sia per assorbimento sul materiale particolato sia tramite i processi biochimici degli organismi.
In particolare, il metallo si accumula in alcuni organismi planctonici come gli ascidiacei, e nelle alghe marine finendo poi nel sedimento quando muoiono (Delbono et al., 2003).
1.5.f Il rame
Gli scarichi derivanti dall’attività di estrazione mineraria rappresentano il principale apporto del metallo nelle acque marine e fluviali.
Il rame si trova sotto forma di ione bivalente (Cu++), idrossidi, carbonati e ha la tendenza a formare complessi con la materia organica ed il materiale particolato.
La precipitazione dei carbonati influenza la concentrazione del metallo a valori elevati di pH.
Quantità elevate di cloruri comportano inoltre un aumento della mobilità del rame in seguito alla formazione degli ioni complessi ed un minor grado di assorbimento all’interno del sedimento (Bourg, 1988).
Il rame pur essendo un micronutriente essenziale per molti organismi risulta tossico se presente in dosi eccessive: molte specie acquatiche mostrano infatti sensibilità a concentrazioni nell’arco di 1-10 μg/l (Bryan, 1976).
1.5.g Lo Zinco
Lo zinco è un elemento essenziale per molti organismi viventi, perchè è il costituente di diversi enzimi ed è coinvolto in varie reazioni metaboliche.
Nonostante questo metallo non sia spiccatamente tossico, talvolta viene rilasciato in mare in quantità elevate (Ansari et al., 2004).
La maggior parte delle contaminazioni da zinco sono dovute alle attività estrattive ed all’industria di lavorazione dell’acciaio.
In acque caratterizzate da una bassa alcalinità il metallo si presenta sotto forma di ione bivalente (Zn++) mentre a pH più basico tende a formare complessi con carbonati e solfati o precipita insieme al carbonato di calcio (Dojlido and Best, 1993).
Lo zinco è in grado di formare complessi con la materia organica ed il materiale particolato.
1.5.h Il nichel
Le principali contaminazioni di questo metallo sono dovute all’estrazione mineraria, alla produzione metallurgica di leghe ed alla lavorazione dei minerali che lo contengono. La forma predominante con la quale si trova nei sistemi acquatici risulta lo ione bivalente (Ni++) il quale forma complessi moderatamente forti con gli acidi umici e può
essere adsorbito dal materiale particolato. Il metallo può passare in soluzione nelle condizioni di buona ossigenazione mentre in condizioni anossiche tende a precipitare sotto forma di solfuri insolubili e concentrarsi nel sedimento (Soundby, 1992).
C
apitolo
D
ue
2.1 INQUADRAMENTO GEOGRAFICO DEI SITI DI PRELIEVO
I prelievi degli individui di Hediste diversicolor utilizzati per il test di bioaccumulo, sono stati effettuati in prossimità delle zone di foce di Serchio, Magra e Scolmatore.
2.1.a Il Magra
Il fiume Magra nasce dal monte Borgognone ed ha una lunghezza di 62 chilometri circa, scorre in gran parte in Toscana e solo gli ultimi 18 chilometri fanno parte della provincia di La Spezia (fig.2.1 e fig 2.2).
In questo tratto della bassa Val di Magra, il fiume scorre tra due dorsali: l’occidentale corrisponde al promontorio che delimita a oriente il golfo di La Spezia e l’orientale che culmina al Monte Cornoviglio e continua al di là della media Val di Magra con le alpi Apuane.
La bassa Val di Magra è una fossa tettonica delimitata da un’associazione di faglie convergenti e l’alveo fluviale è caratterizzato dalla presenza di sabbia e ciottolame ricchi di materiale arenaceo e calcari marmosi; il letto del fiume è ampio e presenta molti meandri e ramificazioni sia attive sia abbandonate (Autorità portuale di La Spezia, 2002).
Figura 2.1. La foce del Magra
2.1.b Il Serchio
Il Serchio nasce dal Monte Fiore ed è lungo circa 102 chilometri. Le precipitazioni piovose e nevose del bacino sono tra le più elevate in Italia (circa 1800 mm\anno) e questa elevata piovosità assicura una portata minima vitale anche nel periodo estivo. Le caratteristiche geologiche delle rocce carbonatiche affioranti consentono cospicui fenomeni di infiltrazione che permettono di alimentare importanti sorgenti e riducono al minimo i tempi di torbidità delle acque superficiali.
La parte terminale del fiume scorre subparallela alla costa e sfocia in prossimità di un lido sabbioso, in un’area compresa tra le pinete di San Rossore e Migliarino. (Fig. 2.3).
2.1.c Lo Scolmatore dell’Arno
Lo Scolmatore è un canale artificiale costruito nel 1966 presso Pontedera, in provincia di Pisa. Ha una lunghezza di circa 32 chilometri e sfocia a nord di Livorno in località Calabrone. (fig.2.4 e fig 2.5).
Lo Scolmatore dell’Arno percorre una vasta area di pianura in parte caratterizzata da zone umide e da opere di bonifica.
Nello Scolmatore confluiscono serie di canali di bonifica, di corsi d’acqua provenienti dalle colline pisane e livornesi il più importante dei quali è il Canale dei Navicelli.
Il territorio dove lo Scolmatore scorre presenta altimetrie corrispondenti al livello del mare e questo è fonte di alcuni problemi: in concomitanza delle aperture delle paratoie che regolano l’incile di Pontedera anche per portate inferiori a quelle di progetto (fatto che si è verificato in seguito alle alluvioni dei primi anni novanta) tutto il reticolo minore va in crisi per impossibilità di deflusso.
Un altro aspetto critico è legato alle arginature del canale, impostate su terreni limo-argillosi, che nel tempo hanno manifestato problemi di subsidenza (Autorità di bacino dell’Arno, 2002).
Figura 2.4. Lo Scolmatore in prossimità della foce
2.2 PRELIEVO E TRATTAMENTO DEGLI ORGANISMI
Parti di sedimento fluviale sono state asportate dall’alveo per una profondità di circa 30-40 cm con una pala; sono state quindi frammentate sul posto per il prelievo degli individui di Hediste diversicolor non maturi.
Dopo il trasporto in laboratorio gli organismi sono stati sottoposti ad una fase di spurgo dalla durata di tre giorni in un recipiente con sabbia quarzifera sommersa in acqua per liberare l’intestino degli animali dal materiale in esso presente. Durante questo periodo gli organismi vengono, anche, acclimatati alle condizioni del test.
La salinità viene portata gradualmente al 36‰-38‰ con l’aggiunta di acqua di mare filtrata, il recipiente contenente gli organismi viene mantenuto in stanza termostata alla temperatura di 16-18 gradi, sotto illuminazione continua ed areato con flusso costante. La concentrazione di ossigeno disciolto nell’acqua soprastante al sedimento viene mantenuta a valori maggiori del 60%.
2.3 ALLESTIMENTO DEL TEST DI BIOACCUMULO
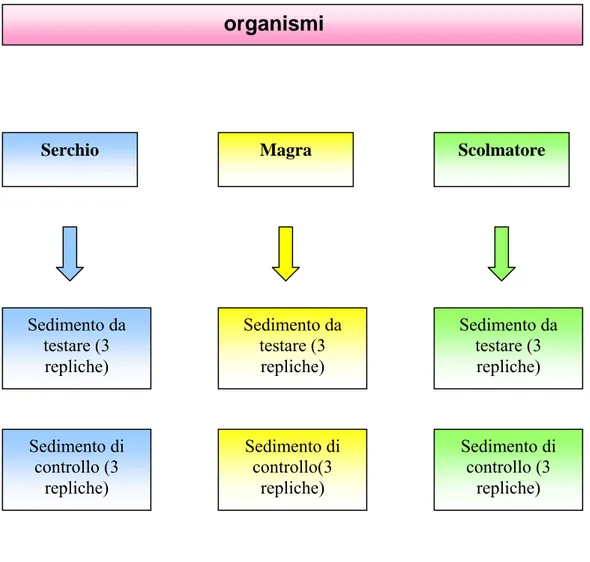
Il test di bioaccumulo è stato allestito in base alle metodologie proposte daDillon (Dillon et al. 1993) ed ha una durata di 28 giorni.
Sono state effettuate tre repliche in becker di vetro da un litro sia per il sedimento da testare che per quello di controllo per ogni gruppo di organismi di diversa origine.
organismi
Serchio Magra Scolmatore
Sedimento da testare (3 repliche) Sedimento da testare (3 repliche) Sedimento da testare (3 repliche) Sedimento di controllo (3 repliche) Sedimento di controllo(3 repliche) Sedimento di controllo (3 repliche)
In ogni becker sono stati introdotti circa 300 cc. di sedimento e 750 cc. di acqua naturale di mare filtrata. I recipienti così preparati vengono messi in camera condizionata ed areati in continuo. Dopo un giorno i becker sono stati tolti dalla stanza condizionata e sono stati misurati i parametri iniziali (pH, ione ammonio, salinità, ossigeno disciolto, temperatura). Gli organismi precedentemente spurgati dalla sabbia quarzifera sono stati recuperati con un setaccio da 1000 μm e cinque di essi sono stati messi in ogni becker. Circa dieci individui spurgati sono stati congelati ed utilizzati come bianco per il calcolo delle concentrazioni al tempo zero.
I becker con gli organismi sono stati coperti con un vetrino e sono stati posti in stanza condizionata per un periodo di 28 giorni alla temperatura di 16-18 gradi ed areati in continuo (fig.2.7). Per tutta la durata del test è stata controllata periodicamente la salinità all’interno dei becker la quale è stata mantenuta al 36‰ -38‰.
Una volta terminato il test sono stati registrati i parametri finali (pH, salinità, temperatura, ossigeno disciolto, ione ammonio) e sono stati recuperati gli organismi con il setaccio da 1000 μm conteggiando quelli morti.
I sopravvissuti sono stati introdotti in becker contenenti 300cc. di sabbia quarzifera e 750 cc. di acqua di mare filtrata e sono stati messi in stanza condizionata alla temperatura di 16-18 gradi ed areati in continuo per altri tre giorni.
Terminata quest’ultima fase di spurgo gli individui di Hediste diversicolor sono stati recuperati con il setaccio da 1000 μm e lavati per un’ora circa in acqua distillata per liberarli da eventuali residui di muco e sabbia, quindi sono stati introdotti in provette di tipo Falcon e congelati.
2.5 ANALISI CHIMICHE
Ogni campione di sedimento (circa 0,4 g p.s.) è stato mineralizzato in forno a microonde, con aggiunta di HNO3 e HCl, mentre gli organismi (circa 0,4 g p.s. per
campione) sono stati mineralizzati con aggiunta di HNO3 e H2O2. La determinazione
analitica è stata effettuata con ICP e per alcuni metalli con Spettrofotometro di Assorbimento Atomico (AAS) con fornetto di grafite, eseguendo due misure per ogni campione. La determinazione dell'Hg totale è stata eseguita secondo la metodica dei vapori freddi (CVAAS) mediante riduzione conSnCl2.
CADMIO
Metodo: EPA 6020
Il campione è analizzato mediante spettrometria ICP-MS
Miscela Standard: Custom Inorganic misture 100 ppm (Ultra Scientific Analytical Solutions).
Limite di rilevabilità strumentale: 0,075 µg/l Limite di quantificazione: 0,0029 µg/Kg ss Recupero = 92%
CROMO
Metodo: EPA 6010B
Il campione è analizzato mediante spettrometria ICP-AES
Miscela Standard: Custom Inorganic misture 100 ppm (Ultra Scientific Analytical Solutions).
Limite di quantificazione: 0,512 mg/Kg ss Recupero = 94%
MERCURIO
Metodo: EPA 6010B
Il campione è analizzato mediante spettrometria ICP-AES con sistema idruri.
Miscela Standard: Custom Inorganic misture 1000 ppm (Ultra Scientific Analytical Solutions).
Limite di rilevabilità strumentale: 0,25 µg/l Limite di quantificazione: 0,0369 mg/Kg ss Recupero = 98%
NICHEL
Metodo: EPA 6010B
Il campione è analizzato mediante spettrometria ICP-AES
Miscela Standard: Custom Inorganic misture 100 ppm (Ultra Scientific Analytical Solutions).
Limite di rilevabilità strumentale: 12,9 µg/l Limite di quantificazione: 0,5907 mg/Kg ss Recupero = 114%
PIOMBO
Metodo: EPA 6010B
Il campione è analizzato mediante spettrometria ICP-AES
Limite di rilevabilità strumentale: 50 µg/l Limite di quantificazione: 4,0 mg/Kg ss Recupero = 102%
RAME
Metodo: EPA 6010B
Il campione è analizzato mediante spettrometria ICP-AES
Miscela Standard: Custom Inorganic misture 100 ppm (Ultra Scientific Analytical Solutions).
Limite di rilevabilità strumentale: 5 µg/l Limite di quantificazione: 0,2951 mg/Kg ss Recupero = 97%
VANADIO
Metodo: EPA 6010B
Il campione è analizzato mediante spettrometria ICP-AES
Miscela Standard: Custom Inorganic misture 100 ppm (Ultra Scientific Analytical Solutions).
Limite di rilevabilità strumentale: 27 µg/l Limite di quantificazione: 1,5812 mg/Kg ss Recupero = 89%
ZINCO
Metodo: EPA 6010B
Miscela Standard: Custom Inorganic misture 100 ppm (Ultra Scientific Analytical Solutions).
Limite di rilevabilità strumentale: 22,7 µg/l Limite di quantificazione: 13,932 mg/Kg ss Recupero = 109
2.6 ANALISI GRANULOMETRICA DEI SEDIMENTI
L’analisi granulometrica è stata condotta prendendo in considerazione le tre principali frazioni: sabbia, ghiaia e frazione minore di 63μm. Aliquote di circa 70 g dei due tipi di sedimento, sono stati trattati per due giorni con una soluzione di perossido di idrogeno ed acqua distillata in rapporto 2:8 a temperatura ambiente per facilitare la separazione dei granuli. Ciascuna delle due aliquote è stata successivamente setacciata in umido su maglia d’acciaio da 63 μm. La fase acquosa contenente la frazione minore di 63μm è stata lasciata decantare per due giorni ed in seguito raccolta su un filtro di carta. Le due frazioni ottenute sono state poi essiccate in stufa a 60 gradi e la porzione maggiore di 63 μm, costituita da sabbia e ghiaia, è stata passata attraverso una batteria di setacci da –1 a 4 phi (phi =-log2 del diametro in mm) (fig.2.10). Le frazioni di sedimento corrispondenti
a ciascun intervallo sono state pesate e ne sono state calcolate le percentuali.
C
apitolo
T
re
3.1 Parametri del test di bioaccumulo
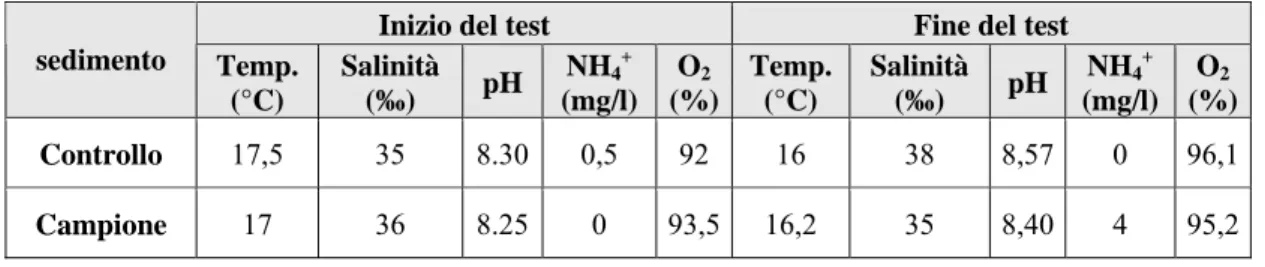
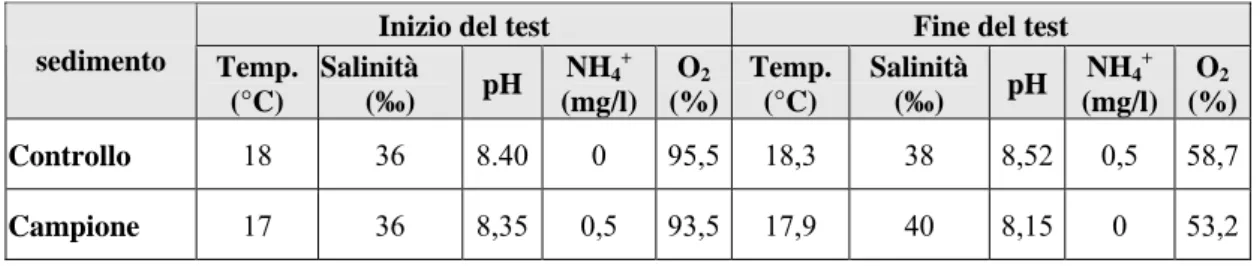
Nelle tabelle sottostanti sono riportati i parametri iniziali e finali rilevati nel test di bioaccumulo con gli organismi di Hediste diversicolor (pH, NH4+
,
ossigeno disciolto,salinità, temperatura). La figura 3.1 riporta i valori di salinità misurati nei siti di prelievo.
Tabella 3.1. Parametri iniziali e finali del test di bioaccumulo con gli organismi del Magra
Inizio del test Fine del test
sedimento Temp. (°C) Salinità (‰) pH NH4+ (mg/l) O2 (%) Temp. (°C) Salinità (‰) pH NH4+ (mg/l) O2 (%) Controllo 17 36 8,35 0,5 93 16,2 35 8,40 4 95,2 Campione 17 36 8,27 0 93 16 38 8,57 0 96,1
Tabella 3.2. Parametri iniziali e finali del test di bioaccumulo con gli organismi del Serchio
Inizio del test Fine del test
sedimento Temp. (°C) Salinità (‰) pH NH4+ (mg/l) O2 (%) Temp. (°C) Salinità (‰) pH NH4+ (mg/l) O2 (%) Controllo 17,5 35 8.30 0,5 92 16 38 8,57 0 96,1 Campione 17 36 8.25 0 93,5 16,2 35 8,40 4 95,2
Tabella 3.3. Parametri iniziali e finali del test di bioaccumulo con gli organismi dello Scolmatore
Inizio del test Fine del test
sedimento Temp. (°C) Salinità (‰) pH NH4+ (mg/l) O2 (%) Temp. (°C) Salinità (‰) pH NH4+ (mg/l) O2 (%) Controllo 18 36 8.40 0 95,5 18,3 38 8,52 0,5 58,7 Campione 17 36 8,35 0,5 93,5 17,9 40 8,15 0 53,2
Dalla figura 3.1 si può osservare che i siti di campionamento degli organismi presentavano valori diversi di salinità. I valori più elevati sono stati registrati per lo Scolmatore. 0 5 10 15 Salintà ‰ Siti di prelievo Magra Serchio Scolmatore
3.2 Granulometria dei sedimenti
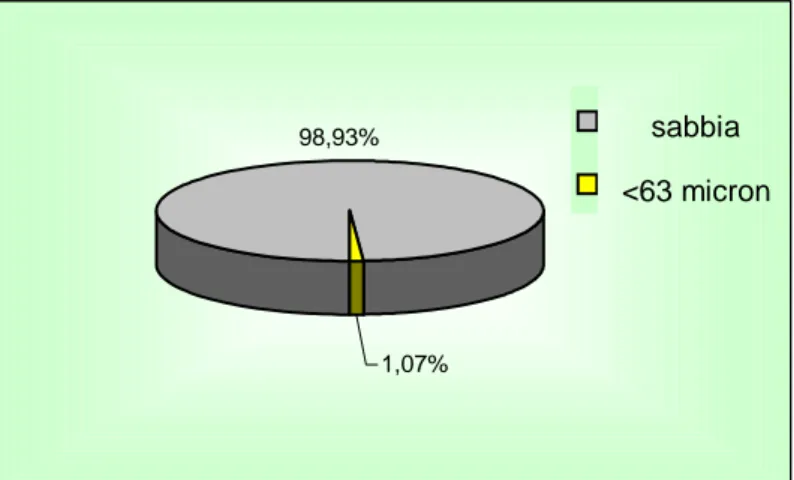
Le figure 3.2 e 3.3 rappresentano le composizioni granulometriche del sedimento denominato campione e del sedimento di controllo espresse nelle loro singole frazioni. Si osserva che i due tipi di sedimento sono caratterizzati da una frazione sabbiosa abbastanza simile, tuttavia nel sedimento campione è presente una piccola percentuale di ghiaia ed una quantità leggermente superiore della frazione minore di 63μm.
Il sedimento utilizzato come controllo proviene dal torrente Bruna ed è stato setacciato a 500 μm. Il sedimento su cui sono stati effettuati i test di bioaccumulo con gli organismi provenienti dai tre diversi siti (denominato campione) è stato prelevato da un canale di scarico industriale ed è stato impiegato nelle prove tal quale.
94,31%
3,26% 2,42%
ghiaia sabbia
<63
98,93%
1,07%
sabbia <63 micron
3.3 Concentrazioni di metalli nei sedimenti e negli organismi
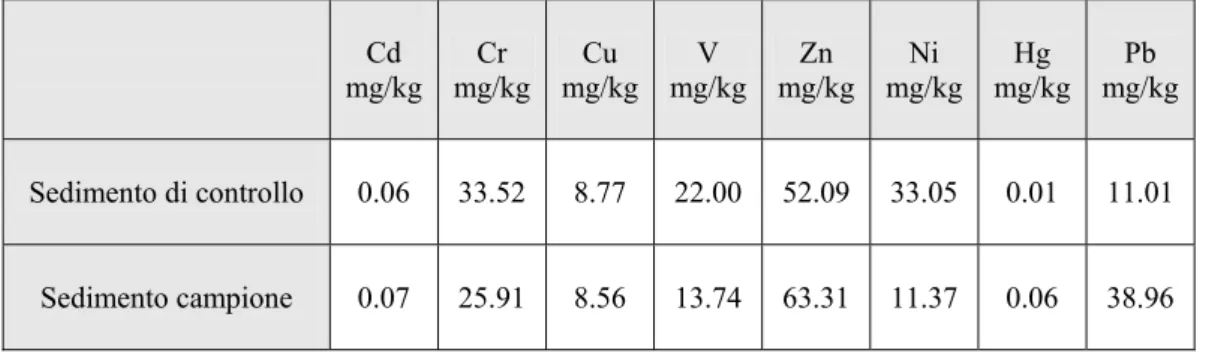
La tabella seguente riporta le concentrazioni di metalli pesanti (mg/kg) nei sedimenti utilizzati nel test di bioaccumulo.
Tabella 3.4. Concentrazioni di metalli (mg/kg) rilevate nei sedimenti di controllo e nel
campione
Cd
mg/kg mg/kg Cr mg/kgCu mg/kgV mg/kgZn mg/kg Ni mg/kg Hg mg/kg Pb Sedimento di controllo 0.06 33.52 8.77 22.00 52.09 33.05 0.01 11.01 Sedimento campione 0.07 25.91 8.56 13.74 63.31 11.37 0.06 38.96
Le tabelle sottostanti, riportano le concentrazioni dei metalli pesanti (mg/kg) rilevate nei tessuti degli individui di Hediste diversicolor provenienti dai tre diversi siti di prelievo (tabelle 3.5, 3.6 e 3.7) Gli organismi utilizzati nel test provengono da estuari che presentano un certo grado di contaminazione da metalli. Vengono riportate le concentrazioni dei metalli misurate nei tessuti degli organismi prima e dopo l’esposizione al sedimento di controllo e al campione. Le differenze osservate nell’accumulo dei metalli negli organismi di diversa provenienza, sono state trasformate in valori percentuali secondo la seguente relazione:
Ce – (Cb/ Ce) x 100 Ce : Concentrazione dopo l’esposizione Cb : Concentrazione del bianco
In seguito le percentuali calcolate sono state confrontate ed è stata considerata come significativa una differenza pari o superiore al 20%.
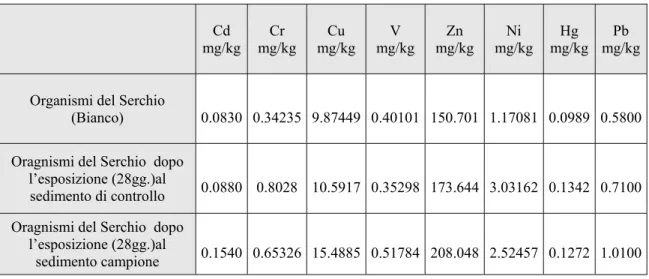
Tabella 3.5. Concentrazioni di metalli (mg/kg) rilevate nei tessuti degli organismi del Serchio al tempo
zero (bianco) e dopo 28 giorni d’esposizione al sedimento di controllo ed al sedimento denominato campione.
Cd
mg/kg mg/kg Cr mg/kg Cu mg/kg V mg/kg Zn mg/kg Ni mg/kgHg mg/kgPb Organismi del Serchio
(Bianco) 0.0830 0.34235 9.87449 0.40101 150.701 1.17081 0.0989 0.5800 Oragnismi del Serchio dopo
l’esposizione (28gg.)al
sedimento di controllo 0.0880 0.8028 10.5917 0.35298 173.644 3.03162 0.1342 0.7100 Oragnismi del Serchio dopo
l’esposizione (28gg.)al
sedimento campione 0.1540 0.65326 15.4885 0.51784 208.048 2.52457 0.1272 1.0100
Tabella 3.6. Concentrazioni di metalli (mg/kg)rilevate nei tessuti degli organismi dello Scolmatore al
tempo zero (bianco) e dopo 28 giorni d’esposizione al sedimento di controllo ed al sedimento denominato campione.
Cd
mg/kg mg/kg Cr mg/kg Cu mg/kg V mg/kg Zn mg/kg Ni mg/kgHg mg/kgPb Organismi dello Scolmatore
(Bianco) 0.5500 0.47100 9.37810 0.60074 147.452 2.34272 0.1202 0.3600 Oragnismi dello Scolmatore
dopo l’esposizione (28gg.)al
sedimento di controllo 0.0290 0.29755 6.39837 0.47324 103.069 1.81633 0.0759 0.2200 Oragnismi dello Scolmatore
dopo l’esposizione (28gg.)al
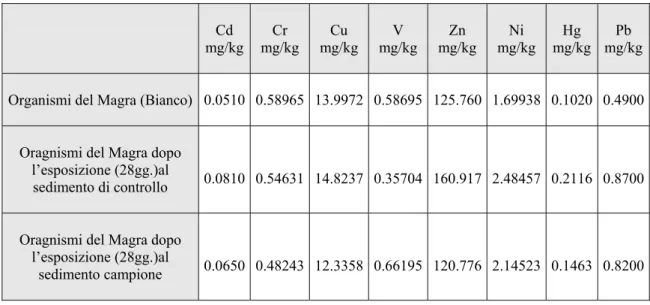
Tabella 3.7. Concentrazioni di metalli (mg/kg)rilevate nei tessuti degli organismi del Magra al tempo zero
(bianco) e dopo 28 giorni d’esposizione al sedimento di controllo ed al sedimento denominato campione.
Cd
mg/kg mg/kg Cr mg/kg Cu mg/kg V mg/kg Zn mg/kg Ni mg/kgHg mg/kgPb Organismi del Magra (Bianco) 0.0510 0.58965 13.9972 0.58695 125.760 1.69938 0.1020 0.4900
Oragnismi del Magra dopo l’esposizione (28gg.)al
sedimento di controllo 0.0810 0.54631 14.8237 0.35704 160.917 2.48457 0.2116 0.8700 Oragnismi del Magra dopo
l’esposizione (28gg.)al
3.4 Bioaccumulo di cadmio
In figura 3.4 vengono riportate le concentrazioni di Cd nei tessuti degli individui di Hediste diversicolor prima (bianco) e dopo la loro esposizione per 28 giorni al sedimenti di controllo e campione. Cd 0 0,05 0,1 0,15 0,2
bianco controllo campione
Serchio Magra Scolmatore
mg/kg
Organismi
Figura 3.4. Concentrazioni di cadmio (mg/kg) rilevate nei tessuti degli organismi prima e dopo la loro
esposizione per 28 giorni ai sedimenti testati.
La concentrazione di cadmio al tempo zero (bianco) è maggiore negli individui provenienti dal Serchio. Dopo l’esposizione per 28 giorni al sedimento di controllo, si osservano concentrazioni abbastanza simili nei tessuti degli organismi del Serchio e in quelli del Magra. Nel sedimento denominato campione, gli individui originari del Serchio mostrano una concentrazione del metallo nei loro tessuti abbastanza superiore agli organismi provenienti dal Magra e dallo Scolmatore.
La tabella 3.8 riporta le differenze delle concentrazioni di cadmio nei tessuti degli organismi espresse in termini percentuali.
Tabella 3.8. Differenze percentuali tra le concentrazioni di cadmio rilevate nei tessuti degli organismi di
diversa origine prima (bianco) e dopo la loro esposizione ai sedimenti testati.
Organismi Bianco Sedimento dicontrollo Sedimentocampione
Serchio-Magra 37.46% 7.95% 57.79%
Serchio-Scolmatore 33.73% 67.94% 63.63%
Magra-Scolmatore 7% 64.19% 13.84%
La figura 3.5 riporta le percentuali del metallo effettivamente accumulate nei tessuti degli organismi. Cd 5,86 % 46,1% 39,92 % 20,15% 0 1,78% 0 5 10 15 20 25 30 35 40 45 50 controllo campione sedimento % di bioaccum ulo
Serchio Magra Scolmatore organismi
Figura 3.5. Confronto tra le concentrazioni (%) di cadmio effettivamente accumulato dagli organismi di
origine diversa.
Non si presentano differenze significative (7%) tra i livelli di cadmio nei tessuti degli organismi originari del Magra e dello Scolmatore, mentre la concentrazione del metallo
rilevata negli individui del Serchio è risultata significativamente superiore se paragonata ai livelli di cadmio individuati negli organismi del Magra (+37,46%) e dello Scolmatore (+33,73%).
Dopo l’esposizione al sedimento di controllo per 28 giorni si nota un accumulo di cadmio non significativo da parte degli organismi del Serchio (+5,86%) mentre per gli individui provenienti dal Magra il livello del metallo risulta amplificato significativamente (+37,46%). Nel sedimento di controllo si registra una differenza significativa tra le concentrazioni nei tessuti degli individui provenienti dal Serchio e dal Magra in confronto a quelli originari dello Scolmatore (+67,94% e +64,19% rispettivamente).
Nel campione la biodisponibilità del cadmio è risultata significativamente positiva per gli organismi del Serchio (+46,10%) e del Magra (+21,53%). Negli individui provenienti dallo Scolmatore l’accumulo di cadmio non risulta significativo (+1,78%).
Una differenza significativa pari a 57,79% si osserva nelle concentrazioni di cadmio rilevate nei tessuti degli organismi originari del Serchio e del Magra mentre tra gli organismi del Serchio e dello Scolmatore questa è risultata del 63,63%.
3.5 Bioaccumulo di nichel
In figura 3.6 vengono riportate le concentrazioni di Ni nei tessuti degli individui di Hediste diversicolor prima (bianco) e dopo la loro esposizione per 28 giorni al sedimenti di controllo e campione. 0 0,5 1 1,5 2 2,5 3 3,5
bianco controllo campione
Serchio Magra Scolmatore Ni mg/kg Organismi
Figura 3.6. Concentrazioni di nichel (mg/kg) rilevate nei tessuti degli organismi prima e dopo la loro
esposizione per 28 giorni ai sedimenti testati.
La concentrazione di nichel (bianco) nei tessuti degli organismi dello Scolmatore è più alta rispetto a quella presente negli individui del Serchio e del Magra.
Nel sedimento di controllo, si nota che i tessuti degli individui del Serchio e del Magra hanno accresciuto la concentrazione del metallo nei loro tessuti.
Nel campione la quantità di nichel presente nei tessuti degli animali originari del Magra e del Serchio è aumentata, anche se in misura minore rispetto a quanto avvenuto nel
La tabella 3.9 riporta le differenze delle concentrazioni di nichel nei tessuti degli organismi espresse in termini percentuali.
Tabella 3.9. Differenze percentuali tra le concentrazioni di nichel rilevate nei tessuti degli organismi di
diversa origine prima (bianco) e dopo la loro esposizione ai sedimenti testati.
Organismi Bianco Sedimento dicontrollo Sedimentocampione
Serchio-Magra 31.10% 18.04% 15.02%
Serchio-Scolmatore 50.02% 40.08% 28.77%
Magra-Scolmatore 27.40% 26.89% 16.1%
La figura 3.7 riporta le percentuali del metallo effettivamente accumulate nei tessuti degli organismi. Ni 61,38 % 53,62% 31,6% 20,78% 0 0 0 10 20 30 40 50 60 70 controllo campione sedimento % d i bi oa cc um ul o
Serchio Magra Scolmatore organismi
Figura 3.7. Confronto tra le concentrazioni (%) di nichel effettivamente accumulato dagli organismi di
La concentrazione iniziale (bianco) di nichel nei tessuti degli organismi dello Scolmatore risulta significativamente differente dalle concentrazioni di questo metallo presenti negli organismi provenienti dal Magra (27,40%) e dal Serchio (50,02%). La quantità di nichel presente nei tessuti degli organismi del Magra risulta più alta (27,40%) rispetto a quella rilevata negli organismi del Serchio.
Nel sedimento di controllo si nota un accumulo significativo del metallo negli organismi del Serchio (+61,38%) e quelli del Magra (+31,6%) al contrario degli individui dello Scolmatore nel quale non si verifica. Le concentrazioni di nichel nei tessuti degli organismi esposti al sedimento di controllo risultano differenti in modo significativo per gli organismi del Serchio e dello Scolmatore (40,08%) e del Magra e dello Scolmatore (26,89%).
Una situazione analoga si verifica anche nel sedimento del campione dove si osserva un accumulo significativo del metallo negli organismi del Serchio (+53,62%) negli organismi del Magra (+20,78%).
La differenza significativa (28,77%)nelle concentrazioni del metallo rilevata negli individui di differente provenienza ed esposti al sedimento campione si osserva soltanto tra gli organismi del Serchio e dello Scolmatore.
3.6 Bioaccumulo di mercurio
In figura 3.8 vengono riportate le concentrazioni di Hg nei tessuti degli individui di Hediste diversicolor prima (bianco) e dopo la loro esposizione per 28 giorni ai sedimenti di controllo e campione. Hg 0 0,05 0,1 0,15 0,2 0,25
bianco controllo campione
Serchio Magra Scolmatore
mg/kg
Organismi
Figura 3.8. Concentrazioni di mercurio (mg/kg) rilevate nei tessuti degli organismi prima e dopo la loro
esposizione per 28 giorni ai sedimenti testati.
Le concentrazioni di mercurio (bianco) nei tessuti degli organismi provenienti dai tre siti di prelievo sono molto simili tra di loro.
L’esposizione per 28 giorni al sedimento di controllo ha determinato un’aumento delle concentrazioni del metallo nei tessuti degli individui del Serchio e del Magra.
Nel campione si osserva che nei tessuti degli individui del Serchio e del Magra è avvenuto un aumento della concentrazione di mercurio, anche se in misura minore rispetto al sedimento di controllo.
La tabella 3.10 riporta le differenze delle concentrazioni di nichel nei tessuti degli organismi espresse in termini percentuali.
Tabella 3.10. Differenze percentuali tra le concentrazioni di mercurio rilevate nei tessuti degli organismi
di diversa origine prima (bianco) e dopo la loro esposizione ai sedimenti testati.
Organismi Bianco Sedimento dicontrollo Sedimentocampione
Serchio-Magra 3.03% 36.57% 13.05%
Serchio-Scolmatore 17.7% 43.44% 20.44%
Magra-Scolmatore 15.14% 64.13% 30.82%
La figura 3.9 riporta le percentuali del metallo effettivamente accumulate nei tessuti degli organismi. Hg 26,3 % 22,24% 51,79% 30,28% 0 0 0 10 20 30 40 50 60 controllo campione sedimento % di bi oaccumul o
Serchio Magra Scolmatore organismi
I livelli di mercurio presenti nei tessuti degli organismi (bianco) provenienti dai tre siti diversi non presentano tra di loro le differenze significative (Serchio-Scolmatore 17,7% Serchio-Magra 3,03% Scolmatore-Magra 15,14%)
Nel sedimento di controllo è stato rilevato un accumulo significativo del metallo da parte degli organismi del Serchio (+26,3%) e del Magra (+51,79%) mentre nei tessuti degli individui dello Scolmatore le concentrazioni di mercurio risultano diminuite. Le concentrazioni del metallo rilevate negli organismi esposti al sedimento di controllo mostrano differenze significative in tutti e tre i casi. (Magra 36,57% Serchio-Scolmatore 43,44% Magra-Serchio-Scolmatore 64,13%).
Nel sedimento nominato campione si nota un incremento significativo del mercurio nei tessuti degli organismi del Serchio (+22,24%) e del Magra (+30,28%) mentre negli individui provenienti dallo Scolmatore non è avvenuto alcun accumulo di questo metallo.
Nell’ambito del sedimento campione si registrano differenze significative tra gli individui del Magra e del Serchio pari a 30,82 % agli organismi originari dallo Scolmatore equivalente a 20,44%.
3.7 Bioaccumulo di piombo
In figura 3.10 vengono riportate le concentrazioni di Pb nei tessuti degli individui di Hediste diversicolor prima (bianco) e dopo la loro esposizione per 28 giorni ai sedimenti di controllo e campione. Pb 0 0,2 0,4 0,6 0,8 1 1,2
bianco controllo campione
Serchio Magra Scolmatore
mg/kg
Organismi
Figura 3.10. Concentrazioni di piombo (mg/kg) rilevate nei tessuti degli organismi prima e dopo la loro
esposizione per 28 giorni ai sedimenti testati.
Le concentrazioni di piombo nei tessuti degli organismi (bianco) del Serchio e del Magra sono piuttosto simili tra loro e sono maggiori di quelle presenti negli individui dello Scolmatore.
Nel sedimento di controllo, si osserva che, gli individui provenienti dal Serchio e dal Magra hanno incrementato la concentrazione del metallo nei loro tessuti.
L’esposizione per 28 giorni al sedimento denominato campione ha comportato l’ aumento delle concentrazioni di piombo nei tessuti di tutti gli organismi.
La tabella 3.11 riporta le differenze delle concentrazioni di piombo nei tessuti degli organismi espresse in termini percentuali.
Tabella 3.11. Differenze percentuali tra le concentrazioni di piombo rilevate nei tessuti degli organismi di
diversa origine prima (bianco) e dopo la loro esposizione ai sedimenti testati.
Organismi Bianco Sedimento dicontrollo Sedimentocampione
Serchio-Magra 15.51% 18.3% 18.81%
Serchio-Scolmatore 37.93% 69.01% 25.74%
Magra-Scolmatore 26.5% 74.71% 8.53%
La figura 3.11 riporta le percentuali di piombo effettivamente accumulate nei tessuti degli organismi. Pb 18,3% 42,52% 43,67% 40,24% 0 52% 0 10 20 30 40 50 60 controllo campione sedimento % d i bi oa cc um ul o
Serchio Magra Scolmatore organismi
Figura 3.11. Confronto tra le concentrazioni (%) di piombo effettivamente accumulato dagli organismi di
La concentrazione di piombo (bianco) nei tessuti degli organismi di Magra e Serchio risulta simile (differenza del 15,51%). Le differenze significative nelle concentrazioni del metallo nei tessuti degli organismi si osservano tra gli individui dello Scolmatore e quelli del Magra (26,5%) e tra gli organismi dello Scolmatore e del Serchio (37,93%). Nel sedimento di controllo si verifica un accumulo significativo negli organismi originari del Magra in quanto si osserva un aumento del 43,67% .Negli organismi del Serchio non si rileva accumulo mentre negli tessuti degli organismi dello Scolmatore si verifica una diminuzione nella concentrazione di questo metallo. Nell’ambito del sedimento di controllo si notano differenze significative (69,01%) nelle concentrazioni di piombo tra gli organismi del Serchio e dello Scolmatore e tra gli organismi di Magra e Scolmatore (74,71%).
L’accumulo del metallo nei tessuti degli organismi esposti al sedimento di campione, è risultato significativo per gli organismi provenienti dal Serchio (+42,57%) dal Magra (+40,24%) e dallo Scolmatore (+52%) e si può notare una differenza significativa nella concentrazione di piombo rilevata negli tessuti degli individui provenienti del Serchio e dello Scolmatore (25,74%).
3.8 Bioaccumulo di rame
In figura 3.12 sono riportate le concentrazioni di Cu nei tessuti degli individui di Hediste diversicolor prima (bianco) e dopo la loro esposizione per 28 giorni ai sedimenti di controllo e campione. Cu 0 5 10 15 20 Serchio Magra Scolmatore
bianco controllo campione
Organismi
mg/kg
Figura 3.12. Concentrazioni di rame (mg/kg) rilevate nei tessuti degli organismi prima e dopo la loro
esposizione per 28 giorni ai sedimenti testati.
La concentrazione di rame nei tessuti degli organismi (bianco) del Magra è maggiore rispetto a quella presente nei tessuti degli organismi del Serchio e dello Scolmatore. Nel sedimento di controllo si è verificato un minimo accumulo del metallo nei tessuti degli individui del Serchio e del Magra.
L’esposizione per 28 giorni al sedimento campione ha determinato l’aumento della concentrazione di rame soltanto nei tessuti degli organismi provenienti dal Magra. La tabella 3.12 riporta le differenze delle concentrazioni di piombo nei tessuti degli organismi espresse in termini percentuali.
Tabella 3.12. Differenze percentuali tra le concentrazioni di rame rilevate nei tessuti degli organismi di
diversa origine prima (bianco) e dopo la loro esposizione ai sedimenti testati.
Organismi Bianco Sedimento dicontrollo Sedimentocampione
Serchio-Magra 29.4% 24.32% 20.35%
Serchio-Scolmatore 6.03% 39.59% 43.98%
Magra-Scolmatore 33.71% 56.8% 29.66%
La figura 3.13 riporta le percentuali del metallo effettivamente accumulate nei tessuti degli organismi. Cu 6,77% 36,24% 5,57% 0 0 5 10 15 20 25 30 35 40 controllo campione sedimento % d i bi oa cc um ul o
Serchio Magra Scolmatore organismi
Figura 3.13. Confronto tra le concentrazioni (%) di rame effettivamente accumulato dagli organismi di
origine diversa.
La concentrazione di rame nei tessuti (bianco) degli organismi del Magra risulta significativamente più elevata dalla concentrazione di questo metallo rilevata nei tessuti
Nel sedimento di controllo l’accumulo di rame è trascurabile riguardo gli organismi del Serchio(+6,77%) e del Magra (+5,57%) mentre negli organismi originari dello Scolmatore si nota una diminuzione nella concentrazione di questo metallo. Le concentrazioni di rame rilevate nei tessuti degli organismi esposti al sedimento di controllo presentano differenze significative tra gli organismi di origine diversa.
Un’ accumulo significativo di rame nel sedimento campione si osserva soltanto negli organismi del Serchio (+36,24%) mentre i livelli di rame rilevate nei tessuti degli organismi degli organismi del Magra e dello Scolmatore mostrano una lieve diminuzione. Nei tessuti degli organismi esposti al sedimento campione si osservano differenze significative nelle concentrazioni del metallo tra gli organismi del Serchio e del Magra pari (20,35%), tra gli organismi del Serchio e dello Scolmatore (43,98%) e tra gli organismi del Magra e dello Scolmatore ( 29,66%).
3.9 Bioaccumulo di cromo
In figura 3.14 sono riportate le concentrazioni di Cr nei tessuti degli individui di Hediste diversicolor prima (bianco) e dopo la loro esposizione per 28 giorni ai sedimenti di controllo e campione. Cr 0 0,2 0,4 0,6 0,8 1 Serchio Magra Scolmatore
bianco controllo campione
mg/kg
Organismi
Figura 3.14. Concentrazioni di cromo (mg/kg) rilevate nei tessuti degli organismi prima e dopo la loro
esposizione per 28 giorni ai sedimenti testati.
Le concentrazioni di cromo (bianco) più elevate si riscontrano nei tessuti degli individui provenienti dal Magra. L’esposizione per 28 giorni al sedimento di controllo ha determinato l’incremento della concentrazione del metallo solo nei tessuti degli organismi originari del Serchio. Lo stesso fenomeno si è verificato anche nel campione, sebbene l’aumento della concentrazione di cromo negli individui provenienti dal Serchio sia minore rispetto a quello avvenuto nel controllo. La tabella 3.13 riporta le differenze delle concentrazioni di cromo nei tessuti degli organismi espresse in termini percentuali.
Tabella 3.13. Differenze percentuali tra le concentrazioni di cromo rilevate nei tessuti degli organismi di
diversa origine prima (bianco) e dopo la loro esposizione ai sedimenti testati.
Organismi Bianco Sedimento dicontrollo Sedimentocampione
Serchio-Magra 41.94% 31.94% 26.15%
Serchio-Scolmatore 27.31% 62.13% 47.99%
Magra-Scolmatore 20.12% 45.53% 29.58%
In figura 3.15 sono riportate le percentuali di cromo effettivamente accumulate nei tessuti degli organismi.
Cr 57,35 % 47,59% 0 0 0 10 20 30 40 50 60 70 controllo campione sedimento % d i bi oaccu mul o
Serchio Magra Scolmatore organismi
Figura 3.15. Confronto tra le concentrazioni (%) di cromo effettivamente accumulato dagli organismi di
origine diversa.
La concentrazione di cromo rilevata nei tessuti (bianco) degli organismi del Magra risulta significativamente superiore alla concentrazione di questo metallo rilevata negli organismi del Serchio (+41,94%) e dello Scolmatore (+20,12%).La concentrazione del