1
Università degli Studi di Pisa Facoltà di Medicina e Chirurgia
Scuola di Specializzazione in Anatomia Patologica
TESI di SPECIALIZZAZIONE
Espressione di AKT nei meningiomi aggressivi
Candidato Relatore
Dr.ssa Elisa Castelluccio Prof.ssa Maura Castagna
Direttore della Scuola di Specializzazione Prof.ssa Gabriella Fontanini
2
INDICE
1. RIASSUNTO ………..…… 5
2. INTRODUZIONE ………..…… 6
2.1 Origine dei meningiomi ………..……… 6
2.2 Epidemiologia e eziologia ………. 7
2.3 Caratteristiche cliniche ……….12
2.4 Cenni di imaging ……… 13
2.5 Aspetto macroscopico ……….……….15
2.6 Classificazione istologica………..…….. 16
2.6 a Meningiomi WHO grado I ………..…….17
2.6 b Meningiomi WHO grado II ………... 21
2.6 c Meningiomi WHO grado III ………24
2.6 d Difficoltà nell’attribuzione del grading ……….. 25
2.7 Patogenesi: aspetti molecolari ……….…………. 26
2.8 Terapia farmacologica ……….………….. 29
3
3. AKT E VIE DI SEGNALAZIONE CORRELATE ………..……. 31
3.1 AKT: struttura e meccanismo d’azione ……….… 31
3.2 Espressione di AKT nei tessuti normali ………... 34
3.3 La mutazione AKT1E17K nei tumori solidi ……… 36
3.4 La mutazione AKT1E17K nei meningiomi ……….. 37
3.5 Il pathway PI3K/AKT/mTOR come target terapeutico ….. 40
4. SCOPI ……… 42 5. MATERIALI E METODI ……… 43 5.1 Casistica ……… 43 5.2 Analisi immunoistochimica ……… 47 5.2 a Tecniche e strumenti ……… 47 5.2 b Anticorpi e protocolli ……….. 48 5.3 Estrazione DNA ……… 51
5.4 Ion Torrent Sequencing (ITS) ……… 52
6. RISULTATI ……….. 55
4 TABELLE ……… 60 GRAFICI ……….. 70 FOTOGRAFIE ……… 71 BIBLIOGRAFIA ………. 75 WEBGRAFIA ………. 80
5 1. RIASSUNTO
I meningiomi rappresentano il 20% dei tumori primitivi intracranici, con un’incidenza stimata di 3-4 casi su 100.000 per anno. Si classificano in benigni (WHO grado I), atipici (WHO grado II) e anaplastici (WHO grado III). Il trattamento elettivo è quello chirurgico. I tumori non completamente resecabili o recidivanti vengono sottoposti a radioterapia, ma attualmente non è disponibile nessun trattamento farmacologico risolutivo.
La serin-treonin protein chinasi AKT è fondamentale in numerosi processi cellulari, come l’uptake del glucosio, la progressione del ciclo cellulare e l’apoptosi. Ad oggi sono note tre isoforme espresse in misura variabile in tutti i tessuti umani. La mutazione AKT1(E17K), identificata in molte neoplasie, determina un’attivazione costitutiva dell’isoforma Akt1 a cui segue una trasformazione cellulare.
Dopo revisione di 363 meningiomi archiviati nel Brain Tumour Registry (Imperial College London), abbiamo selezionato ventiquattro tumori atipici, quindici mitoticamente attivi e quindici recidive. Sono stati usati come controlli dieci meningiomi sopratentoriali non recidivati dopo un follow-up di almeno dieci anni.
Lo scopo di questo lavoro è dimostrare con metodo immunoistochimico l’espressione di AKT nei meningiomi e verificare se esiste una correlazione tra grado istologico e intensità di colorazione.
I risultati potranno contribuire allo sviluppo di un trial clinico volto allo studio dell’efficacia degli inibitori di PI3K/AKT/mTOR nel trattamento dei meningiomi aggressivi.
6 2. INTRODUZIONE
I meningiomi sono tra i tumori intracranici più frequenti dell' adulto, con un'incidenza stimata di 3-4 casi su 100.000 per anno. Spesso sono benigni e non di rado vengono riscontrati incidentalmente in studi di risonanza magnetica nucleare o in sede autoptica.
2.1 Origine dei meningiomi
I meningiomi sembrano originare dalle "cap cells" che risiedono nello strato più esterno dell'aracnoide encefalica e spinale e formano i villi aracnoidei, responsabili del drenaggio liquorale nei seni durali e nelle vene.
Molte analogie citologiche e funzionali sono state identificate tra queste cellule e la loro controparte neoplastica costituita dai meningiomi.
Le cellule aracnoidee possono avere l'aspetto di fibroblasti disposti in monostrato, o raggrupparsi in nidi costituiti da più strati di cellule epiteliali. Con l'avanzare dell'età le cellule disposte in cluster aumentano di numero, fino a formare strutture vorticoidi (whorls) e corpi psammomatosi identici a quelli che si riscontrano nei meningiomi.
La duplice natura epiteliale e mesenchimale delle cellule originarie della neoplasia si manifesta anche nel meningioma.
Caratteristiche epiteliali sono una morfologia citologica rotondeggiante o poligonale, la presenza di numerose giunzioni intercellulari, funzioni secretorie simil-ghiandolari e l'espressione dell'antigene epiteliale di membrana (EMA). La presenza di cellule fusate e la produzione di uno
7
stroma collagene riflette invece l'origine mesenchimale. (Mawrin, Perry J
Neurooncology 2010; 99:379-391)
I due fenotipi morfologici sono espressi con estrema variabilità nelle numerose varianti di meningioma classificate dal WHO.
Una possibile lesione intermedia tra i nidi di cellule aracnoidee normali e il meningioma è una proliferazione di tipo reattivo a traumi, emorragie o neoplasie, definita iperplasia meningoteliale. Tipicamente non infiltra i tessuti circostanti, è multifocale e costituita da una pluristratificazione (oltre dieci strati) di cellule meningoteliali. Ad oggi tuttavia, non sembra essere una lesione preneoplastica, come confermano studi volti alla ricerca di alterazioni genetiche presenti nei meningiomi (Perry et al. Brain
Pathol 2005; 15: 109-115).
2.2 Epidemiologia e eziologia
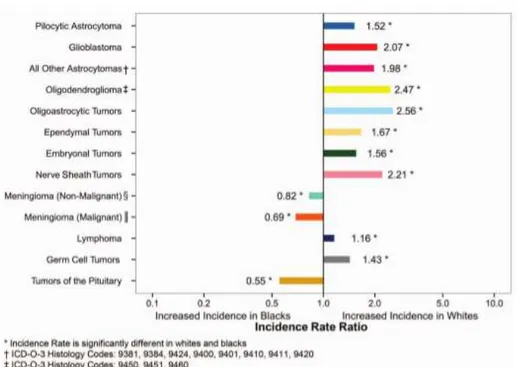
Secondo i dati del Central Brain Tumor Registry of the United States (CBTRUS 2006-2010), la prevalenza stimata dei meningiomi confermati da diagnosi istopatologica è di 97.5/100.000 con oltre 170.000 individui affetti da questo tumore (Fig 1).
8 Figura 1. Distribution of Primary Brain and CNS Tumors by Histology CBTRUS Statistical Report: NPCR and SEER, 2006-2010
I meningiomi sono più comuni negli adulti che nei bambini e l'incidenza aumenta proporzionalmente all'età, con un picco dopo i 65 anni (Fig. 2).
9 Figura 2. Incidenza dei tumori del SNC per tipo istologico e per gruppi di età
CBTRUS Statistical Report: NPCR and SEER, 2006-2010
Gli individui più colpiti appartengono alla razza nera e al genere femminile, con rapporto F:M = 2:1 (Fig. 3a e 3b).
10 Figura 3a. Incidenza dei tumori del SNC per razza
11
La sopravvivenza a 10 anni diminuisce drasticamente con l'età
(85,2% per i pazienti di età compresa tra 24 e 44 anni; 29,1% per quelli di oltre 75 anni).
Essendo un tumore frequentemente benigno, l’identificazione dei fattori di rischio non è stata così accurata come per le neoplasie maligne e attualmente esistono pochi studi epidemiologici ed eziologici condotti su larga scala.
La predisposizione genetica e l’esposizione ad alte dosi di radiazioni ionizzanti sono i due principali fattori di rischio noti, tuttavia vengono identificati in una piccola percentuale di casi.
Un ruolo ormonale è possibile vista la diversa distribuzione di genere dei meningiomi, anche se i dati disponibili a riguardo sono poco consistenti. Recenti pubblicazioni rilevano un’associazione tra terapia sostitutiva ormonale (HRT) e rischio aumentato di sviluppare un meningioma (studio caso/controllo Interphone Group), mentre risultati discordanti riguardano l’utilizzo di contraccettivi orali (studio di coorte The Million Women Study). L’associazione con gravidanza, ciclo mestruale e varianti antropometriche sono ad oggi controverse.
Il trauma cranico è stato considerato come fattore di rischio, ma questo dato è sicuramente affetto da un bias significativo. La maggiore incidenza
potrebbe essere semplicemente legata alle ripetute indagini
neuroradiologiche a cui è sottoposto un paziente traumatizzato, che evidenziano meningiomi altrimenti misconosciuti.
Il possibile rischio legato all’utilizzo del telefono cellulare è stato oggetto di almeno dieci studi, ma essendo un dispositivo a diffusione relativamente recente nei Paesi industrializzati, occorre un periodo di osservazione più lungo (almeno 20-35 anni) per ottenere risultati statisticamente significativi.
12
Nello stesso studio condotto su larga scala (Interphone study) sono stati affrontati aspetti di epidemiologia molecolare per correlare polimorfismi genetici con un aumentato rischio di meningioma.
E’ emersa un’associazione con tre varianti di BRIP1 (17q22), un gene strettamente legato a BRCA1 e coinvolto nella riparazione del DNA.
Nel gene ATM, appartenente alla famiglia delle fosfatidilinositol-3 chinasi (PI3K), sono state identificate quattro varianti coinvolte nel cancro della mammella e nei meningiomi. Tra le sue numerose funzioni, il gene ATM è uno dei più importanti modulatori dell’attivazione del gene AKT (Stagni et al. Int. J. Mol. Sci. 2014), il cui ruolo nella patogenesi dei meningiomi verrà affrontato più avanti in questa tesi.
2.3 Caratteristiche cliniche
Nei meningiomi intracranici sintomatici, la presentazione clinica dipende dalla localizzazione. Poiché la stragrande maggioranza dei casi ha un decorso indolente, di regola i sintomi sono sfumati e insorgono gradualmente. Una cefalea ricorrente di recente insorgenza e non associata a sindrome da ipertensione intracranica è un esordio comune. Meningiomi della convessità cerebrale possono manifestarsi con episodi ripetuti di crisi epilettiche parziali, mentre un cambiamento insidioso della personalità (spesso confuso con depressione o demenza) non è raro nei pazienti con grossi tumori in sede frontale inferiore. In relazione a diverse topografie anatomiche, sono state definite alcune sindromi, comuni a molti
13
tipi di lesioni focali intracraniche come gliomi, cisti, granulomi (vedi Tabella 1).
Tabella 1. Jason Rockhill et al. Neurosurg Focus 23 (4):E1, 2007
2.4 Cenni di imaging
Le tecniche di imaging più indicate per la diagnosi dei meningiomi, il monitoraggio e la valutazione dopo terapia sono la Risonanza Magnetica Nucleare e la Tomografia Computerizzata con mezzo di contrasto. La RMN è il gold standard perché riesce a definire meglio i tessuti intracranici, ma la TC è indispensabile per evidenziare calcificazioni, iperostosi e gli effetti di rimodellamento osseo della massa tumorale in lento accrescimento.
Alla RMN tipicamente un meningioma appare come una massa a stretto contatto con la dura madre, spesso con prolungamento tipo a coda di topo lungo la meninge, isointensa rispetto alla sostanza grigia e con enhancement marcato ed omogeneo dopo iniezione del mezzo di
14
contrasto. In una ristretta percentuale di casi, può avere un aspetto radiologico atipico, mimando una neoplasia gliale di alto grado o una metastasi. L’edema peritumorale può essere marcato, come nel caso del sottotipo secretorio.
In casi selezionati, ad esempio nei pazienti inoperabili, trova indicazione la RMN spettroscopica. Il picco di creatinina (circa 20%) nei meningiomi è superiore a quello del tessuto cerebrale normale, sono stati anche riportati maggiori picchi di alanina e colina. Livelli elevati di inositolo aiutano nella diagnosi differenziale con uno scwhannoma. Un picco di lattati si riscontra frequentemente (63% dei casi) nei meningiomi atipici (Buhl et al: MR spectroscopy in patients with intracranial meningiomas Neurol Res 29:43– 46, 2007).
La tomografia ad emissione di positroni (PET) non è correntemente usata per lo studio dei meningiomi, ma si rivela utile per visualizzare quelli della base cranica, difficilmente indagabili con le tecniche standard.
Dato che i meningiomi esprimono elevate densità di recettori per la somatostatina, la scintigrafia con octreotide trova applicazione soprattutto nel postoperatorio, per differenziare un residuo tumorale da una reazione cicatriziale.
15
2.5 Aspetto macroscopico
Tipicamente i meningiomi si presentano come masse a contorni lisci o lobulate, fermamente adese alle meningi, e comprimono il parenchima cerebrale, dislocandolo. In certe regioni particolari, come l’osso sfenoide, i meningiomi crescono formando placche, piuttosto che masse nodulari. L’invasone della dura madre e dei seni venosi durali è abbastanza comune. Occasionalmente si ha superamento del rivestimento durale e infiltrazione del tessuto osseo, con caratteristica reazione iperostotica ben visibile all’imaging. Possono infiltrare i tessuti sottocutanei e la cute, ed estendersi a compartimenti extrascheletrici, come l’orbita. Alcuni meningiomi hanno una consistenza più dura (sottotipo psammomatoso) o simil-gelatinosa (sottotipo secretorio).
16
2.6 Classificazione istologica
La classificazione WHO definisce tre gradi istologici ai quali corrisponde una diversa prognosi. La maggior parte dei meningiomi sono tipici (WHO grado I), crescono lentamente e vengono trattati in modo risolutivo con la sola chirurgia.
Oltre il 20% dei meningiomi sono atipici o anaplastici e si associano ad elevato rischio di recidiva ed aumentata morbidità.
Un meningioma è classificato come anaplastico (WHO III) quando evidenzia un ovvia malignità citologica o mostra eccessiva proliferazione (più di 20 mitosi per 10 HPF).
I meningiomi mostrano una grande variabilità di pattern istologici e le forme miste sono molto comuni. La classificazione corrente WHO elenca 16 differenti varianti o sottotipi, riportati in tabella.
17
Alcuni sottotipi sono di alto grado per definizione: variante a cellule chiare (WHO grado II), cordoide (WHO grado II), rabdoide (WHO grado III) e papillare (WHO grado III). Tuttavia, se in un tumore misto sono riconoscibili i patterns suddetti, rimane ancora indefinita la percentuale minima necessaria per definirne il grado.
Sarebbe buona norma attribuire il grado WHO corrispondente solo quando la variante istologica rappresenta più del 50% del tumore. Nei casi in cui la percentuale sia inferiore, la presenza di patterns particolari sarà segnalata, ma il grado del tumore corrisponderà alla componente istologica maggiormente rappresentata. In ogni caso è raccomandabile consigliare uno stretto follow up giustificato dalla maggiore aggressività delle lesioni (Perry, J Neurooncol 2010).
2.6a Meningiomi WHO grado I
Sono classificati come grado I i meningiomi che non invadono il parenchima cerebrale e non soddisfano i criteri dei meningiomi atipici o degli anaplastici (vedi tabella).
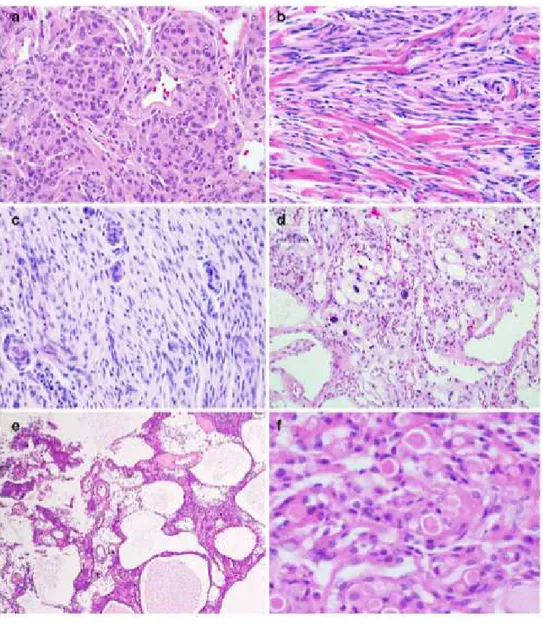
I sottotipi più frequenti sono il meningoteliale, il fibroso e il transizionale. La variante classica meningoteliale (fig. 5a) forma lobuli di varie dimensioni separati da delicati setti di tessuto collagene. Le cellule sono poligonali o epitelioidi, con nuclei ovali o rotondeggianti di taglia uniforme, con cromatina finemente dispersa e occasionale clearing intranucleare. Talvolta si evidenziano pseudoinclusi nucleari eosinofili, formati da invaginazioni del citoplasma all’interno del nucleo. Queste caratteristiche nucleari sono presenti anche quando non si evidenziano whorls o corpi psammomatosi, fornendo un ausilio nella diagnosi dei casi meno
18
paradigmatici. Può essere presente un certo grado di atipia nucleare, espressione di degenerazione piuttosto che di un comportamento biologico aggressivo.
La variante fibrosa o fibroblastica (fig. 5b) è caratterizzata da cellule tumorali con nuclei allungati, disposte in bande parallele o storiformi. La produzione di collagene è abbondante e talvolta preponderante, tanto da rendere difficile la visualizzazione di piccoli nidi cellulari sparsi in una matrice di collagene.
I meningiomi transizionali o misti (fig. 5c) hanno caratteristiche a comune sia con i meningoteliali che con i fibrosi, e tipicamente mostrano whorls e corpi psammomatosi. Quando questi ultimi sono numerosissimi, fino a sostituire quasi del tutto le cellule meningoteliali, si parla di sottotipo psammomatoso, frequentemente localizzato nella regione spinale toracica di donne anziane. I meningiomi psammomatosi esprimono le proteine
bone-related, come l’osteopontina.
La variante angiomatosa (fig. 5d) è contraddistinta da un numero di vasi che occupano più del 50% della massa tumorale. Le pareti vascolari sono marcatamente ialinizzate, con calibro e spessore variabile. E’frequente un’atipia nucleare di tipo degenerativo.
Le cellule tumorali dei meningiomi microcistici (fig. 5e) hanno processi allungati e ricordano più le cellule aracnoidali trabecolari che le cap cells. Spesso si evidenzia pleomorfismo cellulare e un pattern misto, con caratteristiche a comune con il sottotipo angiomatoso. Una ricca vascolarizzazione e edema peritumorale sono elementi di frequente riscontro, mentre le formazioni vorticoidi e i corpi psammomatosi sono rari.
I meningiomi secretori (fig. 5f) sono caratterizzati dai cosiddetti
pseudopsammoma bodies, inclusioni intracellulari eosinofile PAS
19
per altri markers epiteliali. Le strutture simil-ghiandolari spesso presenti potrebbero rappresentare foci di metaplasia epiteliale. Mast-cellule e istiociti sono molto più abbondanti rispetto agli altri sottotipi.
Due varianti rare e peculiari sono il lymphoplasmacyte-rich e il metaplastico.
Nel primo caso si osserva un intenso infiltrato flogistico accompagnato da una componente meningoteliale talvolta veramente incospicua, tanto da far pensare ad una iperplasia meningoteliale reattiva ad un processo infiammatorio cronico, piuttosto che a elementi neoplastici veri e propri. Nel meningioma metaplastico si osserva una differenziazione in senso mesenchimale con produzione di osso, tessuto adiposo, cartilagine ed elementi di tipo xantomatoso. In molti casi però viene messa in discussione un puro processo metaplastico, visto che le cellule con
morfologia mesenchimale continuano ad esprimere marcatori
meningoteliali come l’EMA.
20 Figura 5. Alcuni sottotipi di meningiomi WHO grado I (Perry, 2010)
21
2.6b Meningiomi WHO grado II
Si definisce "atipico" (WHO grado II) un meningioma: 1) di sottotipo cordoide o a cellule chiare, 2) che invade il parenchima cerebrale, 3) che mostra elevata attività mitotica (4-19 mitosi per 10 campi ad alto ingrandimento (HPF) consecutivi), 4) che presenta almeno tre delle seguenti caratteristiche istopatologiche: componente a piccole cellule, ipercellularità, nucleoli prominenti, pattern di crescita ininterrotto (sheet-like), necrosi spontanea (non indotta da embolizzazione).
Il termine “atipico” in realtà è fuorviante, poiché l’atipia citologica non è un elemento necessario per classificare un meningioma come grado II. Tumori citologicamente benigni sono definiti atipici se il numero di mitosi eccede il cut-off di 4x10HPF o se sono invasivi. Dopo la revisione della classificazione WHO dei tumori cerebrali avvenuta nel 2007, l’invasione del parenchima cerebrale è un criterio indipendente per l’attribuzione del grado II.
La definizione di quest’ultima caratteristica non è sempre agevole. Devono essere visualizzate proiezioni di tessuto neoplastico in continuità con la massa tumorale che penetrano nel parenchima cerebrale, dove spesso è presente gliosi reattiva. La colorazione GFAP può essere di aiuto nei casi dubbi.
22
Il sottotipo cordoide si trova più spesso nei grandi meningiomi sopratentoriali. Ricorda morfologicamente il cordoma, con cellule eosinofile epitelioidi disposte in cordoni o trabecole, uno stroma ricco di mucina e vacuoli chiari che assomigliano alle cellule fisalifere. I corpi psammomatosi sono rari e spesso è associato un abbondante infiltrato linfoplasmocitario.
Figura 7. Meningioma cordoide (Perry,2010)
Figura 6. Meningiomi atipici: elevata attività mitotica e invasione del
23
Il meningioma a cellule chiare è caratterizzato da cellule poligonali con citoplasma chiaro, ricco in glicogeno e marcata deposizione di collagene nell’interstizio. La localizzazione più frequente è quella spinale o nella fossa cranica posteriore, in soggetti giovani, bambini inclusi.
Figura 8. Meningioma a cellule chiare (Perry, 2010)
La caratteristica che accomuna il gruppo eterogeneo dei meningiomi di grado II è l’elevato tasso di recidiva. A differenza dei meningiomi di grado I, la diagnosi degli atipici pone spesso problemi interpretativi e la concordanza tra diversi osservatori è difficile da ottenere. La revisione WHO del 2007 ha migliorato la situazione, aumentando la riproducibilità e l’oggettività dei criteri diagnostici. L’indice proliferativo è sicuramente uno dei markers più importante, ma il range del numero di mitosi che definisce il grado II è molto ampio. Un meningioma con 4 mitosi su 10 HPF è classificato come grado II esattamente come un altro con 20 mitosi su 10 HPF, sebbene il rischio di recidiva sia evidentemente superiore nel secondo caso. Quindi è necessario integrare le attuali conoscenze con elementi aggiuntivi quali ad esempio markers molecolari, che
24
caratterizzino ulteriormente neoplasie attualmente classificate come grado II, in modo da poter definire più accuratamente una prognosi ed eventuali terapie mirate.
2.6c Meningiomi WHO grado III
I meningiomi di grado III hanno più di 20 mitosi per 10 HPF, oppure sono francamente anaplastici (fig 9a), con caratteristiche istologiche assimilabili a quelle di carcinomi, melanomi o sarcomi.
Di fronte a una neoplasia con un aspetto scarsamente differenziato, per fare diagnosi di meningioma occorre che almeno in una frazione tumorale sia riconoscibile un’istologia di tipo classico meningoteliale, o che sia presente in anamnesi un pregresso meningioma di grado inferiore nella stessa sede. I dati morfologici e clinici dovranno essere supportati da indagini immunoistochimiche, ultrastrutturali e molecolari.
La variante papillare (fig 9b) può colpire l’età pediatrica, solitamente risparmiata dai meningiomi. Ha un pattern di crescita perivascolare, con formazione di papille vere o pseudopapille, perdita di coesione cellulare e strutture che ricordano le pseudorosette perivascolari dell’ependimoma. Le caratteristiche del meningioma classico spesso sono conservate alla periferia della lesione. Le pareti vascolari sono marcatamente ispessite ed è frequente l’invasione cerebrale. Non sono rare metastasi a distanza. Strati di cellule rabdoidi con nuclei eccentrici e nucleoli prominenti contraddistinguono il meningioma rabdoide (fig 9c). Il citoplasma eosinofilo contiene spesso inclusioni globulari paranucleari che alla
25
microscopia elettronica risultano essere costituiti da filamenti intermedi. Come i papillari, sono associati ad elevato tasso di mortalità e occasionali metastasi extracraniche.
Figura 9 Meningiomi WHO grado III (Perry, 2010)
2.6 d. Difficoltà nell’attribuzione del grading
Alcuni aspetti meritano particolare attenzione perché possono portare ad una sovrastima del grado di un meningioma. Se sono presenti aree necrotiche bisogna escludere che siano state indotte da trattamenti neoadiuvanti e occorre sempre ottenere informazioni precise a riguardo, se i dati clinici del paziente sono incompleti.
I tumori sottoposti a embolizzazione preoperatoria vanno incontro a necrosi, possono mostrare atipia nucleare di tipo riparativo, incremento delle dimensioni del nucleolo e dell’attività mitotica. Il grading di un tumore con estese aree di necrosi e alterazioni di tipo degenerativo deve sempre essere valutato con cautela, se è presente materiale estraneo da
26
procedura di embolizzazione. Sarebbe buona norma valutare l’attività mitotica nelle regioni più distanti dalla necrosi. Bisogna considerare comunque che i meningiomi sottoposti a procedura embolizzante sono di solito di grandi dimensioni e molto vascolarizzati, quindi tumori in cui è più probabile riscontrare una atipia vera. Questo è sicuramente un bias che complica la valutazione del grado.
La radioterapia neoadiuvante è un altro elemento da tenere in considerazione. L’irradiazione del tumore può generare ampi foci di necrosi e alterazioni vascolari di tipo degenerativo.
L’attività mitotica rappresenta un fattore prognostico importante, ma spesso difficile da stabilire. Le tecniche di conteggio possono variare tra gli osservatori e i campi ad alto ingrandimento possono avere dimensioni diverse a seconda dei microscopi utilizzati. Per ovviare a questo, sono state suggerite varie formule con fattori di conversione, che però sono scarsamente applicate nella routine diagnostica.
2.7 Patogenesi: aspetti molecolari
Le anomalie cromosomiche rivestono un ruolo importante nella patogenesi dei meningiomi sporadici. Circa il 60% dei pazienti ha una perdita di eterozigosi in almeno un locus sul cromosoma 22. A questo consegue un’alterazione dei prodotti del gene NF2, come la perdita dell’espressione della Merlina (Ueki et al.1999). La merlina è una proteina strutturale localizzata nella plasma membrana, che lega il citoscheletro alla membrana plasmatica. In un ristretto gruppo di meningiomi è stata riscontrata una mutazione a carico di INI1, un altro gene posto sul cromosoma 22 (Schmitz et al 2001). Una proteina tumor soppressor,
27
DAL-1 (cromosoma 18p11.3), non è espressa in circa il 75% dei casi e spesso questa perdita si accompagna a quella della merlina (Gutmann et al 2000; Perry et al 2000). Altre proteine appartenenti alla stessa famiglia di DAL-1 sono risultate assenti in due linee cellulari analizzate con Western blotting. La perdita di tali proteine portava a crescita tumorale delle cellule (Robb et al 2003).
Le alterazioni genetiche possono essere multiple e determinare la progressione tumorale verso forme più aggressive. In un sottogruppo di meningiomi con neurofibromatosi di tipo 2, l’alterazione del pathway della p53 determina una progressione verso forme di grado II o III (Chang et al 2009).
Una recente analisi genomica condotta su 300 meningiomi non associati a NF-2, è stata individuata una nuova mutazione a carico di TRAF7, una ligasi proapoptotica, in quasi un quarto di tutti i meningiomi esaminati. Spesso era associata anche una mutazione nel fattore di trascrizione KLF4. Un sottogruppo di meningiomi, spesso localizzati alla base cranica, mostravano mutazioni a carico di SMO (Clark et al 2013).
Brastianos e colleghi hanno recentemente analizzato il genoma dei meningiomi NF-2 indipendenti, evidenziando mutazioni a carico di AKT1 e SMO, sempre in tumori localizzati nella base cranica (Brastianos et al 2013).
Nei meningiomi atipici e maligni, l’incidenza delle anomalie sul cromosoma 22q tende ad aumentare e compaiono anche altre aberrazioni cromosomiche.
Il pathway JAK-STAT3 è implicato nella patogenesi dei meningiomi di alto grado (Johnson et al 2009). La proteina STAT3 è un fattore di trascrizione
28
coinvolto in numerose funzioni come la proliferazione cellulare, l’apoptosi e l’angiogenesi ed è attivato da fattori di crescita quali PDGF e EGF. L’attivazione di STAT3 è stata trovata nel 100% dei meningiomi di grado II e III, contro il 75% dei tumori di grado I.
Un’altra proteina legata a molte funzioni cellulari è SPARC (secreted protein, acidic and rich in cysteine), il cui ruolo principale è la regolazione della crescita cellulare. Iperespressa in varie neoplasie come il melanoma, il glioma, cancri del polmone, rene, prostata, ovaio; Bozkurt e collaboratori hanno dimostrato elevate concentrazioni di SPARC anche nei meningiomi con potenziale maligno e con tendenza alla recidiva (Bozkurt et al 2009).
La delezione del braccio corto del cromosoma 1 è una anomalia molto comune, le delezione di 7p si trova spesso nei meningiomi maligni, altri siti comuni di perdita genica sono 14q, 18q, 10 e 6q (Weber et al 1997;
Korshunov et al 2007).
L’attività telomerasica ha un ruolo critico sul controllo della proliferazione e la regolazione della senescenza cellulare, alterazioni a questo livello possono produrre proliferazione incontrollata e immortalità cellulare. Due gruppi hanno esaminato l’attività telomerasica nei meningiomi, che è risultata molto più attiva nei tumori atipici rispetto ai benigni (Leuraud et al
2004).
Il prodotto della proteina (hTERT) ha mostrato una correlazione significativa con l’indice di proliferazione ki67 (Cabuy and de Ridder
2001).
L’ipossia tumorale è stata associata con fenotipi tumorali maligni. L’anidrasi carbonica 9 è un marker endogeno di ipossia e risulta espresso maggiormente nei meningiomi di alto grado (Yoo et al 2007).
29
I meningiomi esprimono i recettori sia per gli estrogeni che per il
progesterone. La presenza di quest’ultimi è riscontrata più
frequentemente ed è associata con una minore percentuale di recidiva
(Perry et al 2000).
I meningiomi esprimono anche i recettori per il fattore di crescita derivato dalle piastrine (PDGF). L’espressione del recettore per il fattore di crescita epidermico (EGFR) sembra correlare con la progressione da forme benigne a forme maligne (Caltabiano et al 2013).
L’espressione della ciclossigenasi COX-2 sembra caratterizzare tumori di alto grado.
Le proteine morfogeniche dell’osso (BMPs) fanno parte della superfamiglia dei fattori di crescita trasformanti B, coinvolti nei processi apoptotici, angiogenetici e di differenziazione cellulare. Dallo studio di Johnson e colleghi, sembra che BMP sia espresso nelle leptomeningi e nei meningiomi ed abbia un ruolo importante nella proliferazione cellulare.
2.8 Terapia farmacologica nei meningiomi
La terapia farmacologica di meningiomi clinicamente aggressivi si basa sull’utilizzo di agenti chemioterapici citotossici che ad oggi sembrano avere solo un modesto effetto clinico al prezzo di pesanti effetti collaterali. L’idrossiurea sembra essere il farmaco più efficace nel trattamento di tumori ricorrenti e/o progressivi, tuttavia dati recenti mettono in dubbio la sua reale efficacia e attualmente sono in fase di studio chemioterapici da utilizzare in combinazione.
30
La somatostatina sembra determinare un down-sizing del tumore, come evidenziato radiologicamente in pazienti risultati positivi ai recettori della somatostatina allo studio scintigrafico con octreotide. Il mifepristone (un inibitore del recettore del progesterone) non ha dato i risultati sperati, sebbene molti meningiomi mostrino positività ai recettori ormonali.
Le terapie molecolari, incluse quelle che hanno come bersaglio i recettori PDGF, VEGF, EGF e i componenti del pathway MAPK sono promettenti in vitro, ma occorrono maggiori evidenze cliniche per delineare il loro potenziale effettivo nel trattamento dei meningiomi aggressivi (Sherman et al. Expert Rev. Neurother, 2012) .
31 3. AKT e VIE DI SEGNALAZIONE CORRELATE
3.1 AKT: struttura e meccanismo d’azione
La protein chinasi AKT, anche nota come proteina chinasi B (PKB), ha un peso molecolare di 57KDa e nei mammiferi rappresenta l’omologo dell’oncogene virale v-Akt responsabile del linfoma delle cellule T murine
(Franke TF, 2003).
AKT/PKB, attraverso vie di segnalazione complesse, regola molte funzioni cellulari, come la crescita e la proliferazione, l’apoptosi, il metabolismo energetico.
Geni distinti codificano per le tre isoforme attualmente note (AKT1/PKBα , AKT2/PKBβ, AKT3/PKBγ), che mostrano elevato grado di omologia strutturale. Il dominio catalitico, localizzato nella parte centrale della proteina, è posto tra una regione C- terminale con attività regolatoria e un’estremità N-terminale costituita da un dominio PH (plekstrin domain). Tutte le isoforme possiedono due siti di fosforilazione, fondamentali per le loro attività.
32
Nella sua forma inattiva Akt è localizzata a livello citoplasmatico. Il primo step per la sua attivazione consiste nel reclutamento a livello di membrana, mediato da proteine prodotte dalle PI3K che interagiscono con il dominio PH. Una prima fosforilazione sul residuo Thr308 avviene grazie alla serin-treonin chinasi PDK1. Il complesso mTOR interviene nella seconda fosforilazione, sul residuo di Serina posto in posizione 473 a livello della estremità C-terminale. Una volta fosforilata, Akt migra sia all’interno del nucleo che nel citoplasma.
L’attività di Akt viene controllata da un complesso sistema di proteine regolatrici in grado d’interagire con il suo dominio PH, chinasico o C-terminale, come la heat-shock protein-90 (HSP90). Numerosi stress cellulari quali lo shock termico, l’ipossia, lo stress ossidativo, l’ipoglicemia e la luce ultravioletta determinano l’aumento dell’attività di Akt .
Akt è in grado di promuovere la sopravvivenza cellulare in quanto tra i suoi targets figurano diverse proteine coinvolte nel processo apoptotico.
Akt, infatti, inibisce il rilascio del citocromo C dai mitocondri mediante fosforilazione dei fattori pro-apoptotici Bad (un membro della famiglia Bcl-2) e caspasi-9. Un altro meccanismo anti-apoptotico mediato da AKT /PKB è la fosforilazione dell’ oncogene MDM2 (murine double minute 2), che a sua volta inibisce la p53. La p53 è una proteina che determina morte cellulare in seguito agli stress, specialmente legati a danno del DNA. Fra i bersagli di Akt vanno annoverati i fattori trascrizionali FoxO, che attivano la trascrizione di geni pro-apoptotici come quello per il ligando Fas (FasL) e per Bim. Se fosforilati da Akt, questi fattori vengono inattivati (Arden KC, 2002; Van Der Heide LP, 2004).
33 Figura 11. Principali pathways AKT dipendenti (Cell Signaling, website)
AKT agisce sinergicamente con ERK promuovendo la via di segnalazione di mTORC1. Il punto di convergenza dei rispettivi pathways sembra
essere il complesso TSC1-TSC2 (Winter et al, Am J Physiol Cell Physiol 2011).
34
3.2 Espressione di AKT nei tessuti normali
Le tre isoforme di AKT sono ubiquitariamente espresse nei tessuti umani. Alti livelli di AKT1 si trovano in tutti gli organi ad eccezione di rene, milza e fegato; AKT2 è molto abbondante nei muscoli scheletrici, nell’intestino e negli apparati riproduttivi; AKT3 è più rappresentata a livello cerebrale e nei testicoli. AKT è abbondantemente espressa nella placenta murina e umana. La protein chinasi è criticamente coinvolta nello sviluppo placentare nel topo e nella migrazione del trofoblasto verso il tessuto uterino nella specie umana.
(Haslinger, AKT isoforms 1 and 3 regulate … .) Secondo i dati di una
recente analisi condotta su tessuti placentari umani con
immunofluorescenza e western blot, AKT1 è localizzato nel citoplasma, ma anche nei nuclei del citotrofoblasto villoso e nel trofoblasto extravilloso. AKT2 mostra una espressione citosolica, che tende a diminuire man mano che il trofoblasto extravilloso si differenzia. AKT3 si trova invece nei nuclei delle cellule trofoblastiche (Haslinger et al, Biology
of reproduction (2013) 88(3):54,1-11).
Nel miocardio, l’attivazione di AKT ha un ruolo cardioprotettivo, riducendo la morte apoptotica dei miocardiociti in risposta a un danno ischemico. Molti bersagli a valle di AKT contribuiscono all’effetto anti apoptotico, come la fosforilazione di molecole appartenenti alla famiglia Bcl-2, aumento dei livelli di ossido nitrico e la regolazione dei livelli di calcio (Sussman, Physiol Rev. 2011 July ; 91(3): 1023–1070).
Una delle funzioni cruciali di AKT è la regolazione dell’omeostasi del glucosio in risposta all’insulina, un processo modulato specificatamente da AKT2. Nei topi knockout per questa isoforma, la traslocazione verso la
35
membrana cellulare del trasportatore per il glucosio GLUT4 è alterata e l’uptake di glucosio nelle cellule muscolari e negli adipociti non avviene correttamente (Gonzalez et al, Insulin-modulated AKT subcellul). Negli adipociti che iperesprimono AKT1E17K (una forma mutata di AKT1 di cui parleremo più avanti), il pattern di distribuzione di GLUT4 è di membrana cellulare, pur in assenza di stimolo insulinico.
Un recente studio condotto su diverse linee cellulari tumorali e non neoplastiche, ha evidenziato una precisa localizzazione subcellulare delle tre isoforme. AKT1 è stato identificato nella membrana citoplasmatica o nel citoplasma, AKT2 in sede mitocondriale o Golgiana e AKT3 nel nucleo (Santi et al. 2010).
36
3.3 La mutazione AKT1E17K nei tumori solidi
Una mutazione somatica a carico del dominio PH di AKT1 (AKT1E17K) è stata identificata in diversi tipi di cancro umani. La sostituzione di una lisina all’acido glutammico in posizione 17 altera la tasca lipidica PH e determina la formazione di nuovi legami idrogeno.
Il risultato è un accumulo patologico di AKT1 sulla plasma membrana, un’attivazione dei segnali intracellulari a valle, una trasformazione cellulare e l’induzione di leucemia nel topo. Questo meccanismo si aggiunge ad altre già note alterazioni oncogenetiche a carico del pathway PI3K/AKT. (Carpten 2007 Nature 448:439-444).
Nello studio di Bleeker la mutazione E17K è stata evidenziata nei tumori della mammella di istotipo duttale e lobulare, negli adenocarcinomi del colon e in una piccola percentuale di carcinomi polmonari, a cellule squamose. Nel melanoma, nei tumori ovarici e negli adenocarcinomi duttali pancreatici la mutazione non è stata evidenziata, ma il numero di casi studiati è stato esiguo per avere significatività statistica (Bleeker, Oncogene 2008).
Tabella 4. Mutazione E17K in alcuni tumori solidi (Bleeker, 2008)
Altri lavori riportano la stessa mutazione anche nel cancro vescicale e prostatico. Nel 2.7% dei carcinomi vescicali analizzati da Ching et al. è stata evidenziata la mutazione di AKT1, talvolta accompagnata anche da
37
una seconda mutazione (E49K), che agisce in sinergia con la prima (Ching et al. Laboratory Investigation 2010).
La prevalenza di AKT1E17K negli adenocarcinomi prostatici riportata in uno studio del 2010 è pari all’1,4% e la mutazione, che correla con una buona prognosi, non sembra associata al pattern di crescita di tipo duttale(JL Boormans, E17K substitution in AKT1 in prostate cancer ). La prevalenza di questa mutazione sembra essere complessivamente bassa, ma occorrono altri studi condotti su larga scala per definire quanto è realmente espressa.
3.4 La mutazione AKT1E17K nei meningiomi
Nel 2013 sono stati pubblicati alcuni studi che riportavano dati concordanti riguardo alla mutazione AKT1E17K evidenziata nei meningiomi. Clark et
al hanno analizzato il profilo genetico di 300 meningiomi, individuando un
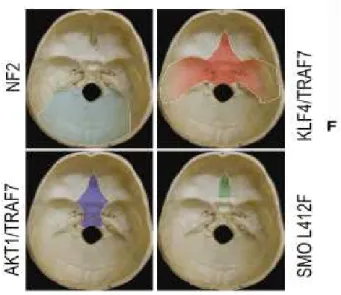
sottogruppo di tumori localizzati nella base cranica con mutazioni a carico di TRAF7, accompagnate o da mutazioni del fattore di trascrizione KLF4, o all’espressione di AKT1E17K. Queste mutazioni si evidenziavano in tumori NF2 wild type.
38
Figura 12. Mutazioni e rispettive localizzazioni nei meningiomi della base cranica
Clark et al, Science (2013)
La mutazione è stata evidenziata anche con metodo immunoistochimico, utilizzando un anticorpo specifico (AKT1E17K R&D System).
Analoghi risultati emergono da un altro studio condotto da Brastianos e collaboratori.
Dal sequenziamento del DNA è emerso che una delle più frequenti alterazioni genetiche è la perdita del cromosoma 22 (contenente il gene NF2), in armonia con risultati di precedenti studi.
Nei tumori di grado I sono state evidenziate perdite di 1p,7p,14p e 19p, mentre tumori di alto grado mostravano perdite su 10q e 14q. Nel 5% dei casi sono state osservate mutazioni a carico di SMO, un elemento della via di segnalazione Hedgehog (Hh).
Le mutazioni a carico del pathway PI3K riguardavano meningiomi non-NF2 mutati, prevalentemente di grado I e appartenenti al sottotipo meningoteliale. I tumori con mutazione AKT1E17K erano stati resecati dalla base cranica, una regione anatomica difficilmente aggredibile dal chirurgo e legata quindi ad alto tasso di recidiva. In questo studio il
39
marker immunoistochimico che ha evidenziato l’iperattivazione del pathway PI3K/AKT è stato un anticorpo specifico per STMN1 (stathmin 1). Tra i meningiomi che mostravano immunoreattività a STMN1 figuravano tumori con mutazioni a carico di AKT1, mTOR e SMO, a riprova dell’interazione tra i pathways PI3K/AK T/mTOR e Hh.
Figura 13. Stathmin 1 è espresso nei meningiomi con mutazioni di AKT1 e SMO (Brastianos, Nat Gen 2013)
Sahm et al. hanno sollevato il problema della riproducibilità dei risultati con l’anticorpo specifico per la mutazione E17K, il cui utilizzo in immunoistochimica in realtà non è stato validato dalla ditta produttrice. Per questo hanno individuato un altro marker evidenziabile con una reazione anticorpale: SFRP1 (secreted frizzled-related protein 1). Questa proteina indotta dalla via di segnalazione Hh (sonic hedgeogh signaling), risulta essere a sua volta iperattivata da AKT. SFRP1 è stato utilizzato anche come marker nella sottoclassificazione dei medulloblastomi.
Secondo questo studio, i meningiomi con AKT mutata sono di grado I, meningoteliali o transizionali, a localizzazione spinale o della base cranica. I meningiomi di alto grado non sono risultati positivi a SFRP1.
40 Figura 14. SFRP1 in un meningioma con mutazione AKT1E17K (a) e wild type (b) (Sahm, Acta Neuropathol 2013)
3.5 Il pathway PI3K/AKT/mTOR come target terapeutico
Le vie di segnalazione PI3K/AKT e mTOR sono strettamente legate e svolgono un ruolo fondamentale nella regolazione della crescita e sopravvivenza cellulare, sia in condizioni fisiologiche che nelle patologie. Il pathway PI3K/AKT è un punto chiave nella regolazione della sopravvivenza durante stress cellulari quali ipossia, acidosi…), mentre mTOR è una serin-treonin chinasi che raccoglie e integra tutte le informazioni relative a disponibilità di nutrienti, fattori di crescita e molti altri stimoli cellulari utili per la regolazione della sintesi proteica.
In molti tumori solidi e ematologici sono stati individuate mutazioni somatiche e/o perdita o iperespressione di geni che fanno parte di questi pathways, che quindi rappresentano un target molto promettente per lo sviluppo di nuovi farmaci antitumorali (Porta, 2014).
La rapamicina (sirolimus) è un antimicotico con proprietà
immunosoppressive e antiblastiche. Recentemente sono stati sviluppati analoghi strutturalmente simili, ma con diversa attività farmacocinetica, che, tramite mediazione della proteina FKBP-1, si legano a mTOR a livello intracellulare, bloccando le sue funzioni. Come risultato si ha inibizione
41
della progressione del ciclo cellulare, della sopravvivenza e dell’angiogenesi.
Temsirolimus è stato impiegato nella terapia del carcinoma a cellule renali e del linfoma mantellare, ridaforolimus nei sarcomi ossei e dei tessuti molli in fase avanzata. Everolimus è stato recentemente approvato dalla Food and Drug Administration (FDA) per il trattamento del carcinoma a cellule renali avanzato, non responsivo a sutinib e/o sorafenib (Motzer,
Lancet 2008).
A differenza degli inibitori di mTOR, i farmaci antagonisti di PI3K e AKT sono ancora in fase di sperimentazione iniziale. La prima generazione di questi composti aveva come capostipite la wortmannina e LY294002, che non sono mai entrati in uso clinico a causa delle scarse proprietà farmacocinetiche. In seguito sono stati messi a punto i cosiddetti “dual PIK3/mTOR inhibitors”, che riconoscono particolari siti con elevato grado di omologia (CAT) presenti sia su mTOR che su PI3K.
Gli inibitori di AKT sono entrati in trials clinici più di recente. Esistono composti che riconoscono diversi substrati, quali il sito ATP, il dominio PH e la sequenza LINK. Uno di essi, la miltefosina, ha completato lo studio di fase III per le metastasi cutanee di cancro della mammella (Leonard, J Clin Oncol 2001).
Un recente studio (Jo H, Pro Natl Acad Sci 2011) ha identificato una molecola in grado di legarsi al dominio PH di AKT e facilitare la sua ubiquitinazione. SC66 è inoltre capace di impedire il legame di AKT1E17K alla membrana citoplasmatica, inibendo la sua azione. Questa molecola quindi potrebbe essere utile nei casi di resistenza agli inibitori PI3K.
Recentemente è stato dimostrato che la mutazione E17K nel dominio PH della proteina AKT1 è associata a resistenza farmacologica alla molecola AKT1/2 inibitore VIII (Kumar, PlosOne 2013).
42 4.
SCOPI
I meningiomi che abbiamo selezionato nella casistica comprendono un sottogruppo di neoplasie aggressive, alcune delle quali hanno recidivato e non sono attualmente trattabili con protocolli terapeutici specifici.
Il nostro intento è verificare con metodo immunoistochimico se questi meningiomi iperesprimono AKT.
Alla luce dei risultati dei recenti lavori di Clark e Brastianos, vogliamo appurare inoltre se nei nostri casi è presente la mutazione E17K a carico dell’isoforma AKT1.
La tecnica di sequenziamento genico utilizzata si avvale del sistema Ion Torrent, che permette una veloce ed economica analisi di sequenze genomiche di interesse.
Infine, intendiamo testare la validità e l’affidabilità su tessuto paraffinato dell’anticorpo monoclonale specifico per la mutazione E17K (MAB6815 R&D System).
43
5. MATERIALI E METODI
5.1 Casistica
I meningiomi esaminati in questo studio provengono dagli archivi del Charing Cross Hospital, Neuropathology Unit di Londra.
Abbiamo selezionato meningiomi intracranici, meningoteliali o
transizionali, evitando altri sottotipi più rari che hanno peculiarità istologiche e cliniche. Per ogni caso sono state visionate tutte le sezioni istologiche ed è stata selezionata la più rappresentativa della lesione, evitando preparati con artefatti da cauterizzazione e ampie zone di necrosi. Sono stati identificati la presenza di invasione cerebrale, il sottotipo e il pattern secondario, le caratteristiche istologiche che costituiscono i criteri minori per l’attribuzione del grado (sheeting, componente a piccole cellule o a cellule chiare, pseudoinclusi nucleari, mcronecrosi). I meningiomi diagnosticati in epoca precedente al 2007 sono stati rivalutati, ponendo particolare attenzione alla presenza di infiltrazione del parenchima cerebrale e alla ricerca delle mitosi.
Nell’ambito dei meningiomi di grado I (gruppo A), abbiamo selezionato quelli che mostravano una maggiore attività proliferativa, pur avendo un numero di mitosi inferiore a 4 per 10 HPF. Questi tumori costituiscono il gruppo B della casistica (meningiomi di grado I, mitoticamente attivi). Al gruppo C appartengono i meningiomi di grado II. Alcuni pazienti hanno avuto una o più recidive, identificate con R1 (prima recidiva) o R2 ( seconda recidiva), preceduta dalla lettera del gruppo di appartenenza. Un paziente del gruppo C ha mostrato una recidiva classificata come grado III (R2 G3).
44
Per ogni paziente abbiamo ricostruito la storia clinica e revisionato gli esami strumentali e/o i referti eseguiti prima e dopo la chirurgia.
I meningiomi di grado I con bassa attività mitotica (gruppo A) sono tutti sopratentoriali e non hanno mostrato recidiva nel follow up di almeno dieci anni.
I pazienti sono in totale dieci, sette maschi e tre femmine. L’età all’epoca dell’intervento va da 35 a 80 anni, con un’età media di 60,6 anni.
Otto neoplasie sono situate in diverse aree della volta cranica, quattro a sinistra (due frontali, un parietale, un temporo-parietale), tre a destra (due parietali e un temporale) e un meningioma bifrontale. Due meningiomi sono della base cranica (uno del solco olfattorio e uno dello sfenoide sinistro).
La valutazione istologica delle neoplasie ha compreso l’individuazione del sottotipo, la segnalazione di eventuali aspetti istologici rappresentati in percentuale minore, la conta delle mitosi. Questo parametro è stato valutato osservando almeno 50 campi ad alto ingrandimento. Il numero delle mitosi è stato poi riparametrato su 10 HPF, secondo i criteri WHO.
I meningiomi di gruppo A sono meningoteliali (otto) e transizionali (due).
All’analisi morfologica è seguito lo studio immunoistochimico di AKT, che è risultato espresso in tutti i tumori, con intensità variabile da 1+ a 2+.
Il gruppo B comprende i meningiomi mitoticamente attivi, caratterizzati da una vivace attività mitotica, ma non ancora tale da poter essere classificati
45
come grado II secondo i criteri WHO 2007. Il numero delle mitosi, calcolate su almeno 50 HPF, era compreso tra 1 e 3.
Sono quindici pazienti, otto di sesso femminile e sette di sesso maschile, di età compresa tra ventisette e ottantatrè anni.
Un paziente ha presentato una recidiva a distanza di tre anni dal primo intevento, quindi i casi studiati sono stati sedici.
Tre meningiomi erano della base cranica (regione sfenoidale). Tredici meningiomi erano situati nella volta cranica: tre a destra (due frontali e un parafalcino), otto a sinistra (due parietali, due temporali, uno sul tentorio, uno occipitale), uno a livello del seno sagittale superiore e un parafalcino frontale.
Dodici appartenevano al sottotipo meningoteliale e quattro al transizionale.
Alcune neoplasie mostravano componenti a piccole cellule, rabdoidi o a cellule chiare, ma la bassa percentuale di questi aspetti non giusticava la classificazione come grado II. In altri casi non è stato possibile stabilire con certezza la presenza di invasione del parenchima cerebrale, quindi sono stati classificati comunque come grado I.
Il gruppo C è composto da meningiomi aggressivi per caratteristiche istologiche, attività mitotica spiccata o invasione del parenchima cerebrale.
Undici pazienti erano di sesso maschile e quattordici di sesso femminile. Oltre a venticinque tumori primitivi, tredici casi analizzati erano recidive, per un totale di trentotto casi. L’età media dei pazienti era compresa tra
46
trenta e ottantatrè anni. Nei casi che hanno presentato recidiva, è stata considerata l’età al primo intervento.
La localizzazione dei meningiomi C era prevalentemente della volta cranica: undici a destra (sette in regione frontale, due parietali, uno occipito-temporale, uno della convessità destra); sedici a sinistra (nove in regione frontale, tre in regione temporo-parietale, due parafalcini e due occipitali). Due meningiomi erano paraventricolari, tre della base cranica, uno della fossa cranica posteriore, uno parafalcino, uno frontale.
Tre meningiomi erano transizionali e trentacinque meningoteliali.
Otto meningiomi mostravano una chiara invasione del parenchima cerebrale, in quattro non è stata definita con certezza, i rimanenti ventisei non erano invasivi.
Le mitosi sono state contate su almeno 100 campi ad alto ingrandimento, su più sezioni, selezionando le aree a maggiore attività mitotica. Sono state considerate solo le figure mitotiche chiare, non confondibili con corpi apoptotici. Il numero delle mitosi è stato poi riparametrato su 10 HPF, secondo i criteri WHO.
I meningiomi del gruppo C mostravano un numero di mitosi compreso tra 1 e 22 su 10 HPF. I tumori che non raggiungevano il numero minimo di 4 mitosi su 10 HPF, mostravano invasione cerebrale o altri parametri istologici che giustificavano la classificazione come grado II.
In questo gruppo sono stati inclusi anche due meningiomi di grado I (C15 G1 e C20 G1), che sono recidivati mostrando caratteristiche aggressive. In particolare il C20 G1 ha recidivato la prima volta come meningioma di grado II (C20 R1) e la seconda volta come grado III (C20 R2 G3) (fotografie).
47
La valutazione dell’infiltrazione del parenchima cerebrale è stata effettuata in modo rigoroso, considerandola presente solo quando propaggini di tessuto neoplastico in continuità con la neoplasia si approfondavano nel sottostante tessuto cerebrale.
5.2 Analisi immunoistochimica
5.2 a Tecnica e strumenti
La tecnica di colorazione immunoistochimica permette di indagare la presenza ed effettuare una valutazione semiquantitativa di un antigene su un campione di tessuto, sfruttando la formazione di complessi antigene-anticorpo che vengono evidenziati con un colorante specifico.
In questo studio per indagare e quantificare la presenza delle proteine AKT e AKT1(E17K) si è eseguita su tutti i campioni un'analisi immunoistochimica su sezioni di 4 micron di spessore su vetrini portaoggetti Superfrost® utilizzando un immunocoloratore automatico BenchMark XT® (VentanaMedical System). L’immunocoloratore ha impiegato per la rivelazione l’ultraView™ DAB (HRP) kit, un sistema biotina-free basato sull’utilizzo di un multimero complessato all’enzima perossidasi Horseradish che permette di identificare in modo sensibile gli anticorpi primari di topo e coniglio. Il kit è costituito da cinque componenti:
• ultraView™ Universal DAB Inhibitor (che impedisce un’aspecifica perossidazione della DAB)
• ultraView™ Universal DAB HRP Multimer (multimero biotina free complessato con la perossidasi Horse-raddish)
48
• ultraView™ Universal DAB Chromogen (diaminobenzidina)
• ultraView™ Universal DAB H2O2 (perossido di idrogeno che attiva l’azione della perossidasi che agisce sulla diaminobenzidina, la quale funge da substrato e determina la formazione di un prodotto finale marrone insolubile in alcool)
• ultraView™ Universal DAB Copper.
La macchina permette la colorazione automatica di 30 sezioni contemporaneamente. Ognuna delle postazioni occupate dal vetrino è indipendente dalle altre e permette di effettuare colorazioni con anticorpi e protocolli diversi all'interno della stessa corsa di colorazione. Durante tutta la procedura i vetrini erano ricoperti da una soluzione oleosa per creare una camera umida sul tessuto ed i reagenti sono stati distribuiti automaticamente. L’unica operazione manuale è stata la titolazione dell’anticorpo primario (100 microlitri di soluzione con diluizione specifica a seconda del marcatore indagato). La controcolorazione è stata effettuata, sempre in modo automatizzato, con ematossilina di Mayer per 4 minuti. Al termine della corsa i vetrini sono stati accuratamente lavati in acqua e sapone per eliminare la soluzione oleosa e successivamente disidratati attraverso passaggi di due minuti ciascuno in soluzioni ascendenti di alcool (50%, 70%, 90%, 100%) ed in xilene 100%; infine i vetrini sono stati montati con Eukitt® (Bio-Optica).
5.2 b Anticorpi e Protocolli
Come marcatore della proteina AKT è stato scelto l'anticorpo monoclonale pan-specifico Monoclonal Mouse IgG2B Clone 281046 (MAB2055),
49
prodotto da R&D Systems; l’anticorpo usato per marcare l’isoforma proteica AKT1 con mutazione E17K è stato invece il Monoclonal Mouse IgG1 Clone 710022 (MAB6815).
Entrambi gli anticorpi hanno avuto bisogno di numerose prove di ottimizzazione.
Dopo ricostituzione, il MAB2055 è stato diluito 1:100 e testato su due sezioni paraffinate, una di tessuto placentare e una di carcinoma duttale infiltrante della mammella. Il tempo di incubazione è stato di 45 minuti. Per ogni corsa dello strumento ci siamo avvalsi di un controllo negativo, in cui veniva omesso l’anticorpo primario.
Il risultato ottenuto è stato negativo, quindi abbiamo ripetuto lo stesso protocollo con concentrazioni anticorpali di 1:50 e 1:25. Solo quest’ultima diluizione dava un risultato, che però corrispondeva ad una colorazione troppo intensa, con notevole effetto “fondo”. Abbiamo allora optato per la diluizione 1:100, con tempo di incubazione di 56 minuti e utilizzo di un kit amplificatore di segnale. Questa volta la positività evidenziata era nitida, senza effetto fondo. Nel controllo positivo si osservava una positività continua di membrana citoplasmatica e di tipo granulare a livello del citoplasma. Questo tipo di colorazione era in linea con i risultati attesi, visto che AKT è una chinasi principalmente espressa a livello citoplasmatico.
Il passo successivo è stato utilizzare il MAB2055 sulla nostra casistica, mantenendo un controllo positivo e uno negativo per ogni corsa.
50
Si tratta infatti di un anticorpo il cui utilizzo in immunoistochimica non è stato validato dalla ditta produttrice (R&D System), quindi non avevamo riferimenti che potessero indirizzare le nostre prove.
Dopo ricostituzione, è stato diluito 1: 100 e lo abbiamo testato sullo stesso campione di carcinoma mammario utilizzato per il MAB 2055. La reazione è avvenuta a pH 9, tempo di incubazione dell’anticorpo primario: 20 minuti. L’esito della reazione è stato negativo. Abbiamo selezionato un secondo campione di carcinoma mammario duttale infiltrante (G3), testato con lo stesso protocollo e stessa diluizione anticorpale, ma il risultato è stato ancora una volta negativo.
Considerando che le due neoplasie selezionate avrebbero potuto essere wild type per la mutazione AKT1E17K, abbiamo scelto di usare come controllo positivo un meningioma della nostra casistica, nel quale la presenza della mutazione AKT1E17K era stata evidenziata mediante sequenziamento genomico con tecnica Ion Torrent.
Applicando lo stesso protocollo e mantenendo la stessa diluizione anticorpale (1:100) non è stata evidenziata alcuna immunoreattività.
Abbiamo deciso quindi di aumentare il tempo di incubazione dell’anticorpo primario e aumentare la sua concentrazione.
Il primo risultato positivo è stato ottenuto con la diluizione dell’anticorpo primario 1:50 e un tempo di incubazione di 60 minuti. La reazione è avventa a pH 9.
Il meningioma mutato per AKT1E17K mostrava una positività granulare citoplasmatica di intensità variabile da 1+ a 2+. In alcune aree era visibile un lievissimo rinforzo a livello della membrana citoplasmatica. Abbiamo applicato lo stesso protocollo a due sezioni di meningiomi che il sequenziamento genico aveva rivelato essere AKT1 wild type. In questi tessuti l’immunoreazione è risultata negativa, quindi abbiamo avuto conferma della sua specificità.
51
5.3 Estrazione del DNA
Abbiamo estratto il DNA dei meningiomi dalle inclusioni in paraffina con il seguente protocollo:
1. Da ciascuna inclusione in paraffina, ottenere cira 10 sezioni di tessuto (spessore 5-10 µm) e posizionarle in una provetta Eppendorf
2. Aggiungere 1 ml di xilolo fino a coprire completamente le sezioni e lasciarle a 37°C per 30 minuti
3. Centrifugare per 20 minuti a velocità massima e rimuovere lo xilolo 4. Aggiungere 1 ml di etanolo 100% per dissolvere e rimuovere lo
xilolo (30 minuti)
5. Centrifugare (20 minuti, velocità massima) e rimuovere
attentamente lo xilolo, evitando il contatto con le sezioni di tessuto 6. Lasciare evaporare xilolo in eccesso per circa 30 minuti
7. Aggiungere 500 µl di TNE contenente 0,5% di SDS e la proteinasi K (100 µg/ml ) e incubare per 1 settimana a 50°C
8. Aggiungere proteinasi K al campione ogni due giorni, per mantenere la digestione
9. Quando tutto il tessuto si è dissolto, aggiungere 500 µl di fenolo e agitare lentamente l’emulsione per 15 minuti
10. Centrifugare a velocità massima per 20 minuti. Rimuovere lo strato acquoso sopranatante, che contiene il DNA. Aggiungere RNAsi A e lasciare agire per 30-60 minuti
11. Aggiungere 500 µl fenolo e agitare delicatamente per 15 minuti 12. Centrifugare alla velocità massima per 15 minuti. Rimuovere lo
52
pulita, aggiungendo 2 volumi di etanolo 100%. Conservare a -80°C overnight, quindi centrifugare per almeno 30 minuti
13. Lavare con 200 µl di etanolo 70% e centrifugare alla massima velocità per 30 minuti
14. Rimuovere l’etanolo e riso spendere il pellet di DNA in 10-50 µl di H202
15. Controllare qualità e concentrazione del DNA con uno spettrofotometro. Il valore di assorbanza 260/280 dovrebbe essere intorno a 1,8.
5.4 Ion Torrent Sequencing (ITS)
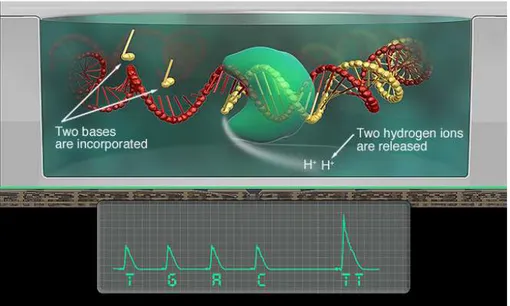
Ion TorrentTM Technology è una delle tecniche di sequenziamento di ultima generazione. Lo strumento Ion Torrent è in grado di analizzare regioni genomiche di interesse nell’arco di una sola giornata. Si sfrutta la tecnologia dei semiconduttori, coniugandola con un meccanismo di sequenziamento basato su processi biochimici già noti. Infatti, nei sistemi biologici, quando un singolo nucleotide è incorporato dall'enzima DNA polimerasi nella catena nascente di DNA a doppia elica, viene rilasciato uno ione idrogeno come sottoprodotto. Se le basi introdotte sono due, gli H+ saranno due, e così via. Quando invece nessuna base viene introdotta, non si ha rilascio di H+ .
53
La tecnologia dell'Ion Torrent è incentrata sull'impiego di un sofisticato array ad alta densità con micropozzetti all'interno dei quali questo processo di sintesi (e conseguente rilascio di ioni idrogeno) viene ripetuto ciclicamente.
Figura 15. Ion Torrent Sequencing: elaborazione digitale della variazione di pH (Cell
Signaling,website)
Il chip contiene un array di 1.5 milioni di sensori, ciascuno dotato di un piccolo incavo studiato per contenere un frammento a filamento singolo di DNA. Per sequenziare un filamento di DNA, la macchina ne sintetizza uno complementare, addizionando per tentativi consecutivi una per una ciascuna delle 4 basi che compongono il DNA. Quando la base corretta viene incorporata nella sequenza in formazione, innesca una reazione chimica per cui un atomo di idrogeno di carica positiva viene rilasciato e rilevato dal sensore presente nel pozzetto, in grado di registrare anche minime variazioni del pH ambientale. Il sistema consente l'aggiunta al chip di un nucleotide noto alla volta: se il nucleotide aggiunto al sistema non viene incorporato nella molecola di DNA neosintetizzata, in quanto non complementare al templato contenuto nel micropozzetto, non verrà
54
prodotta nessuna modifica del pH e di conseguenza nessuna modifica del voltaggio. Un ciclo del processo dura pochi secondi poiché non richiede una rilevazione ottica, come accade invece negli altri sistemi di Next Generation Sequencing.
Un computer registra la formulazione della sequenza avvalendosi della conoscenza dell’esatto momento in cui ciascuna base viene fatta fluire all’interno del chip. Il dispositivo risulta tanto più economico rispetto ad altre macchine perché più semplice. Spetta al chip rilevare la sequenza, secondo un procedimento elettronico.
Esistono pannelli predefiniti di primers pronti all’uso, come il 50 gene Cancer Panel, che vengono selezionati per identificare regioni target (geni, esoni o singole mutazioni hotspots).
Il vantaggio principale di questa nuova macchina è la sua velocità: è infatti in grado di sequenziare un campione di DNA in un paio di ore, contro la settimana e più necessaria per la maggior parte delle macchine attualmente in commercio. Inoltre è sufficiente una piccola quantità di DNA (10 ng) per eseguire il sequenziamento.
Il limite principale della metodica è la difficoltà di enumerare correttamente lunghe ripetizioni omopolimeriche (Metzker 2005).
55 6. RISULTATI
L’espressione di AKT valutata con metodo immunoistochimico è risultata positiva in tutti i casi studiati, più intensa nei meningiomi aggressivi (gruppo C) rispetto ai meningiomi di grado I a bassa attività mitotica (gruppo A). Nel gruppo B abbiamo osservato una immunoreattività variabile.
I meningiomi di grado I con bassa attività mitotica (gruppo A) hanno mostrato una positività debole e diffusa (1+) nel 60% (6/10) dei casi, moderata e diffusa (2+) nel 20% (2/10) dei casi, moderata e focale nel 10% (1/10) dei casi e variabile da debole a moderata nel 10% (1/10) dei casi.
Nei meningiomi di grado I mitoticamente attivi (gruppo B) la positività per AKT era debole e diffusa nel 25% (4/16) dei casi, moderata e diffusa (2+) nel 43,75% dei casi (7/16), moderata (2+) e focale nel 18,75% dei casi (3/16), variabile da moderata (2+) a intensa (3+) nel 6,25% dei casi (1/16), intensa (3+) e focale nel 6,25% dei casi (1/16).
La positività per AKT nei meningiomi aggressivi (gruppo C) era debole e diffusa nel 6,66% (2/30) dei casi, moderata (2+) e focale nel 10% dei casi (3/30), moderata (2+) e diffusa nel 26,6% dei casi (8/30), intensa (3+) e focale nel 13,3% dei casi (4/30), intensa (3+) e diffusa nel 33,33% (10/30) dei casi, molto intensa (4+) e focale nel 6,66% (2/30) dei casi, molto intenso (4+) e diffuso nel 3,33% (1/30) dei casi.
Il sequenziamento con strumento di nuova generazione Ion Torrent ha evidenziato la presenza della mutazione E17K su uno dei tre meningiomi
56
analizzati. Si tratta di un meningioma della convessità cerebrale, di grado I, a bassa attività mitotica, non recidivato a distanza di dieci anni dalla resezione chirurgica. Questo risultato è interessante in quanto rappresenta una novità rispetto allo studio di Clark, dove i meningiomi E17K mutati erano localizzati nella base cranica. Occorre sequenziare tutti i casi per capire se questo risultato è significativo.
L’anticorpo specifico per la mutazione E17K di AKT1 ha dato buoni risultati nelle sezioni paraffinate, in quanto risultava espresso nel meningioma con mutazione accertata mediante sequenziamento genico, ma non in quelli wild type.