Parte sperimentale
Cap. 3
Materiali e Metodi
Lo studio è articolato in una fase di raccolta dei campioni da lepri libere e allevate, nella loro successiva analisi con esami parassitologici quali-quantitativi, nella realizzazione di successive coprocolture al fine di eseguire una identificazione delle specie coccidiche presenti e di una elaborazione statistica dei dati ottenuti.
3.1 Gli animali
La raccolta dei campioni fecali di lepri allo stato libero è stata effettuata presso il Parco dell’Orecchiella, mentre quelli delle lepri in cattività sono stati prelevati presso
l’Allevamento Faunistico di Bieri del Corpo Forestale di Stato, Gestione ex ASFD, a Pieve a Fosciana in provincia di Lucca.
Da uno studio condotto da Pierpaoli e collaboratori dell’INFS (1999- Molecular Ecology 8, 1805-1817) per ricostruire la recente filogenesi delle popolazioni e specie di lepre, è emersa anche la presenza di un aplotipo definito “di montagna” nell’areale del Parco
dell’Orecchiella.
Tre aplotipi divergenti di lepre europea (Leu 1, Leu 2, Leu 3), infatti, sono stati raggruppati separatamente dagli altri perché trovati in campioni raccolti in aree isolate di montagna nel Nord (Monte Cusna), Centro (Parco Nazionale d’Abruzzo) e Sud (Monte Pollino). Il Monte Cusna fa parte del comprensorio dell’Orecchiella dove sono state eseguite le catture per costituire un nucleo di Lepus europaeus aplotipo 2 da allevare a Bieri.
Pertanto, sia nell’allevamento che nel parco esistono due diverse popolazioni di Lepre europea: Lepus europaeus e Lepus europaeus 2 o aplotipo di Montagna (“Garfagnino”). Nelle zone di raccolta è da escludere la presenza di altre specie appartenenti alla Famiglia
Leporidae in quanto si tratta di altitudini (oltre i 1284 m) alle quali non si trovano conigli
selvatici. Infatti, la sottospecie di coniglio selvatico presente in Italia (Oryctolagus
cuniculus huxleyi - Haeckel, 1874) si spinge in montagna fino a 800-1.000 m s.l.m. Il
silvilago (Sylvilagus floridanus) in Italia, nonostante sia stato a più riprese introdotto in molte regioni, è attualmente naturalizzato solo in Piemonte e localmente in Lombardia
mentre non è presente nelle zone campionate(http://www .minambiente .it/st/IVlinistero. aspx?doc=biblioteca/natura/iconografia/lagomorfi/ silvilago. xml).
3.2 Il Parco Naturale dell’Orecchiella
Il Parco Naturale dell’Orecchiella si trova sul versante appenninico della Garfagnana in provincia di Lucca ed è composto da tre riserve naturali: “l’Orecchiella”, “la Pania di Corfino” e “Lama Rossa”, tutte gestite dal Corpo Forestale dello Stato. Il Parco
dell’Orecchiella si estende su 52 Kmq di territorio nell’alta Valle del Serchio in una fascia altimetrica che va dai 600 ai 2.054 metri di altezza s.l.m. del Monte Prado; il crinale appenninico segna il confine con l’adiacente Parco Regionale Emiliano del Gigante
(Pieroni, 1992). Il microclima locale è quello caratteristico dell’appennino tosco-emiliano: inverni rigidi ed estati fresche. La neve rimane a lungo solamente alle quote più elevate e nei versanti rivolti a nord. Quest’area è caratterizzata dalla notevole diversità di situazioni ambientali determinate da clima, altitudine, esposizione e caratteristiche del suolo, a cui fa riscontro una vegetazione particolarmente varia e differenziata: dai boschi di ceno e
castagno presenti alle quote più basse, si passa alle estese faggete delle quote superiori, fino ai cespuglieti dominati dal mirtillo ed alle praterie montane del crinale appenninico. La varietà degli ambienti naturali consente la sopravvivenza ad una abbondante fauna selvatica (Poggi et al., 1985).
Figura 11. Localizzazione geografica del Parco dell’Orecchiella
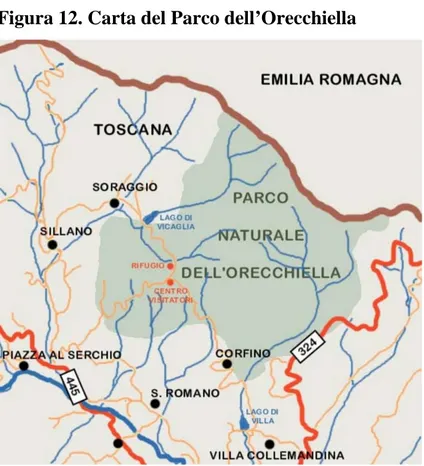
Figura 12. Carta del Parco dell’Orecchiella
(http://www.alpiapuane.com/listaparchi.htm)
I siti all’interno del parco in cui sono stati effettuati i campionamenti sono stati tre: - Monte Bocca di Scala, a quota 1846 m s.l.m. (raggiungibile col Sentiero Cai 58)
- Sella di Campaiana, a quota 1518 m s.l.m. (raggiungibile col Sentiero Airone n°1 o Cai 62)
- Alpe di Caprignana, a quota 1284 m s.l.m. (raggiungibile col Sentiero Airone n°2)
Figura 14. SELLA DI CAMPAIANA
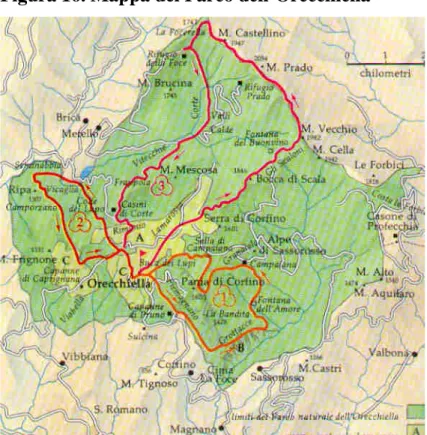
Figura 16. Mappa del Parco dell’Orecchiella
(http://web.tiscalinet.it/catalogo/garfagnana/orecchiella.html)
3.3 L’allevamento di Bieri
I campioni degli animali in cattività sono stati prelevati presso l’Allevamento Faunistico di Bieri del Corpo Forestale di Stato, Gestione ex ASFD, a Pieve a Fosciana in provincia di Lucca.
Si tratta di un allevamento del Centro Faunistico Sperimentale di Bieri-Orecchiella-Montefalcone istituito nel 1980. Vi si allevano diverse specie tra cui il Gallo Forcello, la starna, la pernice, la coturnice e la lepre. Riguardo quest’ultima, in allevamento è presente sia Lepus europaeus come normale allevamento con 120 coppie e 600 soggetti venduti, mantenuti in gabbia, nel parchetto o ambientati a terra. E’ poi presente al fine di studi e ricerche la Lepre europea con caratteri propri dell’ambito geografico di
riferimento/Garfagnana.
Infatti gli animali allevati provengono, secondo quanto ci è stato riferito dal Corpo Forestale di Lucca, da successive catture nelle stesse località del Parco dell’Orecchiella. Nel Parco infatti sono annualmente attuate delle catture di lepri selvatiche e, dopo l’analisi del loro
Dna. è stato costituito un piccolo nucleo di presunto Leu 2 il quale è poi allevato a Bieri. All’interno dell’Allevamento Faunistico di Bieri il 40% dei soggetti allevati presenta “aplotipo di montagna”(Leu 2).
Nell’allevamento sono presenti gabbie di tipo francese che ospitano una coppia di
riproduttori e delle gabbie singole per i leprotti, nonché terreni recintati per l’adattamento dei leprotti a terra.
Il Corpo Forestale dello stato gestisce l’allevamento per scopi faunistico-naturalistici, per salvaguardare la biodiversità dei genotipi delle specie locali evolutesi nelle specifiche condizioni territoriali dell’ Appennino tosco-emiliano e minacciate da errate introduzioni faunistiche.
L’allevamento di questi animali è orientato ad esaltarne la selvaticità allo scopo di ripopolare le aree protette del Parco.
(http ://www2.corpoforestaledellostato.it/portal/page/categoryltem?contentld=3 1029)
L’alimentazione nell’allevamento prevede l’uso di mangimi e alimenti integrativi freschi (soprattutto carote), ad eccezione del fieno fresco che aumenta i rischi di contagio e sporca le gabbie.
La lepre necessita di un alto tenore di fibra nella sua dieta fin dallo svezzamento. Ai leprotti è somministrato un mangime col 16% di fibra, il 12,5% di proteine, il 2,5% di lipidi ed il 9% di ceneri.
Il mangime per i riproduttori ha una maggior percentuale di fibra grezza (17,5%) ed una maggior quota di ceneri gregge 9,5%.
I mangimi composti pellettati sono integrati sia con vitamine (vit.A, Vit. D3, vit.E) che con
coccidiostatici, dal momento che risulta difficile in allevamento controllare completamente la coccidiosi con l’igiene e le corrette pratiche d’allevamento (Spagnesi e Trocchi, 1992). L’uso di gabbie con rete ha ridotto l’importanza di questa malattia, ma non l’ha eliminata. Nonostante l’uso sistematico di mangimi integrati con robenidina (prodotto capaci di limitare lo sviluppo dei coccidi in concentrazione di 66mg per kg di mangime), sia per i riproduttori che per i leprotti, si ricorre talvolta a interventi terapeutici con ossitetraciclina e sulfachinossalina.
Gli anticoccidici sono disciolti nell’acqua di abbeverata (1 g di farmaco per litro d’acqua), i trattamenti sono della durata di 3 giorni e vengono effettuati ogni 40-60 giorni (soprattutto quando le feci si presentano mollicce e appiccicose).
Dopo lo svezzamento a 23-25 giorni di età (epoca in cui i giovani vengono posti in gabbie singole) tutti i leprotti sono alimentati per una settimana con mangime medicato con anticoccidici a cui seguono 14 giorni di sospensione.
La gestione sanitaria dell’allevamento di Bieri prevede la disinfezione delle gabbie e del terreno con calce viva, oltre ai trattamenti per prevenire l’infezione coccidica.
Gli adulti riproduttori, ogni anno, sono sottoposti a vaccinazioni per la profilassi dell’EBHS, della Pasteurellosi e della Bordetellosi.
La prima vaccinazioni dei leprotti è effettuata su animali di 45 giorni che hanno da poco subito lo stress dello svezzamento e che manifestano spesso enteriti. Si esegue un richiamo a 60 giorni.
La stagione riproduttiva va da Gennaio ad Agosto ed il numero di parti per anno può arrivare anche a 7, la media è di 5 parti all’anno.
La prolificità delle femmine pluripare è alta (anche 4 leprotti per parto), mentre le primipare partoriscono solo 1 o 2 leprotti generalmente.
In natura la lepre partorisce 1 o 2 volte in un anno, un massimo di 2 leprotti per parto per cui in natura al massimo da una femmina nascono 4 leprotti all’anno, mentre in allevamento anche 15.
L’alto numero di parti per anno è dovuto alla corta gestazione della lepre (40 giorni circa) ed alla possibile sovrapposizione di 5-7 giorni di 2 gravidanze successive.
Generalmente ogni 37 giorni la femmina partorisce durante la stagione riproduttiva, ed un aumento di intervallo interparto (oltre 60 giorni) è indice di patologie o aborti talvolta causati da traumi violenti quando l’animale disturbato attua la sua naturale tattica di fuga e sbatte contro la gabbia.
Nonostante l’elevata prolificità la produttività dell’allevamento è bassa poiché si hanno il 30-35% di perdite dalla nascita alla vendita dei leprotti. Il 70% dei casi di mortalità nei leprotti è causata da enteriti, le quali si possono manifestare clinicamente nell’ animale che presenta gli occhi socchiusi ed il pelo arruffato e sporco. Si ricorre in questi casi alla
somministrazione di Baytril®, comunque la percentuale di sopravvivenza non supera il 50% degli ammalati.
I Leprotti sono trasferiti dalle gabbie ai recinti a terra generalmente a 50 giorni di età ma talvolta a 70 giorni e 1’ ambientamento a terra dura almeno 30-35 giorni.
La quota di rimonta è rappresentata dai leprotti nati a maggio perché quasi tutte coppie di riproduttori a maggio si riproducono e l’alto numero di soggetti nati dalle diverse coppie limita la consanguineità.
3.4 Campionamento
I campionamenti sono stati effettuati ogni 40 giorni circa (9 campionamenti in 12 mesi). Riguardo le lepri libere, ad ogni campionamento sono stati prelevati da ogni sito tre
campioni fecali costituiti da almeno 8 pellet ciascuno. Le lepri del parco, infatti, sono state suddivise in tre gruppi sulla base della località di raccolta dei campioni: Alpe di Caprignana, Bocca di Scala, Sella di Campaiana.
Le raccolte effettuate nel Parco sono state eseguite in modo tale che ad ogni campione, presumibilmente, corrispondesse un animale diverso. Infatti, ad ogni campionamento si perlustrava un diverso lato dei siti prescelti e, dopo ogni prelievo effettuato, si percorrevano almeno 500 m prima di raccogliere un nuovo campione onde evitare di prelevare più volte le fatte dello stesso animale. Sono stati scelti solo campioni di feci fresche.
Nell’ allevamento sono stati scelti soggetti appartenenti al gruppo dei riproduttori e dei leprotti, a loro volta suddivisi tra aplotipo “europeo” e presunto aplotipo di riferimento Garfagnino (Leu 2).
In particolare i campionamenti (un pool per ciascuna gabbia nel caso degli adulti) sono stati effettuati su:
Riproduttori aplotipo di montagna delle gabbie 15 e 20.
Leprotti aplotipo di montagna delle gabbie 150, 20, 106, 152, 43 e 44. Riproduttori aplotipo europeo delle gabbie 44 e 40.
Leprotti aplotipo europeo delle gabbie: 30, 40, 42, 41, 106 e 114.
I campioni dei leprotti sono stati prelevati ogni volta da 2 gabbie di leprotti aplotipo “europeo” e due gabbie di leprotti aplotipo “Garfagnino”, ma le gabbie ed i soggetti sono stati spesso variati a causa della vendita dei leprotti. Nel caso degli animali allevati sono
stati anche raccolti dati relativi ai parametri riproduttivi (n° parti/anno; intervallo interparto; n° leprotti/parto; mortalità perinatale).
In totale sono stati raccolti 126 campioni fecali, 57 provenienti da animali del parco e 69 dall’ allevamento.
3.5 Analisi Parassitologiche
Analisi Qualitative per la ricerca di uova di nematodi e cestodi, oocisti coccidiche e cisti
protozoarie.
Flottazione-Tecnica
La flottazione è stata eseguita utilizzando una soluzione a bassa densità (soluzione satura di cloruro di sodio-densità 1,2). La procedura consiste nello stemperare in un filtro con garza, posto sopra a un contenitore, circa 2 grammi di feci ai quali poi si aggiungono 58 ml di soluzione satura di NaCl. La miscela ottenuta è quindi versata con una pipetta con la quale poi si riempiono le due camere del vetrino di McMaster. Si attendono 10 minuti e poi si osserva al microscopio il vetrino con l’obiettivo 10x.
Il numero di uova presenti nelle due camere è moltiplicato per 100. La sensibilità di questa tecnica è di 100 UPG/OPG se si conta in 2 camere, 200 UPG/OPG se si conta solo in una.
Coprocolture
Per valutare quali specie di coccidi fossero presenti nei campioni, sono state eseguite delle coprocolture in acqua di fonte contenente ipoclorito di sodio al 2% in rapporto 9:1 e in Bicromato di Potassio al 2,5 %. Per la coltivazione, si seminano le feci stemperate in piastre di Petri in strato sottile (in modo che ci sia un maggior esposizione all’aria), al buio (perché la luce diretta inibisce la crescita) ed a temperatura di circa 20° C. Le colture sono quindi esaminate giornalmente per calcolare il tempo di sporulazione (cioè l’intervallo necessario perché le oocisti divengano infettanti).
Le differenze relative al tempo di sporulazione, osservate nei due tipi di colture, sono state registrate.
Le oocisti mature sono state valutate morfometricamente al microscopio ottico e con un oculare micrometrico. Per l’identificazione delle specie coccidiche in causa, sono state
utilizzate le descrizioni fornite da Pèllerdy (1965, 1974), Levine (1972) e Aoutil e collaboratori (2005).
Le coprocolture delle pillacole delle lepri allo stato libero sono state approntate su pool dei tre campioni provenienti dai diversi siti di raccolta. Per gli animali allevati, invece, non sono stati utilizzati pool bensì campioni provenienti da singole gabbie.
Analisi Quantitativa
Tecnica di Mc Master: la camera di McMaster permette di contare il numero di uova (o
oocisti) per grammo di feci, consente dunque di effettuare un esame quantitativo del campione ovvero di quantificare il numero di Uova/Oocisti Per Grammo di Feci (UPG/OPG).
Si basa sull’uso di un vetrino doppio in quanto presenta una intercapedine calibrata tra due lamelle di vetro, una inferiore che funge da base ed una superiore separate da uno spazio di altezza pari a 1,5 mm. La lamella superiore è appoggiata a tre spessori equidistanti, di cui quello centrale divide lo spazio tra le lamelle in due camere uguali. Sulla lamella superiore è inciso, per ogni camera, un reticolo delimitato da un quadrato di 1 cm (10 mm) dilato.
Quindi lo spazio sotto ciascun quadrato comprende un volume pari a 0,15 ml (150 mm3). Si procede stemperando 2 grammi di feci in un filtro con garza, posto sopra un matraccio, con 58 ml di soluzione satura di NaC1 (60 ml totale). La sospensione ottenuta è mescolata
Colorazioni Permanenti
I campioni sono stati analizzati anche per la ricerca di Cryptosporidium e Giardia.
A tal fine sono state effettuate colorazioni permanenti (Giemsa e Ziehl-Nielsen modificata) di strisci fecali.
La colorazione di Giemsa è indicata per la diagnosi di Giardia mentre la colorazione di Ziehl Nielsen modificata si usa per la diagnosi di Cryptosporidium.
(S.A.Henriksen, .T.F.L.Pohienz, Acta Vet.Scand. 22: 594- 596; 1981) in un cilindro di 10-15 ml fino a formare un menisco convesso che viene ricoperto con un vetrino coprioggetto di poco più grande del diametro del cilindro. Si attendono 20 minuti e poi si monta su un vetrino portaoggetti e si esamina al microscopio ottico.
Colorazione di Giemsa
La soluzione di Giemsa è costituita da 30 gocce di colorante di Giemsa e 20 ml di H20 neutra. Per H20 neutra si intende 1000 ml di acqua distillata contenente 2 g di potassio fosfato monobasico (KH2PO4) e 1 g di potassio fosfato bibasico (K2HPO4).
Il procedimento consta nello stemperare su un vetrino una piccola quantità di feci
precedentemente ammorbidite e omogenate con acqua, asciugare all’aria i vetrini e fissarli con alcool metilico per 4 minuti. Dopo aver scolato l’alcool metilico si ricoprono i vetrini con la soluzione di Giemsa e si lascia agire per 25-30 mm. Poi i vetrini sono lavati sotto acqua corrente, asciugati e montati per l’osservazione microscopica. Al microscopio ottico il parassita è individuato perché i nuclei del protozoo si colorano in rosso mentre il
citoplasma si cobra in azzurro dando risalto al trofozoita.
Colorazione di Ziehl Nielsen modificata
La soluzione di fucsina fenicata è costituita da 25 ml di Fucsina di Ziehl e 75 ml di H20 fenicata. In aggiunta ai suddetti coloranti si adoperano anche la soluzione di acido solforico al 2 % e la soluzione di verde malachite al 5%
Il procedimento consiste nel preparare gli strisci di materiale fecale a fresco o previa
concentrazione e lasciar seccare all’aria. Fissare in metanolo per 5 minuti, asciugare i vetrini all’aria. Immergere i vetrini nella soluzione di fucsina fenicata per 1 ora. Sciacquare in H20 corrente. Differenziare nella soluzione di acido solforico al 2 % per circa 20 sec., agitando i vetrini. Sciacquare in H20 corrente. Controcolorare con la soluzione di verde malachite al 5 % per 5 mm. Sciacquare in H20 corrente e lasciar asciugare i vetrini all’aria. Esaminare i vetrini al microscopio (obiettivo 40 X o 100 X).
Questa tecnica sfrutta l’acido resistenza di alcuni protozoi ed è la colorazione elettiva per evidenziare le oocisti di Cryptosporidium. Esse rimangono colorate in rosso su uno sfondo verde o blu essendo così facilmente visibili.
Tecnica di Baerman
Questo metodo si presta per isolare le larve presenti nelle feci fresche (strongili polmonari,
L’ apparato di Baermann è costituito da un imbuto di plastica di 7-8 cm di diametro. All’ imbuto viene inastata una piccola provetta sorretta da un tubo di gomma. L’imbuto si riempie per ¾ di acqua tiepida e sopra, a pelo d’acqua, si pone una rete a maglie sottili. Sulla rete metallica si pone il campione fecale (circa 3-4 grammi). Dopo alcune ore di riposo a temperatura ambiente si stacca la provetta dall’apparato. In essa saranno contenuti tutte le larve presenti nel campione uscite spontaneamente dalle feci e sedimentate sul fondo a causa del loro idrotropismo. Il contenuto della provetta si esamina al microscopio
stereoscopico. Altrimenti si osservano al microscopio ottico le ultime gocce rimaste nella provetta, dopo aver gettato il surnatante, aspirandole con una sottile pipetta Pasteur e ponendole tra vetro e vetrino per l’identificazione microscopica. Per migliorare
l’osservazione delle larve sul vetrino esse vengono fissate e chiarificate con formolo o colorate col Lugol. L’osservazione generale è compiuta usando l’obiettivo 10x mentre per l’identificazione si usano gli obiettivi 25 e 40 x per valutare i particolari.
3.6 Analisi Statistica
I dati ottenuti sono stati elaborati utilizzando il metodo statistico SAS Institute (2002) (JMP. SAS Institute Inc., CARY, NC. USA-ISBN 1-59047-070-2).
I dati meteo giornalieri (dall’01/10/05 al 30/09/06) relativi all’umidità e alla temperatura medie rilevate nel Parco dell’Orecchiella sono stati forniti dalla stazione di Orecchiella dell’ARSIA (Agenzia Regionale per lo Sviluppo e l’Innovazione nel settore Agro-forestale della Regione Toscana).