M
M
A
A
T
T
E
E
R
R
I
I
A
A
L
L
I
I
e
e
M
19
7. SOSTANZE
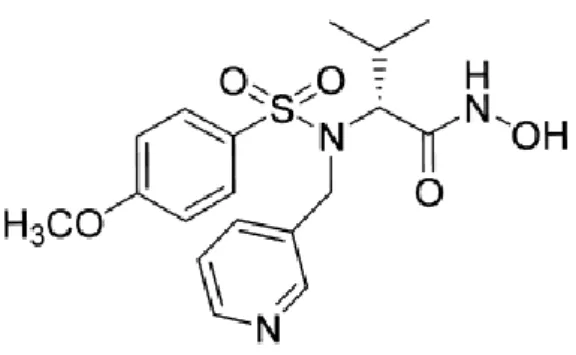
Nel seguente lavoro di tesi sono stati testati sette potenti inibitori MMPs (4, 5a, 5b, 5c, 5d, 6, 7) appartenenti alla famiglia dei sulfonamido idrossamati, sulle cellule di glioblastoma umano U87MG, rispetto al composto CGS_27023A (3) usato come standard di riferimento.
Tutti i composti sono stati forniti dal laboratorio del Prof. Rossello, presso il dipartimento di Scienze Farmaceutiche dell’ Università di Pisa. In tale laboratorio sono stati effettuati saggi in tube per valutare l’attività inibitoria dei composti verso alcune MMPs. Questi saggi sono stati fatti utilizzando enzimi ricombinanti umani, con lo scopo di determinare i rispettivi valori di IC50.
Ar
SO
2N
H
N
O
OH
Figura 5: struttura chimica generale degli inibitori sulfonammido idrossammati, senza
20
Figura 6: Struttura chimica dell’inibitore CGS_27023A (standard di riferimento)
7.1 Coltura cellulare
La linea cellulare di glioblastoma umano, U87MG, è stata donata dall’Istituto Nazionale per la Ricerca sul Cancro (ICLC) di Genova.
Le cellule U87MG (1 x106) sono state seminate in piastre di 10 cm e la coltura è avvenuta in mezzo completo sterile costituito da:
RPMI 1640 (Cambrex Bio Science Walkersville,Inc; Walkersville, MD) addizionato di siero fetale bovino (FBS) al 10%;
L-glutammina 2 mM;
100U/ml di penicillina;
100 mg/ml di streptomicina;
1% di amminoacidi non essenziali (GIBCO, Milano, Italia).
La coltura è stata mantenuta nell’incubatore a 37°C in atmosfera umidificata composta da 5% di CO2 e 95% di O2.
21
8. LA ZIMOGRAFIA DELLE MMPs
La zimografia è una tecnica elettroforetica utilizzata per identificare l’attività proteolitica di enzimi, che vengono separati sulla base del loro peso molecolare su speciale gel di poliacrilammide ed in condizioni non denaturanti. Tale separazione, effettuata sulla base del peso molecolare, permette di identificare separatamente la forma pro enzimatica dalla forma attiva della MMP-2. La tecnica è basata sull’utilizzo di gel di poliacrilammide che sono stati polimerizzati inglobando il substrato specifico della MMP da investigare, ovvero nel caso specifico della MMP-2, la gelatina. La corsa elettroforetica viene effettuata in presenza di SDS, un agente denaturante, che conferisce alle proteine una carica negativa, in modo tale da permetterne la separazione in seguito all’applicazione di un campo elettrico. Alla corsa elettroforetica è fatta poi seguire una prima fase di rinaturazione con Triton X-100, che rimuove i residui di SDS presenti nel gel di poliacrilammide, e successivamente favorita l’attività dell’enzima attraverso una fase di incubazione in condizioni di temperatura idonea e in presenza di cofattori. La tecnica si conclude con la colorazione con un colorante delle proteine e la successiva decolorazione fino alla comparsa di bande “non colorate” che rappresentano l’attività digestiva delle proteine substrato presenti nel gel da parte dell’enzima.
Questa tecnica è molto sensibile e permette di evidenziare concentrazioni di enzima nell’ordine del picogrammo.
Con lo scopo di valutare l’inibizione dell’attività della MMP-2 esercitata dai composti di nuova sintesi presi in esame, il pro-enzima ricombinante umano della MMP-2 è stato convertito nella sua forma attiva attraverso incubazione per un’ora a 37°C in presenza di p-aminofenilmercurio acetato
22
(APMA) 1mM. Dopo attivazione dell’enzima (0,14 nM) è stato incubato con ciascun composto alla concentrazione di 5 nM per 3 ore.
Preparazione dei gel di poliacrilamide:
Gel di impaccamento: è il gel all’interno del quale vengono costituiti i pozzetti per il caricamento dei campioni.
Gel di separazione: è il gel dove avviene la separazione delle proteine in base al peso molecolare e dove viene incorporata la gelatina (Sigma-Aldrich, St. Louis, MO, USA) che rappresenta il substrato enzimatico. E’ un gel di poliacrilamide al 10% contenente sodio dodecil solfato (SDS) denaturante.
La polimerizzazione dei gel avviene mediante una reazione di catalisi radicalica che prevede l’aggiunta di un iniziatore di reazione, l’ammonio
persolfato (APS), e di un catalizzatore N,N,N’,N’-tetrametilendiammina
(TEMED).
Il campione da caricare nel gel viene preparato aggiungendo a 200 pg di MMP-2 ricombinante (20 µ) 5µl di una soluzione contenente:
- Tris-HCl 0,5 M pH 6.8
- SDS 2% che denatura le proteine fornendo loro una carica negativa; - Glicerolo 15%, utilizzato come addensante per favorire il
caricamento del campione nel pozzetto;
- Blu di bromofenolo, colorante inerte che permette di visualizzare il fronte di migrazione.
La corsa elettroforetica viene effettuata in tampone di corsa 1X (Tris-HCl, glicina, SDS, pH 8.6) ad amperaggio costante. Dopo la corsa elettroforetica il gel viene lavato due volte con Triton X-100 al 2,5% per 30 minuti . In seguito, il gel viene incubato per 19 ore a 20°C in tampone d’incubazione (Tris-HCl 50mM pH 7.5, CaCl2 10mM, NaCl 150 mM, Briji 35 0,05%).
23
Al termine dell’incubazione il gel viene immerso in una vaschetta contenente la soluzione colorante (Coomassie Brilliant Blue R-250 0,25%, metanolo 50%, acido acetico 10% in H2O MilliQ). Dopo 15 minuti,
vengono effettuati lavaggi con soluzione decolorante (metanolo 30% e acido acetico 10% in H2O MilliQ).
Le bande chiare che appaiono dopo la decolorazione corrispondono all’attività di digestione della gelatina da parte delle MMP-2, la quale può essere quantificata mediante il software che permette l’analisi densitometrica dell’immagine (ImageJ, Istituto Nazionale della Salute, Bethesda, Maryland, USA).
9. SAGGIO DI INVASIVITA’ SU MATRIGEL
Il saggio di invasività si basa sull’utilizzo di una membrana basale, detta matrigel (BD Bioscences), che mima la matrice extracellulare dei mammiferi. Questo tipo di saggio viene utilizzato per quantificare il grado d’invasività di molti tipi di cellule, andando a determinare la loro capacità di degradare la matrice e quindi di migrare attraverso il matrigel. Quest’ultimo componente è un estratto dal sarcoma di topo
Engelbtreth-Holm-Swarm (EHS), un tumore ricco di proteine della matrice
extracellulare quali laminina, collagene IV, entactina e proteoglicani. Il matrigel inoltre è ricco anche di fattori di crescita che sono presenti naturalmente nel sarcoma EHS.
A temperatura ambiente il matrigel polimerizza producendo così la matrice che simula la membrana basale.
Precedentemente, era stata effettuata la messa a punto del sistema, attraverso il calcolo dell’indice d’invasività [(cellule invasive/cellule
24
migrate) x 100], il quale deve essere prossimo al 50%, perchè il test sia ottimale.
Il saggio è stato effettuato utilizzando un Transwell da 24 pozzetti (diametro di 6,5 mm, filtri in policarbonato con pori di 8,0 µm, Costar,Corning, NY), mostrato in figura 7.
Figura 7: Transwell da 24 pozzetti. Diametro di 6,5 mm, filtri in policarbonato con pori
di 8,0 µ.
In ogni pozzetto del Transwell è posizionato un inserto, con filtro poroso in policarbonato, a distanza fissa dalla base, che separa il compartimento inferiore (basale) da quello superiore (apicale).
25
In generale le cellule vengono seminate sul filtro e migrano verso il compartimento basale dove, a differenza dell’apicale, vengono messe sostanze chemio attrattive (figura 8).
Figura 8: inserto posizionato in un pozzetto del Transwell
Il matrigel è stato diluito con mezzo privo di siero ad una concentrazione finale di 0.32 ng/ml e 25µl sono stati caricati sugli inserti del Transwell e lasciati incubare tutta la notte.
Nella camera inferiore del Transwell sono stati poi aggiunti 200 µl di mezzo completo, contenente il siero fetale bovino al 10% che esercita una funzione chemio attrattiva sulle cellule. Le cellule sospese in mezzo di coltura privo di siero vengono caricate nella camera superiore del Transwell ad una densità di 6x104 cellule, in assenza ed in presenza dei composti di nuova sintesi. Il Transwell è stato poi mantenuto per 24 ore nell’incubatore a 37°C con atmosfera umidificata, composta da 5% CO2 e 95% O2 .
Il giorno successivo le cellule rimaste al di sopra della membrana porosa sono state rimosse e quelle migrate, che si trovano adese alla superficie
26
inferiore della membrana porosa, sono state fissate, colorate e contate. Per il fissaggio sono stati aggiunti 500µl di paraformaldeide al 4% (diluita dal 20% con PBS 1x contenente CaCl2 1M) per 15 minuti a temperatura
ambiente. Dopo lavaggi con PBS 1x addizionato con CaCl2 1M, sono stati
aggiunti 500µl di cristal violetto, che penetra nelle cellule vive colorandole, e lasciati a incubare per 10 minuti.
I filtri sono stati fotografati al microscopio, ognuno in cinque zone diverse (campi) e le cellule viola sono state contate al computer usando un software ImageJ (ImageJ Software, versione 1,41o; USA).
10. SAGGIO DI VITALITA’ CELLULARE: TRYPAN BLUE
Le cellule U87MG coltivate come precedentemente descritto sono state seminate nei multi-well da 6 pozzetti, con una densità di 3x103 cellule/cm2 in 1 ml di mezzo al 10% di FBS. Le cellule, dopo 24 ore di incubazione, sono state trattate con ciascun composto in esame e con lo standard di riferimento CGS_27023A, alla concentrazione di 5 nM. Come controllo le cellule sono state trattate con il dimetilsolfossido (DMSO), solvente in cui sono stati solubilizzati i composti e lo standard.
Dopo 24 ore di trattamento con gli MMPIs, le cellule adese sono state staccate mediante l’utilizzo di tripsina. La sospensione cellulare è stata quindi centrifugata a 800 x g per 5 minuti, il sovranatante è stato eliminato ed il pellet risospeso in un volume di mezzo completo opportuno per la conta di vitalità delle cellule, effettuata con il saggio del Trypan blue (TB) (Sigma/RBI, Natick, MA) (Ruan et al., 1999).
Il saggio con il Trypan blue è un test utilizzato per determinare il numero delle cellule vive e morte presenti in una sospensione. Esso si basa sul
27
principio che le cellule vive, avendo una membrana cellulare intatta, siano in grado di escludere l’ingresso al proprio interno di certi coloranti, come appunto il Trypan blue, al contrario di quanto si verifica per le cellule morte, le quali invece, lasciando passare il colorante, assumono una colorazione blu.
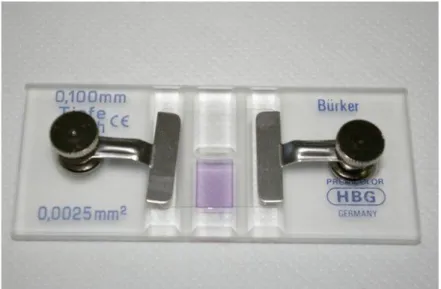
Per effettuare la conta cellulare sono stati prelevati 100 µl di ogni sospensione, messi in eppendorf e sono stati aggiunti 20 µl di Trypan blue, allo 0,4% in NaCl 0,9%. Dopo circa 2 minuti 10 µl della soluzione cellulare sono stati caricati nella camera conta-cellule di Burker ed è stata effettuata la conta al microscopio (Figura 9).
28
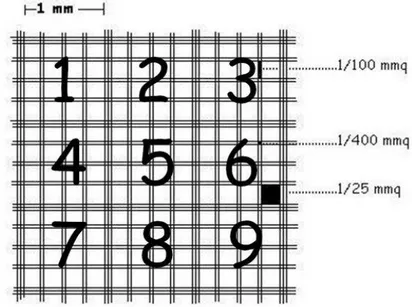
Il reticolo dell’emocitometro di Burker è strutturato in nove quadrati, delimitati da tre righe parallele, con all’interno sedici piccoli quadrati delimitati da due righe parallele (Figura 10).
Figura 10: Reticolo della camera di Burker visto al microscopio
Le cellule vive e morte visibili nei novi quadrati sono state contate ed è stata fatta la media delle cellule presenti in ciascun quadrato (M). Per calcolare il numero di cellule che erano presenti in ogni pozzetto è stato eseguito il seguente calcolo:
Cellule = M x 10
4x V in ml x Fattore di diluizione
29
11. ANALISI DEI DATI
Le analisi statistiche sono state eseguite attraverso ANOVA a un criterio di classificazione seguita da test di Bonferroni, usando il programma GraphPad Prism (GraphPad Software, versione 4.0; San Diego, CA). Il livello di significatività è stato posto al valore P<0,05. Infine, tutti i valori sono stati presentati come medie ± errore standard delle media (SEM) e derivano almeno da tre esperimenti indipendenti, condotti in duplicato.