SEZIONE III
1. STUDIO DELL’INFEZIONE DA TTV NEI
SOGGETTI IN ESAME
1.1 PRESENZA E TITOLI DI TTV
Il gruppo di pazienti esaminato in questo studio longitudinale era costituito da 34 soggetti adolescenti e pre-adolescenti, di età compresa tra i 7 e i 15 anni, affetti da asma persistente ben controllata; le caratteristiche generali dei pazienti sono riassunte nella tabella I della sezione II. I soggetti durante tutto il periodo di studio (Ottobre 2002 – Marzo 2006) sono stati sottoposti a visite periodiche di controllo durante le quali veniva misurata la concentrazione di ossido nitrico nell’aria espirata (eNO), mediante la metodica definita on-line a respiro singolo (Baraldi et al., 2002), e venivano prelevate le secrezioni nasali. Inoltre durante la prima visita veniva valutato lo stato atopico per mezzo di un test allergologico cutaneo.
L’infezione da TTV nei fluidi nasali dei soggetti è stata determinata e quantificata mediante la metodica Real-Time PCR.
Il numero totale di prelievi di secrezioni nasali effettuati dai pazienti nell’arco di tempo sopra indicato, è stato di 173 con una media per soggetto di 4 prelievi (tabella III.1).
Per facilitare l’elaborazione statistica dei dati, i valori ottenuti, espressi in numero di copie di genoma di TTV per ml di fluido nasale, sono stati convertiti in scala logaritmica in base 10. Inoltre, i prelievi che mostravano titoli virali inferiori a 3,0 log10 (limite di sensibilità
della Real-Time PCR), sono stati arbitrariamente considerati TTV negativi.
I risultati, come riportato nella tabella III.1, hanno evidenziato la prevalenza di TTV in 148 dei 173 (85%) tamponi nasali testati, con titoli virali compresi tra 3,3 e 9,5 log10 copie di TTV per ml di fluido
nasale (media geometrica ± deviazione standard [DS]: 6,1 ± 1,6). Questi dati, che denotano l’alta percentuale di positività e l’ampio range dei titoli virali di TTV nei campioni analizzati dei soggetti asmatici, concordano con i risultati ottenuti da precedenti studi (Maggi et al., 2003).
Tabella III.1: Prevalenza e titoli di TTV nelle secrezioni nasali dei soggetti asmatici dello studio.
Parametri
N° soggetti esaminati N° totale di prelievi N° medio di prelievi per soggetto (range)
N° prelievi risultati TTV positivi (%)
Titolo medio di TTV (media ± DSa)
N° (%) di prelievi con titolo di TTV ≥ 6,0 log10 copie/ml 34 173 4 (2-9) 148 (85) 6,1 ± 1,6 81 (47) a Deviazione standard
1.2 CONCENTRAZIONE DELL’OSSIDO NITRICO
NELL’ARIA ESALATA
La misura della frazione di ossido nitrico espirata (eNO) nei soggetti asmatici rappresenta un marcatore non invasivo della flogosi bronchiale che permette un monitoraggio dell’attività della malattia; è inoltre un indice predittivo di riacutizzazione e permette di modulare il trattamento dell’asma con le dosi di farmaco più idonee (Smith et al., 2005). Sembra, infatti, che l’NO sia in grado di provocare nelle vie aeree di pazienti asmatici un incremento del flusso sanguigno bronchiale (Alving et al., 1993), e che elevati livelli locali della molecola possano esplicare un effetto citotossico sulle cellule epiteliali, effetto che potrebbe contribuire allo sfaldamento delle cellule che si riscontra nei polmoni dei soggetti con asma (Heiss et al, 1994). Un aumento endogeno di NO nelle vie aeree di pazienti asmatici potrebbe provocare vasodilatazione con conseguente iperemia e quindi essudazione.
L’NO esplica anche un effetto sul controllo nervoso della broncodilatazione: agisce infatti come neurotrasmettitore del sistema inibitore non-adrenergico, non-colinergico, provocando il rilasciamento della muscolatura bronchiale (Streeton, 1991). Nel paziente asmatico potrebbe esserci una disfunzione di questo effetto modulatore della broncodilatazione favorendo quindi la broncocostrizione.
Da quanto detto risulta chiaro che la concentrazione di eNO è generalmente elevata negli individui asmatici, caratterizzati da un processo infiammatorio cronico a livello delle vie aeree, rispetto ai soggetti sani (Alving et al., 1993), nei quali i valori normali di eNO misurati sono compresi tra 15 e 25 parti per miliardo (ppm); (Baraldi et al., 2005). Tali variazioni sono da attribuirsi alla differenza di sesso, età e sintomi atopici, i quali devono essere tenuti presenti per effettuare una corretta misurazione di eNO.
Nel mio studio di tesi in 25 dei 34 soggetti con asma è stata misurata la frazione di eNO durante le stesse visite di controllo in cui sono state prelevate le secrezioni nasali per la determinazione del TTV (tabella III.2). Questo ha premesso di seguire nel tempo le variazioni della carica virale del virus parallelamente alle variazioni della concentrazione di eNO.
Il numero totale di misurazioni di eNO effettuate è stato 121: la concentrazione media di eNO riscontrata è stata di 19,7 ppm con un range di valori compresi tra 5,0 e 77,1 ppm.
Tutti i soggetti dello studio, grazie alle periodiche visite di controllo e agli specifici trattamenti farmacologici a cui erano sottoposti, presentavano soddisfacenti condizioni cliniche, tanto che la media delle misurazioni dell’eNO era compresa nell’intervallo di valori considerati normali dalle linee guida internazionali.
Dato che i valori di eNO erano stati rilevati a tutte le date in cui ciascun soggetto era stato sottoposto a visita di controllo e che spesso questi valori mostravano significative fluttuazioni, ho ritenuto interessante calcolare l’entità delle singole variazioni che l’eNO subiva nel tempo. Lo stesso è stato fatto anche per i titoli di TTV. Per determinare tale variazione, ho rilevato la misurazione ad una singola data e ho calcolato la differenza rispetto alla misurazione ottenuta nella precedente visita di controllo (tabella III.3).
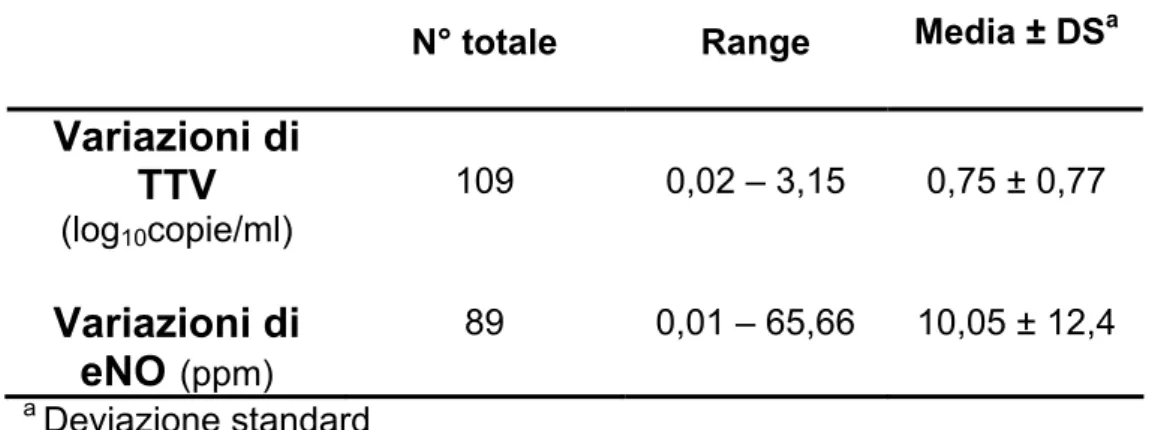
Le variazioni della concentrazione di eNO misurate, sono state 89 con valori compresi tra 0,01 e 65,66 (media geometrica ± [DS]: 10,5 ± 12,4).
Il numero totale di variazioni della carica virale di TTV calcolate è stato 109, con valori compresi tra 0,02 e 3,15 log10 copie/ml (media
geometrica ± [DS]: 0,75 ± 0,77).
Dato che modeste variazioni dei titoli di TTV sono spesso soltanto dovute alla variabilità intrinseca del sistema di quantificazione utilizzato, variazioni significative nella carica virale sono state considerate tutte quelle risultanti maggiori di 0,6 log10 copie/ml.
La differenza nel numero totale di variazioni calcolate tra TTV ed eNO è da attribuirsi al fatto che durante tutte le visite di controllo venivano prelevate ai pazienti le secrezioni nasali per le indagini virologiche, ma non sempre è stato possibile effettuare la misurazione della frazione di eNO.
Tabella III.2: Concentrazione di NO nell’aria espirata dei soggetti asmatici.
Parametri
N° soggetti esaminati N° totale di misurazioni Media di misurazioni per soggetto (range)
Concentrazione media dell’eNO (ppm media ± DSa)
Range delle concentrazioni dell’eNO (ppm) 25 121 4 (2-9) 19,7 ± 13,6 5,0 – 77,1 a Deviazione standard
Tabella III.3: Variazioni della carica virale di TTV e delle concentrazioni di eNO.
N° totale Range Media ± DSa
Variazioni di
TTV
(log10copie/ml) 109 0,02 – 3,15 0,75 ± 0,77Variazioni di
eNO
(ppm) 89 0,01 – 65,66 10,05 ± 12,4 a Deviazione standard2. CORRELAZIONE TRA LE VARIAZIONI
DELLA CARICA VIRALE DI TTV E LE
VARIAZIONI DELLA CONCENTRAZIONE DI
OSSIDO NITRICO
2.1 OSSERVAZIONI INIZIALI
L’ampio intervallo dei valori riscontrato nella concentrazione di eNO e nella carica virale di TTV, come riportato nella tabella III.1 e nella tabella III.2, mi ha suggerito di valutare l’esistenza di una relazione tra questi due parametri.
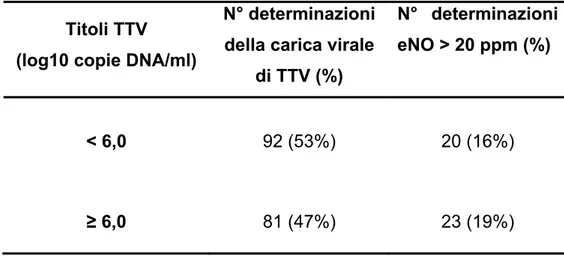
A tal fine ho suddiviso le cariche di TTV, in base al titolo del virus quantificato nel fluido nasale. Il limite che ho scelto come discriminante è stato di “6,0 log10 copie di DNA virale per ml di fluido
nasale”. La scelta di questo valore deriva da precedenti risultati dai quali emergeva una correlazione positiva tra livelli sierici della proteina cationica eosinofilica (ECP) e titoli di TTV maggiori di 6 log10
(Maggi et al., 2004). Gli alti titoli di TTV sono stati quindi correlati con i livelli di eNO. I livelli di eNO sono stati considerati patologici se superiori a 20 ppm in accordo a quanto riportato dalle linee guida internazionali per la misura dell’eNO (Baraldi et al., 2002).
Come mostrato nella tabella III.4, nessuna relazione è tuttavia emersa fra questi due parametri.
Trattandosi, però, di uno studio longitudinale e avendo a disposizione i valori delle variazioni nel tempo di TTV e delle variazioni nel tempo di eNO ho pensato di andare ad indagare una loro possibile relazione.
Ho così esaminato, attraverso un test statistico di correlazione
lineare, le variazioni delle misurazioni di eNO (ppm) e le variazioni
della carica virale del virus (log10 copie/ml).
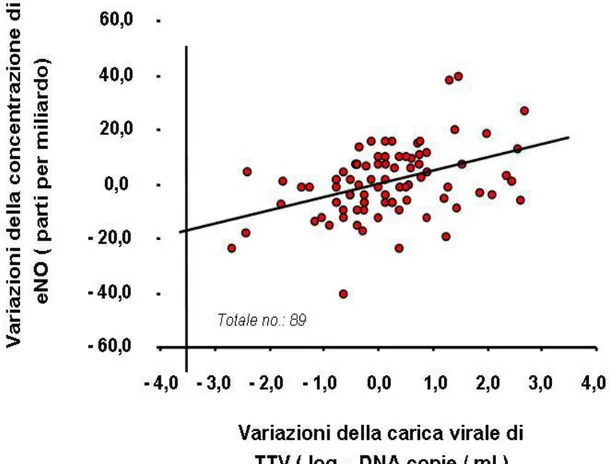
L’analisi ha mostrato l’esistenza di una correlazione positiva tra i parametri suddetti, sia con un test non parametrico (rho di Spearman, r = 0,367 e p = 0,001) che parametrico (coefficiente di correlazione di Pearson, r = 0,378 e p < 0,0001).
Tale relazione è riportata nella figura III.2 dove è rappresentata la
retta di correlazione lineare tra i due parametri da me presi in esame.
La figura mostra come a variazioni maggiori della carica virale di TTV corrispondano variazioni più elevate della concentrazione di eNO.
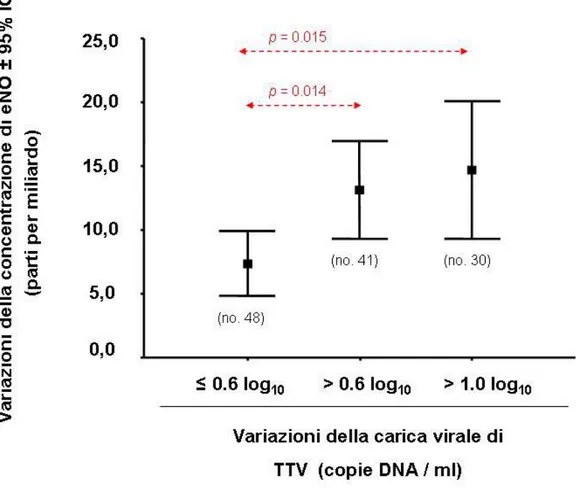
A conferma di questo dato, le variazioni della carica virale di TTV sono state suddivise in 3 categorie, in base alla loro ampiezza: a) variazioni ≤ 0,6 log10 copie/ml: considerate non significative, b)
variazioni > 0,6 log10 copie/ml: considerate significative e c)
ed è stato elaborato un grafico (figura III.3) rispetto alle variazioni della concentrazione di eNO (figura III.3).
Ancora una volta, si osserva l’esistenza di una relazione significativa tra le variazioni di TTV e variazioni di eNO. Infatti variazioni maggiori della carica virale (> 0,6 e > 1,0 log10 copie DNA/ml) correlano con
valori più elevati di variazioni della concentrazione di eNO.
Come mostrato in figura, le differenze osservate mostrano significatività statistica.
Tabella III.4: Numero delle determinazioni e percentuale delle misurazioni di eNO > 20 ppm divise in base al titolo di TTV.
Titoli TTV (log10 copie DNA/ml)
N° determinazioni della carica virale
di TTV (%)
N° determinazioni eNO > 20 ppm (%)
< 6,0 92 (53%) 20 (16%)
Figura III.2: Correlazione tra le variazioni dei titoli di TTV nel fluido nasale e variazioni della concentrazione di eNO nei soggetti con asma.
Figura III.3: Variazioni di eNO e variazioni di TTV. Le variazioni di TTV sono distinte in base alla loro ampiezza.
2.2 DETERMINAZIONE DELLE VARIABILI
CLINICO-TERAPEUTICHE ASSOCIATE ALLE
VARIAZIONI DI eNO
I risultati descritti mi hanno spinto a prendere in esame ulteriori caratteristiche dei soggetti asmatici: dati anamnestici e dati clinici valutati al momento delle visite di controllo, schemi terapeutici e risultati dei test di sensibilizzazione ai vari allergeni (tabella III.4). Ho dunque studiato le relazioni esistenti fra le variazioni della concentrazione di eNO e alcuni parametri ritenuti in grado di influenzarne l’andamento. Essendo infatti noto che molteplici fattori possono influenzare i livelli di eNO ho cercato di comprendere quali di questi fattori avessero un peso maggiore nello studio, e in particolare se le variazioni dei titoli di TTV continuassero ad avere un peso significativo sull’ eNO anche quando veniva valutata l’influenza esercitata da altri fattori. E’ stata così eseguita un’analisi di
regressione lineare multipla grazie alla quale è stato possibile
valutare il contributo di ogni variabile indipendente considerata sulla variabile dipendente eNO.
Le variabili indipendenti prese in esame sono state: gli anni trascorsi dall’inizio della terapia con steroidi, la dose dei farmaci assunti quali steroidi inalati (µg/die), β2-agonisti ad azione ritardata (µg/die) e
monteulkast (mg/die), l’età dei soggetti e la positività ad allergeni stagionali fra cui le graminacee, la parietaria e l’olivo.
I farmaci usati per la terapia, appartenenti alla stessa classe ma con nomi commerciali diversi, sono stati convertiti in dosi equivalenti grazie all’uso di apposite tabelle di conversione. A ciascun allergene è stato attribuito un “peso” diverso a seconda del periodo stagionale così come ricavato dal calendario pollinico elaborato dall’associazione allergologi immunologi territoriali e ospedalieri (AAITO). Si è deciso così di attribuire una scala da 1 a 4 a seconda del periodo di fioritura per quel determinato allergene. Un valore di 1 è stato attribuito ai prelievi effettuati quando lo specifico allergene non risultava essere presente, un valore di 2 quando la stagionalità era bassa, valori di 3 e 4 quando il periodo stagionale dell’allergene era medio o alto. Un valore di 0 è stato attribuito invece quando i soggetti in studio risultavano negativi al test cutaneo per quel determinato allergene.
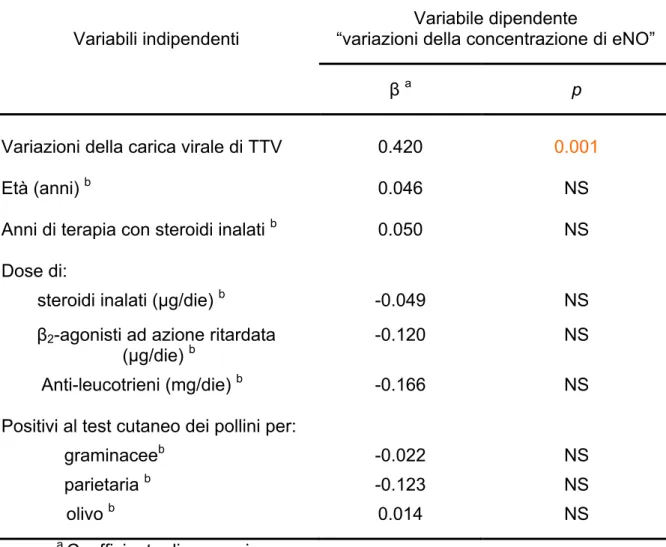
In tabella III.5 osserviamo che tra tutte le variabili studiate soltanto le variazioni della carica virale di TTV influenzavano in maniera positiva le variazioni di concentrazione di eNO, con un coefficiente di regressione β = 0,420 ed una significatività statistica p = 0,001.
Al contrario tutte le altre variabili tra cui la durata della terapia con corticosteroidi, l’età, la somministrazione di farmaci, e la positività ai
test allergologici non apparivano avere un peso significativo all’interno del modello.
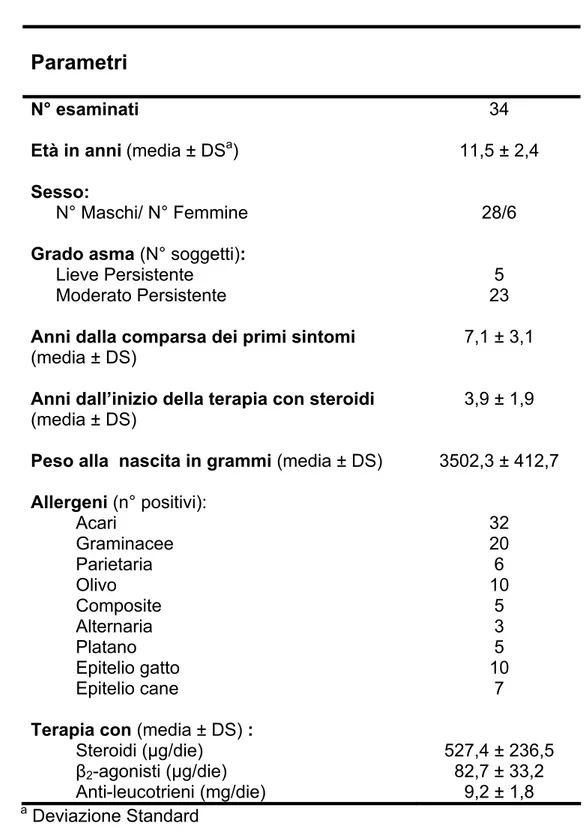
Tabella III.4: Parametri anamnestici, terapeutici e clinici dei soggetti con asma.
a Deviazione Standard
Parametri
N° esaminatiEtà in anni (media ± DSa) Sesso:
N° Maschi/ N° Femmine
Grado asma (N° soggetti): Lieve Persistente
Moderato Persistente
Anni dalla comparsa dei primi sintomi (media ± DS)
Anni dall’inizio della terapia con steroidi (media ± DS)
Peso alla nascita in grammi (media ± DS) Allergeni (n° positivi): Acari Graminacee Parietaria Olivo Composite Alternaria Platano Epitelio gatto Epitelio cane
Terapia con (media ± DS) : Steroidi (µg/die) β2-agonisti (µg/die) Anti-leucotrieni (mg/die) 34 11,5 ± 2,4 28/6 5 23 7,1 ± 3,1 3,9 ± 1,9 3502,3 ± 412,7 32 20 6 10 5 3 5 10 7 527,4 ± 236,5 82,7 ± 33,2 9,2 ± 1,8
Tabella III.5: Regressione lineare multipla fra la variabile dipendente “variazioni della concentrazione di eNO” e 9 variabili indipendenti.
a Coefficiente di regressione.
Variabile dipendente
“variazioni della concentrazione di eNO” Variabili indipendenti
β a p
Variazioni della carica virale di TTV 0.420 0.001
Età (anni) b 0.046 NS
Anni di terapia con steroidi inalati b 0.050 NS Dose di:
steroidi inalati (µg/die) b -0.049 NS
β2-agonisti ad azione ritardata
(µg/die) b
-0.120 NS
Anti-leucotrieni (mg/die) b -0.166 NS
Positivi al test cutaneo dei pollini per:
graminaceeb -0.022 NS
parietaria b -0.123 NS
olivo b 0.014 NS
b Variabili rimosse dall’ultimo modello perchè il valore assunto dalle
loro p non era significativo ( ≥ 0,05).
NS, non significativo, il valore di p delle variabili indipendenti era maggiore o uguale a 0,05 con intervallo di confidenza al 95%.
3. STUDIO NEL TEMPO DI SINGOLI
PAZIENTI
L’esistenza di una relazione positiva tra le variazioni nel tempo della carica virale di TTV e le variazioni nel tempo della concentrazione di eNO, risultata significativa dai test statistici precedentemente descritti, mi ha spinto a svolgere un’analisi più approfondita su singoli pazienti.
Lo studio si è focalizzato su un gruppo di 8 soggetti selezionati perchè avevano almeno 5 determinazioni di eNO e di TTV, compiute in un intervallo di tempo relativamente ampio (da un minimo di 10 mesi nel soggetto A1 e A5 ad un massimo di 21 mesi nel soggetto A8).
Come mostrato nei singoli grafici di seguito riportati, nella maggior parte dei soggetti, appare evidente una netta correlazione fra le variazioni di TTV e le variazioni di NO. Tale correlazione, entro ciascun soggetto, si manteneva costante per tutti o per quasi tutti i punti considerati. In particolare, in 6 degli 8 soggetti (A1, A2, A3, A4, A5 e A7) l’andamento tra le variazioni nel tempo di TTV e le variazioni nel tempo di eNO era pressoché parallelo in tutti i punti presi in esame. In 2 soggetti (A6 e A8) invece la correlazione fra i due parametri non era evidente ma dall’ osservazione dei relativi
grafici risultava, in questi due casi, un andamento particolare dell’infezione da TTV che scompariva transitoriamente per brevi periodi di osservazione.
Per cercare di approfondire lo studio di questa interessante correlazione, ho esaminato alcuni parametri che potevano influenzare questo andamento. Ho quindi determinato in tutti e 8 i soggetti i genogruppi di TTV coinvolti nell’infezione, esaminando tutti i prelievi ottenuti da ciascun soggetto. La distribuzione dei 5 genogruppi è risultata simile a quella osservata nella popolazione generale residente nella stessa area geografica (Maggi et al., 2003; Maggi et al., 2004).
Si è notato, infatti, che i genogruppi più rappresentati sono il genogruppi 1, presente in 5 soggetti, e il genogruppo 3 che nella nostra analisi è risultato essere prevalente (in 7 soggetti); al contrario il genogruppo 2 è risultato essere assente in tutti i soggetti analizzati, mentre per il genogruppo 5 la frequenza risultava appena più elevata rispetto a quella osservata in altre indagini. Non era invece sorprendente l’alta frequenza d’infezioni miste presenti in 5 soggetti, anch’essa in linea con i risultati di precedenti lavori (Maggi et al., 2003a). L’analisi dei genogruppi infettanti ha inoltre dimostrato come gli isolati di TTV rilevati, in ogni paziente al primo prelievo, rimanevano, salvo poche eccezioni, pressoché costanti, escludendo così l’acquisizione di nuove infezioni di TTV.
Questo risultato nega la possibilità che uno o più genogruppi di TTV potessero avere avuto un ruolo importante nell’influenzare l’osservato andamento dell’eNO.
Un altro parametro che è conosciuto influenzare i livelli di eNO nei soggetti con asma è l’infezione con virus respiratori comuni. Per escludere un ruolo importante di questi virus sono andata quindi ad indagare la loro presenza. In particolare è stata investigata l’infezione da: Metapneumovirus, virus respiratorio sinciziale (RSV), virus
Parainfluenzali, Influenza, Adenovirus e Rinovirus, (Stark et al.,
2005).
Lo screening ha rilevato la positività per il virus parainfluenzale di tipo 3 nel soggetto A1, ad una sola data, e 4 prelievi positivi per Rinovirus nei soggetti A3 (3 date positive) e A7 (1 data positiva).
I 4 isolati di Rinovirus sono stati sequenziati e sono risultati appartenere ad isolati diversi.
Poiché in alcune delle date in cui tali soggetti sono risultati positivi alla presenza di questi virus, si osservava anche un parallelo aumento della variazione di eNO, non si può del tutto escludere un ruolo di tali virus nel modulare l’NO. Tuttavia la costante correlazione tra variazioni della carica virale di TTV e variazioni di eNO in tutti i soggetti nelle date successive alla scomparsa dell’infezione dai comuni virus respiratori, suggeriscono un maggior ruolo di TTV nell’andamento dell’eNO.
Inoltre, sopra ogni singolo grafico è riportata la terapia farmacologica assunta ed ogni eventuale variazione della dose somministrata. Come si può osservare l’aumento, la diminuzione, o la completa sospensione dei farmaci usati nella terapia non sembrano influire significativamente sull’andamento dell’eNO e sopratutto non appaiono in grado di modificare il parallelismo nel tempo fra TTV ed eNO.
Fra parentesi, i genogruppi di TTV presenti alle date indicate.
La linea tratteggiata in nero indica la sospensione della terapia farmacologica.
A.1
INFEZIONI CON ALTRI VIRUS
Date prelievi Metapneumo virus RSV Parainfluenza 1 2 3 Influenza A B Adeno virus Rhino virus 15/01/05 26/02/05 16/04/05 11/06/05 17/09/05 29/10/05 – – – – – – ― – – – – – – – – – – – – – – – – – – – + – – – – – – – – – – – – – – – – – – – – – – – – – – – –
Fra parentesi, i genogruppi di TTV presenti alle date indicate.
A.2
INFEZIONI DA ALTRI VIRUS
Date prelievi Metapneumo virus RSV Parainfluenza 1 2 3 Influenza A B Adeno virus Rino Virus 16/09/04 01/12/04 27/01/05 26/02/05 16/04/05 11/06/05 16/07/05 24/09/05 – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – –
Fra parentesi, i genogruppi di TTV presenti alle date indicate.
La linea tratteggiata in nero indica la sospensione della terapia farmacologica.
A.3
INFEZIONI DA ALTRI VIRUS
Date prelievi Metapneumo virus RSV Parainfluenza 1 2 3 Influenza A B Adeno virus Rino Virus 17/01/05 14/02/05 04/04/05 25/05/05 19/09/05 03/11/05 20/02/06 – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – +a – – +b +c – –
a Sequenziato ha dato un’omologia del 97% con l’isolato 99058240. b Sequenziato ha dato un’ omologia del 95% con l’isolato 98128507. c Sequenziato ha dato un’omolgia del 92% con l’isolato PH1001.
Fra parentesi, i genogruppi di TTV presenti alle date indicate.
La linea tratteggiata in nero indica la sospensione della terapia farmacologica.
A.4
INFEZIONI DA ALTRI VIRUS
Date prelievi Metapneumo virus RSV Parainfluenza 1 2 3 Influenza A B Adeno virus Rino virus 26/02/05 02/04/05 25/05/05 08/09/05 07/12/05 25/01/06 09/03/06 – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – –
Fra parentesi, i genogruppi di TTV presenti alle date indicate.
La linea tratteggiata in nero indica la sospensione della terapia farmacologica.
A.5
INFEZIONI DA ALTRI VIRUS
Date prelievi Metapneumo virus RSV Parainfluenza 1 2 3 Influenza A B Adeno virus Rino Virus 26/04/05 25/06/05 27/09/05 20/12/05 02/02/06 – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – +a – –
a Sequenziato ha dato un’omologia del 97% con il Rinovirus di tipo
Fra parentesi, i genogruppi di TTV presenti alle date indicate. La linea tratteggiata in rosso indica assenza dell’infezione da TTV.
A.6
INFEZIONI DA ALTRI VIRUS
Date prelievi Metapneumo virus RSV Parainfluenza 1 2 3 Influenza A B Adeno virus Rino virus 02/04/05 27/05/05 28/09/05 15/11/05 09/03/06 – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – –
Fra parentesi, i genogruppi di TTV presenti alle date indicate.
A.7
INFEZIONI DA ALTRI VIRUS
Date prelievi Metapneumo virus RSV Parainfluenza 1 2 3 Influenza A B Adeno virus Rino virus 17/07/04 20/09/04 23/03/05 28/05/05 02/07/05 17/09/05 29/10/05 – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – +a – – – – –
Fra parentesi, i genogruppi infettanti di TTV alle date indicate.
La linea tratteggiata in nero indica la sospensione della terapia farmacologica. La linea tratteggiata in rosso indica assenza dell’infezione da TTV.
A.8
INFEZIONI DA ALTRI VIRUS
Date prelievi Metapneumo virus RSV Parainfluenza 1 2 3 Influenza A B Adeno virus Rino virus 17/07/04 20/09/04 12/12/04 17/01/05 07/03/05 09/04/05 03/11/05 09/04/06 – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – –