75
RISULTATI
PREPARAZIONE DEGLI SCAFFOLDSUtilizzando la tecnica di wet-spinning, con l’impiego di circa 2,5ml di soluzione polimerica e l’utilizzo di un contenitore di geometria cilindrica contenente il bagno di coagulazione, abbiamo ottenuto scaffolds tridimensionali a base di *PCL e di *PCL caricato con due diversi antibiotici (EF o LF), con altezza di circa 15mm e diametro di circa 16mm (Figura V.1).
Figura V.1 – Immagine della struttura fibrosa tridimensionale degli scaffolds allestiti con tecnica di wet-spinning.
CARATTERIZZAZIONE FISICO-CHIMICA
Gli scaffolds sviluppati sono stati sottoposti a caratterizzazione fisico-chimica per valutare la loro morfologia, l’efficienza di caricamento del processo di fabbricazione e la cinetica di rilascio degli antibiotici in vitro.
MICROSCOPIA ELETTRONICA A SCANSIONE (SEM)
Scaffolds ottenuti con wet-spinning manuale
L’analisi effettuata mediante Microscopia Elettronica a Scansione (SEM) rivela che i supporti tridimensionali presentano una struttura microfibrosa con disposizione casuale delle fibre (Figura V.2 a-i) caratterizzate da un diametro di poche centinaia di μm e pori interfibra con dimensione di circa 100-500μm.
Dall’analisi delle micrografie ad alto ingrandimento (Figura V.2 c,f,i) è risultato che le fibre sono caratterizzate da una morfologia porosa con dimensione
76 dei pori di qualche micrometro che è risultata superiore nel caso di scaffolds caricati con antibiotico.
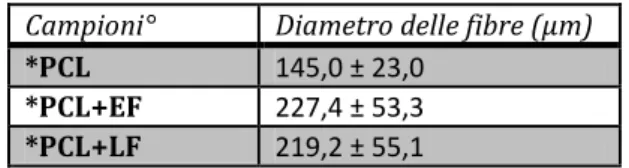
Come riportato in Tabella V.1, gli scaffolds hanno mostrato un diametro delle fibre nel range 100-300 μm. Inoltre gli scaffolds caricati con antibiotico hanno mostrato un diametro delle fibre significativamente superiori rispetto agli scaffolds di riferimento non caricati.
Figura V.2 – Micrografie SEM delle strutture fibrose (a, d, g), delle singole fibre (b, e, h) e della superficie di una singola fibra (c, f, i) ottenute dagli scaffolds allestiti con *PCL189 (a-c), *PCL189+EF (d-f) e *PCL189+ LF (g-i).
Tabella V.1 – Diametro delle fibre che costituiscono gli scaffolds. Campioni° Diametro delle fibre (µm)
*PCL 145,0 ± 23,0
*PCL+EF 227,4 ± 53,3
*PCL+LF 219,2 ± 55,1
77
Scaffolds ottenuti con wet-spinning automatizzato
Le scansioni SEM (Figura V.3) dei supporti in *PCL prodotti mediante wet-spinning automatizzato hanno evidenziato una buona riproducibilità dell’architettura interna degli scaffold e un buon grado di allineamento delle fibre polimeriche. Le fibre polimeriche sono caratterizzate da una morfologia porosa sia sulla superficie esterna che nella sezione trasversale, con dimensione dei pori nella fibra di pochi micrometri. Il diametro delle fibre è risultato essere pari a 246±19 μm e la dimensione dei pori inter-fibra pari a 68±21 (Tabella V.2). Gli scaffolds a base di materiale composito *PCL-HA hanno mostrato una morfologia simile a quella degli
scaffolds a base di *PCL, senza evidenti differenze in termini di allineamento e
porosità delle fibre. Tuttavia, il diametro delle fibre è risultato essere inferiore (194±6 μm) e conseguentemente la dimensione dei pori è risultata essere superiore (99±8 μm).
Tabella V.2 – Diametro delle fibre e dimensione dei pori degli scaffolds in *PCL e *PCL-HA ottenuti con tecnica automatizzata
Campioni° Diametro delle fibre (µm) Dimensione dei pori (µm)
*PCL 246 ± 19 68 ± 21
*PCL-HA 194 ± 6 99 ± 8
°dati espressi come media ± deviazione standard
*PCL189 -HA
*PCL189
Figura V.3 – Micrografie SEM di scaffolds prodotti mediante wet-spinning automatizzato (superficie superiore e sezione trasversale).
78 VALUTAZIONE DEL CARICAMENTO
Gli scaffolds caricati con EF e con LF nelle due diverse concentrazioni (0,1% e 0,2% w/v) sono stati sottoposti ad analisi di efficacia di caricamento valutando la percentuale sia del farmaco effettivamente caricato nelle fibre, sia di quello presente nel bagno di coagulazione alla fine del processo.
La procedura sviluppata per la valutazione del caricamento mediante tecnica HPLC ci ha permesso di valutare che la maggior parte dell’antibiotico aggiunto alla soluzione polimerica (circa il 65-70%) risulta disciolta nel bagno di coagulazione. Una percentuale di circa il 30%, in funzione del tipo di antibiotico e della sua concentrazione nella soluzione (Tabella V.3), risulta invece effettivamente caricata nelle fibre dello scaffold.
Osservando, inoltre, i dati riportati in Tabella V.3 abbiamo notato che un aumento della concentrazione del farmaco caricato nella soluzione si riflette in un aumento della percentuale effettivamente caricata nelle fibre (dal 18,2% al 23,1% per EF, dal 22,5% al 26,3% per LF).
Tabella V.3- Dati di Efficienza di caricamento.
CINETICA DI RILASCIO IN VITRO
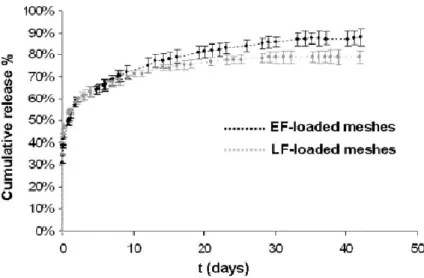
La cinetica di rilascio dagli scaffolds di entrambi i farmaci, EF e LF (0,2% w/v nella soluzione di partenza), è stata valutata su campioni mantenuti in PBS (pH 7,4 a 37°C) in agitazione costante per circa sei settimane.
Come mostrato in Figura V.4 e V.5, le due tipologie di scaffolds hanno mostrato un profilo di rilascio analogo, caratterizzato da un rilascio veloce nelle prime 24h, fino a raggiungere circa il 50% del farmaco caricato nelle fibre, seguito
Tipo di antibiotico e
concentrazione° Efficenza di caricamento%
EF (0,1% w/v) 18,2 ± 3,1
EF (0,2% w/v) 23,1 ± 1,7
LF (0,1% w/v) 22,5 ± 5,6
LF (0,2% w/v) 26,3 ± 7,4
79 da una progressiva diminuzione della velocità di rilascio che diventa poi costante attorno alle 400 ore e rimane stabile fino a circa 700 ore.
Il rilascio percentuale di farmaco alla fine del test (circa 6 settimane), quando la velocità di rilascio era approssimativamente nulla, è stato di circa 88% (circa 845µg) per gli scaffolds caricati con EF e di circa 79% (circa 857µg) per gli
scaffolds caricati con LF.
Figura V.4 – Curve di rilascio cumulativo dei farmaci (EF=blu, a sinistra; LF=rosso, a destra) in vitro (PBS Ix, pH 7,4, 37°C).
Figura V.5 - Rilascio cumulativo percentuale di EF e LF dagli scaffolds durante le prove di rilascio in vitro (PBS Ix, pH 7,4, 37°C). La barra di errore corrisponde a ± la deviazione standard calcolata su misure effettuate su tre replicati.
80
PROVE DI BIOCOMPATIBILITA’ IN VITRO
La biocompatibilità in vitro degli scaffolds preparati e’ stata investigata utilizzando la linea di pre-osteoblasti murini MC3T3-E1. Le prove sono state condotte su strutture fibrose in *PCL189 non caricate con farmaci, effettuando saggi
di vitalità, adesione e morfologia per mezzo di test biochimici e valutazioni colorimetriche a intervalli di tempo di 7 e 14 giorni.
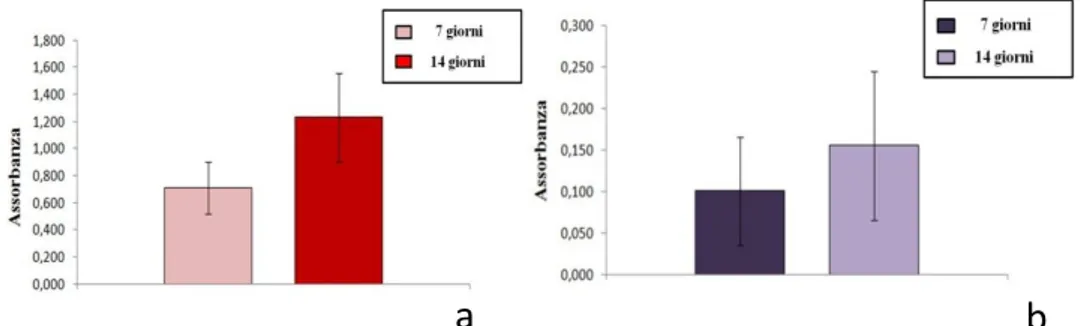
La vitalità e proliferazione cellulare sono state valutate con il test di citotossità WST-1 sia per contatto diretto sia per adesione e proliferazione. Dal rilievo dell’assorbanza del formazano solubile, derivante dalla riduzione enzimatica dei sali di tetrazolio, sono stati elaborati i grafici riportati in Figura V.6.
Dai valori rilevati a 7 e 14 giorni nel saggio per contatto diretto (CD) risulta evidente un incremento della quota di formazano solubile (Figura V.6a) correlato all’aumento di cellule metabolicamente attive presenti in coltura e indicante l’assenza di rilascio di componenti citotossiche da parte dello scaffold.
Figura V.6 – Grafici dell’assorbanza del formazano solubile nel test WST-1 nei due saggi condotti (a) per contatto diretto (CD), b) per adesione e proliferazione(AP)). I dati sono espressi in media ± la deviazione standard.
Considerando il test di adesione e proliferazione (Figura V.6b) i dati evidenziano come ci sia un netto incremento dell’assorbanza del formazano a 14 giorni, indice di aumento del numero di cellule metabolicamente attive presenti in coltura e della capacità dello scaffold di sostenere e promuovere l’adesione e proliferazione dei pre-osteoblasti murini.
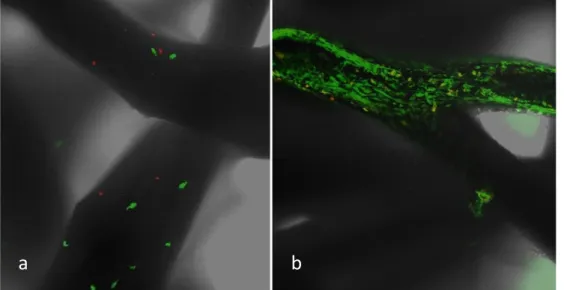
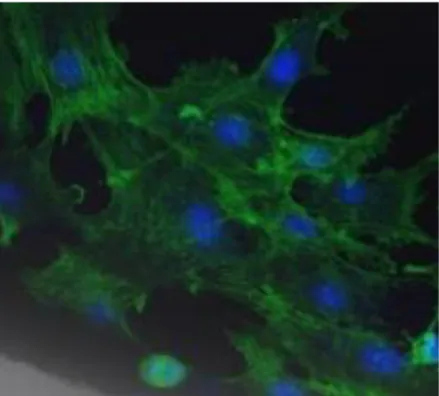
81 Il test colorimetrico Live/dead, che discrimina le cellule vitali da quella non-vitali conferendo loro, rispettivamente, una colorazione rossa o verde fluorescente, eseguito a 7 e 14 giorni e valutato mediante microscopia confocale a scansione laser (CLSM) ha evidenziato un aumento delle cellule vitali col passare del tempo di osservazione (Figura V.7a e V.7b), confermando i dati ottenuti dal saggio del WST-1.
Figura V.7 – Test di vitalità cellulare Live/dead, in verde fluorescente sono evidenziate le cellule vitali, in rosso le cellule morte. a) campione a 7 giorni; b) campione a 14 giorni.
L’immagine a 7 giorni (Figura V.7a) mostra un numero di cellule con fluorescenza verde relativamente basso, con un altrettanto scarso numero di cellule non vitali (rosse). L’immagine a 14 giorni (Figura V.7b) mostra, al contrario, un notevole aumento del numero di cellule vitali aderenti alla struttura, associate ad uno scarso numero di cellule morte a conferma di quanto evidenziato dal test biochimico WST-1.
Il test colorimetrico con blu di Toluidina è stato condotto per valutare la distribuzione spaziale delle cellule sulla struttura fibrosa degli scaffolds (Figura V.8a
e V.8b). Sebbene l’architettura della struttura, caratterizzata da scarsa trasparenza
delle fibre, determini un contrasto tale da determinare una bassa risoluzione microscopica della componente cellulare, e non consentendo quindi uno studio attento della citomorfologia, questo test colorimetrico ci ha comunque permesso di osservare come a 7 giorni (Figura V.8a) sia presente un certo numero di cellule
82 adese che, col passare dei giorni (Figura V.8b) tende a proliferare ricoprendo maggiormente le fibre.
Figura V.8 – Test citochimico con Blu di Toluidina. a) campione a 7 giorni; b) campione a 14 giorni. La barra corrisponde a 100µm ed è applicabile a entrambe le immagini.
Un’analisi più approfondita della diffusione delle cellule sulle fibre e della loro morfologia è stata ottenuta col la marcatura fluorescente DAPI/Falloidina-Alexa 488 e microscopia confocale a scansione laser. Evidenziando in blu il nucleo e in verde fluorescente il citoscheletro, questo test ci ha permesso di osservare come a 7 giorni (Figura V.9a) siano presenti cellule aderenti alle fibre con morfologia e distribuzione coerenti con uno stato di vitalità cellulare. Le cellule, inoltre, non presentano una distribuzione uniforme lungo le fibre ma si raggruppano in colonie in tratti discreti delle fibre. La maggior parte di esse mostra una morfologia allungata con numerose estroflessioni della membrana citoplasmatica indicanti la tendenza a proliferare e adattarsi alla struttura tridimensionale.
Figura V.9 – Analisi citochimica con CLSM mediante colorazione con DAPI/Falloidina-Alexa 188 (blu= nuclei; verde= citoplasma). La barra corrisponde ad una lunghezza di 200µm ed è applicabile ad entrambe le
immagini.
a
b
83 L’immagine a 14 giorni (Figura V.9b) mostra un’importante aumento del numero di cellule rispetto a quella a 7 giorni, a conferma dell’intensa proliferazione. Inoltre, nei punti di contatto tra le fibre (Figura V.9b, frecce) le cellule sembrano ammassarsi maggiormente. Microfotografie ottenute a più alto ingrandimento (Figura V.10), da sezioni casuali del supporto fibroso, mostrano come, in certi punti, la fibra risulti quasi totalmente ricoperta da uno strato di cellule caratterizzate da connessioni intercellulari con colorazione fluorescente più intensa proveniente da filamenti di actina di singoli elementi. In certi casi, a livello dei punti di contatto interfibra, si osservano ponti cellulari tesi tra fibre vicine e indicanti la riorganizzazione tridimensionale della coltura cellulare.
Figura V.10 – Microfotografia a 20X della coltura cellulare MC3T3 a 14 giorni (CLSM con DAPI/Falloidina-Alexa 188). L’immagine mostra una maggior intensità del colore verde tra cellule più vicine ad indicazione di un
84
SPERIMENTAZIONE IN VIVO
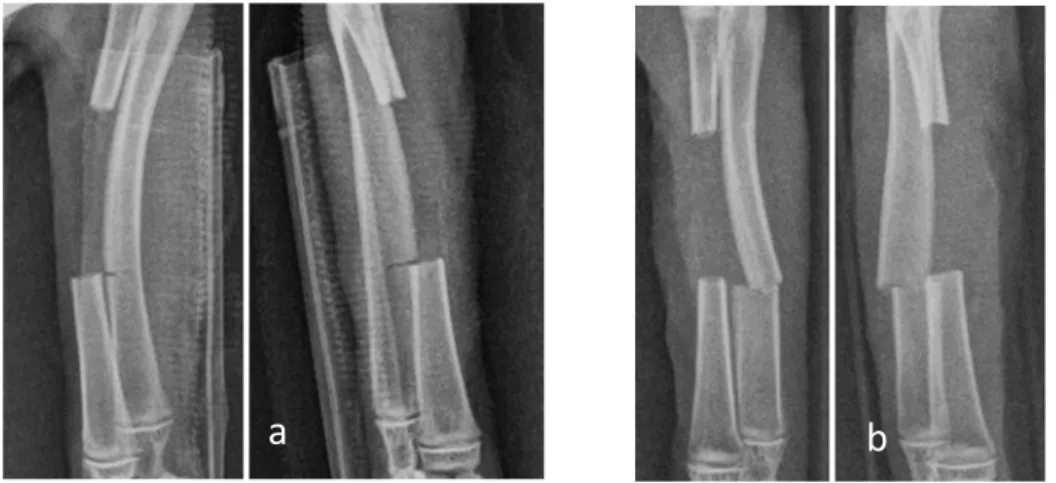
La tecnica di intervento prescelta si è presentata facilmente eseguibile con tempi medi di intervento di 24±7 minuti. In un solo soggetto la procedura è stata complicata dalla errata protezione dell’ulna che è stata incisa nella sua corticale, evidente al controllo radiografico post-operatorio (Figura V.11a), con, conseguente, perdita della continuità dell’osso a 5 giorni dall’intervento e mobilizzazione dell’impianto (Figura V.11b). Tale soggetto è stato escluso dallo studio e trattato con osteosintesi di radio e ulna.
Figura V.11 – Immagini radiografiche frattura iatrogena ulna (a – operatorie, b - 5 giorni
post-operatorie).
Il recupero funzionale dell’arto trattato è stato piuttosto rapido, tutti i soggetti hanno riacquistato la stazione quadrupedale durante il risveglio dall’anestesia, con carico dell’arto trattato inizialmente differenziato (primi 3-4 giorni) poi completo a 10 giorni dall’osteotomia (Figura V.12).
a
b
a
b
Figura V.12 – Immagini del recupero funzionale post-operatorio dell’arto trattato. a) a 7 giorni dalla chirurgia; b) a 15 giorni dall’impianto.
85 Un solo soggetto ha presentato segni di disconfort nelle prime 24 ore post-operatorie, con segni di intolleranza alla fasciatura che si è rimosso. Erano inoltre presenti segni di parestesia con appoggio sul margine dorsale delle falangi e l’animale si lambiva e autotraumatizzava la parte distale dell’arto, causando la mutilazione della prima falange del 3° dito. La neuropatia all’origine di tale sintomatologia è stata imputata a edema del nervo radilale in seguito all’esecuzione del blocco nervoso loco-regionale eseguito in associazione all’anestesia generale ed è stata prontamente trattata mediante terapia anti-edemigena sistemica (metilprednisolone emisuccinato, 1mg/kg sottocute q12h per 4 giorni, poi q24h per altri 4 giorni), curettage chirurgico e medicazioni giornaliere della ferita con soluzione topica spray di ossitetraciclina. Il recupero funzionale dopo tale trattamento è stato rapido, con carico corretto sull’arto. Per tale motivo il soggetto non è stato escluso dallo studio.
Nei quindici giorni successivi all’inserimento dell’impianto, durante ogni pulizia della gabbie di stabulazione, i soggetti sono stati monitorati per produzione di feci e urine, consumo regolare di acqua e cibo, presenza o meno di segni di stress (assenza di grooming, depressione del sensorio e altro). Per quanto riguarda tali parametri tutti i soggetti hanno presentato un regolare recupero della funzione emuntoria con recupero regolare della produzione di feci e urina nelle 24 ore dopo l’intervento. In nessun caso si è osservata diarrea o anoressia e il consumo di acqua e cibo è stato regolare per ogni animale per tutto il periodo di osservazione. Questo dato è stato confermato anche dall’incremento ponderale valutato in ogni soggetto durante ogni indagine radiografica a intervalli di 4, 8 o 12 settimane e prima di ogni espianto. L’aumento di peso medio rilevato dopo 4 settimane è risultato essere 0,61± 0,34 kg, dopo 8 settimane di 1,04±0,29 kg, dopo 12 settimane di 1,10±0,54 kg.
86 VALUTAZIONI RADIOGRAFICHE
Le osservazioni radiologiche condotte subito dopo l’impianto degli scaffolds hanno permesso di valutare la correttezza della procedura eseguita, confermando in tutti i casi la perfetta radiotrasparenza dei due tipi di scaffolds applicati. Dalle misurazioni radiologiche condotte con software Microdicom è emerso che le osteotomie eseguite sono state di circa 20mm (20,73±0,89).
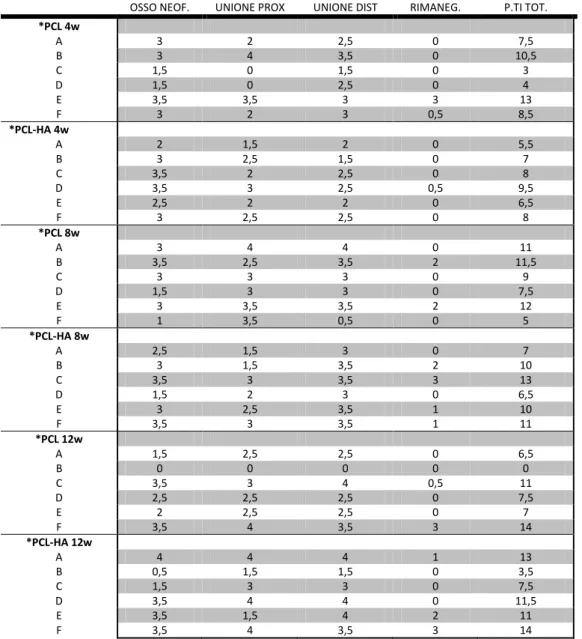
I risultati ottenuti dalla valutazione a punteggi applicata sulle immagini radiografiche effettuate al momento dell’espianto sono presentati in Tabella V.4. Il punteggio massimo attribuibile, secondo il sistema di scoring utilizzato, era di 16 punti.
OSSO NEOF. UNIONE PROX UNIONE DIST RIMANEG. P.TI TOT.
*PCL 4w A 3 2 2,5 0 7,5 B 3 4 3,5 0 10,5 C 1,5 0 1,5 0 3 D 1,5 0 2,5 0 4 E 3,5 3,5 3 3 13 F 3 2 3 0,5 8,5 *PCL-HA 4w A 2 1,5 2 0 5,5 B 3 2,5 1,5 0 7 C 3,5 2 2,5 0 8 D 3,5 3 2,5 0,5 9,5 E 2,5 2 2 0 6,5 F 3 2,5 2,5 0 8 *PCL 8w A 3 4 4 0 11 B 3,5 2,5 3,5 2 11,5 C 3 3 3 0 9 D 1,5 3 3 0 7,5 E 3 3,5 3,5 2 12 F 1 3,5 0,5 0 5 *PCL-HA 8w A 2,5 1,5 3 0 7 B 3 1,5 3,5 2 10 C 3,5 3 3,5 3 13 D 1,5 2 3 0 6,5 E 3 2,5 3,5 1 10 F 3,5 3 3,5 1 11 *PCL 12w A 1,5 2,5 2,5 0 6,5 B 0 0 0 0 0 C 3,5 3 4 0,5 11 D 2,5 2,5 2,5 0 7,5 E 2 2,5 2,5 0 7 F 3,5 4 3,5 3 14 *PCL-HA 12w A 4 4 4 1 13 B 0,5 1,5 1,5 0 3,5 C 1,5 3 3 0 7,5 D 3,5 4 4 0 11,5 E 3,5 1,5 4 2 11 F 3,5 4 3,5 3 14
87 Dall’analisi di tali dati è emerso come lo score totale medio ottenuto dal gruppo *PCL 4w sia 7,75± 3,8. Considerando i parametri di maggior interesse ai fini dello studio è emerso che 2 animali hanno presentato copertura ossea compresa tra 25 e 50%; 3 copertura tra 50 e 75%, un solo soggetto presentava copertura pressoché totale già dopo 4 settimane. Segni di rimodellamento con presenza di un abbozzo di canale midollare sono stati osservati in un solo soggetto mentre, nei restanti 5 non è stato evidenziato alcun segno di rimodellamento.
Il gruppo *PCL-HA 4w ha mostrato un punteggio radiologico di rigenerazione di 7,41±1,39. Un soggetto ha presentato tessuto neoformato a copertura dello
scaffold per il 25-50%, per 3 animali la copertura è stata compresa tra 50 e 75%, per
2 casi la copertura di presentava pressoché completa (75-100%). In nessun soggetto inserito in questo gruppo sono stati osservati segni di rimaneggiamento osseo.
Il gruppo *PCL 8w ha totalizzato uno scoring di rigenerazione medio di 9,33±2,71. Il tessuto neoformato è stato giudicato compreso tra 50 e 75% in 3 animali, 1 solo coniglio ha presentato copertura giudicata maggiore del 75%, un soggetto l’ha presentata scarsa o assente (minore del 25%) e l’ultimo compresa tra 25 e 50%. Il rimaneggiamento è stato giudicato assente in 4 animali e appena accennato in altri 2.
Per il gruppo *PCL-HA 8w lo scoring medio è stato 9,58±2,45. Per 3 conigli la neoformazione di tessuto è stata giudicata tra 50 e 75%, per 2 maggiore del 75%, per 1 compresa tra 25 e 50%. Il rimodellamento è stato giudicato assente per 4 soggetti, accennato per 1 e con evidenza di un abbozzo di canale midollare per un altro.
Lo scoring radiologico medio di rigenerazione calcolato per il gruppo *PCL 12w è 7,66±4,72. L’osso neoformato copriva in 2 casi la guida in maniera quasi completa, in 2 casi per il 25-50%, un caso presenta copertura inferiore al 25% e un altro copertura buona (50-75%). Il rimodellamento è stato giudicato discreto con evidenziazione del canale midollare solo in un caso, mentre nei restanti 5 è stato giudicato assente.
88 Per l’ultimo gruppo di studio identificato con la sigla *PCL-HA 12w, lo scoring medio di rigenerazione è stato di 10,08±3,92. In questo gruppo 4 animali hanno presentato copertura pressoché completa della guida, per i restanti 2 animali: 1 ha avuto rigenerazione scarsa, il secondo giudicata tra 25 e 50%. Nessun soggetto di questo gruppo ha presentato segni di formazione di corticali ben distinguibili, un soggetto presentava evidente formazione di un canale midollare, in un altro quest’ultimo era appena accennato, in 4 animali non sono stati evidenziati segni di riorganizzazione.
I dati ottenuti dalla nostra sperimentazione in vivo, riguardanti la capacità rigenerativa degli scaffolds valutata con scoring radiologico, sono stati confrontati con quelli raccolti da numerosi autori sulle capacità rigenerative di lesioni critiche (>15 mm) non sottoposte a trattamento (Hedberg et al., 2005; Bodde et al., 2007; Kasten et al., 2008; Liu et al., 2009; Niemeyer et al., 2010;Wang et al., 2010). Le analisi statistiche condotte su tali dati, i cui valori sono riportati in Tabella V.5, mostrano una rigenerazione significativamente maggiore (p<0,05) nei soggetti trattati con *PCL e *PCL-HA rispetto ai non trattati.
*PCL *PCL-HA Controllo
4 Settimane 7,75±3,80 7,41±1,39 0,67±0,52A
8 Settimane 9,33±2,71 9,58±2,45 0,83±0,41A
12 Settimane 7,66±4,72 10,08±3,91 1,17±0,41A
Dati espressi come media±deviazione standard
Tabella V.5–. Punteggi radiologici di rigenerazione nei vari gruppi, ai vari intervalli di tempo. I dati sono espressi come valori medi±deviazione standard. I dati dei gruppi di controllo sono stati estrapolati da Hedberg et al., 2005; Bodde et al., 2007; Kasten et al., 2008; Liu et al., 2009; Niemeyer et al., 2010; Wang et al., 2010. A Dati con differenza statisticamente significativa (p-Value ANOVA <0,05) rispetto a quelli dei gruppi *PCL e *PCL-HA.
Confrontando i dati ottenuti dai due tipi di impianti studiati, ai vari intervalli di osservazione, emerge come non esista una differenza statisticamente significativa tra i due scaffolds (p>0,05) né considerando lo scoring totale, né quello di tessuto osseo neoformato e rimaneggiamento presi singolarmente.
Un’ulteriore valutazione è stata condotta andando a giudicare l’evoluzione del processo rigenerativo col passare del tempo di osservazione per uno stesso
89 soggetto. Tali dati sono stati estrapolati dagli animali appartenenti ai gruppi osservati per 8 e 12 settimane.
Per quei soggetti che hanno presentato uno scoring elevato di rigenerazione già alla 4° settimana di osservazione, il processo rigenerativo col passare delle settimane è progredito verso un rimaneggiamento piuttosto che verso una ulteriore espansione dell’osso neoformato sullo scaffold (Figura V.13).
Nei casi in cui, il punteggio radiografico calcolato, metteva in evidenza un rigenerazione di media o scarsa entità, al pari dei precedenti, il trascorrere delle settimane non ha indotto una progressione del processo rigenerativo (Figura V.14
eV.15).
L’analisi delle immagini radiografiche ha permesso, inoltre, di rilevare in quasi tutti i soggetti trattati, anche in quelli classificati con scoring radiologico basso, la presenza di una maggior rigenerazione ossea sul versante laterale dello
scaffold (Figura V.16).
4 sett. 8 sett. 12 sett.
*P C L *P C L-HA
Figura V.13 - Immagini radiografiche dell’evoluzione del processo rigenerativo ai vari intervalli di tempo considerati con i 2 diversi tipi di impianto.
90 *PCL-HA 8 sett.
*PCL-HA 4 sett.
*PCL 8 sett.
*PCL 12 sett.
Figura V.14 – Immagini radiografiche di soggetto con scoring radiografico medio a 8 e 12 settimane dall’impianto.
Figura V.15 – Immagini radiografiche di soggetto con scoring radiologico basso indicanti l’evoluzione del processo rigenerativo.
91 *P C L189 -HA *P C L189
a
b
c
d
e
f
Figura V.16 – Immagini radiografiche con evidenza di rigenerazione sul versante laterale dello scaffold. a-b) soggetti *PCL con scoring alto appartenenti ai gruppi 12 e 8w; c) soggetto *PCL 12 w con scoring modesto; d-e) soggetti *PCL-HA con scoring alto appartenenti ai gruppi 12 e 8w; f) soggetto *PCL–HA 12 w con scoring scarso.
92 VALUTAZIONI MACROSCOPICHE ESPIANTO
Durante la fase di espianto tutti i campioni sono stati sottoposti ad una serie di valutazioni miranti a rilevare la presenza di reazione infiammatoria evidente peri-impianto, l’aderenza o meno ai tessuti molli circostanti lo scaffold, la copertura o meno della struttura fibrosa e il grado di cedevolezza al tatto delle fibre macroscopicamente evidenti. Il punteggio massimo totalizzabile con la tabella di scoring elaborata è stato di 12 punti.
Tabella V.6 – Scoring valutazione macroscopica espianto nei diversi gruppi di osservazione (nel punteggio totale sono considerati anche i punteggi massimi ottenuti per assenza di infiammazione e di adesione ai
tessuti molli vicini).
ESPOS fibre.
CEDIM al tatto
PUNTI TOT. ESPOS
fibre. CEDIM al tatto PUNTI TOT. *PCL 4w *PCL-HA 4w A 3 3 11 A 2 1 9 B 2 2 10 B 2 3 11 C 1 2 9 C 1 3 10 D 1 2 9 D 2,5 2 10,5 E 1 1 8 E 0,5 2 8,5 F 1,5 2 9,5 F 1,5 2 9,5 *PCL 8w *PCL-HA 8w A 2 2 10 A 1 1 8 B 2 0 8 B 1 2 9 C 2 3 11 C 2 2 9 D 2 2 10 D 1 0 7 E 2 3 11 E 1,5 0,5 8 F 0 0 5 F 2 2 10 *PCL 12w *PCL-HA 12w A 0 0 6 A 1 1 8 B 0 0 6 B 2 0 8 C 2 2 10 C 2 0,5 8,5 D 2 0,5 8,5 D 1,5 3 10,5 E 2 1 9 E 3 3 12 F 1 1 8 F 2 3 11
93 I dati ottenuti hanno messo in evidenza come in nessun campione sia stata rilevata presenza di segni di reazione infiammatoria macroscopicamente evidente a carico dei tessuti limitrofi all’impianto (score massimo 3 punti). Per tutti i campioni, inoltre, l’esaminatore ha evidenziato assenza di adesione ai tessuti molli viciniori e presenza di una sottile “pellicola” translucida avvolgente l’impianto a formare un manicotto (score massimo 3 punti).
I dati riguardanti copertura delle fibre e grado di cedevolezza delle stesse al tatto hanno presentato maggior variabilità e sono schematicamente riportati in
Tabella V.6.
La valutazione macroscopica media ottenuta dal gruppo *PCL 4w è stata di 9,4±1,02 e la maggior parte dei soggetti (5/6) ha presentato un grado lieve di cedevolezza al tatto, mentre in un caso la fibra si presentava di consistenza solida simile all’osso e in un altro la cedevolezza è stata giudicata notevole.
Il gruppo *PCL-HA 4w ha riportato uno score medio di 9,75±0,93. Anche per questo gruppo in un solo caso la cedevolezza è stata giudicata particolarmente importante, mentre 2 casi presentavano consistenza solida ala pari dell’osso sano.
Il punteggio medio riportato dal gruppo *PCL 8w è stato di 9,16±2,31. Considerando il parametro di cedevolezza al tatto 2 sono stati giudicati solidi, 2 con cedevolezza lieve e 2 totalmente cedevoli con fibre mobili al tatto.
Nel gruppo *PCL-HA 8w è stato registrato un punteggio medio pari a 8,5±1,05. Nessun coniglio inserito in questo gruppo ha presentato consistenza solida, in 3 casi è stata giudicata lieve, in 2 abbondante e in uno totale.
Lo scoring medio del gruppo *PCL 12w è stato di 7,91±1,62. La cedevolezza è stata considerata lieve in un solo caso, nei restanti 5 è stata rilevata abbondante (3 casi) o completa.
Per il gruppo *PCL-HA 12w lo scoring medio ottenuto è stato di 9,66±1,72 ed hanno ottenuto un punteggio massimo con consistenza solida 3 campioni, mentre per i restanti è stato rilevato un abbondante o totale grado di cedevolezza alla digitopressione esercitata sulle fibre.
94 Per quanto riguarda gli scoring ottenuti dai singoli gruppi il test ANOVA a una via e ha messo in evidenza l’assenza di una differenza significativa tra i vari gruppi.
Le osservazioni macroscopiche degli espianti hanno permesso di rilevare quanto osservato anche radiologicamente, ovvero, la presenza di una zona di rigenerazione più abbondante sul margine laterale dello scaffold, vicina all’ulna (Figura V.17).
Figura V.17 – Particolare di espianto. La freccia indica l’osso neoformato a coprire parzialmente, sul versante laterale, lo scaffold.
95 VALUTAZIONI ISTOPATOLOGICHE
Lo studio dei preparati istologici, secondo i tre livelli di sezione, ha confermato in tutti i gruppi quanto osservato mediante indagine radiografica.
Nei campioni che hanno ottenuto uno scoring radiologico elevato, si osserva la presenza di tessuto osseo neoformato che non invade mai completamente lo
scaffold, rimanendo confinato sul versante laterale dello scaffold (in prossimità
dell’ulna). Tale tessuto osseo presenta caratteri di rimaneggiamento indicati dalla presenza di un canale midollare delimitato da una corticale ben definita. (Figura
V.8).
Il tessuto osseo di nuova formazione, sia lamellare che intrecciato, si spinge tra le fibre della struttura tridimensionale dello scaffold (Figure V.19a e V.19b), entrando in stretto contatto con esse.
a
b
Figura V.19 - Particolari a ingrandimento di 4X e 10X dell’immagine di Figura 8a indicanti la presenza di osso neoformato tra le fibre dello scaffold (a) e la contemporanea presenza di osso lamellare e intrecciato (b).
(EE, le frecce gialle indicano le fibre e le frecce verdi il tessuto osseo neoformato).
a
b
ulna
Figura V.18 – Immagini dei preparati istologici da sezione trasversale (a) e longitudinale (b). La freccia gialla indica le fibre dello scaffold, la freccia blu indica la cavità midollare neoformata. (EE: 2.5X (a), 4X (b)).
96 Per gli espianti che radiologicamente non hanno evidenziato segni di riorganizzazione con formazione del canale midollare, le analisi istologiche hanno, comunque, confermato la formazione di tessuto osseo neoformato che, disponendosi attorno alle fibre, ha creato una struttura speculare allo scaffold, rendendo visibile la struttura a celle anche radiograficamente (Figura V.20a-c).
Nei campioni classificati radiologicamente con un punteggio intermedio, la presenza di tessuto osseo neoformato è stata evidenziata come un ponte teso tra radio e ulna ed entro le fibre a contatto col moncone del radio, con accrescimento definito “a sole raggiante” (Figure V.21a e V.21b). Come per i casi con alto grading di rigenerazione, il tessuto neoformato si presenta sia lamellare che intrecciato (Figure V.21c e V.21d). La colorazione tricromica di Mallory ha confermato quanto
a
b
c
Figura V.20 – (a) Immagine radiografica a forte ingrandimento. Il tessuto neoformato attorno alle fibre dello scaffold ha permesso l’evidenziazione della conformazione a celle della struttura tridimensionale. (b e c) Sezioni istologiche che confermano l’immagine radiologica (a). Presenza di tessuto neoformato (tessuto connettivo fibroso e tessuto osseo) tra le fibre dello scaffold. (a- Rosso Congo, 2.5X, b- tricromica di Mallory, 2,5X). La freccia nera vuota indica la matrice osteoide fra le fibre.
97 sin ora affermato dalle valutazioni condotte con colorazione con EE permettendo, grazie alla colorazione in azzurro del tessuto connettivo collageno, di evidenziare le zone di transizione tra osso neoformato e tessuto connettivo eventualmente presente tra le fibre dello scaffold (Figure V.22a e V.22b).
ulna scaffold
*
b aa
c
d
b
Ulna Ulna radioFigura V.21 – a) Immagine con presenza di un ponte di tessuto tra ulna e scaffold (freccia nera vuota). (EE, 1X) b) Particolare con evidenza di tessuto neoformato a raggiera sul moncone del radio e scaffold (freccia nera vuota).(EE, 2.5X) c) particolare a maggior ingrandimento delle immagini precedenti: la freccia verde vuota indica il tessuto osseo neoformato intrecciato, mentre la freccia verde piena indica il tessuto osseo neoformato lamellare.(EE, 10X) d) Ulteriore ingrandimento delle immagini precedenti, la freccia verde vuota indica il tessuto intrecciato mentre la freccia verde piena indica quello lamellare.(EE, 25X).
Figura V.22 – Tricromica di Mallory 2.5X (a); 10X (b). Le immagini mostrano il tessuto neoformato tra le fibre dello scaffold. Nell’immagine a sinistra (a) il tessuto è in prossimità dell’ulna e si spinge tra le fibre (frecce gialle) per i primi 6-8 strati (frecce verdi). L’immagine a destra (b) mostra un particolare a maggior ingrandimento con tessuto osseo neoformato che sostituisce il tessuto fibroso (*).
98 Nei campioni che radiologicamente hanno ottenuto un punteggio basso di rigenerazione ossea i preparati istologici esaminati hanno evidenziato l’assenza di banda di rigenerazione a partenza dell’ulna e scaffolds per lo più infiltrati da tessuto connettivo (Figura V.23).
Da un attento esame del tessuto neoformato all’interno degli scaffolds con basso scoring, è stata evidenziata la presenza di aree focali di reazione infiammatoria intorno alle fibre (Figura V.24a) con infiltrato infiammatorio mononucleato (Figura V.24b). La colorazione tricromica ha evidenziato, talora, la presenza di tessuto di granulazione (Figura V.24c) e di tessuto connettivo fibroso (Figura V.24d). E’ stata inoltre osservata una infiltrazione di tessuto adiposo ed uno stretto rapporto tra le fibre dello scaffold ed il tessuto muscolare scheletrico periferico (Figure V.24e e V.24f).
ulna radio
scaffold
Figura V.23 – Colorazione EE 1X. L’immagine mostra in sezione longitudinale la scarsa presenza di tessuto in rigenerazione sullo scaffold a contatto con il moncone del radio.
99
b
a
c
d
e
f
*
Figura V.24 – Particolari dei reperti con basso scoring radiologico di rigenerazione. a) presenza di focolai di infiltrato infiammatorio (frecce rosse) nel tessuto connettivo fibroso tra le fibre. EE, 10X: b) particolare dell’immagine precedente che evidenzia la presenza di infiltrato infiammatorio mononucleato. EE, 25X c) compenetrazione tra le fibre di tessuto di granulazione (*) con presenza di abbondanti vasi neoformati (frecce gialle vuote) Tricromica di Mallory, 10X d) abbondante tessuto connettivo fibroso (freccia arancio vuota). Tricromica di Mallory, 10X e) la freccia bordeaux indica la stretta compenetrazione tra scaffold e tessuto muscolare scheletrico. Tricromica di Mallory, 10X. f) L’immagine mostra la presenza di tessuto adiposo in piccole e rare zone (freccia fucsia), Tricromica di Mallory, 10X.