3
PARTE GENERALE
4 1.1 Aspetti generali
La leishmaniosi canina è sostenuta da un protozoo flagellato, la Leishmania infantum, ed è trasmessa da artropodi del genere Phlebotomus (Phlebotomus perfiliewi, pernicious e major).
La malattia è endemica nel bacino del Mediterraneo e in Italia è maggiormente diffusa lungo le zone costiere e nelle isole, anche se sono presenti focolai in alcune zone circoscritte dell’entroterra (Ferroglio et al., 2005).
I protozoi del genere Leishmania sono parassiti intracellulari della linea monocita/macrofagica.
Il cane rappresenta il serbatoio principale e l’ospite naturale di Leishmania infantum, ma può colpire, anche se molto di rado, il gatto (Poli et al., 2002; Pennini, 2002) e numerosi animali selvatici (Gramiccia et al., 2000).
L’uomo è considerato un ospite occasionale.
La Leishmania è un organismo dixeno, in quanto compie il proprio ciclo biologico in due ospiti, un vertebrato che svolge il ruolo di serbatoio e un invertebrato che rappresenta il vettore.
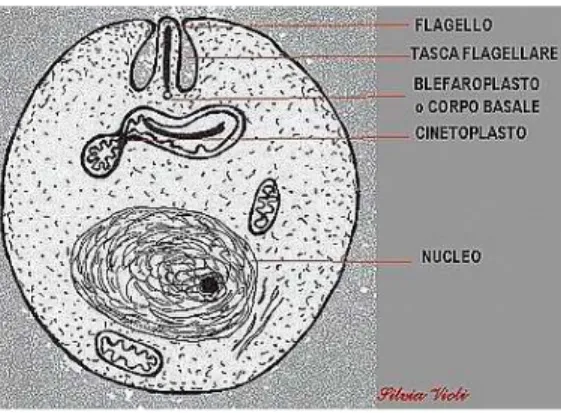
La forma del parassita all’interno dell’ospite vertebrato prende il nome di amastigote (figura 1) e si presenta come un organismo ovoidale, di circa 5 µm, con un abbozzo di flagello.
5
Fig. 1 Amastigote di Leishmania.
All’interno dell’ospite invertebrato, invece, si presenta sotto forma di promastigote (figura 2), un organismo di forma allungata che può raggiungere i 15 µm di lunghezza e caratterizzato dalla presenza di un lungo flagello (Urquhart et al., 2001).
Fig. 2 Promastigote di Leishmania.
L’agente responsabile della trasmissione della malattia, il flebotomo (figura 3), è un piccolo insetto con il corpo ricoperto di peli, con lunghi arti, ali lanceolate (tenute erette rispetto
6 al corpo), e antenne molto lunghe presenti in entrambi i sessi. E’ attivo principalmente all’alba e al tramonto e in parte durante le ore notturne.
Fig. 3 Phlebotomus.
L’azione vettoriale è sostenuta dalle femmine, in quanto sono le uniche ad essere ematofaghe. Il sangue, infatti, è necessario per lo sviluppo delle uova (Urquhart et al., 2001).
Il ciclo del vettore inizia quando una femmina di flebotomo compie un pasto di sangue su un soggetto infetto. Gli amastigoti ingeriti raggiungono l’intestino dell’insetto dove si trasformano in promastigoti e, in seguito a ripetute divisioni per scissione binaria, migrano in senso anteriore.
Una volta arrivati nella faringe, i parassiti si trasformano in promastigoti metaciclici altamente mobili e si dispongono a livello della proboscide del flebotomo.
I promastigoti, in seguito ad un’ulteriore puntura di insetto, vengono quindi trasmessi all’ospite vertebrato.
Il ciclo all’interno del flebotomo varia da 4 a 20 giorni, in base alla temperatura e all’umidità dell’ambiente circostante.
Nell’ospite vertebrato poi, i promastigoti vengono fagocitati dai macrofagi all’interno dei quali si trasformano in amastigoti.
7 All’interno del vacuolo parassitoforo subiscono ulteriori scissioni binarie allo scopo di raggiungere un numero tale da provocare la rottura del macrofago.
Gli amastigoti, una volta liberi, vengono fagocitati da altri macrofagi nei quali compiono nuove scissioni binarie diventando sempre più numerosi (Urquhart et al., 2001).
In questo modo si ha una colonizzazione da parte del parassita con conseguente reazione infiammatoria a livello degli organi interessati.
8 1.2 Patogenesi
La leishmaniosi è caratterizzata da un corteo sintomatico molto vasto ed estremamente variabile, l’animale colpito può manifestare una combinazione di più segni clinici, un solo sintomo o essere asintomatico.
La molteplicità di presentazioni cliniche è il risultato sia dei meccanismi patogenetici che inducono la malattia, sia della risposta immunitaria dell’ospite.
Occorre sottolineare infatti che molte manifestazioni cliniche sono legate più al tipo di risposta immunitaria che non ad una precisa azione diretta del parassita.
Un ruolo fondamentale nella patogenesi è sostenuto dal macrofago parassitato, diversi fattori strutturali e biochimici intervengono sia nel legame (binding) iniziale sia nella fase intracellulare del parassita (Handman, 1986).
La via di contagio naturale è rappresentata dall’inoculazione dei promastigoti metaciclici infettanti da parte del flebotomo parassitato nella cute, la quale rappresenta il sito primario di infezione.
E’ comunque ritenuta una possibile via di contagio anche la trasfusione di sangue (de Freitas et al., 2006).
Il flebotomo non svolge solo l’inoculazione meccanica e passiva dei promastigoti, ma ne promuove anche attivamente l’iniziale penetrazione e la successiva propagazione. L’insetto infatti, insieme ai promastigoti, inietta anche delle sostanze contenute nella
saliva, quali potenti vasodilatatori, inibitori della coagulazione del sangue e fattori immuno-modulatori che facilitano la Leishmania nell’instaurare l’infezione (Ribeiro,
9 Sono stati individuati, inoltre, sul rivestimento del parassita dei recettori di natura glicolipidica (glicoconiugati) che sono implicati nell’adesione con il macrofago. In particolar modo la componente idrofila ha la capacità di legarsi specificatamente ai macrofagi e non ad altre cellule linfoidi. I glicoconiugati sono presenti in tutte le specie di Leishmania, ma sono antigenicamente distinti.
E’ possibile, infatti, che il polimorfismo di queste molecole, nelle diverse specie, sia direttamente responsabile dell’integrazione del parassita con differenti subpopolazioni di cellule del sistema fagocitico mononucleare spiegando così il differente tropismo tissutale e i diversi aspetti patologici della malattia. (Pizzirani, 1989).
Al binding segue la fagocitosi; la capacità della Leishmania di sopravvivere e moltiplicarsi nel sistema vacuolare del macrofago dipende da molteplici fattori (Pizzirani, 1989), quali:
• la neutralizzazione di H2O2 ad opera di una superossido dismutasi • l’inibizione diretta degli enzimi lisosomiali
• la protezione della digestione enzimatica offerta dai fosfolipidi di membrana del parassita
La risposta immunitaria elaborata dall’ospite può essere sia di tipo cellulo-mediata che umorale, ed è proprio la predominanza di una delle due che determina rispettivamente la resistenza o la sensibilità all’infezione.
Se l’animale sviluppa maggiormente l’immunità cellulo-mediata, caratterizzata dalla risposta Th1, i macrofagi attivati sono in grado di eliminare il parassita, si parla in questo caso di immunità protettiva, in quanto capace di respingere la malattia.
I linfociti helper 1 attivano la risposta cellulo-mediata promovendo la produzione di interleuchina 2 (IL2), interferone γ (IFNγ) e tumour necrosis factor (TNF).
10 Nel caso invece di predominanza della risposta umorale (risposta Th2) gli animali risultano sensibili all’infezione. I linfociti helper 2 stimolano, attraverso la produzione di specifiche interleuchine (IL–4, IL-5, IL-6 e IL-10) ed il fattore di stimolazione BSF-1 (B cell stimulation factors), la proliferazione dei linfociti B e la produzione di anticorpi (Urquahart et al., 2001).
Le sostanze prodotte dai Th2 richiamano, nel sito di partenza dell’infezione, macrofagi immaturi a bassissimo potenziale antiparassitario. I parassiti all’interno dei macrofagi provocano una continua sollecitazione delle cellule immunocompetenti che comporta uno squilibrio del sistema immunitario, con iperfunzione della risposta umorale ed anomalie quali-quantitative in quella cellulo-mediata (Pizzirani, 1989).
La risposta umorale in corso di leishmaniosi, quindi, non è protettiva, gli anticorpi specifici prodotti sono privi di azione neutralizzante e risultano dannosi nel corso della patologia.
I sintomi e i segni clinici osservabili sono determinati dalla deposizione degli immunocomplessi, dalla produzione di auto-anticorpi (causa di trombocitopenia e/o anemia) e dall’iperglobulinemia, associata alla continua stimolazione dei linfociti B (causa dell’incremento delle proteine totali e dell’inversione del rapporto albumine/globuline).
Il contatto tra antigene e immunocomplessi è lento e continuo ed è per questo che la malattia solitamente ha un decorso cronico o sub-acuto e progressivo, anche se è stata riportata in letteratura una forma acuta con febbre, sintomi nervosi e morte del soggetto (Bourdeau, 1983).
La gravità delle manifestazioni cliniche è correlata sia alla quantità che alla localizzazione degli immunocomplessi prodotti.
11 Tali complessi, costituiti essenzialmente da IgG, si depositano principalmente a livello renale, articolare, vascolare e oculare provocando quadri di glomerulonefrite, poliartrite, vascolite e uveite.
L’animale affetto dalla Leishmaniosi si trova in condizioni generali precarie e indifeso da un punto di vista immunitario tanto da provocare l’insorgenza di infezioni e patologie concomitanti che complicano il quadro clinico.
Non è raro, infatti, trovare associate a tale patologia quadri di demodicosi, piodermite, babesiosi o polmonite (Roze, 2002).
12 1.3 Metodi diagnostici
La diagnosi di leishmaniosi canina basata solo sull’osservazione della sintomatologia è solitamente difficile dato il quadro clinico polimorfo e non sempre patognomonico. Bisogna comunque tener presente che anche alcune delle prove diagnostiche non hanno una specificità/sensibilità del 100%.
Da un punto di vista clinico-patologico le alterazioni più significative si hanno a livello del proteinogramma e, in particolare, l’incremento delle proteine totali e l’inversione del rapporto albumine/globuline costituiscono il punto di partenza per un forte sospetto di leishmaniosi.
La sieroelettroforesi riveste inoltre particolare importanza anche per il controllo della malattia, in quanto permette di valutarne la gravità, l’anzianità e lo stadio evolutivo e quindi di emettere un prognostico aderente alla realtà clinica del paziente (Bizzeti, 1998).
Effettuare periodicamente tale esame sui soggetti malati fornisce anche un valido aiuto per il monitoraggio della terapia specifica.
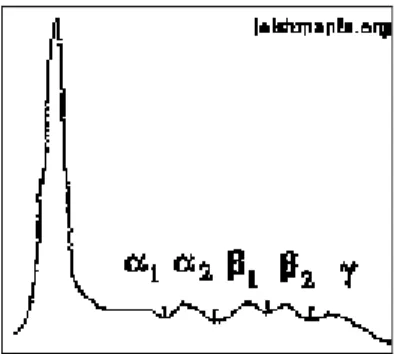
Il tracciato elettroforetico di un soggetto malato è caratterizzato da ipoalbuminemia e da iperbetaglobulinemia nelle forme recenti (Fig. 5) o ipergammaglobulinemia nelle forme avanzate (Fig. 6).
In caso invece di forme acute o di riacutizzazioni si assiste ad un innalzamento delle α2-globuline.
13 Fig. 4 Tracciato normale.
Fig. 5 Infezione recente.
14 Gli ausili diagnostici che solitamente vengono utilizzati sono:
Metodi parassitologici: consistono nell’evidenziazione del parassita attraverso l’osservazione al microscopio di strisci: a) di midollo osseo, b) di puntati linfonodali, c) di agoaspirati e impronte da lesioni cutanee, d) di biopsie cutanee.
I preparati citologici allestiti possono essere colorati col metodo di Giemsa o con il Diff Quick che permettono un’agevole evidenziazione degli amastigoti.
La sua specificità è molto elevata, ma la sensibilità del metodo è bassa (Urquahart et al., 2001).
Per quanto riguarda l’esame di biopsie cutanee bisogna ricordare che il quadro istologico delle lesioni non è specifico per leishmaniosi e che quindi solo la presenza di amastigoti permette una diagnosi certa. Tuttavia in aree endemiche un pattern istopatologico caratterizzato da dermatite granulomatosa diffusa soprattutto periannessiale e caratterizzato dalla presenza di macrofagi, linfociti e plasmacellule è molto suggestivo di tale malattia.
Quest’ultimo tipo di esame diagnostico deve essere sempre preso in considerazione al cospetto di pazienti sintomatologicamente sospetti (oligosintomatici) con IFAT dubbia o negativa.
Metodi sierologici: si basano sulla dimostrazione della presenza di anticorpi anti-Leishmania circolanti (in modo particolare IgG1), in quanto gli animali sensibili all’infezione elaborano una forte risposta umorale nei confronti del parassita e producono titoli alti di IgG anti-Leishmania.
15 Le prove maggiormente utilizzate sono: l’immunofluorescenza indiretta (IFAT), il test ELISA e l’agglutinazione diretta (DAT).
Per ciò che concerne la loro affidabilità bisogna considerare che la sieropositività non indica sempre la presenza della malattia, soprattutto per quei soggetti che vivono in aree endemiche. In questo caso, infatti, l’animale potrebbe essersi infettato ma non manifesterà clinicamente la malattia in quanto il suo sistema immunitario è in grado di eliminare il parassita (Urquahart et al., 2001).
Tra i metodi sierologici il più utilizzato è l’IFAT.
IFAT: E’ una tecnica sicura dotata di sensibilità e specificità elevate, anche se vengono segnalati una certa percentuale di falsi negativi: 5-6% (Denerolle, 1996), 1-2% (Rivò et al., 2000).
Si può affermare che un riscontro positivo a titolo superiore o uguale a 1/160 indica sempre un’infezione in atto; mentre titoli compresi tra 1/40 e 1/80, in assenza di sintomi, devono essere considerati dubbi e quindi da controllare periodicamente; inoltre si può avere malattia anche con sierologia negativa (Mancianti, 2001).
La metodica utilizza come antigene promastigoti di Leishmania fissati su un vetrino e prevede i seguenti passaggi:
1. Diluizione del siero in esame per raddoppio in base 10. 2. Incubazione con l’antigene per 30 minuti a 37°C. 3. Lavaggio.
4. Aggiunta di un’antiglobulina specifica coniugata con isotiocianato di fluorescina.
16 6. Lavaggio.
7. Montaggio di vetrini con glicerina.
8. Osservazione dei vetrini con microscopio a raggi ultravioletti.
I sieri positivi conferiscono una netta fluorescenza ai promastigoti ed al flagello. Il test ELISA (Enzyme-linked immunosorbent assay) si usa per rilevare anticorpi anti-Leishmania tramite un antigene specifico attaccato ad un supporto solido. Se ci sono i suddetti anticorpi si legano all’antigene e non vengono portati via durante i lavaggi. Gli anticorpi legati vengono quindi rilevati usando un anti-immunoglobulina legata ad un enzima.
Immunoistochimica: permette l’evidenziazione degli amastigoti di Leishmania attraverso l’utilizzo combinato di tecniche immunologiche e istochimiche. E’ una tecnica di notevole sensibilità e specificità.
Prevede l’utilizzo di sezioni di tessuto dell’animale al quale si deve diagnosticare la leishmaniosi, ottenute da biopsie cutanee, successivamente deparaffinate, reidratate in alcool, incubate con un anticorpo specifico e lavate con soluzioni contenenti enzimi. Il preparato così ottenuto viene fissato su vetrino e osservato al microscopio ottico (Xavier et al., 2006).
Metodi di biologia molecolare: si basano sulla dimostrazione/ amplificazione del DNA di Leishmania. Viene utilizzata la tecnica della PCR (polymerase chain reaction) che permette l’amplificazione di vari frammenti di DNA del parassita. Tale tecnica è utile soprattutto per l’identificazione delle diverse specie ed ha un’alta sensibilità/specificità.
17 L’importanza di questa prova è senza dubbio nel fatto di essere in grado di rilevare, in maniera attendibile, gli stadi precoci della malattia (Gradoni, 2002).
Nella diagnosi della Leishmaniosi canina la PCR può essere eseguita su sangue intero, midollo osseo, linfonodo, o altri tessuti bioptici.
Vengono utilizzati primers (sequenze specifiche di oligonucleotidi che reagiscono col materiale genomico in questione) universali di Leishmania oppure specie-specifici (Urquahart et al., 2001).
Si segnala un metodo innovativo non invasivo, tutt’ora allo studio, che consiste nel prelievo, tramite tampone di cotone sterile per batteriologia, di materiale esfoliativo congiuntivele (congiuntiva palpebrale) su cui effettuare la PCR. Questo metodo è risultato sensibile al 92%, se il prelievo viene effettuato su entrambi gli occhi, e specifico al 100% (Strauss – Ayali et al., 2004).
18 1.4 Aspetti clinico-patologici
Da un punto di vista clinico si può affermare che la malattia non ha predilezione di razza o sesso e che colpisce animali di età compresa tra 12 mesi e 11 anni, con un’incidenza maggiore nei soggetti tra i 3 e i 7 anni (Pizzirani, 1989).
Sono descritte una forma cutanea e una forma viscerale.
Le lesioni dermatologiche sono molto frequenti e generalmente tra le prime manifestazioni ad essere segnalate in sede anamnestica, accompagnate da linfoadenopatia localizzata o generalizzata, dimagrimento e disoressia. L’animale infatti mostra un “ appetito capriccioso”, che può essere aumentato o diminuito.
I linfonodi prescapolari sono in genere più aumentati dei poplitei mentre l’interessamento dei sottomandibolari è sempre contenuto.
I linfonodi risultano solitamente aumentati di volume (ma macroscopicamente di forma normale), non dolenti e di consistenza dura (Pizzirani, 1989).
In alcuni casi può essere presente anche epistassi bilaterale, intermittente o continua. La febbre nel cane è poco segnalata, ed è quindi considerato un segno incostante e variabile, presente soprattutto nei giovani animali già debilitati da altri fattori (Roze, 2002).
L’onicogrifosi (crescita abnorme delle unghie) è considerata espressione dello stato flogistico della matrice ungueale, provocato dall’azione dei parassiti, ed è presente in molti casi.
Più raramente la forma dermatologica è associata ad atrofia muscolare, in modo particolare dei muscoli facciali e temporali, ad anemia, a lesioni oculari, a glomerulonefrite, ad epato e splenomegalia e a poliartrite.
19 La glomerulonefrite, solitamente membrano-proliferativa cronica, è relativamente comune in corso di leishmaniosi ed evolve progressivamente in insufficienza renale, che rappresenta una delle prime cause di morte negli animali affetti da tale patologia (Poli et al., 1986).
Il primo indice di danno renale a comparire è la proteinuria, in quanto la polidipsia e la poliuria accompagnano invece gli stadi più avanzati e cronici della malattia glomerulare.
La proteinuria può essere così massiva da provocare una ipoproteinemia con conseguente formazione di ascite, edema agli arti e distacco retinico (Pizzirani, 1989). Le lesioni oculari possono essere primarie, vale a dire direttamente provocate dal parassita, secondarie, legate cioè alla risposta immunitaria, o miste. I sintomi sono quasi sempre bilaterali ma non necessariamente simmetrici.
Le lesioni più comuni sono la cheratocongiuntivite e l’uveite.
La cheratocongiuntivite si manifesta come flogosi cronica con neovascolarizzazione superficiale ed edema corneale, il quale può presentarsi d’entità moderata oppure grave, tanto da impedire l’osservazione della camera anteriore.
L’uveite, solitamente anteriore, può presentare una forma a carattere granulomatoso, caratterizzata dall’irregolarità della superficie iridea per piccoli granulomi da cui si isola il parassita e una a carattere non granulomatoso, in cui l’iride si presenta edematosa, che può evolvere in glaucoma .
La splenomegalia, a differenza dell’epatomegalia, può essere apprezzata alla palpazione in soggetti magri o con addome retratto.
La milza, istologicamente, presenta un quadro congestizio-emorragico caratterizzato dalla presenza di estese lacune emorragiche.
20 A livello epatico, da un punto di vista istologico, è possibile rilevare piccoli aggregati di macrofagi parassitati, linfociti e plasmacellule sparsi nel parenchima o localizzati nelle vicinanze delle aree portali.
La poliartrite solitamente è di tipo non erosivo, associata o no a sinovite e può causare una zoppia più o meno lieve e intermittente.
La frequenza con cui vengono rilevati i segni clinici è riportata in tabella 1 (Noli,1999). Lo studio della Noli si basa sulla raccolta di dati estrapolati da alcune pubblicazioni (Slappendel et al., 1998, Kontos et al., 1993, Denerolle, 1996 e Ciaramella et al., 1997).
21 TABELLA 1: SINTOMI PREVALENZA RELATIVA (%) Linfoadenopatia 71,2 – 96,1 Lesioni cutanee 75,0 - 89 Pallore delle mucose 58 – 94,2 Perdita di peso 30,7 - 70 Piressia (febbre, ipertermia) 23,0 - 70
Letargia 18 - 70
Anoressia (assenza d’appetito) 18 - 70
Splenomegalia 15 – 53,3 Insufficienza renale 16 - 32 Lesioni oculari 16 - 50 Epistassi 10 - 37 Artropatie 4 – 6,4
Come si evince dalla tabella, i segni dermatologici sono sicuramente tra i più importanti nel corso della patologia e vengono riscontrati in oltre l’80% dei casi.
Le lesioni cutanee sono generalmente di natura cronica, simmetrica e non pruriginosa, associate ad aree di alopecia, in corrispondenza delle quali la cute si presenta ispessita e paracheratosica.
22 1.4.1 Forme dermatologiche tipiche
Le forme di dermatite ritenute più comuni in caso di leishmaniosi sono (Ferrer et al., 1988):
1. Dermatite esfoliativa. 2. Dermatite ulcerativa. 3. Dermatite nodulare.
23 DERMATITE ESFOLIATIVA:
Questa forma si manifesta con rarefazione del pelo, seborrea secca e aree alopeciche pressoché simmetriche, localizzate soprattutto sulla testa. In alcuni casi tale alopecia inizia dalla testa per poi estendersi ad altre parti del corpo, quali le porzioni laterali del tronco e gli arti.
La dermatite è caratterizzata dalla presenza di grosse scaglie forforacee, lamellari, secche, di color bianco-argento di aspetto amiantaceo e per lo più aderenti nella parte centrale.
Tale forma colpisce principalmente la testa, ed in particolare le zone perioculari, il padiglione auricolare, il dorso del naso e la porzione distale degli arti, in un secondo tempo le lesioni possono anche estendersi a tutto il corpo.
Alcuni soggetti mostrano alopecia a livello perioculare, che in modo caratteristico viene descritto come “segno degli occhiali”, o ipercheratosi naso-digitale, con conseguente difficoltà alla deambulazione per la dolorabilità ai polpastrelli.
Sul dorso spesso è riscontrata la presenza massiva di scaglie forforacee senza, però, alopecie evidenti, mentre il ventre è solitamente poco interessato.
Questa forma colpisce indistintamente animali di tutte le età e razza.
Assieme al dimagrimento ed all’atrofia muscolare questa dermatite sulla testa conferisce all’animale l’aspetto di “cane vecchio”.
Istologicamente si tratta di una dermatite diffusa e non suppurativa, con presenza di cellule infiammatorie rappresentate da macrofagi, linfociti e plasmacellule. Nei casi più gravi l’infiltrato infiammatorio interessa anche l’ipoderma e il tessuto adiposo sottocutaneo. L’epidermide presenta ipercheratosi ortocheratosica.
24 Gli amastigoti sono evidenti nel citoplasma dei macrofagi in numero variabile.
Clinicamente, per quanto riguarda il diagnostico differenziale di questa forma si devono prendere in considerazione soprattutto la demodicosi e il pioderma generalizzato. La differenziazione tra le varie forme può essere ottenuta già sulla base dei risultati dei raschiati cutanei (positivi in caso di demodicosi), degli esami citologici della cute (presenza di batteri) e del midollo osseo (presenza di Leishmanie). La diagnosi certa di leishmaniosi può essere comunque emessa solo dopo il reperimento del parassita.
25 DERMATITE ULCERATIVA:
Le lesioni ulcerative a carico della cute si presentano tipicamente sugli arti, a livello soprattutto delle articolazioni (gomito, ginocchio e tibia-tarso-metatarso) sulle prominenze ossee e sui cuscinetti plantari, in quanto rappresentano le aree di maggior sollecitazione.
Ulcere ed erosioni si possono trovare, però, anche a livello delle mucose ed in particolar modo di quella nasale, tanto da provocare epistassi.
Per questa forma non viene segnalata in letteratura alcuna predisposizione di razza. Istologicamente queste ulcerazioni sono circondate da epidermide iperplastica e da una dermatite mista diffusa.
L’infiltrato infiammatorio è composto da neutrofili, eosinofili, macrofagi e linfociti. Solitamente in questo tipo di lesione si riscontra un numero di parassiti piuttosto basso. Rientrano nel diagnostico differenziale di questa lesione il lupus eritematoso, neoplasie e granulomi micobatterici. La conferma della diagnosi si ottiene attraverso un iter complesso che prevede l’esame citologico di cute, linfonodi e midollo osseo, l’esame sierologico, biopsie cutanee, ed eventualmente la PCR.
26 DERMATITE NODULARE:
I noduli che si formano possono avere dimensioni diverse, da pochi millimetri fino anche a 10 cm di diametro e non hanno la tendenza ad ulcerarsi. Normalmente i noduli di minori dimensioni hanno una distribuzione uniforme su tutto il corpo mentre quelli più grandi si trovano in aree isolate. Si possono trovare sia a livello cutaneo che mucosale.
Per questa forma sembra che ci sia una certa predispozione di razza, infatti in base ad uno studio effettuato da Ferrer et al. (1988) il Boxer risulterebbe maggiormente colpito. Istologicamente tali noduli corrispondono al locale accumulo di macrofagi, cellule giganti multinucleate, linfociti e plasmacellule.
Solitamente il numero di amastigoti all’interno dei noduli è alto ed in modo particolare nel contesto dei noduli di dimensioni maggiori.
Per questa forma il diagnostico differenziale comprende cisti cutanee multiple, mastocitoma (in modo particolare per il Boxer), linfoma cutaneo, altri tumori e dermatiti nodulari infettive.
La diagnosi definitiva si ottiene attraverso biopsie ed evidenziazione di amastigoti in preparati citologici da cute, linfonodi e midollo osseo o in sezioni istologiche.
27 1.4.2 Forme di più raro riscontro
Nel corso degli anni gli studi effettuati sugli animali affetti da Leishmaniosi hanno dimostrato l’esistenza di altre manifestazioni dermatologiche cosiddette atipiche, in quanto non classicamente attribuibili a tale patologia.
La dermatite pustolosa sterile è stata inserita da Ferrer et al. (1988) tra le forme cutanee classiche ma risulta in realtà di difficile reperimento nella pratica attuale. Alcune pubblicazioni più recenti (Blavier et al., 2001), infatti, la inseriscono tra le forme atipiche di leishmaniosi cutanea.
28 DERMATITE PUSTOLOSA STERILE:
Questo genere di dermatite è caratterizzata dalla presenza di pustole subcorneali, piccole lesioni rilevate nello spessore dell’epidermide, a diffusione generalizzata. Si trovano in modo particolare a livello del tronco, dell’addome e dell’inguine.
Viene classificata come sterile in quanto nelle pustole non sono presenti batteri.
Istologicamente gli animali mostrano pustole subcorneali neutrofiliche senza acantolisi, con exocitosi e una lieve follicolite suppurativa, specialmente al di sotto delle pustole (Ferrer et al., 1988).
I parassiti possono essere riscontrati all’interno dei macrofagi del derma, ma non nelle pustole (Blavier et al., 2001).
Tale dermatite offre al clinico notevoli difficoltà diagnostiche, in quanto le pustole ricordano per aspetto e localizzazione quelle osservate nel pemfigo foliaceo e non lo indirizzano correttamente verso un sospetto di leishmaniosi. Tuttavia tali lesioni non sono compatibili né citologicamente, né istologicamente con questa malattia autoimmune.
E’ quindi fondamentale verificare il contenuto delle pustole che in caso di pemfigo sono caratterizzate dalla presenza di acantociti (Albenese e Leone, 2004).
Altre possibili diagnosi differenziali comprendono il pemfigo eritematoso, la dermatosi da IgA e la pustolosi eosinofilica sterile.
Tuttavia biopsie cutanee e midollari e il test dell’immunofluorescenza indiretta sono la chiave per una corretta diagnosi definitiva.
29 Altre lesioni dermatologiche che negli anni hanno fatto la loro comparsa nel vasto corteo sintomatico che caratterizza la leishmaniosi e che possono essere definite atipiche o comunque di recente segnalazione sono essenzialmente: la dermatite papulare o “ chancre de inoculation “ e altre forme di dermatite papulo-nodulare con varia localizzazione.
Sono state, inoltre, segnalate all’ultimo congresso di Lisbona (Verde et al., 2006) come forme di leishmaniosi cutanea atipica le seguenti lesioni:
• Pododermatite ulcerativa. • Necrolisi e osteolisi dei piedi.
• Noduli eritematosi e ulcerativi della mucosa prepuziale. • Noduli a livello del pene.
• Papule localizzate a livello perioculare. • Pustole dell’area peniena e inguinale.
30 DERMATITE PAPULARE:
Si tratta di una forma di leishmaniosi cutanea da poco segnalata in letteratura, caratterizzata da dermatite papulare.
Solitamente questo tipo di lesione è stata riscontrata in animali giovani, con un’età compresa tra 4 e 24 mesi, e con una risposta immunitaria cellulare specifica.
Nei casi descritti in letteratura tali lesioni si presentano in assenza di altri segni clinici, con una certa percentuale di remissione spontanea e senza recidive. Tutto ciò ha fatto pensare che questa forma clinica sia benigna e da mettere in relazione ad immunocompetenza, quindi ad una prognosi favorevole della patologia.
Gli autori Ordeix, Solano-Gallego, Fondevilla, Ferrer e Fondati dell’Università Autonoma di Barcellona (Ordeix et al., 2005) ipotizzano che queste papule siano i siti di inoculazione e moltiplicazione del parassita e che quindi si tratti de le chancre de inoculation, espressione francese che letteralmente significa “ ulcera di inoculazione “. Le chancre de inoculation descritto da Vidor et al. (1991), in base ad uno studio condotto su 50 cani, viene descritto come una lesione superficiale a carattere stagionale e con tendenza alla risoluzione spontanea, caratterizzata da 3 fasi di evoluzione:
- Fase precoce: caratterizzata da una lesione eritematosa/squamosa di 10-15 mm di diametro.
- Fase intermedia: caratterizzata da una lesione ulcero-crostosa di 2-3 cm di diametro.
- Fase pre-cicatriziale: immediatamente precedente alla definitiva scomparsa. Tale tesi è avvalorata dal fatto che le papule si trovano in zone del corpo glabre o, comunque, scarsamente coperte di peli e quindi più suscettibili alla puntura del vettore
31 e che la loro comparsa è da collocare alla fine del periodo di massima attività dell’insetto. In quasi tutti i soggetti, infatti, le lesioni sono comparse tra la fine del periodo estivo e l’inizio del periodo autunnale, tranne che in un soggetto nel quale erano già presenti a Maggio.
Nella maggior parte dei casi gli animali, all’esame obiettivo generale, non presentano niente da segnalare se non in rari casi un leggero aumento di volume dei linfonodi, che può essere localizzato, in modo particolare ai retromandibolari e prescapolari, o generalizzato.
Dal punto di vista clinico si evidenziano delle lesioni sode e rilevate di diametro variabile, compreso tra 0,5 e 1 cm, alopeciche, ombelicate e non pruriginose.
La superficie può presentarsi eritematosa, erosiva o esfoliativa.
Le localizzazioni più frequenti delle papule sono a livello della superficie interna del padiglione auricolare, sul dorso del naso, sulle labbra, intorno all’occhio, sull’addome e sulla cute parapeniena.
All’esame citologico si evidenziano neutrofili plurisegmentati, macrofagi, plasmacellule. Per ciò che concerne l’esistenza di forme di amastigoti di Leishmania all’interno delle lesioni si possono rilevare in letteratura pareri contrastanti. Alcuni studi ne sostengono la presenza in gran numero (Roze, 2005), altri la escludono (Blavier et al., 2001) e altri ancora ne testimoniano un numero esiguo (Ordeix et al., 2005; Bottero et al. 2006).
Inoltre in alcuni soggetti oltre alle lesioni papulari sono state riscontrate aree di alopecia multifocale sul muso e lesioni nodulari.
Riporto di seguito la tabella con segnalamento dei soggetti interessati e distribuzione delle lesioni. La tabella è stata costruita tenendo presente lo studio di Ordeix et al.
32 (2005) per l’inserimento dei casi da 1 a 5, lo studio di Bottero et al. (2006) per i casi da 6 a 13 e lo studio di Fileccia (2001) per il caso 14.
33 lesioni
1-Rottweiler F 16 Addome e dorso del naso.
2-Boxer M 18 Padiglione auricolare, sulla coscia e sul prepuzio.
3-Boxer F 24 Padiglione auricolare,
labbra, regione perioculare, faccia interna dell’arto anteriore e posteriore.
4-Boxer F 17 Coscia.
5-Rottweiler M 22 Addome.
6-Beagle F 4,5 Padiglione auricolare e
tartufo.
7-Meticcio F 6 Padiglione auricolare.
8-Pointer F 4 Padiglione auricolare e cute
periauricolare.
9-Meticcio M 7 Padiglione auricolare.
10-Meticcio M 5,5 Padiglione auricolare.
11-Pitt Bull F 8 Carpo.
12-Pitt Bull M 6 Padiglione auricolare.
13-Meticcio M 7,5 Cute peniena.
14-Meticcio F 2 Padiglione auricolare, nuca,
fronte, gomiti e polpastrello.
34 Osservando la localizzazione delle lesioni dei casi sopra citati è evidente come la superficie interna del padiglione auricolare (9 su 14) sia sicuramente la più frequente, essendo comunque probabili anche le altre.
Alcuni dei soggetti riportati in tabella presentavano oltre alle forme cutanee descritte altre lesioni:
Il cane n° 1 aveva delle aree multifocali di alopecia sul muso, compresa la regione perioculare.
Il cane n° 5 mostrava delle lesioni nodulari sul mento e l’esame istopatologico rilevò una dermatite eosinofilica perivascolare, dovuta ad una probabile reazione da morso di insetto.
I cani n° 4 e n° 14 presentavano una lieve linfoadenopatia generalizzata.
Il soggetto n° 6 presentava un lieve ingrossamento dei linfonodi retromandibolari e prescapolari.
Per la diagnosi dei casi sopra citati gli autori si sono avvalsi di metodologie diverse. Per quanto riguarda le forme papulari descritte da Ordeix et al. (2005) gli esami diagnostici hanno compreso l’elettroforesi delle proteine sieriche, le quali sono risultate in tutti e 5 i soggetti (casi 1 – 5 di cui in tabella) entro i valori soglia e l’ELISA che ha confermato l’infezione mostrando valori leggermente sopra il cut-off nei casi 2,3 e 5 e valori nella norma nei casi 1 e 4.
Sul caso n° 2 è stato effettuato l’ago aspirato del midollo osseo, che ha mostrato un’iperplasia della linea mieloide ma non la presenza amastigoti.
Sul n° 1 il raschiato cutaneo dalle aree alopeciche ha identificato parassiti del genere Demodex (coinfezione).
35
L’esame citologico delle papule, effettuato su tutti i casi, ha mostrato un’infiammazione piogranulomatosa. In 4 dei casi non sono stati visualizzati agenti
infettivi, nel caso 3, invece, sono stati messi in evidenza nei macrofagici corpi intracitoplasmatici compatibili con amastigoti di Leishmania.
Nei casi esaminati da Bottero et al. (2006) l’esame citologico delle lesioni, su tutti i soggetti (casi 6-13 di cui in tabella), è stato eseguito per ago infissione e ha mostrato la presenza di neutrofili plurisegmantati , alcuni in attiva fagocitosi batterica, macrofagi e numerose plasmacellule. L’esame ha evidenziato, anche se in numero esiguo, la presenza di forme compatibili con amastigoti di Leishmania, per lo più extracellulari. Solo nei campioni ottenuti dai soggetti n° 10 e 13 gli amastigoti erano presenti nei macrofagi in sede citoplasmatica.
L’autore riporta anche gli esiti degli esami sierologici con metodica di immunofluorescenza indiretta e dell’elettroforesi sierica. L’esame sierologico è rusultato positivo in 2 soggetti (caso 6: 1/160 IFAT e caso 8: 1/80 IFAT) e l’elettroforesi ha mostrato un aumento delle gammaglobuline solo nel soggetto n° 6. Nei restanti soggetti l’esame sierologico è risultato negativo e l’elettroforesi normale. Nel caso esaminato da Fileccia (2001), il numero 14, è stato eseguito l’esame citologico, realizzato attraverso un calco cutaneo per apposizione, che ha dimostrato la presenza di forme di amastigoti di Leishmania intra ed extracellulare.
L’esame istologico è stato effettuato sul materiale raccolto dai noduli presenti sul padiglione auricolare e sul gomito e ha evidenziato iperplasia a livello dell’epidermide e infiltrato infiammatorio a carattere nodulare con macrofagi, contenenti amastigoti, plasmacellule e neutrofili a livello del derma.
36 Inoltre è stato effettuata anche l’immunofluorescenza indiretta che ha dato come risultato un titolo anticorpale di 1/320.
Per quanto riguarda quest’ultimo caso bisogna segnalare che, a differenza degli altri soggetti, non c’è stata remissione spontanea della sintomatologia ma piuttosto la comparsa di nuove manifestazioni cutanee compatibili con la leishmaniosi dopo circa 10 mesi dall’interruzione della terapia.
E’ difficile dire se questa seconda forma sia una recidivante della precedente o se, vivendo in area endemica, il soggetto sia stato di nuovo infettato.
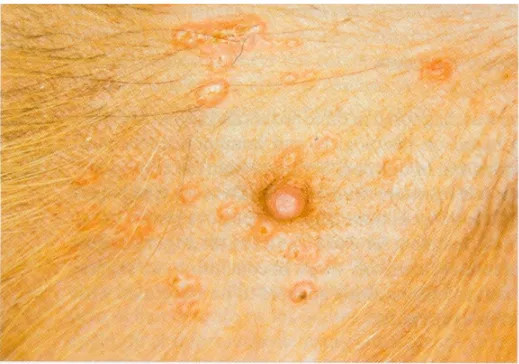
37 Figura 7: Addome; papule, multiple, sode e ombelicale.
Caso 1.
38 GRANULOMA PENIENO DA LEISHMANIA
Sono stati descritti in letteratura dei casi di granulomi penieni indotti da Leishmania nel cane, quello descritto da Gravino et al. (1994) si aggiunge ad una casistica sempre meno occasionale, iniziata con la segnalazione di Domina et al. (1992).
Gravino riporta il caso di un Yorkshire maschio di 8 anni.
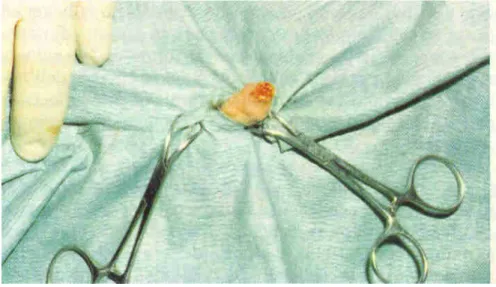
L’anamnesi del soggetto riferiva di molteplici manifestazioni autoeccitative esitanti in sanguinamenti della durata di più giorni e la presenza sulla punta del pene di una lesione granulomatosa a carattere ulcerativo (Figura 9).
Le manifestazioni autoeccitative e la lesione peniena non avevano trovato soluzione né con farmarci capillaroprotettivi né con l’intervento di orchiectomia (effettuato in quanto era stata imputata la genesi di tali episodi ad uno squilibrio endocrino).
Gli esami ematochimici riferivano solo un aumento della proteinemia totale (9,80 g/L), con inversione del rapporto albumine – globuline ed iperglobulinemia.
L’esito di tali esami induceva a pensare alla leishmaniosi che veniva confermata dalla presenza di amastigoti sia nello striscio della lesione ottenuto per impronta che dal puntato sternomidollare ed inoltre dalla prova di immunofluorescenza indiretta (1/80). Il soggetto veniva quindi trattato con antimoniato di metilglucamina, riscontrando un rapido miglioramento dell’ulcera peniena, che dopo 15 giorni di trattamento cessava di sanguinare. Al 30° giorno di trattamento il granuloma assumeva un aspetto lardaceo con tendenza alla cicatrizzazione (Figura 10).
Tale terapia poneva fine anche ai fenomeni autoeccitativi legati al prurito determinato dall’ulcera.
39 Gli autori che riportano questo caso si interrogano in merito alla genesi del fenomeno granulomatoso in questo soggetto, ritenendo che sia la conseguenza di fenomeni cellulo-mediati e non di sovrapposti esiti cicatriziali esuberanti di ulcere provocate da traumi meccanici in risposta all’intensa reazione infiammatoria locale.
40 Fig. 9: Ulcerazione granulomatosa della punta del pene.
41 1.5 Patologie associate a leishmaniosi
Sono stati descritti in letteratura casi di leishmaniosi in associazione con altre patologie concomitanti caratterizzate da manifestazioni dermatologiche varie. In modo particolare si tratta di quadri di demodicosi (Mozos et al., 1999) e di pemfigo foliaceo (Scarampella e Bonfanti, 2001).
L’importanza di questi reperti sta nel fatto che queste associazioni complicano notevolmente il quadro clinico già di per se così polimorfo e rendono più difficoltosa la diagnosi.
Demodicosi e leishmaniosi:
La demodicosi è una malattia parassitaria piuttosto comune dovuta ad un’eccessiva proliferazione di un acaro, il Demodex, che normalmente si comporta da commensale nei follicoli piliferi e nelle ghiandole sebacee della maggior parte dei mammiferi. Si caratterizza per avere un quadro dermatologico piuttosto vario, l’evoluzione clinica della malattia dipende dall’età del soggetto e dal suo stato immunitario. Normalmente in animali giovani si presenta in forma meno grave e le lesioni dermatologiche hanno un estensione piuttosto limitata, in quanto vengono interessati principalmente la testa e gli arti anteriori da alopecia, lieve desquamazione e ispessimento della cute che si presenta anche leggermente eritematosa.
42 Esiste, però, una forma più grave che colpisce generalmente animali adulti con il sistema immunitario compromesso, e caratterizzata dall’insorgenza di sovrainfezioni batteriche (nella maggior parte dei casi Stafilococchi).
Le lesioni sono distribuite su tutto il corpo e la cute si presenta ispessita, grinzosa e con numerose pustole che trasudano pus, siero e sangue. Entrambe le forme sono caratterizzate dall’assenza di prurito (Urquahart et al., 2001).
Mozos et al. (1999) riportano dei casi riguardanti soggetti affetti da entrambe le malattie:
Caso 1: Incrocio di Fox terrier maschio di 9 anni.
All’esame ispettivo generale l’animale mostrava solo una linfoadenopatia generalizzata. Da un punto di vista dermatologico presentava un eritema generalizzato con alopecia e una grave desquamazione, presenti da circa un anno. Il quadro è successivamente peggiorato evolvendosi in pioderma profondo e foruncolosi, causando una grave dermatite pruriginosa associata a eritema, seborrea, iperpigmentazione e croste emorragiche.
La diagnosi di demodicosi è stata effettuata attraverso raschiati cutanei profondi risultati positivi, mentre per quanto riguarda quella di leishmaniosi sono stati effettuati una biopsia cutanea e un ago aspirato dei linfonodi che hanno portato all’identificazione degli amastigoti
43 Caso 2: German Shepherd maschio di 4 anni.
Presentava un leggero prurito, depilazione a livello perioculare e follicolite e furoncolosi generalizzate nella zona anteriore del dorso, a livello lombosacrale e sulla coda.
Osservando i raschiati e le biopsie cutanee furono messi in evidenza numerosi Demodex e macrofagi infettati da Leishmania.
Caso 3: Chihuahua femmina di 3 anni.
All’esame obiettivo generale presentava solo un leggero calo di peso e una linfoadenopatia generalizzata.
Le lesioni dermatologiche erano iniziate con alopecia diffusa sul tronco e all’esame obiettivo particolare furono messi in evidenza un grave eritema con pustole follicolari, iperpigmentazione focale e una seborrea generalizzata.
La diagnosi di leishmaniosi è stata realizzata attraverso l’ago aspirato dei linfonodi poplitei e quella di demodicosi con l’identificazione di numerosi Demodex attraverso il raschiato cutaneo, che ha messo in evidenza anche la presenza di Stafilococchi.
Da un punto di vista istopatologico gli esami al microscopio hanno rilevato nei casi 1 e 2 una grave dermatite piogranulomatosa, diffusa, superficiale e profonda associata a follicolite suppurativa e foruncolosi. L’infiltrato piogranulomatoso consisteva in numerosi macrofagi, contenenti un numero variabile di amastigoti di Leishmania, molte plasmacellule e neutrofili. I linfociti risultavano scarsamente presenti.
44 Tutti e tre i casi presentavano epidermide iperplastica, ipercheratosi, pustole subcorneali e croste.
Pemfigo foliaceo e leishmaniosi:
Il complesso “pemfigo”, descritto nell’uomo, nel cane, nel gatto, nel cavallo e nella capra, comprende quattro forme più o meno rare e gravi che hanno in comune la formazione di autoanticorpi diretti contro la sostanza cementante intercellulare della cute.
La forma più grave è il pemfigo volgare, caratterizzato dalla presenza di vescicole nelle mucose e sulla cute.
La forma più comune è il pemfigo foliaceo caratterizzato da dermatite eruttiva pustolosa a livello di testa, orecchie e muso.
E’ riportato uno studio che descrive la contemporanea presenza di pemfigo foliaceo e leishmaniosi:
Scarambella e Bonfanti (2001) riportano il caso di un cane maschio, alano, di un anno e mezzo circa di età.
Il soggetto era affetto da pemfigo foliaceo, per il quale veniva trattato da alcuni mesi con una terapia immunosoppressiva che aveva portato ad una remissione totale della sintomatologia clinica.
All’esame obiettivo generale si presentava in buono stato di nutrizione ma leggermente abbattuto, con un lieve rialzo febbrile (39,2° C) e con linfoadenomegalia generalizzata. Dal punto di vista dermatologico veniva evidenziata una dermatite nodulare multifocale che interessava tronco, testa e arti.
45 L’esame citologico del materiale prelevato per ago aspirato dai noduli aveva messo in evidenza numerosi istiociti con vacuoli intracitoplasmatici, linfoblasti, poche plasmacellule e linfociti.
L’esame istopatologico dei noduli era caratterizzato dalla presenza di una dermatite nodulare mononucleare nel derma profondo. Le cellule dell’infiltrato della linea istiocito-macrofagica contenevano numerose forme di amastigoti di Leishmania.
La diagnosi di leishmaniosi venne in seguito confermata dal risultato dell’immunofluorescenza indiretta e dagli esami emocromocitometrici, biochimici e delle urine che mostrarono linfopenia, monocitosi, ipergammaglobulinemia, ipoalbuminemia e proteinuria.
Venne sospesa la terapia immunosoppressiva (per il pemfigo) e iniziata quella per la leishmaniosi, questo portò ad una riduzione notevole della dimensione dei noduli e ad un lieve miglioramento delle condizioni generali ma anche ad una ricaduta del pemfigo.