3. LO STATO OSSIDATIVO
Lo stato ossidativo di un soggetto è il risultato del bilanciamento tra la componente ossidante e la componente riducente presenti nei liquidi organici.
La componente ossidante è costituita da specie chimiche reattive di diversa natura che hanno la capacità di ossidare le molecole organiche causando un danno funzionale e strutturale alla cellula e che sono prodotte durante numerose reazioni metaboliche.
La componente riducente è costituita da sostanze chimicamente e biologicamente eterogenee che svolgono un’azione antiossidante e che sono state elaborate dagli organismi nel corso dell’evoluzione come sistema di difesa nei confronti dei composti ossidanti.
In condizioni fisiologiche (sforzo intenso, gravidanza, aumentata PO2
ambientale) un aumento di formazione di sostanze ossidanti induce anche un aumento della produzione di antiossidanti endogeni; questo meccanismo, che nell’uomo diminuisce con l’età, mantiene in equilibrio lo stato redox dell’organismo, proteggendolo dai danni che deriverebbero da un surplus di radicali liberi.
Lo stato ossidativo di un soggetto può risultare alterato per: - eccessiva produzione di composti ossidanti
- diminuita sintesi di antiossidanti endogeni - diminuita assunzione di antiossidanti esogeni
In ogni caso, quando la quantità di antiossidanti non è più sufficiente a tamponare la componente ossidante si parla di stress ossidativo.
3.1 - Principali Specie chimiche reattive rilevanti in biologia
Le specie chimiche reattive sono agenti di natura radicalica o non radicalica capaci di ossidare un substrato organico.
Le specie chimiche reattive di maggior interesse biologico sono quelle centrate sull’ossigeno (ROS)*, sull’azoto (RNS)*, sul carbonio (radicali alchilici), sul cloro (acido ipocloroso) e sullo zolfo (radicali tiolici) (vedi Tabella 5).
Specie reattive Radicaliche Non Radicaliche
Anione superossido Perossido di idrogeno
Radicale idrossile Acido ipocloroso
Radicale alcossile Ozono
Ossigeno singoletto ROS Radicale idroperossile Idroperossido Acido nitroso Tetrossido di azoto Ossido nitrico Triossido nitrico Perossinitrito Alchil-perossinitrito Acido perossinitroso RNS Diossido nitrico Catione nitronio
I radicali liberi sono atomi o molecole aventi uno o più elettroni spaiati in uno degli orbitali esterni delle specie che li costituiscono e possono essere anioni, cationi o molecole neutre. La loro esistenza fu comprovata sperimentalmente per la prima volta da Gomberg (1900), il quale riuscì ad ottenere il radicale trifenilmetile, (C6H5)3C. Tuttavia, solo dopo molto tempo fu proposto che i radicali dell’ossigeno e altre specie reattive, potevano formarsi negli organismi viventi come sottoprodotto del normale metabolismo aerobico.
In funzione della distribuzione della carica e/o del proprio potenziale di ossido-riduzione, i radicali liberi presentano una reattività più o meno spiccata, legata alla tendenza spontanea ad esistere come entità aventi tutti gli elettroni disposti in coppie, condizione che corrisponde alla stabilità chimica; per tale ragione reagiscono ossidando qualsiasi molecola organica con cui vengono a contatto (glicidi, lipidi, aminoacidi, proteine, nucleotidi) strappando ad essa un elettrone.( Iorio, 2003).
3.2 - Meccanismi di formazione delle specie reattive
I radicali liberi di maggiore rilevanza biologica sono generati principalmente attraverso 3 meccanismi:
1. La scissione omolitica.
La scissione omolitica consiste nella divisione di una molecola a livello dei suoi legami covalenti per effetto della somministrazione di energia termica (pirolisi) o radiante (radiolisi) con generazione di nuove specie chimiche ciascuna con un elettrone spaiato (radicali liberi);
2. L’ossidazione o la riduzione di un metallo di transizione (ferro, rame)
L’ossidazione di un metallo di transizione in forma ionica (es. da Fe2+ a Fe3+) libera un elettrone che va a spezzare un legame covalente di una molecola bersaglio generando così un radicale libero ed un anione.
È necessario ricordare che quasi tutti gli enzimi conosciuti richiedono la presenza di ioni metallici per esprimere la propria attività catalitica.
Tra i metalli di transizione, ricopre notevole rilevanza biologica il ferro. Un esempio di meccanismo, si osserva nella reazione di Haber Weiss, attraverso la quale, a partire da un radicale perossido e dal perossido di idrogeno, derivato dalla propria dismutazione ( reazione intramolecolare nella quale avviene un’ossido-riduzione interna, con la formazione di due distinti prodotti da un unico substrato) si ottiene una molecola di radicale idrossililico (HO°), la più reattiva delle specie parzialmente ridotte dell’ O2.
Fortunatamente la velocità di questa reazione è molto scarsa, tale da precludere una rilevanza biologica. A questo punto entra in gioco il ferro, che è in grado di catalizzare la reazione con un meccanismo descritto per la prima volta da Fenton.
Lo ione ferroso (Fe2+) ossidandosi a ione ferrico (Fe3+) cede il suo elettrone ad una molecola di perossido di idrogeno e ne scinde uno dei legami covalenti, generando il radicale libero (HO·) (radicale idrossile) ed un anione (ione ossidrile) (Verna F. et al., 2003).
Anche la riduzione di un metallo di transizione in forma ionica, ad es. da Fe3+ a Fe2+, può portare alla formazione di un radicale quando l’elettrone viene estratto dal legame covalente di una molecola bersaglio causando la decomposizione di quest’ultima in un radicale libero ed un catione. Per
esempio, lo ione ferrico può ridursi, rigenerandosi come qualsiasi catalizzatore, a ione ferroso Fe2+, strappando un elettrone ad una molecola di perossido di idrogeno H2O2, facendo sì che questa si scinda in un radicale libero
(HOO·) (radicale peridrossile) ed un catione (ione idrogeno H+).
Il ferro, negli organismi superiori in buona salute, non è mai ferro libero o debolmente legato. Esso viene trasportato nello stato ferrico dalla transferrina, in un complesso molto difficile da ridurre. Allo stesso modo viene depositato nello stato ferrico mediante la ferritina, una proteina ubiquitaria nei tessuti e nel plasma. Il radicale superossido è in grado di ridurre allo stato ferroso il ferro legato alla ferritina, che viene così rilasciato. È questo ferro rilasciato dalla produzione patologica di superossido, che è ora in grado di catalizzare la reazione di Haber Weiss.
3. La decomposizione di azocomposti.
Alcuni azocomposti come i perossinitriti possono generare spontaneamente il radicale idrossile ed il radicale nitrossido nel citoplasma.
Una volta formati i radicali liberi possono dar luogo a reazioni a catena nel corso delle quali il sito radicalico può essere trasferito o inattivato.
Il radicale libero può ossidare una molecola bersaglio e formare un nuovo radicale. Ad esempio il radicale ossidrile HO· attaccando una molecola organica (R-H) strappa a questa un atomo H+ generando una molecola di H2O ed un
radicale alchilico (R·). Così il sito radicalico si trasferisce dal radicale ossidrile al radicale alchile.
3.3 - Siti di formazione delle specie reattive
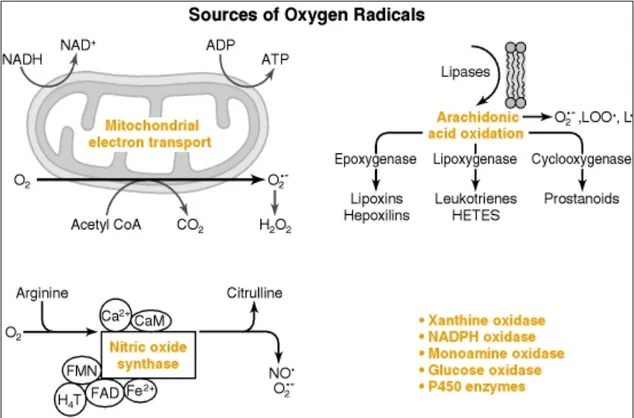
Figura 16. principali siti di formazione dei ROS
Le specie chimiche reattive, ed in particolare i ROS, sono generati nel corso della normale attività metabolica cellulare e si possono individuare 5 fonti primarie nella loro produzione :
1. A livello della membrana plasmatica.
Nel corso del “respiratory burst” due enzimi localizzati sulla membrana dei polimorfonucleati, la NADPH ossidasi e la lipoossigenasi, catalizzano la formazione dell’anione superossido e di intermedi metabolici come gli idroperossidi acidi in seguito a processi reattivi infettivi e/o infiammatori.
La NADPH ossidasi è l’unico enzima dell’organismo che produce superossidi in modo programmato. Questo enzima riduce l’ossigeno molecolare ad anione superossido che essendo instabile è subito convertito in perossido di idrogeno da parte dell’enzima superossidodismutasi. Sia l’anione superossido che gli idroperossidi sono precursori di ossidanti più potenti. Il primo reagendo con l’ossido nitrico forma specie azotate altamente reattive (i perossinitriti). Il secondo può reagire con il ferro formando il radicale idrossile responsabile della degradazione dei lipidi di membrana, dell’aggregazione, del cross-linking e della frammentazione delle proteine (AOPP = Advanced Oxidation Protein Products) e dei danni a carico dei filamenti di DNA. Il perossido di idrogeno risulta essere inoltre anche il substrato dell’enzima mieloperossidasi che catalizza la reazione tra questo e lo ione cloro con formazione di acido ipocloroso. Questo è un composto altamente istolesivo che agisce soprattutto sui lipidi, sui proteoglicani e sui gruppi tiolici delle proteine di membrana e può reagire con ammine endogene (R-NH2) e produrre le cloroamine (RNH-Cl ).
La membrana plasmatica contiene inoltre due enzimi, la lipoossigenasi e la cicloossigenasi che convertono l’acido arachidonico in prostaglandine, leucotrieni e trombossani. Durante queste reazioni sono prodotti dei radicali liberi intermedi degli acidi grassi che possono avere un effetto citotossico.
2. A livello dei mitocondri.
Durante la fosforilazione ossidativa, una certa quota di elettroni sfugge ai coenzimi e reagisce direttamente con l’ossigeno molecolare generando l’anione superossido ed il perossido di idrogeno che può essere scisso in radicale idrossile e ione ossidrile attraverso la reazione di Haber-Weiss.
La produzione di radicali a questo livello può aumentare nell’esercizio fisico intenso, in gravidanza, in corso di deplezione di ADP o per esposizione ad elevate concentrazioni di ossigeno.
3. A livello dei perossissomi.
Durante la beta-ossidazione degli acidi grassi, in cui una flavo proteina estrae una coppia di atomi di idrogeno da una molecola di acido grasso attivato (Acetil CoA) trasferendola direttamente all’ossigeno molecolare, con formazione di perossidi di idrogeno che vengono subito inattivati da una catalasi.
4. A livello del reticolo endoplasmatico
Soprattutto negli epatociti. In queste cellule la produzione di specie reattive avviene attraverso le reazioni catalizzate dal sistema del citocromo P450 nel catabolismo degli ormoni steroidei e di composti non fisiologici come gli xenobiotici, le tossine ed i farmaci.
5. A livello del citoplasma.
La produzione di radicali liberi avviene nel corso di numerose reazioni biochimiche fisiologiche, ad esempio nella sintesi delle catecolamine, ma soprattutto durante la riperfusione post ischemica e nello shock emorragico a causa dell’estrema ipotensione.
In corso di ischemia, a causa della limitata disponibilità di ossigeno, la produzione di ATP diminuisce ed aumenta quella di AMP che è metabolizzato ad adenosina, ad inosina e quindi a ipoxantina. A causa del danno alle membrane cellulari si verifica inoltre un aumento della
concentrazione citoplasmatica di calcio che causa l’attivazione di alcune proteasi che trasformano la xantina deidrogenasi, enzima coinvolto nel catabolismo dei nucleotidi purinici, in xantina ossidasi. Durante la riperfusione aumenta improvvisamente la disponibilità di ossigeno e l’ipoxantina viene ossidata e si ha la produzione di anione superossido. L’anione superossido oltre a causare direttamente un danno tissutale diretto attiva delle chemochine superossido dipendenti che attraggono i neutrofili nel sito di riperfusione con ulteriore rilascio di perossidi da parte di questi ultimi.
Sempre a livello citoplasmatico è prodotto un altro radicale libero: l’ossido nitrico. La reazione è catalizzata dall’enzima ossidonitrico sintetasi (NOS) che ha come substrato l’aminoacido L-arginina. L’ossido nitrico agisce come messaggero intra ed intercellulare ed è prodotto a livello dei macrofagi, dei neuroni e delle cellule dell’endotelio vascolare. Ad elevate concentrazioni, a causa della sua natura radicalica, può reagire con altre specie chimiche. Se sono elevate anche le concentrazioni di anione superossido, questo reagisce con l’ossido nitrico e si ha la formazione di perossinitriti (ONOO`) altamente istolesivi. Dai perossinitriti si può formare l’acido perossinitroso e da questo il radicale idrossile ed altri intermedi reattivi. I perossinitriti sono inoltre responsabili della nitrazione dei residui fenolici delle tiroxine e le nitrotirosine sono infatti considerate markers della tossicità tissutale dell’ossido nitrico.
3.4 - Il sistema di difesa antiossidante
Figura 17. azioni degli antiossidanti
Poichè le specie reattive sono potenzialmente lesive, gli organismi hanno sviluppato un sistema di difesa antiossidante formato da agenti chimicamente eterogenei quali enzimi, proteine di trasporto e di accumulo, vitamine, oligoelementi e composti di varia natura come l’albumina, l’acido urico, il glucosio, il colesterolo,la bilirubina etc.
Gli antiossidanti possono essere classificati in base all’origine (endogeni-esogeni), alla natura chimica (enzimatici-non enzimatici), alla solubilità (idrosolubili-liposolubili) ed in base al meccanismo d’azione.
In base al meccanismo d’azione si distinguono antiossidanti:
1. Preventivi
2. “Scavenger”
3. “Chain breakers”
4. Agenti di riparo
1) Gli antiossidanti preventivi formano la prima barriera di antiossidanti e hanno azione specifica. Fanno parte di questo gruppo gli enzimi superossidodismutasi, catalasi, glutatione perossidasi, eme-ossigenasi, numerose proteine come la ferritina, la transferrina, la lattoferrina, la ceruloplasmina, l’albumina e l’emoglobina ed alcune vitamine.
Possono agire attraverso differenti meccanismi di azione: a) la chelazione dei metalli, b) il sequestro dell’ossigeno singoletto, c) l’inattivazione dell’anione superossido e d) dei perossidi, e) il catabolismo dell’anello porfirinico.
a) Chelazione dei metalli
Le proteine di trasporto e di stoccaggio chelano i metalli. In condizioni di acidosi o in caso di aumentata produzione di perossido di idrogeno, queste proteine possono subire modificazioni conformazionali che provocano il rilascio di metalli in forma ionica. Questi metalli, soprattutto il ferro ed il rame, sono capaci di innescare la reazione Fenton con scissione degli idroperossidi organici in radicali alcossilici e perossilici responsabili dei danni all’endotelio e della perossidazione delle lipoproteine.
b) Sequestro dell’ossigeno singoletto
Alcune vitamine, soprattutto il beta-carotene e l’alfa-tocoferolo, e l’enzima superossido dismutasi (SOD) sono capaci rispettivamente di
sequestrare e dismutare l’ossigeno singoletto. Questo radicale libero estremamente reattivo è in grado di attaccare acidi grassi polinsaturi causando perossidazione lipidica.
c) Inattivazione dell’anione superossido
L’enzima superossido dismutasi (SOD), presente in tutte le cellule, converte due molecole di anione superossido nel meno tossico perossido di idrogeno e ossigeno molecolare. Si ottiene dunque un debole ossidante relativamente stabile in confronto al precursore di partenza molto più aggressivo.
In realtà si deve tener presente che in particolari condizioni, come ad esempio l’acidosi, la preenza di metalli pesanti liberi, può determinare la trasformazione del perossido di idrogeno a radicale ossidrile.
La SOD è presente in tre isoforme, che si differenziano in base alla natura del nucleo metallico attivo e sulla base degli aminoacidi costituenti: la MnSOD nei mitocondri, la CuZnSOD nel citoplasma e la EcSOD nei liquidi extracellulari. (Landis et al., 2005)
d) Inattivazione dei perossidi
Le perossidasi (Px) inattivano gli idroperossidi (ROOH), che derivano dall’attacco dei ROS su substrati organici, ed il perossido di idrogeno. I perossidi sono relativamente stabili ma in ambiente acido ed in presenza dei metalli di transizione dissociati possono essere decomposti liberando il radicale alcossile, il radicale perossile ed il radicale idrossile, molto più nocivi.
Le perossidasi (Px) demoliscono gli idroperossidi in O2 ed una molecola
- la catalasi che lavora in maniera sequenziale rispetto alla SOD ed è maggiormente espressa nei perossissomi a livello degli eritrociti e degli epatociti dove inattiva il perossido di idrogeno.
-la glutatione perossidasi (GSH-PX) che presenta come cofattori il glutatione ridotto ed il selenio ed agisce sia sul perossido di idrogeno che sugli altri perossidi. Queste hanno una diffusione ubiquitaria nei tessuti e aumentano fortemente in preenza di elevati livelli di perossidi.
La glutatione perossidasi compete con le catalasi per il substrato H2O2
ed è la risorsa protettiva maggiore contro i bassi livelli di stress ossidativi. Anche la GSH-Px è presente in tre isoforme: di membrana, citosolica e plasmatica.
Il ruolo protettivo del glutatione (GSH) nei confronti dello stress ossidativo è svolto attraverso diversi meccanismi:
- come detto, il glutatione è un cofattore di diversi enzimi detossificanti, quali la glutatione perossidasi, la glutatione transferasi ed altri.
- Il GSH partecipa nel trasporto degli aminoacidi attraverso le membrane cellulari.
- Il GSH è capace di rigenerare i più importanti antiossidanti, come la vitamina C ed E, nelle loro forme attive.
e) Catabolismo dell’anello porfirinico
L’eme-ossigenasi è un enzima microsomiale che degrada le emoproteine a pigmenti biliari prevenendo la liberazione in circolo di ferro allo stato ionico. Più precisamente l’HO-1 degrada l’eme in monossido di carbonio (molecola vasoattiva) e biliverdina (ad azione antiossidante).
2) Gli “Scavenger” formano una seconda barriera di antiossidanti di tipo non specifico ed agiscono inattivando i radicali liberi. Essi sono:
- l’ubichinone, è una sostanza liposolubile, importante antiossidante di membrana che agisce sui lipoperossidi, è conosciuto anche come coenzima Q. È un importante trasportatore di elettroni e rientra in un complesso sistema di ossidoriduzioni a livello mitocondriale. In realtà l’ubichinone può comportarsi sia da scavenger che da generatore di specie reattive, attraverso il fenomeno di autossidazione, mediante una reazione il cui equilibrio dipende dalle condizioni chimiche del microambiente. In particolare, a livello delle membrane biologiche prevale l’attività antiossidante nei confronti della lipoperossidazione. Pertanto possiede effetti protettivi nei confronti del danno ossidativo verso lipidi, proteine e DNA.
- l’acido urico, molecola idrosolubile, presente a pH fisiologico in forma ionizzata di urato ed attivo nei confronti del radicale idrossile, acido ipocloroso, ossigeno singoletto ed ozono. E’ inoltre in grado di chelare gli ioni ferro e rame prevenendo la generazione dei ROS.
- i composti tiolici (es. glutatione, cisteinglicina), importanti come antiossidanti sia intracellulari che plasmatici perché i gruppi sulfidrici SH sono in grado di inattivare i radicali alcossilici (RO·) ed idrossilici (HO·) rilasciati rispettivamente come molecole di alcool o di H2O.
- Il glutatione è un tripeptide, costituito dall’acido glutammico, cisteina e glicina, che può esistere in una forma ridotta (GSH) ed in una forma ossidata (GS-SG). Oltre ad agire come cofattore della glutatione perossidasi agisce indipendentemente come scavanger del perossido di idrogeno, del radicale idrossile e di ossidanti a base di azoto come i perossinitriti.
- le emoproteine come l’ossiemoglobina, la biliverdina e la bilirubina. L’ossiemoglobina agisce da scavanger dell’ossido nitrico formando il nitrato (NO3).
3) I “chain breakers” bloccano le reazioni radicaliche a catena prevenendo la lipoperossidazione lipidica.
Sono chain breakers la vitamina A (i caroteni), la vitamina E (i tocoferoli) e la vitamina C (l’ascorbato).
La vitamina A è una vitamina liposolubile. Con il termine vitamina A vengono indicati sia i retinoidi che i carotenoidi. Questi ultimi sono provitamine, ricavate da fonti vegetali, ma svolgono anche un’azione antiossidante. Il beta-carotene è il composto più attivo e neutralizza i radicali perossilici.
La vitamina E, anch’essa liposolubile, è costituita principalmente dall’alfa-tocoferolo, un composto capace di bloccare le reazioni a catena di perossidazione lipidica catturando i radicali lipoperossilici.
Il radicale a T° è molto meno reattivo nell’attaccare le catene laterali degli acidi grassi rispetto ai radicali perossilici ed è riconvertito in tocoferolo tramite una reazione con l’ascorbato. La vitamina E induce la sintesi di SOD e CAT e di ossido nitrico a livello delle cellule endoteliali vascolari, inibisce l’espressione di molecole di adesione e l’attività della NADPH-ossidasi (Xin et al., 2001).
E’ stato inoltre dimostrato che anche la vitamina C inibisce l’attività della NADPH ossidasi mentre incrementano quella della superossido dismutasi (Xin et al., 2001).
4) Gli agenti di riparo intervengono dopo che il danno da specie reattive è stato prodotto. Le idrolasi, le trasferasi e le polimerasi (che identificano il segmento di molecole ossidato, lo separano e inseriscono un nuovo segmento) sono i più importanti tra gli agenti di riparo. Nella letteratura più recente sono riportati numerosi studi sull’attività antiossidante di altre molecole come gli acidi grassi omega tre, i polifenoli del thè verde e la quercitina (Halliwell, 1996; Fang et al., 2002; Caimi et al., 2004).