Liberazione della catalasi per l’ inibizione ROS-mediata nei tessuti danneggiati e metastasi tumorali
Gli organismi aerobici, incluso gli umani, usano l’ossigeno per generare energia dai nutrienti. Il processo della generazione di energia produce uno spreco di materiali, quali l’ acqua e il biossido di carbonio (CO2)(56). In
aggiunta a questi materiali, durante l’ ossidazione dei nutrienti, sono inevitabilmente generati alcuni sottoprodotti tra cui i più importanti sono le specie reattive dell’ ossigeno (ROS); nel complesso I e III della catena di trasporto elettronico nei mitocondri, è generato l’ anione superossido che è convertito in perossido di idrogeno attraverso una reazione spontanea o attraverso la suprossido dismutasi (SODs), se perossido di idrogeno fosse successivamente degradato da catalasi o perossidasi in ossigeno e acqua. Questi enzimi antiossidanti sono abbondanti nelle cellule aerobiche.
Anche se l’ossigeno è essenziale per tutti gli organismi aerobici, i gas, specialmente i suoi metaboliti reattivi, come l’anione superossido, il radicale idrossile, il perossido di idrogeno, sono altamente tossici per tutti gli organismi. Queste ROS interagiscono con una varietà di componenti cellulari, incluso proteini, lipidi e acidi nucleici. Queste reazioni chimiche portano a malfunzionamento delle molecole, degli organelli subcelluari, delle cellule, dei tessuti, degli organi, o persino degli organismi, a seconda della varietà del danno ossidativo e dell’ attività del sistema riparatore endogeno. Non è una sorpresa la scoperta che l’ ultimo antenato comuna universale fosse dotato di un enzima con attività di catalasi/perossidasi. Nonostante sembri difficile provare questo è possibile immaginare che organismi nei primi stadi di sviluppo della terra difendessero se stessi grazie a tale gene antiossidante dallo stress ossidativo indotto dalla luce ultravioletta.
Recenti studi hanno sottolineato l’ importanza del perossido di idrogeno e di altre ROS come secondi messaggeri nei segnali intracellulari e nella regolazione trascrizionale. E’ stato trovato che il fattore nucleare kB (NF-kB) è attivato dal perossido d’ idrogeno. E’ stato anche trovato che la subunità α del fattore inducibile dell’ ipossia (HIF)-1α è stabilizzata dal perossido d’ idrogeno. Poichè NFkB, HIF-1α e altri fattori di trascrizione, l’ attività dei quali è regolata dal perossido d’ idrogeno, sono delle proteine chiave che regolano l’espressione dei geni coinvolti in una varietà di stati patologici, il controllo dei livelli di perossido d’ idrogeno può essere un modello per il trattamento dei danni legati all’eccessiva produzione di questo composto. La catalasi, un enzima che scinde il perossido d’ idrogeno in acqua e ossigeno, è stata identificata e classificata da LOEW nel 1900(57) grazie alla sua azione catalitica sul perossido d’ idrogeno. Questo enzima è ampiamente distribuito nel nostro organismo, con un’ alta concentrazione nel fegato, nei reni e negli eritrociti, e la sua espressione è regolata a diversi livelli. A causa della sua abbondanza e larga distribuzione attraverso il corpo, la catalasi riceve una minor attenzione come agente terapeutico per i danni causati delle ROS. Un evento che ha segnato un’ epoca è stata la scoperta della SOD nel 1969 ad opera di Mc Cord e Fridovich(58), tale scoperta ridusse ulteriormente l’ attenzione data alla catalasi. Comunque, benché la SOD sia abbastanza efficace nella dismutazione dell’ anione superossido, l’ iniziale generazione delle ROS attraverso l’ aspirazione o sotto condizioni fisio-patologiche, non può sostituire la catalasi a causa della sua incapacità a degradare il perossido d’ idrogeno.
E’ ormai noto(56) che in numerose malattie umane sono coinvolte le ROS. Sotto tali condizioni patologiche, che l’eccesso di ROS è generato per distruggere i meccanismi di difesa di enzimi antiossidanti ed altri antiossidanti eventualmente presenti nell’ organismo. Considerando il fatto
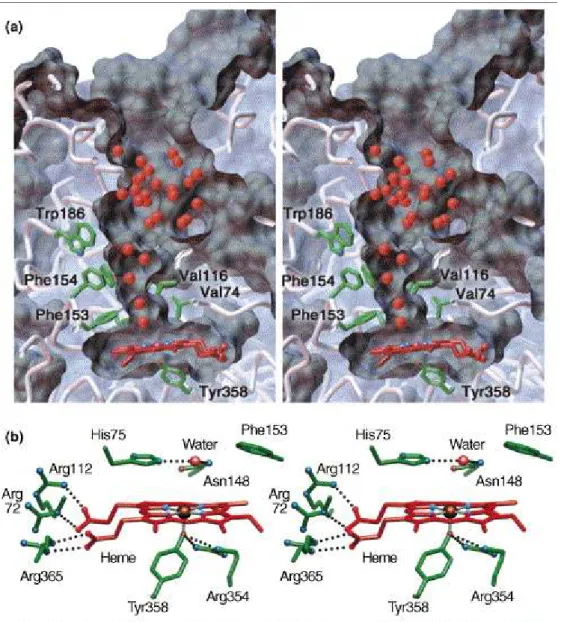
che le SOD producono perossido d’ idrogeno attraverso la dismutazione dell’ anione superossido, la somministrazione della catalasi è efficace per trattare le malattie ROS-mediate. Comunque, il problema più grande associato all’ uso di catalasi nel trattamento di queste malattie è la sua distribuzione ai siti dove i livelli di ROS, specialmente di perossido d’ idrogeno, sono aumentati. La catalasi dei mammiferi è un tetramero di 4 subunità identiche con peso molecolare di circa 240 kDA (Figura 18 (59)) Il fatto che sia una molecola così grossa limita la distribuzione a livello dei tessuti dopo la somministrazione, ma contemporaneamente ci dà l’ opportunità di controllare la sua distribuzione tissutale per farlo arrivare al target. Questo è in contrasto con i casi da antiossidanti con basso peso molecolare, la distribuzione tissutale dei quali è difficilmente controllabile.
Figura 18. Rappresentazione sterica della catalasi eritrocitica umana. (a) Sezione attraverso la tasca dell'eme della catalasi umana e canale di avvicinamento. Il canale ha una lunghezza di 25A° e ha una costrizione di 2-3Â sopra al sito attivo°. Le catene laterali in verde creano la costrizione idrofobica, che orienta gli atomi di H2O2 in modo appropriato per il contatto con il sito attivo. Il
residuo di Tyr358, funzionalmente importante, è localizzato sotto l’eme ed è anch’esso colorato in verde. (b) Vista delle strutture in, e vicino, all'eme.
ESPRESSIONE ED ATTIVITA’ DELLA CATALASI
La catalasi è codificata da un singolo gene, il quale è altamente conservato tra le specie. I mammiferi, incluso gli umani e i topi, esprimono catalasi in tutti i tessuti e un’ alta concentrazione di catalasi può essere trovata nel fegato, nei reni e negli eritrociti. Uno studio sull’ attività della catalasi nei topi mostra che un’ elevata attività catalasica si trova nel fegato (66,100 unità/g tessuto), nel polmone (2390 unità/g tessuti) e negli eritrociti (6340 unità / ml sangue). L’ espressione è regolata a livello di trascrizione, post-trascrizione e post-translazione. Un’ alta attività catalasica si osserva nei perossisomi. La catalasi è presente anche nel citosol degli eritrociti in cui gioca un ruolo chiave nella regolazione della concentrazione di perossido d’ idrogeno.
Nell’ uomo e in altre specie animali, è stata evidenziata una deficienza di catalasi. Tale deficienza può essere: acatalasemia che ha meno del 10% della normale attività catalasica e ipocatalasemia che ne ha circa la metà. E’ stato riportato che l’ attività catalasica del fegato è ampiamente ridotta durante la crescita tumorale, ma dopo la rimozione del tumore, ritorna a livelli normali. La riduzione può essere mediata da vari fattori incluse le citochine. Ripetute iniezioni del fattore α necrotico ricombinante del tumore umano riducono significativamente l’ attività catalasica del fegato nei ratti. E’ stato inoltre osservato che il soppressore 1 del tumore di WILM è capace di sopprimere la trascrizione del gene della catalasi.
Una sovraespressione di catalasi è stata inoltre osservata nella drosofila e nei topi. Uno studio ha mostrato che la sovraespressione di catalasi indirizzata ai mitocondri aumenta la lunghezza di vita dei topi. La sovraespressione di catalasi nel cuore sopprime l’ infarto cardiaco. Un’
iniezione intravenosa di catalasi coniugata con polietilene glicol (PEG-catalase) è risultata molto efficace nell’ inibire la perossidazione lipidica indotta dal perossido d’ idrogeno nei topi. Inoltre, l’ espressione di catalasi a livelli fisiologici non è sufficiente a rimuovere il perossido d’ idrogeno generato in alcune condizioni pato-fisiologiche.
CONTROLLO DELLA DISTRIBUZIONE TISSUTALE DELLA CATALASI
La catalasi è un enzima che detossifica il perossido d’ idrogeno, così che può ridurne i livelli. A causa del limitato passaggio attraverso l’ endotelio in molti tessuti e organi, la catalasi non può distribuirsi uniformemente nell’ organismo. D’ altra parte, la generazione di ROS è spesso un evento localizzato, così che l’ indirizzamento mirato della catalasi al sito dove le ROS sono state generate potrebbe essere più efficace di una convenzionale incontrollata introduzione dell’ enzima.
Natura epatotrofica della catalasi
La catalasi del fegato bovino è velocemente accolta dal fegato dopo un iniezione intravenosa nei topi. L’ assorbimento della catalasi dipende dalla dose, e un incremento di questa ritarda l’ uptake epatico della catalsi 111 In-labeled, suggerendo il coinvolgimento di un meccanismo specifico nell’ assorbimento epatico della catalasi. In aggiunta, epatociti, non cellule di Kupffer,o cellule endoteliali sinusoidali, costituiscono il contributo maggiore all’ uptake. La 111In-catalasi è inoltre accolta dal fegato di ratti isolati perfusi, dove nessun componente del siero è incluso nel perfusato, indicando un piccolo contrbuto dei componenti sanguigni all’ assorbimento
epatico della catalsi. Il meccanismo di questo uptake non è ancora pienamente compreso, ma lo co-somministrazione di composti captati in modo selettivo dagli epatociti, difficilmente colpisce l’ assorbimento epatico della 111In-catalasi. L’ albumina sierica Bovina (BSA) galattosilata (Gal), un ligando tipico per i recettori delle asialoglicoproteine sugli epatociti che riconoscono il galattosio sul terminale non riducente della catena zuccherina, non ha effetto sull’ assorbimento della 111In-catalase. La catalsi è una proteina contenete eme, ma altre proteine contenenti eme come l’ emoglobina e la mioglobina, che sono inoltre trasportate negli epatociti non colpiscono l’ assorbimento epatico della 111In-catalasi. Altre proteine che trasportano il ferro, come la transferrina, la lactoferrina, e la ferritina sono inoltre assorbite dagli epatociti, ma nessuna di esse inibisce l’ uptake della 111In-catalasi. La catalasi è trasportata ai perossisomi attraverso la ricognizione di un segnale preciso perossisomiale. La uricasi, un’ altra proteina destinata ai perossisomi, difficilmente colpisce l’ assorbimento epatico della 111In-catalasi suggerendo che le sequenze di segnali non hanno effetti significativi sull’ assorbimento. Dopo il legame alla superficie delle cellule epatiche, la 111In-catalse è internalizzata, poi degradata in maniera simile ad altre proteine che sono endocitotiche. Ulteriori studi sono necessari per capire la natura epatotropica della catalasi così come il suo trasporto intracellulare dopo l’ uptake cellulare.
L’ iniezione sub cutanea della catalsi è un opzione per incrementare la durata della sua efficacia terapeutica, perché c’è un processo di assorbimento dal sito di iniezione al circolo sistemico. Quando la 111 In-catalasi è iniettata in modo subcutaneo scompare molto lentamente dal sito di iniezione con un emivita apparente di 27 ore.
PEGilazione
Benchè il meccanismo di uptake epatico della catalasi non sia pienamente compreso, questa unica maniera di distribuirsi nei tessuti può essere alterata dalla schermatura della superficie degli enzimi con polimeri. L’ attenzione dovrebbe essere rivolta al tipo e alla natura dei polimeri usati, poiché alcuni polimeri hanno modelli unici di distribuzione tissutale, che riflettono la loro specifica o non specifica interazione con componenti biologici. Una varietà di polimeri bioinerti è stata utilizzata per modificare proteine biologicamente attive, inclusa la catalasi, e il polimero più utilizzato e più promettente è il polietilen glicol (PEG).
La coniugazione di PEG o PEGilazione, incrementa enormemente l’ emivita circolatoria della catalasi dopo l’ iniezione sistemica nei topi. L’ area sotto la curva concentrazione-tempo del plasma della 111In-PEG-catalsi è all’ incirca 67-volte più grande di quella della 111In-catalasi. Circa il 30% della 111In-PEG-catalsi è accumulata nel fegato dopo 1 ora dall’ iniezione quando più del 20% della dose iniettata rimaneva ancora nel sistema circolatorio. Il rapporto della clearence dell’ uptake epatico (0,23 ml/h) rispetto alla clearence totale dell’ organismo (0,52 ml/h) suggerisce che circa il 45% della PEG-catalsi è distribuita nel fegato. Questo valore è leggermente più piccolo di quello della catalasi, che si accumula nel fegato fino al 70%, 10 min dopo l’ iniezione. La degradazione enzimatica della PEG-catalasi dopo l’ assorbimento cellulare potrebbe essere ritardata a causa dell’ ingombro sterico dovuto al PEG.
La 111In-catalase scompare più lentamente dalla cavità peritoneale rispetto alla InPEG-catalsi dopo l’iniezione intraperitoneale nei topi. E’ stato calcolato che l’ apparente emivita sia di 0,76 e 1,95 ore per la 111In-catalasi e la 111In-PEG-catalsi rispettivamente. La differenza tra questi 2 derivati può essere spiegata dal fatto che la velocità di assorbimento dalla cavità peritoneale al sistema circolatorio è in funzione del peso molecolare dei
soluti. La velocità di assorbimento può essere cambiata radicalmente in condizioni patologiche, come la peritonite, la diffusione peritoneale nelle cellule cancerogene e l’ accumulo di fluido ascitico.
Cationizzazione
La catalasi è una proteina negativamente caricata così che l’ interazione con la superficie delle cellule cariche negativamente è incrementata dalla cationizzazione. Diversi reagenti o polimeri sono stata coniugati con la catalasi per dotare l’ enzima con una carica superficiale positiva, e ciò include l’ N,N’ – dimetil-1,3-propandiamina, 1,6-diaminohexane (esametildiamina; HMD) e etilendiamina (ED).
La catalasi cationizzata mostra un incremento di legami con una varietà di cellule in coltura, incluso le cellule epiteliali alveolari di coniglio primariamente coltivate e le cellule umane di epatoma HepG2.
In generale le macromolecole cationizzate, dopo la somministrazione, interagiscono con una varietà di cellule dell’ organismo. Dopo iniezione intravenosa nei topi, i derivati della catalasi 111In-cotionizzata, per esempio quelli modificati con ED o HMD (ED-catalasi e HMD-catalasi, rispettivamente), scompaiono dalla circolazione sanguigna molto velocemente e una larga frazione di radioattivo iniettato si accumula nel fegato. Analisi immunoistochimiche hanno mostrato anche che la ED-catalasi è molto più efficiente se indirizzata ai tubuli prossimali nei reni. Quando si inietta all’ interno delle articolazioni del ginocchio del topo con artrite indotta, la catalsi cationizzata viene trattenuta nei tessuti sinoviali e cartilaginosi per un lungo periodo di tempo.
Succinilazione o altre modificazioni che aumentano la carica negativa netta.
Polimeri altamente carichi negativamente e altre macromolecole sono riconosciute da recettori scavenger che sono presenti in una varietà di cellule inclusi i macrofagi peritoneali, le cellule di Kupffer e le cellule endoteliali sinusoidali. Succinilazione, maleilazione ed altre modificazioni simili per incrementare la carica negativa netta sono state usate per modificare una varietà di proteine che, dopo la modificazione mostrano una maggior affinità per le cellule che esprimono recettori scavenger. Dopo l’ iniezione intravenosa nei topi la 111In-succinilata (Suc)-catalasi si dirige soprattutto al fegato ed in particolare alle cellule non parenchimatiche. Nei fegati perfusi dei topi, la 111In-Suc-catalasi è continuamente estratta dal fegato con un estrazione proporzionale a circa il 40% rispetto ad una concentrazione di influsso di 0,1 µg/ml.
Glicosilazione
La liberazione di specifiche cellule di composti macromolecolari incluso proteine attive biologicamente, può essere teoricamente ottenuta attraverso il trapianto di specifici ligandi su di loro. I maggiori risultati sono stati ottenuti utilizzando macromolecole glicosilate chimicamente, probabilmente a causa del numero e della accessibilità dei recettori corrispondenti. L’ attenzione dovrebbe essere rivolta ai metodi di glicosilazione in quanto alcuni di questi riducono la carica netta delle proteine. Tale riduzione può dotare le proteine di una certa affinità per i recettori scavenger; un buon esempio è costituito dal mannosilato (Man-) dell’ albumina serica umana.
I recettori delle asialoglicoproteine, espressi maggiormente sugli epatociti, riconoscono i residui di galattosio sui terminali non ridotti delle catene
oligosaccaridiche. Proprio di recente è stato riportato che i recettori sono un fattore chiave che determina una sopravvivenza dell’ ospite nella sepsi acuta. A causa della natura dell’ interazione tra i recettori e i ligandi, sono stati utilizzati ligandi galattosilati per la liberazione di una varietà di composti a livello degli epatociti. E’ stato osservato nei topi, che la Gal-catalasi è quasi completamente indirizzata agli epatociti quando la distribuzione tissutale è esaminata utilizzando un composto 111In-labeled. La clearence di uptake della 111In-Gal-catalasi è all’ incirca di 73 ml/h quando iniettata ad una dose di 0,1 ml/kg, dose che è strettamente proporzionale al flusso plasmatico nel fegato. Perciò, la Gal-catalasi sarà quasi completamente assorbita dal fegato durante un singolo passaggio attraverso l’ organo alle condizione esaminate. Studi che utilizzano fegati perfusi di ratto, hanno indicato che la 111In-Gal-catalsi ha un numero inferiore di siti di legame, un’ affinità di legame maggiore ed un’ internalizzazione proporzionalmente maggiore rispetto alla 111In-catalasi. Un altro tipo di recettori zuccherini disponibili per la liberazione mirata, è il recettore per il mannosio, espresso soprattutto sui macrofagi e sulle cellule endoteliali sinusoidali del fegato. La 111In-Man-catalasi si ritrova accumulata soprattutto nel fegato in seguito ad un’ iniezione intravenosa nei topi. La 111In-Man-catalasi ha un ampia clearence epatica ed un’ internalizzazione proporzionale. In aggiunta all’ uptake epatico recettore-mediato le macromolecole mannosilate sono legate a proteine seriche leganti il mannano. Un’ analisi farmacocinetica della distribuzione tissutale delle proteine mannosilate con diverse proprietà fisico-chimiche ha indicato che il legame alle proteine seriche leganti il mannano colpisce l’ assorbimento epatico delle proteine altamente mannosilate somministrate a basse dosi. Questo effetto non è significativo quando la dose viene aumentata ad 1 mg/kg o più, a causa della limitata presenza delle proteine leganti il mannano in circolo.
Rilascio controllato
Un incremento cronico nella produzione di ROS può essere trovato in una varietà di condizioni patologiche incluso il diabete. In tali casi il rilascio controllato della catalasi o dei suoi derivati chimicamente modificati, sarebbe benefico. L’ emivita in vivo delle proteine può essere aumentata utilizzando formulazioni a rilascio controllato o sostenuto. Il tempo di ritenzione della ED-catalasi, un derivato cationizzato è significativamente aumentato utilizzando la gelatina hydrogel. Una hydrogel biodegradabile che consiste in una gelatina acida, incrementa in modo significativo la ritenzione della 111In-ED-catalasi dopo un’ iniezione intraperitoneale nei topi.
INIBIZIONE DEL DANNO TISSUTALE ROS-MEDIATO
Come descritto sopra, la distribuzione tissutale della catalasi può essere controllata in modo preciso con modificazioni dinamiche e/o con l’ uso di formulazioni a rilascio controllato. Nell’ uso di derivati della catalasi, nel trattamento di condizioni patologiche ROS-mediate, dovrebbe essere prestata attenzione al modello spazio temporale della produzione di ROS: locale o sistemico, acuta o cronica. Se la produzione è limitata a un ambito locale, la liberazione di derivati della catalasi a livello del sito specifico può essere efficace, ed è stato osservato che sono efficaci nell’ inibire eventi patologici indotti da produzione acuta e copiosa di ROS. D’ altra parte, quando gli effetti nocivi dell’ aumento dei livelli di ROS sono evidenti in
tutto l’ organismo, la rimozione delle ROS dalla circolazione sistemica può essere benefica.
Danni epatici da ischemia/riperfusione
I progressi nelle tecniche chirurgiche e lo sviluppo di potenti immunosoppressori, hanno enormemente incrementato il numero di pazienti che possono subire un trapianto di fegato in tutto il mondo. A causa della nature del trattamento il flusso sanguigno del fegato trapiantato è occluso prima della rimozione dal donatore e poi, il flusso è ripristinato dopo che i vasi sanguigni sono suturati nel destinatario. Questo sistema include inevitabilmente un processo di ischemia/riperfusione che, come noto può generare una grande quantità di ROS che innesca una danno tissutale. Le cellule di Kupffer, macrofagi residenti nel fegato, sono attivate durante l’ ischemia/riperfusione, quindi producono ROS e rilasciano enzimi lisosomiali e citochine, che portano alla morte degli epatociti. Questi cambiamenti iniziali innescano poi l’ infiltrazione di neutrofili nel tessuto post ischemico del fegato e l’ esplosione respiratoria dei neutrofili aderenti alle cellule sinusoidali o agli epatociti, giustifica la maggior parte della fase successiva dei danni epatici da ischemia/riperfusione. Perciò l’ inibizione della produzione di ROS attraverso le cellule di Kupffer nel periodo iniziale della riperfusione, sarebbe una strategia efficace per inibire i danni epatici da ischemia/riperfusione. La Suc-catalasi e la Man-catalasi, derivati che hanno come obiettivo le cellule non parenchimatiche del fegato, comprese le cellule di Kupffer e le cellule endoteliali sinusoidali, hanno dimostrato di essere efficaci nell’ inibizione del danno iniziale del fegato riperfuso. L’ aumento dei livelli di aspartato aminotransferasi (AST) e di alanina aminotransferasi (ALT) nel plasma, può essere inibito significativamente
con una singola iniezione intravenosa di Suc-catalasi o Man-catalasi 5 min prima della riperfusione del flusso sanguigno epatico occluso. Sezioni di fegato trattati con veicoli (salini) hanno mostrato una distruzione nucleare e altri danni importanti, ma all’ apparenza le sezioni indicano di essere state colpite da ischemia/riperfusione. La co-iniezione di Man-superossido dismutasi (Man-SOD), migliora in parte gli effetti inibitori della Suc-catalasi. Questa combinazione terapeutica, sopprime in maniera efficace l’espressione della molecola1 di adesione intracellulare lungo la sinusoide del fegato. Questa soppressione previene l’ infiltrazione neutrofila nel fegato riperfuso. Quindi la liberazione mirata della catalasi alle cellule non parenchimatiche del fegato è un approccio efficace per l’ inibizione dei danni al fegato indotti dall’ ischemia in seguito alla riperfusione.
Danni tissutali indotti chimicamente
Una varietà di farmaci così come prodotti chimici e tossine possono indurre un’ infiammazione del fegato soprattutto attraverso la produzione di ROS durante il metabolismo nel fegato. In questa circostanza, le ROS ossidano una varietà di componenti dei tessuti, inclusi i lipidi, le proteine e il DNA, portando ad un danno tissutale. In aggiunta a queste reazioni dirette, le ROS, specialmente il perossido d’ idrogeno, agiscono come secondi messaggeri nel processo di segnalazione cellulare e nelle funzioni cellulari di controllo incluse la proliferazione e l’ apoptosi, attraverso la regolazione dell’ espressione di una varietà di geni. Un importante fattore di trascrizione che è attivato dalle ROS è l’ NF-kB. L’attivazione di questo fattore di trascrizione è collegato con un danno epatico indotto da prodotti chimici. È stato riportato che la tioacetamide è metabolizzata dal CYP2E1 e induce
danni al fegato attraverso la produzione di ROS e l’ attivazione di NF-kB. La tioacetamide, conosciuta come un’ epatotossina sperimentale, induce epatite fulminante e cirrosi epatica in modelli di animali. Il controllo della tioacetamide induce un notevole incremento nei livelli di AST e ALT nel siero. E’ stato osservato che l’ iniezione intravenosa di Man-catalasi o Suc-catalasi, i derivati diretti alle cellule non parenchimatiche del fegato, è efficace nell’ inibire l’ incremento dei livelli di AST e ALT nel plasma e nell’ incrementare il periodo di sopravvivenza dei topi. La ragione per cui i derivati catalasici aventi come obiettivo le cellule non parenchimatiche del fegato hanno effetti maggiori sui danni indotti al fegato dalla tioacetamide rispetto ad altri derivati, può essere spiegata con un’ evidenza sperimentale e cioè che la distruzione funzionale delle cellule di Kupffer attenua i danni indotti dalla tioacetamide al fegato(60). L’ analisi di imaging in vivo dell’ attività di NF-kB nei topi dimostra chiaramente che l’ attivazione di NF-kB indotta dalla tioacetamide nel fegato è significativamente prevenuta dalla Man- o Suc-catalasi.
Lo shock settico è una condizione di pericolo di vita, in cui un’ infezione da gram negativi innesca una risposta infiammatoria sistemica. Il lipopolisaccaride (LPS) o endotossina, un componente della membrana esterna dei batteri gram negativi, è il maggior mediatore, che è riconosciuto soprattutto dal recettore-4 Toll-like presente sulle cellule di Kupffer. Il riconoscimento è seguito dalla produzione di ROS e citochine infiammatorie(61). I cambiamenti patologici, così come il rilascio di AST e ALT e l’ attivazione di NF-kB nel fegato, indotti da LPS e D-galactosamina, sono effettivamente inibiti dalla Man o Suc-catalasi, indicando che la liberazione della catalasi alle cellule non parenchimatiche del fegato, probabilmente alle cellule di Kupffer, è efficace nell’ inibire l’ infiammazione del fegato indotta da LPS.
Il tetracloruro di carbonio è un’ altra epatotossina che causa un grave danno al fegato. Il metabolismo P-450 mediato del tetracloruro di carbonio produce il radicale triclorometile (·CCl3), un metabolita altamente reattivo,
e in seguito, si genera perossido d’ idrogeno. Alcuni ricercatori hanno provato ad evitare i gravi danni epatici indotti da tetracloruro di carbonio con il rilascio di catalasi sulla superfice delle cellule del fegato attraverso la cationizzazione(62). L’ incremento nel siero dei livelli di AST, ALT e lattato deidrogenasi (LDH) è inibito in modo significativo attraverso la ED-catalasi, un derivato catalasico cationizzato che mostrava un legame più rapido e solido al fegato di un altro derivato cationizzato, l’ HMD-catalase. Benchè le proteine cationizzate e i policationi, così come la polilisina e la polietilamina, si leghino in modo non specifico alla superficie cellulare attraverso un’ interazione elettrostatica, è stato osservato che le macromolecole cationizzate, si accumulano in grande misura nel fegato in seguito a somministrazione intravenosa, probabilmente a causa dell’ alta percentuale di flusso sanguigno all’ organo e alla vasta superficie dell’ area. In aggiunta alla captazione epatica, le proteine cationizzate vengono ampiamente captate dai reni perfusi dei ratti. Dopo iniezione intravenosa nei topi, la ED-catalasi viene inviata in modo più efficace rispetto alla catalasi non modificata, al tubulo prossimale del rene. Gli effetti farmacologici dell’ invio ai reni della ED-catalasi, sono stati esaminati in un modello di topo, al quale era somministrato nella cavità peritoneale il cisplatino (CIS-diamin-dicloroplatino II), un agente anticancro usato per il trattamento di diverse neoplasie maligne. Il cisplatino è assorbito dalle cellule tubulari renali e almeno parzialmente metabolizzato nelle specie tossiche, le quali causano in seguito danni tubulari e disfunzioni tubulari. Il meccanismo preciso della tossicità subcellulare e molecolare indotta dal cisplatino, non è stata ancora pienamente compreso, ma il legame a diversi componenti cellulari e la produzione di ROS sono stati riconosciuti come
importanti cause dei gravi danni renali indotti dal cisplatino(63). Ripetute dosi di ED-catalasi riducono enormemente i cambiamenti indotti dal cisplatino dell’ azoto ureico del sangue, della creatinina sierica, dei livelli di nitrito/nitrato, dell’ attività di LDH e del contenuto renale di glutatione totale e dei livelli di malondialdeide. La necrosi indotta dal cisplatino è grave nei tubuli prossimali ed è inibita efficacemente dalla ED-catalasi. L’ inibizione del danno renale da parte della ED-catalasi è associato a una piccola riduzione nell’ attività antitumorale del cisplatino. La somministrazione combinata di ED-catalasi e cisplatino sembra essere efficace nell’ incremento della sopravvivenza dei topi affetti da tumore.
INIBIZIONE DELLE METASTASI TUMORALI
Recenti progressi nelle tecniche chirurgiche e nella chemioterapia, inclusi i farmaci a targeta molecolare, hanno migliorato enormemente le prognosi dei pazienti affetti da cancro. Comunque, il cancro è ancora una malattia che mette in pericolo la vita e la metastasi tumorale è la ragione del fallimento della terapia nei pazienti affetti da cancro. La metastasi delle cellule tumorali è un processo complicato e sequenziale in cui sono coinvolti non solo le cellule tumorali ma anche altre cellule, inclusi i macrofagi, le cellule dendritiche, le cellule endoteliali e i linfociti. Le cellule tumorali metastatiche dopo l’ ingresso nella circolazione sistemica, soffrono di un incremento dello stress ossidativo, che danneggia gravemente molte cellule tumorali e spesso ne provoca la morte. In aggiunta, le radiazioni ed alcuni agenti anticancro incrementano i livelli di ROS all’ interno o attorno alle cellule tumorali, provocando la loro
distruzione. Perciò, le ROS sono l’ arma migliore contro una varietà di tumori. Gli effetti della distribuzione della catalasi sulla crescita di tumori solidi primari è difficilmente valutabile, quindi sono necessari ulteriori approfondimenti. Gli effetti biologici delle ROS sono una funzione della loro efficace concentrazione attorno alle cellule cancerose. Concentrazioni sub letali di ROS sono fortemente efficaci per la loro distruzione e, cosa ancora più importante, possono incrementare l’ espressione di una varietà di geni attraverso l’ attivazione di fattori di trascrizione, così come il fattore di trascrizione kB. Il microambiente delle cellule cancerose può essere caratterizzato come uno degli alti stress ossidativi, così che livelli di ROS non sufficientemente elevati per uccidere le cellule tumorali sarebbero uno stimolo per la progressione del tumore attraverso la promozione della proliferazione, sopravvivenza ed invasione cellulare. In aggiunta a queste proprietà ossidanti, il perossido d’ idrogeno gioca un ruolo importante nella vasodilatazione. Perciò, la rimozione di perossido d’ idrogeno per mezzo della liberazione della catalasi sarebbe efficace per ritardare la crescita delle metastasi tumorali per mezzo della riduzione dell’ apporto di sangue dovuto alla vasocostrizione.
Inibizione delle metastasi epatiche delle cellule tumorali
Il fegato è un sito comune delle metastasi dei tumori primari del tratto gastrointestinale, del pancreas, dei polmoni così come altri siti dell’ organismo. Metastasi epatiche di cellule tumorali sono state esaminate nei topi che hanno ricevuto un’ iniezione di cellule tumorali dalla vena porta. Le cellule tumorali entrano nel fegato attraverso la vena porta, innescando una varietà di cambiamenti, inclusa una risposta infiammatoria. E’ stato dimostrato che l’ inoculazione di cellule di adenocarcinoma del colon
colon26 nella vena porta dei topi, attiva NF-kB sia nelle cellule del fegato che nelle cellule colon26(64). La distruzione funzionale delle cellule di Kupffer abolisce quasi completamente l’ attivazione delle cellule epatiche, indicando l’ importanza dell’ interazione tra le cellule tumorali e le cellule di Kupffer. Fattori solubili dalle cellule di Kupffer così come citochine pro infiammatorie e ROS, sono la causa maggiore dell’ attivazione di NF-kB, il quale incrementa successivamente l’ espressione dell’ adesione di molecole sulle cellule endoteliali. L’ attivazione di NF-kB sia nelle cellule epatiche che in quelle tumorali, viene inibita in modo significativo dall’ iniezione di derivati catalasici diretti al fegato, quali la GaL-catalasi e la Suc-catalasi. Inoltre, questo trattamento con derivati catalasici, riduce significativamente il numero delle colonie metastatiche sulla superficie del fegato, indicando che la rimozione di perossido d’ idrogeno sull’ interfaccia delle cellule tumorali e delle cellule del fegato, è efficace nell’ inibire le metastasi tumorali. E’ stato dimostrato che gli effetti inibitori dei derivati catalasici sono legati alla riduzione dell’ attività della metalloproteasi di matrice (MMP), l’ attività delle quali, è incrementata enormemente nei tumori del fegato. Le MMP sono enzimi proteolitici attivi in processi di invasione e metastasi tumorale. La Gal-catalasi, un derivato che ha come obiettivo gli epatociti, ha mostrato una marcata riduzione dell’ attività delleMMP nel fegato, suggerendo l’ importante ruolo degli epatociti nella crescita metastatica delle cellule tumorali nel fegato.
Inibizione di metastasi polmonari delle cellule tumorali
Il polmone è un altro sito di metastasi, perché è il primo organo che le cellule tumorali incontrano dopo il rilascio dai tumori primari. La distribuzione tissutale e la proliferazione delle cellule tumorali B16-BL6 del melanoma del topo, sono state esaminate nei topi utilizzando cellule tumorali stabilmente transfettate con il gene della luciferasi delle lucciole. Circa il 60-90% delle cellule B16-BL6/Luc iniettate nella vena della coda dei topi Syngeneic C57BL/6 erano recuperate dal polmone dopo 1 ora, dopo che il numero era sceso al 2-4% nelle prime 24 ore. In questa riduzione di numero delle cellule tumorali è coinvolto lo stress meccanico causato dalla respirazione e dalla risposta immune. Poi, il numero delle cellule tumorali nel polmone aumentava con il tempo e le colonie metastatiche potevano essere chiaramente osservate 14 giorni dopo l’ inoculazione del tumore. La PEG-catalasi, un derivato che rimane a lungo in circolo, riduceva notevolmente il numero di cellule B16-BL6/Luc osservate nel polmone 24 ore dopo l’ iniezione del tumore. Queste scoperte suggeriscono che le prime fasi della metastasi tumorale, inclusa l’ adesione delle cellule tumorali alle cellule endoteliali, sono inibite dalla la PEG-catalasi. Inoltre, la PEG-catalasi è efficace nel ridurre il numero di cellule tumorali, persino quando iniettate uno o 3 giorno dopo l’ iniezione del tumore. E’ stato riportato che, la proliferazione cellulare è accelerata dal perossido d’ idrogeno e perciò la rimozione efficace di perossido d’ idrogeno(65) attraverso la PEG-catalasi potrebbe inibire la crescita delle cellule tumorali metastatiche nel polmone. Iniezioni multiple di PEG-catalasi sono risultate efficaci nell’ inibire l’ incremento del numero delle cellule tumorali, e iniezioni quotidiane di PEG-catalasi inibiscono quasi completamente la crescita di cellule tumorali e aumentano la sopravvivenza dei topi affetti da tumore. La PEG-catalasi è inoltre efficace in un differente
modello di metastasi polmonare in cui le cellule di colon26 sono iniettate nella vena della coda dei topi syngeneic BALB/c. In questo modello, iniezioni sub cutanee di catalasi sono efficaci anche nell’ inibire la crescita delle metastasi tumorali nel polmone. Studi di distribuzione tissutale che utilizzano composti 111In-labeled suggeriscono che la ritenzione dell’ attività catalasica in circolo è un promettente approccio per inibire le metastasi polmonari. La rimozione chirurgica dei tumori è ancora un approccio molto comune ed efficace per i tumori solidi, quando è possibile. Progressi nelle tecniche chirurgiche, come la chirurgia endoscopica, hanno enormemente ridotto i traumi dovuti alla chirurgia. Comunque, la rimozione chirurgica dei tumori primari non può evitare la produzione di ROS, che possono essere prodotte dall’ ingresso di cellule infiammatorie nei tessuti danneggiati. Perciò, la rimozione chirurgica del tumore può essere associata alla recidiva del tumore ROS mediato e di metastasi. E’ stato osservato in un modello metastatico spontaneo di melanoma B16 BL6/Luc che la rimozione chirurgica di un tumore alla zampa, incrementava significativamente la sostanza reattiva all’ acido tiobarbiturico, un marcatore della stress ossidativo nel plasma(66). Questo incremento è stato osservato anche nei topi in seguito alla rimozione di un non tumore della zampa, indicando chiaramente che, la chirurgia stessa genera ROS. Inoltre, la rimozione del tumore alla zampa e la successiva produzione di ROS sono legati ad una grande proliferazione di cellule tumorali metastatiche nel polmone, fatto che è in accordo con i precedenti studi preclinici e clinici. Una singola iniezione di PEG-catalasi appena prima della rimozione, sopprime significativamente non solo la per ossidazione ma anche la crescita tumorale metastatica. L’ incremento indotto dalla chirurgia nell’ espressione del recettore per il fattore di crescita epidermico, risulta ridotto anche dal trattamento. Recentemente, gli effetti antimetastatici sono stati
osservati utilizzando derivati della SOD in modelli spontanei di metastasi polmonare.
Inibizione delle diffusione peritoneale delle cellule tumorali
La diffusione peritoneale è un problema molto importante per i pazienti affetti da cancro gastrointestinale, ed è la causa di morte di pazienti con tumori gastrici, ovarici e pancreatici. La diffusione peritoneale viene stabilita attraverso l’ attacco delle cellule cancerose distaccate dai tumori primari alle cellule mesoteliali, e la penetrazione delle cellule nei tessuti attraverso il peritoneo. Il processo di questo tipo di metastasi tumorale è inoltre regolato da una varietà di molecole chiave, incluse le MMP e le molecole di adesione, e l’ espressione di queste molecole è almeno in parte regolata dalle ROS. Ancora, è riportato che il trauma chirurgico, così come la successiva guarigione delle ferite promuove la locale ricomparsa. Precedenti studi hanno mostrato che la catalasi derivata da cellule del sangue rosso previene l’ adesione di cellule tumorali al peritoneo e la successiva ricomparsa del cancro. Sono stati riprodotti gli effetti inibitori della catalasi in modelli di diffusione peritoneale di cellule B16-BL6/Luc o cellule colon26(56). Una inibizione più grande è stata ottenuta con la PEG-catalasi, probabilmente perché questo derivato è trattenuto per un periodo più lungo rispetto alla catalasi stessa. L’ incremento dell’ espressione di una varietà di geni così come, la molecola-1 di adesione intracellulare, la molecola-1 di adesione vascolare, le metalloproteasi della matrice e la membrana di tipo 1, nel grande omento erano inibiti significativamente dalla PEG-catalasi. Un risultato inibitorio migliore è stato ottenuto con la ED-catalasi, un derivato cationizzato, che ha mostrato una prolungata presenza nella cavità peritoneale dopo l’ iniezione intraperitoneale nei topi,
rispetto alla PEG-catalasi. In più, l’ uso di una gelatina hydrogel come formulazione a rilascio controllato incrementa in modo significativo la potenza della ED-catalasi nell’ inibire la diffusione peritoneale delle cellule tumorali.
CONCLUSIONI E PROSPETTIVE.
L’ ossigeno è indispensabile per la vita, e noi consumiamo ossigeno in ogni momento della nostra vita con l’ aiuto di un sistema di difesa contro i metaboliti altamente tossici dell’ ossigeno. Ci sono molti studi che mostrano che lo stress ossidativo è implicato in varie malattie umane. I risultati della liberazione di catalasi in modelli di topi affetti da varie malattie, indicano che la somministrazione esterna di derivati catalasici è molto efficace nell’ inibire o prevenire eventi patologici ROS mediati. La dose di catalasi utilizzata negli studi riportati in letteratura(56) è molto inferiore rispetto al livello endogeno e perciò queste scoperte suggeriscono che la rimozione di perossido d’ idrogeno fuori dalle cellule è altamente importante per gli effetti terapeutici. A discapito delle basse dosi dei derivati catalasici, i loro possibili effetti collaterali dovrebbero essere attentamente esaminati prima delle applicazioni cliniche, in quanto il perossido d’ idrogeno, il substrato per la catalasi, ha una varietà di attività come la vasodilatazione. A causa del fondamentale ed essenziale ruolo dell’ ossigeno nella vita, la liberazione di catalasi avrà un’ ampia applicazione nel futuro più prossimo.