CAPITOLO 1
1
L’OCCHIO UMANO: PATOLOGIE ONCOLOGICHE E TERAPIE PER
LA LORO CURA
1.1 Struttura dell’occhio umano
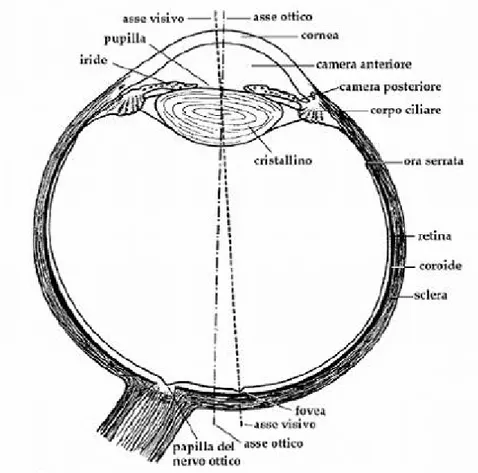
L’occhio, o bulbo oculare (Fig. 1.1), è una struttura sferoidale del diametro di circa 2.5 cm con una sporgenza pronunciata sulla superficie anteriore. La parte esterna è formata da tre strati di tessuto: il più esterno è la sclera, un rivestimento protettivo che ricopre circa cinque sesti della superficie oculare e che, nella parte anteriore, è in continuità con la cornea, trasparente e sporgente. Lo strato intermedio è la coroide, molto ricca di vasi sanguigni, che riveste i tre quinti posteriori del bulbo oculare ed è in continuità con il corpo ciliare e con l’iride che si trova nella parte anteriore dell’occhio. Infine, lo strato più interno è la retina, sensibile alla luce.
La cornea è una membrana trasparente, convessa in avanti, costituita da cinque strati, attraverso la quale la luce penetra all’interno dell’occhio. Dietro la cornea c’è una cavità (camera anteriore) che contiene un liquido trasparente e acquoso, l’umor acqueo, che la separa dal cristallino, una struttura che rappresenta la “lente” dell’occhio. Il cristallino è una sfera appiattita formata da un gran numero di fibre trasparenti disposte in strati; è circondato dal
muscolo ciliare, di forma circolare, a cui è collegato da alcuni legamenti. Insieme ai tessuti circostanti, il muscolo ciliare forma il corpo ciliare che, appiattendo il cristallino o arrotondandolo, ne modifica la lunghezza focale, cioè la distanza alla quale esso mette a fuoco le immagini.
Figura 1.1 – Bulbo oculare destro in sezione orizzontale, con gli assi ottici.
Da G. Chiarugi, Istituzioni di Anatomia dell’ Uomo, Vallardi Editore
L’iride è una formazione circolare, pigmentata, localizzata dietro la cornea e davanti al cristallino; essa presenta un’apertura circolare al centro, la pupilla, le cui dimensioni sono controllate da un muscolo posto sul suo margine. Contraendosi e rilassandosi, questo muscolo fa allargare o rimpicciolire la pupilla stessa, controllando la quantità di luce che penetra nell’occhio.
Dietro il cristallino, il bulbo oculare contiene una sostanza gelatinosa trasparente, l’umor vitreo, racchiusa da uno strato membranoso sottile, la membrana ialoidea. La pressione dell’umor vitreo mantiene il bulbo oculare disteso.
La retina è una membrana fotosensibile, formata in gran parte da cellule nervose stratificate che poggiano, dal lato esterno della retina, su uno strato pigmentato. Queste cellule si distinguono, a seconda del loro aspetto e della loro funzione, in coni e bastoncelli e hanno differenti sensibilità ai colori e alla quantità di luce. I coni sono più sensibili ai colori e permettono un’alta acutezza visiva; i bastoncelli sono più sensibili dei precedenti alla luce e permettono la visione crepuscolare a scarsa acutezza visiva (con il termine acutezza visiva si intende la capacità di discriminare un oggetto; essa è tanto maggiore quanto minore è la distanza alla quale si percepiscono come separati due punti appartenenti a quell’oggetto). Sulla retina, in perfetta opposizione alla pupilla, si trova una piccola zona ellissoidale del diametro di circa 2.5 mm, di colore giallo, chiamata macula (fovea centralis): essa corrisponde alla zona di massima acutezza visiva dell’occhio. Nella fovea le cellule fotosensibili sono rappresentate solo da coni. Intorno a essa sono presenti sia coni sia bastoncelli; procedendo verso la periferia della zona sensibile i coni si diradano e, all’estremità esterna, si trovano solo bastoncelli.
Nel punto in cui il nervo ottico penetra nel bulbo oculare si trova una piccola zona rotonda di retina priva di cellule fotosensibili, la papilla ottica, che rappresenta il punto cieco dell’occhio [1, 2].
1.2 Principali patologie oncologiche a carico dell’occhio e terapie per la loro
cura
Le più comuni neoplasie maligne intraoculari che si sviluppano in età adulta sono essenzialmente tre: il melanoma uveale, le metastasi e l’emangioma della coroide. In età pediatrica, invece, il tumore più significativo risulta essere il retinoblastoma.
Tra le patologie citate, il melanoma uveale è quella che più di frequente colpisce gli adulti e che ha maggior significatività clinica, rappresentando circa 2.5 % del totale delle neoplasie umane. Questo tipo di tumore tende a crescere sia all’interno del bulbo, invadendo e disorganizzando i tessuti intraoculari, sia all’esterno, infiltrando la sclera ed i tessuti orbitali.
Presenta un’elevata tendenza alla metastasi che avviene unicamente per via ematica, dal momento che a livello bulbare non sono presenti vasi linfatici.
Il retinoblastoma è una patologia che può presentarsi in forma ereditaria o sporadica e coinvolgere uno od entrambi gli occhi. Ha un’incidenza compresa tra lo 0,01 % e lo 0,04 % e risulta responsabile del 5 % di tutti i casi di cecità [16]. Tale neoplasia può essere letale se non viene prontamente identificata e curata.
Negli ultimi venti anni, il trattamento delle patologie neoplastiche a carico dell’occhio è cambiato notevolmente, passando dall’intervento radicale di enucleazione del bulbo oculare ai trattamenti conservativi effettuati in minima parte per via chirurgica e prevalentemente mediante radioterapia.
Per quanto riguarda il melanoma uveale, l’evidenza anatomica di un tumore completamente contenuto nel guscio sclerale e l’assenza di vasi linfatici bulbari hanno giustificato per anni l’utilizzo dell’enucleazione quale unica metodica terapeutica. Tuttavia, nonostante l’apparente radicalità dell’intervento e l’assenza di metastasi al momento del trattamento, l’analisi di ampie casistiche retrospettive ha evidenziato un elevato tasso di mortalità, dovuto, forse, ad una disseminazione di cellule neoplastiche durante l’intervento chirurgico [16].
Anche nella cura del retinoblastoma l’enucleazione è stata per decenni la terapia più efficace ed è tuttora in molti casi la più valida scelta terapeutica, anche se negli ultimi anni l’introduzione di valide terapie alternative, come fotocoagulazione, crioterapia, radioterapia con placche episclerali, chemioterapia e termoterapia, ha consentito di ridurre i casi di enucleazione, contribuendo a mantenere un buon grado di acuità visiva e, quindi, ad assicurare ai pazienti una miglior qualità della vita.
1.3 Terapie conservative “classiche”
Tra le terapie conservative che vengono utilizzate nella cura delle neoplasie oculari, la chemioterapia, impiegata in passato solo nel retinoblastoma extraoculare e metastatico, è attualmente divenuta un trattamento di prima scelta anche nel retinoblastoma intraoculare. I vantaggi dell’utilizzo della chemioterapia sistemica sono la riduzione delle dimensioni dei
focolai da trattare e quindi la possibilità di utilizzare minori energie termiche e un maggior controllo delle micrometastasi durante il trattamento conservativo.
La fotocoagulazione per il trattamento del retinoblastoma consiste nel circondare il tumore con un anello di “spots” su retina sana (tecnica indiretta) per poi trattarlo direttamente sulla sua superficie (tecnica diretta). La fotocoagulazione è stata usata per decenni con enorme successo, successivamente sostituita da quella con laser, che però non ha rappresentato un’alternativa sempre sicura ed efficace. Recentemente l’introduzione della termoterapia transpupillare (TTT) ha rivalutato l’uso delle sorgenti laser associate alla chemioterapia. Le complicanze più comuni della fotocoagulazione comprendono occasionali emorragie retiniche, trazioni retiniche, danno irideo, edema corneale e opacità del cristallino [17].
La crioterapia è efficace nei tumori fino a 3-4 mm di diametro e 2 mm di spessore. Il tumore deve essere perfettamente localizzato e viene criocoagulato con tre successivi spots (nella stessa sede) a temperatura di –80 °C, di 30-60 secondi di durata ciascuno. La più frequente complicanza è l’edema congiuntivale e palpebrale.
Il trattamento conservativo attualmente più utilizzato per la maggior parte delle neoplasie oculari è però la radioterapia, il cui scopo è quello di sterilizzare il tumore inibendone la capacità replicativa cellulare. Dal momento che alcune patologie, tra cui il melanoma uveale, si sono dimostrate radioresistenti, è subentrata la necessità di utilizzare dosi elevate di radiazioni che in genere, però, sono mal tollerate dalle strutture intraoculari più radiosensibili come cristallino e corpo ciliare. Per questo motivo in alternativa alla radioterapia con sorgente esterna (teleterapia) e allo scopo di somministrare alte dosi al tumore risparmiando invece i tessuti peritumorali sani, sono state messe a punto tecniche di irradiazione più focalizzate, in grado di consentire una maggior salvaguardia delle strutture sane. La radioterapia di contatto mediante placche episclerali (o brachiterapia) è una di queste tecniche e consiste nell’inserimento delle sorgenti radioattive direttamente all’interno del tumore o nelle sue immediate vicinanze. Le placche episclerali sono costituite da gusci metallici di forma e dimensioni adeguate, contenenti un isotopo radioattivo (Rutenio106 beta-emittente o Iodio125 gamma-emittente). La placca viene suturata alla sclera in corrispondenza del tumore permanendo il tempo necessario (sino a 10 giorni) a somministrare una dose totale
di circa 100 Gy. Grazie al guscio metallico l’irradiazione avviene prevalentemente verso il tumore con una dispersione minima ai lati della placchetta, evitando di esporre l’area peribulbare a significative quote di radiazione ionizzante. Mediante questa tecnica possono essere trattate lesioni con spessore massimo di 5-6 mm [6, 17].
Figura 1.2- Placche episclerali per brachiterapia - applicatori COMS Eckert & Ziegler: struttura e
configurazione degli slot per l’alloggiamento dei semi radioattivi.
Per quanto la brachiterapia si sia rivelata un trattamento piuttosto ben tollerato dai pazienti, studi clinici hanno evidenziato come essa possa produrre complicanze tardive legate alla perdita di acuità visiva in una percentuale non trascurabile dei casi, riducendo notevolmente le attrattive della terapia conservativa. Negli ultimi anni sono stati fatti tentativi per ridurre la dose di radiazioni somministrata ai pazienti trattati con radioterapia a placche episclerali, cercando di compensare la riduzione nella dose di radiazioni con la termoterapia.
1.4 Terapie “biologiche”: l’ipertermia oncologica
Con il termine ipertermia oncologica si intende l’induzione nei tessuti biologici di temperature di poco superiori a quella fisiologica, allo scopo di favorire un effetto citotossico sulle cellule neoplastiche. Numerosi studi hanno dimostrato che l’esposizione alle elevate temperature (da 41 °C a 45 °C) è in grado di determinare la morte delle cellule tumorali in maniera temperatura e dose dipendente, legata ad una riduzione dell’efficacia dei sistemi riparativi presenti a livello cellulare, funzionante invece nelle cellule sane. A tali temperature la maggior parte delle cellule neoplastiche, a causa delle peculiari anomalie del patrimonio genetico ed enzimatico, non è in grado di riparare i danni dovuti al calore e può andare incontro alla morte cellulare programmata, o apoptosi. Tale danno viene ulteriormente amplificato grazie alle caratteristiche vascolari del tumore che, generalmente, è irrorato da una rete di vasi sanguigni insufficiente che favorisce un microambiente scarsamente ossigenato, a pH ridotto e povero di sostanze nutritive [3, 18].
Il microambiente ipossico presente nei tumori solidi influenza non solo le cellule tumorali, ma anche le cellule stromali non-neoplastiche e conferisce al tumore una maggior aggressività ed un aumentato potenziale metastatico. Inoltre l’ipossia fornisce alle cellule tumorali un microambiente che facilita la radio e la chemio-resistenza, rendendole nettamente più resistenti delle cellule normo-ossigenate alle radiazioni ionizzanti. La base molecolare di tale resistenza risiede nel fatto che, mentre in condizioni di normossia l’ossigeno reagisce con i radicali prodotti nel DNA dalle radiazioni ionizzanti fissando il danno in maniera permanente, in assenza di ossigeno la maggior parte di tali radicali viene riconvertita in una forma non danneggiata, in seguito alla donazione di idrogeno da parte di gruppi sulfidrilici non proteici presenti nella cellula.
Sebbene l’ipertermia figuri tra le opzioni terapeutiche di provata efficacia riconosciute dall’oncologia, i meccanismi d’interazione tra il calore e i processi non sono del tutto noti. Le conseguenze dell’esposizione al calore di tessuti biologici normali e patologici sono alcuni dei molti obiettivi della ricerca nella biologia molecolare.
1.5 Interazione tra trattamenti convenzionali e ipertermia
Studi in vivo hanno dimostrato che l’ipertermia non ha efficacia a lungo termine se usata come singolo agente terapeutico, ma l’associazione di due o più opzioni terapeutiche in varie patologie neoplastiche e a determinati stadi di progressione della malattia, come radiazioni ionizzanti o chemioterapia, consente una migliore radicalità dell’intervento e quindi maggiori garanzie di riuscita. Infatti il calore esalta gli effetti delle terapie convenzionali sul tumore, senza aumentarne gli effetti collaterali (cioè gli effetti debilitanti su tessuti ed organi sani derivanti dalla citotossicità di chemioterapia e radioterapia), permettendo un significativo miglioramento nel controllo della massa tumorale bersaglio. I vasi tumorali, infatti, non consentono la vasodilatazione fisiologica necessaria ad un’adeguata dissipazione del calore introdotto, favorendo l’azione citotossica delle radiazioni ionizzanti e dei farmaci chemioterapici sulle cellule in attiva proliferazione.
Un altro considerevole vantaggio dell’ipertermia è costituito dal fatto che la reattività immunitaria del malato tumorale, solitamente depressa dalla malattia stessa e dalle cure messe in atto per controllarla, viene potenziata dall’ipertermia, la quale, mimando il meccanismo di difesa fisiologica rappresentato dalla febbre, provoca la liberazione di sostanze immunoregolatrici (citochine), che hanno effetto protettivo per l’organismo del malato. La sinergia, quindi, dei trattamenti combinati di ipertermia e chemioterapia o radioterapia può consentire il raggiungimento dello stesso risultato, utilizzando le terapie convenzionali a dosaggi ridotti, con conseguente riduzione dei loro, spesso pesanti, effetti collaterali.
1.5.1 Ipertermia e chemioterapia
L’associazione tra calore e farmaci citostatici si è dimostrata complementare in quanto l’ipertermia agisce prevalentemente sulle cellule ipossiche e scarsamente nutrite che con più difficoltà vengono raggiunte dai chemioterapici, nelle porzioni più profonde della massa tumorale. L’aumento della permeabilità cellulare consente una maggiore possibilità di passaggio di farmaci all’interno della cellula e quindi può permettere di ottenere i medesimi risultati con una riduzione del dosaggio dei farmaci chemioterapici.
1.5.2 Ipertermia e radioterapia
L’interazione tra ipertermia e radiazioni ionizzanti trae origine dall’attivazione di due diversi fenomeni che coinvolgono differenti popolazioni cellulari e agiscono in maniera tra loro complementare. Innanzitutto il calore induce un effetto citotossico diretto sulle cellule ipossiche tumorali resistenti alle radiazioni: queste, infatti, dal momento che tendono a trovarsi lontane dai vasi sanguigni, e quindi lontane dall’azione refrigerante della circolazione sanguigna, quando vengono sottoposte al calore raggiungono una temperatura più alta delle cellule normo-ossigenate e possono essere uccise dalla sola citotossicità del calore, o rese comunque più sensibili alle radiazioni.
Le cellule tumorali ben ossigenate, situate più vicino ai grandi vasi sanguigni, restano generalmente più fredde, ma vengono uccise dalle radiazioni, dal momento che l’ipertermia, anche moderata (< 42˚C), siè dimostrata in grado di aumentare il flusso sanguigno tumorale, determinando una maggiore concentrazione di ossigeno e, di conseguenza, una maggiore diffusione dei farmaci antiblastici, una migliore riossigenazione, e un’aumentata efficacia della radioterapia.
Dati di laboratorio derivanti dalle evidenze sperimentali, hanno mostrato un incremento di efficacia, a seconda dei tipi di tumore e dei protocolli terapeutici, da circa una volta e mezzo a tre volte, rispetto alle sole radiazioni, suggerendo che il risultato congiunto delle due terapie sia addirittura migliore di quanto atteso dall’applicazione indipendente dei due trattamenti ed è massimizzato se questi vengono somministrati entro un breve intervallo di
tempo [11, 13]. L’effetto sinergico di ipertermia e radioterapia è quantificato dal Thermal
Enhancement Ratio (TER), definito come:
TER= _________dose di RT senza ipertermia_________ dose di RT per effetto equivalente con ipertermia
Studi su cavie relativi a diverse tipologie di tumore oculare hanno mostrato un innalzamento dei valori di TER da 1.5, quando l’applicazione dei due trattamenti avviene in sequenza, a 4.4 fino a 5 quando la somministrazione è contemporanea [10, 13]. Ciò suggerisce che l’inibizione della radioresistenza dovuta all’ipertermia sia più efficiente se la temperatura del tumore è elevata durante il processo di irradiazione.
Il trattamento congiunto con radioterapia ed ipertermia permette quindi di avere un pari controllo del tumore e un profilo di tossicità più basso e più esteso temporalmente rispetto al solo trattamento con radiazioni e, dal momento che è possibile utilizzare una più bassa dose di radiazioni mantenendo simili risultati, si possono utilizzare cicli di trattamento radio-ipertermico addizionali per curare potenziali recidive negli anni a venire.
1.5.3 La “terapia sandwich”
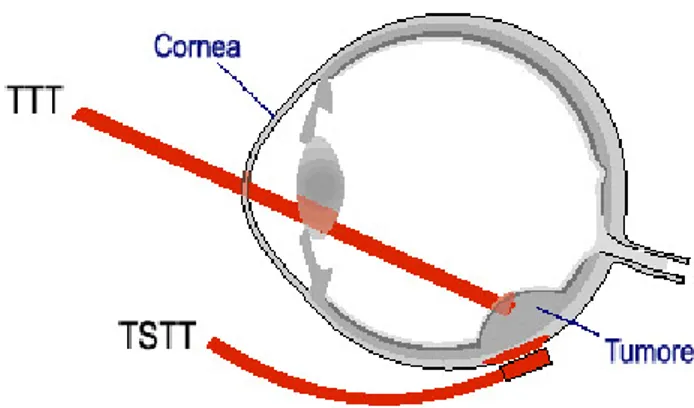
Per quanto riguarda i trattamenti oncologici in ambito oculistico che sfruttano l’azione combinata di terapie convenzionali ed ipertermia, merita di essere citata la cosiddetta “terapia sandwich”. Essa prevede l’associazione di termoterapia transpupillare e brachiterapia. La termoterapia transpupillare (TTT), innanzitutto, adotta un approccio molto poco invasivo, realizzato con un laser a diodi a pupilla dilatata, andando a colpire e a distruggere con un raggio la parte più interna del tumore. La parte più esterna viene trattata applicando delle piccole placche episclerali per effettuare la brachiterapia. Questo trattamento viene denominato “terapia sandwich”, in quanto dietro al tumore vengono applicate le placche e, contemporaneamente, davanti la neoplasia viene colpita dal laser. La “terapia sandwich” consente di trattare conservativamente i melanomi localizzati al polo posteriore dell’occhio, con spessore fino a 12.5 mm, se vengono utilizzate placche caricate con Iodio125, e sino a 8.5 mm, se vengono impiegate placche di Rutenio106. Con tale trattamento è stato possibile
ottenere un miglior controllo locale del tumore, soprattutto quando questo si trova in prossimità del disco ottico e della foveola riducendo in maniera statisticamente significativa la percentuale di recidive a cinque anni (2.5 % rispetto al 4-11 % della sola brachiterapia) e non si sono rilevate differenze sostanziali nell’incidenza di complicanze rispetto alla monoterapia [6, 7].
Figura 1.4- Terapia sandwich.
Altri studi condotti sulla termoradioterapia episclerale con dosi di radiazioni ridotte del 30 % circa rispetto alla brachiterapia senza ipertermia, hanno dimostrato tassi di controllo del tumore simili a quelli ottenuti con dose di radiazione piena, con complicazioni quali emorragie nell’umor vitreo e distaccamento emorragico della retina che scompaiono se la temperatura viene mantenuta al di sotto dei 44 °C [11, 12]. L’addizione dell’ipertermia riduce quindi la dose di radiazione richiesta per la completa sterilizzazione del tumore e può rendere non necessari ulteriori trattamenti di coagulazione volti al controllo delle possibili recidive.
1.6 Considerazioni sull’efficacia terapeutica
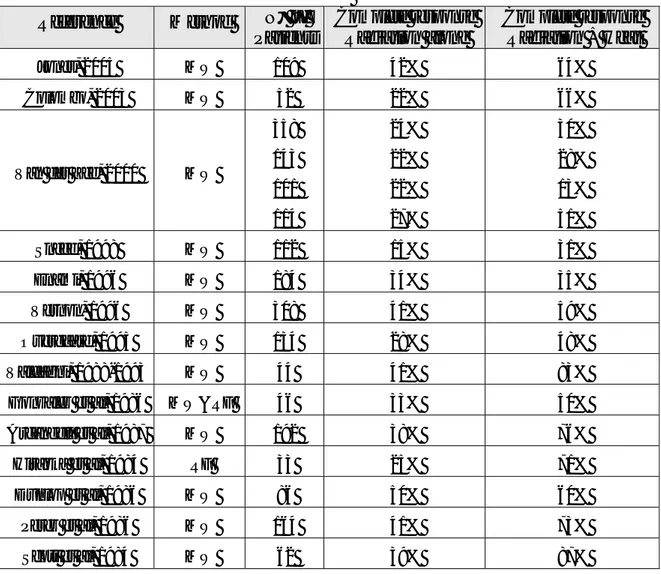
Nella tabella riportata di seguito vengono messi a confronto i risultati ottenuti nella cura di differenti tipi di tumore adottando tecniche classiche in monoterapia o in combinazione con ipertermia elettromagnetica. La prima colonna di percentuali si riferisce a terapie a raggi x, la
seconda alla terapia combinata. La risposta alla terapia viene considerata “complete response” nei casi in cui il tumore non ricompare per almeno cinque anni e quindi si può essere certi di aver ottenuto la guarigione.
Tabella 1.1 – Risultati di studi sull’ipertermia a confronto
Da C.Masiani, A.Fiorentino, A.Iori, F.Iori, Ipertermia a Microonde e Termoregolazione e da G. C. van Rhoon, , Hyperthermia in Cancer Treatment. Concepts, Benefits and Future Perspectives
Reference Method N° of Patients Complete response Radiation alone Complete response Radiation + Heat Jones, 2005 MW 109 42% 64% Colombo, 2003 MW 52 22% 66%
Van der Zee, 2000 MW
358 143 101 114 24% 22% 22% 27% 30% 28% 13% 51% Sneed, 1998 MW 112 15% 31% Enami, 1996 MW 184 34% 35% Vernon, 1996 MW 308 41% 59% Overgaard, 1995 MW 134 28% 48% Valdagni, 1988-1993 MW 44 41% 83%
Gonzalez et al, 1986 MW&RF 46 33% 50%
Arcangeli et al, 1987 MW 192 38% 76%
Hiraoka et al, 1984 RF 33 25% 71%
Dunlop et al, 1986 MW 86 50% 60%
Perez et al, 1986 MW 164 41% 73%
Scott et al, 1984 MW 62 39% 87%
Dai risultati appare evidente come le percentuali di successo aumentino quando alla radioterapia viene abbinato il trattamento elettromagnetico, dimostrando un effetto sinergico delle due tecniche. È stato inoltre provato che, utilizzando solo ipertermia elettromagnetica i
risultati sono comunque migliori di quelli ottenuti con le altre tecniche di riscaldamento. Sono tuttora in corso studi per verificare se la terapia elettromagnetica sia più efficace perché il riscaldamento ottenuto in questo modo è migliore o perché il danneggiamento riportato dalle cellule tumorali è enfatizzato dalla presenza del segnale elettromagnetico in quanto tale, a prescindere dal fatto che provochi riscaldamento.