34
CAPITOLO 2: PARTE SPERIMENTALE
2.1 MATERIALI
La preparazione dei sistemi micro e nanoparticellari, le caratterizzazioni effettuate e la sintesi del poliuretano funzionalizzato, hanno richiesto l’utilizzo dei seguenti solventi e reattivi:
• Polivinilalcol (Aldrich, Mw = 13000-23000, 87-89% idrolizzato) • Tween80 (Acros, d = 1,08)
• Poli(N-vinil-2-pirrolidinone) (Fluka, Mr = 360000) • Diclorometano (Carlo Erba, purezza ≥ 99,5%)
• Acetonitrile (Carlo Erba, purezza ≥ 99,9% grado HPLC) • Tampone fosfato pH = 7,4 (Sigma)
• Poli(ε-caprolattone) diolo (Aldrich, Mn = 2000) essiccato in stufa sotto vuoto a T = 60°C per 48 ore prima dell’uso
• 1,2-Dicloroetano (Carlo Erba, purezza ≥ 99,5%) essiccato a riflusso in Soxhlet su setacci molecolari
• Etere di petrolio (Carlo Erba, miscela 40-70°C) • Metanolo (Carlo Erba, purezza ≥ 99%)
• Dilaurato di dibutilstagno (Fluka) • Cloroformio (Aldrich)
• Acido trifluoroacetico (Aldrich) • L-lisina etil estere (Fluka)
L’etil-2,6-diisocianatoesanoato (LDI) e i polimeri C27, CLCE-635, CLCE-650, CLC-2000, ELC-2000, CHC-1250 erano disponibili da un precedente lavoro di tesi.
Il Paclitaxel è stato gentilmente messo a disposizione dalla Sorin Biomedica Cardio S.P.A.
35
2.2 METODI
MICROSCOPIA ELETTRONICA A SCANSIONE (SEM)
L’analisi morfologica delle micro e nanosfere è stata eseguita mediante microscopia elettronica a scansione utilizzando uno strumento SEM JEOL JSM 300 e lavorando a 12 o 14 kV.
CALORIMETRIA A SCANSIONE DIFFERENZIALE (DSC)
L’analisi termica delle microsfere è stata realizzata mediante un calorimetro differenziale a scansione Perkin-Elmer DSC 7 collegato ad un computer per l’elaborazione dei dati. L’analisi è stata eseguita per riscaldamento da 30 a 250°C alla velocità di 20°C/min. Le analisi sono state realizzate su 5-7 mg di campione pesato all’interno di apposite capsuline di alluminio.
CROMATOGRAFIA A ESCLUSIONE DIMENSIONALE (SEC)
Il peso molecolare e la distribuzione del peso molecolare del PU-GRGDG è stato determinato tramite lo strumento Waters mod 600 E equipaggiato di rivelatore a indice di rifrazione Waters mod 410 e sistema di acquisizione su personal computer Millennium Chromatography Manager Waters. Come fase stazionaria è stata utilizzata una colonna PL gel Mixed-C, e come eluente è stato impiegato cloroformio. Per la calibrazione sono stati impiegati campioni monodispersi di polistirene.
36
RISONANZA MAGNETICA NUCLEARE (NMR)
Gli spettri di risonanza magnetica al protone (1H-NMR) per il PU-GRGDG, l’estensore contenente il peptide e per il poliuretano non funzionalizzato, sono stati eseguiti a 600MHz con lo spettrometro NMR BRUKER AVANCE DMX600. I chemical shift sono riportati in δ (ppm) rispetto al TMS usato come standard interno.
SPETTROSCOPIA INFRAROSSA (IR)
Gli spettri sono stati effettuati con uno strumento Perkin Elmer Spectrum-One FT-IR Spectrometer. Il PU-GRGDG, in forma di film è stato analizzato in modalità ATR (Riflettanza Totale Attenuata). Le microsfere di PU-GRGDG sono state analizzate in modalità FTIR, disposte su una pasticca di KBr.
SPETTROSCOPIA ULTRAVIOLETTA (UV)
Gli spettri del PU-GRGDG protetto, PU-GRGDG deprotetto e di ECL-2000 sono stati effettuati in soluzione di CHCl3 (4x10-3 g/ml) con uno strumento UV-VIS Shimadzu Recording Spectrophotometer UV-2100, utilizzando il solvente puro come riferimento.
CROMATOGRAFIA LIQUIDA AD ALTE PRESTAZIONI (HPLC)
Per le analisi è stato utilizzato uno strumento HPLC della serie 200 Perkin-Elmer dotato di autocampionatore, pompa binaria e rilevatore UV. La colonna impiegata è stata una Alltech C4 Prosphere HP per cromatografia in fase inversa lunga 25 cm e di diametro 4,6 mm. Le analisi sono state effettuate in condizioni isocratiche con una fase mobile costituita da una miscela CH3CN/H2O 58%/42%. La velocità di flusso era di 1 ml/min, il volume iniettato di 100 µl e il rivelatore è stato settato a 230 nm.
37
MICROSCOPIA A FORZA ATOMICA (AFM)
Lo strumento adoperato è un Autoprobe CP della Park Scientific Instruments equipaggiato con uno scanner con escursioni massime x-y-z di 100µm-100µm-7µm rispettivamente e operante per mezzo di un sistema di controllo (Scan Master) che permette la misura, il riposizionamento e l’ingrandimento in una zona prescelta.
2.3 RETTA DI TARATURA PER HPLC
Su un foglio di carta lucida sono stati accuratamente pesati 100 mg di Paclitaxel e sono stati quantitativamente trasferiti in un matraccio tarato da 100 ml. Il farmaco è stato sciolto nella minor quantità possibile di acetonitrile e la soluzione ottenuta è stata portata a volume con una miscela acqua/acetonitrile 1:1. Con una Guilson, è stato prelevato 1 ml di tale soluzione ed è stato trasferito in un altro matraccio tarato da 100 ml e portato a volume. Successivamente sono stati prelevati 10 ml di tale soluzione, trasferiti in un altro matraccio tarato da 100 ml e portati a volume. Da quest’ultima soluzione sono stati prelevati 0, 1, 2, 3, 5, 7, 9, 12, 15 e 30 ml, trasferiti in matracci tarati da 100 ml e portati a volume. Le soluzioni ottenute sono state analizzate mediante
HPLC (fase mobile: CH3CN/H2O 58%/42%; volume iniettato: 100 µl; flusso: 1 ml/min; λ = 230 nm). La retta di taratura ottenuta è riportata in appendice X.
2.4 PREPARAZIONE E CARATTERIZZAZIONE DELLE
MICROSFERE
Le varie tipologie di microsfere sono state preparate con la tecnica di evaporazione-estrazione del solvente ad emulsione singola olio in acqua. La tecnica è basata sulla dispersione di una soluzione organica di polimero e farmaco in una fase acquosa. Una microemulsione viene ottenuta mediante agitazione meccanica che porta alla formazione di microgocce di soluzione organica disperse nella fase acquosa. Il solvente
38 organico viene successivamente fatto evaporare lentamente in modo da ottenere l’indurimento delle microgocce. Le particelle ottenute vengono infine isolate dall’ambiente di reazione.
2.4.1 PREPARAZIONE DELLE MICROSFERE DI C27, CLCE-635,
CHC-1250, CLCE-650, CLC-2000, ELC-2000 e PU-GRGDG CON PVA
COME EMULSIONANTE.
In un beaker da 250 ml sono stati posti con un cilindro graduato 100 ml di acqua distillata in cui sono stati sciolti, sotto agitazione e leggero riscaldamento (40°C), 2,5 g di PVA aggiungendoli a piccole porzioni. Dopo circa 30 minuti è stata ottenuta una soluzione limpida. Tale soluzione è stata raffreddata a temperatura ambiente e versata in un pallone a tre colli da 500 ml munito di agitatore meccanico.
In un becker da 25 ml sono stati posti 5 ml di DCM e in essi sono stadi sciolti sotto agitazione, 300 mg di polimero insieme a 15 o 60 mg di Paclitaxel accuratamente pesati in modo da ottenere rispettivi rapporti in peso farmaco/polimero 5 o 20%. La soluzione limpida ottenuta è stata versata velocemente nel pallone a tre colli e i due colli laterali sono stai chiusi con tappi di vetro smerigliati.
Le due fasi sono state agitate a 800 rpm per due ore al fine di ottenere una microemulsione. Successivamente la velocità di agitazione è stata diminuita a 250 rpm ed è stato tolto uno dei due tappi. L’emulsione è stata lasciata in agitazione a 250 rpm per tutta la notte.
Le particelle sono state isolate per centrifugazione selettiva: la prima centrifugazione è stata effettuata a 5000 rpm per 5 minuti. Il surnatante è stato raccolto e centrifugato a 14000 rpm per 5 minuti.
Le particelle ottenute sono state accuratamente lavate 8-10 volte con acqua distillata e poste in liofilizzatore. Infine, una volta liofilizzate, sono state conservate in essiccatore in frigorifero ad una temperatura di circa 4°C. Per ogni polimero sono state preparate, parallelamente e con la stessa procedura, delle microsfere senza farmaco incapsulato (microsfere placebo) e sono state trattate e conservate allo stesso modo di quelle caricate con Paclitaxel.
39
2.4.2 PREPARAZIONE DELLE MICROSFERE DI CLCE-635,
CHC-1250 e CLCE-650 CON LA MISCELA PVA+TWEEN80 COME
EMULSIONANTE.
In un beaker da 250 ml è stata preparata una soluzione di PVA al 2,5% (g/100 ml) che successivamente è stata trasferita in un pallone a tre colli da 500 ml munito di agitatore meccanico come riportato nel paragrafo 2.3.1.
In un becker da 25 ml sono stati posti 5 ml di DCM e in essi sono stadi sciolti, sotto agitazione, 200 mg di polimero insieme a 10 mg di Paclitaxel accuratamente pesati. La soluzione limpida ottenuta è stata versata velocemente nel pallone a tre colli e i due colli laterali sono stai chiusi con tappi di vetro smerigliati.
Le due fasi sono state agitate a 800 rpm per due ore. Successivamente la velocità di agitazione è stata diminuita a 250 rpm ed è stato tolto uno dei due tappi. A questo punto sono stati aggiunti 1,5 ml di Tween80 (1,62 g) e l’emulsione è stata lasciata in agitazione a 250 rpm per tutta la notte.
Le particelle sono state isolate dall’ambiente di reazione come descritto nel paragrafo 2.3.1. Per ogni polimero sono state preparate, parallelamente e con la stessa procedura, delle microsfere placebo, trattate e conservate allo stesso modo di quelle caricate con Paclitaxel.
2.4.3 PREPARAZIONE DELLE MICROSFERE DI CHC-1250 CON LA
MISCELA PVA+PVP COME EMULSIONANTE
In un beaker da 250 ml sono stati posti con un cilindro graduato 100 ml di acqua distillata in cui sono stati sciolti, sotto agitazione e leggero riscaldamento (40°C), 2,5 g di PVA e 250 mg di poli(N-vinil-2-pirrolidinone) aggiungendoli a piccole porzioni. Dopo l’ottenimento di una soluzione limpida, quest’ultima è stata raffreddata a temperatura ambiente e versata in un pallone a tre colli da 500 ml munito di agitatore meccanico.
40 La preparazione è stata completata con gli stessi passaggi descritti nel paragrafo 2.3.1 utilizzando un rapporto in peso farmaco/polimero al 5%. Microsfere placebo sono state preparate conservate allo stesso modo.
2.4.4 VALUTAZIONE DELL’INDICE DI RISOSPENDIBILITÁ (R.I.)
Su un foglio di carta lucida sono stati accuratamente pesati campioni da 30 mg di microsfere recuperate dalla centrifugazione a 5000 rpm e sono stati trasferiti in tubi da centrifuga contenenti 5 ml di acqua distillata. Le sospensioni sono state agitate con il vortex per 5 min e successivamente lasciate a riposo per 15-20 min al fine di permettere la sedimentazione spontanea degli aggregati. I surnatanti sono stati cautamente rimossi, trasferiti in altri tubi da centrifuga e sottoposti allo stesso trattamento altre due volte. I surnatanti derivanti dall’ultimo periodo di sedimentazione, sono stati cautamente trasferiti in altri tubi da centrifuga e centrifugati a 6000 rpm, mentre gli aggregati sono stati riuniti e trasferiti in beaker da 5 ml precedentemente portati a peso costante. Le particelle centrifugate sono state riprese con la minor quantità di acqua possibile e trasferite in beaker da 5 ml precedentemente portati a peso costante. I beaker contenenti gli aggregati e le particelle disperse sono stati liofilizzati e conservati in essiccatore. La massa degli aggregati e delle particelle disperse, è stata infine determinata pesando i beaker per differenza. Ogni determinazione è stata condotta su tre replicati e i risultati, espressi in termini di R.I.%, sono stati determinati con la seguente formula:
R.I.% = Mr*100 /(Mr + Ma) dove:
Mr = massa risospesa Ma = massa aggregata
In tabella 2.1 vengono riportati i valori massimi e minimi calcolati per i replicati delle varie tipologie di microsfere.
41 TABELLA 2.1 R.I. dei replicati di ogni campione aventi la maggiore e la minore risospendibilità
POLIMERO EMULSIONANTE R.I. min % R.I. max %
C27 PVA 100 100 CLCE-653 PVA 82,6 93,1 CHC-1250 PVA PVA + PVP 16,0 32,6 24,7 40,2 CLCE-650 PVA PVA + TW 100 100 100 100 CLC-2000 PVA 47,5 55,1 ELC-2000 PVA 66,2 75,3 PU-GRGDG PVA 81,2 87,2
2.4.5 EFFICACIA D’INCAPSULAMENTO (EE)
Su un foglio di carta lucida sono stati accuratamente pesati campioni da 10 mg di microsfere recuperate dalla centrifugazione a 5000 rpm e sono stati quantitativamente trasferiti in beacker da 50 ml. Ogni campione è stato disciolto in 5-6 ml di diclorometano e il solvente è stato fatto successivamente evaporare mediante debole agitazione meccanica. Il residuo è stato ripreso con 10 ml di acetonitrile e 10 ml di acqua distillata. Per ogni campione è stato prelevato 1 ml di soluzione, trasferito in matraccio tarato da 100 ml e portato a volume con una miscela CH3CN/H2O 1:1.
42 Aliquote delle soluzioni risultanti sono state filtrate e analizzate mediante HPLC (fase mobile: CH3CN/H2O 58%/42%; volume iniettato: 100 µl; flusso: 1 ml/min; λ = 230 nm). La concentrazione di PXT è stata determinata tramite la retta di taratura ricavata come descritto nel paragrafo 2.3.
Ogni determinazione è stata condotta su tre replicati e i risultati, espressi in termini di EE.%, sono stati determinati con la seguente formula:
EE = ∆D*100/DT dove:
DT = quantità totale di farmaco utilizzato.
∆D = quantità di farmaco ricavata dall’analisi HPLC
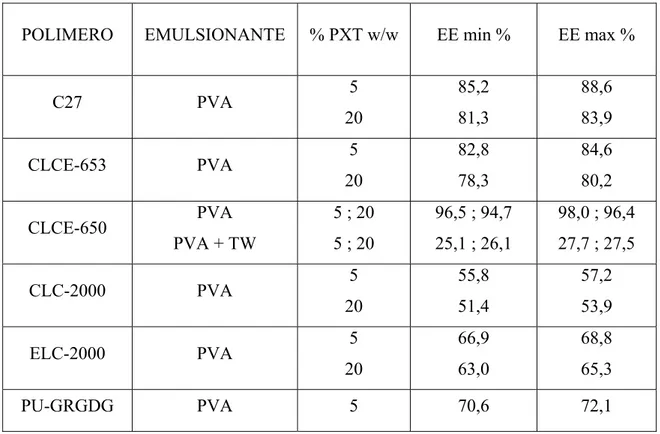
In tabella 2.2 vengono riportati i valori massimi e minimi calcolati e corretti (paragrafo 2.3.5.1) per i replicati delle varie tipologie di microsfere.
TABELLA 2.2 EE corrette dei replicati di ogni campione che presentano il maggiore e il minore incapsulamento di PXT.
POLIMERO EMULSIONANTE % PXT w/w EE min % EE max %
C27 PVA 5 20 85,2 81,3 88,6 83,9 CLCE-653 PVA 5 20 82,8 78,3 84,6 80,2 CLCE-650 PVA PVA + TW 5 ; 20 5 ; 20 96,5 ; 94,7 25,1 ; 26,1 98,0 ; 96,4 27,7 ; 27,5 CLC-2000 PVA 5 20 55,8 51,4 57,2 53,9 ELC-2000 PVA 5 20 66,9 63,0 68,8 65,3 PU-GRGDG PVA 5 70,6 72,1
43
2.4.5.1 FATTORE DI CORREZIONE PER L’EFFICACIA
D’INCAPSULAMENTO
Quantità pesate di microsfere placebo e PXT nello stesso rapporto in peso di quelle caricate, sono state trattate con la procedura descritta nel paragrafo 2.3.5. Il fattore di correzione per le EE delle varie tipologie di microsfere, è stato calcolato rapportando la concentrazione del PXT determinata mediante analisi HPLC con quella teorica ed è stato utilizzato per il calcolo dei dati riportati in tabella 2.2.
2.5 RILASCIO DI PACLITAXEL IN VITRO
Su un foglio di carta lucida sono stati accuratamente pesati 10 mg di microsfere recuperate dalla centrifugazione a 5000 rpm, e sono stati quantitativamente trasferiti in apposite provette. Le microsfere sono state disperse in 5 ml di soluzione tampone (pH 7,4) e sonicate per 15-20 minuti. Successivamente le provette sono state poste in un bagno termostatato a 37°C. Ad intervalli di tempo variabili, le microsfere sono state centrifugate a 6000 rpm e sono state prelevate aliquote misurate della soluzione di rilascio. Tali aliquote sono state diluite 1:1 con acetonitrile ed analizzate mediante HPLC (fase mobile: CH3CN/H2O 58%/42%; volume iniettato: 100 µl; flusso: 1 ml/min; λ = 230 nm). La concentrazione di PXT è stata determinata tramite la retta di taratura ricavata come descritto nel paragrafo 2.3 . Le quantità di PXT ricavate dall’analisi delle aliquote prelevate nel tempo, sono state progressivamente sommate e i risultati sono stati espressi in termini di rilascio percentuale. Per ogni campione l’analisi è stata condotta su tre replicati. Nelle tabelle 2.3-9 vengono riportati i valori massimi e minimi di rilascio percentuale esibiti dai replicati dei vari campioni di microsfere.
44 TABELLA 2.3 Rilasci % max e min dei campioni replicati delle microsfere di C27
MICROSFERE DI C27
PACLITAXEL 5% w/w PACLITAXEL 20% w/w Giorni Rilascio% max Rilascio% min Rilascio% max Rilascio% min
0 0 0 0 0 1 1,77 0,98 0,91 0,53 3 2,33 1,90 1,14 0,72 6 3,25 2,44 1,77 0,94 8 3,79 2,91 1,98 1,11 10 4,48 3,12 2,55 1,43 13 5,26 2,87 2,83 1,78 15 5,85 3,22 3,18 1,90 17 6,27 3,89 3,85 2,02 20 6,81 4,10 3,99 2,14 22 7,42 5,03 4,16 2,36 24 7,73 5,43 4,53 2,51 27 8,25 5,52 4,72 3,02 29 8,52 6,28 4,90 3,20 32 9,49 6,36 5,12 3,37 34 9,90 6,88 5,23 3,49
45 TABELLA 2.4 Rilasci % max e min dei campioni replicati delle microsfere
di CLCE-635
MICROSFERE DI CLCE-635
PACLITAXEL 5% w/w PACLITAXEL 20% w/w Giorni Rilascio% max Rilascio% min Rilascio% max Rilascio% min
0 0 0 0 0 1 3,92 2,97 1,63 0,62 3 5,80 4,88 2,02 1,14 6 8,14 7,01 3,05 1,97 8 9,21 7,83 3,72 2,18 10 11,37 10,18 4,24 2,85 13 13,56 11,78 4,82 3,01 15 15,75 13,70 5,36 3,43 17 18,16 14,30 5,94 4,11 20 18,93 16,32 6,67 4,53 22 20,77 18,35 7,47 5,16 24 22,16 19,89 7,94 6,36 27 23,41 20,74 8,44 6,72 29 25,55 22,16 8,95 6,91 32 27,62 23,64 9,73 7,40 34 28,14 24,76 10,88 7,37
46 TABELLA 2.5 Rilasci % max e min dei campioni replicati delle microsfere
di CLCE-650 (PVA)
MICROSFERE DI CLCE-650 (PVA)
PACLITAXEL 5% w/w PACLITAXEL 20% w/w Giorni Rilascio% max Rilascio% min Rilascio% max Rilascio% min
0 0 0 0 0 1 3,88 2,94 2,71 1,55 3 7,12 5,12 4,16 2,42 6 9,57 7,22 5,77 3,79 8 10,88 8,31 6,55 4,58 10 12,05 9,54 7,23 5,03 13 14,14 10,67 8,12 6,27 15 15,27 11,18 8,94 6,90 17 16,40 12,53 9,35 7,42 20 16,95 13,10 10,11 7,99 22 17,51 13,48 10,90 8,41 24 18,64 13,93 11,75 8,65 27 20,21 14,77 12,68 8,80 29 21,03 15,87 13,63 9,21 32 21,87 16,65 14,22 9,86 34 22,60 17,04 14,57 9,98
47 TABELLA 2.6 Rilasci % max e min dei campioni replicati delle microsfere
di CLCE-650 (PVA+Tween80)
MICROSFERE DI CLCE-650 (PVA+Tween80)
PACLITAXEL 5% w/w PACLITAXEL 20% w/w Giorni Rilascio% max Rilascio% min Rilascio% max Rilascio% min
0 0 0 0 0 1 5,25 3,82 2,74 1,45 3 10,52 8,41 5,21 3,22 6 15,77 12,96 7,38 5,13 8 20,11 17,06 9,93 6,87 10 24,66 20,55 11,40 8,15 13 27,72 24,77 12,96 9,09 15 32,08 28,12 14,88 10,77 17 35,11 31,45 16,05 11,86 20 39,04 34,50 17,87 13,05 22 41,19 37,14 19,18 14,63 24 43,55 39,66 20,45 15,65 27 46,16 41,82 21,97 16,44 29 48,98 44,38 22,55 17,81 32 50,93 45,07 25,14 18,50 34 52,44 46,83 26,23 18,87
48 TABELLA 2.7 Rilasci % max e min dei campioni replicati delle microsfere
di CLC-2000
MICROSFERE DI CLC-2000
PACLITAXEL 5% w/w PACLITAXEL 20% w/w Giorni Rilascio% max Rilascio% min Rilascio% max Rilascio% min
0 0 0 0 0 1 0,61 0,22 0,23 0,11 3 1,05 0,61 0,47 0,22 6 1,50 0,68 0,60 0,29 8 1,96 0,75 0,74 0,43 10 2,08 0,83 0,87 0,49 13 2,29 0,90 0,93 0,55 15 2,49 0,98 1,01 0,62 17 2,57 1,04 1,09 0,69 20 2,66 1,18 1,20 0,75 22 2,71 1,25 1,28 0,81 24 2,79 1,30 1,33 0,84 27 2,87 1,36 1,38 0,88 29 2,94 1,38 1,42 0,89 32 3,0 1,41 1,47 0,91 34 3,12 1,48 1,50 0,92
49 TABELLA 2.8 Rilasci % max e min dei campioni replicati delle microsfere
di ELC-2000
MICROSFERE DI ELC-2000
PACLITAXEL 5% w/w PACLITAXEL 20% w/w Giorni Rilascio% max Rilascio% min Rilascio% max Rilascio% min
0 0 0 0 0 1 3,89 2,62 1,74 0,72 3 6,24 4,47 2,96 1,34 6 7,81 5,03 3,41 1,90 8 8,63 5,92 3,83 2,15 10 9,22 6,50 4,13 2,87 13 10,16 7,33 4,52 3,41 15 11,42 8,18 5,03 4,03 17 11,88 8,94 5,52 4,25 20 12,75 9,75 5,97 4,38 22 13,59 10,62 6,23 4,65 24 14,18 11,20 6,46 4,90 27 14,70 11,98 6,64 5,25 29 15,43 12,64 6,75 5,39 32 15,96 13,01 6,81 5,54 34 16,23 13,37 7,03 5,74
50 TABELLA 2.9 Rilasci % max e min dei campioni replicati delle microsfere
di PU-GRGDG
MICROSFERE DI PU-GRGDG (PXT 5% w/w) Giorni Rilascio% max Rilascio% min
0 0 0 1 2,92 1,88 3 4,11 3,02 6 5,30 3,81 8 5,88 4,75 10 7,03 5,14 13 8,01 5,90 15 8,64 6,68 17 9,10 7,13 20 10,18 7,92 22 10,77 8,22 24 11,32 8,47 27 11,96 8,82 30 12,25 9,16
2.6 PREPARAZIONE DELLE NANOSFERE
In un beaker da 250 ml sono stati posti con un cilindro graduato 150 ml di acqua distillata in cui sono stati sciolti, sotto agitazione e leggero riscaldamento (40°C), 5,25 , 5,7 o 6 g di PVA, a seconda del polimero utilizzato, aggiungendoli a piccole porzioni. La soluzione ottenuta è stata posta in un bagno di acqua/ghiaccio e sono stati aggiunti 5 ml di DCM contenenti 150 mg di polimero e 7,5 mg di Paclitaxel disciolti.
51 Le due fasi sono state agitate mediante omogenizzatore (Miccra D-8)a 21500 rpm per 30 minuti. Successivamente la microemulsione è stata lasciata in agitazione a 250 rpm, mediante agitatore magnetico, per tutta la notte.
Le particelle sono state isolate dall’ambiente di reazione per centrifugazione a 14000 rpm, lavate 8-10 volte con acqua distillata e poste in liofilizzatore. Infine, una volta liofilizzate, sono state conservate in essiccatore in frigorifero ad una temperatura di circa 4°C. Per ogni polimero sono state preparate, parallelamente e con la stessa procedura, delle nanosfere senza farmaco incapsulato (nanosfere placebo) e sono state trattate e conservate allo stesso modo di quelle caricate con Paclitaxel.
L’Indice di Risospendibilità è stato determinato con il metodo descritto nel paragrafo 2.3.4.
2.7 SINTESI DEL POLIMERO PU-GRGDG
Una soluzione di PCL diolo (Mn = 2000) in circa 70 mL di DCE è stata anidrificata per riflusso in Soxhlet su setacci molecolari. Durante questa operazione la soluzione è stata concentrata a circa 10 mL. Alla soluzione è stato aggiunto il diisocianato (LDI) in rapporto molare 2:1 con il PCL diolo. La miscela di reazione è stata mantenuta in agitazione a 85°C per 150 min. Alla miscela di reazione, raffreddata a temperatura ambiente, sono stati aggiunti il catalizzatore (dibutil Sn dilaurato) e una soluzione dei due estensori in DCE anidro, in rapporto molare 1:1 con il prepolimero. La miscela dei due estensori era costituita da L-lisina etil estere e H-Lys-Amc-Gly-Arg(Pbf)-Gly-Asp(OtBu)-Gly-OCH3 in rapporto molare 3:1. Lo stadio di estensione di catena ha richiesto un periodo di circa 18 h, alla fine del quale un’analisi IR ha confermato la scomparsa del picco relativo ai gruppi isocianato presenti nel prepolimero. La reazione è stata interrotta aggiungendo 5 mL di metanolo.
Il polimero è stato precipitato in etere di petrolio, filtrato e seccato a pressione ridotta a 35°C. Le impurezze a basso peso molecolare sono state rimosse mediante precipitazione in metanolo da soluzione cloroformica.
Dopo la polimerizzazione le protezioni in catena laterale del peptide sono state rimosse per trattamento con TFA al 15% in DCM.
52
2.7.1 SINTESI DELL’ESTENSORE
H-Lys-Amc-Gly-Arg(Pbf)-Gly-Asp(O
tBu)-Gly-OCH
3La sintesi è stata realizzata nei laboratori del Dipartimento di Scienze Chimiche dell’Università di Padova, nel Gruppo di ricerca diretto dal Prof. E. Peggion. Il prodotto è stato preparato secondo i protocolli standard di sintesi peptidica in fase solida, purificato via Flash Chromatography e caratterizzato mediante HPLC-MS.
2.8 PREPARAZIONE DELLE MICROSFERE DI PU-GRGDG PER
ANALISI FTIR
Microsfere di grandi dimensioni di PU-GRGDG, sono state preparate con la stessa procedura descritta nel paragrafo 2.4.1 con i seguenti parametri operativi:
• PVA 1,8% (g/100ml) • PXT 5% w/w