Capitolo 2 - Adenosina e recettori adenosinici
2.1- L’adenosina (1)
L’adenosina (ADO)(Fig.4) è un nucleoside endogeno costituito dalla base purinica adenina legata mediante un legame N9-C1 allo zucchero ribosio. L’ADO è presente, nei mammiferi, a livello intra- ed extracellulare in numerosi tessuti dove prende parte a svariate funzioni fisiologiche (2).
Fig.4 - Struttura chimica dell’adenosina.
La formazione dell’ADO dipende essenzialmente dal metabolismo dell’adenosin-trifosfato (ATP). A livello intracellulare, l’ADO è formata per idrolisi dell’adenosin-monofosfato (AMP) per mezzo dell’enzima 5’nucleotidasi o, alternativamente ed in concentrazioni minori, attraverso l’idrolisi della S-adenosilomocisteina (SAH) per mezzo di una specifica idrolasi (3). I livelli extracellulari di ADO, invece, sembrano essere
regolati dal rilascio di ADO intracellulare e dalla degradazione di nucleotidi adeninici presenti nello spazio extracelluare. L’equilibrio fra le concentrazioni di ADO ai due lati della membrana cellulare è mantenuto per mezzo di un trasportatore bidirezionale di nucleosidi (3).
L’eliminazione dell’ADO extracellulare è principalmente mediata dalla sua ricaptazione attraverso la membrana cellulare, seguita dalla fosforilazione ad AMP ad opera della adenosina kinasi o dalla deamminazione ad inosina ad opera dell’adenosina deamminasi.
Una via catabolica alternativa è rappresentata da una reazione reversibile catalizzata dalla SAH-idrolasi che porta alla formazione di SAH a partire da ADO e L-omocisteina (3).
Fig.5 - Ciclo di formazione e di degradazione dell’adenosina
Nel Sistema Nervoso Centrale, l’ ADO è liberata dai neuroni e dalle cellule della glia come risultato della loro attività metabolica (3) e funziona da modulatore per regolare la liberazione del neurotrasmettitore o nelle risposte neuronali post- sinaptiche.
L’ADO agisce a livello pre- e postsinaptico comportandosi come un neuromodulatore in grado di regolare il rilascio di neurotrasmettitori e il funzionamento neuronale (4).
2.2 - I recettori per l’adenosina
La trasmissione purinergica coinvolge tutta la famiglia dei derivati purinici dell’ATP, ovvero ATP, ADP, AMP ed ADO. I vari mediatori impiegano recettori differenti e classificabili in due famiglie distinte: recettori P1, sensibili all’ADO, e recettori P2, sensibili ad ATP ed ADP.
Al momento sono stati caratterizzati quattro sottotipi di recettori P1 definiti come A1, A2A, A2B ed A3 (5).(Fig.6)
Fig.6 - Struttura dei recettori adenosinici.
I recettori A2B ed A3 presentano un’affinità ridotta per l’ADO e si pensa che siano stimolati solamente durante condizioni patologiche in cui si osserva un incremento dei livelli extracellulari di ADO (6). Al contrario, i recettori A1 ed A2A mostrano un’elevata affinità per l’ADO e sono attivati da concentrazioni fisiologiche del nucleoside, essendo quindi i sottotipi recettoriali principalmente coinvolti nei suoi effetti.(7) I diversi sottotipi recettoriali P1 si differenziano tra loro per l’affinità ad analoghi non idrolizzabili dell’adenosina, ottenuti modificando la purina o lo zucchero presenti nella sua struttura.
In questo modo si possono ottenere agonisti od antagonisti selettivi per quasi tutti i sottotipi noti.
I recettori adenosinici sono tutti accoppiati alla adenilato ciclasi (AC), dove l’attivazione dei recettori A1 e A3 la inibisce, mentre quella dei recettori A2A e A2B la stimola. Inoltre, il legame degli agonisti ai recettori A1 e A3 stimola la
fosfolipasi C (PLC) e, nel caso dei recettori A1, inibisce le conduttanze per il Ca2+e stimola quelle per il K+.
In quanto accoppiati a proteine G, i recettori adenosinici presentano la caratteristica struttura composta da sette domini transmembrana, con segmento amminoterminale extracellulare e segmento carbossiterminale intracellulare. Gli agonisti, probabilmente, legano i recettori a livello dei segmenti TM2, TM3 e TM7, come indirettamente dimostrato dall’elevato grado di conservazione di tali domini in tutti i sottotipi finora scoperti (8).
Fig.7 - Accoppiamento dei vari sottotipi recettoriali adenosinergici all’AC. I recettori A1 ed A3 inibiscono l’AC mentre i recettori A2A ed A2B la stimolano.
I recettori P1 hanno una distribuzione varia, ma spesso sovrapponibile, nei diversi tessuti ed in numerose cellule è stata dimostrata una colocalizzazione tra i differenti sottotipi di recettore adenosinico. In particolare la coespressione di recettori A1 ed A2A è stata descritta in cellule della muscolatura liscia e striata, cellule del mesangio, cellule del glomerulo renale, astrociti e neuroni piramidali (9,10,11,12). Il differente accoppiamento dei singoli sottotipi recettoriali all’AC si traduce quindi in una complessa regolazione della
2.3 - Localizzazione cerebrale dei recettori per l’adenosina
I recettori adenosinergici presentano una distribuzione cerebrale molto diffusa ma sono riscontrabili differenze significative nella localizzazione dei diversi sottotipi recettoriali.
I recettori A2A sono espressi in quasi tutte le aree cerebrali ed i livelli massimi
si osservano nell’ ippocampo, corteccia (cerebrale e cerebellare) e nuclei del talamo, mentre, livelli moderati rispetto a queste strutture, sono presenti nel corpo striato e nel nucleus accumbens (13). I recettori A2A sono situati principalmente a livello presinaptico dove la loro stimolazione inibisce il rilascio di neurotrasmettitori. (14)
I recettori A2A sono selettivamente espressi nelle regioni cerebrali che presentano un elevato contenuto di dopamina, come nello striato, nel nucleo accumbens, nel tubercolo olfactorium e nei globuli bianchi (15).
La localizzazione dei recettori A2A è stata inizialmente dimostrata in maniera indiretta attraverso studi su omogenati provenienti da aree dopaminergiche che hanno mostrato una stimolazione dell’AC per opera dell’ADO (16). Successivamente, studi di binding e di immunoistochimica, che hanno impiegato anticorpi specifici, hanno dimostrato la massiccia presenza di recettori A2A nelle regioni cerebrali, come già detto, ed elevato contenuto di dopamina (17). Alcuni studi, inoltre, hanno mostrato la presenza di recettori A2A anche in differenti aree del cervello, come ad esempio la corteccia cerebrale, l’ippocampo o i neuroni colinergici (18,12,19).
Particolarmente interessante è l’elevato grado di espressione dei recettori A1 ed A2A nei gangli della base, un insieme di nuclei sottocorticali (corpo striato, globo pallido, nucleo subtalamico e sostanza nera) aventi un ruolo fondamentale nell’esecuzione dei movimenti e nell’acquisizione di programmi motori semplici (20). I gangli della base, ricevono afferenze glutammatergiche da corteccia cerebrale e talamo mentre i neuroni in uscita dai gangli della base, che hanno origine nel corpo striato, sono di tipo gabaergico.
Tali neuroni sono ulteriormente distinti in striato-nigrali e striato-pallidi secondo i nuclei di terminazione.
similitudini ma anche importanti differenze giacché sono state dimostrate sia la colocalizzazione neuronale dei recettori A1 ed A2A che una specifica segregazione dei due sottotipi recettoriali. La co-espressione dei recettori A1 ed A2A è stata dimostrata sia sugli interneuroni colinergici che sulle terminazioni glutamatergiche striatali (21,22). Al contrario, lo studio dei neuroni striatali di proiezione ha evidenziato come i recettori A1 siano espressi dai neuroni striato-nigrali, mentre i recettori A2A siano localizzati sui neuroni striato-pallidi (23,24,25). La modulazione della funzionalità dei gangli della base da parte dei recettori adenosinici è alla base degli effetti della caffeina, che si comporta come un antagonista competitivo verso questi recettori (26,27).
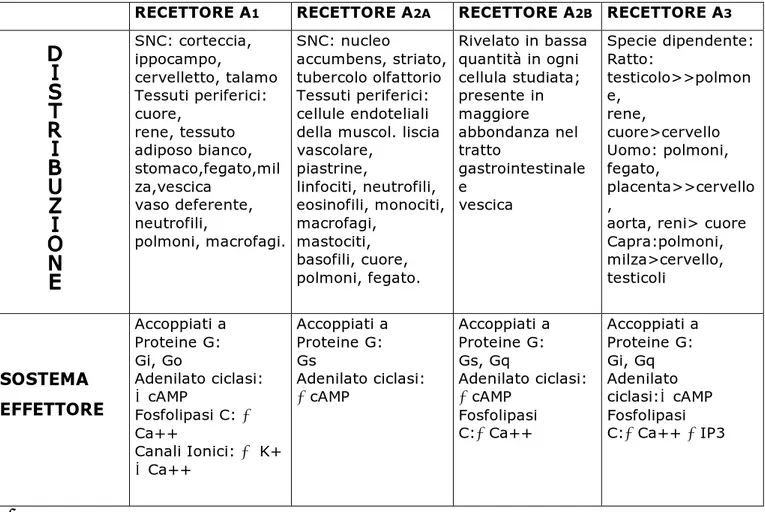
TABELLA 1 – Classificazione, distribuzione e caratteristiche principali dei recettori adenisinici.
RECETTORE A1 RECETTORE A2A RECETTORE A2B RECETTORE A3
SNC: corteccia, ippocampo, cervelletto, talamo Tessuti periferici: cuore, rene, tessuto adiposo bianco, stomaco,fegato,mil za,vescica vaso deferente, neutrofili, polmoni, macrofagi. SNC: nucleo accumbens, striato, tubercolo olfattorio Tessuti periferici: cellule endoteliali della muscol. liscia vascolare, piastrine, linfociti, neutrofili, eosinofili, monociti, macrofagi, mastociti, basofili, cuore, polmoni, fegato. Rivelato in bassa quantità in ogni cellula studiata; presente in maggiore abbondanza nel tratto gastrointestinale e vescica Specie dipendente: Ratto: testicolo>>polmon e, rene, cuore>cervello Uomo: polmoni, fegato, placenta>>cervello ,
aorta, reni> cuore Capra:polmoni, milza>cervello, testicoli SOSTEMA EFFETTORE Accoppiati a Proteine G: Gi, Go Adenilato ciclasi: cAMP Fosfolipasi C: Ca++ Canali Ionici: K+ Ca++ Accoppiati a Proteine G: Gs Adenilato ciclasi: cAMP Accoppiati a Proteine G: Gs, Gq Adenilato ciclasi: cAMP Fosfolipasi C:Ca++ Accoppiati a Proteine G: Gi, Gq Adenilato ciclasi:cAMP Fosfolipasi C:Ca++ IP3
2.4 – Recettori adenosinici A2A (28)
Il gene codificante per il recettore umano A2A è localizzato nel cromosoma 22, (24,29) ed evidenzia un’omologia dell’82,9% con i recettori A2A del ratto.(30,31)
I recettori A2A sono presenti, a livello centrale, nelle aree ricche di dopamina quali striato, nucleo accumbens, tubercolo olfattivo e nelle cellule di Purkinjie del cervelletto,(15) mentre a livello periferico sono abbondanti nelle cellule endoteliali della muscolatura liscia vascolare, in piastrine, linfociti, monociti, macrofagi, neutrofili, basofili, eosinofili, mastociti, polmoni, cuore, vescica e tessuti immunitari.(32,33)
Nei neuroni spinali intermedi dello striato i recettori A2A sono in stretta associazione con i recettori dopaminergici D2 e sono state descritte reciproche interazioni negative.(34,35)
Viene suggerito da evidenze biochimiche, anatomiche e comportamentali che i recettori A2A interagiscono, sia con modalità diretta che indiretta, con diversi sistemi neurotrasmettitorI, quali dopaminergici, GABAergici, acetilcolinergici e glutammatergici, sia nei gangli basali che in altre strutture cerebrali.(36) I recettori A2A modulano la neurotrasmissione eccitatoria in diverse regioni del cervello: l’attivazione di tale sottotipo recettoriale sembra essere in grado di ridurre l’affinità della dopamina per i recettori D2.
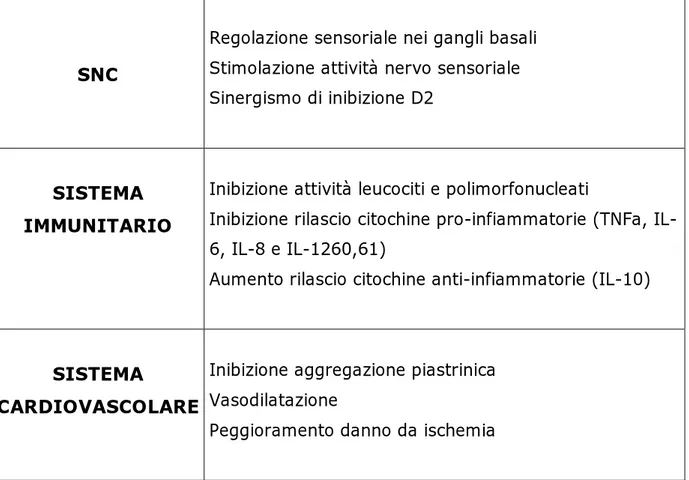
TABELLA 2 – Effetti mediati dal recettore A2A in vari sistemi.(28)
SNC
Regolazione sensoriale nei gangli basali Stimolazione attività nervo sensoriale Sinergismo di inibizione D2
SISTEMA IMMUNITARIO
Inibizione attività leucociti e polimorfonucleati
Inibizione rilascio citochine pro-infiammatorie (TNFa, IL- 6, IL-8 e IL-1260,61)
Aumento rilascio citochine anti-infiammatorie (IL-10)
SISTEMA
CARDIOVASCOLARE
Inibizione aggregazione piastrinica Vasodilatazione
2.5 – Dopamina e recettori dopaminergici
La Dopamina (Fig.8) è la catecolamina più abbondante nel Sistema Nervoso Centrale, come neurotrasmettitore inibitorio che modula diversi comportamenti in stato di veglia e non solo il movimento ma anche alcune funzioni cognitive, i meccanismi dell’apprendimento legati alla ricompensa, la motivazione e i comportamenti alimentari.(37)
O
H
O
H
NH
2
Fig.8 - Struttura Dopamina
La dopamina è prodotta dai neuroni dopaminergici attraverso la seguente via: L-tirosinaL-dopadopamina
Dopo aver interagito con i suoi recettori, la dopamina viene metabolizzata da due enzimi diversi, MAO-B (Mono-amino-ossidasi) e COMT (Catecol-O-metil-tranferasi).
I recettori della dopamina possono essere suddivisi in due famiglie distinte sulla base delle proprietà farmacologiche e strutturali.
Esitono diversi tipi recettoriali D1, D2, D3, D4, D5 (Tabella 3) e, a seconda della loro collocazione, si dividono in sinaptici e post-sinaptici. I pre-sinpatici sono essenzialmente del tipo D2 e sono chiamati autoinibitori, perchè
regolano la trasmissione post-sinaptica.
Ossia, se i recettori pre-sinaptici funzionano inibiscono la trasmissione di dopamina nei recettori post-sinaptici. In pratica funzionano in maniera inversa rispetto a quelli post-sinaptici.(38)
Tabella 3
Distribuzione dei recettori Dopaminergici
D1 D2 D1 D5 D2 D3 D4 -Striato -neocorteccia -Ippocampo -Ipotalamo -Sriato -SNp -Tubercolo olfatt. -Accumbens -Ipotalamo -Corteccia centrale -Midollo -Cervello centrale cAMP IP3 cAMP Canali K
Sia i D1 che i D2, presenti a livello dello striato, sono coinvolti nel morbo di Parkinson. I primi mediano la risposta di vasodilatazione dei vasi periferici, a livello renale, mesenterico, coronario e celebrale, i secondi inibiscono la trasmissione nei gangli simpatici e la liberazione di noradrenalina a livello delle terminazioni nervose simpatiche attraverso un effetto sulla membrana presinaptica. Nel’ambito del sistema nervoso centrale sono riconoscibili tre cluster di cellule dopaminergiche che danno origine a tre diverse vie assonali: il sistema nigrostriatale, il sistema mesocorticolimbico e la via tubero infundibolare. Il sistema mesocorticolimbico modula diverse funzioni cognitive ed emozionali, il sistema tuberoinfundibolare regola il rilascio di prolattina e il sistema nigrostriatale origina dalla pars compatta della sostanza nigra (SNc) proiettata sullo striato dorsale (nuclei caudato e putamen) ed è principalmente responsabile del controllo del movimento.(Fig.9) Nel Parkinson la ridotta disponibilità di dopamina nello striato, a causa della distruzione dei neuroni dopaminergici, da luogo ad una diminuzione della via diretta e ad un incremento della via indiretta. Questo porta ad una riduzione dell’input eccitatorio dal talamo alla corteccia con un effetto di riduzione dell’eccitazione della corteccia celebrale motoria.
Fig.9 - Regione Pars compatta.
2.6 - Organizzazione dei gangli basali:Attinenti alla malattia del Parkinson (39)
La patogenesi del Parkinson deriva dalla progressiva irreversibile degenerazione dei neuroni localizzati nella sostanza nigra pars compatta (SNc) proiettata sul caudate-putamen (CPu). Tuttavia, è comunemente riconosciuti come una tipica caratteristica della malattia,la formazione dei corpi inclusi intracellulari di aggregati proteici (Corpi di Lewy). Le più marcate modifiche nel SNc avvengono nella regione ventro-laterale. I cambiamenti degenerativi possono anche essere osservati nella corteccia celebrale, nei nuclei basali del Meynert, nel locus ceruleo, nei nuclei peduncolopontini (PPN) e nella spina dorsale.
Il Parkinson, da un punto di vista biochimico, è caratterizzato da una diminuzione nei livelli striatali di dopamina, particolarmente evidenti nel putamen postero-laterale, una regione innervata tramite la parte ventrolaterale del SNc. Possono essere rilevate anche modificazioni nei neurotrasmettitori noradrenergici, serotoninergici, colinergici e
osservati nel Parkinson, dovrebbe essere in primo luogo descritta la funzionalità del circuito neuronale dei gangli basali (BG), un gruppo di nuclei del cervello fondamentali nella funzione motoria (Fig.10).
I BG includono la Cpu i segmenti interni (Gpi) ed esterni (Gpe) dei globuli pallidi, la SNc e SN reticolata (SNr) e nuclei subtalamici (STh). La maggior parte della popolazione neuronale del CPu è rappresentata da neuroni spinali di media taglia che impiegano l’acido γ-ammino butirrico (GABA) come neurotrasmettitore e costituiscono il 95% dei neuroni striatali.
Il residuo 5% dei neuroni della CPu è costituito da interneuroni aspinali, fra cui interneuroni colinergici e gabaergici.
La funzionalità dei neuroni spinali di media taglia è mediata tramite due principali inputs:
-una via afferente dopaminergica dal SNc;
-Proiezioni glutamatergiche dell’area corticale, talamica e libica;(40)
Inoltre i neuroni spinali gabaergici danno origine a due maggiori circuiti efferenti striatali:la via striatonigrale e striatopallida.
I neuroni della via striatonigrale (diretta) esprimono i neuropeptidi Dinorfina (DYN) e la sostanza P insieme con i recettori dopamina D1; questo circuito si proietta direttamente dalla CPu nel Gpi/SNr.(fig.10) Viceversa i neuroni appartenenti alla via striatopallida (indiretta) contengono il neuropeptide Encefalina (ENK) e soprattutto esprime i recettori dopamina D2. Questo circuito convoglia gli inputs striatali al Gpi/SNr formando delle connessioni sinaptiche nel Gpe e STh.(Fig.10)(40)
La dopamina regola la coordinazione motoria e i movimenti fini tramite la stimolazione dei recettori D1 che agiscono sulla via diretta e l’inibizione dei recettori D2 che agiscono sulla via indiretta.(40)
La deplezione della dopamina che si verifica nella CPu durante il Parkinson produce una riduzione della stimolazione di entrambi i recettori della dopamina D1 e D2 che risulta in una diminuzione della inibizione della via neuronale indiretta e in un’attenuazione dell’eccitazione nella via neuronale
L’attenuazione dell’inibizione della via indiretta disinibisce il STh e aumenta l’eccitazione dei neuroni Gpi/SNr, mentre la diminuzione della stimolazione della via diretta porta a una riduzione del controllo inibitorio sul Gpi/SNr.
Fig.10- (Sezione del cervello di ratto) Rappresentazione schematica delle regioni e della localizzazione dei recettori coivolti nel PD nel Caudato-Putamen.
Nel loro insieme, questi eventi inducono una eccessiva attivazione dei neuroni Gabaergici efferenti dei BG, accompagnati da una inibizione dei sintomi motori.(41) In più, la deficienza di dopamina nel Parkinson suscita diverse modifiche secondarie, che interessano il circuito neuronale che collega i BG, talamo e corteccia, tra cui la sopraeccitazione indotta dal glutammato dei neuroni localizzati nel STh e che si proiettano sul SNr/Gpi.(41)
Questo, a sua volta, si traduce in una aumentata attività della via gabaergica SNr/Gpi (41,40) che inibisce il talamo e il PPN. Infine l’inibizione del PPN e
un’anormale eccitazione dei neuroni spinali, provoca un aumento del tono muscolare e movimenti alterati.
L’osservazione che i Parkinsoniani presentano una considerevole difficoltà ad iniziare il movimento volontario ha portato alla formulazione della teoria che i gangli della base siano deputati all’esecuzione automatica di schemi motori. La carenza di DA altera questa funzione.
• L' OSSERVAZIONE CHE I PAZINTI
2.7 - Interazione tra recettori A2A e recettori dopaminergici nei gangli
della base (1)
La collocazione dei recettori adenosinergici A2Ae dei recettori dopaminergici D2
a livello dei gangli della base forniscono un punto di partenza anatomico per l’esistenza di un’interazione funzionale tra questi due recettori.
I recettori A2A ed i recettori D2 sono co-localizzati a livello della membrana dei neuroni gabaergici striatopallidi ed è ampiamente dimostrato come la stimolazione dei recettori A2A eserciti un’azione facilitatoria sulla funzionalità dei neuroni striatopallidi anche grazie ad una riduzione dell’attività dei recettori D2 (42,43). La prima evidenza sperimentale di questa interazione è stata ottenuta in membrane striatali di ratto in cui è stato osservato come l’attivazione dei recettori A2A fosse associata ad una diminuzione dell’affinità dei recettori D2 verso la dopamina verosimilmente a causa della formazione di complessi eterodimeri tra i due recettori (44,45).
La forte interazione antagonistica esistente tra i recettori A2A ed i recettori D2 si manifesta anche a livello dei secondi messaggeri (Fig.11), poiché la stimolazione dei recettori D2 inibisce l’AC, mentre quella dei recettori A2A la stimola (46).
Ciò si traduce in un’opposta regolazione dell’attività della proteina chinasi, dipendente da AMP ciclico (PKA), che regola lo stato di attivazione di numerosi recettori, canali ionici, fosfodiesterasi e fosfoproteine. Inoltre, è stato dimostrato come l’attivazione dei recettori A2A, sia in grado di inibire le risposte Ca 2+dipendenti, mediate dal recettore D2 (47).
intracellulare, come la fosfoproteina regolata dalla dopamina e dal cAMP (DARPP-32) e la fosfoproteina regolata dal cAMP (CREB), che controllano la trascrizione proteica e l’espressione genica, e di conseguenza la funzionalità neuronale (46,15).
Fig.11 - Interazioni tra recettori A2A e recettori D2 a livello molecolare (A) ed a livello dei secondi messaggeri (B). I due sottotipi recettoriali esercitano un’attività regolatoria opposta sull’AC, inibita dai D2 e stimolata dagli A2A.
In aggiunta alle interazioni esistenti con i recettori D2, è stato dimostrato come i recettori A2A siano in grado di influenzare anche il funzionamento dei recettori D1. A questo riguardo è stato osservato come la somministrazione di antagonisti per il recettore A2A sia in grado di potenziare gli effetti comportamentali e neurochimici prodotti dalla stimolazione del recettore D1 nel ratto (48,49).
Dal momento che i recettori A2A ed i recettori D1 sono localizzati su popolazioni neuronali differenti (50), è verosimile che l’interazione tra questi recettori avvenga attraverso le fibre collaterali dello striato o attraverso circuiti che comprendono le proiezioni subtalamico-nigro-cortico-striatali. A questo proposito, studi recenti effettuati hanno evidenziato come il globo pallido sia
2.8 - Bibliografia
(1) Università degli studi di Cagliari,Facoltà di Farmacia,Dipartimento di tossicologia,Dottorato di ricerca in:Farmacologia delle tossicodipendenze Settore Scientifico-Disciplinare:AREA 05 BIO714. Coordinatore del Dottorato:Prof.Gaetano Di Chiara. Tesi:Sensibilizzazione alla caffeina e sensibilizzazione crociata all.amfetamina:influenza della suscettibilità individuale agli effetti della caffeina.
(2) RIBEIRO JA, SEBASTIAO AM, de MENDONCA A. Adenosine receptors in the nervous system: pathophysiological implications.Prog Neurobiol. 2002, 68:377-392.
(3) LATINI S, PETADA F. Adenosine in the central nervous system: release mechanisms and extracellular concentrations.J Neurochem. 2001, 79:463-484.
(4) LATINI S, PEDATA F. Adenosine in the central nervous system: release mechanisms and extracellular concentrations.J Neurochem. 2001, 79:463-484.
(5) FREDHOLM BB, ABBRACCHI MP, BURNSTOCK G, DALY JW, HARDEN TK, JACOBSON KA,LEFF P, WILLIAMS M.Nomenclature and classification of purinoceptors. Pharmacol Rev. 1994, 46:143-156. (6) FREDHOLM BB, IRENIUS E, KULL B, Schulte G. Comparison of the
potency of adenosine as an agonist at human adenosine receptors expressed in Chinese hamster ovary cells.Biochem Pharmacol. 2001, 61:443-448.
(7) DUNWIDDIE TV, Masino SA. The role and regulation of adenosine in the central nervous system.Annu Rev Neurosci. 2001, 24:31-55.
(8) CATTABENI F, ABBRACCHIO MP. Trasmissione Purinergica in “Farmacologia Generale e Molecolare” UTET, Torino,1996, pp.469-480.
(9) DIXON AK, GUBITZ AK, SIRINATHSINGHJI DJ, RICHARDSON PJ, FREEMAN TC. Tissue distribution of adenosine receptor mRNAs in the rat. Br J.Pharmacol. 1996, 118:1461-1468.
(10) LYNGE J, HELLSTEN Y. Distribution of adenosine A1, A2A and A2B receptors in human skeletal muscle.Acta Physiol Scand. 2000, 169:283-290.
(11) ALLOSIO S, CUGNOLI C, FERRONI S, NOBILE M. Differential modulation of ATP-induced calcium signalling by A1 and A2 adenosine receptors in cultured cortical astrocytes.Br J Pharmacol. 2004, 141:935-942.
(12) REBOLA N, RODRIGUES RJ, OLIVEIRA CR, CUNHA RA. Different roles of adenosine A1, A2A and A3 receptors in controlling kainate-induced toxicity in cortical cultured neurons.Neurochem Int. 2005b, 47:317-325.
(15) SVENNINGSSON P, LE MOINE C, KULL B, SUNAHARA R, BLOCH B, FREDHOLM BB. Cellular expression of adenosine A2A receptor messenger RNA in the rat central nervous system with special reference to dopamine innervated areas.Neuroscience. 1997b, 80:1171-1185.
(16) FREDHOLM BB. Activation of adenylate cyclase from rat striatum and tuberculum olfactorium by adenosine.Med. Biol. 1977, 55: 262-267 (17) ROSIN DL, ROBEVA A, WOODARD RL, GUYENET PG, LINDEN J.
Immunohistochemical localization of adenosine A2A receptors in the rat central nervous system.J Comp Neurol. 1998, 401: 163-186.
(18) GUBITZ AK, WIDDOWSON L, KUROKAWA M, KIRKPATRICK KA, Richardson PJ. Dual signalling by the adenosine A2a receptor involves activation of both N- and P-type calcium channels by different G proteins and protein kinases in the same striatal nerve terminals.J Neurochem. 1996, 67:374-381.
(19) TEBANO MT, MARTIRE A, REBOLA N, PEPONI R, DOMENICI MR,ET AL. Adenosine A2A receptors and metabotropic glutamate 5 receptors are co-localized and functionally interact in the hippocampus: a possible key mechanism in the modulation of N-methyl-D-aspartate effects. J Neurochem. 2005, 95:1188-1200.
(20) HAUBER W. Involvement of basal ganglia transmitter systems in movement initiation. Prog Neurobiol. 1998, 56:507-540.
(21) PRESTON Z, LEE K, WIDDOWSON L, FREEMAN TC, DIXON AK, RICHARDSON PJ. Adenosine receptor expression and function in rat striatal cholinergic interneurons.Br J Pharmacol. 2000, 130:886-890. (22) RODRIGUES RJ, ALFARO TM, REBOLA N,OLIVEIRA CR, CUNHA RA.
Co-localization and functional interaction between adenosine A(2A) and metabotropic group 5 receptors in glutamatergic nerve terminals of the rat striatum.J Neurochem. 2005, 92:433-441.
(23) SCHIFFMANN SN, VANDERHAEGHEN JJ. Adenosine A2 receptors regulate the gene expression of striatopallidal and striatonigral neurons.J Neurosci. 1993, 13:1080-1087.
(24) FERRE’ S, FREDHOLM BB, MORELLI M, POPOLI P, FUXE K. Adenosine-dopamine receptor-receptor interactions as an integrative mechanism in the basal ganglia.Trends Neurosci. 1997, 20:482-487.
(25) FERRE’ S, RIMONDINI R, POPOLI P, REGGIO R, PEZOLA A, HANSSON AC, ANDERSSON A,,FUXE K. Stimulation of adenosine A1 receptors attenuates dopamine D1 receptormediated increase of NGFI-A, c-fos and jun-B mRNA levels in the dopamine-denervated striatum and dopamine D1 receptor-mediated turning behaviour. Eur J Neurosci. 1999, 11:3884-3892.
(26) FREDHOLM BB, BATTIG K, HOLMEN J, NEHLIG A, ZVARTAU EE. Actions of caffeine in the brain with special reference to factors that contribute to its widespread use. Pharmacol Rev. 1999, 51:83-133. (27) FISONE G, BORGKVIST A, USIELLO A. Caffeine as a psychomotor
stimulant: mechanism of action.Cell Mol Life Sci. 2004, 61:857-872. (28) Università degli studi di Trieste, Dottorato di ricerca in scienze del
eterociclici quali antagonisti per i recettori adenosinici.Validazione di modelli recettoriali.Anno accademico 2006-2007.
(29) FREDHOLM BB.;ARISIAN G.;HALLDNER L.;KULL B.;SCHULTE G.;WESSEMAN W..Structure and function of adenosine receptor and their genes.Naunyn Schiedebergs Arch.Pharmacol 2000.362,364-374. (30) CHU, Y.Y., TU, K.H., LEE, Y.C., KUO Z.J. LAI H.L. CHERN Y.
Characterization of the rat A2A adenosine receptor gene. DNA Cell. Biol. 1996, 15, 329-337.
(31) PETERFREUND R.A., MACCOLLIN M., GUSELLA J. FINK J.S. Characterization and expression of the human A2A adenosine receptor gene. J. Neurochem., 1996,66, 362.
(32) VARANI K.; GESSI S.; DALPIAZ A.; BOREA P.A. Pharmacological and biochemical characterization of purified A2A adenosine receptor in human platelet membranes by [3H]-CGS 21680 binding. Br. J. Pharmacol., 1996, 117, 1693.
(33) VARANI K.;GESSI S.;DIONISOTTI S.;ONGINI E.;BOREA P.A. [3H]-SCH 58261 labelling of functional A2A adenosine receptor in human neutrophyl membranes. Br. J. Pharmacol., 1998,123, 1723.
(34) GAUDA E.B., NORTHINGTON F.J., LINDEN J. ROSIN D.L. Different expression of A2A , A1–adenosine and D2-dopamine receptor genes in the rat peripheral arterial chemoreceptors during postnatal development. Brain Res. 2000, 872, 1-10.
(35) FERRE’ S., FUXE K., VON EULER G., JOHANSSON J., FREDHOLM B.B. Adenosine-dopamine interactions in the brain. Neuroscience, 1992, 51, 501.
(36) HETTINGER BD, LEE A, LINDEN J, ROSIN DL. Ultrastructural localization of adenosine A2A receptors suggests multiple cellular sites for modulation of GABAergic neurons in rat striatum.J Comp Neurol. 2001, 431:331-346.
(37) Università di Bologna;Scuola di dottorato:Scienze mediche.Dottorato di ricerca in fisiologia applicata e fisiopatologia.Tesi:Valutazione della regolazione riflessa spinale in relazione a quadri di presunta disregolazione dopaminergica.Anno accademico 2004-2005.
(38) Artkin Blog:Sistema dopaminergico;amisulpride e levosulpiride.
(39) SIMOLA N.,MORELLI M. E PINNA A.Adenosine A2a Receptor antagonists and Parkinson’s Disease:State of the art and future directions.Current Pharm.design,2008;14:1475-1489.
(40) GERFEN CR, WILSON C. In:Swanson LW, Bjorklund A,Hoekfelt T.Eds, Handbook of chemical neuroanatomy, integrated systems of the CNS.Elsevier Science 1996;12:371-468.
(41) OBESO JA, RODRIGUEZ-OROZ MC, RODRIGUEZ M, LANCIEGO JL, ARTIERA J, PONZALO N, et al. Pathophysiology of the basal ganglia in Parkinson’s disease.Trends Neurosi 2000;23:S8-19.
(42) HETTINGER BD, LEE A, LINDEN J, ROSINI DL. Ultrastructural localization of adenosine A2A receptors suggests multiple cellular sites
(43) HILLION J, CANALS M, TORVINEN M, CASADO V, SCOTT R, TERASMAA A, HANSSON A,WATSON S, OLAH ME, MALLOL J, ET AL. Coaggregation, cointernalization, and codesensitization of adenosine A2A receptors and dopamine D2 receptors. J Biol Chem. 2002, 277:18091-18097.
(44) FUXE K, FERRE’ S, CANALS M, TORVINEN M, TERASMAA A, MARCELLINO D, GOLDBERG SR,STAINES W, ET AL. Adenosine A2A and dopamine D2 heteromeric receptor complexes and their function.J Mol Neurosci. 2005, 26:209-220.
(45) FERRE’ S, VON EULER G, JOHANSSON B, FREDHOLM BB, FUXE K. Stimulation of high-affinity adenosine A2 receptors decreases the affinity of dopamine D2 receptors in rat striatal membranes.Proc Natl Acad Sci U S A. 1991, 88:7238-7241.
(46) KULL B, FERRE’ S, ARSLAN G, SVENNINGSSON P, FUXE K, OWMAN C, FREDHOLM BB. Reciprocal interactions between adenosine A2A and dopamine D2 receptors in Chinese hamster ovary cells co-transfected with the two receptors. Biochem Pharmacol. 1999, 58:1035-1045. (47) YANG SN, DASGUPTA S, LLEDO PM, VINCENT JD, FUXE K.
Reduction of dopamine D2 receptor transduction by activation of adenosine A2a receptors in stably A2a/D2 (long-form) receptor co-transfected mouse fibroblast cell lines: studies on intracellular calcium levels.Neuroscience. 1995, 68:729-736.
(48) PINNA A, DI CHIARA G, WARDAS J, MORELLI M. Blockade of A2a adenosine receptors positively modulates turning behaviour and c-Fos expression induced by D1 agonists in dopamine-denervated rats.Eur J Neurosci. 1996, 8:1176-1181.
(49) POLLACK AE, FINK JS. Synergistic interaction between an adenosine antagonist and a D1 dopamine agonist on rotational behavior and striatal c-Fos induction in 6-hydroxydopamine-lesioned rats.Brain Res. 1996, 743:124-130.
(50) SCHIFFMANN SN, VANDERHAEGHEN JJ. Adenosine A2 receptors regulate the gene expression of striatopallidal and striatonigral neurons.J Neurosci. 1993, 13:1080-1087.
SIMOLA N, FENU S, BARALDI PG, TABRIZI MA, MORELLI M. Involvement of globus pallidus in the antiparkinsonian effects of adenosine A(2A) receptor antagonists.Exp Neurol. 2006a, 202:255-257.