Preparazione delle
Alcune anidridi sono prodotti industriali CH3COCCH3 O O Anidride acetica O O O O O O Anidride ftalica Anidride maleica
Dagli acidi bicarbossilici
Le anidridi cicliche a 5 e 6 termini possono essere preparate per disidratazione degli acidi bicarbossilici C C H H COH COH O O O O O H H tetracloroetano 130°C (89%) + H2O
Reazioni delle
RCOCR' O O RCOR' O RCNR'2 O RCO– O Reazioni delle Anidridi
Reazioni delle Anidridi
+ RCOR'
O
+ Le anidridi reagiscono con gli alcoli
per dare esteri:
R'OH RCOCR
O O
RCOH O
generalmente si usano anidridi simmetriche (entrambi i gruppi R sono uguali)
La reazione è fatta in presenza di piridina (una base) o è catalizzata dagli acidi
Esempio (60%) H2SO4 + CH3COCCH3 O O CH3CHCH2CH3 OH CH3COCHCH2CH3 O CH3
Reazioni delle Anidridi degli acidi
+ RCNR'2
O
+
Le anidridi reagiscono con ammoniaca e ammine per dare ammidi:
2R'2NH RCOCR O O RCO– O R'2NH2 +
Esempio: (98%) + CH3COCCH3 O O H2N CH(CH3)2 O CH3CNH CH(CH3)2
Reazioni delle Anidridi degli acidi
+ 2RCOH
O
Le anidridi reagiscono con acqua per dare acidi carbossilici (ioni carbossilato in base):
H2O + 2RCO– O + 2HO– H2O RCOCR O O RCOCR O O
Esempio + H2O O O O COH O COH O
Sintesi delle Immidi a partire dalle anidridi + NH3 O O O CNH2 O CONH4 O O O NH Ftalimmide calore
CH3COCH2CH2CH(CH3)2 O
Gli esteri sono molto comuni nei prodotti naturali
Acetato di 3-metilbutile
Anche chiamato" acetato di isopentile " o "acetato di isoamile "
Esteri del Glicerolo
R, R', ae R" possono essere uguali o differenti Sono chiamati "triacilgliceroli“, "gliceril triesteri," o "trigliceridi"
grassi e oli sono miscele di trigliceridi
RCOCH CH2OCR' O CH2OCR" O O
Esteri del Glicerolo CH3(CH2)16COCH CH2OC(CH2)16CH3 O CH2OC(CH2)16CH3 O O
Tristearina: si trova in molti grassi animali e vegetali
Esteri Ciclici (Lattoni)
(Z)-5-Tetradecen-4-olide
(feromone sessuale femminile di uno scarafaggio giapponese) O O H H CH2(CH2)6CH3
Esterificazione di Fischer Dai cloruri degli acidi
Dalle anidridi degli acidi carbossilici
”
RCOR’ O + H2O RCOH O + R’OH H +
Reazione globale di esterificazione di un acido carbossilico
Punti di Ebollizione
Gli esteri hanno punti di ebollizione più alti degli alcani perchè sono più polari.
Non potendo formare legami idrogeno con
altre molecole di estere hanno punti di
ebollizione più bassi degli alcoli. CH3CHCH2CH3 CH3 CH3COCH3 O CH3CHCH2CH3 OH 28°C 57°C 99°C Punti di ebollizione
Solubilità in Acqua
Gli esteri possono
formare legami idrogeno con l’acqua, per cui quelli a basso peso molecolare hanno buona solubilità in acqua.
La solubilità decresce con l’aumentare del numero di atomi di carbonio. CH3CHCH2CH3 CH3 CH3COCH3 O CH3CHCH2CH3 OH ~0 33 12.5 Solubilità (g/100 g)
Con i reattivi di Grignard Riduzione con LiAlH4
Con ammoniaca e ammine Idrolisi
Reazioni degli Esteri
RCOR' O RCNR'2 O RCO– O Reazioni degli Esteri
Reazioni degli Esteri
+ RCNR‘’2
O
+
Gli esteri reagiscono con ammoniaca e ammine per dare le ammidi:
R‘’2NH RCOR'
O
Reazioni degli Esteri
+ RCNR'2
O
+
Gli esteri reagiscono con ammoniaca e ammine per dare le ammidi:
R'2NH RCOR' O R'OH via: R C O OR' NR’'2 H -
Esempio (75%) + CCNH2 CH3 O H2C CH3OH CCOCH3 CH3 O H2C + NH3 H2O
Si aumenta la formazione di estere rimuovendo l’acqua
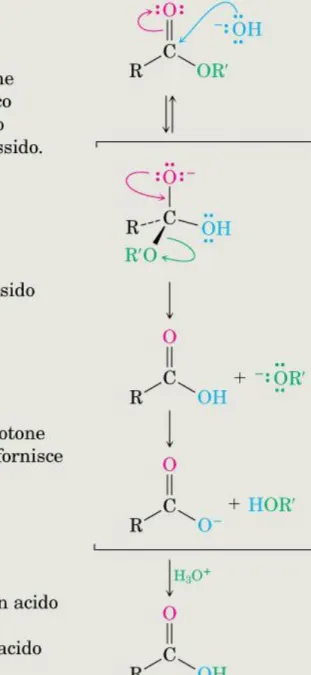
Si aumenta l’idrolisi dell’estere in grande eccesso di acqua L’equilibrio ben bilanciato perchè il carbonile di un estere e quello di un acido carbosslico sono similmente stabilizzati
Idrolisi Acido-Catalzzata degli Esteri
RCOH O + R'OH RCOR' O + H2O H +
Esempio HCl, calore + H2O O CHCOCH2CH3 Cl + CH3CH2OH O CHCOH Cl (80-82%)
E’ il contrario del meccanismo dell’ esterificazione acido-catalzzata.
Come il meccanismo dell’esterificazione, comporta due stadi:
1) formazione dell’ intermedio tetraedrico (3 passaggi)
2) dissociazione dell’ intermedio tetraedrico (3 passaggi)
Meccanismo dell’Idrolisi Acido-Catalizzata degli Esteri
Meccanismo dell’Idrolisi Acido-Catalizzata degli Esteri
1 RC O O R' •• • • • • •• O • • + H H H
1 RC O O R' •• • • • • •• O • • + H H H •• RC O O R' •• • • + H • • O • • H H
1 •• RC O O R' •• • • + H l’ossigeno carbonilico è protonato poichè il catione prodotto è stabilizzato per risonanza RC O O R' •• • • + H ••
2 •• • • O • • H H RC O O R' •• • • + H
2 •• • • O • • H H RC O O R' •• • • + H RC OH OR' •• • • • • •• O • • + H H
3 • • O • • H H •• RC OH OR' •• • • • • O • • H H +
3 • • O • • H H •• RC OH OR' •• • • • • O • • H H + O • • H H H + •• RC OH OR' •• • • • • O • • H ••
Scissione dell’ intermedio tetraedrico
4 O • • H H H + •• RC OH O •• • • • • OH •• •• R'
4 O • • H H H + •• RC OH O •• • • • • OH •• •• R' •• RC OH O •• • • OH •• •• R' H + • • O • • H H
5 •• RC OH O •• • • OH •• •• R' H +
5 •• RC OH O •• • • OH •• •• R' H + •• O •• R' H + RC OH •• • • OH •• •• +
5 RC OH •• OH •• •• + RC OH •• • • OH •• •• +
6 O •• H •• H RC O •• OH •• •• + H + O H •• H H RC O •• OH •• •• • •
Attivazione del gruppo carbonilico per protonazione dell’ossigeno carbonilico
Addizione nucleofila dell’acqua al gruppo carbonilico per formare l’intermedio tetraedrico
Eliminazione di alcol dall’intermedio tetraedrico e ripristino del gruppo carbonilico
Studi di marcatura isotopica con 18O + H2O COCH2CH3 O COCH2CH3 O + H2O
Il benzoato di etile, marcato con 18O
all’ossigeno carbonilico, è stato sottoposto a idrolisi acido-catalizzata.
Il benzoato di etile, ricuperato prima del
completamento della reazione,aveva perso
l’18O marcato.
Questa osservazione è coerente con l’intermedio tetraedico.
Studi di marcatura isotopica con 18O C OH OH OCH2CH3 + H2O COCH2CH3 O H+ COCH2CH3 O + H2O H+
Idrolisi degli Esteri in Base: Saponificazione
E’ chiamata saponificazione
E’ irreversibile a causa della forte stabilizzazione dello ione carbossilato
Se il prodotto desiderato è l’acido carbossilico, la saponificazione è seguita da acidificazione (aggiustando il pHdella soluzione)
Idrolisi Basica degli Esteri
RCO– O + R'OH RCOR' O + HO–
Idrolisi Basica degli Esteri RCO– O + R'OH RCOR' O + HO– H+ RCOH O
Esempio Acqua/metanolo, calore (95-97%) CH2OCCH3 CH3 O + NaOH CH2OH CH3 O CH3CONa +
Esempio (87%) + CCOH CH3 O H2C 1. NaOH, H2O, calore 2. H2SO4 CH3OH CCOCH3 CH3 O H2C
I saponi CH3(CH2)yCOCH CH2OC(CH2)xCH3 O CH2OC(CH2)zCH3 O O L’idrolisi basica dei trigliceridi (dai grassi e oli) dà
sali di acidi carbossilici a lunga catena.
Questi sali sono
saponi. K2CO3, H2O, calore CH3(CH2)xCOK O CH3(CH2)yCOK O CH3(CH2)zCOK O
Quale legame si scinde quando gli esteri sono idrolizzati in base? RCO O + R' •• – OH • • •• •• •• • • •• RCO O + R'OH •• •• • • •• – • • •• ••
Una possibilità è un attacco SN2 dell’idrossido sul gruppo alchilico dell’estere (scissione
alchile-ossigeno ). Lo ione carbossilato è il gruppo uscente.
Quale legame si scinde quando gli esteri sono idrolizzati in base? + •• – OH • • •• RC O OR' •• •• • • •• + – • • •• O•• R'
Una seconda possibilità è la sostituzione
nucleofila acilica (scissione acile-ossigeno). RC O • • •• •• •• OH
La marcatura con 18O dà la risposta
L’18O finisce nell’alcol, non nel carbossilato; quindi avviene una sostituzione nucleofila acilica (scissione acile-ossigeno).
CH3CH2COCH2CH3 O NaOH + CH3CH2CONa O CH3CH2OH +
L’analisi stereochimica dà la stessa risposta L’alcol ha la stessa configurazione al centro stereogenico dell’estere; quindi,avviene una sostituzione nucleofila acilica e non una SN2 CH3COK O + CH3C O C O H C6H5 CH3 C HO H C6H5 CH3 KOH, H2O
Si passa attraverso un intermedio tetraedrico? + •• – OH • • •• RC O OR' •• •• • • •• + – • • •• O•• R'
La sostituzione nucleofila acilica procede in un unico passaggio, o è coinvolto un intermedio tetraedrico? RC O • • •• •• •• OH
Studi di marcatura isotopica con 18O + H2O COCH2CH3 O COCH2CH3 O + H2O
Il benzoato di etile, marcato con 18O
all’ossigeno carbonilico, è stato sottoposto a idrolisi basica.
Il benzoato di etile, ricuperato prima del
completamento della reazione,aveva perso
l’18O marcato.
Questa osservazione è coerente con l’intermedio tetraedico.
Studi di marcatura isotopica con 18O C OH OH OCH2CH3 + H2O COCH2CH3 O HO– COCH2CH3 O + H2O HO–
Coinvolge due stadi:
1) formazione dell’intermedio tetraedrico 2) dissociazione dell’intermedio tetraedrico
Meccanismo dell’Idrolisi Basica degli Esteri
Primo stadio: formazione dell’intermedio tetraedrico RC OH OH OR' + H2O RCOR' O L’acqua si addiziona al gruppo carbonile dell’estere
questo stadio è analogo all’addizione
base-catalizzata dell’acqua a un chetone
Secondo stadio: scissione dell’intermedio tetraedrico RC OH OH OR' + R'OH RCOH O HO–
Meccanismo di formazione dell’intermedio tetraedrico
1 RC O OR' •• • • • • •• O • • H • • •• –
1 RC O OR' •• • • • • •• RC O OR' •• • • • • •• O • • H • • – •• O • • H • • •• –
2 RC O OR' •• • • • • •• O • • H • • – •• • • O •• H H
2 RC O OR' •• • • • • •• O • • H • • – •• • • O •• H H RC O OR' •• • • •• O • • H • • •• H • • – • • O •• H
Dissociazione dell’intermedio tetraedrico
3 RC O OR' •• • • •• O • • H • • •• H • • – • • O •• H
3 • • O •• H H RC O OR' •• • • •• O • • H • • •• H • • – • • O •• H OR' • • •• – •• RC • • O •• • • •• O H
4 OR' • • •• – •• RC • • O •• • • •• O H HO– RC • • O •• • • •• O • • – H OR' •• •• H2O
Il primo passaggio è l’addizione nucleofila dello ione ossidrile al carbonile
Nel primo stadio si forma un intermedio tetraedrico Nel secondo stadio c’è la dissociazione indotta dallo ione idrossido dell’intermedio tetraedrico