CAPITOLO 5
C
ONVERSIONE DIA
CIDOL
EVULINICO INP
RODOTTI ADA
LTOV
ALOREA
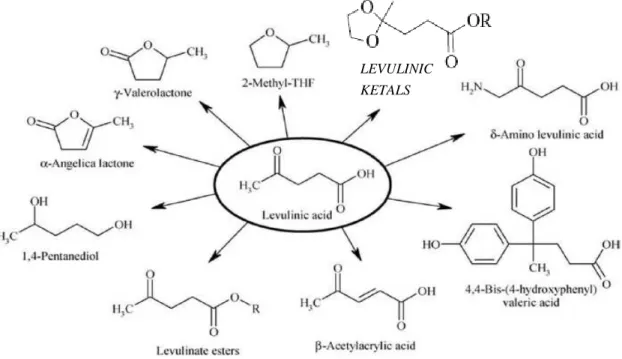
GGIUNTOL’acido levulinico è una piattaforma chimica versatile di notevole interesse (Fig. 1); la presenza del gruppo carbonilico e del gruppo carbossilico rendono la molecola adatta alla conversione in fine chemicals di grande interesse mediante reazioni catalitiche che, negli ultimi anni, sono state oggetto di approfonditi studi.
L’acido levulinico ha la tipica reattività degli acidi carbossilici e dei chetoni; generalmente l’atomo di carbonio del gruppo carbonilico è più suscettibile all’attacco nucleofilo rispetto a quello del gruppo carbossilico.
Il prezzo dell’acido levulinico è ancora alto, circa 5 $ al kg; le chiavi per rendere economica la filiera dell’acido levulinico sono molteplici: è necessario ridurne il costo di produzione (per questo è necessario sintetizzarlo, a partire da biomasse di scarto o colture dedicate, mediante processi green ed economicamente validi) e trovare valide alternative sintetiche per convertirlo in prodotti a più alto valore aggiunto.
Figura 1 - L'acido levulinico come piattaforma chimica. KETALS
5.1 PRODUZIONE DI ETIL LEVULINATO
L’etil levulinato può essere utilizzato come additivo ossigenato per carburanti (non contiene zolfo ed ha un alto potere lubrificante), oltre che come piattaforma chimica da cui produrre chetali e altri substrati. Oltre all’etil levulinato è possibile sintetizzare, in condizioni simili, altri esteri dell’acido levulinico; molti di essi, come il vinil levulinato, possono essere copolimerizzati con altri monomeri come acrilonitrile e cloruro di vinile. Nel presente lavoro di tesi si valuta la conversione dell’etil levulinato nei rispettivi chetali utilizzando catalizzatori acidi solidi di tipo zeolitico.
Le reazioni di esterificazione che coinvolgono il gruppo carbossilico dell’acido levulinico e portano alla formazione dei vari esteri sono molto importanti per la valorizzazione del substrato. Per ottenere rese rilevanti in esteri levulinici si conduce la reazione in catalisi acida omogenea in presenza di acidi minerali come H2SO4 [1], acido polifosforico [2] o acido p-toluensolfonico [3] (Fig. 2). Recentemente [4] è stato messo a punto un metodo di produzione degli esteri dell’acido levulinico a partire da una soluzione acquosa contenente acido levulinico, detto “permeation enhanced reactive extraction”: nelle condizioni di esterificazione (temperatura compresa tra 50 e 250 °C e presenza di un catalizzatore acido) la soluzione acquosa viene messa in contatto con una soluzione alcolica per mezzo di una membrana. L’alcool (metanolo, etanolo o propanolo) presente nella fase organica agisce sia da agente esterificante che da estraente per il chetale che si forma quando le due fasi sono in contatto. Mediante la membrana la fase organica, ricca in chetale, viene separata dalla fase acquosa povera di acido levulinico.
È possibile produrre gli esteri dell’acido levulinico a partire da furfuril alcool (Fig. 3).
→ + + − O H H ROH , 2
Figura 2 - Formazione di alchil levulinati da AL in catalisi acida.
In un brevetto americano [16] è descritto un processo di produzione di esteri dell’acido levulinico mediante aggiunta di alcool furfurilico ad una soluzione contenente un altro alcool (ROH in figura 3), che agisce come agente esterificante, a temperature comprese tra 64 e 220 °C, in condizioni anidre ed in presenza di HBr o HCl. Per ottenere rese rilevanti è necessario aggiungere lentamente l’alcool furfurilico alla miscela reagente: la sua concentrazione non deve mai superare il 2 % v/v. Un ulteriore brevetto [17] utilizza un procedimento simile in presenza dello 0,4 - 4 % di acqua per evitare la formazione di cloruri alchilici che altrimenti si formerebbero in presenza del solo alcool. In un brevetto russo [18] gli autori rivendicano la produzione di esteri dell’acido levulinico a partire da furfuril alcool ed alcool alifatici in presenta di CCl4 e di un catalizzatore solido a base di ferro acetil acetonato. Conducendo la reazione per 2 - 5 h in condizioni di riflusso gli autori rivendicano rese in esteri comprese tra l’80 ed il 98 %.
In un brevetto del 2010 [15] viene descritta una procedura per produrre etil levulinato, in alte rese ed in un solo stadio, mediante un processo batch o continuo. Il prodotto di reazione stesso è riciclato al reattore ed è anche il solvente della reazione; questa è condotta in presenza di H2SO4 anche a pressione atmosferica. Tuttavia rimane inevitabile la formazione di sottoprodotti solidi ad alto peso molecolare che rimangono sospesi nel reattore e devono essere allontanati. La reazione può essere effettuata utilizzando acidi protici non volatili come l’acido solforico. La reazione può essere effettuata anche a pressione atmosferica.
5.2 SINTESI DI CHETALI A PARTIRE DAGLI ESTERI DELL’ACIDO LEVULINICO
La reazione di chetalizzazione selettiva di esteri dell’acido levulinico costituisce un valido percorso industriale per la sintesi di nuovi polimeri, oligomeri, additivi per polimeri e solventi, ottenuti a partire da fonti rinnovabili. Utilizzando una moderata quantità di un catalizzatore acido protico è possibile ottenere conversioni e selettività nel prodotto desiderato maggiori del 95 %. La cinetica della reazione non risente molto delle basse concentrazioni di acido che si possono usare [5].
La reazione di un alcool con il gruppo chetonico (chetalizzazione) porta alla formazione dei chetali mentre la reazione con il gruppo estereo causa l’indesiderata reazione di trans esterificazione. L’obiettivo dello studio realizzato da Mullen nel 2010 [6][9] è quello di produrre selettivamente chetali ciclici, in catalisi acida, eliminando completamente la possibilità di formazione dei prodotti di trans esterificazione ad alto peso molecolare. Acidi minerali forti (HCl e H2SO4) e acidi solidi (resine a scambio ionico e zeoliti) sono noti
catalizzatori sia delle reazioni di condensazione tra alcoli e chetoni con formazione di chetali, sia delle reazioni di trans esterificazione tra alcoli e esteri che portano alla formazione di prodotti ad alto peso molecolare.
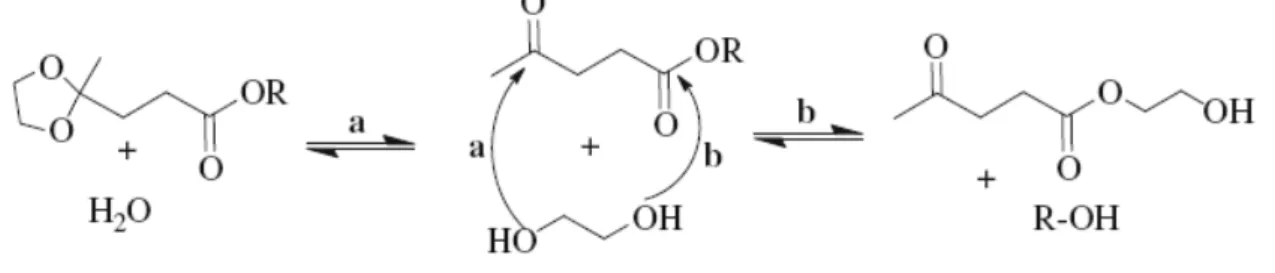
In letteratura sono note reazioni di formazione di chetali ciclici a partire da dioli sostituiti in posizione 1,2 o 1,3 [7]; anche substrati con 3 o 4 gruppi OH (polioli) possono essere usati per formare chetali se almeno due gruppi ossidrilici del substrato sono in configurazione 1,3 o 1,2 [8][9]. Un diolo, tuttavia, può reagire anche con la funzionalità esterea di un cheto estere; il prodotto risultante ha un ossidrile libero su cui può avvenire ulteriore trans esterificazione. Come vediamo (Fig. 4), la reazione tra un diolo può quindi seguire due diversi percorsi: il percorso ‘a’ conduce alla formazione del prodotto desiderato, il chetale ciclico, il percorso ‘b’ porta alla formazione di un sottoprodotto non desiderato.
In letteratura sono riportati molti esempi in cui la reazione di formazione dei chetali dai rispettivi cheto esteri e dioli, è condotta in presenza di catalizzatori acidi minerali forti; utilizzando H2SO4 in basse concentrazioni (10-3 - 10-4 M) e come reagenti glicerolo ed etil levulinato si formano considerevoli quantità di oligomeri (Fig. 4 percorso ‘b’) [10].
Ono [8] ha studiato la reazione di chetalizzazione dell’etil levulinato con vari dioli usando come catalizzatore acido p-toluensolfonico (10-2 M); conducendo la reazione per 2 h in toluene sono state ottenute rese in chetali comprese tra il 78 ed il 98 %.
McCullough [11], usando acido p-toluensolfonico (10-2 M), etilen glicol e vari cheto esteri, ha ottenuto rese in chetali dell’81 % dopo 48-72 h.
In letteratura sono riportati studi che utilizzano gli stessi acidi in concentrazioni simili a quelle appena viste per esterificare acidi carbossilici; per questo motivo è difficile condurre la reazione di chetalizzazione in modo selettivo.
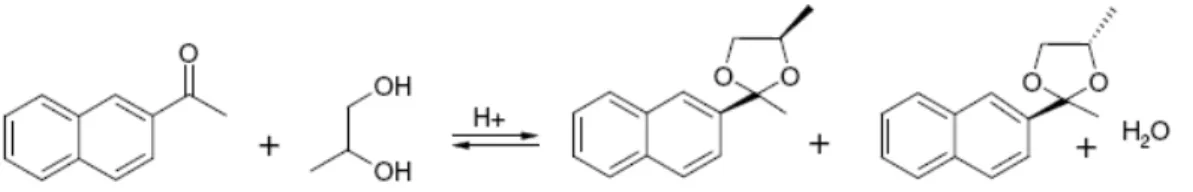
In un lavoro del 2008 [13] vengono studiate le reazioni tra diversi substrati contenenti gruppi chetonici e vari dioli ; in particolare, la reazione tra 8.8 mmol di metil naftil chetone e 21 mmol di glicol propilenico (rapporto diolo / chetone = 2,4) (Fig. 5) viene condotta in presenza di catalizzatori acidi solidi, di tipo non zeolitico, a base di ossidi misti (in particolare WO3 e
ZrO2). Utilizzando il catalizzatore più attivo e selettivo (15WZ-750, dove W = WO3 e Z = ZrO2), nelle condizioni ottimali di reazione (temperatura di 146 °C, tempo di residenza di 1 h, eliminazione dell’acqua mediante distillazione sottovuoto), gli autori rivendicano conversioni di metil naftil chetone (reagente limitante) comprese tra il 70 % (usando l’1 % w/w di catalizzatore) e il 97 % (usando il 7 % w/w di catalizzatore) con selettività del 100 %.
In un lavoro del 2002 [14] viene esaminata la reazione tra vari substrati contenenti un solo gruppo funzionale, il chetone, e vari dioli di tipo 1,2 (Fig. 5) e 1,3. Sono stati utilizzati catalizzatori solidi amorfi o cristallini, a base di metalli tetravalenti e fosfati, contenenti siti acidi di Lewis e di Bronsted, di struttura generale MIV (HXO4)2 · nH2O dove MIV = Sn, Ti, Zr. Ce e Th e dove X = P, As, W e Mo. Nelle condizioni ottimali di reazione tra il cicloesanone e l’etilen glicol (tempo di residenza di 3 h in condizioni di riflusso, rapporto molare cicloesanone / solvente (toluene) = 1 / 65, rapporto molare cicloesanone / etilen glicol = 1 / 1,3), gli autori rivendicano una resa ponderale massima in chetale del 90 % rispetto al chetone utilizzando il catalizzatore amorfo contenente Sn e P (Fig. 6). Nelle stesse condizioni di reazione, usando come substrato l’acetofenone è stata ottenuta una resa del 56 % in peso mentre usando propiofenone è stata ottenuta una resa del 72 % in peso (rapporto ottimale propiofenone / etilen glicol = 1 / 2).
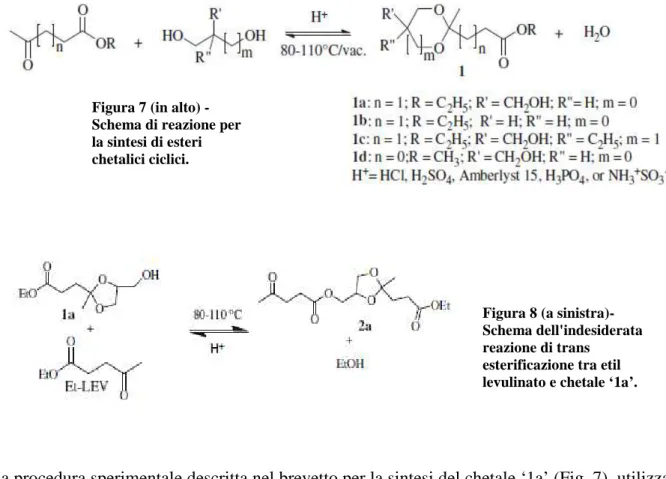
I cheto esteri ottenuti dall’acido levulinico, già prodotti dalla Segetis (250.000 lbs / anno) dal 2009, possono trovare varie applicazioni commerciali. Con riferimento alla figura 7, chetali in cui il numero di atomo di carbonio del gruppo alchilico R è piccolo possono essere usati come solventi non volatili e non infiammabili praticamente universali, chetali in cui il numero di
Figura 5 - Reazione tra metil naftil chetone e propilen glicol.
atomi di carbonio nei gruppi R, RI ed RII è vario possono essere usati come bioplastificanti (possono sostituire in modo efficace, sia dal punto di vista economico che delle performance, gli ftalati utilizzati come plastificanti nel PVC ed i benzoati utilizzati negli adesivi), polioli e monomeri per la sintesi di omopolimeri e copolimeri (resine termoindurenti e poliesteri). Per rendere economicamente valida la filiera dei chetali, oltre ad avere a diposizione acido levulinico a basso costo, è necessario aumentare la selettività e le rese del processo di produzione del chetale desiderato.
In uno studio del 2009 [9] è stato dimostrato che utilizzando acidi minerali forti in concentrazioni maggiori di 10-3 M la selettività a chetali è bassa mentre utilizzando gli stessi acidi in concentrazioni minori di 10-3 M è possibile aumentare la selettività a chetali senza pregiudicare la cinetica della reazione. Conducendo la reazione in queste condizioni per 1 ora è possibile ottenere selettività del 98 % e conversioni del cheto estere del 99 %.
Nel brevetto è descritta la reazione tra diversi cheto esteri e vari polioli (Fig. 7) con l’obbiettivo di eliminare le reazioni che portano alla formazione di prodotti ad alto peso molecolare (Fig. 8).
La procedura sperimentale descritta nel brevetto per la sintesi del chetale ‘1a’ (Fig. 7) utilizza 0,53 moli di etil levulinato e 0,14 moli di glicerolo (reagente in difetto); la reazione è stata effettuata in un pallone da 500 ml munito di agitatore meccanico, separatore Dean Stark e
Figura 7 (in alto) - Schema di reazione per la sintesi di esteri chetalici ciclici.
Figura 8 (a sinistra)- Schema dell'indesiderata reazione di trans
esterificazione tra etil levulinato e chetale ‘1a’.
condensatore. Quando la temperatura della miscela reagente ha raggiunto 110 °C è stato aggiunto il catalizzatore (2,5·10-5 moli di acido solforico al 98 % w/w) e la pressione è stata ridotta a 30 torr. Nel separatore è stata raccolta una miscela che smista in due fasi (inferiore etil levulinato, superiore acqua); dopo 30 minuti di reazione gli autori rivendicano una conversione del glicerolo del 99 % ed una selettività in chetale del 100 % con totale assenza di sottoprodotti (analisi al GC-MS). Nel brevetto la miscela reagita viene neutralizzata con fosfato di sodio, filtrata e distillata per ottenere il chetale puro. Le procedure per gli altri substrati sono simili. In nessun caso è utilizzato un solvente.
La sintesi dell’etil levulinato etilen chetale o 2-(2-etossicarbonil etil)-2-metil-1,3-diossolano (chetale ‘1b’ in figura 7) è stata effettuata a partire da etilen glicol ed etil levulinato; la reazione è stata condotta per 120 minuti usando come catalizzatore 2,5·10-5 moli di H2SO4; gli autori rivendicano una selettività a chetale del 100 % ed una conversione dell’etilen glicol dell’88 %. L’uso di un catalizzatore acido solido (Amberlyst 15) per la sintesi di ‘1b’ permette di ottenere conversioni del reagente in difetto maggiori del 99 % e selettività in chetale del 100 %.
Tabella 1 - Selettività a chetale dei processi descritti nel brevetto [9].
Le reazioni di formazione dei chetali ciclici sono reazioni di equilibrio; per aumentare le conversioni è quindi necessario rimuovere l’acqua che si forma come coprodotto durante la reazione; negli esperimenti effettuati su scala laboratorio descritti nel brevetto l’acqua era allontanata per distillazione sotto vuoto e raccolta nel separatore Dean Stark. In fase di scale up del processo è necessario valutare la rimozione dell’acqua ricorrendo ad una distillazione azeotropica o all’impiego di setacci molecolari.
Prodotto Catalizzatore Moli H+ t (min) Conversione reagente in difetto (%) Selettività a chetale (%) 1a H2SO4 3·10-5 20 > 99 100 1a H2SO4 2,5·10 -3 20 > 99 97 1c H2SO4 2,5·10 -5 60 98 100 1c H2SO4 2,5·10 -3 60 99 86 1d H2SO4 2,5·10-5 100 > 99 88,5 1b H2SO4 2,5·10 -5 120 88 100 1a HCl 2,5·10-5 30 > 99 100 1a Amberlyst 15 2,5·10-5 100 > 99 100 1a H3PO4 3·10-5 20 95,5 100
I chetali sono noti come gruppi protettori di chetoni o dioli: sono relativamente stabili alle basi ma idrolizzano in presenza di acqua o di acidi [12]. Nel lavoro è stato riscontrato che il chetale ‘1a’ si idrolizza completamente in 5 min a 60 °C in presenza di acido solforico.
Le elevate conversioni e selettività ottenute nelle procedure descritte hanno permesso un rapido scale up del processo fino ad un impianto (di proprietà della Segetis) capace di produrre 250.000 lbs / anno di chetali.
Nel presente lavoro di tesi verranno studiati catalizzatori acidi solidi di tipo zeolitico per la sintesi del chetale ottenute a partire da etil levulinato ed etilen glicol: il nome IUPAC del chetale ottenuto è 2-(2-etossicarbonil etil)-2-metil-1,3-diossolano mentre nel presente lavoro di tesi è indicato semplicemente come ElEgK.
L’uso delle zeoliti permette di svolgere la reazione in eterogeneo eliminando i problemi di corrosione di un impianto che utilizza H2SO4 e facilitando il recupero ed il riciclo (dopo eventuale rigenerazione) del catalizzatore. La shape selectivity dovrebbe impedire o limitare la formazione di sottoprodotti ad alto peso molecolare dovuti a reazioni di condensazione.
5.3 ALTRI DERIVATI DELL’ACIDO LEVULINICO
5.3.1 Sintesi dell’acido difenolico
L’acido 4,4-bis-(4-idrossifenil)pentanoico (DPA) può sostituire il bisfenolo A (BPA), attualmente prodotto ad un costo minore dall’industria petrolchimica, come monomero per la sintesi di policarbonati, resine epossidiche e molte altri polimeri. Può inoltre essere utilizzato per produrre lubrificanti, adesivi e vernici [19].
DPA è preparato per reazione di addizione nucleofila del fenolo all’acido levulinico. La reazione necessita di catalizzatori acido omogenei (HCl) o eterogenei (ZSM-5, MCM-49 e altri) [20].
→ cat
+
L’acido levulinico può subire addizione nucleofila al gruppo carbonilico; in presenza di H2 e di un opportuno catalizzatore, ammine primarie possono reagire con l’acido levulinico per formare 5-metil-2-pirrolidone, utilizzato nell’industria farmaceutica [21].
5.3.2 Reazioni che coinvolgono il gruppo metilico
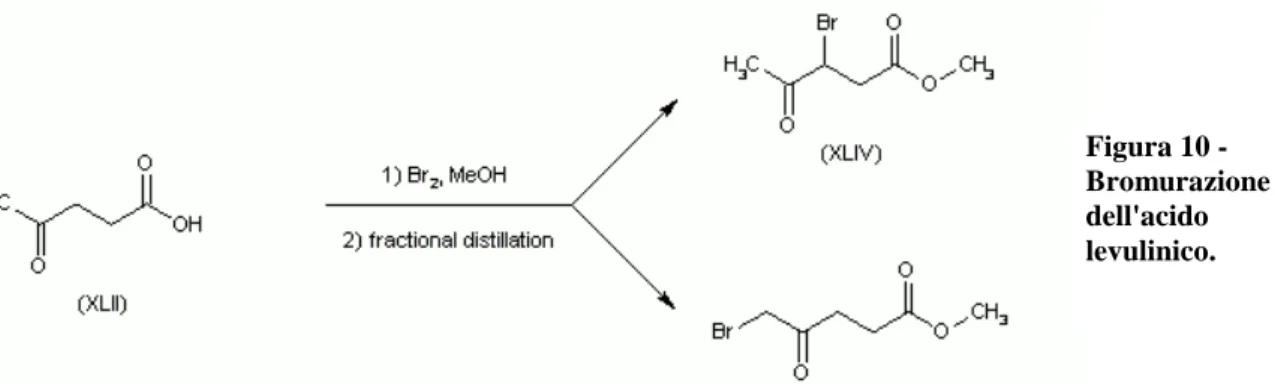
Una reazione tipica del gruppo metilico dell’acido levulinico è l’alogenazione con Cl2 o Br2 in metanolo [22]. Il l’acido 5-bromolevulinico è un precursore dell’acido γ-amminolevulinico (DALA), molto utilizzato come erbicida biocompatibile.
5.3.3 Sintesi dell’acido succinico
L’ossidazione dell’acido levulinico in catalisi basica può portare alla produzione di acido succinico. Anche l’ossidazione ad alte temperature (365 - 390 °C), in presenza di V2O5 come catalizzatore, permette di ottenere AL con rese di circa l’80 % (Fig. 11) [23].
L’acido succinico è un intermedio chimico versatile. Mediante la sua idrogenazione può essere sintetizzato il γ-butirrolattone (GBL), utilizzato nell’industria agrochimica e farmaceutica, e l’1,4-butandiolo (BOD), substrato base per la produzione di importanti polimeri (poliesteri, poliuretani e poliesteri) tra cui il polibutilen tereftalato, usato per la sintesi di materie plastiche, fibre, films e adesivi [24]. Dal BOD può essere sintetizzato,
Figura 10 - Bromurazione dell'acido levulinico. Figura 11 - Sintesi dell'acido succinico.
→
V2O5,365°C 2 CO +mediante disidratazione, il tetraidrofurano (THF); questo è usato come solvente e per sintetizzare materiali polimerici come il politetrametiln glicol.
5.3.4 Produzione di γ-valerolattone
L’acido levulinico o i suoi esteri possono essere ridotti, mediante idrogenazione catalitica, a γ-valerolattone (GLV) (Fig. 12); la ciclizzazione del substrato di partenza comporta la perdita, rispettivamente, di acqua o dell’alcool corrispondente. La reazione di idrogenazione può essere condotta mediante catalizzatori omogenei (sistemi a base di rodio o rutenio) [25][26] o eterogenei (sistemi a base di platino, rutenio, rodio, iridio e palladio)[27][28].
Nel Dipartimento di Chimica e Chimica Industriale dell’Università di Pisa è stato brevettato [29] un sistema innovativo per l’idrogenazione
selettiva di AL o etil levulinato a GLV in acqua o etanolo; l’innovazione è basata sulla combinazione di due componenti catalitiche: una componente metallica (a base di rutenio o palladio) in presenza di una componente acida solida (fosfato di niobio, Amberlyst 70) che attiva il gruppo carbonilico all’idrogenazione; questa può essere condotta con alte rese in condizioni blande: pressione di 5 atm e temperatura di 50 °C.
GLV, oltre ad essere utilizzato come solvente nei profumi e nelle lacche e come insetticida è valutato come substrato da cui generare additivi per carburanti e monomeri usati per la sintesi di polimeri acrilici e del bio-nylon. Il più importante derivato del GLV è il metil tetraidrofurano (MTHF), un potenziale additivo per carburanti ottenuto per idrogenazione catalitica [30]
La reazione tra il GLV e la formaldeide conduce alla formazione dell’α-metilen-γ-valerolattone (MGLV) (Fig. 12), un monomero acrilico dalla struttura molto simile al metil metacrilato (MMA).
5.3.5 Sintesi di acido δ-amminolevulinico
L’acido δ-aminolevulinico (DALA) è una molecola presente in natura nelle cellule animali e vegetali. Costituisce il principio attivo di molti erbicidi e insetticidi visto che è un composto
Figura 12 - GLV (in alto) e MGLV (in basso).
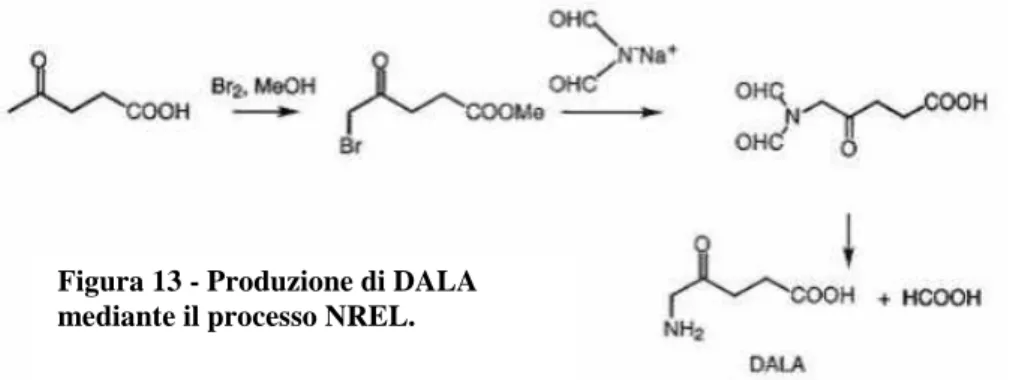
compatibile con l’ambiente. Per produrre il DALA dall’acido levulinico è necessario introdurre selettivamente sul C5, un gruppo amminico. Il metodo più vecchio usato per attivare la posizione C5 è la bromurazione dell’acido levulinico in mezzo alcoolico a dare l’acido 5 - bromolevulinico. Quest’ultimo è quindi amminato utilizzando una specie nucleofila contenente azoto. Tuttavia questo processo non è economico ed ha basse rese. Il processo NREL (Fig. 13) ha significativamente migliorato la resa in DALA. In questo processo si produce acido formico come coprodotto e si riducono i costi ma l’utilizzo del DALA rimane confinato a trattamenti erbicidi altamente selettivi e molto costosi [30].
Figura 13 - Produzione di DALA mediante il processo NREL.
B
IBLIOGRAFIA1. A. R. Bader, A. D. Kontowicz, J. Am. Chem. Soc., 1953, 75, 5416. 2. P. J. Fagan, L. E. Manzer, US patent 7,153,996, 2006.
3. W. A. Farone, J. E. Cuzens, US patent 6,054,611, 2000. 4. P. M. Ayoub, World patent 2005/070867 A1, 2005. 5. A. O. King, N. Yasuda, Top. Organ. Chem., 2004, 6, 205.
6. B. D. Mullen, V. Badarinarayana, M. Santos-Martinez, S. Selifonov, Top. Catal., 2010, 53, 1235.
7. F. A. Carey, R. J. Sundberg, Advanced Organic Chemistry, 1983, parte B 2nd ed., 544. 8. D. Ono, A. Masuyama, Y. Nakatsuji, M. Okahara, S. Yamamura, T. Takeda, J. Am. Oil.
Chem. Soc., 1993, 70, 29.
9. S. Selifonov, S. D. Rothstein, B. D. Mullen, World patent 2009/049041, 2009. S. Selifonov, S. D. Rothstein, B. D. Mullen, World patent 2009/048874, 2009. 10. S. Selifonov, World patent 2007/062118, 2007.
11. M. Okahara, Y. Masuyama, JP patent 04217972, 1992.
12. Y. Leblanc, B. J. Fitzsimmons, J. Adams, F. Perez, J. Org. Chem., 1986, 51, 789.
13. J. Justus, A. Vinu, M. B. Devassy, V. V. Balasubramanian, W. Bohringer, J. Fletcher, S. B. Halligudi, Cat. Communic., 2008, 9, 1671.
14. S. M. Patel, U. V. Chudasama, P. A. Ganeshpure, J. Molec. Catal., 2003, 194, 267. 15. F. Jing, S. Donen, S. Selifinov, B. Mullen, World patent 2010/102203, 2010. 16. L. R. Hart, R. Kenneth, US patent 2,763,665, 1956.
17. G. W. Huffman, E. K. Stigger, US patent 3,203,964, 1965.
18. U. M. Dzhemilev, R. I. Khusnutdinov, A. R. Baiguzina, A. Smirnov, R. Mukminov, RU
patent 2,319,690, 2008.
19. M. Weber, K. Weiser-Elbl, European patent 373,232, 1998.
20. Y. Xiaodan, G. Yihang, L. Kexin, Y. Xia, X. Leilei, G. Yingna, H. Jianglei Hu, J.
Molec. Catal. A, 2008, 290 (1-2), 44.
21. L. E. Manzer, F. E. Herkes, US patent 0,192,933 A1, 2004.
22. H. J. Ha, S. K. Lee, Y. J. Ha, J. W. Park, Synth. Commun., 1994, 24. 2257. 23. A. P. Dunlop, S. Shelbert, US patent 2,676,186, 1954.
24. T. Willke, K. D. Vorlop, Appl. Microbiol. Biotech., 2004, 66, 131.
25. M. Poliakoff, R. A. Bourne, J. G. Stevens, J. Ke, Chem. Commun., 2007, 4632. 26. L. E. Manzer, US patent 6,617,464, 2003.
27. A. M. Raspolli Galletti, G. Braga, G. Sbrana, J. Organomet. Chem., 1982, 231, 79. 28. I. T. Horvath, H. Medhi, V. Fabos, R. Tuba, A. Bodor, L. T. Mika, Top. Catal. 2008,
29. A. M. Raspolli, M. Martinelli, V. De Luise, IT patent A000032, 2009.
30. J. J. Bozell, L. Moens, D. C. Elliott, Y. Wang, G. G. Neuenscwander, S. W. Fitzpatrick, R. J. Bilski, J. L. Jarnefeld, Res. Conserv. Recycl., 2000, 28, 227.
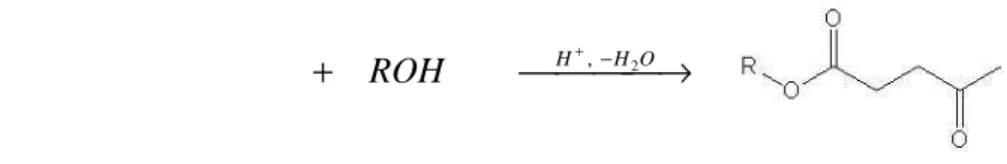
![Tabella 1 - Selettività a chetale dei processi descritti nel brevetto [9].](https://thumb-eu.123doks.com/thumbv2/123dokorg/7547289.108935/7.892.139.802.638.922/tabella-selettività-chetale-processi-descritti-brevetto.webp)