UNIVERSITA’ DEGLI STUDI DI PISA
Facoltà di Medicina e Chirurgia
Scuola di Specializzazione in
Anestesia e Rianimazione
Indirizzo: Terapia Antalgica
APPROCCIO MULTIMODALE AL
TRATTAMENTO DEL DOLORE
POSTOPERATORIO IN CHIRURGIA
ADDOMINALE MAGGIORE
Relatore Candidata
Dr. V. Pavoni Dr. E. Crisci
Anno accademico 2010/2011
INDICE
PARTE PRIMA
Definizione Pag. 2 Fisiopatologia del dolore Pag. 4 Caratteristiche del dolore postoperatorio Pag.13 Valutazione del dolore postoperatorio Pag.17 Effetti avversi causati dal dolore Pag.18 Preemptive analgesia Pag.23 Terapia del dolore postoperatorio Pag.27 Pregabalin Pag.33 Modalità di somministrazione degli analgesici Pag.37 Tecniche chirurgiche per le malattie infiammatorie intestinali Pag.41
PARTE SECONDA
Scopo della tesi Pag.44 Materiali e Metodi Pag.44
Risultati Pag.48
Discussione Pag.53
PARTE PRIMA
DEFINIZIONE
Il dolore postoperatorio (DPO) è considerato la forma più caratteristica di dolore acuto. La Società Internazionale per lo Studio del Dolore definisce il dolore acuto come “una spiacevole esperienza sensoriale ed emozionale associata ad un danno tessutale attuale o potenziale”. Il DPO è, quindi, un dolore generalmente prevedibile, caratterizzato da forte intensità e di breve durata, dovuto alla stimolazione di recettori specifici da parte dell’insulto chirurgico.
Esiste un’ampia variazione individuale nella quantità di dolore che si percepisce in risposta a un preciso stimolo, e vi è anche una grande differenza nelle risposte a particolari approcci terapeutici. Queste differenze sono in funzione non solo della patologia preesistente, della sede, del tipo e dell’importanza dell’intervento chirurgico, ma anche, e talvolta prevalentemente, sono dovute sia a differenze genetiche individuali sia a fattori di modulazione non fisiologici che fanno da contorno ad ogni condizione di dolore: l’ansia, la paura, il senso del controllo, il substrato etno-culturale e le precedenti esperienze dolorose
individuali. Il DPO comporta, quindi, una serie di sgradevoli esperienze sensoriali, mentali ed emozionali associate con risposte autonomiche, comportamentali e psicologiche tali che impongono il suo trattamento, non solo per ragioni umanitarie ma anche per le numerose dimostrazioni dei suoi effetti avversi che conducono ad un significativo aumento sia della morbilità che della mortalità. La SIAARTI ( Società Italiana di Anestesia Analgesia Rianimazione e Terapia Intensiva) ha perciò elaborato delle raccomandazioni in materia, partendo dalla premessa che il controllo del dolore postoperatorio dovrebbe essere inserito in un piano di trattamento della “malattia postoperatoria”, che consideri il dolore come il “quinto parametro vitale” da monitorare al pari di frequenza cardiaca, pressione arteriosa, diuresi e temperatura corporea. Infatti lo scopo dell’analgesia postoperatoria, oltre a migliorare il confort dei pazienti operati, è quello di attutire le risposte riflesse autonomiche e somatiche dovute al dolore e migliorare il recupero delle funzioni, permettendo quindi al paziente di respirare, tossire e muoversi più facilmente riducendo così le complicanze respiratorie, cardiovascolari e tromboemboliche.
FISIOPATOLOGIA DEL DOLORE
La sensibilità al dolore è resa possibile da un complesso sistema anatomico costituito da recettori periferici o nocicettori deputati alla trasduzione degli stimoli dolorosi, da vie di trasmissione specifiche, da centri soprassiali preposti all’elaborazione degli input algici con partenza dalla periferia e da vie discendenti per la modulazione e il controllo dell’informazione dolorosa.
L’insulto tessutale provocato dall’atto chirurgico determina l’attivazione dei nocicettori presenti nella cute, nei muscoli e nei visceri per il rilascio dei mediatori dell’infiammazione e di sostanze algogene, sintetizzate o liberate a livello dell’area sede del danno tessutale, quali: potassio, acetilcolina, prostaglandine, leucotrieni, istamina, serotonina, 5-idrossitriptofano, sostanza P, neurochinina A, bradichinina, ecc.
I nocicettori sono terminazioni libere di fibre afferenti di tipo A-delta (recettori meccanotermici ad alta soglia) e C (recettori polimodali) che trasferiscono lo stimolo nocicettivo dalla periferia al SNC. Le fibre di tipo A-delta sono rivestite da una guaina mielinica, hanno diametro maggiore e trasferiscono rapidamente il segnale dolorifico che viene descritto come acuto, puntorio e localizzato, le fibre di tipo C, invece,
sono demielinizzate, hanno minor diametro e trasportano il segnale più lentamente e con le caratteristiche di un dolore sordo e mal definito. Entrambi i tipi di fibre costituiscono il 70-90% dei recettori periferici a livello dei tessuti ed hanno il corpo cellulare nei gangli annessi alle radici posteriori del midollo spinale. Queste cellule gangliari (neurone di primo ordine) inviano le proprie terminazioni assonali ai neuroni di secondo ordine, situati nelle corna posteriori. Dopo una soluzione di continuo dei tessuti vengono rilasciate le sostanze sopra descritte che, localmente, danno inizio ad alcune reazioni responsabili di modificazioni a carico della sensibilità dei recettori periferici. Dall’azione combinata di tutte queste sostanze ( diretta per la bradichinina e facilitante per i prodotti dell’acido arachidonico) si attua l’attivazione del recettore, che dà inizio al processo d’informazione nocicettiva con conseguente rilascio di mediatori a livello delle cellule del corno dorsale. Bradichinina e prostaglandine incrementano, inoltre, la permeabilità vascolare, la chemiotassi e la degranulazione mastocitaria, favorendo l’attivazione e la sensibilizzazione dei terminali afferenti primari. Tali sostanze abbassano la soglia di eccitazione dei recettori e aumentano la frequenza di scarica delle fibre afferenti periferiche. Si verificano, quindi, fenomeni di sensibilizzazione sia periferica sia centrale, che inducono iperalgesia,
ovvero un’alterazione della sensibilità a causa della quale l’intensità della sensazione dolorosa è enormemente accentuata.
Il primo filtro degli impulsi dolorifici è rappresentato dai neuroni delle lamine I, II, e V, presenti a livello del corno posteriore del midollo spinale, considerato un fondamentale centro di integrazione del dolore. A tale livello è infatti presente la sostanza gelatinosa del Rolando, alla quale sono attribuite numerose funzioni, la più importante delle quali è una funzione “cancello”, cioè una funzione di feed-back e controllo locale sull’ingresso delle sensazioni dolorifiche. Secondo la “gate control theory” (Melzack e Wall, 1965), la funzione inibitrice sulle afferenze è dovuta ad un interneurone situato nella sostanza gelatinosa del Rolando che riceve collaterali dalle fibre afferenti delle radici posteriori. L’interneurone è inibito dagli impulsi condotti dalle fibre di piccolo diametro, è invece eccitato dagli impulsi condotti dalle fibre di grosso diametro, perciò se prevalgono i primi si determina una minore azione inibitrice con passaggio degli impulsi algogeni, invece se prevalgono i secondi l’azione inibitrice è aumentata e si riduce la trasmissione degli impulsi afferenti ai centri superiori.
L’arrivo massivo di impulsi nocicettivi a livello del corno dorsale del midollo spinale determina la liberazione di neurotrasmettitori specifici,
come l’N-metil-D-Aspartato (NMDA), che attiva e sensibilizza i recettori spinali. Poiché alcuni di questi neuroni hanno connessione con il corno anteriore e la colonna intermedio-laterale del midollo, attivano i motoneuroni pregangliari del simpatico innescando sia risposte riflesse motorie con spasmo e contrattura muscolare, sia una risposta simpatica con vasodilatazione cutanea e vasocostrizione muscolare e viscerale. Quindi gli stimoli periferici vengono trasferiti tramite le fibre afferenti alle vie di conduzione ascendenti del dolore (tratto spinotalamico) per raggiungere i centri sovraspinali. Il sistema nocicettivo ascendente è rappresentato dal tratto spinotalamico che occupa la colonna anterolaterale del midollo spinale. La maggior parte delle fibre che sono situate in questo tratto non raggiungono il talamo, ma contraggono sinapsi con cellule situate a livelli più bassi nel midollo stesso o nel tronco cerebrale. Queste fibre, crociate e non crociate, terminano in alcuni sistemi di sostanza grigia che occupano il tronco cerebrale a livello romboencefalico, mesencefalico e anche diencefalico, a cui è stato dato il nome di “sostanza reticolare”. Il tratto spinotalamico viene perciò suddiviso nel fascio neo-spino-talamico (fibre A-delta) che dirige direttamente gli impulsi a livello talamo-corticale, e nel fascio paleo-spino-talamico (fibre C), che convoglia principalmente gli impulsi verso
la sostanza reticolare e verso le stazioni limbiche corticali e sottocorticali. Nella via ascendente possono così essere individuati due sistemi: uno, mono- o oligosinaptico, detto “sistema specifico” o “lemniscale” comprendente il fascio neo-spino-talamico, il quale media una precisa capacità di localizzazione dello stimolo (sensibilità dolorosa discriminata) con scarse reazioni affettive ed emotive; e l’altro, polisinaptico, chiamato “sistema specifico” o “extralemniscale”, comprendente il fascio paleo-spino-talamico, prevalentemente connesso con la componente affettiva ed emotiva del dolore.
Il talamo infine rappresenta la sede fondamentale della integrazione e della elaborazione delle sensazioni dolorose, infatti lesioni talamiche su base vascolare o compressiva possono provocare un dolore violento e mal localizzabile (Dolore Talamico). L’integrazione talamica dell’informazione dolorosa avviene sia nel gruppo mediale dei nuclei talamici (nuclei intralaminari, nucleo centro-mediano) sia nei nuclei specifici (ventrale postero-laterale, ventrale postero-mediale), sia nei nuclei dorsali. La coscienza delle sensazioni dolorose si ha quando gli imput nocicettivi raggiungono la corteccia della regione del giro post-centrale, la quale, mediante l’integrazione con il sistema libico, coinvolge il tono affettivo e attribuisce la localizzazione. È noto da tempo che
esistono meccanismi discendenti capaci di ridurre l’ingresso degli stimoli nocicettivi sulla via spinale, tramite un’azione, generalmente inibitrice, a livello spinale. Ciò ha condotto alla ricerca e alla identificazione del sistema di controllo endogeno del dolore; sistema che si proietta sulla radice spinale posteriore inibendo gli stimoli nocicettivi con un meccanismo a feed-back negativo. I bersagli dell’attività di questo sistema discendente sono due: i neuroni del corno posteriore e il tratto spinotalamico. Tale sistema risulta costituito da: Sostanza Grigia Periacqueduttale e Periventricolare, dal Locus Ceruleus, dalle A5 Cell Group e dal Nucleo del Rafe Magno, e viene attivato da stimoli elettrici, stress, oppioidi, ecc. Poiché le vie coinvolte nel controllo endogeno del dolore sono vie serotoninergiche ed adrenergiche, si spiega l’effetto analgesico e di potenziamento degli oppioidi, degli antidepressivi triciclici, di alcuni farmaci serotoninergici (attivi sui recettori HT2 e HT5) e dei bloccanti dei recettori alfa 2 adrenergici (clonidina), in quanto recettori per gli oppioidi endogeni (encefaline e beta-2-endorfine) e per le amine (noradrenalina e serotonina) sono variamente distribuiti nel SNC sia a livello spinale che sopraspinale. Il sistema dei polipeptidi oppioidi endogeni è fondamentale per l’attività dei circuiti discendenti di controllo del dolore. Essi agiscono attivando un recettore specifico che inibisce il
rilascio della sostanza P e degli altri neurotrasmettitori dai quali dipende il passaggio dell’impulso algogeno dal primo al secondo neurone.
A livello del midollo spinale, inoltre, avvengono fenomeni di neuroplasticità amplificati dai recettori spinali midollari che coinvolgono fibre sensitive adiacenti in un meccanismo di ridondanza definito “wind up”. Questo fenomeno dipende dalla frequenza e dalla durata degli stimoli provenienti dalle fibre C, non è prevenuto dall’anestesia generale ma è modificato dalla somministrazione di oppioidi. La stimolazione neuronale è responsabile della liberazione di neurotrasmettitori quali il Glutammato, la Tachinina NK1 e l’Aspartato che a loro volta sembrano essere rilasciati in seguito all’attività di canali Ca e K dipendenti. Si assiste, quindi, ad un reclutamento di neuroni adiacenti che amplificano e riverberano gli impulsi dolorifici. Sulla membrana presinaptica dei neuroni di primo ordine i neurotrasmettitori oppioidi e noradrenergici condividono lo stesso meccanismo d’azione: l’interazione agonista-recettore iperpolarizza le fibre afferenti impedendo la propagazione dello stimolo doloroso e il rilascio dei neurotrasmettitori eccitatori (glutammato, sostanza P e neurokinine). Inoltre sembra che gli oppioidi endogeni intervengano nella modulazione del dolore anche con meccanismi di inibizione post-sinaptica.
A livello clinico tutti questi meccanismi si traducono nei fenomeni di: iperalgesia primaria (esagerata risposta allo stimolo nocicettivo nella sede della lesione), iperalgesia secondaria (estensione della ipersensibilità al tessuto non offeso circostante la sede della lesione) e allodinia (riduzione nella intensità degli stimoli necessari a indurre dolore, per cui stimoli, normalmente non dolorosi, vengono percepiti come tali). Alla base della allodinia si ha il meccanismo della sensibilizzazione periferica che è un aumento della sensibilità di trasduzione dei nocicettori sensitivi periferici ad alta soglia; mentre i fenomeni della iperalgesia si spiegano con il meccanismo della sensibilizzazione centrale dove l’input afferente risulta amplificato dalla ipereccitabilità dei neuroni del corno dorsale. Gli stimoli nocicettivi vengono inviati, tramite il sistema nocicettivo ascendente, ai centri nervosi superiori talamici e sottotalamici per poi andare alla corteccia dove vengono decodificati ed integrati. Una parte, invece, rimane a livello del midollo spinale dove evoca risposte riflesse segmentali (spasmi muscolari), causando un ulteriore aumento del dolore nella zona lesa ed in quelle circostanti, un aumento del consumo di ossigeno, della produzione dei lattati ed attivando il sistema nervoso simpatico.
La risposta soprasegmentale si realizza a livello ipotalamico e consiste, da un punto di vista neuroendocrino, nella liberazione degli ormoni dello stress, cioè ACTH con conseguente aumento degli ormoni catabolizzanti (cortisolo, glucagone, aldosterone, GH e catecolamine), inibizione degli anabolizzanti (testosterone ed insulina) e liberazione di ADH a partire dalla neuroipofisi. Da tutto ciò deriva la “reazione metabolica allo stress chirurgico”.
La risposta corticale e l’integrazione affettiva del dolore causano, insieme alla pregressa esperienza personale e alle caratteristiche della personalità del soggetto, ansia e sofferenza che aumentano tutti i fenomeni sopra descritti, condizionando talvolta l’esito dell’intervento chirurgico [1;2].
CARATTERISTICHE DEL DOLORE POSTOPERATORIO
I fattori che influenzano l’incidenza, l’intensità, la qualità e la durata del dolore postoperatorio sono molteplici. I più rilevanti si possono suddividere in tre grandi “variabili”: il tipo di chirurgia, il paziente stesso e il trattamento anestesiologico-antalgico utilizzato.
- Sede e tipo di chirurgia. (Tabella 1) [1]
SEDE INTERVENTO INTENSITA' MODERATA INTENSITA' ELEVATA DURATA gg Torace 20-35% 45-65% 3-7 Alto Addome 20-30% 50-75% 3-7 Basso Addome 30-40% 35-45% 1-4 Art. Maggiori 30-40% 35-45% 1-6 Perineo 25-35% 50-60% 1-5 Collo e Testa 35-45% 5-15% 1-3
L’atto chirurgico produce nell’organismo un dolore nocicettivo e neuropatico.
La componente nocicettiva è legata a un insulto bifasico, dovuto durante l’intervento al trauma tessutale che genera una serie di impulsi nocicettivi
e determinato nelle ore successive dalla risposta infiammatoria al trauma, anch’essa responsabile della generazione di impulsi nocicettivi.
La componente neuropatica deriva dal danno delle fibre nervose che causa variazioni della modulazione dolorifica e della sensibilizzazione centrale. Questo crea amplificazione dei meccanismi del dolore, iperalgesia e allodinia.
In particolare il DPO in chirurgia addominale proviene da quattro siti: cute (nella sede d’incisione), muscoli, peritoneo parietale e strutture di supporto dei visceri interessati (dolore somatico profondo, ben localizzato, aggravato dai movimenti) , visceri (dolore sordo, diffuso, associato a ipertono simpatico, ipertensione, tachicardia, nausea, vomito, pallore, ansia) e colonna vertebrale ( in rapporto alla posizione obbligata sul letto operatorio).
- Tecnica chirurgica. Le tecniche chirurgiche possono incidere sulla intensità e durata del dolore; ad esempio, una resezione del colon per via laparoscopica richiede una terapia antalgica per 36-48 ore, mentre lo stesso intervento eseguito per via laparotomica necessita di terapia del dolore per almeno 48-60 ore.
- Profilo psicologico del paziente. Soggetti ansiosi e depressi necessitano di una maggiore somministrazione di farmaci analgesici e presentano livelli di dolore più alti rispetto ai pazienti più calmi e tranquilli. Questa variabilità interindividuale può essere spiegata da fenomeni farmacocinetici, farmacodinamici e biologici .
- Età. I bambini soffrono più degli adulti, infatti con il trascorrere degli anni i dosaggi di morfina, farmaci antiinfiammatori non steroidei ed anestetici locali si riducono per innalzamento della soglia del dolore. - Sesso. Il sesso femminile presenta una soglia del dolore più alta.
- Dolori cronici. Pazienti affetti da dolore cronico presentano un consumo maggiore di analgesici nel periodo postoperatorio [4].
- Trattamento anestesiologico prima, durante e dopo l’intervento. Importanza della “preemptive analgesia” nel ridurre l’intensità del dolore postoperatorio, e di conseguenza , la quantità di farmaci analgesici utilizzati per curarlo.
- Qualità del trattamento postoperatorio. Si intende il tipo di analgesico scelto e la modalità di somministrazione [3;4].
Un adeguato trattamento del DPO contribuisce significativamente alla riduzione della morbilità perioperatoria, valutata come incidenza di
complicanze postoperatorie (accidenti cardiovascolari, respiratori, trombosi venosa profonda ed embolia polmonare), di giornate di degenza e di costi, specialmente nei paziente ad alto rischio (ASA III-IV), sottoposti a interventi di chirurgia maggiore e seguiti in aria critica [1].
LA VALUTAZIONE DEL DPO
Il dolore postoperatorio è caratterizzato da forte intensità e relativa breve durata. Può essere valutato su scale dette unidimensionali che si basano su una delle sue caratteristiche (l’intensità); queste scale hanno inoltre il vantaggio di essere semplici e rapide nella loro utilizzazione. Esse possono essere classificate in settoriali, numeriche ed analogico-visive. Le scale settoriali attribuiscono un aggettivo all’intensità del dolore al quale può essere attribuita una percentuale. Sono di semplice utilizzo ma possono suggestionare il paziente ed essere influenzate dall’operatore che può orientare le risposte inconsapevolmente.
Le scale numeriche graduate da 0 a 100 assegnano una percentuale all’intensità del dolore. Esse sono facilmente comprensibili dalla grande maggioranza dei pazienti.
Le scale analogico-visive (VAS) sono le più usate. Esse consistono di un piccolo regolo sul quale è riportata sul lato anteriore una linea di 10 cm e su quello posteriore il dato numerico; il paziente dovrà indicare l’intensità del dolore accusato sul lato anteriore; il medico potrà quantificare tale intensità visualizzando il numero posteriormente.
EFFETTI AVVERSI CAUSATI DAL DOLORE
L’analgesia postoperatoria è importante, oltre che per l’aspetto prettamente etico, per gli effetti sistemici che il dolore comporta, infatti dopo la lesione tessutale si manifestano importanti alterazioni fisiopatologiche tipiche della “reazione da stress” dovute a risposte riflesse che lo stimolo doloroso scatena lungo la via sensitiva afferente. Il dolore postoperatorio è spesso responsabile, attraverso vari meccanismi, di alcune delle maggiori complicanze del periodo postoperatorio.
Apparato respiratorio:
I pazienti sottoposti ad intervento chirurgico, soprattutto a livello addominale e toracico, presentano una riduzione della capacità vitale (CV), del volume espiratorio forzato al primo secondo (FEV1) e della capacità funzione residua (CFR). Queste alterazioni sono responsabili di una sindrome restrittiva acuta a cui si possono associare ipercapnia ed ipossiemia anche significative. Il dolore può determinare una maggiore tendenza al respiro superficiale per riduzione della funzionalità del diaframma a causa di un aumentato tono dei muscoli addominali, ciò comporta un aumento della frequenza respiratoria e una riduzione del
volume corrente, inoltre diminuisce l’efficacia della tosse con conseguente accumulo delle secrezioni che possono favorire la comparsa di infezioni polmonari e atelettasie. Inoltre le modificazioni neuroendocrine che si accompagnano alla “reazione da stress” provocano un aumento dell’acqua extracellulare a livello polmonare con alterazione del rapporto ventilazione-perfusione. Nel periodo postoperatorio immediato la CV si riduce del 40-60% (alla 4^ ora), mentre la riduzione della CFR e della FEV1 sono massime alla 24^ ora per tornare ai valori pre-operatori dopo 7-14 giorni dall’intervento [1].
Apparato cardiovascolare:
Il coinvolgimento del sistema cardiovascolare nella reazione da stress può essere estremamente pericoloso. Il dolore determina un aumento del tono simpatico e della liberazione di catecolamine che comportano un aumento del cronotropismo cardiaco, della gittata, del lavoro cardiaco e delle resistenze vascolari periferiche;con un aumento del consumo di O2 miocardico. Si può avere un aumento dell’incidenza di ischemia miocardica postoperatoria, soprattutto in pazienti coronaropatici. Inoltre la concomitante ritenzione idrosalina promossa da aldosterone, ADH e
cortisolo può precipitare episodi di insufficienza cardiaca in pazienti con ridotta riserva [1].
Coagulazione e complicanze tromboemboliche:
Nel periodo postoperatorio i fattori di rischio per alterazioni della coagulazione sono numerosi: l’immobilità, la stasi venosa, l’iperaggregabilità piastrinica e lo stato di ipercoagulabilità (aumento dei livelli del plasminogeno e dell’AT III), indotta dai mediatori della flogosi. Il dolore può accentuare l’immobilità con un aumentato rischio di complicanze tromboemboliche a carico dei vasi venosi profondi. Vari studi dimostrano gli effetti favorevoli della anestesia e della analgesia periferica sulla reologia del sangue e sull’aumento del flusso ematico periferico con conseguente riduzione dell’incidenza di TVP [19;20].
Apparato gastro-intestinale e genito-urinario:
L’iperattività simpatica indotta dal dolore si accompagna a paralisi della muscolatura liscia causando una inibizione riflessa della funzione gastrointestinale, con comparsa di ileo paralitico che contribuisce alla presenza di nausea, vomito e ritardo nella ripresa dell’alimentazione per via entrale [21]. La ritenzione urinaria, dovuta al risentimento della
vescica e dell’uretra per gli effetti negativi del dolore, aumenta il rischio infettivo, con conseguente necessità di cateterizzazione vescicale del paziente nel postoperatorio [1;5;6].
Metabolismo e sistema neuroendocrino:
La nocicezione evoca una risposta riflessa soprasegmentale responsabile di profonde alterazioni neuroendocrine. Questa si caratterizza infatti per un aumento del tono simpatico, della stimolazione ipotalamica, della secrezione di catecolamine ( i livelli di adrenalina tornano normali dopo 6-12 ore dall’intervento, mentre quelli di noradrenalina rimangono elevati più a lungo) e soprattutto per un aumento degli ormoni catabolici (cortisolo, prolattina, ACTH, ADH, GH, AMPc, glucagone, aldosterone, renina ed angiotensina II ), mentre è diminuita la secrezione degli ormoni anabolici come il testosterone e l’insulina. Le conseguenze di queste alterazioni sono rappresentate da una aumentata ritenzione di Na e H2O, aumento della glicemia e degli acidi grassi liberi, aumento dei lattati e un bilancio azotato positivo. Si viene quindi a creare uno stato ipercatabolico con aumentato consumo di ossigeno, deplezione del patrimonio proteico tra cui le immunoglobuline e le proteine di trasposto
del Ferro, con conseguente riduzione delle difese immunitarie ed iposideremia.
Effetti psicologici:
Il dolore attiva dei circuiti corticali che determinano la percezione cosciente del dolore e che sono alla base di vari processi psicopatologici. Tutto questo comporta un aumento dell’ansia e la comparsa di sentimenti negativi come rabbia, depressione, insonnia, disagio e immobilità volontaria per paura di aggravare la sintomatologia algica [18].
PREEMPTIVE ANALGESIA
E’ una tecnica che ha lo scopo di prevenire la sensibilizzazione centrale all’incisione chirurgica e quella relativa all’infiammazione locale nel post-operatorio.
Lo stimolo nocicettivo può interessare tutto il periodo perioperatorio (pre-intra-postoperatorio). Un programma di prevenzione farmacologia deve essere esteso a tutte e tre le fasi.
Le conoscenze fisiopatologiche acquisite sulla genesi del dolore hanno contribuito all’introduzione in clinica del concetto di “preemptive analgesia”. A questa è riconosciuto un ruolo importante nel ridurre l’intensità del dolore postoperatorio e, di conseguenza, l’ulteriore fabbisogno di farmaci. Questo è possibile mediante l’applicazione precoce di un trattamento antalgico, cioè prima della comparsa della sintomatologia algica. Lo scopo è quello di prevenire o di ridurre lo sviluppo di qualsiasi “memorizzazione” dello stimolo doloroso nel sistema nervoso centrale tramite la somministrazione di agenti analgesici. Alla base di tutto questo stanno i meccanismi della sensibilizzazione e del wind-up spinale. Nonostante non sia ancora esattamente conosciuto il meccanismo con cui i tessuti danneggiati siano in grado di produrre
alterazioni prolungate a carico del midollo spinale, studi recenti indicano che i fenomeni di sensibilizzazione centrale e di wind-up dipendono dalla prolungata attivazione dei recettori NMDA e che gli antagonisti di tali recettori possono prevenire tale sensibilizzazione quando somministrati prima della lesione. Il legame del glutammato con i recettori NMDA ne determina l’attivazione e comporta l’apertura dei canali magnesio-dipendenti con aumento della permeabilità a tutti i cationi e in particolar modo al Na e al Ca. Il flusso del calcio in ingresso stimola il rilascio dello stesso ione dai depositi intracellulari iniziando una serie di reazioni intracellulari mediate dalle protein-kinasi C, dalla calcio-calmodulina e da una protein-kinasi A AMPc dipendente. La funzione di questi enzimi è quella di fosforilare alcune proteine di membrana e canali ionici delle cellule post-sinaptiche, aumentando ulteriormente la loro eccitabilità. Infine il secondo messaggero intracellulare attiva l’espressione di geni particolari che possono modificare ulteriormente i processi neurali. Tutto ciò determina un aumento dei fenomeni di iperalgesia primaria che persistono per alcuni giorni nell’area di incisione, così come i fenomeni di iperalgesia secondaria nei tessuti circostanti caratterizzati da una durata più breve. È da tutto ciò che deriva l’importanza di bloccare lo stimolo nocicettivo prima che provochi la sensibilizzazione centrale. Il fatto che
il vero significato clinico della preemptive analgesia sia controverso e che i risultati dei vari studi siano disparati deriva dalle diverse qualità della pratiche di gestione del dolore da parte degli operatori.
La preemptive analgesia si basa sull’importanza di prevenire l’insorgenza della “memoria del dolore” ma è altrettanto importante il fatto che, nel periodo postoperatorio, si possono instaurare fenomeni di ipersensibilità legati ad una continua stimolazione del midollo in seguito alla risposta infiammatoria da parte del tessuto leso e ciò può ridurre, fino ad annullare, gli effetti di una corretta analgesia pre-chirurgica. Queste considerazioni sono ben espresse nel lavoro di Woolf e Chang (Figura 1). Un altro concetto è quello dell’analgesia multimodale, indicando con questo termine un approccio basato sull’impiego combinato di più farmaci somministrati attraverso tecniche e in momenti perioperatori diversi. Questo tipo di analgesia, sfruttando l’effetto sinergico di più farmaci con meccanismo d’azione diverso, minimizza gli effetti collaterali tipici della terapia monofarmacologica e permette di intervenire a livelli diversi nella via del dolore, garantendo una migliore qualità dell’analgesia. Quindi per ottenere una efficace analgesia postoperatoria il trattamento analgesico pre-chirurgico deve essere seguito da una corretta terapia antalgica postoperatoria che permetta di evitare l’ipersensibilizzazione
derivante dalla lesione dei tessuti per l’insulto chirurgico [1;8;9;10;11;12;13;17].
Fig 1: A L’input nocicettivo avviene nel corso dell’intervento e durante la degenza postoperatoria; in entrambi i casi si sviluppa uno stato di ipersensibilità. B L’ALR previene il primo stadio della ipersensibilità ma non è in grado di prevenire l’ipersensibilità causata dalla fase infiammatoria postoperatoria, anche se si dimostra più efficace di un singolo trattamento analgesico postoperatorio. C. D la somministrazione di una adeguata analgesia intra e postoperatoria può essere considerata la forma migliore di trattamento antalgico per la prevenzione degli stati di ipersensiblità. S = surgery.
TERAPIA DEL DOLORE POSTOPERATORIO IN CHIRURGIA ADDOMINALE MAGGIORE
È possibile effettuare l’analgesia postoperatoria con molteplici metodi di trattamento, analgesici e modalità di somministrazione, da scegliere in base allo stato clinico e psicofisico del paziente, al tipo di dolore postoperatorio previsto in base all’intervento che viene effettuato ed agli eventuali effetti collaterali. I farmaci a disposizione per l’analgesia comprendono analgesici non oppioidi (FANS, farmaci antiinfiammatori non steoridei), oppioidi deboli (tramadolo) e forti (morfina, meperidina, fentanyl e derivati).
Analgesici non oppioidi
I principali rappresentanti di questa categoria di analgesici sono i FANS, farmaci antinfiammatori non steroidei, composti derivati dall’acido acetilsalicilico, capostipite di acidi organici con differenti selettività sulle ciclossigenasi. I cox-inibitori si dividono in inibitori non selettivi (della COX-1 e COX-2) e inibitori selettivi (della COX-2). Questi farmaci sono indicati per il trattamento del dolore acuto lieve e moderato, ma da soli non sono in grado di controllare il dolore nella chirurgia maggiore.
In tal caso possono essere utilizzati come adiuvanti riducendo così le dosi e, di conseguenza, gli effetti collaterali degli oppiacei migliorando la qualità dell’analgesia. In questa categoria rientrano molecole diverse dal punto di vista chimico ma caratterizzate dallo stesso meccanismo d’azione, infatti tali farmaci mediante l’inibizione dell’enzima cicloossigenasi (COX) modulano la sintesi delle prostaglandine che rappresentano le sostanze responsabili della riduzione della soglia di stimolazione dei nocicettori. I FANS modulano il dolore principalmente attraverso la riduzione della risposta infiammatoria periferica, nonostante sia possibile anche l’inibizione dei meccanismi centrali alla base della iperalgesia. Vari studi effettuati su cellule umane hanno permesso di scoprire la presenza di due isoenzimi della cicloossigenasi: COX-1 e COX-2, la cui differenza principale risiede nella diversa espressione e regolazione a livello tessutale. Infatti la COX-1 è un prodotto costitutivo delle cellule sane, presente nella quasi totalità dei tessuti ed ha la funzione di promuovere la sintesi di prostaglandine coinvolte nelle normali funzioni cellulari (produzione di muco gastrico, mantenimento del flusso ematico renale, aggregazione piastrinica). La COX-2 invece è la forma inducibile dell’enzima, è quasi assente in condizioni basali tranne che nel cervello e nella corticale del rene, per comparire in corso di
infiammazione o danno tessutale, infatti le prostaglandine sintetizzate da questo isoenzima sono direttamente coinvolte nella modulazione della risposta infiammatoria e nella trasmissione degli stimoli dolorosi. A differenza degli analgesici oppioidi, l’efficacia dei fans dipende dalla presenza di processi infiammatori periferici o centrali, sebbene sia stato documentato un effetto inibitorio anche sulla liberazione degli ormoni dello stress, sulle proteine di fase acuta e su altre risposte immunologiche. È stato comunque dimostrato che la maggiore efficacia di questi farmaci si ottiene somministrandoli prima della chirurgia così da ridurre la risposta nocicettiva al danno tessutale (preemptive), in quanto gli analgesici non-oppioidi prevengono la formazione di nuove prostaglandine ma non hanno effetto su quelle già liberate che continuano ad esercitare i loro effetti iperalgici, come la PGE2 le cui azioni possono durare per diverse ore. La diminuzione delle prostaglandine, condizione che è alla base dell’effetto terapeutico, è anche la causa dei principali effetti collaterali dei FANS, che sono: gastrolesività (sanguinamento e ulcerazioni), effetti renali (insufficienza renale), complicanze emorragiche per riduzione dell’aggregabilità piastrinica (reversibile dopo 24-48 h dalla sospensione della terapia con FANS ad eccezione dell’aspirina). Inoltre il paziente può presentare
reazioni allergiche (broncospasmo, rinite, edema della glottide) e disturbi del SNC (cefalea e convulsioni). La loro incidenza è comunque molto bassa e dipende dalle condizioni cliniche preesistenti del paziente. Alcuni di questi effetti possono essere prevenuti dall’uso di farmaci (es. H2 antagonisti) [1;2;7;9].
Analgesici oppioidi
Gli oppioidi sono sicuramente gli analgesici più potenti, tanto che sono considerati i farmaci di prima scelta per il controllo del dolore moderato-grave. Questi agiscono direttamente sui sistemi centrali coinvolti nella modulazione dello stimolo nocicettivo. La Morfina e gli analoghi sintetici interagiscono con recettori specifici di membrana (recettori degli oppioidi) variamente distribuiti a livello dell’encefalo e del midollo spinale. Le proprietà dei vari oppioidi dipendono dalla specificità e dalla affinità che hanno nei confronti dei vari tipi e sottotipi recettoriali, in quanto i recettori hanno una ben documentata diversità nel profilo farmacologico. Si possono distinguere due importanti effetti a carico degli oppioidi: un effetto “analgesico locale” evidente soprattutto nelle sedi colpite da processi infiammatori cronici, ed un effetto “analgesico sistemico” dovuto all’attivazione dei recettori a livello dei gangli sensitivi
delle radici dorsali. Gli effetti indesiderati degli oppioidi sono un’estensione della loro attività farmacologica, infatti nel paziente in trattamento possiamo trovare in misura diversa: sedazione, miosi, depressione respiratoria, costipazione, nausea e vomito, ritenzione urinaria, modificazioni del tono dell’umore, rigidità muscolare e prurito. Gli analgesici oppioidi, in base all’attività e all’affinità nei confronti dei recettori, vengono classificati in: agonisti, antagonisti, agonisti parziali e agonisti misti. I farmaci agonisti puri (Morfina, Meperidina, Fentanyl, Remifentanyl, ecc.) sono i più utilizzati in terapia antalgica. Tali oppioidi, nonostante la loro relativa selettività per i recettori mu, hanno una moderata attività anche sulle altre classi recettoriali, spiegando le loro proprietà analgesiche spinali e sopraspinali, ma anche le reazioni indesiderate correlate alla dose e il loro potenziale effetto additivo. Il Tramadolo è invece un analgesico centrale di sintesi con debole affinità per i recettori mu e la sua azione è quella di modificare la trasmissione degli impulsi nocicettivi tramite l’inibizione del re-uptake della serotonina e della noradrenalina. Vari studi hanno dimostrato che questi meccanismi agiscono in maniera sinergica per determinare l’analgesia con moderati effetti sulla funzione respiratoria [1; 2; 4; 6; 16].
ADIUVANTI
Corticosteroidi. Tali farmaci possono avere un ruolo nel controllo del dolore acuto e subacuto. Esplicano il loro massimo effetto nei casi in cui il dolore è associato all’edema o sono presenti fenomeni di compressione nervosa. Agiscono tramite un effetto antinfiammatorio e mediante la riduzione dell’eccitabilità neuronale con azione diretta di stabilizzazione sulla membrane cellulari.
Antidepressivi. Sono utili sia per la loro azione analgesica ma soprattutto per il trattamento dei sintomi psichici che accompagnano ogni forma di dolore [1].
Anticonvulsivanti. Il Gabapentin e il suo derivato Pregabalin prevengono la quota di dolore dovuta al trauma chirurgico sulle terminazioni nervose periferiche e la conseguente sensibilizzazione centrale [1].
Agonisti alfa 2 adrenergici. Stimolano recettori specifici pre e post-sinaptici delle corna posteriori normalmente attivati dalle vie bulbospinali noradrenergiche inibitrici della trasmissione nocicettiva. Tali farmaci inibiscono la liberazione di sostanza P e iperpolarizzano le membrane
postsinaptiche dei neuroni (Clonidina) con un’azione analgesica sia a livello spinale che sopraspinale [1].
Ketamina. È un agonista dei recettori NMDA, dotata di buon effetto analgesico evidente soprattutto a livello cutaneo e muscolo scheletrico, è infatti utilizzata nel trattamento del dolore neuropatico [1;11].
PREGABALIN
Negli ultimi anni la comprensione dei meccanismi fisiopatologici alla base della risposta dell’organismo al dolore ha fatto capire come una delle principali terapie antalgiche sia prevenire e/o attenuare la sensibilizzazione centrale, fenomeno che contribuisce in modo importante al dolore acuto postoperatorio [23].
Il Pregabalin, analogo del neurotrasmettitore inibitorio acido gamma-aminobutirrico, si lega alle sub-unità alfa-delta dei canali del calcio voltaggio dipendenti che sono ampiamente distribuiti nel midollo spinale e nell’encefalo. Così facendo modula il flusso del calcio, con conseguente riduzione della depolarizzazione e rilascio di neurotrasmettitori eccitatori, come il glutammato, la noradrenalina, la serotonina, la dopamina, la
sostanza P, da cui risulta una riduzione del fenomeno di sensibilizzazione centrale [24].
In generale la modulazione del rilascio di questi neurotrasmettitori contribuisce agli effetti analgesici, antiperalgesici, anticonvulsionanti e ansiolitici del farmaco [25;26].
Il pregabalin ha una farmacocinetica lineare, tale da rendere semplice il suo utilizzo clinico: l’assorbimento è rapido e direttamente proporzionale alla dose somministrata, il volume di distribuzione è elevato, non presentando legame con le proteine plasmatiche, il metabolismo epatico è assente e l’escrezione avviene per via renale. Presenta un’alta biodisponibilità per via orale (>90%). La concentrazione massima nel plasma è raggiunta in un’ora, lo steady state in 24-28 h e l’emivita di eliminazione in 6 h. [25].
Diversi studi hanno valutato l’utilizzo del pregabalin nel trattamento del dolore acuto postoperatorio [25]. Le differenti dosi utilizzate e i vari tipi di chirurgia hanno portato a risultati contrastanti.
Uno studio ha dimostrato che una singola dose preoperatoria di pregabalin (300 mg), negli interventi chirurgici di isterectomia, è efficace nel ridurre il dolore postoperatorio secondo la scala VNRS, e il consumo di morfina, senza significative differenze negli effetti collaterali [27].
Spreng e coll. hanno visto che in pazienti sottoposti a laminectomia lombare, una dose preoperatoria di pregabalin (150 mg) abbassa il dolore postoperatorio e il consumo di morfina durante il ricovero in terapia subintensiva [28]. In un altro studio clinico si è osservato che una dose singola preoperatoria di pregabalin (150 mg) è utile a ridurre il consumo di morfina dopo gastrectomia per via laparoscopica, garantendo un’effettiva analgesia con una bassa incidenza di effetti avversi, come il PONV [29].
Agarwal e coll. hanno dimostrato l’efficacia di una singola dose preoperatoria di pregabalin (150 mg) nell’attenuare la componente statica e dinamica del dolore acuto postoperatorio e il consumo di fentanyl in paziente sottoposti a colecistectomia per via laparoscopica [30]. L’approccio analgesico multimodale preoperatorio con pregabalin (150 mg) e celecoxib è responsabile del ridotto consumo intra-post-operatorio di oppioidi in paziente sottoposti a prostatectomia radicale per via laparoscopica [31].
Al contrario, White e coll. hanno evidenziato come chirurgia minore elettiva la somministrazione di pregabalin, in singola dose preoperatoria, non riduce il dolore postoperatorio [32]. Osserva inoltre una correlazione lineare tra l’incremento delle dosi del farmaco (75-150-300
mg) e quello dei suoi effetti collaterali (sedazione, vertigini, disturbi visici, nausea, vomito, edema periferico, aumento di peso)[25;32;33;34]. Un altro studio ha dimostrato che per interventi chirurgici di colecistectomia per via laparoscopica somministrare una bassa dose preoperatoria di Pregabalin (50-75 mg) non comporta minor consumo di analgesici nel postoperatorio, nè riduzione degli effetti collaterali legati agli oppioidi e dei tempi di ricovero [35].
In uno studio sperimentale, su un modello animale, è stato visto che il Pregabalin determina inibizione dose-correlata dell’allodinia indotta dalla somministrazione di TNBS (Trinitrobenzene Sulfonic Acid), ma non modifica la soglia del dolore in condizioni normali. Questo indica come effettivamente esista un’anormale ipersensibilità, e suggerisce un possibile utilizzo del farmaco nella Sindrome del Colon Irritabile [36]. L’ipotesi che la suddetta azione possa essere conseguenza del blocco farmaco-indotto sulla sensibilizzazione dei neuroni delle corna dorsali del midollo spinale è confermata da un altro studio sperimentale più recente [37].
MODALITA’ DI SOMMINISTRAZIONE DEGLI ANALGESICI
La somministrazione degli analgesici può essere continua o a boli:
- Somministrazione “al bisogno”. È una metodica che determina uno stato alternante di benessere e sofferenza in base alle caratteristiche farmacocinetiche e farmacodinamiche dell’analgesico utilizzato. Inoltre per ottenere la soppressione di un forte dolore in atto è necessaria la somministrazione di una dose maggiore di farmaco. Nonostante lo scopo di questo tipo di somministrazione sia quello di ridurre il consumo di farmaci spesso si ottiene non solo l’effetto contrario ma anche l’assenza di benessere per il paziente. È quindi indicata solo in caso di dolore moderato e in evoluzione migliorativa (Figura 2.1 A, B).
- Somministrazione “a tempo”. È il tipo di somministrazione preferibile se il fine è quello di ottenere effetti analgesici costanti ed è la metodica di scelta qualora il paziente presenti un dolore intenso (Figura 2.1 C).
- Somministrazione “in continuo”. Rappresenta una metodica vantaggiosa ed efficace nella cura del dolore acuto. È la modalità ideale in quanto permette di ottenere livelli ematici costanti di analgesico. Per l’attuazione di questa metodica sono necessari farmaci che non si
accumulano e le dosi devono essere personalizzate. Inoltre richiede un sistema di infusione preciso rappresentato da dispositivi monouso che permettono l’infusione continua di farmaci in soluzione a velocità costante preimpostata ( pompe meccaniche, pompe elastomeriche, pompe elettroniche). Per mezzo di questo sistema il fluido viene spinto lungo la linea d’infusione direttamente in vena, sottocute o nello spazio peridurale.
A) Iniezione di analgesico effettuata al limite della tollerabilità del dolore: la latenza dell’effetto analgesico fa sì che il dolore arrivi alla intollerabilità e che poi le sofferenze si protraggano a lungo. Le singole dosi di analgesico devono essere alte per poter sopprimere un dolore forte; B) Iniezione di analgesico effettuata subito dopo la percezione del dolore: il paziente avverte periodicamente dolore anche se questo non raggiunge l’intollerabilità. Le singole dosi di analgesico possono essere ridotte perché il dolore è moderato; C) Iniezione di analgesico effettuata ad intervalli regolari prima della comparsa del dolore. Le dosi di analgesico possono essere basse perché non esiste un dolore da abolire.
- Somministrazione controllata dal paziente (Patient Controlled Analgesia: PCA). È una tecnica per il trattamento del dolore postoperatorio che permette al paziente di autosomministrarsi dosi prestabilite di analgesico al bisogno. La PCA può essere programmata secondo due modalità : somministrazione a richiesta oppure infusione continua basale più la somministrazione a richiesta.
Per l’applicazione di questa metodica è necessario un apparecchio che eroghi le dosi supplementari, sottoforma di bolo, in modo esatto ed entro limiti posologici prefissati dal medico.
TECNICHE CHIRURGICHE PER LE MALATTIE INFIAMMATORIE CRONICHE INTESTINALI
Le malattie infiammatorie croniche dell’intestino possono richiedere interventi chirurgici atti a risolvere le complicanze (stenosi, ascessi, fistole). La consapevolezza che la chirurgia non guarisce dalla malattia, ha portato allo sviluppo di tecniche di “chirurgia conservativa”, il cui scopo consiste nella risoluzione della complicanza preservando il maggior quantitativo tessuto intestinale così da ridurre i rischi di malassorbimento intestinale e/o la sindrome da intestino corto (malassorbimento, ipoalbuminemia, dimagramento). Queste tecniche sono le resezioni di minima e le stricturoplastiche (SP).
La SP, indicata per il trattamento di stenosi con il massimo risparmio possibile di tessuto intestinale, consiste nell’eliminare il restringimento inserendo una plastica.
Le plastiche si differiscono a seconda del tipo di stenosi:
-se la stenosi è corta si pratica un'incisione longitudinale dell'ansa intestinale comprendente il cercine stenotico e quindi si esegue la sutura in senso trasversale (plastica secondo Heineke - Mikulizt) (vedi figura seguente) .
- se la stenosi è lunga, ma l'ansa ha conservato una certa elasticità, la si
incide per tutta la lunghezza della stenosi fino a raggiungere la zona normale e quindi si ripiega l'ansa su se stessa e si suturano i bordi aperti (plastica secondo Finney) (vedi figure seguenti).
Se invece è necessaria l’asportazione di un segmento intestinale (stenosi serrata senza lume residuo, fistola o ascesso), l’intervento consiste
nell’asportazione del solo tratto intestinale sede della complicanza (resezione intestinale limitata).
L’intervento chirurgico piu’ demolitivo è la Colectomia: - Proctocolectomia con ileostomia finale.
- Colectomia totale con pouch ileale e anastomosi anale, che
comporta la rimozione dell’intestino crasso, con continuità intestinale ripristinata mediante l'anastomosi fra l'ileo e il canale anale. Per
ricostituire la funzione di "serbatoio" fecale del retto, viene inoltre confezionato un nuovo "serbatoio" utilizzando l'ileo (pouch ileale). - Colectomia totale con anastomosi ileorettale, che consiste nella rimozione dell’intestino crasso con connessione diretta tra ileo e ano senza creazione di un “serbatoio” (pouch).
PARTE SECONDA
SCOPO DELLA TESI
Lo scopo dello studio è stato valutare l’efficacia di un approccio multimodale basato sulla somministrazione preoperatoria di Pregabalin sul controllo del DPO nei Pazienti sottoposti a chirurgia addominale maggiore per malattia infiammatoria cronica intestinale.
MATERIALI E METODI
Lo studio, di tipo prospettico-randomizzato, è stato condotto presso la Sezione di Anestesia e Rianimazione della Chirurgia dell’Apparato Digerente dell’ospedale Careggi di Firenze, nel periodo compreso tra Dicembre 2010 e Giugno 2011, ed ha incluso 30 Pazienti, di entrambi sessi, ASA II, sottoposti ad intervento elettivo di chirurgia addominale per malattia infiammatoria cronica intestinale.
Sono stati esclusi tutti i Pazienti in terapia cronica con oppiacei, sedativi, farmaci antiepilettici, o che erano a conoscenza di diatesi allergica per oppiacei e/o Pregabalin, avevano un’anamnesi positiva per abuso di
alcolici, presentavano diabete mellito o alterazione della funzionalità renale.
I Pazienti, durante una valutazione preoperatoria, sono stati assegnati casualmente a due gruppi per ricevere o Pregabalin (Lyrica; Pfizer) 150 mg un’ora prima dell’intervento chirurgico (Gruppo I) o placebo (Gruppo II). Ai Pazienti di entrambi i gruppi è stato somministrato il questionario STAI (State-Trait Anxiety Inventory) [38] per la valutazione del loro stato di ansia.
Il questionario STAI è uno strumento psicologico utilizzato per valutare il grado di ansia. Esso si compone di due sub test di 20 domande ciascuna con 4 possibilità di risposta (1= per nulla, 2= un po’; 3= abbastanza; 4= moltissimo). Il primo sub test è volto a valutare l’ansia come “stato” ovvero uno stato emotivo di fronte ad una determinata situazione; il secondo sub test riflette l’ansia come “tratto”, cioè la tendenza del soggetto a sviluppare ansia. Un valore di ansia medio viene definito da un cut-off di 40 in entrambi i sub tests.
Dopo una preanestesia con Midazolam (0.4 mg/kg), i pazienti sono stati sottoposti ad anestesia generale con Propofol (2 mg/kg), Fentanyl (2 µg/kg). L’intubazione orotracheale è stata agevolata con la
somministrazione di Cisatracurio (0.15 mg/kg) a cui è seguita una infusione continua di 0.06 mg/Kg/ora.
Per il mantenimento dell’anestesia è stato utilizzato Sevoflurano (MAC 0,2-2%) in ossigeno (40%) e aria (60%). L’analgesia intraoperatoria è stata effettuata con Remifentanyl in infusione (0.1-0.15 µg/kg/min). Prima del termine della somministrazione di Sevofluorano, è stato somministrato morfina per via endovenosa a dosaggio di 0.1 mg/Kg, Paracetamolo (1 gr) e Ketorolac Trometamina (30 mg).
L’infusione analgesica di Remifentanyl è stata sospesa al termine della sutura chirurgica.
Al termine dell’intervento, il blocco neuromuscolare è stato antagonizzato con Neostigmina (0.04 mg/Kg) ed Atropina (0.02 mg/Kg) ed è stata iniziata una terapia antalgica postoperatoria con l’applicazione di una pompa PCA (Patient Controlled Analgesia) della durata di 48 ore, preparata con una infusione continua di Morfina a dosaggio di 0.015 mg/Kg/ora plus Ondansetrone (8 mg) e con la possibilità di effettuare un bolo di 1 mg con lockout di 30 minuti (Morfina in PCA a “demand”). Il piano analgesico è stato completato con l’aggiunta di Paracetamolo (1 grammo) ogni 6 ore.
E’ stata effettuata profilassi per il PONV con Esomeprazolo (40 mg) trenta minuti prima dell’inizio dell’intervento chirurgico, e con Desametasone (8 mg) e Ondansetron (8 mg), trenta minuti prima della fine dell’intervento chirurgico.
Al termine dell’intervento i Pazienti sono stati monitorizzati in una recovery room per circa un’ ora e poi trasferiti in reparto chirurgico. I pazienti sono stati valutati durante la prima ora postintervento e nelle successive: 1 ora (T1), 4 ore (T2), 6 ore (T3), 12 ore (T4) e 24 ore (T5) postoperatorie per VAS a riposo ed al movimento ed incidenza di effetti collaterali, quali sedazione, nausea e vomito. La scala di Ramsay è stata utilizzata per valutare il grado di sedazione ( 1= paziente agitato; 2= orientato e tranquillo; 3= risposta a comando verbale; 4= risposta a lieve scuotimento; 5= risposta a stimolo doloroso; 6= assenza di risposta). I Pazienti con una scala di sedazione > di 4 sono stati considerati sedati [39]. Depressione respiratoria è stata definita come la presenza di una frequenza respiratoria ≤8 ed una SpO2 ≤90% in aria ambiente. E’ stata
inoltre valutata la comparsa di ipotensione (PA media≤80 mm Hg) e/o di altri effetti collaterali quali cefalea, prurito, confusione mentale, diarrea, costipazione, nausea, vomito ed edema agli arti inferiori.
RISULTATI
Sono stati analizzati i dati relativi a 30 Pazienti, di questi 15 di sesso maschile e 15 di sesso femminile, sottoposti ad interventi di chirurgia addominale maggiore per malattia infiammatoria cronica intestinale. Il Gruppo I (Pregabalin), di età media di 46,1 anni, comprendeva 16 Pazienti, di cui 9 di sesso maschile e 7 di sesso femminile. Il Gruppo II (Controllo), età media 39,7 anni, comprendeva 14 Pazienti di cui 6 di sesso maschile e 8 di sesso femminile.
La tipologia degli interventi per i due gruppi è riportata nella Tabella 1.
Tabella 1. Tipi di chirurgia
Gruppo I N° Pazienti Gruppo II N° Pazienti Resezioni Ileali 6 2 Resezioni ileo-coliche 3 5 Colectomie 8 0 Stricturoplastiche 1 5
Non si sono riscontrate differenze statisticamente significative tra i due gruppi per quanto riguarda altri effetti collaterali (sedazione, confusione mentale, ipotensione, depressione respiratoria).
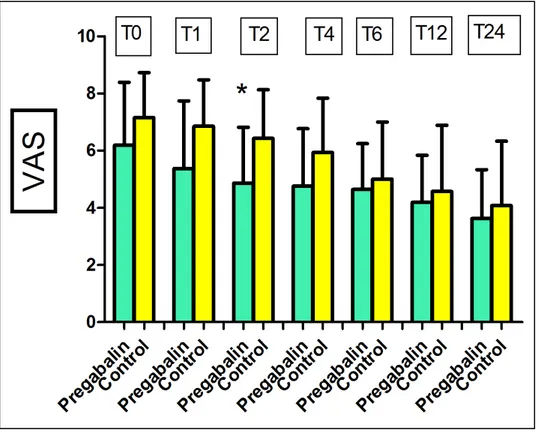
I due Gruppi di Pazienti hanno manifestato valori di VAS differenti negli intervalli di tempo da T0 a T4, più bassi nel Gruppo I con valori statisticamente significativi a T2. I livelli di analgesia sono stati sovrapponibili da T6 a T12 (Figura 1).
Figura 1. Valori di VAS
*(p < 0.05)
Le dosi aggiuntive di farmaci analgesici (Morfina in PCA a “demand”) somministrate ai Pazienti nel periodo postoperatorio, sono stati statisticamente differenti tra i due Gruppi e, in particolare, inferiori nel Gruppo I (Tabella 2).
Tabella 2. Morfina in PCA a “demand”
Gruppo I Gruppo II Sig. Dosi Totali (mg) 0.25±0.4 1.6±1.3 0.001
Per quanto riguarda gli effetti collaterali l’incidenza complessiva di PONV nel Gruppo I e nel Gruppo II è stata bassa ma, comunque, vi è stata una differenza statisticamente significativa tra i due gruppi al T2,T3,T4,T6 e T24 (Tabella 3).
Tabella 3. Incidenza di PONV
PONV Gruppo I Gruppo II Sig. T0 0.20±0.41 0.64±0.84 0.08 T1 0.13±0.35 0.38±0.65 0.20 T2 0.07±0.25 0.5±0.76 0.04 T4 0.07±0.25 0.6±0.85 0.03 T6 0.07±0.25 0.4±0.51 0.02 T12 0.07±0.25 0.29±0.61 0.21 T24 ±0.00 0.38±0.65 0.03
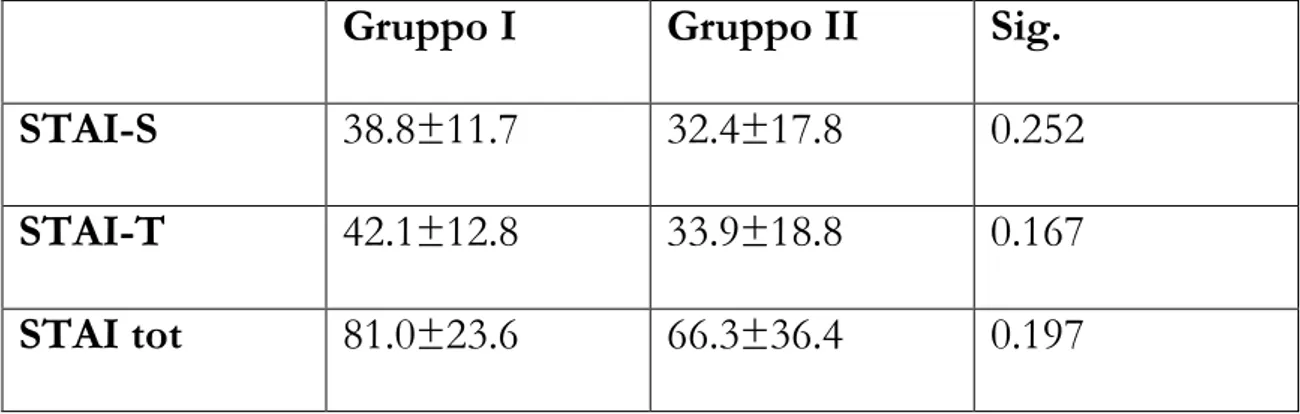
La maggior parte dei Pazienti di entrambi i Gruppi è risultata soffrire di una componente di ansia avendo un punteggio STAI totale maggiore di 40 (Tabella 4).
Tabella 4. Questionario STAI
Gruppo I Gruppo II Sig. STAI-S 38.8±11.7 32.4±17.8 0.252 STAI-T 42.1±12.8 33.9±18.8 0.167 STAI tot 81.0±23.6 66.3±36.4 0.197
Lo stato dell’ansia è risultato essere significativamente correlato con le richieste di farmaci aggiuntivi nel periodo postoperatorio (Tabella 5).
Tabella 5. Correlazione tra lo stato psicologico preoperatorio valutato con il questionario STAI e le richieste di farmaci analgesici aggiuntivi
Rescue doses (r) Rescue doses (Sig.)
STAI-S 0.917 0.028
STAI-T 0.902 0.036
DISCUSSIONE
Il principale risultato del presente studio è stato che, nei pazienti sottoposti a chirurgia addominale maggiore per malattie infiammatorie croniche intestinali, un approccio multimodale, basato sulla somministrazione preoperatoria di Pregabalin, ha permesso di ridurre il dolore postoperatorio e la richiesta di analgesici oppiacei nelle prime 12 ore. Tali effetti positivi del Pregabalin non sono stati accompagnati da effetti collaterali.
La prevenzione del dolore postoperatorio è basata sul blocco degli stimoli dolorosi generati in tutto il periodo perioperatorio, impedendo così l’instaurarsi di fenomeni di sensibilizzazione centrale all’incisione chirurgica ed ai fenomeni d’infiammazione locale postoperatoria (“preemptive analgesia”). Poiché il dolore acuto postoperatorio ha origine sia centrale che periferica è necessario eseguire una analgesia che antagonizzi la componente nocicettiva, mediante la somministrazione di oppioidi e di antinfiammatori (FANS)[20;21;25], e quella neuropatica, caratterizzata dai meccanismi di allodinia e iperalgesia, con farmaci che agiscano verso detti fenomeni. Quindi il DPO può consistere di una componente infiammatoria, neurogena e viscerale.
Diversi studi hanno suggerito che una “medicazione protettiva” con Pregabalin prima di un’insulto infiammatorio o di uno stimolo chirurgico, può ridurre il grado di sensibilizzazione centrale con effetto analgesico [40;41].
La malattia infiammatoria intestinale è una delle più frequenti sindromi in gastroenterologia [42]. Un’alterata motilità, fattori psicosociali ed una
ipersensibilità viscerale con allodinia ed iperalgesia sono i maggiori meccanismi che interagiscono nella patologia. In un recente studio sperimentale, Diop e coll. hanno dimostrato la potente attività del Pregabalin di bloccare l’allodinia cronica del colon [36].
Nessuno studio finora ha dimostrato come il Pregabalin possa agire riducendo il dolore acuto viscerale legato all’intervento chirurgico in Pazienti con elevato grado di dolore cronico. Nel nostro studio il VAS è stato minore nel gruppo Pregabalin rispetto al gruppo di controllo, con differenza statisticamente significativa nelle prime 4 ore postoperatorie e riduzione della discrepanza nelle ore successive. Ciò può essere spiegato dal fatto che il Pregabalin ha un’emivita di 12 ore. La somministrazione di Pregabalin ha inoltre permesso una riduzione della dose di oppiacei aggiuntiva e degli effetti collaterali quali PONV.
Limiti del nostro studio sono stati: - la valutazione del dolore postoperatorio solo nelle prime 12 ore; - un’unica somministrazione preoperatoria di Pregabalin. Ciò è stato condizionato dal fatto che successive somministrazioni per via orale in pazienti sottoposti a chirurgia addominale avrebbero potuto non essere efficaci per mancato assorbimento e quindi alterata farmacocinetica.
Punti positivi del nostro studio sono stati: - la numerosità del campione considerato per la patologia; - la valutazione del grado di ansia preoperatorio che ha permesso di dimostrare come la maggior parte dei Pazienti con malattie infiammatorie intestinali soffre di tale patologia psichiatrica e come il grado di ansia sia significativamente correlato al consumo di analgesici supplementari.
White e coll. hanno dimostrato che la somministrazione preoperatoria di Pregabalin a dosi di 75-300 mg aumenta il grado di sedazione e non riduce il grado di ansia e di dolore postoperatorio [32]. Questo studio ha considerato solo interventi di breve durata (degenza media ospedaliera < 24 ore) ed il dosaggio del Pregabalin somministrato è stato maggiore di quello utilizzato nel nostro studio. Probabilmente il grado di sedazione potrebbe essere legato sia alla brevità dell’intervento chirurgico che all’elevato dosaggio di farmaco.
Attualmente, con i nostri risultati preliminari, non possiamo dimostrare se la singola somministrazione di Pregabalin (150 mg) sia in grado di ridurre la componente ansiosa con miglioramento della sintomatologia dolorosa per l’innalzarsi della soglia del dolore. Studi futuri potranno cercare di capire se il Pregabalin somministrato preoperatoriamente possa agire sul miglioramento della qualità di vita dei pazienti con malattie infiammatorie croniche intestinali sottoposti ad intervento chirurgico, incidendo sia sulla componente ansiosa che sulla componente algogena.
BIBLIOGRAFIA
[1] Savoia C, Alampi D, Mattia C et al. SIAARTI recommendations for the treatment of postoperative pain. 2010
[2] Novelli GP, Casali R, Mediati RD. Terapia del Dolore. S.E.E.-Firenze, 1999
[3] Berti M. Dolore Post-operatorio: La teoria e la pratica. CE.DI.S Edizioni, 2001
[4] Bonica’s – Trattamento del dolore. Terza edizione. Delfino Editore, 2001
[5] Barash PG, Cullen BF, Stoelting RK. Clinical Anesthesia. Five Edition. Lippincott Williams & Wilkins, 2006
[6] Nolli M, Nicosia F. La gestione del dolore postoperatorio. Minerva Anestesiologica 2000; 66:585-601
[7] Brasseur L, Chauvin M. Dolori: Fondamenti di base- Farmacologia- Dolori acuti e cronici- Terapie. UPSA, 2001
[8] Berry A. Preemptive analgesia for postoperative pain. Paediatric Anesthesia 1998; 8: 187-188
[9] Mezei I, Hahn O, Penzes I, Preemptive analgesia- Preoperative diclofenac sodium for postoperative analgesia in general surgery. Maqy Seb 2002; 55 (5): 313-17
[10] Hepner DL. Preemptive analgesia what does it really mean? Anesthesiology 2000; 93: 1368
[11] McCulloch TJ. Preemptive analgesia by intravenous low-dose Ketamine and epidural Morphine. Anesthesiology 2001; 95 (2):565-67
[12] Daley MD, Norman PH. Improved, but not preemptive, analgesia. Anesthesiology 2001; 95 (2):565-67
[13] Sarantopoulos CD, Fassoulaki A. When is preemptive analgesia truly preemptive?. Anesthesiology 2001; 95 (2):565-566
[14] Block BM, Liu SS, Rowlingson AJ, et al. Efficacy of postoperative epidural analgesia: A meta-analysis. JAMA 2003;290:2455-63
[15] Dirks J, Moiniche S, Hilsted KL, Dahl JB. Mechanisms of postoperative pain: Clinical indications for a contribution of central neuronal sensitization. Anesthesiology 2002;97:1591-6
[16] Fishman S, Borsook D. Opioids in pain management. In: Benzon H, Raja S, Molloy RE, Strichartz G, editors. Essentials of pain medicine and regional anesthesia. New York: Churchill Livingstone; 1999; 51-4
[17] Moiniche S, Kehlet H, Dahl JB. A qualitative and quantitative systematic review of preemptive analgesia for postoperative pain relief. The role of timing of analgesia. Anesth. 2002; 96 (3):725-41
[18] Kulik JA, Mahler HI. Social support and recovery from surgery. Health Psychol. 1989; 8 (2):221-238
[19] Sharrock N, Ranawat CS, Urquhart B, Peterson M. Factors influencing deep vein thrombosis following total hip arthropaty under epidural anesthesia. Anesth. Analg. 1993; 76 (4):756-71
[20] Turnan KJ, McCarthy RJ, March RJ, DeLaria GA, Patel
RV, Ivankovich AD. Effects of epidural anesthesia and analgesia on
coagulation and outcome after major vascular surgery. Anesth. Analg. 1991; 73 (6):696-704
[21] Steinbrook RA. Epidural analgesia and gastrointestinal motility. Anesth. Analg. 1998; 86 (4):837-44
[22] Dougherthy PM, Staats PS. Intrathecal drug therapy for chronic pain: from basic science to clinical practice. Anesthesiology 1999; 91:1891-918
[23] Woolf C. Central sensitization. Anesthesiology. 2007; 106: 864-7 [24] Gajraj NM. Pregabalin: its pharmacology and use in pain management. Anesth Analg 2007; 105: 1805-15
[25] Zhang J, Ho KY, Wang Y. Efficacy of pregabalin in acute
postoperative pain: a meta-analysis. Br J Anaesth 2011; 106 (4): 454-62 [26] Nutt D, Mandel F, Baldinetti F. Early onset anxiolytic efficacy after a single dose of pregabalin: double-blind, placebo- and active-comparator controlled evaluation using a dental anxiety model. J Psychopharmacol 2009; 23: 867-73
[27] Ittichaikulthol W, Virankabutra T, Kunopart M et al. Effect of pregabalin on post operative morphine consumption and pain after abdominal hysterectomy with/ without salphingo-oophorectomy: a randomized, double-blind trial. J Med Assoc Thai 2009 Oct; 92 (10): 1318-23
[28] Spreng UJ, Dahl V, Raeder J. Effect of a single dose of pregabalin on postoperative pain and pre-operative anxiety in patients undergoing discectomy Acta Anaesthesiol Scand 2011; 55: 571-576
[29] Cabrera Schulmeyer MC, de la Maza J, Ovalle C et al. Analgesic effects of a single preoperative dose of pregabalin after laparoscopic sleeve gastrectomy. Obes Surg 2010 Dec; 20 (12): 1678-81
[30] Agarwal A, Gautam S, Singh U. Evaluation of a single preoperative dose of pregabalin for attenuation of postoperative pain after laparoscopic cholecystectomy. Br J Anaesth 2008; 101 (5): 700-4
[31] Trabulsi EJ, Patel J, Lallas CD et al. Preempive multimodal pain regim reduces opioid analgesia for patients undergoing robotic-assisted laparoscopic radical prostatectomy. Urology 2010; 76 (5): 1122-4
[32] White PF, TufanogullariB, Taylor G et al. The effect of pregabalin on preoperative anxiety and sedation levels: a dose-ranging study. Ambulatory Anesthesiology April 2009; vol.108, N.4: 1140-1145
[33] Mathiesen O, Jacobsen LS, Holm HE et al. Pregabalin and dexamethasone for postoperative pain control: a randomized controlled study in hip arthroplasty. Br J Anaesth 2008; 101: 535-41
[34] Blum A, Simsolo C, Tatour I Isr. Hyponatremia and confusion caused by pregabalin. Med Assoc J. 2009 Nov;11 (11): 699-700
[35] Peng PW, Li C, Chung F et al. Use of low-dose pregabalin in patients undergoing laparoscopic cholecystectomy. Br J Anaesth 2010 Aug; 105 (2): 155-61
[36] Diop L, Raymond F, Doherty AM et al. Pregabalin (CI-1008) Inhibits the Trinitrobenzene Sulfonic Acid-Induced Chronic Colonic