2
Materiali e Metodi
2.1 Materiali
Tutte le soluzioni usate in questo lavoro di tesi sono state preparate con acqua doppiamente deionizzata, proveniente da un sistema di purificazione Millipore S.A.670120 Mosheim. La stessa è stata usata anche come mezzo di reazione.
Le soluzioni stock di cloruro di sodio, di cacodilato di sodio (NaCac=(CH3)2AsOONa) e di cloruro di magnesio sono state preparate per pesata a partire dal prodotto commerciale di grado analitico. Le soluzioni di EtOH sono state preparate a partire da etanolo assoluto con grado di purezza > 99.8%.
2.1.1 Il Polinucleotide
È stato utilizzato il polinucleotide sintetico Poly[dG-m5dC]· Poly[dG-m5dC], prodotto commerciale della Pharmacia (Pharmacia Biotech, Uppsala, Sweden). Il polinucleotide liofilizzato sotto forma di sale sodico è stato disciolto direttamente in acqua bidistillata. Sono stati utilizzati due tipi di polinucleotide con catene di lunghezze diverse, precisamente 2908bp e 11886bp. La concentrazione delle soluzioni ottenute in seguito alla dissoluzione del sale è stata determinata spettrofotometricamente usando un coefficiente di estinzione molare diverso per i due polinucleotidi di diversa lunghezza, calcolato sulla base del certificato di analisi fornito dalla ditta produttrice (Appendice IV). Le concentrazioni sono espresse in coppie di basi per litro (bp).
2.1.2 Il TO
Il colorante cianinico TO è stato fornito come sale solido di CH3C6H4SO3- dal Prof. S. Yarmoluk dell’Istituto di Biologia Molecolare e Genetica dell’Accademia Nazionale delle Scienze di Kiev (Ukraina) ed è stato conservato a 4°C fino al momento dell’impiego.
Le soluzioni stock di tale colorante sono state preparate sciogliendo piccole quantità di solido (<1mg) in dimetilsolfossido (DMSO) al fine di ovviare ai problemi dovuti all’instabilità del colorante in acqua su lungo periodo. Queste soluzioni sono state conservate in frigorifero alla temperatura di 4°C ed al buio al fine di evitare eventuali effetti fotolitici. Le soluzioni di lavoro in ambiente acquoso sono state preparate immediatamente prima del loro utilizzo, avendo l’accortezza di utilizzare diluizioni tali che la quantità di DMSO presente fosse tale da poter essere considerata trascurabile (<1%).
Il titolo delle soluzioni diluite di cianina è stato determinato spettrofotometricamente utilizzando per il TO ε = 3.56×104M-1cm-1 a λ = 505nm (Yarmoluk et al. 2001).
2.2 Metodi
2.2.1 Misure di pH
Le misure di pH sono state eseguite con un pH-metro Metrohm Titrino con risoluzione fino al centesimo di unità di pH, corredato di un elettrodo a vetro combinato e ponte salino costituito da NaCl 3M. Il pH delle soluzioni, contenenti il tampone cacodilato di sodio, è stato aggiustato mediante piccole aggiunte di acido (HCl) o di base (NaOH) 1M al fine di raggiungere il valore desiderato (pH=7.0).
2.2.2 Le misure spettrofotometriche
Per le misure spettrofotometriche sono stati utilizzati due spettrofotometri.
Il primo, uno spettrofotometro a doppio raggio UV-VIS Perkin-Elmer Lambda 17, dotato di lettura digitale fino al millesimo di unità di assorbanza (Fig 2.1). Come
sorgenti di radiazione continua possono essere utilizzate sia una normale lampada al tungsteno per la regione del visibile che una lampada allo Xenon (Hamamatsu) per la regione dell’ultravioletto. La luce passa attraverso un monocromatore a reticolo e la radiazione monocromatica uscente viene inviata ad un beam-splitter e poi modulata da un chopper rotante. Il rivelatore è collegato con un sistema computerizzato di registrazione dei dati. Le misure di assorbanza sono state registrate come differenza tra l’assorbimento della cella contenente il campione e quello della cella contenente il riferimento. La cella di riferimento contiene il solvente usato per la preparazione delle soluzioni. Le soluzioni sono contenute in celle di quarzo, con cammino ottico di 1 cm, munite di tappo a tenuta e termostatate alla temperatura di lavoro.
Fig 2.1 Schema a blocchi di uno spettrofotometro a doppio raggio
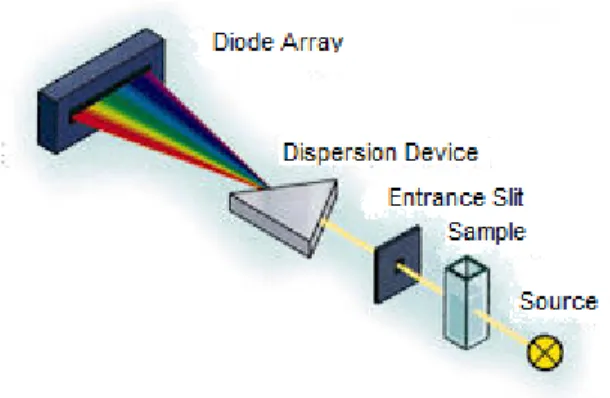
Il secondo spettrofotometro utilizzato è stato uno spettrofotometro hp 8452A a singolo raggio con range di lunghezze d’onda tra 190 e 1100nm, slit da 1-nm, rivelazione a diodo array, lampade a Deuterio e Tungsteno. Questo strumento è assai più semplice rispetto ad uno spettrofotometro a doppio raggio non essendo dotato di monocromatori (Fig2.2).
Fig 2.2 Schema dello spettrofotometro a diodo array utilizzato
I diodi array sono insiemi di fotodiodi singoli in un array lineare. In questo strumento l’array ha 1024 elementi. La luce dispersa da un prisma in tutte le lunghezze d’onda arriva al diodo array ed è misurata simultaneamente, ovvero l’acquisizione dei dati avviene in parallelo per tutti i fotodiodi. L’elevata velocità di acquisizione dei dati di questo tipo di strumento è uno dei fattori che maggiormente lo discostano dalla strumentazione classica a doppio raggio. Si effettuano con questa tecnica misure a diverse lunghezze d’onda simultaneamente.
Anche in questo caso le soluzioni sono contenute in celle di quarzo, con cammino ottico di 1 cm, munite di tappo a tenuta e termostatate alla temperatura di lavoro. Per le misure di assorbanza sono state utilizzate celle Hellma in quarzo ad elevata purezza con cammino ottico di 1cm aventi volumi totali di 3500μl (celle macro), 1400 μl (celle semi micro) e 100 μl (celle ultra micro).
2.2.3 Misure spettrofluorimetriche
La fluorimetria è una tecnica molto utile per studiare l’interazione di piccole molecole con gli acidi nucleici e per monitorare gli eventuali cambiamenti conformazionali che ne conseguono. L’emissione di fluorescenza risulta infatti molto più sensibile all’intorno molecolare della specie fluorescente di quanto non lo sia l’assorbimento della luce.
La fluorescenza, assieme alla fosforescenza, fa parte del fenomeno più generale della luminescenza secondo il quale alcune sostanze, una volta investite da radiazioni di
lunghezza d’onda opportuna, emettono energia sotto forma di radiazione luminosa. Per comprendere meglio questo fenomeno si può far riferimento al diagramma di Jablonsky, riportato in Fig 2.3.
Una molecola fluorescente che inizialmente si trova nello stato fondamentale S0 colpita da una radiazione di opportuna lunghezza d’onda, assorbe un certo numero di fotoni che promuoveranno la transizione degli elettroni da S0 ad uno stato eccitato di singoletto S1.
Fig 2.3 Diagramma di Jablonsky
Gli elettroni raggiungono lo stato elettronico eccitato (assorbimento) in tempi brevi (10-15 sec) e si distribuiscono tra i vari livelli eccitati. L’energia in tal modo accumulata potrà essere dispersa in diversi modi:
‐ rilassamento vibrazionale; questo fenomeno avviene in ogni caso, la specie riemette energia e si posiziona sul livello vibrazionale più basso dello stato elettronico eccitato;
‐ conversione interna; la molecola ritorna al livello elettronico fondementale attraverso un processo non radiativo a causa della parziale sovrapposizione delle funzioni d’onda dei livelli elettronici interessati;
‐ fluorescenza; la molecola ritorna verso i diversi livelli vibrazionali dello stato elettronico fondamentale emettendo energia radiante; il processo avviene in tempi che generalmente vanno da 10-9 a 10-7 sec, la sensibilità della fluorescenza è una conseguenza del tempo relativamente lungo in cui la molecola permane nello stato eccitato prima di ritornare allo stato fondamentale;
‐ fosforescenza; attraverso un processo denominato conversione intersistema, l’elettrone eccitato inverte il suo spin in modo che il sistema passi allo stato di tripletto, dallo stato di tripletto, quindi, l’elettrone raggiunge il livello vibrazionale più basso dello stato eccitato e da qui ritorna ai livelli vibrazionali dello stato fondamentale tramite l’emissione di energia radiante. E’ opportuno puntualizzare che, come diventa chiaro osservando il diagramma di Jablonsky, la luce di fluorescenza possiede una lunghezza d’onda superiore a quella della radiazione eccitante.
La sensibilità più elevata dei metodi fluorimetrici rispetto a quelli spettrofotometrici è dovuta al fatto che l’intensità di fluorescenza può notevolmente aumentare aumentando la potenza della sorgente.
L’intensità di fluorescenza dipende dall’intensità della radiazione eccitante, dalla quantità di molecole fluorescenti e dalla resa quantica di fluorescenza, che è quindi una proprietà caratteristica della sostanza e pertanto può essere considerata l’analogo del coefficiente di estinzione molare. La legge che lega l’intensità di fluorescenza alla concentrazione è riportata in Appendice I ed assume una forma molto simile alla legge di Lambert-Beer per basse concentrazioni di fluoroforo.
F = ϕc (2.1)
dove ϕ è una costante di proporzionalità e c è la concentrazione della specie fluorescente.
La spettrofotometria di fluorescenza permette di utilizzare con concentrazioni dell’ordine di 10-7-10-8M, mentre con la spettrofotometria di assorbimento difficilmente si scende al di sotto di concentrazioni dell’ordine di 10-6M. Per
l’assorbimento l’aumento di segnale può essere ottenuto aumentando l’intensità della sorgente I0, ciò produce un proporzionale aumento dell’intensità emergente I e quindi non aumenta l’entità del segnale come rapporto I/I0.
I metodi fluorimetrici trovano applicabilità in molti campi, in particolare nelle analisi di prodotti alimentari, farmaceutici, di campioni clinici e di prodotti naturali e hanno subito, specie negli ultimi anni, notevoli sviluppi fino ad arrivare alla tecnica di spettroscopia di correlazione (FCS) (Eigen e Riegler, 1994), che permette l’identificazione di una singola molecola fluorescente.
Le misure spettrofluorimetriche sono state condotte mediante uno spettrofluorimetro Shimadzu RF‐5301, dotato di lampada allo Xenon e lettura digitale fino al millesimo d’intensità di fluorescenza. Lo strumento possiede due monocromatori. Il primo, posto tra la lampada e la cella di misura, serve a selezionare la lunghezza d’onda d’eccitazione, mentre il secondo, posto tra la cella e il rivelatore di fluorescenza, serve a selezionare quella di emissione. Il secondo monocromatore è posto a 90° rispetto alla direzione del fascio di luce incidente in modo tale da minimizzare la quantità di fotoni provenienti dalla sorgente che possono raggiungere il detector. In Fig 2.4 è riportato uno schema generale di spettrofluorimetro. Fig 2.4 Schema di uno spettrofluorimetro: 1) lampada; 2) moncromatore di eccitazione ; 3) monocromatore di emissione; 4) reticolo; 5) divisore del fascio; 6) tubo fotomoltiplicatore di riferimento; 7) tubo fotomoltiplicatore del campione; 8) riflettore totale; 9) cella di compensazione dell’assorbanza; 10) compartimento del campione .
2.2.4 Il Dicroismo Circolare
Le tecniche di dicroismo circolare e lineare forniscono informazioni circa l’orientazione del colorante relativamente ala doppia elica del DNA. Queste tecniche dunque permettono di differenziare le diverse modalità di binding del colorante all’elica.
Il dicroismo circolare è una tecnica spettroscopica basata sul fatto che alcune molecole interagiscono in maniera diversa con la luce diversamente polarizzata. Affinché vi sia discriminazione fra i due tipi di luce polarizzata (destrogira e levogira) la molecola deve essere chirale, ciò si verifica per la maggior parte delle molecole di interesse biologico.
La tecnica presenta ottime capacità di distinguere tra enantiomeri di uno stesso composto. Per le molecole di DNA la tecnica fornisce spettri diversi per le conformazioni A, B e Z. Anche molti leganti presentano centri chirali e pertanto, interagendo con la luce polarizzata, danno origine a spettri CD propri. I leganti achirali non presentano uno spettro CD proprio in seguito all’interazione con gli acidi nucleici e la struttura ad elica acquisiscono un dicroismo circolare “indotto” caratteristico dell’interazione con il DNA. I cambiamenti nello spettro di dicroismo circolare di un polinucleotide in seguito all’interazione con un colorante possono essere utilizzati per determinare le costanti di equilibrio della reazione, inoltre forniscono indicazioni qualitative circa la natura dell’interazione.
Gli spettri di dicroismo circolare sono stati registrati su uno spettrometro MOS-450 BioLogic (Claix, France). Per le misure sono state utilizzate celle con un cammino ottico di 1.0 cm nel campo di lunghezze d’onda da 200 a 550 nm.
Le titolazioni CD sono state effettuate aggiungendo quantità crescenti di colorante al polimero posto in cella e registrando gli spettri dopo ogni aggiunta.
2.2.5 La Calorimetria Differenziale a Scansione
La calorimetria differenziale a scansione è una tecnica di analisi termica che sfrutta le variazioni dei flussi di calore attraverso un campione per determinare la presenza di variazioni strutturali e cambi di stato dovuti a variazioni di temperatura. Tramite la tecnica DSC si possono osservare transizioni vetrose o anche formazione e fusione di cristalli. La DSC è molto utilizzata anche nello studio dei polinucleotidi (Ferreira e Sheardy 2006) per monitorare il processo di denaturazione della doppia elica in seguito a riscaldamento.
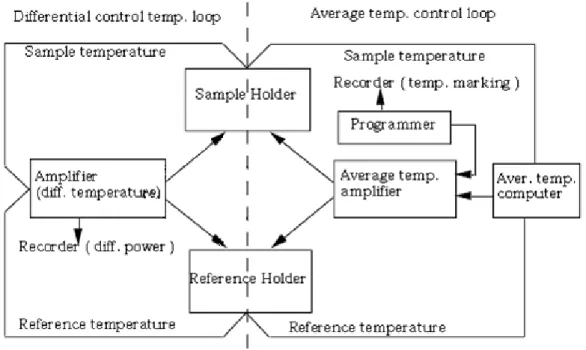
Un tipico diagramma a blocchi di uno strumento DSC è mostrato in Fig 2.5. Un portacampione contenente il materiale di indagine ed un portacampione di riferimento sono fissati in posizione simmetrica in un blocco di metallo.
Fig 2.5 Schema a blocchi di un calorimetro differenziale a scansione
La differenza nelle temperature rivelata dai sensori fornisce un segnale di correzione per le potenze delle unità di riscaldamento incaricate di realizzare la coincidenza tra le temperature. La differenza tra le energie fornite dai riscaldatori è quindi misurata e registrata come funzione lineare del tempo e della temperatura. D'altra parte, un circuito di controllo della temperatura media confronta il valor medio fra le
temperature rivelate sul campione e sul riferimento con quella selezionata dal programmatore di temperatura. Il valore della differenza fornisce un segnale di correzione alle unità di riscaldamento necessario per effettuare spazzate di temperatura.
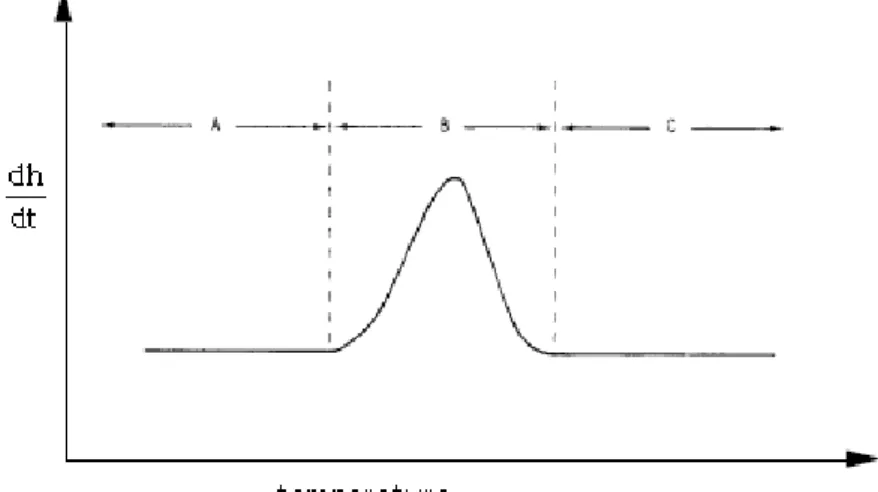
L'andamento dello spettro DSC in funzione della temperatura può essere compreso con l'ausilio delle seguenti considerazioni. Prima di una transizione la differenza di energia tra campione e riferimento al variare di T è costante (zona A della Fig 2.6); non appena il campione subisce una transizione, il riscaldatore del campione deve fornire ulteriore energia nel caso endotermico o minore energia nel caso esotermico per mantenere coincidenti la temperatura del campione e del riferimento.
Questa variazione nella differenza di energia si mostra come una curva nella registrazione DSC (zona B della Fig 2.6). Alla fine della transizione la variazione di energia fornita al campione per mantenere temperature equivalenti è di nuovo costante (zona C della Fig 2.6).
Fig 2.6 Termogramma DSC che mostra l’andamento tipico di un materiale che effettua una transizione con calore latente. Le zone denominate come A B e C delimitano rispettivamente la zona prima della transizione , la
transizione vera e propria e la fine della transizione.
La tecnica calorimetrica è quindi in grado di misurare la velocità differenziale di flusso di calore, coincidente a pressione costante con la variazione di entalpia, ed il segnale registrato fornisce l'andamento del calore specifico cp al variare della temperatura. La Fig 2.6 mostra un andamento tipico per transizioni di fase che presentano calore latente. In questo caso il valore dell'area sotto la curva DSC, sia
esoterma che endoterma, può essere correlato al calore latente, individuando nella
DSC una tecnica non solo qualitativa ma anche quantitativa.
Il calorimetro utilizzato in questo lavoro di tesi è stato un Setaram micro DSC III differential scanning calorimeter.
2.2.6 Misure cinetiche
2.2.6.1 La tecnica Tjump
Le tecniche di rilassamento chimico vennero introdotte da Eigen negli anni ‘60 (Eigen e De Mayer 1963). Queste tecniche consistono nella perturbazione di un sistema all’equilibrio mediante la rapida variazione di una variabile esterna come la temperatura (T-jump), la pressione (P-jump), o il campo elettrico (Electric Field-jump).
La variazione della costante di equilibrio di una reazione è infatti legata alle variazioni delle variabili suddette dalla seguente relazione:
dE E K ln dP P K ln dT T K ln K ln d T , P E , T E , P ⎟ ⎠ ⎞ ⎜ ⎝ ⎛ ∂ ∂ + ⎟ ⎠ ⎞ ⎜ ⎝ ⎛ ∂ ∂ + ⎟ ⎠ ⎞ ⎜ ⎝ ⎛ ∂ ∂ = (2.2)
Nel caso del salto di temperatura dP=dE=0 e si perviene all’equazione di Vant’Hoff dT RT H K ln d 2 0 ⎟ ⎟ ⎠ ⎞ ⎜ ⎜ ⎝ ⎛ Δ =
L’equilibrio è perturbato da un rapido salto di temperatura ottenuto tramite la scarica di un condensatore per effetto Joule, la soluzione infatti costituisce di fatto una resistenza elettrica. Affinché questa tecnica possa essere applicata occorre ovviamente che il ΔH della reazione studiata sia diverso da zero.
La perturbazione istantanea dell’equilibrio provoca una variazione delle concentrazioni delle specie presenti che rilassano verso una nuova situazione di equilibrio, imposta dal valore assunto dalla costante a quella data nuova temperatura. Tale cambiamento può essere osservato per via spettrofotometrica, se
almeno una delle specie assorbe, oppure per via spettrofluorimetrica, se almeno una delle specie emette luce di fluorescenza.
Se il processo in esame è semplice, come nel caso di una reazione costituita da un solo passaggio, il segnale varia con un andamento monoesponenziale al quale si può associare una costante di tempo. Nel caso di un processo più complesso, (più reazioni) il segnale può variare con un andamento biesponenziale (due costanti di tempo) o multiesponenziale.
In questo lavoro di tesi è stato utilizzato uno strumento T-Jump, in grado di registrare segnali sia in assorbanza sia in emissione di fluorescenza, assemblato nel laboratorio del dipartimento di chimica, sezione di chimica fisica, dell’Università di Burgos (Spagna). Uno schema per un’apparecchiatura T-jump con tali caratteristiche è mostrato in Fig 2.7. Fig 2.7 Schema di un’apparecchiatura T‐Jump: 1a) lampada, 1b) monocromatore, 1’) Laser, 2) Beam splitter, 3) Cella vista dall’alto, 4) Fotodiodo di misura per la fluorescenza, 5) Fotodiodo per l’assorbanza, 6) Fotodiodo di riferimento, 7) Spark gap, 8) Condensatore, 9) Alimentatore ad alta tensione, 10) Oscilloscopio a memoria digitale, 11) Calcolatore, ↑ ) Bilanciamento tra voltaggio di riferimento e di misura.
Indipendentemente da quale sia il sistema di irraggiamento del campione, la maggior parte della luce prodotta viene inviata al campione e raggiunge il fotodiodo di misura, mentre una piccola parte viene inviata ad un fotodiodo di riferimento tramite uno specchio semiriflettente (beam splitter). La strumentazione utilizzata è dotata di due serie di dinodi per l’amplificazione del segnale di fluorescenza posti perpendicolarmente alla finestra di entrata della luce di eccitazione. Prima di inziare la serie di misure è necessario uguagliare i due segnali ed il bilanciamento è effettuato in modo che sia il detector di riferimento che il detector che rivela la fluorescenza generino un segnale di 10 V. Occorre sempre assicurarsi che il segnale dei fotodiodi non superi mai i 12 V, valore oltre il quale i diodi vanno in saturazione. Tale bilanciamento e l’eventuale attenuazione del segnale vengono fatti per mezzo di un potenziometro e di opportuni filtri. In questo lavoro di tesi sono stati utilizzati filtri Schott da 500 nm, scelti in modo da tagliare la luce di eccitazione eventualmente presente nel segnale in uscita in seguito a fenomeni di scattering.
Il salto di temperatura viene provocato dalla scarica di un condensatore della capacità di 0.05 μF caricato con la differenza di potenziale di 20 KV. La scarica viene prodotta azionando un interruttore di tipo spark-gap. La soluzione in esame viene introdotta all’interno di una cella DIA-RT T-jump system di Dialog (Düsseldorf) inserita all’interno del circuito del condensatore. La cella presenta quattro finestre di quarzo (2 di fluorescenza, una di assorbanza e una di eccitazione), un volume totale di 0.8 ml ed un cammino ottico di 7 mm. La cella può essere usata sia in fluorescenza che in assorbanza. Il campo elettrico prodotto dalla scarica del condensatore si sviluppa tra due elettrodi in oro posti all’interno della cella e perpendicolarmente alle finestre di quarzo. Nelle condizioni usate il salto di temperatura è risultato essere pari a 3.8° C pertanto, per misure sperimentali a T = 25° C, la cella è stata termostatata alla temperatura di 21.2° C.
Il segnale in uscita, una volta amplificato, viene inviato ad un oscilloscopio Agilent 6400 a memoria digitale, che lo memorizza in 1000 punti e successivamente trasferito ad un personal computer interfacciato con lo strumento. La curva cinetica viene elaborata dal programma Jandell, software che fornisce direttamente i valori dell’ampiezza della curva e del tempo di rilassamento del processo o dei processi
chimici coinvolti nel sistema. Analizzando i tempi di rilassamento in funzione della concentrazione dei reagenti si ottengono informazioni sulle costanti cinetiche dirette e inverse degli stadi che costituiscono la reazione globale.
Nelle tecniche di rilassamento chimico il limite inferiore, per quanto riguarda la scala dei tempi analizzabili, è rappresentato dal tempo di scarica del condensatore, che è dell’ordine dei microsecondi ed è tanto più veloce quanto più alta è la forza ionica (minore resistenza) e quanto minore è la capacità del condensatore. D’altra parte non è possibile mantenere a lungo la cella in condizioni adiabatiche e ciò fa sì che il metodo T-jump non possa essere applicato allo studio di reazioni lente. Possiamo dire che il metodo T-jump permette di studiare reazioni con tempi che vanno all’incirca da 1μs a 1s, scala che comprende una larga gamma di sistemi biologici. 2.2.6.2 La tecnica stoppedflow
La tecnica stopped-flow è stata utilizzata nel presente lavoro per studiare la reazione di ritorno alla forma B del DNA a partire dalla forma Z, ossia la cinetica ZÆB, troppo rapida per essere studiata con tecniche spettrofotometriche di assorbimento. La tecnica ha inoltre permesso di utilizzare volumi ridotti di reattivo Poly[dG-m5dC]· Poly[dG-m5dC] e di verificare il comportamento del sistema in esame a diverse temperature grazie alla termostatazione del sistema. È stata utilizzata una cella di osservazione con un volume totale di 120μl.
La tecnica stopped-flow consiste nel mescolare i reagenti, inizialmente contenuti in due siringhe separate, all’interno di una camera ed osservare la variazione nel tempo delle loro concentrazioni subito dopo il mescolamento attraverso un sistema ottico di rilevazione, che può raccogliere la luce emessa in fluorescenza o quella assorbita. Infatti, se una o più specie assorbono o fluorescono, la variazione di composizione della miscela dà origine ad una variazione del segnale, che si identifica nella curva cinetica.
Le tecniche di mescolamento non si prestano allo studio di reazioni estremamente veloci, perché il loro limite inferiore è fissato dal tempo di mescolamento dei due liquidi, il quale non può scendere sotto il millisecondo. Non esiste invece, in linea di principio, un limite superiore di utilizzo di tale tecnica. La tecnica stopped-flow ci
permette così di studiare il comportamento cinetico di reazioni i cui tempi di rilassamento sono compresi tra pochi millisecondi e molti minuti. Per questo motivo la tecnica stopped-flow è utilissima quando affiancata ad altre atte allo studio di reazioni con tempi di rilassamento estremamente ridotti, nell’analisi di sistemi che presentino reazioni in più stadi caratterizzate da tempi molto diversi fra loro.
I reagenti sono contenuti in due siringhe termostatate i cui pistoni vengono fatti avanzare mediante un sistema pneumatico, così da spingere i reagenti in una camera di mescolamento (Fig 2.8). Segue la cella vera e propria, una microcella in quarzo, nella quale si osserva il decorso della reazione. Questa cella viene attraversata da una radiazione di opportuna lunghezza d’onda selezionata tramite un monocromatore. Il flusso viene poi raccolto da una siringa il cui pistone, arretrando, aziona un contatto elettrico che pone in funzione il sistema di registrazione del segnale. La Fig 2.9 rappresenta lo schema dello strumento Fast modular UV-Vis spectrophotometer / polarimeter – MOS – 450 - CD BioLogic utilizzato in questo lavoro di tesi sia come stopped-flow sia per le misure statiche di dicorismo circolare.
Fig 2.8 Schema interno di un apparecchio stopped‐flow. A) luce d’entrata proveniente dal monocromatore e dal sistema di specchi B) luce in uscita indirizzata al tubo fotomoltiplicatore 1) pistone, 2) siringhe, 3) siringhe serbatoio, 4) camera di mescolamento, 5) camera di osservazione, 6) blocco di termostatazione, 7) tubo di drenaggio, 8) valvola di blocco drenaggio, 9) siringa di stop, 10) bulloni regolabili di fermo corsa, 11) fermo meccanico, 12) meccanismo di trigger (attivato dal pistone della siringa di stop).
Fig 2.9 Schema ottico dell’apparecchiatura Fast modular UV‐Vis spectrophotometer / polarimeter – MOS – 450‐ CD Bio‐Logic utilizzato in questo lavoro di tesi sia per gli esperimenti di dicorismo circolare che come stopped‐ flow