INDICE:
1.RIASSUNTO ANALITICO..………..….... Pag 2
2.RUOLO DEI CURARI NELLA MODERNA MEDICINA…….. Pag 3
-Fisiologia…….……….….. . Pag.4
-Farmacologia……….. ... Pag12
3.BLOCCANTI NEUROMUSCOLARI E MONITORAGGIO
INTRAOPERATORIO……….... Pag 21
-Differenti tipi di stimolazione nervosa…….……… Pag.26
4.REAZIONI AVVERSE E UTILIZZO NELLA
PATOLOGIA D’ORGANO----…….………... Pag.36
-Effetti al livello degli organi e apparati………. Pag.36
-Interazioni con altri farmaci……….. Pag.38
-Reazioni avverse all’uso dei bloccanti
neuromuscolari……… Pag.39
5.UTILIZZO DEI REVERSAL:PROBLEMI E SOLUZIONI….. Pag.41
-Principali determinanti della velocità e della
adeguatezza dei reversal………... Pag.43
-Le gammaciclodestrine.………. Pag.51
RIASSUNTO ANALITICO
Il blocco neuromuscolare è largamente utilizzato nella pratica anestesiologica al fine di rendere più agevoli le manovre chirurgiche, facilitare l’intubazione oro-tracheale e dove necessario la ventilazione meccanica in corso di procedure chirurgiche.
Spesso l’entità della profondità del blocco neuromuscolare è affidato a criteri clinici ma la variabilità della risposta individuale e del range terapeutico impongono un monitoraggio di maggior livello.
L’utilizzo dell’acceleromiografia facilita il raggiungimento del livello ottimale di blocco necessario alla procedura chirurgica e ne indica la reversibilità 2 favorendo un più corretto impiego dei farmaci anticolinesterasici con riduzione dell’incidenza di blocco residuo e di episodi di ricurarizzazione tardiva.
Gli agenti anticolinesterasici ad azione reversibile sono utilizzati da diversi decenni in anestesia per antagonizzare il blocco indotto dai curari competitivi.
Il loro impiego è però gravato da importanti effetti collaterali che ne limitano l’utilizzo, specie in alcune categorie di pazienti.
Recentemente, una nuova molecola appartenente alla famiglia delle ciclodestrine, ha mostrato di avere capacità di antagonizzare il blocco NM, anche profondo, indotto da rocuronio e vecuronio in modo rapido irreversibile e sicuro poponendola come valida alternativa alla succinicolina nelle intubazioni difficili e nella chirurgia di breve durata in cui è richiesta miorisoluzione totale.
RUOLO DEI CURARI NELLA MODERNA MEDICINA
Nel 1942 Harold Griffith pubblicò i risultati di uno studio sull’impiego della d-tubocurarina(composto appartenente ai curari, gruppo di sostanze da tempo note per le loro proprietà di indurre paralisi muscolare ), durante l’anestesia, allo scopo di indurre rilassamento della muscolatura scheletrica.Un anno dopo Cullen ne descrisse l’uso in 131 pazienti che erano stati sottoposti ad intervento chirurgico in anestesia generale. La Succinilcolina, introdotta da Thesleff e Folders nel 1952 cambiò drasticamente la pratica anestesiologica: il suo rapido onset e la breve durata d’azione semplificarono notevolmente l’intubazione tracheale. Nel 1967 Baird e Reid documentarono per primi l’utilizzo dell’amoniosteroide pancuronio (1).
3
Figura 1A, Richard Gill torno’dal suo viaggio in Ecuador nel 1938 con 11 kg di una pasta scura dalla quale
Squibb and Sons, Inc., prepararono la soluzione sterile iniettabile Intocostrin. B, Harold Griffith e Enid Johnson (non mostrati in figura) usarono l’Intocostrin in 43 interventi di chirurgia addominale con successo nel 1942. (Courtesy of the Guedel Memorial Anesthesia Center, San Francisco, CA.)
In seguito i miorilassanti sono entrati rapidamente a far parte dell’armamentario farmacologico degli anestesisti.
Ad oggi il blocco neuromuscolare trova molteplici ed importanti applicazioni cliniche :
-Facilitare l’intubazione tracheale
-Fornire le condizioni necessarie per la messa in atto della ventilazione controllata in corso di anestesia
-Fornire al chirurgo assenza di riflessi e le condizioni di miorilassamento ottimali( chirurgia addominale, riduzione di fratture ossee in chirurgia ortopedica, ventilazione monopolmonare in chirurgia toracica)
-Permettere la ventilazione controllata in pazienti ricoverati in terapia intensiva migliorando la compliance toraco-polmonare e quindi gli scambi respiratori in particolari assetti ventilatori, come in corso di ventilazione protettiva in pazienti con ALI/ARDS
FISIOLOGIA
Le fibre muscolari sono innervate da grosse fibre nervose mieliniche che originano dai grandi motoneuroni delle corna anteriori del midollo.
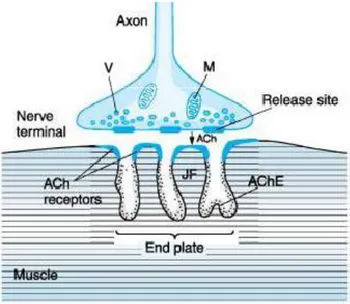
Ogni fibra nervosa si ramifica più volte per stimolare un numero variabile da una manciata a diverse centinaia di fibre muscolari. La terminazione nervosa forma una giunzione con la fibra muscolare, chiamata giunzione neuromuscolare, e questa struttura è responsabile della trasmissione dell’impulso nervoso alla cellula muscolare (fig 2).
Le ramificazioni della fibra nervosa formano alle loro estremità un complesso di bottoni terminali nervosi, che si invaginano nella fibra muscolare pur restando all’esterno della membrana plasmatica della fibra stessa.
L’intera struttura si chiama placca motrice ed è coperta dalle cellule di Schwann che la isolano dall’ambiente circostante.
L’invaginazione della membrana viene detta doccia sinaptica, e lo spazio compreso tra il bottone terminale e la membrana della fibra viene detto spazio sinaptico.
Questo spazio, largo 20-30 nanometri, è occupato da un sottile strato di fibre reticolari spugnose che costituiscono la lamina basale ed attraverso cui scorre il fluido extracellulare.
Nel fondo della doccia sinaptica sono presenti numerosi ripiegamenti della membrana della fibra neuromuscolare chiamate pliche sub neurali, che amplificano notevolmente la superficie sulla quale può agire il mediatore chimico.
Nel bottone terminale c’è una abbondanza di mitocondri deputati alla funzione di sintetizzare il mediatore chimico che è responsabile dell’eccitazione della fibra muscolare, l’acetilcolina.
L’acetilcolina è sintetizzata nel citoplasma del bottone terminale, e viene accumulata all’interno di numerose vescicole sinaptiche presenti normalmente nei bottoni terminali di una singole placca motrice in numero di 300.000 .
Ogni volta che ogni volta che l’impulso nervoso giunge alla giunzione neuromuscolare 150 di esse sono rilasciate nello spazio sinaptico.
Quando un potenziale d’azione nervoso provoca la depolarizzazione del terminale assonico, avviene l’attivazione dei canali di membrana voltaggio dipendenti e ciò provoca un flusso entrante di ioni calcio.
Questi ioni positivi esercitano una attrazione sulle vescicole presinaptiche dimodochè esse sono indotte a fondersi con la adiacente membrana plasmatica del nervo;così facendo il loro contenuto di molecole di acetilcolina viene liberato nel versante esterno della membrana cellulare. Le molecole di Ach, diffondono attraverso il vallo sinaptico e si legano ai recettori nicotinici presenti a livello della porzione specializzata della membrana muscolare, la placca neuromuscolare.
Essi sono maggiormente localizzati al livello delle imboccature degli spazi subneurali della membrana (fig 2).
La placca neuromuscolare contiene circa 5 milioni di questi recettori ed è sufficiente l’attivazione di un decimo di essi per provocare la contrazione muscolare.
Figura 2: la giunzione neuromuscolare. V, vesicola sinaptica; M, mitocondrio; ACh, acetilcolina; AChE, acetilcolinesterasi; JF, spazi subneurali (junctional folds).
Ogni recettore è un complesso proteico costituito da 5 subunità (vedi dopo)le quali sono disposte a formare un canale:il legame con l’acetilcolina provoca un riarrangiamento cui consegue l’apertura del canale stesso.
Esso è altamente selettivo nei confronti dei cationi (sodio, potassio e cloro), mentre gli anioni non riescono a passare per via delle cariche negative presenti al suo interno.
In realtà il ruolo degli ioni sodio è preponderante rispetto a quello degli altri due tipi di ioni.
Infatti gli ioni calcio sono presenti in concentrazioni significativamente minori degli altri due, in più il potenziale negativo all’interno della membrana muscolare (-90mV) attira gli ioni Na+ verso l’interno mentre impedisce al K+ di uscire.
L’effetto determinato da questo flusso massiccio di cariche positive verso l’interno della fibra muscolare è una variazione del potenziale locale della membrana.
Il brusco aumento degli ioni sodio all’interno della fibra muscolare, che segue l’apertura dei canali dell’acetilcolina, provoca un aumento di 50-75 millivolt senso positivo del potenziale interno della membrana, dando luogo ad un potenziale locale chiamato potenziale di placca.
Il potenziale di placca generato dall’acetilcolina è di norma di gran lunga più grande di quello sufficiente a produrre un potenziale d’azione nella fibra muscolare.
Per questa ragione, quindi, ogni impulso che arriva alla giunzione neuromuscolare induce un potenziale di placca che è circa tre volte superiore a quello minimo necessario per eccitare la fibra muscolare:
questo particolare comportamento è chiamato fattore di sicurezza della trasmissione neuromuscolare(26).
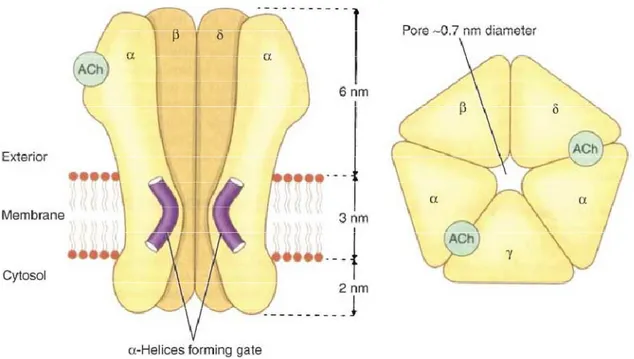
Figura 3: Struttura del recettore nicotinico della placca neuromuscolare visto da lato (sinistra) e dall’alto (destra). I cinque protomeri formano un raggruppamento che circonda un poro central trasmembrana, la cui parte sporgente è formata da due segmenti ad elica per ciascuna sub unità. Questi contengono in prevalenza amminoacidi di carica negative, che rendono ragione della selettività del canale ai cationi.Ci sonio due siti di legame dell’acetilcolina (ACh)nella porzione extracellulare del recettore all’interfaccia tra le subunità α-γ e α-δ.
Quando avviene il legame dell’acetilcolina, un cambiamento conformazionale viene trasmesso attraverso le subunitaà che formano il recettore che fa si che avvenga l’apertira del canale.Il recettore mostrato èquello fetale. In seguito avviene lo switch tra l’RNA che codifica la sub unità γ e l’RN ache codifica la subunità ε . Figura riprodotta da Pharmacology 5th Edition (2003) by
Rang, H.P., Dale, M.M., Ritter, J.M., and Moore, P.K. Churchill Livingstone/Elsevier Science, Edinburgh. Questa figura e basata su studi originali di N. Unwin
Rimozione dell’acetilcolina dal vallo intersinaptico
Una volta liberata nello spazio intersinaptico, l’acetilcolina continua ad attivare il canale dell’acetilcolina fino a che permane in questo spazio.
Tuttavia essa viene velocemente rimossa in due modi:la maggior parte dell’acetilcolina viene distrutta dall’enzima acetilcolinestarasi che èancorato alla lamina basale, il sottile strato di tessuto connettivo che riempie lo spazio tra il bottone terminale presinaptico e la membrana del muscolo postsinaptico;una piccola parte difonde all’esterno dello spazio sinaptico e così non può più agire sulla membrana della fibra muscolare.
Il breve periodo, che dura al massimo millisecondi, nel quale l’acetilcolina permane nello spazio intersinaptico, è quasi sempre sufficiente ad eccitare la fibra muscolare.
I meccanismi fisiologici deputati alla rapida rimozione dell’acetilcolina impediscono che si possa verificare una nuova eccitazione del muscolo dopo che la fibra ha recuperato dal primo potenziale d’azione.
Il recettore nicotinico
Il recettore nicotinico dell’acetilcolina media la neurotrasmissione ed esplica la sua funzione al livello della porzione post-sinaptica della giunzione neuromuscolare e dei gangli del sistema nervoso autonomo. Inoltre al livello del sistema nervoso centrale controlla il rilascio di neurotrasmettitore dalle zone presinaptiche.
Il recettore nicotinico deve il suo nome al fatto che è stimolato sia dal neurotrasmettitore acetilcolina che dall’alcaloide nicotina.
Ci sono differenti sottotipi di recettori che agiscono al livello della giunzione neuromuscolare e dei gangli del sistema nervoso autonomo, e i diversi tipi di agenti farmacologici che agiscono su di loro sono in grado di discriminarli.
Gli studi classici sull’azione del curaro e della nicotina, effettuati per la prima volta più di un centinaio di anni or sono, hanno reso il recettore nicotinico il prototipo di recettore farmacologico.
Prendendo a modello le strutture specializzate che si sono evolute per mediare la trasmissione colinergica e le tossine che bloccano l’attività motrice, sono stati descritti i recettori nicotinici periferici, prima e successivamente, quelli centrali, e questi studi ed i risultati che ne sono derivati hanno rappresentato un passo fondamentale nello sviluppo della farmacologia molecolare.
Gli organi elettrici delle specie acquatiche Electrophorus e specialmente Torpedo hanno rappresentato una preziosa sorgente di recettori nicotinici. In questi organi, a differenza del muscolo scheletrico, più del 40% della superficie è eccitabile e contiene recettori colinergici.
Nei muscoli dei vertebrati invece, le placche motorie rappresentano meno dello 0, 1 % della superficie cellulare.
La scoperta dell’effetto di antagonista apparentemente irreversibile di estratti di veleno di specie come il Bungarus multicintus (imputabile alle α tossine, peptidi di di 700 dalton) o delle specie di cobra naja naja, hanno rappresentato strumenti utili per l’identificazione del recettore.
Tossine radio marcate sono state usate da Changeux (2) e colleghi nel 1970 per saggiare il recettore colinergico isolato in vitro.
Le α tossine hanno una affinità estremamente elevata e un basso tasso di dissociazione dal recettore, sebbene il legame non sia covalente.
In sito ed in vivo il suo comportamento riproduce quello che ci si aspetta per un antagonista ad elevata affinità.
Dal momento che la trasmissione colinergica media l’attività motrice nei vertebrati marini e nei mammiferi, i terpinoidi, un vasto gruppo di molecole, e le tossine che bloccano il recettore nicotinico si sono affermati come meccanismo evolutivo in grado di impedire o favorire a seconda delle circostanze la predazione tra le specie viventi (3).
Il processo di purificazione del recettore ha portato recentemente all’isolamento del DNA complementare (c DNA) che codifica ciascuna delle subunità, e questo ha permesso a sua volta la clonazione di geni codificanti i recettori a subunità multiple situati nel tessuto nervoso e muscolare dei mammiferi (4).
Con la simultanea espressione dei geni che codificano le singole subunità all’interno di sistemi cellulari in svariate combinazioni, osservando il legame e gli eventi elettriofisiologici che risultano in seguito al legame stesso con l’agonista, i ricercatori sono stati in grado di mettere in relazione proprietà funzionali e struttura primaria dei di questi recettori(5).
La struttura del recettore nicotinico:
Il recettore nicotinico dell’apparato muscolare scheletrico è un pentamero costituito da quattro subunità distinte (α, β, γ, δ, ), nel rapporto stechiometrico rispettivamente di 2:1:1:1 .
Nelle placche muscolari mature la subunità γ è sostituita da ε, una subunità strettamente correlata.
Le singole subunità sono identiche per quanto riguarda il 40% della loro sequenza aminoacidica, a sostegno del fatto che esse derivano da un gene primordiale comune .
La struttura del recettore nicotinico è stata assunta come protoitpo di canale ionico pentamerico attivato da ligando, famiglia che include i recettori per i neurotrasmettitori inibitori (GABA e glicina) e certi recettori della serotonina ( 5 HT-3).
Ognuna delle subunità del recettore pentamerico ha una massa molecolare compresa tra 40 e 60 kilodalton, con i 210 residui terminali che costituiscono tutto il dominio extracellulare .
Quest’ultimo è unito a quattro domini trasmenbrana; la regione compresa tra il terzo ed il quarto dominio forma la maggior parte della componente citoplasmatica.
Ciascuna delle subunitàdel recettore dell’acetilcolina sporge sia dal lato intracellulare che extracellulare, ed esse sono assemblate secondo uno pseudo asse di simmetria e circoscrivono un canale interno.
Il recettore nella sua interezza è una molecola asimmetrica (14 × 8 nm) di 250000 dalton con la parte più voluminosa del dominio trasmenbrana situata sulla superficie extracellulare.
Nella placca neuromuscolare il recettore è disposto in strutture molto ordinate ad elevata densità recettoriale (10.000µm2) .
I siti di legame dove avviene il legame con l’agonista sono situate al livello dell’interfaccia tra le subunità, ma nel muscolo solo due delle cinque interfacce, α-γ e α-δ si sono evolute per trasportare il segnale.
Entrambe le subunità che formano l’interfaccia contribuiscono alla specificità.
Le misurazioni della conduttanza di membrana dimostrano che i flussi di ioni attraverso il recettore sono sufficientemente rapidi (5 ×10 7ioni/s) da implicare un flusso attraverso il canale aperto; non sarebbero compatibili invece con meccanismi di trasporto attivo.
Inoltre i cambiamenti di permeabilità ionica in seguito alla sua stimolazione(tipicamente una corrente entrante di ioni Na+ e successivamente di Ca2+)si verificano per mezzo di recettore canale intrinseco alla struttura del recettore.
La seconda regione transmembrana su ciascuna delle cinque subunità forma il perimetro interno del canale .
Il sito di legame con l’agonista è intimamente accoppiato ad un canale ionico;nella placca muscolare il legame simultaneo di due molecole dell’agonista provoca un rapido cambiamento conformazionale che apre il recettore .
I dettagli della cinetica di apertura del canale sono stati resi noti da tecniche di patch-clamp che sono in grado di discriminare l’apertura e la chiusura di un singolo canale (6).
FARMACOLOGIA:
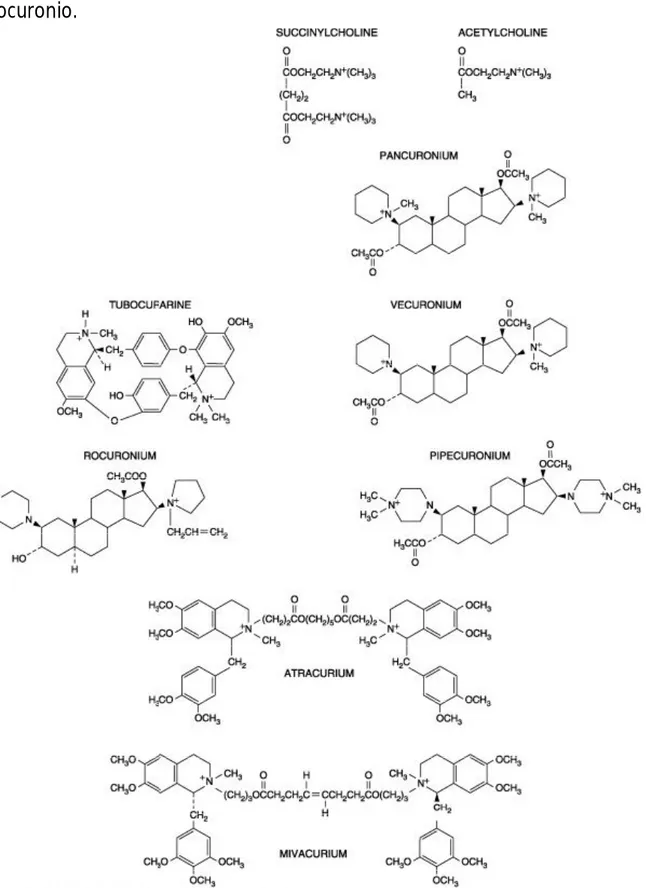
Tutti i farmaci disponibili che bloccano la trasmissione neuromuscolare sono strutturalmente simili all’acetilcolina: nel caso della succinilcolina il farmaco ècostituito da due molecole di Ach legate tra di loro, mentre i farmaci non depolarizzanti mascherano la struttura della “doppia acetilcolina” in una varietà di sistemi ciclici e voluminosi e semirigidi (7). Il processo fisiologico chiave è quindi l’interazione con il normale release di acetilcolina al livello della placca neuromuscolare .
I bloccanti neuromuscolari sono divisi in due classi:depolarizzanti e non depolarizzanti.
Questa divisione riflette sostanziali differenze per quanto riguarda il meccanismo di azione, la risposta alla stimolazione del nervo periferico, e il reversal del blocco.
Tab 1: classificazione dei bloccanti neuromuscolari:
DEPOLARIZZANTI A breve durata d’azione :
Succunilcolina NON DEPOLARIZZANTI A breve durata d’azione:
Mivacurio A durata d’azione intermedia: Atracurio Cis-atracurio
Vecuronio
Rocuronio
A lunga durata d’azione:
Pancuronio
Pipecuronio Doxacurio (Adriano Lachin: farmacologia e monitoraggio del blocco neuromuscolare)
Analogamente alla ACh, tutti i bloccanti neuromuscolari sono composti quaternari dell’ammonio la cui carica positiva fornisce una affinità verso i recettori della acetilcolina.
I miorilassanti depolarizzanti presentano una marcata analogia con la struttura dell’acetilcolina e quindi si legano ai recettori postsinaptici, anche se, non venendo metabolizzati dall’acetilcolinesterasi, mantengono a lungo la loro concentrazione nel vallo intersinaptico provocando una prolungata attivazione della placca neuromuscolare.
Questa continua depolarizzazione causa il rilassamento muscolare in quanto l’apertura dei canali al sodio perigiunzionali è tempo dipendente:dopo la stimolazione iniziale i canali si chiudono e non possono riaprirsi fino a che la placca non si ripolarizza.
Questo non si verifica finchè il farmaco continua ad occupare il recettore (blocco in fase I).
La depolarizzazione è in questo modo prolungata, provocando per un breve periodo una eccitazione ripetuta che può provocare fascicolazioni muscolari transitorie.
Dopo un certo periodo di tempo, la prolungata depolarizzazione può causare un cambiamento ionico e conformazionale nel recettore che esita in un blocco di fase II(8), paragonabile a quello dei farmaci non depolarizzanti.
I miorilassanti non depolarizzanti invece legano i recettori dell’ACh ma sono incapaci di provocarne l’attivazione, pertanto il potenziale di placca non si sviluppa.
I miorilassanti muscolari depolarizzanti agiscono quindi come agonisti, mentre i non depolarizzanti si comportano come antagonisti competitivi.
Classificazioni:
Due tipi di classificazioni sono utili, in particolare per effettuare una distinzione sulla base del comportamento farmacocinetico e degli effetti collaterali.
La prima si riferisce alla durata d’azione, per cui possiamo distinguere tra farmaci a breve, intermedia e lunga emivita(vedi tab 1).
La durata prolungata del blocco e la difficoltà di un completo reversal dopo chirurgia effettuata con D-tubocuraina, metocurina, pancuronio e doxacurio ha portato allo sviluppo di vecuronio e atracurio, agenti a durata intermedia. A questo ha seguito lo sviluppo di farmaci a breve emivita come il mivacurio.
In genere quelli a lunga emivita sono i più potenti, e richiedono l’impiego in un range di concentrazioni più basse, anche se questa necessità ne ritarda l’onset.
Il rocuronio è un farmaco di emivita intermedia ma che dimostra un rapido onset ed una bassa potenza.
Proprio il suo rapido tempo di insorgenza ne permette l’utilizzo come alternativa alla succinilcolina negli interventi che necessitano una rapida induzione e come opzione per indurre il rilassamento della muscolatura della laringe e della mandibola per facilitare l’intubazione (9)(20).
La seconda classificazione deriva invece dalla natura chimica dei farmaci che sono divisi in: alcaloidi naturali e composti affini, amminosteroidi, e le benzilisochinoline.
Gli alcaloidi naturali D-tubocuraina e l’alcaloide semisintetico alcuronio non sono molto usati nella pratica clinica, in favore dei nuovi composti che presentano una diminuita incidenza di effetti collaterali, tra cui il blocco gangliare, blocco vagale, e il rilascio di istamina.
Il pancuronio, prototipo degli amminosteroidi, non induce praticamente rilascio di istamina, ad ogni modo blocca i recettori muscarinici e questo antagonismo si manifesta primariamente in un blocco vagale e tachicardia.
Quest’ultima non si verifica con i nuovi aminosteroidi vecuronio e rocuronio.
Le benzilisochinoline non mostrano effetti vagolitici o di blocco ganglionare ma dimostrano una marcata tendenza al rilascio di istamina.
Tab 2 Caratteristiche cliniche dei bloccanti neuromuscolari non depolarizzanti: ED95 per adduttore del pollice Durante anestesia N2/O2 (mg/kg) Dose per l’intubazione (mg/kg) Onset dose per intubazione (min) Durata dose per intubazione (min) Mantenimento dose in boli (mg/kg) Mantenimento dose in i.c (mg/kg/min). Succiniicolina 0, 5 1, 0 0, 5 5-10 0, 15 2-15 Rocuronio 0, 3 0, 8 1, 5 35-75 0, 15 9-12 Mivacurio 0, 08 0, 2 2, 5-3, 0 15-20 0, 05 4-15 Atracurio 0, 2 0, 5 2, 5-3, 0 30-45 0, 1 5-12 Cisatracurio 0, 05 0, 2 2, 0-3, 0 40-75 0, 02 1.2 Vecuronio 0, 05 0, 12 2, 0-3, 0 45-90 0, 01 1, 2 Pancuronio 0, 07 0, 12 2, 0-3, 0 60-120 0, 01 - Pipecuronio 0, 05 0, 1 2, 0-3, 0 80-120 0, 01 - Doxacurio 0, 025 0, 07 4, 0-5, 0 90-150 0, 05 -
Assorbimento, metabolismo e escrezione:
I bloccanti neuromuscolari derivati dai composti quaternari dell’ammonio sono assorbiti in maniera del tutto inefficace attraverso il tratto
gastrointestinale, mentre è soddisfacente l’assorbimento per via
intramuscolare e endovenosa;quest’ultima modalità garantisce un rapido onset (sebbene gli agenti farmacologici più potenti siano frequentemente somministrati in dosaggi più bassi a scapito della rapidità dell’insorgenza degli effetti).
Quando sono somministrati agenti a lunga emivita come il pancuronio e la tubocuraina, si osserva una diminuzione dell’entità del blocco neuromuscolare dopo 30 minuti a causa della ridistribuzione del farmaco. La somministrazione in dosi ripetute permette di ridurre questo fenomeno, sebbene si possa determinare accumulo del farmaco.
In genere comunque si preferisce impiegare dosi frazionate di agenti a breve emivita piuttosto che agenti a lunga durata in un’unica somministrazione (tab .2)
Di sicuro interesse è il metabolismo del composto atracurio e del suo analogo più recente mivacurio, che li rende indicati in speciali situazioni. Infatti la clearance dei questi composti dipende dall’idrolisi della porzione estere da parte delle esterasi plasmatiche per degradazione spontanea o reazione di Hofmann (clivaggio della porzione N-alchilica delle benzililisochinoline).
Ci sono quindi due vie di degradazione, ciascuna delle quali rimane attiva in corso di insufficienza renale.
Il mivacurio in particolare e molto sensibile alla catalisi ad opera delle colinesterasi o di altre idrolasi plasmatiche, in accordo con la sua breve durata di azione (10) .
Per quanto riguarda i bloccanti muscolari non depolarizzanti, la durata d’azione estremamente ridotta della succinilcolina è dovuta in larga parte alla sua suscettibilità all’idrolisi da parte delle butirrilcolinesterasi plasmatiche ed epatiche.
Sono stati descritti in molte occasioni episodi di apnea prolungata conseguenti alla somministrazione di succinilcolina o mivacurio; in molti dei pazienti che hanno manifestato questa reazione è stata riscontrata una variante anomala di colinesterasi plasmatica dovuta a mutazione genetica (11) (12), malattie epatiche o renali, oppure disordini nutrizionali, anche se alcuni casi i livelli di enzima sono normali (13).
Azioni farmacologiche al livello degli organi e apparati:
Muscolatura scheletrica:
L’insorgenza di paralisi muscolare dovuta all’uso dei curari fu descritta per la prima volta da Claude Bernard nel 1850.
L’evidenza che il sito effettore era costituito dalla placca neuromuscolare fu fornita da osservazioni sperimentali mediante microscopia elettronica e
a fluorescenza, l’applicazione microintoforetica di farmaco, l’analisi mediante patch-clamp e registrazioni intracellulari.
Quando il farmaco è applicato direttamente di una fibrocellula muscolare isolata la cellula diviene insensibile agli impulsi nervosi ed alla infusione diretta di acetilcolina, anche se la placca muscolare e ciò che resta della fibra muscolare sono comunque sensibili alla depolarizzazione e quindi rispondono ad una stimolazione diretta mediante corrente elettrica.
Sempre da studi effettuati mediante patch-clamp risulta che l’evento responsabile dell’attivazione agisce con un meccanismo del tipo tutto o nulla per cui la natura dell’agonista determina la durata della apertura del canale piuttosto che l’ampiezza del potenziale(6)
Con l’aumento della concentrazione dell’antagonista competitivo diminuisce progressivamente l’ampiezza del potenziale di placca postgiunzionale.
L’ampiezza di questo potenziale deve scendere sotto il 70% del suo valore iniziale prima che diventi incapace di dare origine ad un potenziale d’azione muscolare (e ciò costituisce il fattore di sicurezza della trasmissione neuromuscolare).
È altresì noto che la tubocuraina riduce la frequenza di apertura del canale ma non la conduttanza o la durata di apertura del singolo canale (14).
Ad alte concentrazioni i curari bloccano i canali direttamente in modo non competitivo con meccanismo dipendente da variazioni del potenziale di membrana (15).
Gli agenti depolarizzanti, come precedentemente accennato, depolarizzano la membrana nella stessa maniera dell’acetilcolina, sebbene la loro azione sia molto più prolungata a causa della loro resistenza all’acetilcolinestarasi. La depolarizzazione prolungata e consiste in un breve periodo di di eccitazione (nella quale si osservano le fascicolazioni) a cui segue il blocco. Anche se il sito principale d’azione di tutti i bloccanti neuromuscolari è sicuramente la membrana post-giunzionale le fascicolazioni tipicamente osservate con gli agenti depolarizzanti potrebbero di fatto essere una
conseguenza di una loro azione presinaptica, la quale da origine ad una stimolazione nervosa in senso antidromico.
L’azione presinaptica dei bloccanti neuromuscolari non competitivi può diventare significativa in corso di stimolazione ripetitiva ad alta frequenza in quanto i recettori nicotinici pregiunzionali potrebbero essere coinvolti nella mobilitazione dell’Ach durante la fase di rilascio dal terminale nervoso 16)(17).
Altri farmaci e tossine bloccano la trasmissione neuromuscolare con meccanismi differenti, per esempio interferendo con la sintesi o il rilascio di acetilcolina(18) ma non sono utilizzati nella pratica clinica con l’eccezione dellla tossina botulinica, impiegata nel trattamento del blefarospasmo, strabismo e acalasia.
Il dantrolene blocca il rilascio di Ca2+
Dal reticolo sarcoplasmatico ed è usato nel trattamento dell’ipertermia maligna.
Sequenza e caratteristiche di insorgenza del blocco:
Quando una dose appropriata di un antagonista competitivo é iniettato per via endovenosa in un essere umano, si ha insorgenza di debolezza muscolare che progredisce rapidamente verso la paralisi flaccida.
Cessa per prima l’attività dei piccoli muscoli dell’occhio, dei muscoli della mandibola e della laringe, dopodichè quella degli arti e del tronco.
In seguito si verifica la paralisi dei muscoli intercostali e da ultimo il diaframma e con esso si arresta la respirazione.
Il recupero avviene sempre nell’ordine inverso a quello della paralisi, per cui il diaframma è il primo muscolo a recuperare la funzione (19) (20).
Dopo una infusione endovenosa di un agente depolarizzante come la succinilcolina, invece, si verificano precocemente le fascicolazioni al livello del tronco e dell’addome, quindi entro 1 min insorge la miorisoluzione che diventa massima nel giro di 2 min(in questa fase compare l’apnea transitoria) e scompare tipicamente nel giro di 5 min.
Una miorisoluzione di durata maggiore è ottenuta mediante infusione continua(dopo la cessazione dell’infusione gli effetti del farmaco spariscono rapidamente a causa della sua rapida idrolisi da parte delle butirrilcolinesterasi plasmatiche ed epatiche).
Sistema nervoso centrale:
La tubocuraina e gli altri agenti bloccanti neuromuscolari sono sostanzialmente privi di effetti sul sistema nervoso centrale nei dosaggi impiegati nella pratica clinica in quanto incapaci di penetrare la barriera ematoencefalica.
Gli esperimenti clinici effettuati peraltro non numerosi non evidenziano effetti stimolanti, depressogeni o analgesici al livello del SNC.
Gangli del sistema nervoso autonomo e siti effettori muscarinici:
I bloccanti neuromuscolari hanno range variabili di potenza nel produrre blocco gangliare, i cui effetti possono essere comunque convertiti o antagonizzati in modo analogo agli effetti sulla placca neuromuscolare . Ai dosaggi di tubocuraina che venivano usati nella pratica clinica si verificava un blocco parziale sia nei gangli del SNA che nel midollo, il che provoca una caduta della pressione arteriosa e tachicardia. I farmaci più recenti si dimostrano notevolmente migliori da questo punto di vista dal momento che il pancuronio dimostra un minore blocco gangliare, e ancora più selettivi sono atracurio, vecuronio, doxacurio, pipecuronio, mivacurio e rocuronio.
Il pancuronio ha però un effetto vagolitico, presumibilmente a causa del blocco dei recettori muscarinici.
Rilascio di istamina:
Il rilascio di istamina è tipicamente una azione diretta dei miorilassanti sulle mastcellule piuttosto che una anafilassi mediata delle IgE (22).
La tubocuraina produce le tipica sintomatologia dell’istamina quando è iniettato per via intracutanea o intraarteriosa nell’essere umano, ed alcune manifestazioni cliniche indotte dai bloccanti neuromuscolari appaiono
indotte dal rilascio di istamina, quali broncospasmo, ipotensione, aumento delle secrezioni salivari e bronchiali .
Anche succinilcolina, mivacurio, doxacurio, e atracurio provocano il rilascio di istamina anche se di minore entità a meno che non siano somministrate troppo rapidamente.
Gli amminosteroidi pancuronio vecuronio pipecuronio e rocuronio hanno anch’essi la tendenza a rilasciare istamina dopo iniezione intradermica o endovenosa (23)
BLOCCANTI NEUROMUSCOLARI E MONITORAGGIO
INTRAOPERATORIO
Probabilmente gran parte dei progressi raggiunti dalla moderna chirurgia non sarebbero stati possibili senza l’avvento degli agenti del blocco neuromuscolare.
A fronte degli innegabili vantaggi offerti dai miorilassanti sono parallelamente emerse alcune problematiche legate ad un loro inopportuno inutilizzo, ad una loro somministrazione inappropriata, magari per sopperire alla mancanza di un adeguato piano anestesiologico.
È evidente quindi che un corretto utilizzo dei miorilassanti non può prescindere da un monitoraggio adeguato, al fine di evitare dosi inutilmente elevate di farmaco con con conseguente prolungamento della paralisi oltre le esigenze operatorie, specie dopo infusioni prolungate cui potrebbero risultare inadeguati recuperi funzionali e maggiori difficoltà di antagonismo del blocco residuo (24) (25).
In passato gli anestesisti valutavano il grado del blocco neuromuscolare durante e dopo l’anestesia basandosi esclusivamente su criteri clinici.
Tuttavia la raccomandazione per l’impiego di un monitoraggio strumentale è basata essenzialmente su due criteri:da un lato, la variabilità individuale alla risposta nei confronti del blocco neuromuscolare, dall’altro la ristretta finestra terapeutica.
Non c’è infatti un blocco apprezzabile fino a che il 75-85% dei recettori non siano occupati e con l’occupazione del 90-95% la paralisi è completa (26). La miorisoluzione corrisponde quindi allo stretto range compreso tra 85 e 90% dell’occupazione recettoriale.
Lo scopo del monitoraggio è quindi permettere una corretta gestione clinica del blocco neuromuscolare in modo da garantire condizioni ottimali durante l’intervento chirurgico(o per ciascuna delle altre applicazioni), e fare in modo che, venuta meno l’indicazione, il blocco regredisca in maniera veloce e affidabile con gli antagonisti.
Indicazioni al monitoraggio del blocco neuromuscolare
-Stabilire l’intensità del blocco neuromuscolare
-Valutare il recupero della funzione neuromuscolare del paziente - Stabilire se e quando somministrare un anticolinesterasico
Segni clinici e strumentali della decurarizzazione
L’adeguatezza del blocco neuromuscolare può essere stimata dall’assenza della tosse alla laringoscopia, dall’assenza di tentativi di respirazione e rilassamento dei muscoli addominali.
Tutti questi segni sono comunque influenzati dalla profondità dell’anestesia(27).
Uno dei più frequenti segni di esaurimento del blocco neuromuscolare è il tentativo da parte del paziente di attuare degli atti respiratori spontanei, evidenziabili sul trattato capnografico con la improvvisa comparsa della cosiddetta “curva dicotoma”, ovvero una incisura deflettente sulla linea di plateau, e la contemporanea brusca modificazione del tracciato della curva pressione/volume nel monitoraggio spirometrico;sempre la spirometria evidenzierà una progressiva diminuzione della compliance toraco-polmonare.
La capacità di mantenere la testa sollevata per 5 secondi è considerato il segno clinico standard di un adeguato recupero nei confronti del blocco neuromuscolare.
Altri segni clinici utili sono l’apertura degli occhi, la protrusione della lingua, la comparsa del riflesso di deglutizione e di prensione.
Nei pazienti pediatrici, il sollevamento delle gambe ed il pianto sono stati suggeriti come indicatori di recuperi dal blocco neuromuscolare.
Monitoraggio tramite stimolazione neuromuscolare
È una metodica attraverso la quale si valuta la risposta di un muscolo alla stimolazione elettrica sopramassimale di un nervo motorio periferico(vedi fig 2a, 2b)
Viene applicato uno stimolo al nervo in modo da evocare una contrazione muscolare, la cui ampiezza e caratteristica sono utilizzate per valutare il grado del blocco.
Il tipico stimolo usato è un a corrente di onda quadra sopramassimale della durata di 0.1 -0.3 ms.
Ciascuna fibra si contrae seguendo il principio del tutto o nulla .Viene impiegato uno stimolo sopramassimale (maggiore del 20-30 % del valore soglia in grado di evocare la contrazione) in quanto ciò garantisce che ogni fibra muscolare innervata dal nervo si contragga;non si usano stimoli di durata maggiore che potrebbero causare scariche ripetitive (27).
Per applicare lo stimolo il catodo dello stimolatore nervoso è collegato distalmente ad un elettrodo di superficie, simile ad un elettrodo ECG .
I siti al livello dei quali avviene la stimolazione sono:il nervo ulnare(più frequentemente), il nervo tibiale posteriore, il nervo peroneo comune, il nervo faciale .
Per la valutazione della risposta muscolare nei confronti della stimolazione nervosa viene frequentemente utilizzata la acceleromiografia, metodica
nella quale un cristallo con proprietà piezoelettriche è attaccato alla base o alla estremità del pollice.
La stimolazione del nervo ulnare provoca l’accelerazione o la torsione del cristallo in conseguenza dei movimenti del pollice.
Misurando l’accelerazione impressa dal muscolo dopo suddetta stimolazione si ottiene una valutazione quantitativa del grado di miorilassamento.
Questo parametro viene utilizzato per calcolare la risposta al TOF ed il TOF ratio (vedi dopo).Altri metodi possono essere la meccanomiografia, che utilizza la forza della contrazione isometrica del pollice in risposta alla stimolazione del nervo ulnare e l’elettromiografia che consiste nella registrazione del potenziale evocato composto motorio in risposta alla stimolazione nervosa.
Figure 2a e2 b (DA NEUROMUSCULAR JUNCTION MONITORING FOR THE ORGANON PROTOCOL 19.4.308 SUGGAMEDEX TRIAL)
DIFFERENTI TIPI DI STIMOLAZIONE NERVOSA
Stimolazione a singolo impulso (single twitch stimulation)
È la più semplice forma di stimolazione e richiede un singolo stimolo elettrico soprasoglia, di frequenza tra 1 e 0.1 Hz e di durata compresa tra 0.1 e 0.2 msec (27).
Viene provocata una singola contrazione ad una corrente sopramassimale che induce un singolo potenziale d’azione muscolare in ogni fibra del fascio nervoso.
L’altezza della risposta muscolare evocata dipende dal numero di fibre muscolari reclutate.
Ci sono diverse limitazioni e svantaggi: con questa forma di stimolazione:la ampiezza della risposta non può essere interpretata se non è comparata ad un valore di riferimento precedente al blocco, senza l’impiego di uno strumento di registrazione è difficile monitorare e comparare l’intensità di due stimoli diversi nel tempo.
Durante il blocco depolarizzante inoltre la risposta alla stimolazione a singolo impulso non è ridotta se non sono occupati almeno il 75-80% dei recettori e quindi non è in grado di individuare un blocco minore del 70%-tutte queste caratteristiche ne restringono l’uso a limitate applicazioni.
In sala operatoria viene impiegata la stimolazione di un ciclo per secondo per rilevare l’onset del blocco.
Questa frequenza di stimolazione però produce apparentemente una più rapida insorgenza del blocco quando è comparata con una ottenuta con una frequenza di 0.1:questo fenomeno è conosciuto come fenomeno di insorgenza tempo-dipendente, ed è molto probabilmente una conseguenza dell’aumento di flusso sanguigno indotto dalla stimolazione, che aumenta il delivery del farmaco, e dell’insorgenza di affaticamento neuromuscolare.
Stimolazione tetanica
Questa tecnica consiste nella erogazione rapida di una stimolazione di 50 Hz per 5 secondi.
È molto dolorosa e può produrre un duraturo antagonismo del blocco neuromuscolare del muscolo stimolato.
Inoltre, generalmente, tutte le informazioni possono comunque essere fornite dalla risposta TOF, sicuramente più tollerata.
La principale applicazione di questa tecnica è quella di valutare il grado di blocco neuromuscolare quando non c’è risposta alla stimolazione TOF o singolo impulso.
Il rilascio di acetilcolina dai terminali presinaptici agisce sulla membrana post-sinaptica per produrre la contrazione muscolare.
Essa agisce anche al livello della vescicole presinaptiche per produrre la mobilizzazione dei quanti di neurotrasmettitore.
Quando la trasmissione neuromuscolare avviene in condizioni normali non c’è caduta della risposta neanche con la stimolazione tetanica in quanto la quantità di acetilcolina rilasciata al livello della membrana sinaptica è più che sufficiente per produrre la contrazione(26).
In un blocco non depolarizzante, è richiesta una maggiore quantità di ACh per spiazzare il bloccante neuromuscolare dal recettore post-sinaptico per produrre lo stesso livello di contrazione muscolare.
L’efficacia dei meccanismi fisiologici di compenso è ridotta a causa del blocco prodotto dal miorilassante e la risposta cade.
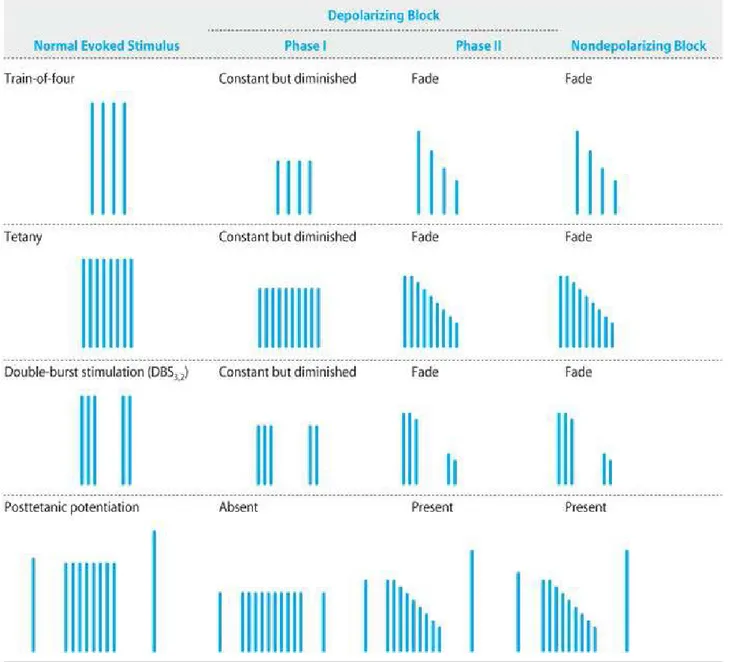
Stimolazione con treno di quattro-TOF (Train of Four)
È una metodica di stimolazione molto popolare e che viene routinariamente utilizzata nella pratica clinica per il monitoraggio della giunzione neuromuscolare, descritta per la prima volta da Ali et al (28).
Si applicano quattro stimoli sopramassimali ogni 0, 5 secondi (2 Hz), ognuno dei quali causa una contrazione nel muscolo. A questa frequenza i depositi
di acetilcolina che sono immediatamente disponibili sono depleti e la quantità rilasciata dal nervo diminuisce ad ogni successivo stimolo.
Anche se la minore disponibilità di neurotrasmettitore è comunque sufficiente alla contrazione in un muscolo normale, grazie al largo margine di sicurezza insito nel meccanismo della trasmissione neuromuscolare, in presenza di miorilassanti non depolarizzanti questo margine di sicurezza viene meno, e alcuni potenziali di placca non propagano nessun potenziale d’azione. In un blocco non depolarizzante c’è una caduta (riduzione sequenziale) dell’ampiezza delle quattro contrazioni.
Nella risposta di controllo(in cui non è presente blocco neuromuscolare) le quattro risposte sono teoricamente uguali.
Dividendo l’ampiezza della quarta risposta per l’ampiezza della prima si ha la valutazione del rapporto TOF (TOF ratio).
In un blocco depolarizzante l’ampiezza di tutte e quattro le contrazioni èuguale, sebbene ridotta rispetto a quella del controllo
-Se sono individuate tutte e quattro le risposte viene visualizzata la TOF – ratio(T4/T1).
-Per meno di quattro risposte o se il primo spasmo è inferiore al 20%:visualizzato solo il numero delle risposte.
-Ciascun set di stimoli può essere applicato in continuo ogni 10-15 sec Vantaggi della stimolazione con TOF:
Questo pattern di stimolazione può essere applicato in qualunque fase del blocco neuromuscolare e può fornire una quantificazione della profondità del blocco senza necessità di misurazioni di controllo prima della somministrazione di miorilassanti. Inoltre la correlazione della profondità del blocco con il numero di risposte, fornisce un valore facilmente interpretabile.
L’osservazione delle risposte evocate dal TOF dopo una piccola dose di agente non depolarizzante permette di predire accuratamente la dose richiesta da ciascun paziente.
Ha un minor grado di occupazione recettoriale inoltre più sensibile nei confronti della metodica a singola contrazione.
L’entità di caduta del potenziale è simile a quella che si verifica con una stimolazione di 50 Hz e perciò garantisce la stessa sensibilità ma è meno doloroso.
La relativa bassa frequenza consente di poter effettuare una valutazione visiva o tattile .
La mancanza della facilitazione post tetanica permette la ripetizione ogni 10-12s.
Essa non influenza il grado di blocco neuromuscolare, e infine, può essere eseguita con corrente sub massimale che risulta meno dolorosa ma conserva lo stesso grado di caduta del potenziale (29).
L’immediatezza del valore numerico inoltre permette una rapida e chiara interpretazione e comunicazione del dato.
Figura 5: esempio di monitoraggio intrapoeratorio mediante TOF DA NEUROMUSCULAR JUNCTION MONITORING FOR THE ORGANON PROTOCOL 19.4.308 SUGGAMEDEX TRIAL
Conta post tetanica-PCT (Post Tetanic Count)
-Permette di valutare il grado di blocco neuromuscolare quando non ci sia risposta al TOF o allo stimolo singolo come conseguenza di un intenso blocco non depolarizzante (30).
Durante un blocco non depolarizzante parziale, la stimolazione tetanica del nervo è seguita da un incremento post tetanico della tensione di contrazione (detta facilitazione post.tetanica).
Questo accade perche l’aumento di mobilizzazione e sintesi dell’acetilcolina causato dalla stimolazione tetanica permane per un certo tempo dopo la cessazione della stimolazione.
Quindi, dopo una stimolazione tetanica sono somministrati stimoli singoli. Si contano quindi il numero di risposte muscolari allo stimolo singolo.
Questa modalità è impiegata per valutare la profondità del blocco quando il TOF è zero.
Sono applicati 50 Hz di stimolazione tetanica per 5 s dopodichè si provoca la contrazione a 1 Hz per 15 s.
La conta post tetanica è inversamente proporzionale alla profondità del blocco neuromuscolare
Stimolazione a doppia scarica –DBS (Double Burst Stimulation)
Permette di valutare la presenza di piccole quantità di blocco neuromuscolare residuo subclinico.
Con il TOF non e possibile rilevare una caduta della risposta di piccola intensità senza l’ausilio di strumenti de registrazione (31).
La stimolazione in doppia scarica consiste di due scariche di 50 Hz della durata di 0, 2 ms separate da un intervallo di tempo di 750 ms (32).
Il pattern di stimolazione può essere costituito anche da tre impulsi ciascuno (3.3) oppure da tre impulsi seguiti da due (3.2).
Se vengono impiegati stimoli tetanici la risposta è più ampia e così è più facile vedere la caduta.
Lo stimolo è applicato per un tempo breve per cui la stimolazione in doppia scarica è meno dolorosa della stimolazione tetanica.
Si assiste alla comparsa di 2 brevi contrazioni muscolari(ogni 750 ms). Interpretazione dei risultati:
-In assenza di blocco:le due contrazioni sono d’eguale intensità -in presenza di blocco residuo:la seconda contrazione è più debole I vantaggi i questa tecnica sono:
-Permette il rilievo manuale (tattile) di piccoli gradi di blocco neuromuscolare residuo
Figura 6 variazione della risposta alle differenti modalità di stimolazione nervosa nei vari tipi di blocco neuromuscolare e controllo (da Morgan’s Clinical Anesthesiology 4th ed)
Impiego del monitoraggio nelle varie fasi dell’intervento chirurgico
Differenti modalità di stimolazione nervosa sono impiegate nelle differenti fasi dell’anestesia
Induzione :
L’elettrodo stimolante è collegato al paziente prima dell’induzione dell’anestesia.
Dopo l’induzione, ma prima della somministrazione del miorilassante viene acceso.
L’intensità dello stimolo deve essere aumentata fino ad ottenere una risposta massimale del muscolo, quindi la corrente di stimolo deve essere aumentata del 20-30% in modo da ottenere uno stimolo sopramassimale. Quando si ricerca il livello dello stimolo sopramassimale è preferibile impiegare la modalità a singola contrazione.
Intubazione:
Dopo che lo stimolo sopramasimale è stabilito, il miorilassante è somministrato alla dose necessaria all’intubazione, la modalità ad singola contrazione o il TOF vengono utilizzate per determinare il momento opportuno per procedere all’intubazione, di norma quando non si rileva no risposte con una di queste due tecniche.
Mantenimento:
Con l’impiego di un agente non depolarizzante si assiste ad una lunga fase di blocco neuromuscolare in seguito all’intubazione nella quale non si rilevano risposte con le metodiche di registrazione sopra citate. Se il blocco è molto profondo la conta post tetanica è zero.
Dopo la cessazione del blocco la conta post tetanica aumenta.
La prima risposta delle quattro stimolazioni appare nel giro di pochi minuti dal momento in cui la conta post tetanica raggiunge il valore di 10.
Un adeguato grado di miorilassamento può essere ottenuto nonostante la presenza di due o tre risposte al TOF, sempre in presenza di un adeguato livello di anestesia.
Reversal:
l’antagonismo di un blocco neuromuscolare non dovrebbe essere iniziato se non almeno prima della comparsa di due, preferibilmente tre stimolazioni al TOF (o dopo riscontro di evidenti segni clinici di recupero della funzione neuromuscolare).
Recupero:
Un TOf ratio (T4/T1) maggiore o uguale di 0.8-0.9 è associato ad un buon recupero clinico.
L’utilizzo della stimolazione a doppia scarica permette di ottenere una sensibilità maggiore .
Tab 3 Interpretazione delle risposte alla stimolazione mediante TOF: Se èpresente una sola risposta al
TOF:
Blocco neuromuscolare del 90-95%
Miorisolusione sufficiente per
l’intubazione endotracheale anche a livelli superficiali di anestesia
(attenzione alle risposte autonome) Presenza di 2-3 risposte alla
stimolazione TOF:
Miorisoluzione chirurgica sufficiente se associata ad un buon piano anestesiologico
Ricomparsa della quarta risposta TOF
Blocco neuromuscolare del 60-65%
Nb:Per effettuare l’antagonismo farmacologico del blocco è preferibile che siano presenti almeno 3 risposte TOF (33)
Impiego del monitoraggio nella critical illness:
La sindrome da debolezza muscolare acquisita é una evenienza sfavorevole e piuttosto frequente nel paziente critico 1-6.
Questa situazione ha molteplici cause 1 ma principalmente e attribuibile a tre condizioni:polineuropatia e miopatia acquisite in corso di degenza in UTI e blocco neuromuscolare residuo 3, queste ultime due condizioni attribuibili all’uso degli bloccanti neuromuscolari.
Il monitoraggio strumentale della durata e della profondità del blocco è utile per ottimizzare le impostazioni terapeutiche nel singolo paziente e limitare le complicanze 1, 2, 7.
Tra le tecniche di stimolazione nervosa periferica disponibili, tuttavia il TOF si è rivelato il metodo più semplice ed affidabile nel contesto della terapia intensiva[1].
Nelle linee guida aggiornate al 2002(75), e nelle precedenti è raccomandato il monitoraggio mediante TOF in combinazione con la valutazione clinica per tutti i pazienti trattati con NMBA, e si è altresì visto che l’applicazione di queste linee guida è associata con una minore incidenza di episodi di debolezza muscolare residua.
In uno studio effettuato da Rudis (76) e colleghi i quali hanno assegnato in maniera randomizzata 77 pazienti che ricevevano vecuronio in infusione continua al monitoraggio TOF o alla valutazione clinica si è notato che il gruppo monitorizzato con TOF ha necessitato di minori quantità di farmaco, ha beneficiato di un ripristino più rapido del respiro spontaneo e all’interno di esso si sono registrati minori episodi di recupero tardivo (definito come un tempo > di 4 h tra stop del farmaco e ricomparsa del T4).
Limiti e svantaggi:
Per quanto riguarda limiti e potenziali svantaggi della metodica, ci possono essere problemi interpretativi, per esempio la presenza di perspirazione o edema tissutale può interferire con la stimolazione nervosa, e si può verificare una stimolazione diretta del muscolo che provoca una contrazione anche in presenza di blocco.
Inoltre un diverso approccio alla valutazione, per esempio uso di valutazione visiva piuttosto che tattile o un differente sito di stimolazione( per es. nervo faciale invece che ulnare) causare variabilità di interpretazione ed in questo senso il training del personale medico e infermieristico migliora notevolmente l’affidabilità della metodica (77). C’è inoltre una minore quantità di studi riguardo all’impiego di altri farmaci, per esempio atracurio e cisatracurio anche se comunque è lecito aspettarsi risultati analoghi.
REAZIONI AVVERSE E UTILIZZO NELLA PATOLOGIA D’ORGANO
L’impiego dei bloccanti neuromuscolari nella pratica clinica può essere gravato da effetti avversi, talora anche di una certa gravità, che comprendo tra gli altri apnea prolungata collasso cardiocircolatorio, effetti derivanti dall’eccessivo rilascio di istamina e, raramente anafilassi.
L’instaurarsi dell’insufficienza respiratoria nel postoperatorio è una condizione che può essere dovuta a diversi fattor correlati in maniera diretta (paralisi neuromuscolare persistente) o indiretta all’utilizzo dei bloccanti neuromuscolari.
Questi ultimi possono comprendere ostruzione delle vie aeree, diminuita paCO2 secondaria all’iperventilazione durante le procedure operatorie, o effetto depressogeno neuromuscolare dovuto a eccessivi livelli di di neostigmina impiegati per la conversione del blocco instaurato con antagonisti competitivi.
Fattori direttamente implicati possono essere alterazioni della temperatura corporea, del bilancio elettrolitico, in particolare del K+, bassi livelli di butirrilcolinesterasi plasmatiche, miastenia gravis latente (vedi dopo), ridotto flusso ematico scheletrico, ridotta clearance secondaria ad insufficienza renale.
Dovrebbe essere prestata pertanto una particolare attenzione nel somministrare questi farmaci pazienti disidratati, con squilibri elettrolitici e affetti da gravi patologie.
EFFETTI AL LIVELLO DEGLI ORGANI E APPARATI: Effetti cardiovascolari:
Vecuronio, pipecuronio, doxacurio, rocuronio posseggono trascurabili effetti cardiovascolari. Gli altri farmaci miorilassanti non depolarizzanti usati nella pratica clinica (pancuronio, atracurio, mivacurio) sono responsabili di qualche effetto cardiovascolare mediato da recettori del SNA, da recettori istaminici o da entrambi. La tubo curarina, e in misura
minore, metocurina, miuvacurio, atracurio possono causare ipotensione causata dalla liberazione di istamina, effetto che può essere attenuato dal pretrattamento con antistaminici.
Il pancuronio produce una modesta tachicardia dovuta all’effetto vagolitico e verosimilmente da altre interazioni sulla liberazione e sulla ricaptazione di noradrenalina dalle terminazioni nervose adrenergiche.
La succinilcolina al contrario può provocare effetti sia inotropo e cronotropo negativo, per la stimolazione dei i recettori colinergici, muscarinici al livello del nodo del seno(anch’essi attenuati dalla somministrazione di farmaci colinergici), che effetti inotropi e cronotropi positivi in somministrazioni ad alti dosaggi (7).
Altri effetti del blocco depolarizzante sono: iperkaliemia:
Durante la depolarizzazione prolungata le cellule muscolari possono rilasciare significative quantità di ioni K che viene scambiato con Na, Cl e Ca.In pazienti che hanno subito estesi danni tissutali la iperpotassiemia indotta dalla succuinilcolina può essere fatale, pertanto ci sono molteplici condizioni nelle quali l’uso della succinilcolina e controindicato o deve essere preso in considerazione con grande attenzione (Goodman &Gilmann pg 6), tra le quali trauma, ustioni, danni nervosi, affezioni neuromuscolari. A causa degli arresti cardiaci indotti presumibilmente dall’iperpotassiemia, nel 1993 la FDA decise di controindicarne l’uso nei pazienti pediatrici.
Il divieto fu successivamente convertito in controindicazione relativa dal momento che non erano disponibili valide alternative alla succinilcolina nelle condizioni che richiedono induzioni rapide.
Aumento della pressione endooculare:
Questo effetto si verifica in meno di un minuto dopo la somministrazione endovenosa è massimale dopo 2-4 minuti e cala dopo 5 minuti, nonostante ciò non sussiste la controindicazione per interventi oftalmologici salvo che la camera anteriore debba rimanere aperta
Di entità compresa tra 5 e 40 cm H20 indotto dalle fascicolazioni in pazienti con muscolatura particolarmente sviluppata, può causare vomito con aspirazione del contenuto gastrico in soggetti con ritardato svuotamento gastrico(diabetici, obesi)
dolore muscolare:
sequela post operatoria lamentata frequentemente dai pazienti;è difficile valutare se il ruolo giocato dalla succinilcolina nella sua patogenesi sia determinante o sussistano altri fattori (Katsung pag 438-439)
INTERAZIONI CON ALTRI FARMACI: Anestetici inalatori:
Gli anestetici per via inalatoria potenziano il blocco neuromuscolare da miorilassanti non depolarizzanti con un meccanismo dose dipendente. Riguardo ai comuni anestetici impiegati nella pratica clinica il potenziamento da alotano è maggiore;
seguono sevofurano, desfurano, enflurano e alotano.
I meccanismi più importanti che sono implicati sono la depressione al livello del sistema nervoso al livello dei siti prossimali alla giunzione neuromuscolare e l’aumento del flusso ematico vascolare dovuto a vasodilatazione periferica che si traduce in un migliore raggiungimento da parte del farmaco dei siti effettori.
Antibiotici:
Molti antibiotici, in particolare gli amminoglicosidi, causano una riduzione della liberazione di acetilcolina simile a quella indotta dal magnesio: i meccanismi sembrano essere:blocco dei canali del calcio di tipo p pregiunzionale, e attività post.giunzionale
La maggior parte degli anestetici locali a dosaggi elevati blocca la trasmissione neuromuscolare mentre a dosaggi inferiori potenziano il blocco neuromuscolare provocato da entrambe le classi di miorilassanti. A basse dosi gli anestetici locali deprimono il potenziale post tetanico mentre a dosi più elevate gli anestetici locali bloccano le contrazioni muscolari indotte dall’acetilcolina, per il blocco dei canali ionici legati ai recettori nicotinici.
Altri bloccanti neuromuscolari:
Gli effetti depolarizzanti della succinilcolina possono essere antagonizzati dai bloccanti non depolarizzanti.
È possibile associare basse dosi di un bloccante neuromuscolare (es 0, 5 mg di pancuronio) onde ridurre le fascicolazioni indotte dalla succinilcolina, anche se ciò necessita l’aumento di un 50-90% della dose di farmaco e può causare sensazione di debolezza muscolare, per cui questa pratica non è eseguita di routine.
REAZIONI AVVERSE ALL’USO DEI BLOCCANTI NEUROMUSCOLARI
Reazioni avverse in corso di miastenia grave :
La miastenia grave (o la sindrome miastenica che si verifica in corso di sindrome di Lambert Eaton secondaria a carcinoma polmonare a piccole cellule ) causata da anticorpi verso il recettore dell’acetilcolina aumenta notevolmente il blocco neuromuscolare indotto da questi farmaci.
Nell’età avanzata si assiste ad una riduzione della loro clearance e conseguentemente una più lunga durata d’azione .
Una diminuzione dell’effetto farmacologico si verifica invece in pazienti con gravi ustioni e quelli con interessamento dei motoneuroni superiori, verosimilmente per una proliferazione dei recettori extragiunzionali che competono anch’essi per il legame al farmaco, per cui si necessita di dosaggi maggiori(7).
Ipertermia maligna:
È una condizione potenzialmente mortale scatenata dalla somministrazione
di certi tipi di anestetici e bloccanti neuromuscolari. Le caratteristiche cliniche includono spasmi muscolari, rigidità, ipertermia severa, acidosi metabolica tachicardia, fenomeni conseguenti ad un massiccio aumento del metabolismo muscolare, il cui evento scatenante è il rilascio incontrollato di calcio dal reticolo endoplasmatico.
I farmaci implicati sono gli anestetici inalatori(specie gli idrocarburi alogenati alotano, isofurano, sevofurano) e la succinilcolina ma anche associazioni farmacologiche di bloccanti non depolarizzanti e anestetici. È stata descritta una suscettibilità all’ipertermia maligna un tratto autosomico dominante che èassociato con certe miopatie congenite come la “central core disease”, e sono state identificate oltre 20 mutazioni del recettore RYR-1 e del canale l al Ca2+voltaggio dipendente (34) (35).La terapia comprende somministrazione endovenosa di dantrolene che inibisce il rilascio di Ca2+ dal reticolo sarcoplasmatico limitando la capacità del calcio stesso e della calmodulina di attivare RYR-1 (36).
Terapie aggiuntive possono essere il rapido raffreddamento, ossigenoterapia e controllo dell’acidosi.
Pazienti con altre miopatie o distonie muscolari hanno altresì una aumentata incidenza di ipertermia .La somministrazione di succinilcolina nei pazienti suscettibili induce rigidità nel muscolo massetere(condizione per la quale è stata individuata una mutazione del canale Na voltaggio-dipendente (37)) che può complicare l’intubazione e il controllo delle vie aeree, e può costiture un segno precoce di insorgenza di ipertermia maligna.
Sindrome miopatica acuta quadriplegica(AQMS):
Questa sindrome è una delle cause di debolezza acquisita in pazienti ricoverati in reparti di terapia intensiva che è stata associata all’utilizzo prolungato di bloccanti neuromuscolari, di solito in concomitanza con l’assunzione di corticosteroidi (70)(71).
È caratterizzata dalla debolezza persistente degli arti e del tronco con risparmio della muscolatura extraoculare .
Agli esami strumentali c’è il riscontro di abnormi potenziali composti motori in presenza di una normale conduzione senitiva[29].
I meccanismi implicati sono la diffusa necrosi muscolare che comporta elevati livelli plasmatici di creatinfosfochinasi (68) e perdita selettiva di miosina che è accompagnata dalla marcata riduzione dell’mRNA della miosina.
Sebbene sia stata riportata inizialmente con l’aminosteroide pancuronio e vecuronio è stata riscontrata anche una associazione con i composti benzilisochinolinici (71)(72)(73)(74).
Non è ancora chiaro se il monitoraggio con TOF allo scopo di evitare sovradosaggi non svolga un ruolo protettivo in quanto molti casi di AQMS insorgono nonostante l’impiego del monitoraggio strumentale.
UTILIZZO DEI REVERSAL:PROBLEMI E SOLUZIONI
Dopo la somministrazione di un bloccante neuromuscolare, è essenziale assicurare un adeguato ritorno alla normale funzionalità muscolare.
Il recupero della normale funzione neuromuscolare dipende da diversi fattori, ciascuno dei quali deve condurre ad un incremento relativo della concentrazione di acetilcolina rispetto quella del miorilassante al livello della placca neuromuscolare in modo che quest’ultima sia in grado di spiazzare il bloccante neuromuscolare.
Il primo fattore è rappresentato dalla continua diffusione del miorilassante dalla placca neuromuscolare verso la circolazione sistemica e la sua ridistribuzione del farmaco.
Il secondo fattore invece è la sua eliminazione dall’organismo.
I bloccanti neuromuscolari possono essere eliminati in diversi modi, tra cui escrezione della sostanza immodificata nelle urine, metabolismo epatico, idrolisi enzimatica.
Inoltre altri fattori secondari sono in grado di influire sul recupero spontaneo della funzione neuromuscolare.
L’utilizzo anestetici inalatori può, come precedentemente discusso, potenziare il blocco neuromuscolare e prolungare il tempo di recupero, e la presenza di acidosi, ipokaliemia, ipotermia possono anch’essi potenziare il blocco neuromuscolare e rendere l’antagonismo farmacologico più difficile. I farmaci comunemente usati per antagonizzare il blocco neuromuscolare appartengono alla classe farmacologica degli inibitori dell’enzima acetilcolinesterasi.
Tre di questi farmaci:neostigmina, edrofonio e piridostigmina, sono comunemente impiegati nella pratica clinica.
Il loro meccanismo d’azione è costituito primariamente dalll’inibizione dell’enzima acetilcolinesterasi che aumenta la concentrazione di acetilcolina al livello della placca neuromuscolare
In condizioni normali la potente attività catalitica di questo enzima fa sì infatti che vengano catalizzate ben 4000 molecole di Ach per ogni sito attivo al secondo (82), e grosso modo metà della acetilcolina rilasciata è idrolizzata al livello del vallo prima di raggiungere i recettori della Ach . La porzione attiva dell’enzima è composta da due siti:il sito anionico, la cui funzione di legare e orientare l’Ach, ed il sito esterasico, che è responsabile del processo idrolitico(83).
È stato proposto anche un secondo sito anionico, chiamato sito periferico(84).
La neostigmina e la piridostigmina agiscono trasferendo un gruppo carbamminico all’enzima acetilcolinesterasi, il quale forma un legame covalente con il sito esterasico.
L’edrofonio invece si lega sia al sito anionico che a quello esterasico:al primo mediante attrazione elettrostatica, al secondo con una legame ad idrogeno(85).