Indice
Introduzione………...……..1 I FLAVONOIDI………….………1 LA QUERCETINA………2 Farmacocinetica ………..……… 4 Farmacodinamica ………...10LA QUERCETINA NELLA LEISHMANIOSI………13
Protocolli terapeutici……….………...16
Effetti e farmacodinamica………..17
L’ESPERIDINA………20
Presenza nei prodotti farmaceutici ed effetti………20
Farmacocinetica………...23
Scopo della tesi………...29
Materiali e metodi……….………..30
MATERIALI………...30
METODI………...31
Preparazione delle soluzioni standard……….31
Preparazione di una delle fasi mobili………..32
Metodo analitico hplc…….……….32
Rette di taratura………...33
Sperimentazione animale……….………33
Estrazione di quercetina dal plasma……….………. 34
Estrazione di esperidina dal plasma………35
Validazione del metodo………...35
Risultati……….. ...38
OTTIMIZZAZIONE DEL METODO ANALITICO…………..……….40
RETTA DI CALIBRAZIONE DELLA QUERCETINA…….………47
RETTA DI CALIBRAZIONE DELL’ESPERIDINA……….……….48
RISULTATI FARMACOCINETICI………49
Discussione e conclusioni...…………53
Introduzione
I FLAVONOIDI
I flavonoidi costituiscono un’ampia classe di composti fenolici distribuiti in modo ubiquitario in tutto il regno vegetale (Bruni, 1999). Essi sono metaboliti secondari ed in quanto tali non ricoprono un ruolo ben specifico e riconosciuto nel metabolismo della pianta. Tuttavia si è evidenziato che possono svolgere compiti utili come difendere da erbivori e microrganismi o attrarre animali per favorire l’impollinazione e la disseminazione.
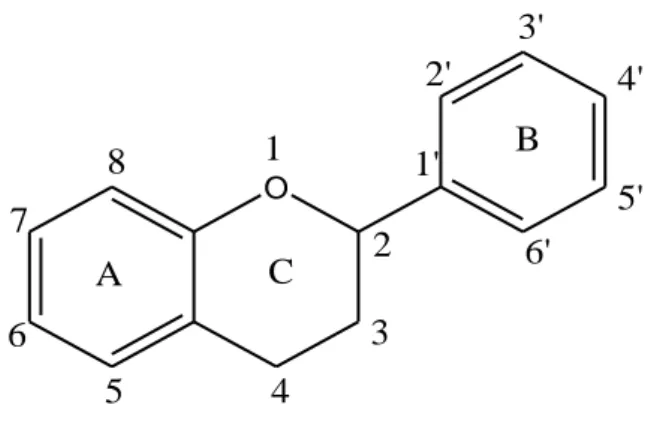
I flavonoidi derivano da prodotti delle vie dell’acido scichimico e dell’acido malonico. Sono costituiti da due anelli aromatici uniti insieme da un anello piranico centrale. In Figura 1 viene mostrato lo scheletro base dei flavonoidi (Maugini et al., 2006). O A C 3 5 6 7 1' 2' 4' 5' 4 B 6' 8 1 2 3'
Figura 1. Scheletro base dei flavonoidi (Maugini et al.,2006).
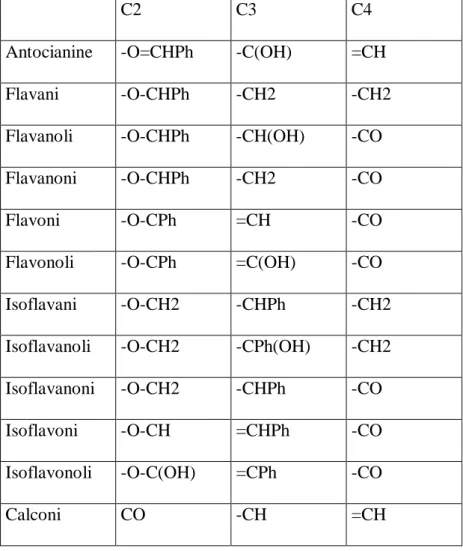
I flavonoidi vengono classificati in base alla diversa funzionalizzazione dell’anello C come mostrato in Tabella 1 (Bruni, 1999).
C2 C3 C4
Antocianine -O=CHPh -C(OH) =CH
Flavani -O-CHPh -CH2 -CH2
Flavanoli -O-CHPh -CH(OH) -CO
Flavanoni -O-CHPh -CH2 -CO
Flavoni -O-CPh =CH -CO
Flavonoli -O-CPh =C(OH) -CO
Isoflavani -O-CH2 -CHPh -CH2
Isoflavanoli -O-CH2 -CPh(OH) -CH2
Isoflavanoni -O-CH2 -CHPh -CO
Isoflavoni -O-CH =CHPh -CO
Isoflavonoli -O-C(OH) =CPh -CO
Calconi CO -CH =CH
Tabella 1. Classificazione dei flavonoidi in base alla sostituzione nell’anello centrale (Bruni, 1999).
All’aumentare della coniugazione corrisponde un incremento della colorazione, secondo la sequenza flavani (incolori), flavoni (gialli) ed antociani (rossi/violacei) (Bruni, 1999).
LA QUERCETINA
Tra i flavonoli troviamo la quercetina (Figura 2) in cui il C2 fa un legame singolo con l’O in posizione 1 ed è legato ad un sostituente fenolico, il C3 instaura un doppio legame con il C2 e lega un gruppo ossidrile, e il C4 dà luogo ad un gruppo chetonico.
O HO OH OH OH OH O 7 5 1 2 4 8 6 1' 2' 3' 4' 5' 6' 3 Figura 2. Quercetina.
La quercetina è presente nelle piante principalmente come O-glicoside ed è legata a zuccheri come il glucosio, il galattosio o il ramnosio (Bravo, 1998).
In particolare questo flavonolo si trova nel thè sotto forma di rutina (Figura 3 A) e nelle cipolle come spireaoside (Figura 3 B) (Erlund et al., 1999).
O HO OH O OH OH O 4' 3' 5 7 glucosio-ramnosio 3 Figura 3 A. Rutina. O HO OH OH OH O glucosio O 3' 4' 5 7 3 Figura 3 B. Spireaoside.
I glucosidi della quercetina si trovano nelle mele, nei broccoli e specialmente nelle cipolle con un’abbondanza di 0,25-0,50 g/kg (Hertog et al., 1993).
Dal punto di vista farmacoterapico si pensa che la quercetina abbia vari effetti benefici tra cui la prevenzione del cancro, l’arresto dell’infiammazione o la diminuzione dell’assorbimento dei grassi (Yang et al., 2008).
Alcuni studi hanno dimostrato che tale sostanza naturale esercita vasodilatazione a livello sia sistemico che coronarico ed effetti antiaggreganti in vitro (Gryglewski et al.,1987; Duarte et al., 1993; Perez-Vizcaino et al., 2002). Inoltre la quercetina riduce la pressione sanguigna, gli stati ossidativi e i danni provocati dall’ipertensione in modelli animali, compresi ratti che spontaneamente presentavano questa patologia (Duarte et al., 2001; Sanchez et al., 2006; Macha e Mustafa, 2005; Romero et al., 2010).
La quercetina, se assunta regolarmente, riduce anche la pressione sanguigna in soggetti ipertesi di grado 1 (Edwards et al., 2007), tuttavia non ci sono studi che ne analizzano gli effetti acuti in seguito a somministrazione orale (Galindo et al., 2012). Recentemente è stata testata anche la sua attività leishmanicida (da Silva et al., 2012).
Farmacocinetica
In seguito all’ingestione, la quercetina è assorbita rapidamente e viene metabolizzata a coniugati glucuronati e solfato.Tra i metaboliti si trovano l’isoramnetina (Figura 4) ed il kemferolo (Figura 5).
O HO OH OCH3 OH OH O Figura 4. Isoramnetina HO OH OH O OH O Figura 5. Kemferolo
Tali composti rappresentano rispettivamente il 10% ed il 2% dei prodotti metabolici individuabili nel plasma canino (Reinboth et al., 2010).
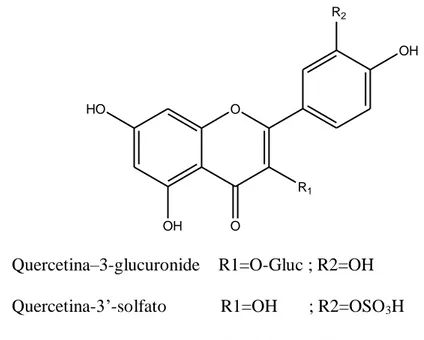
Per quanto riguarda invece i glicosidi della quercetina assunti con la dieta, questi sono rapidamente idrolizzati a livello dell’intestino tenue o dall’attività batterica nel colon per dare luogo all’aglicone. La quercetina assorbita è velocemente coniugata con acido glucuronico e gruppi solfato durante il metabolismo di primo passaggio, inoltre parte dei metaboliti subisce metilazione. Nel ratto e nell’uomo i metaboliti maggiormente prodotti sono la quercetina-3-glucuronide, la quercetina-3’-solfato e l’isoramnetina-3-glucuronide le cui strutture sono mostrate in Figura 6, mentre l’aglicone non è generalmente identificabile (Manach et al., 1998; Scalbert e Williamson, 2000; Day et al., 2001; Mullen et al., 2006).
O R1 OH HO R2 OH O
Quercetina–3-glucuronide R1=O-Gluc ; R2=OH Quercetina-3’-solfato R1=OH ; R2=OSO3H
Isoramnetina-3-glucuronide R1=O-Gluc ; R2=OMe
Figura 6. Quercetina-3-glucuronide, quercetina-3’-solfato e isoramnetina-3-glucuronide.
In seguito al metabolismo l’attività biologica della quercetina è solitamente ridotta, tuttavia per alcuni metaboliti è stata riportata un’attività antiossidante (Williamson e Manach, 2005; Lodi et al., 2008; Lodi et al., 2009).
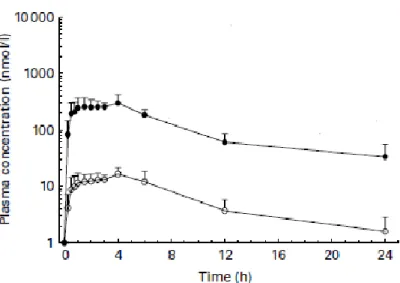
Nel contesto di uno studio sui cani Beagle a cui è stata somministrata quercetina per via orale in una dose di 10 mg/kg di peso corporeo, la concentrazione plasmatica di questa sostanza naturale risulta apprezzabile entro 15 minuti dall’ingestione ad una concentrazione che supera di un ordine di grandezza quella di un proprio metabolita, ovvero l’isoramnetina. In Figura 7 sono visualizzabili gli andamenti della concentrazione plasmatica della quercetina e dell’isoramnetina .
Figura 7. Curve della concentrazione plasmatica di quercetina ( puntini neri) e di isoramnetina (
puntini bianchi) dopo somministrazione per via orale di quercetina in dose di 10 mg/kg corporeo (Reinboth et al., 2010). .
La curva delle concentrazioni plasmatiche vs tempo mostra la presenza di due Cmax: una entro un’ora dalla somministrazione e una, di concentrazione maggiore dopo quattro ore; dopodiché si ha un progressivo decremento nell’arco delle ventiquattro ore. Dall’analisi farmacocinetica sono state ricavate un’AUC di 185,0 min mol/l ed una biodisponibilità assoluta del 3,8 % (Reinboth et al., 2010).
Per quanto riguarda l’eliminazione, fino al 40% del flavonolo è eliminato attraverso la bile durante il metabolismo di primo passaggio (Crespy et al., 2003).
Un recente studio condotto da Zhao e colleghi (2011) ha posto l’attenzione sul grano saraceno (Fagopyrum tataricum Gaertn.) che è ampiamente utilizzato, specialmente in alcuni paesi asiatici, nella dieta quotidiana e nella medicina tradizionale.
E’ stato dimostrato che i principali componenti chimici di questa pianta sono flavonoidi come la quercetina ed i suoi glicosidi tra cui la rutina e la quercitrina (Wang et al., 2009; Fabjan et al., 2003; Kreft et al., 1999; Steadman et al., 2000; Zielinski e Kozlowska, 2000; Chen et al., 2009).
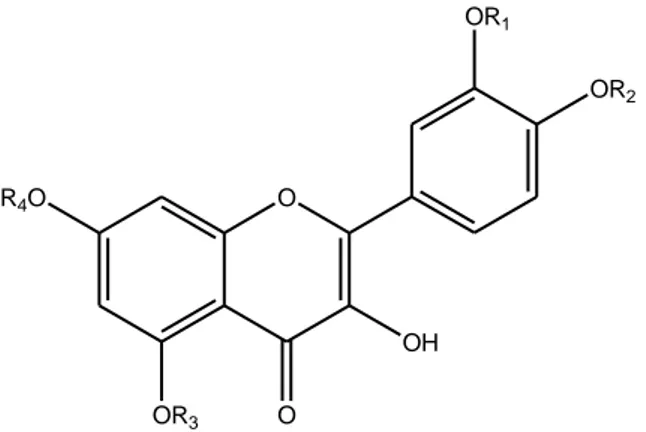
Zhao e colleghi (2011), nel contesto di una sperimentazione sui ratti a cui veniva somministrata una singola dose orale di estratto di Fagopyrum tataricum Gaertn. (60, 120 o 240 mg/kg), hanno studiato il profilo farmacocinetico della quercetina totale. La forma agliconica totale nel plasma è stata quantificata da Zhao e colleghi (2011) attraverso un metodo analitico che fa ricorso agli enzimi sulfatasi e β-glucuronidasi che scindono le coniugazioni di fase II che avvengono a vari livelli della molecola (Mochizuchi et al., 2004; van der Woude et al., 2004; Moon et al., 2001; Morand et al., 1998; Moore et al., 1991; Janish et al., 2004) come riportato in Figura 8.
O OR1 OR2 OH OR3 R4O O
R1, R2, R3, R4 = H, acido glucuronico, solfato o glucosio
Figura 8. Coniugazioni di fase II della quercetina (Mochizuchi et al., 2004; van der Woude et al.,
2004; Moon et al., 2001; Morand et al., 1998; Moore et al., 1991; Janish et al., 2004).
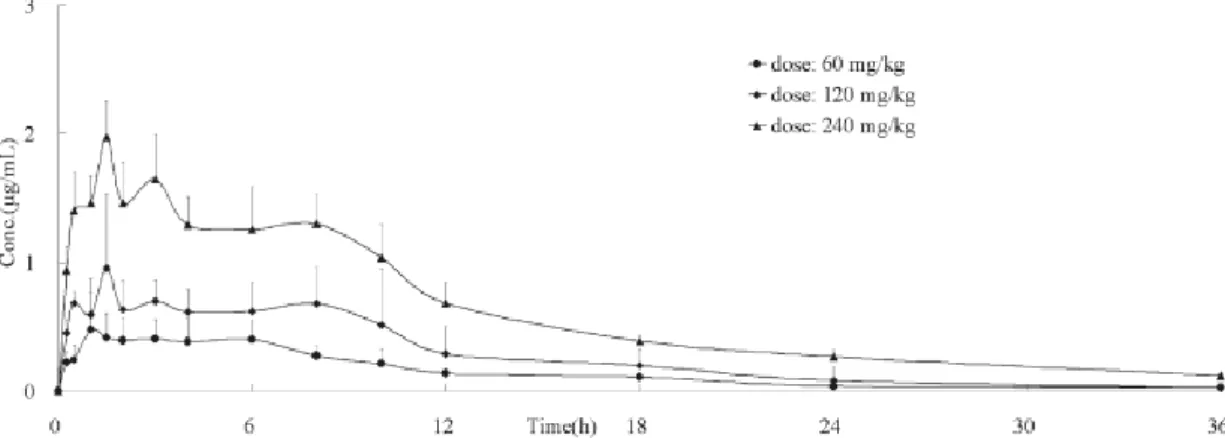
Zhao e colleghi (2011) hanno osservato in seguito a singola dose orale di estratto di grano saraceno, corrispondente a somministrazione di rutina e quercetina in rapporto di circa 4:1, le seguenti curve concentrazione vs tempo (Figura 9).
Figura 9. Curve concentrazione vs tempo della quercetina totale dopo tre differenti singole dosi orali
di estratto di grano saraceno (Zhao et al., 2011).
Come si può notare dalle curve si hanno picchi plasmatici multipli e valori di concentrazione massima di quercetina totale pari a 0,55, 1,10 e 2,05 µg/ml nel caso, rispettivamente, di bassa, media ed alta dose.
Il tempo in cui è raggiunta la concentrazione massima risulta essere 2,33, 2,75 e 2,50 h nel caso di somministrazione dei tre dosaggi crescenti di estratto di
Fagopyrum tataricum Gaertn. .
In seguito al raggiungimento del picco plasmatico, la concentrazione della quercetina totale diminuisce in maniera biesponenziale, con una fase terminale che inizia dopo 12 ore dalla somministrazione.
Altri principali parametri farmacocinetici che emergono dallo studio relativo al grano saraceno sono visibili in Tabella 2.
Tabella 2. Parametri farmacocinetici che emergono dallo studio di Zhao et al., 2011.
I risultati di AUC0-t, AUC0-∞, e Cmax suggeriscono l’instaurarsi di una relazione
Zhao e colleghi hanno anche confrontato il Tmax della quercetina totale, ottenuto dalla loro sperimentazione, con quello emerso da precedenti studi in cui non venivano somministrate contemporaneamente le forme agliconica e glicosidica (caso rappresentato dallo studio relativo all’estratto di grano saraceno), bensì l’una o l’altra.
E’ stato osservato che dopo singola somministrazione di quercetina, quest’ultima raggiunge rapidamente il picco plasmatico dopo 0,7 h circa, mentre nel caso di forme glicosidiche, come la rutina, il raggiungimento del picco è lento e avviene dopo circa 7 h (Moon et al., 2001; Erlund et al., 2000; Graefe et al., 2001).
La coesistenza della forma agliconica e glicosidica provoca variazioni significative nel tempo necessario a raggiungere la Cmax come emerge dai risultati citati precedentemente (2,33, 2,75 e 2,50 h).
Zhao e colleghi (2011) in base a questo confronto postulano che un diverso rapporto tra tale flavonolo ed una sua forma glicosidica, ovvero la rutina, possa generare un differente profilo farmacocinetico della quercetina totale stessa; essi offrono con questa ipotesi un interessante punto di partenza per studi futuri.
Farmacodinamica
Galindo e colleghi (2012) hanno ipotizzato il meccanismo d’azione alla base dell’attività antipertensiva mostrata dai glucuronidi della quercetina e dall’isoramnetina, prodotti in seguito alla somministrazione orale di quercetina. Questi autori postulano che il flavonolo potrebbe essere inizialmente inattivato durante l’assorbimento da reazioni di coniugazione e rilasciato alla parete arteriosa infiammata; a questo punto, a livello delle cellule del muscolo liscio vascolare, i metaboliti verrebbero convertiti ad aglicone. Le suddette considerazioni sono in accordo con l’ipotesi che i glucuronidi dei flavonoidi fungano da metaboliti di
trasporto attraverso il plasma verso target cellulari piuttosto che solamente coinvolti in processi di escrezione (Galindo et al., 2012).
I target più plausibili per il rilasciamento della muscolatura liscia vascolare includono le proteinchinasi coinvolte nella regolazione dell’interazione actina -miosina, comprese la proteinchinasi C, la chinasi delle catene leggere della miosina oppure la Rho chinasi e probabilmente il canale del potassio (Pèrez-Vizcaino et al., 2002; Duarte et al., 2001; Duarte et al., 1994; Cogolludo et al., 2007).
Per quanto riguarda l’azione della quercetina nei confronti dei tumori, Kang e colleghi (2011) hanno dimostrato la capacità di tale flavonolo di inibire la crescita tumorale in varie linee cellulari.
Il relativo meccanismo d’azione ipotizzato è da una parte l’inibizione dell’EGF (fattore di crescita dell’epidermide), dell’NF-B (fattore nucleare B), della ciclina D e della tirosina chinasi, tutti fattori che favoriscono la progressione del tumore, dall’altra l’incremento delle caspasi che possono indurre apoptosi (Aggarwal e Shishodia, 2006; Gulati et al., 2006; Mertens-Talcott et al., 2005).
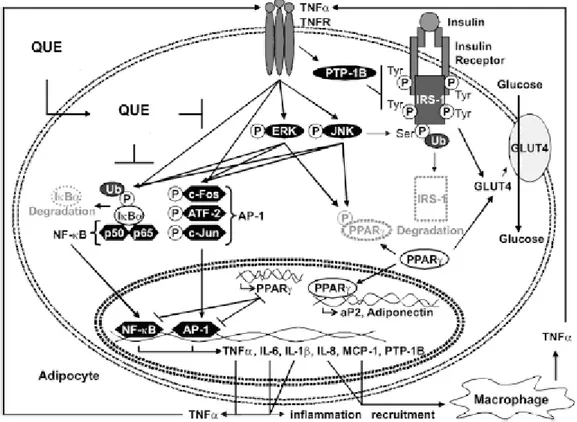
Per quanto concerne l’effetto antinfiammatorio della quercetina, Chuang e colleghi (2010) hanno proposto il seguente modello (Figura 10).
Figura 10. Modello proposto da Chuang e colleghi (2010) per gli effetti della quercetina in adipociti
umani primari.
Essi hanno dimostrato che la quercetina diminuisce l’espressione genica dell’IL-6, IL-1β, IL-8 e dell’MCP-1 (proteina chemiotattica per i monociti) e la secrezione dell’IL-6, IL-8 e dell’MCP-1 in modo dose-dipendente.
Inoltre Chuang e colleghi (2010) hanno studiato l’effetto di tale flavonolo sulla fosforilazione di MAPK (MAP-chinasi; proteina attivata da mitogeni) come ERK (chinasi regolata da segnali extracellulari) e JNK (chinasi c-Jun N-terminale), le quali intervengono nell’attivazione dei fattori di trascrizione che inducono l’espressione di geni coinvolti nella risposta infiammatoria. Effettivamente la quercetina provoca la diminuzione della fosforilazione delle ERK e JNK.
Tale flavonolo si è inoltre rivelato capace di impedire l’attivazione di c-Jun, un componente di AP-1 (proteina 1 d’attivazione), evitando la fosforilazione mediata da TNF-α (fattore di necrosi tumorale-).
Nello studio preso in considerazione è stata anche dimostrata la proprietà della quercetina di inibire la resistenza insulinica mediata dal TNF-α, valutando vari fattori tra cui la fosforilazione di un residuo di serina nel relativo recettore.
I risultati descritti dimostrano che tale flavonolo è in grado di contrastare l’infiammazione e la resistenza insulinica in adipociti umani primari, mediate dal TNF-α (Chuang et al., 2010).
LA QUERCETINA NELLA LEISHMANIOSI
La quercetina è stata anche oggetto di studi riguardanti le infezioni da Leishmania. La leishmaniosi è una malattia infiammatoria cronica della cute, delle mucose, o degli organi interni causata da parassiti intracellulari obbligati dell’ordine dei Kinetoplastidi, trasmessi tramite il morso di insetti vettori ematofagi infetti (McAdam e Sharpe, 2006). La leishmaniosi è endemica in tutto il Medio Oriente, nell’Asia del Sud, in Africa ed in America Latina (Magill, 1995).
Il ciclo vitale di Leishmania comprende due forme: il promastigote, che si sviluppa e vive in ambiente extracellulare nel vettore flebotomo, e l’amastigote, che si moltiplica nel citoplasma dei macrofagi dell’ospite. Il serbatoio naturale di
Leishmania è rappresentato dai mammiferi, inclusi i roditori, i cani e le volpi.
Quando gli insetti vettori pungono uomini o animali infetti, ingeriscono macrofagi che contengono gli amastigoti. Gli amastigoti si differenziano in promastigoti e si moltiplicano nel canale alimentare del flebotomo migrando poi al faringe, dove rimangono fino ad essere iniettati nell’ospite successivo con la puntura dell’insetto vettore (McAdam e Sharpe, 2006).
Quando il flebotomo infetto punge un soggetto, i promastigoti, che sono sottili e flagellati, vengono rilasciati nel derma dell’ospite unitamente alla saliva del vettore, che potenzia l’infettività del parassita (Titus e Ribeiro, 1988) .
I promastigoti vengono fagocitati dai macrofagi e l’acidità presente all’interno del fagolisosoma li induce a trasformarsi in amastigoti rotondeggianti senza flagelli, ma che presentano un mitocondrio contenente DNA, chiamato chinetoplasto (Zilberstein e Shapira, 1994).
Gli amastigoti proliferano all’interno dei macrofagi che, andando in apoptosi, liberano gli amastigoti che a loro volta possono infettare altri fagociti.
Le diverse specie di Leishmania provocano quattro differenti lesioni nell’uomo: a) viscerale, b) cutanea, c) mucocutanea e d) cutanee diffuse.
a) Nella leishmaniosi viscerale, provocata da L.donovani o L.chagasi, i parassiti invadono i macrofagi di tutto il sistema monocitico-macrofagico e provocano una grave malattia sistemica caratterizzata tra l’altro da epatosplenomegalia. La massiccia infezione delle cellule fagocitiche predispone il paziente a superinfezioni batteriche che sono in genere la causa di morte.
b) La leishmaniosi cutanea, causata da L.major, L.mexicana e L.braziliensis, è una malattia relativamente lieve e localizzata che produce una singola ulcera che guarisce per involuzione in 6 mesi senza trattamento.
c) Nella leishmaniosi mucocutanea causata da L. braziliensis si possono sviluppare lesioni ulcerate o no a livello per esempio della laringe o delle giunzioni mucocutanee del setto nasale. Successivamente le lesioni regrediscono e cicatrizzano, sebbene sia possibile una riattivazione dopo lunghi intervalli di tempo. d) La leishmaniosi cutanea diffusa è una rara forma di infezione cutanea e si diffonde a tutto il corpo. Le lesioni non si ulcerano in questo caso e spesso hanno scarsa risposta alla terapia (McAdam e Sharpe, 2006).
Per quanto riguarda la leishmaniosi canina, anche se il quadro clinico caratteristico ha portato nel passato a separare la forma cutanea da quella viscerale, oggi entrambe
sono considerate forme evolutive della medesima malattia, indicata con il nome di leishmaniosi canina generalizzata.
Le due specie responsabili della leishmaniosi canina sono Leishmania infantum (L.
donovani infantum) e Leishmania chagasi (L. donovani chagasi). Esistono altre
specie come L. tropica, L. braziliensis ed L. mexicana che possono provocare lesioni cutanee e/o mucocutanee nel cane, senza però coinvolgimento viscerale.
La patogenesi della leishmaniosi canina non è stata finora adeguatamente chiarita ed i meccanismi patogenetici sono spesso estrapolati dagli studi condotti sull’uomo e sugli animali da laboratorio. Per quanto riguarda la capacità degli amastigoti di sopravvivere nei macrofagi e disseminarsi nell’organismo, rivestono un ruolo fondamentale sia fattori intrinseci al parassita, sia fattori legati al tipo di risposta immunitaria cellulo-mediata che viene elaborata dall’ospite. Infatti i macrofagi invasi dai parassiti, se adeguatamente stimolati dai linfociti T helper (Th), sono in grado di produrre numerosi enzimi lisosomiali ed altri fattori come il superossido, il perossido di idrogeno e l’ossido di azoto (NO), che sono tossici per il parassita. Recenti studi in
vitro hanno tuttavia dimostrato che diversi glicofosfolipidi e proteine strutturali di Leishmania sono in grado di inibire l’attività ossidativa dei macrofagi, diminuendo la
produzione di metaboliti tossici.
Negli animali da laboratorio la resistenza all’infezione da Leishmania è caratterizzata dalla risposta Th1, con la produzione di IL-12, IFN- e attivazione dei macrofagi che eliminano il parassita. Al contrario, negli animali sensibili all’infezione, la risposta è del tipo Th2, caratterizzata dalla produzione di IL-4 e IL-10 con conseguente soppressione dell’attività parassiticida dei macrofagi e la stimolazione dei linfociti B con l’aumento della produzione di immunoglobuline.
La sintomatologia della leishmaniosi canina è estremamente variabile e può comprendere linfoadenopatia periferica (oltre il 90% dei soggetti infetti), lesioni
cutanee (>80%), congiuntivite cronica (50%), onicogrifosi (40%), anoressia (>35%), aumento dell’appetito (30%), febbre (20%), insufficienza renale (20%), epistassi (10%), uveite (8%) e disturbi di deambulazione (6%). Anche se l’animale colpito in genere presenta una combinazione di più segni clinici, è possibile osservare anche un solo sintomo (per esempio la congiuntivite). Il cane spesso presenta il mantello opaco e condizioni generali precarie. Alcuni cani mostrano segni di cachessia, debilitazione e debolezza. Molti soggetti dimagriscono nonostante un aumento dell’appetito. L’anoressia in genere colpisce gli animali con insufficienza renale.
La febbre è stata segnalata in diversi casi di Leishmania ed è dovuta ad infezioni secondarie. I segni cutanei sono tra i più importanti della malattia. Vengono descritte dermatiti di vario tipo, tra cui la forma esfoliativa è quella più frequentemente riscontrata. Quest’ultima colpisce la zona perioculare, il padiglione auricolare ed il dorso del naso, per estendersi al resto del corpo. La dermatite è caratterizzata dalla presenza di squame forforacee biancastre. Le lesioni ulcerative si presentano tipicamente sulle prominenze ossee ed i cuscinetti plantari (Urquhart et al., 2007).
Protocolli terapeutici
Applicando corretti protocolli terapeutici è possibile controllare i segni clinici dell’infezione per periodi anche prolungati ed in certi casi è possibile raggiungere la guarigione clinica. I farmaci impiegati nella terapia di Leishmania sono gli antimoniali pentavalenti, l’aminosidina, l’allopurinolo e l’amfotericina B.
L’antimoniato di N-metilglucamina è il farmaco più frequentemente utilizzato nella leishmaniosi canina. Se la sintomatologia non scompare dopo sei settimane di terapia, è probabile che il protozoo sia resistente al farmaco e sarà necessario ricorrere ad altri farmaci.
L’allopurinolo è dotato di azione parassitostatica nei confronti di Leishmania. Tale farmaco può essere utile in casi di recidive della malattia. All’inizio della terapia è possibile associare l’antimoniato con l’allopurinolo per le prime 3-6 settimane, dopo di che si sospende l’antimoniato e si continua la somministrazione di allopurinolo. L’amfotericina B è un antibiotico polienico che si è dimostrato efficace contro
Leishmania nel corso di vari studi.
E’ importante ricordare che gli animali non raggiungono la guarigione parassitologica. Infatti i parassiti sono stati isolati da cani infetti anni dopo la terapia e la guarigione clinica. E’ probabile che i protocolli terapeutici attualmente impiegati permettano solo l’abbassamento della carica parassitaria, la scomparsa dei segni clinici e lo sviluppo di una risposta immunitaria più efficace nei confronti del protozoo (Urquhart et al., 2007).
Effetti e farmacodinamica
La quercetina ha un effetto leishmanicida sullo stadio di amastigote di Leishmania
donovani (Tasdemir et al., 2006) e di quella amazonensis (Muzitano et al., 2006 a, b)
e riduce la carica del parassita nelle cellule spleniche di criceto infettate da
Leishmania donovani (Sen et al., 2008).
L’azione della quercetina è da ricondursi all’inibizione che essa esercita nei confronti dell’enzima arginasi come hanno dimostrato da Silva e collaboratori (2012).
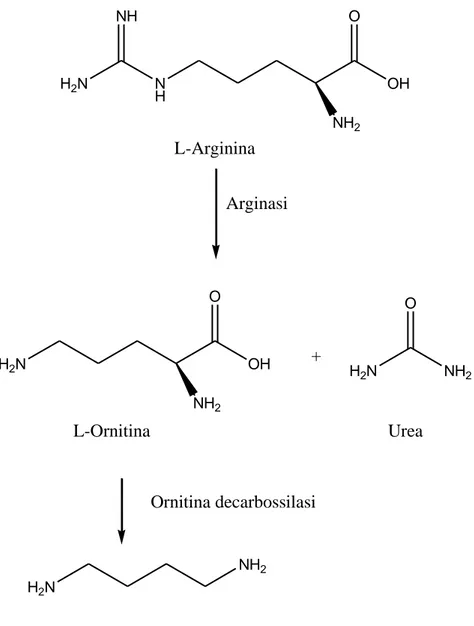
L’arginasi è il primo enzima che è coinvolto nella sintesi delle poliammine in
Leishmania e catalizza l’idrolisi della L-Arginina a L-Ornitina ed urea. La L-Ornitina
dà luogo, attraverso una decarbossilazione ad opera dell’enzima ornitina decarbossilasi, alla putresceina (Figura11). Quest’ultimo è un composto di tipo amminico da cui prosegue la sintesi delle poliammine (Vannier-Santos et al., 2008).
H2N N H OH NH2 NH O L-Arginina Arginasi H2N OH O NH2 + H2N NH2 O Ornitina decarbossilasi L-Ornitina Urea H2N NH2 Putresceina
Figura 11. Alcuni stadi della sintesi delle poliammine in Leishmania (Vannier-Santos et al., 2008).
La produzione di arginasi A1, una delle due isoforme conosciute nei mammiferi, può essere stimolata dai linfociti Th2 ed il risultante incremento dell’attività di tale enzima ha come risultato il decremento del suo substrato L-Arginina e della sintesi di NO, condizioni che favoriscono la proliferazione del parassita nei macrofagi. E’ importante sottolineare infatti che una diminuzione di L-Arginina è correlata con quella di NO, in quanto la prima costituisce il substrato dell’enzima NO sintetasi per produrre il secondo (Wanderley e Barcinsky, 2010).
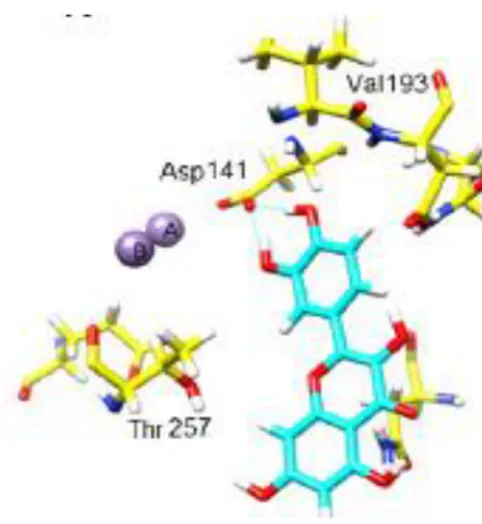
Le analisi di docking hanno mostrato che i due ossidrili catecolici della quercetina donano due legami a idrogeno all’Asp 141 del sito attivo dell’arginasi (Figura 12) nel caso di Leishmania amazonensis (da Silva et al., 2012).
Figura 12. Legami instaurati dalla quercetina nel sito attivo dell’arginasi nel caso di Leishmania amazonensis (da Silva et al., 2012).
Inoltre ad alte concentrazioni, come 150 M (45,3 mg/l), la quercetina linearizza il 40% dei minicircoli di kDNA, ovvero un aggregato di piccole molecole lineari di DNA che formano una rete estremamente ampia ad alto PM. Tale flavonolo esplica questa azione inducendo la topoisomerasi II e provocando apoptosi (Mittra et al., 2000).
La quercetina risulta essere un farmaco multitarget nel trattamento delle infezioni da
Leishmania in quanto agisce non solo sugli enzimi arginasi e topoisomerasi II, come
precedentemente affermato, ma anche sulla ribonucleotide reduttasi (Sen et al., 2008).
Tale composto, insieme ai flavonoidi, può quindi essere considerato un prototipo per il rational drug design, sulla base delle interazioni instaurate con i propri target (da Silva et al., 2012).
L’ESPERIDINA
Nell’ampia classe dei flavonoidi l’esperidina (Figura 13) risulta essere un flavanone in base al tipo di sostituzione che caratterizza il suo anello centrale. In quest’ultimo infatti il C2 presenta un legame singolo con l’O in posizione 1 ed è legato ad un sostituente fenolico; il C3 è di tipo metilenico; in ultima analisi il C4 dà luogo ad un gruppo chetonico. O O O OH OH OH CH3 OH OH OH O O OH O OH OCH3 7 8 6 5 4 3 2 2' 3' 4' 5' 6' Figura 13. Esperidina.
L’esperidina (3’-5,7-triidrossi-4’-metossiflavanone 7-ramnoglucoside) presenta come porzione non zuccherina l’aglicone esperetina, invece come parte zuccherina un rutinoside, unito alla restante struttura da un legame 7-O-glicosidico.
Questo flavanone è caratterizzato da un carbonio chirale, più precisamente il C2, che genera (R)- e (S)- enantiomeri.
L’esperidina è abbondante nei frutti degli agrumi e nei prodotti da essi derivati come i succhi (Gil-Izquierdo et al., 2001).
Presenza nei prodotti farmaceutici ed effetti
Per quanto riguarda la sua presenza nei prodotti farmaceutici, questo flavanone si ritrova per esempio nel DAFLON , un farmaco che contiene una frazione flavonoidica purificata e micronizzata, costituita da diosmina per il 90% ed esperidina per il restante 10%.
Questo farmaco è indicato come terapia adiuvante nel trattamento di varici, delle complicazioni flebitiche delle emorroidi e di quelle legate a stati di fragilità capillare. L’azione terapeutica dei flavonoidi può garantire una riduzione del rischio di ulcere venose, dell’edema e della sintomatologia associata, in pazienti affetti da patologia venosa di grado C4-C6 (Gohel e Davies, 2010).
Inoltre il trattamento con tale farmaco ha consentito a pazienti con insufficienza venosa di ottenere una riduzione del dolore e del fastidio agli arti inferiori (Ting et al., 2001).
I risultati di studi sperimentali condotti su cani e ratti hanno mostrato che Daflon 500 ® migliora il drenaggio linfatico (Foldi, 1999; Labrid, 1995), incrementando il flusso linfatico e la pulsatilità (Labrid, 1995; Cotonat e Cotonat, 1989). Inoltre la frazione flavonoidica micronizzata riduce significativamente la migrazione dei leucociti dalle venule post capillari al tessuto connettivo circostante durante un’occlusione venosa indotta sperimentalmente e successiva riperfusione (Takase et al., 1999; Friesenecker et al., 1994).
Il flavanone preso in esame ha effetti inibitori nei confronti di patologie in cui il fattore di necrosi tumorale (TNF-), una citochina prodotta dai monociti, riveste un ruolo fondamentale nell’induzione di risposte infiammatorie acute e croniche. Tali condizioni patologiche sono i) il diabete di tipo 2, ii) l’artrite reumatoide ed iii) infiammazioni che interessano l’intestino (Kawaguchi et al., 2011).
i) Effetti sull’obesità ed il diabete di tipo 2: l’infiammazione cronica, che in caso di obesità interessa il tessuto adiposo, provoca una ridotta secrezione di adiponectina ed aumento della secrezione di citochine infiammatorie come il TNF-, l’IL-6, l’IL-8 e la MPC-1, ovvero la proteina chemiotattica per i monociti. Si ha così un’esacerbazione dell’infiammazione vascolare. L’instaurarsi di questa condizione conduce ad un alterato effetto dell’insulina sul rilascio di acidi grassi liberi attraverso
la lipolisi e ad una disfunzione endoteliale che promuove il diabete di tipo 2 (Kawaguchi et al., 2011; Yang et al., 2009). Studi a riguardo hanno mostrato che l’assunzione di esperidina con la dieta, da una parte diminuisce i livelli di glucosio nel sangue, alterando l’attività enzimatica che regola il glucosio, dall’altra normalizza i livelli di lipidi ed adiponectina (Akiyama et al., 2010).
ii) Effetti inibitori sull’artrite reumatoide: tale patologia è caratterizzata da infiammazione cronica delle articolazioni sinoviali e da proliferazione e migrazione di sinoviociti. Si ha in questo contesto attivazione dei mastociti e produzione di
TNF-, IL-6 e IL-8. Inoltre i fibroblasti a livello sinoviale producono metalloproteasi di matrice che operano la distruzione delle articolazioni. Studi effettuati hanno mostrato che la somministrazione orale di esperidina attenua la sintomatologia del gonfiore e riduce l’indice artritico nei ratti (Kometani et al., 2008).
iii) Effetti inibitori su patologie infiammatorie dell’intestino: si fa riferimento a malattie infiammatorie croniche autoimmuni che interessano l’apparato gastrointestinale, come il morbo di Crohn e la colite ulcerosa, caratterizzate da un’impropria risposta immunitaria.
In tali condizioni patologiche l’epitelio intestinale può subire alterazioni a livello delle giunzioni strette, induzione dell’apoptosi ed essere interessato dall’insorgenza di ulcerazioni. Esso quindi risulta compromesso nelle proprie funzioni e contraddistinto da un incremento della captazione antigenica. Il TNF- è fondamentale sia nel morbo di Crohn che nella colite ulcerosa ed è coadiuvato nel primo caso dall’IFN- e nel secondo dall’ IL-3 (Dharmani e Chadee, 2008). Studi a riguardo hanno dimostrato che il trattamento con esperidina di ratti in cui è stata indotta colite ha diminuito l’indice di attività della patologia (Xu et al., 2009).
Farmacocinetica
Vari studi hanno dimostrato che l’esperidina somministata per via orale è idrolizzata dalle β-glucosidasi, dando luogo all’aglicone esperetina. Tale reazione avviene prima dell’assorbimento (Ameer et al., 1996; Matsumoto et al., 2004).
Più in particolare gli enzimi β-glucosidasi sono presenti a livello della microflora intestinale (Ameer et al., 1996; Garg et al., 2001; Matsumoto et al., 2004; Manach et al., 2003).
L’esperetina assorbita viene immediatamente metabolizzata a glucuronide e coniugati solfato nell’epitelio intestinale e nel fegato (Ameer et al., 1996; Matsumoto et al., 2004).
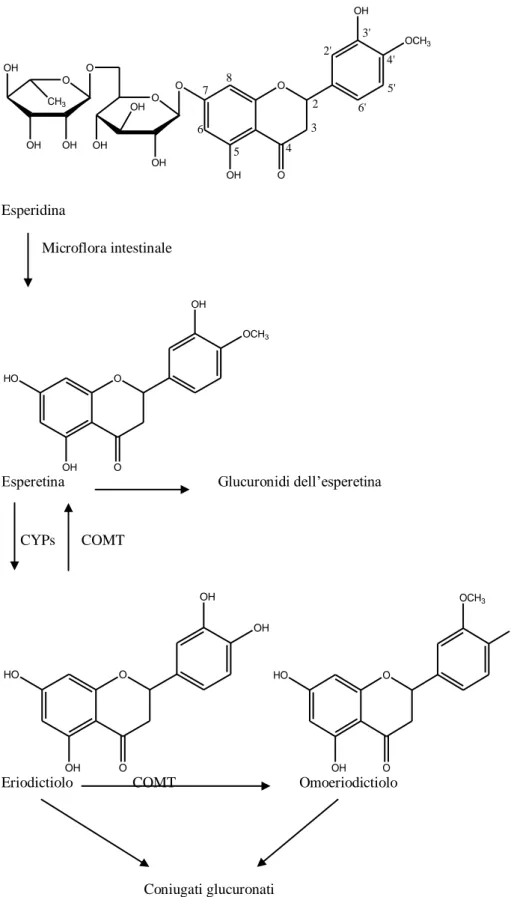
Matsumoto et al. (2004) hanno segnalato che i glucuronidi dell’esperetina e dell’omoeriodictiolo sono rilevati nel plasma di ratto in seguito a somministrazione orale del flavanone stesso. In Figura 14 è illustrata la via metabolica dell’esperidina dopo somministrazione orale.
O O O OH OH OH CH3 OH OH OH O O OH O OH OCH3 7 8 6 5 4 3 2 2' 3' 4' 5' 6' Esperidina Microflora intestinale O HO OH O OH OCH3
Esperetina Glucuronidi dell’esperetina
CYPs COMT O HO OH O OH OH O HO OH OCH3 OH O Eriodictiolo COMT Omoeriodictiolo
Coniugati glucuronati
Figura 14. Via metabolica dell’esperidina dopo somministrazione orale (Ameer et al., 1996; Garg et
al., 2001; Matsumoto et al., 2004; Manach et al., 2003).
In questo contesto Jin et al. (2010) hanno condotto uno studio sul ruolo critico che la microflora intestinale ricopre nel metabolismo e quindi nell’assorbimento del flavanone esperidina.
Jin et al. (2010) hanno sottoposto i ratti ad un trattamento antibiotico per poter rimuovere in maniera più completa possibile i batteri a livello intestinale.
Il modello animale che ne deriva è in effetti definito pseudo-germ-free a sottolineare che fattori come l’esposizione ambientale a batteri esogeni e la presenza di organismi antibiotico-resistenti possono impedire la totale assenza di batteri intestinali coinvolti nei processi farmacocinetici oggetto di studio.
Nonostante questo, il trattamento con antibiotici riesce comunque a creare una composizione diversa nella microflora intestinale.
Dallo studio, sopra introdotto, di Jin et al. (2010) è emerso l’andamento della concentrazione plasmatica di esperetina totale (esperetina e glucuronidi dell’esperetina) che può essere visualizzato in Figura 15.
L’esperetina risulta apprezzabile nel plasma del ratto circa due ore dopo la somministrazione di 50 mg/kg di esperidina e mostra due picchi: il primo a 6 ore ed il secondo a 10 ore e quest’ultimo risulta più basso del primo. La concentrazione plasmatica a questo punto decresce sempre più nell’arco delle ventiquattro ore.
Figura 15. Profilo plasmatico concentrazione-tempo dell’esperetina dopo somministrazione di
esperidina in dose di 50 mg/kg ai ratti (Jin et al., 2010).
Per quanto riguarda i parametri farmacocinetici ottenuti da Jin et al. (2010) per i ratti non trattati con antibiotici risulta un’area sotto la curva (AUC) di 6,3 µg-h / ml, un tempo di emivita (t ½) di 4,3 h, una concentrazione massima (Cmax) di 0,58 µg/ml ed infine una Tmax di 8 h.
Nei modelli animali invece sottoposti a trattamento antibiotico si ha una diminuzione sia dell’area sotto la curva che diviene 2,8 µg-h /ml sia della concentrazione massima che risulta essere 0,2 µg/ml. Le differenze evidenziate nei suddetti parametri indicano gli effetti dei batteri intestinali sulla farmacocinetica ed il metabolismo dell’esperidina e suggeriscono che alterazioni della microflora incidono sulle attività farmacologiche del flavanone stesso (Jin et al., 2010).
L’esperidina è stata anche oggetto di studio di Cheng et al. (2012) che hanno svolto il loro lavoro di ricerca valutando le proprietà farmacocinetiche di tale flavanone che, insieme ad acido ferulico ed acido p-cumarico, costituisce uno dei principali componenti fenolici dell’estratto di Portulaca oleracea L. Quest’ultima è una pianta commestibile, utilizzata nella medicina popolare di molti paesi come diuretico, antipiretico, antisettico, antispasmodico e vermifugo (Mohanapriya et al., 2006;
Rasheed et al., 2004). In effetti ne sono state dimostrate le proprietà antibatteriche (Zhang et al., 2002), analgesiche (Chan et al., 2000), miorilassanti scheletriche (Parry et al., 1993) e vulnerarie (Rashed et al., 2003).
Dallo studio di Cheng et al. (2012) è emerso un andamento della concentrazione plasmatica che è possibile visualizzare in Figura 16.
L’esperidina risulta apprezzabile nel plasma sanguigno entro quindici minuti dalla somministrazione orale di estratto di Portulaca oleracea L. e mostra un unico picco a 2 ore. La concentrazione plasmatica subisce a questo punto un decremento, monitorato fino a sei ore.
Figura 16. Andamento nel tempo della concentrazione media plasmatica dell’esperidina dopo
somministrazione orale di estratto di Portulaca oleracea L. (Cheng et al., 2012).
I parametri farmacocinetici che emergono sono i seguenti: Tmax 2,0 h Cmax 0,196 µg /ml T1/2 5,94 h AUC da 0 a t 0,867 mg h /l AUC da 0 a ∞ 1,75 mg h/ l CL 8,01 l Kg/h
Confrontando i valori sopra riportati con quelli ricavati dagli studi di Jin et al. (2010) e focalizzando l’attenzione sul parametro T max, è evidente una diminuzione di quest’ultimo. Un tale decremento del tempo necessario per raggiungere la concentrazione massima indica che il sinergismo tra i vari componenti fenolici dell’estratto di Portulaca Oleracea L. potrebbe essere il fattore che migliora l’assorbimento (Cheng et al., 2012).
Quest’ultima considerazione può essere interessante qualora in studi aventi come oggetto l’esperidina si renda necessario creare le condizioni favorevoli per migliorare il processo di assorbimento.
Scopo della tesi
Scopo del presente lavoro di tesi è stato quello di studiare la farmacocinetica della quercetina e dell’esperidina in cani Beagle al fine di valutarne un possibile utilizzo nella cura della leishmaniosi canina.
Materiali e metodi
MATERIALI
La quercetina e l’esperidina, oggetto della presente tesi, sono state utilizzate in forma di polvere pura (purezza 98%) e sono state fornite da Medalpharma S.A.S. ITALY. I prodotti chimici che sono stati impiegati sono i seguenti: metanolo per HPLC (VWR, BDH PROLABO, Leuven, Belgium), ammonio acetato 97% di grado reagente (Aldrich: Sigma-Aldrich Co. Ltd-Gillingham-Dorset UK; Aldrich-Chemie Gmbh & Co. KG Steiheim, Germany), acido cloridrico superpuro (Carlo Erba Reagenti Milano, Italy), acido acetico 99-100% di grado reagente (J.T. Baker B.V. Deventer, Holland), acetone 99,9% di grado HPLC (Aldrich: Sigma-Aldrich-Steinheim-Germany; Sigma-Aldrich-Saint Louis-USA), DMSO (VWR, BDH PROLABO, Leuven, Belgium), β-Glucuronidasi di tipo HP-2 da Helix pomatia (Sigma-Aldrich, Saint Louis, USA), acido L-ascorbico (Sigma Ultra: Sigma-Aldrich Co.P.O. Saint Louise, USA; Sigma-Aldrich Chemie Gmbh P.O. Steinheim, Germany).
E’ stata utilizzata acqua bidistillata filtrata in tutti gli esperimenti.
Strumentazione
E’ stato impiegato un HPLC Jasco composto da un rivelatore UV-VIS UV-975, una pompa PU -980, un’unità gradiente di tipo ternario LG-980-02 ed avente un loop da 20 µl. La corsa cromatografia è stata condotta utilizzando una colonna Agilent Poroshell 120 C 18 (3.0 100 mm, 2.7 micrometri).
Per le operazioni di centrifugazione è stato fatto ricorso ad una centrifuga Hettich Universal 320 e ad una mini Spin plus pb international epperndorf.
Sono stati inoltre impiegati l’agitatore di campioni Dynal ed un vortex VWR. L’incubazione dei campioni è stata effettuata con una stufa PB international.
Per le operazioni di misurazione di pH è stato utilizzato un agitatore magnetico AIC ed un PH metro Hanna instruments. HI 9219.
Per misurare il peso sono state utilizzate le seguenti bilance: Mettler PC 440 Delta Range (0.1 mg – 10 gr) ed Acculab Atilon Sartorius Group (2 – 500 gr).
La preparazione delle capsule è stata effettuata con un’incapsulatrice ZUMA.
L’acqua è stata filtrata utilizzando una pompa a vuoto Vacuubrand ,Gmbh +Co, Wertheim, Germany, da collegare ad un imbuto per la filtrazione Whatman, England su cui viene sistemata una pinza Sartorius. La suddetta operazione è stata effettuata utilizzando appositi dischetti filtranti in acetato di cellulosa con porosità 0.5 micron.
METODI
Preparazione delle soluzioni standard
Le soluzioni standard di quercetina ed esperidina sono state preparate utilizzando come solventi organici MeOH e DMSO sulla base del lavoro svolto da Jones e colleghi (1998) apportando qualche modifica.
La soluzione standard madre nel caso dell’esperidina è stata preparata alla concentrazione di 10000 ppm e a partire da essa sono state effettuate varie diluizioni che hanno condotto a concentrazioni di 2000, 1000, 500, 200, 100 ppm.
Invece per quanto riguarda la quercetina, la soluzione madre è caratterizzata da una concentrazione di 1000 ppm; da tale standard sono state eseguite le diluizioni per giungere a concentrazioni di 100, 50, 20, 10, 5 ppm.
Quando è stata effettuata la sperimentazione con quercetina, l’esperidina ha ricoperto il ruolo di SI e viceversa.
Preparazione di una delle fasi mobili
Per la preparazione della soluzione di ammonio acetato 0,1 M a pH 4 sono stati pesati 7,708 g di ammonio acetato, è stata aggiunta acqua, precedentemente filtrata utilizzando una pompa a vuoto, fino a raggiungere il volume di 1 l. Il pH è stato misurato con l’ausilio di un pHmetro con elettrodo a vetro ed è stato addizionato gradualmente HCl 1 N per ottenere il valore desiderato, ovvero 4.
La soluzione è stata conservata in frigorifero a +4°C.
Metodo analitico hplc
La separazione è stata effettuata utilizzando come fasi mobili sono state utilizzate le seguenti: ammonio acetato 0,1 M a PH 4 e MeOH di grado HPLC sulla base dello studio di D.J.L. Jones e colleghi (1998) apportando qualche modifica.
L’eluizione, ottimizzata dopo differenti prove, caratterizzata da una velocità di flusso di 0,250 ml/min, è avvenuta secondo un gradiente così strutturato:
Tempo 0 min A 25% B 75% Tempo 10 min A 60% B 40% Tempo 15 min A 60% B 40% Tempo 25 min A 25% B 75% Tempo 35 min A 25% B 75%
dove A rappresenta il MeOH, mentre B l’ammonio acetato 0,1M a PH 4 La lunghezza d’onda è stata impostata a 375 nm (D.J.L. Jones et al., 1998).
La pressione del sistema durante le analisi si è aggirata intorno a 228 bar con leggere variazioni al variare del gradiente che ha condotto ad oscillazioni di ±10 unità.
Rette di taratura
Per poter risalire alle concentrazioni degli analiti durante le analisi dei campioni di plasma canino sono state effettuate le rette di taratura di entrambe le sostanze nella matrice in oggetto.
Per la costruzione della retta di taratura della quercetina sono state iniettate soluzioni standard a concentrazioni crescenti, ovvero 1, 10, 20, 50 e 100 ppm . Dalla lettura dei relativi cromatogrammi si è ricavato il tempo di ritenzione del flavonolo esaminato (16 0,5 min).
Parallelamente l’esperidina è stata iniettata a concentrazioni crescenti di 50, 100, 200 500 e 1000 ppm . Tale flavanone ha mostrato un tempo di ritenzione di 9 0,5 min.
Sperimentazione animale
La sperimentazione animale è stata approvata dal comitato etico di sperimentazione animale dell’Università di Pisa.
Studio 1) A quattro cani Beagle aventi un peso compreso tra 15 e 23 kg è stata somministrata quercetina in un’unica dose orale di 150 mg/kg di peso corporeo, utilizzando la forma farmaceutica di capsule. Questa formulazione è stata preparata estemporaneamente nel laboratorio di Farmacologia veterinaria usando un’incapsulatrice.
Sono stati effettuati prelievi di 3 ml di sangue canino dalla vena giugulare attraverso un catetere permanente ai seguenti intervalli di tempo: 0, 15, 30 min ed 1, 2, 4, 6, 8, 10 e 24 ore.
I campioni di sangue sono stati raccolti in provette contenenti eparina come anticoagulante e centrifugati a 4000 rpm per 5 min al fine di separare il plasma dalla frazione cellulare del sangue.
Dopo un periodo di wash out di circa 30 giorni lo stesso procedimento è stato seguito per l’altra sostanza oggetto di studio, ovvero l’esperidina.
Studio 2) A quattro cani Beagle aventi un peso compreso tra 15 e 23 kg è stata somministrata esperidina in un’unica dose orale di 150 mg/kg di peso corporeo. La forma farmaceutica utilizzata è stata quella delle capsule, preparate estemporaneamente nel laboratorio di Farmacologia veterinaria con l’ausilio di un’incapsulatrice.
I prelievi di 3 ml di sangue canino sono stati effettuati dalla vena giugulare attraverso un catetere permanente ai seguenti intervalli di tempo: 0, 15, 30 min ed 1, 2, 4, 6, 8, 10 e 24 ore.
La raccolta dei campioni di sangue è avvenuta in provette contenenti eparina come anticoagulante. La successiva centrifugazione a 4000 rpm per 5 min ha separato il plasma dalla frazione cellulare del sangue.
Estrazione di quercetina dal plasma
Ad 1 ml di plasma canino vengono aggiunti 100 µl di standard interno esperidina alla concentrazione di 3000 ppm; il tutto viene miscelato utilizzando il vortex ed addizionato di 20 µl di una soluzione composta da acido acetico 0,5 M e acido L-ascorbico alla concentrazione di 2 mg/ml. L’acidificazione viene effettuata a causa dell’instabilità dei flavonoidi ad alto pH (Zhao et al., 2011).
In seguito ad agitazione con vortex vengono aggiunti 5 µl di β-glucuronidasi e dopo un ulteriore utilizzo del vortex, il tutto viene sottoposto ad incubazione per un’ora a 37°.
Si procede addizionando 3 ml di acetone, trattando con il vortex, successivamente con l’agitatore per 10 min e centrifugando a 3500 rpm per 10 min.
Vengono prelevati 2,7 ml di surnatante da porre in apposita provetta in cui alla fine confluirà il surnatante ottenuto dalla seconda procedura estrattiva.
Infatti, a questo punto il precipitato derivante dalla centrifugazione viene addizionato di 3 ml di acetone, miscelato con il vortex e l’agitatore per 10 min ed infine centrifugato a 3500 rpm per 10 min.
Vengono prelevati 2,7 ml di surnatante che sono aggiunti a quelli precedentemente ottenuti. L’aliquota unica risultante viene portata a secco con Elio e successivamente ripresa con 100 µl di miscela DMSO-MeOH in cui i due solventi sono in rapporto 1:1.
Vengono iniettate in HPLC aliquote da 20 µl di ogni campione per essere analizzate.
Estrazione di esperidina dal plasma
Tale procedura di estrazione è identica a quella descritta per la quercetina, da cui differisce unicamente per lo standard interno che in questo caso è rappresentato dalla quercetina alla concentrazione di 5 ppm.
Validazione del metodo
Per la validazione del metodo HPLC-UV è stata utilizzata la linea guida dell’EMEA (“Guideline on validation of bioanalytical methods”).
Accuratezza - La dimostrazione dell’accuratezza del metodo è avvenuta iniettando il
plasma di cani non soggetti a trattamento con le sostanze naturali oggetto della presente tesi (bianchi).
Variabilità - La ripetizione delle analisi dei campioni di controllo qualità (CQ) nello
stesso giorno ed in giorni differenti ha determinato le variazioni intra-day ed inter-day.
Ripetitibilità - La dimostrazione della ripetibilità del metodo è stata effettuata
attraverso il confronto dei risultati relativi all’iniezione di tre campioni a tre concentrazioni diverse di quercetina (1, 10 ,50 ppm) ed esperidina (50, 200, 500 ppm) per un numero totale di tre volte nello stesso giorno, nello stesso laboratorio, dallo stesso operatore, utilizzando la stessa apparecchiatura ad intervalli di tempo brevi.
Precisione - La precisione intermedia è stata valutata facendo ricorso alla stessa
procedura ma in intervalli di tempo lunghi (una volta al giorno per cinque giorni consecutivi). La stabilità a lungo termine è stata ottenuta confrontando le aree dei campioni CQ freschi con le aree dei campioni CQ aggiunti alla matrice organica e conservati a –20°C per 14 giorni e per 2 mesi. Il confronto tra i risultati ottenuti nel laboratorio di San Piero con quelli ottenuti nel laboratorio di Scienze Fisiologiche dell’Università di Pisa attraverso l’analisi degli stessi campioni con lo stesso metodo, ma da parte di operatori, apparecchiature ed intervalli temporali diversi, ha permesso di dimostrare la riproducibilità del metodo.
Specificità - Per valutare la specificità del metodo sono stati confrontati i
cromatogrammi relativi all’iniezione di bianco di plasma di cani non trattati con alcuna sostanza, con quelli ottenuti iniettando il plasma spiccato con gli analiti a concentrazioni note e tenuti a 37°C per 30 min (metodo delle aggiunte) e quelli ottenuti analizzando i campioni di plasma di cani sottoposti a trattamento con le sostanze oggetto della tesi.
Sensibilità - La più bassa concentrazione rilevabile ma non quantificabile (LOD) e la
calcolate attraverso la determinazione del rapporto segnale-rumore ricavabile paragonando i segnali misurati su campioni contenenti concentrazioni note di quercetina ed esperidina con quelle di campioni bianchi. La linearità del metodo è stata dimostrata iniettando in HPLC-UV soluzioni dell’analita a cinque concentrazioni note. La curva di calibrazione è stata ricavata dall’area dei relativi picchi; a questo punto il calcolo del parametro r2 (coefficiente di correlazione) ha permesso di verificare la linearità. Per la valutazione del range lineare è stato determinato l’intervallo di concentrazione in cui il segnale varia linearmente con la concentrazione.
Robustezza - La valutazione della robustezza è avvenuta considerando parametri
come pH, temperatura, concentrazione, volatilità, stabilità in soluzione degli analiti, tempo di estrazione, composizione della miscela di estrazione, variazione della composizione di fase mobile, variazione della velocità di flusso e tipo di colonna.
Risultati
VALIDAZIONE DEL METODO
E’ avvenuta seguendo la linea guida dell’EMEA (“Guideline on validation of bioanalytical methods” (Anonimo, 2009)
Accuratezza –E’ stata ottima perché nessuna sostanza endogena è presente ai tempi di
ritenzione degli analiti nel plasma di cani non soggetti a trattamento (bianchi).
Variabilità – La ripetizione delle analisi dei campioni di controllo qualità (CQ) nello
stesso giorno ed in giorni differenti ha determinato le variazioni intra-day ed inter-day.
I risultati sono riportati nelle Tabelle 3-4
QUERCETINA Concentrazione (ppm) n° CV (%) INTRADAY 1 9 2,9 10 9 4,7 50 9 3,1 INTERDAY 1 3 6,7 10 3 7,1 50 3 6,9
ESPERIDINA Concentrazione (ppm) n CV% INTRADAY 50 9 3,5 200 9 3,9 500 9 1,8 INTERDAY 50 3 7,1 200 3 4,5 500 3 5,2
Tabella 4. n°=iniezioni in un giorno; CV=coefficiente di variazione percentuale
Ripetibilità – La ripetibilità del metodo è risultata al di sotto del range del 15%
imposto dall’EMEA.
Precisione – Questo aspetto emerge dalla valutazione del parametro definito
coefficiente di variazione percentuale (CV) che è mostrato dai risultati riportati nelle tabelle 3 e 4. I valori ottenuti per i due flavonoidi rispettano i limiti stabiliti dall’EMEA.
Specificità – Il confronto tra i cromatogrammi relativi a tre tipologie di plasma:
1) bianco
2) aggiunto con analiti a concentrazioni note
3) prelevato da cani trattati con le sostanze oggetto della tesi
ha dimostrato la capacità di determinare univocamente gli analiti di interesse, in quanto in corrispondenza dei loro tempi di ritenzione (16±0,8 min per la quercetina e 9±0,5 min per l’esperidina) la matrice plasmatica non mostra interferenze. Nonostante la buona specificità, sarebbe necessario ricorrere all’analisi con
HPLC-DAD oppure HPLC-MS per poter escludere sovrastime dovute all’eventuale formazione in vivo di metaboliti che possono eluire insieme agli analiti di interesse.
Sensibilità – Si è rivelato un metodo sensibile per la quercetina che risulta
quantificabile a basse concentrazioni (LOQ 1 ppm), al contrario l’esperidina per poter essere quantificata necessita di più alte concentrazioni (LOQ 50 ppm). I coefficienti di correlazione per le curve di calibrazione si sono dimostrati >0,99 dimostrando una buona linearità nel range 1-100 ppm per la quercetina e in quello 50-1000 ppm per l’esperidina.
OTTIMIZZAZIONE DEL METODO ANALITICO
Il metodo analitico oggetto della presente tesi deriva da un processo di ottimizzazione che ha riguardato varie condizioni cromatografiche.
Per quanto riguarda il pH, il valore ottimale di 4 è stato ritenuto preferibile rispetto a quello di 5 (utilizzato da Jones e colleghi, 1998) e 7. In Figura 17 ed in Figura 18 è mostrato il confronto tra la quercetina 100 ppm iniettata in HPLC alle medesime condizioni ma a pH diversi. A pH 4 (Figura 18) si nota un andamento più regolare del cromatogramma dal fronte del solvente al picco della quercetina.
Figura 17. Quercetina 100 ppm a pH 7
Figura 18. Quercetina 100 ppm pH 4.
Per quanto concerne il rapporto tra le fasi mobili, si è giunti all’utilizzo di un gradiente ed alla sua ottimizzazione in seguito a numerose prove.
Inizialmente l’eluizione è stata di tipo isocratico. A titolo di esempio sono riportati i cromatogrammi in cui la quercetina 50 ppm eluisce in due differenti condizioni: nella prima (Figura 19) il MeOH e l’ammonio acetato sono in rapporto rispettivamente di
80:20 e nella seconda (Figura20) rispettivamente di 40:60. Risulta evidente che il rapporto 40:60 è preferibile. Infatti in caso del rapporto 80:20, l’analita eluisce in modo estremamente veloce a causa dell’elevata componente organica della fase mobile.
Figura 20. Quercetina 50 ppm in condizioni MeOH: ammonio acetato 40: 60.
A causa delle caratteristiche dei picchi ottenuti, che non risultavano né ben separati, né aventi una forma ideale, è stato deciso di utilizzare un’eluizione a gradiente. Il gradiente scelto è risultato così strutturato:
Tempo 0 min A 25% B 75% Tempo 10 min A 60% B 40% Tempo 15 min A 60% B 40% Tempo 25 min A 25% B 75% Tempo 35 min A 25% B 75%
Dove A rappresenta il MeOH, mentre B l’ammonio acetato 0,1 M a pH 4.
Nell’ottimizzazione del gradiente, il periodo di riequilibratura a fine corsa è stato importante per il miglioramento del cromatogramma. Confrontando infatti i cromatogrammi ottenuti da iniezioni di quercetina ed esperidina in assenza (Figura 21) o presenza (Figura 22) di questa condizione, si nota in caso di riequilibratura da una parte il delinearsi del picco dell’esperidina che diviene più alto e stretto e
dall’altra un assottigliamento del picco della quercetina, il quale dimostra di
perfezionarsi sia per la simmetria, sia per l’avvicinamento alla linea di base.
Figura 21. Quercetina 20 ppm ed esperidina 500 ppm in assenza di periodo diriequilibratura. Quercetina
Figura 22. Quercetina 20 ppm ed esperidina 500 ppm in presenza di un periodo di riequilibratura
Vengono mostrati alcuni cromatogrammi esemplificativi relativi all’iniezione di plasma in seguito all’ottimizzazione del metodo: in Figura 23 è mostrato il plasma bianco, mentre in Figura 24 è riportato il plasma aggiunto con quercetina 10 ppm ed esperidina 500 ppm.
Figura 23. Plasma bianco
Quercetina
Figura 24. Plasma con aggiunta di esperidina 500 ppm e quercetina 10 ppm.
Q E
E’ possibile visualizzare inoltre un cromatogramma (Figura 25) che deriva da un’iniezione di plasma di cane trattato con quercetina (utilizzando come standard interno esperidina 3000 ppm).
Figura 25. Plasma di cane trattato con quercetina (S.I. esperidina 3000 ppm).
RETTA DI CALIBRAZIONE DELLA QUERCETINA
L’analisi con il programma Graph Pad Prism 4 Project delle aree dei picchi derivanti da iniezioni di quercetina, aggiunta in plasma canino di controllo a concentrazioni crescenti (1, 10, 20, 50, 100 ppm) ha fornito l’equazione della retta ed il parametro r2 visibili in Figura 26.
E
Figura 26. Retta di taratura della quercetina.
RETTA DI CALIBRAZIONE DELL’ESPERIDINA
L’analisi con il programma Graph Pad Prism 4 Project delle aree dei picchi che si ricavano dalle iniezioni di esperidina, aggiunta a concentrazioni di 50, 100, 200, 500 e 1000 ppm in plasma canino di controllo, hanno prodotto la seguente retta di calibrazione ed il parametro r2 (Figura 27).
RISULTATI FARMACOCINETICI
I cani sottoposti alla sperimentazione non hanno mostrato nessun effetto collaterale ascrivibile alla somministrazione di quercetina ed esperidina.
La somministrazione di una dose di 150 mg/kg di peso corporeo di quercetina ha dato luogo all’andamento concentrazione-tempo, relativamente al plasma canino, mostrato in Figura 28.
La quercetina risulta apprezzabile a livello plasmatico entro 30 min dalla sommininistrazione, raggiunge il picco plasmatico ad un valore medio di 3,50 h, in cui raggiunge una Cmax media di 10,45 g/ml e decresce nelle 24 ore.
Figura 28. Andamento concentrazione-tempo della quercetina dopo somministrazione di 150 mg/kg
di peso corporeo in cani Beagle (n=4).
Figura 29. Andamento concentrazione plasmatica della quercetina nei singoli cani trattati con 150
mg/kg di peso corporeo.
Invece l’esperidina, somministrata in una dose di 150 mg/kg di peso corporeo dà luogo al seguente andamento concentrazione-tempo (Figura 30).
Figura 30. Andamento concentrazione-tempo dell’esperidina in seguito a somministrazione di una
dose orale di 150 mg/kg di peso corporeo in cani Beagle (n=4).
0 2 4 6 8 10 12 -1 4 9 14 19 24 cane 1 cane 2 cane 3 cane 4 mean Tempo (ore) Co nc g/ m l
Tale flavanone risulta apprezzabile nel plasma un’ora dopo la somministrazione, raggiunge la Cmax media (7,00 g/ml) ad un Tmax medio di 3,50 h e subisce un decremento che è monitorato fino a 10 ore.
Si può inoltre visualizzare (Figura 31) l’andamento nei singoli cani trattati con esperidina.
Figura 31. Andamento concentrazione plasmatica dell’esperidina nei singoli cani trattati con 150
mg/kg di peso corporeo.
Sono inoltre emersi i seguenti parametri farmacocinetici che riguardano entrambi i flavonoidi (Tabella 5).
Tabella 5. Parametri farmacocinetici di quercetina ed esperidina.
Quercetina Esperidina
Parametri Media SD Media SD
R2 0,97 0,05 0,840 0,220 λz (1/h) 0,23 0,07 0,32 0,12 T1/2 λz (h) 3,25 1,14 2,40 1,20 Tmax (h) 3,50 1,00 3,50 1,00 Cmax (g/mL) 10,45 0,50 7,00 1,21 AUC 0-∞ (h g/mL) 128,99 6,11 40,30 4,41 VZ (mL/Kg) 5,46 1,88 12,70 5,90 CL (mL/h/Kg) 3,41 4,45 3,68 0,37 0 1 2 3 4 5 6 7 8 9 0 2 4 6 8 10 cane 1 cane 2 cane 3 cane 4 mean Tempo (ore) Conc g/ m l
Paragonando i risultati si nota che l’andamento concentrazione-tempo è similare nelle due sostanze, sebbene l’assorbimento della quercetina risulti più rapido.
Per quanto riguarda R2 e T1/2 sono emersi valori analoghi tra i due flavonoidi.
Nelle due sostanze il Tmax è lo stesso e la Cmax risulta simile,anche i valori della CL corrispondono .
Le uniche differenze più marcate sono quelle che emergono dal confronto tra AUC e VZ, dove il primo parametro ha un valore maggiore nella quercetina, mentre il secondo nell’esperidina.
Discussione e conclusioni
Il flavonolo quercetina ed il flavanone esperidina hanno dimostrato nel corso di vari studi di esercitare numerose attività farmacologiche.
Infatti la quercetina esplica i propri effetti benefici in condizioni patologiche come l’infezione da Leishmania, l’ipertensione, i tumori e l’infiammazione (Tasdemir et al., 2006; Muzitano et al., 2006 a e b; Sen et al., 2008; Mittra et al., 2000; Edwards et al., 2007; Kang et al., 2011; Chuang et al., 2010).
La quercetina nella suddetta malattia parassitaria ha un effetto leishmanicida sullo stadio di amastigote sia di Leishmania donovani (Tasdemir et al., 2006) che di quella
amazonensis (Muzitano et al., 2006 a, b) e riduce la carica del parassita nelle cellule
spleniche di criceto infettate da Leishmania donovani (Sen et al., 2008). Inoltre, questa sostanza naturale linearizza il 40% dei minicircoli di kDNA, ovvero un aggregato di piccole molecole lineari di DNA che formano una rete estremamente ampia ad alto PM (Mittra et al., 2000).
Il flavonolo nell’ipertensione ha dimostrato, per esempio, di ridurre la pressione sanguigna, se assunto regolarmente da soggetti ipertesi di grado 1 (Edwards et al., 2007).
La quercetina nei confronti dei tumori inibisce la crescita tumorale in varie linee cellulari (Kang et al., 2011).
Il flavonolo nell’infiammazione risulta per esempio provocare una diminuzione sia dell’espressione genica, sia della secrezione di specifiche citochine e chemochine (Chuang et al., 2010).
L’esperidina ha dimostrato di avere effetti benefici nei confronti di patologie infiammatorie come per esempio l’artrite reumatoide e la colite ulcerosa (Kawaguchi et al., 2001).
Questo principio attivo è infatti usato nel farmaco Daflon® che contiene una frazione flavonoidica costituita per il 10% dal flavanone e che, utilizzato in studi sperimentali su cani e ratti, ha migliorato il drenaggio linfatico (Foldi, 1999; Labrid, 1995), incrementando il flusso linfatico e la pulsatilità (Labrid, 1995; Cotonat e Cotonat, 1989).
In questo ampio scenario di azioni farmacologiche attribuite ai due flavonoidi, l’industria farmaceutica Medalpharma S.A.S. (Italia) si è interessata ad essi nell’ottica di un loro possibile utilizzo nella cura della leishmaniosi canina.
I due elementi che hanno portato a tale interesse ipotizzando un buon successo terapeutico sono stati gli effetti dimostrati contro la leishmaniosi (Tasdemir et al., 2006; Muzitano et al., 2006 a e b; Sen et al., 2008; Mittra et al., 2000) e la natura di tipo infiammatorio di tale malattia vista la proprietà di entrambe le sostanze di contrastare l’infiammazione (Chuang et al., 2010; Kawaguchi et al., 2001).
L’ industria Medalpharma, già distributrice del farmaco Endotel® per uso umano, ha così dato l’incarico di studiare la quercetina e l’esperidina nel cane per poter valutare il profilo farmacocinetico delle due sostanze.
L’andamento della concentrazione plasmatica è similare nel flavonolo quercetina e nel flavanone esperidina, sebbene l’assorbimento risulti più rapido nella quercetina. Questo fa ipotizzare che una singola somministrazione di Endotel®, contenente entrambi i flavonoidi, possa presentare un similare profilo farmacocinetico delle due sostanze. Ad avvalorare questa supposizione vi sono anche i confronti tra i parametri farmacocinetici delle singole sostanze: il Tmax risulta lo stesso nel flavonolo e nel flavanone (3,50 h) ed in accordo con il Tmax (4 h) emerso dallo studio di Reinboth e colleghi (2010) su cani Beagle. Esiste anche un’analogia tra la Cmax della quercetina (10,45 µg/mL) e dell’esperidina (7,00 µg/mL) che unitamente all’uguaglianza del
Tmax fa ipotizzare che l’associazione delle due sostanze dia luogo dopo uno stesso periodo di tempo a simili concentrazioni massime.
La corrispondenza si nota anche nei valori del T1/2 e della CL. Infatti il primo risulta
3,25 h nella quercetina e 2,40 h nell’esperidina, invece la seconda ha un valore di 3,41 mL/h/kg nel flavonolo e 3,68 mL/h/kg nel flavanone. Questo fa supporre che la loro coesistenza in un unico farmaco generi un simile profilo di eliminazione.
Le precedenti considerazioni sulla contemporanea somministrazione dei due flavonoidi rimangono a livello di ipotesi, a causa del fatto che nel presente studio le cinetiche sono state sviluppate singolarmente per volontà della ditta e potrebbero invece risultare diverse nel caso di co-somministrazione per l’eventuale instaurarsi di interazioni cinetiche. Infatti Zhao e colleghi (2011) postulano che la coesistenza e la variazione dei reciproci rapporti tra la quercetina ed una sua forma glicosidica, ovvero la rutina, possano generare un differente profilo farmacocinetico della quercetina stessa; anche Cheng e colleghi (2012) ipotizzano che l’assorbimento dell’esperidina possa essere migliorato dal sinergismo che si instaura tra vari componenti fenolici somministrati insieme al flavanone stesso.
A questo punto è importante sottolineare che questo studio ha presentato i seguenti limiti:
i) Il numero degli animali da poter sottoporre alla sperimentazione è stato esiguo (n=4), quindi i dati ottenuti non sono sufficientemente numerosi e necessitano di essere confermati.
ii) Le dosi di quercetina ed esperidina somministrate agli animali sono state elevate a causa della metodica analitica utilizzata (HPLC-UV). Una delle restrizioni di questa metodica è quella di avere limiti di quantificazione abbastanza elevati. Infatti il limite di quantificazione di 1 ppm per la quercetina e di 50 ppm per l’esperidina ha imposto il ricorso ad alte concentrazioni, dopo il tentativo di uno studio pilota a 10