INDICE
1 INTRODUZIONE 3
2 ENCEFALOPATIA NEONATALE 4
2.1 Encefalopatia Ipossico-Ischemica 4
3 PARALISI CEREBRALE INFANTILE 9
3.1 Fisiopatologia della paralisi cerebrale infantile 11
3.2 Eziologia della paralisi cerebrale infantile 11
3.3 Paralisi cerebrale infantile ad eziologia asfittica intrapartum 12
3.4 Come prevenire la paralisi cerebrale 16
4 MONITORAGGIO FETALE 19
4.1 Conta dei movimenti fetali 20
4.2 Ecografia ostetrica 21
4.3 Dopplerflussimetria feto-placentare 21
4.4 Profilo biofisico fetale 22
4.5 Contraction Stress Test 26
5 MONITORAGGIO DELLA FREQUENZA CARDIACA FETALE 27
5.1 Auscultazione intermittente vs monitoraggio fetale elettronico continuo in travaglio di parto 32
5.2 Monitoraggio fetale elettronico intermittente vs continuo in travaglio di parto 33
5.3 Cardiotocografia all’ingresso in ospedale di gestante in travaglio 34
5.4 Quando effettuare monitoraggio fetale elettronico continuo 34
6 VALUTAZIONE DEL TRACCIATO CARDIOTOCOGRAFICO 38
6.1 Tracciato nel periodo espulsivo 47
6.2 Classificazione del tracciato nel periodo espulsivo di Melchior-Bernard modificato da Piquard 48
6.3 Cosa fare in caso di tracciato cardiotocografico patologico 49
6.4 La cardiotocografia computerizzata 53
7 TECNICHE INTEGRATIVE ALLA CARDIOTOCOGRAFIA IN TRAVAGLIO DI PARTO 55
7.1 Ossimetria fetale 56
8 IL CONTENZIOSO MEDICO-LEGALE 57
9 LA GIURISPRUDENZA 60
9.1 Colpa grave per assenza di monitoraggio cardiotocografico 60
9.2 Responsabilità in ambito civile 63
9.2.1 Mancata effettuazione monitoraggio cardiotocografico 63
9.2.2 Inadeguato monitoraggio cardiotocografico 65
9.2.3 Errata valutazione del tracciato cardiotocografico 68
9.3 Responsabilità in ambito penale 72
10 CASISTICA 75
11 CONSIDERAZIONI MEDICO-LEGALI 92
BIBLIOGRAFIA 98
INDICE CRONOLOGICO DELLE PRONUNCE 103
1. INTRODUZIONE
Le richieste di risarcimento per casi di responsabilità professionale medica hanno avuto, negli ultimi anni, un costante incremento ed una delle specializzazioni che maggiormente ne ha risentito, è rappresentata dall’Ostetricia-Ginecologia [1]. I ginecologi possono aspettarsi di essere chiamati in causa da due a cinque volte nel corso della loro carriera e, visto che l’entità dei risarcimenti raggiunge cifre elevate anche in relazione ai danni riflessi dei genitori, i sanitari condannati possono o non avere sufficiente copertura assicurativa o perderla successivamente.
Il contenzioso ostetrico comporta un’escalation continua dei costi assicurativi, interferisce con le scelte mediche e porta lo specialista a “fuggire” nella medicina difensiva influenzando negativamente un’altrimenti soddisfacente carriera professionale.
“La Medicina Difensiva si verifica quando i medici prescrivono test, trattamenti o visite, od evitano pazienti o
trattamenti ad alto rischio, primariamente (ma non necessariamente in modo esclusivo) allo scopo di ridurre la propria esposizione al rischio di accuse di malpractice. Quando i medici eseguono extra-test o trattamenti principalmente per ridurre le accuse di malpractice, essi praticano la medicina difensiva positiva. Quando essi evitano determinati pazienti o interventi, essi praticano la medicina difensiva negativa”. [2]
I rischi maggiormente ricorrenti della tale branca ostetrica-ginecologica si possono distinguere in tre gruppi principali:
• “Il rischio di arrecare danno alla salute della gestante a causa di terapie o manovre inidonee o errate, sia
durante la gestazione che durante il parto; …
• Il rischio di arrecare danno alla salute del nascituro, anche in questo caso a causa di imperizia,
imprudenza o negligenza durante la gestazione o al momento del parto;
• Il rischio … di causare direttamente (attraverso la negligente esecuzione di un intervento di interruzione
di gravidanza) ovvero indirettamente (non rilevando e quindi non segnalando alla madre le malformazioni del feto sì da impedirle di esercitare il diritto d’aborto) una nascita indesiderata”. [3]
Il contenzioso medico-legale in ambito ostetrico è rappresentato dal “danno alla salute del
nascituro” e, in particolar modo, da gravidanze complicate dalla nascita di neonati con
encefalopatia, condizione che spesso riflette un grave danno neurologico ed un significativo rischio di sequele a lungo termine.
2. ENCEFALOPATIA NEONATALE
L’encefalopatia neonatale è una sindrome clinicamente definita che si manifesta nella prima settimana di vita con disturbi della respirazione, depressione del tono muscolare e dei riflessi, alterato livello di coscienza e, frequentemente, convulsioni [4, 5].
Le cause di tale patologia sono eterogenee, sia materne che fetali, possono insorgere durante tutto il corso della gravidanza e addirittura in epoca preconcezionale: disordini metabolici, esposizione a tossici, infezioni, anomalie cromosomiche o sindromi genetiche, ipossia cronica.
Studi epidemiologici hanno documentato che, fra tutti i neonati con encefalopatia, il 69% dei casi presentano solo fattori di rischio antepartum, il 25% sia ante che intrapartum, il 4% hanno solo ipossia intrapartum senza fattori che possano aver contribuito all’encefalopatia ed il 2% non ha alcun fattore di rischio identificato. L’incidenza di encefalopatia neonatale attibuibile ad ipossia intrapartum in assenza di altre anomalie è stimata, in letteratura, in 1.6 casi su 10.000 [6].
2.1 ENCEFALOPATIA IPOSSICO-ISCHEMICA
Un sottotipo di encefalopatia neonatale è l’encefalopatia ipossico-ischemica che riconosce come
eziologia l’asfissia perinatale1, ovvero una limitazione dell’apporto di ossigeno (ipossiemia) e del
flusso di sangue (ischemia) ai tessuti fetali in epoca perinatale per inadeguata perfusione placentare. Si parla di encefalopatia ipossico-ischemica quando all’evento asfittico segue un interessamento del sistema nervoso centrale per cui, nelle ore o nei giorni successivi all’insorgenza dell’asfissia, si manifesta una sindrome neurologica neonatale.
Il danno cerebrale che si verifica in seguito all’insulto ipossico-ischemico è caratterizzato da due fasi:
1. un’iniziale risposta vascolare all’asfissia perinatale consistente nella redistribuzione del flusso sanguigno agli organi vitali (cuore, encefalo, ghiandole surrenali) con concomitante riduzione negli altri distretti;
2. alla persistenza dell’insulto segue una condizione di ipotensione sistemica che coinvolge anche il distretto cerebrale con riduzione del flusso ed ischemia cerebrale. [7]
1 L’asfissia induce le seguenti modificazioni biochimiche: progressiva riduzione dell’apporto di ossigeno ai tessuti (ipossia); progressivo accumulo di anidride carbonica (acidosi respiratoria); passaggio dalla glicolisi aerobica a quella anaerobica con accumulo di radicali acidi (acidosi lattica)
Figura 1. Rappresentazione schematica dei principali meccanismi alla base del danno ischemico cerebrale dopo asfissia perinatale [7]
A questo punto, se l’insulto ipossico-ischemico ha agito per un periodo di tempo sufficiente (almeno 10 minuti in caso di anossia e non più di 3 ore per ipossia grave sennò il feto va incontro a morte), si realizza un danno cerebrale irreversibile. La morte delle cellule cerebrali non si verifica solo durante l’insulto ma può continuare anche nelle ore e nei giorni successivi alla riperfusione cerebrale [8].
Storicamente, l’erronea assunzione che l’encefalopatia neonatale fosse sempre di tipo ipossico-ischemico acuto ha portato a criminalizzare l’evento nascita considerandolo un fondamentale fattore eziopatogenetico dell’encefalopatia.
E’ stato invece dimostrato che l’asfissia può verificarsi prima, durante o dopo la nascita e il momento scatenante è rappresentato, o da una diminuzione acuta o cronica degli scambi gassosi tra madre e feto, o dal mancato inizio dell’attività respiratoria autonoma del neonato con prevalente utilizzazione delle vie anaerobiche per la produzione di energia e successiva liberazione di radicali acidi (soprattutto acido lattico) con insorgenza di acidosi metabolica.
L’eziologia dell’asfissia è eterogenea potendosi riconoscere cause fetali, placentari o materne:
• fetali: riduzione dell’emoglobina fetale (emolisi o emorragia materno-fetale), prolasso o compressione del cordone;
• materne: ipossia sistemica e riduzione del flusso ematico utero-placentare conseguente ad ipotensione, vasospasmo accompagnato ad ipertensione, shock, rottura d’utero, anemia, arresto cardiaco, disordini ematologici, polmonari, renali, iperattività uterina.
Tali fattori possono agire in maniera acuta (ore), cronica (giorni o settimane), continua o intermittente. [8, 5]
Il 20-50% dei neonati asfittici che sviluppa l’encefalopatia muore durante il periodo neonatale, mentre il 25% dei sopravvissuti va incontro ad esiti neurologici permanenti : paralisi cerebrale infantile, turbe dell’apprendimento, epilessia. [9, 10]
La severità dell’encefalopatia che segue un evento asfittico è variabile a seconda della durata dell’asfissia, dell’età gestazionale e delle condizioni di sviluppo intrauterino. Secondo la Classificazione di Sarnat del 1976 si possono individuare tre gradi di severità (lieve, moderata e severa) che sono stati riportati nella tabella sottostante [7].
Lieve (Grado 1) Moderata (Grado 2 ) Severa (Grado 3)
Ipervigilanza
Tono passivo normale
Lieve ipertono estensorio del collo
Suzione ipovalida Moro a bassa soglia No convulsioni
Letargia Lieve ipotonia
Flessione distale accentuata Riflessi osteotendinei vivaci Suzione debole o assente Convulsioni Stato stuporoso Ipotonia severa Assenza di movimenti spontanei Suzione assente Convulsioni e stato di male epilettico
Tabella 1. Classificazione dell’encefalopatia ipossico-ischemica secondo Sarnat e Sarnat (1976)
I neonati con encefalopatia ipossico-ischemica lieve di solito hanno una prognosi favorevole, quelli con encefalopatia moderata sviluppano un danno neurologico a lungo termine nel 20-25% dei casi, quelli con encefalopatia severa presentano un rischio maggiore dell’80% di morte o sequele neurologiche a lungo termine.
E’ difficile definire con sicurezza la relazione tra severità dell’insulto ed espressività clinica perché, per il fenomeno del preconditioning, ad insulto di pari intensità, un encefalo che abbia già subito altri insulti, darà luogo ad esiti minori rispetto ad un encefalo che non abbia sperimentato prima un insulto analogo ed è anche per questo fattore che solo una parte dei neonati con encefalopatia ipossico-ischemica svilupperà paralisi cerebrale.
L’individuazione dell’epoca di produzione del danno ipossico-ischemico è fondamentale per inquadrare l’eventuale profilo di responsabilità delle figure sanitarie (ostetrici o neonatologi) coinvolte nella gestione della gravidanza, del parto e del post-partum.
La maggior parte dei casi di paralisi cerebrale, a differenza di ciò che si riteneva in passato ovvero che la causa esclusiva fosse l’asfissia acuta intrapartum, è correlata a noxae patogene preesistenti al parto e responsabili di sofferenza fetale. La sofferenza fetale si può rendere manifesta durante il travaglio a causa delle normali sollecitazioni cui viene normalmente sottoposto il neonato che, nel caso in cui sia già compromesso, può rispondere con segni di ipossia-ischemia. [11, 12]
Il travaglio è infatti una fase del parto difficilmente superabile per feti già “provati” da un insulto precedente in quanto è caratterizzato da una parte, da un aumento della domanda metabolica fetale e dall’altro, da una diminuzione dell’apporto materno di ossigeno conseguente all’ostruzione fasica del letto vascolare per le contrazioni uterine. Quindi, feti già indeboliti da una sofferenza pregressa, sono senza dubbio più predisposti ad un danno ipossico in questa fase. [11]
In tali situazioni, anche nel caso in cui si decidesse di accelerare l’espletamento del parto tramite taglio cesareo, solo raramente si riuscirebbe ad impedire la sofferenza cerebrale cronica del feto già in atto [4]. Quanto appena detto fa sì che l’asfissia intrapartum sia frequentemente causa di implicazioni medico-legali sia per quanto riguarda la sua prevedibilità che per la possibilità di evitare gli esiti dannosi o, comunque, di limitarne la gravità mediante un tempestivo intervento ostetrico.
Già nel 1995 il Consensus Statement delle Società Perinatali dell’Australia e Nuova Zelanda sottilineava che: “There is no evidence that current obstetric practices can reduce the risk of cerebral palsy. The
origins of many cases of cerebral palsy are likely to be antenatal”. [13]
Fino a tempi recenti sono stati ritenuti indizi di asfissia alla nascita i seguenti segni: liquido
amniotico contaminato da meconio2, parametri cardiotocografici non rassicuranti, basso indice
2Il meconio è il materiale contenuto nell’intestino del feto. Presenta un colore bruno-verdastro, ha consistenza vischiosa e viene emesso nei primi giorni di vita del bambino. È costituito dai prodotti delle secrezioni intestinali, da cellule epiteliali intestinali desquamatesi e dal liquido amniotico ingerito durante il periodo pre-natale. Nel 10 - 15% dei nati a termine e post-termine, il meconio può essere emesso prima o durante il parto e ciò è indicativo di sofferenza fetale. Può essere aspirato dal feto con conseguente polmonite da aspirazione di meconio dopo 24 - 48 ore.
di Apgar ed encefalopatia neonatale in assenza di criteri oggettivi che mostrassero il momento di insorgenza dell’evento ipossico acuto.
Nel 1998 l’American College Obstetricians and Gynaecologists [12] ha stabilito i criteri per definire un’encefalopatia alla nascita come il risultato di un insulto ipossico-ischemico acuto verificatosi durante il parto:
1. pH alla nascita misurato nel sangue arterioso del funicolo <7. Una severa acidosi fetale si associa ad aumentato rischio di outcome neurologico avverso anche se l’acidosi alla nascita è una condizione relativamente comune (2% di tutte le nascite), e solo una piccola percentuale di questi neonati svilupperà un danno neurologico;
2. indice di Apgar tra 0 e 3 per più di 10 minuti3;
3. danno multiorgano. Il danno multiorgano è conseguente all’ipoperfusione a livello di rene, fegato, apparato emopoietico, tratto gastro-enterico, cuore e polmone ed è documentato da svariati markers: oliguria, ipercreatinemia, iperazotemia, ipertransaminasemia, riduzione delle piastrine e coagulazione intravascolare disseminata, necessità di ricorrere ad agenti pressori per mantenere il circolo, emorragie polmonari e ricorso alla ventilazione meccanica, enterocolite necrotizzante.
A questo punto possiamo ricordare le relazioni intercorrenti tra encefalopatia neonatale, asfissia intrapartum ed esiti neonatali: l’encefalopatia neonatale è una condizione clinica eterogenea ad eziopatogenesi multipla riconducibile a fattori prenatali, perinatali e postnatali, può essere correlata ad un insulto asfittico perinatale primitivo o secondario a fattori di rischio antenatali, oppure, nei casi non associati ad asfissia intrapartum, può essere causata da malattie materne o fetali, complicanze prenatali, fattori socio-demografici, anomalie della placenta o eventi post natali.
3
il test di Apgar deve essere effettuato dopo 1 e dopo 5 minuti dalla nascita, è un punteggio di vitalità basato su cinque parametri: 1) l’attività cardiaca; 2) la respirazione; 3) i riflessi; 4) il colorito della cute; 5) il tono muscolare. Per ogni parametro viene assegnato un punteggio di 0-1-2 a seconda che sia assente, poco rappresentato o normalmente presente. La somma del punteggio parziale costituisce il punteggio totale. Un punteggio normale è compreso tra 7 e 10. Un punteggio di Apgar da 8 a 10 al 1° minuto dalla nascita esprime una buona condizione, mentre da 6 a 4 esprime uno stato di sofferenza di grado medio ed un punteggio di 3 o inferiore esprime una condizione di asfissia grave. Solitamente un neonato con un punteggio di Apgar basso ad 1 minuto dopo la nascita, se correttamente assistito, raggiunge un punteggio normale dopo 5 minuti. La persistenza di un punteggio inferiore a 7 a 5 minuti dalla nascita significa che il neonato non è stato in grado di recuperare vitalità ed è perciò affetto da una condizione di vera asfissia.
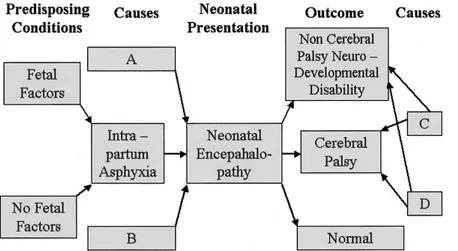
L’encefalopatia può comportare nessuna conseguenza per il neonato, oppure paralisi cerebrale o altre disabilità neurologiche [4, 14]. Come riportato nel grafico sottostante, non tutti i neonati con encefalopatia svilupperanno paralisi cerebrale.
Figura 2. Rappresentazione schematica delle relazioni tra fattori di rischio fetale, asfissia intrapartum, encefalopatia neonatale e outcome .
A e B sono cause diverse dall’asfissia intrapartum che possono causare encefalopatia neonatale; C e D sono cause differenti dall’asfissia intrapartum responsabili di paralisi cerebrale. [14]
3. PARALISI CEREBRALE INFANTILE
La paralisi cerebrale infantile (PCI), nota inizialmente come Morbo di Little, è stata descritta per la prima volta nel 1862 da sir John Litttle, ortopedico inglese, che ipotizzò che la spasticità e le deformità fossero causate dall’asfissia e dall’emorragia cerebrale secondarie alla sofferenza del parto.
Negli anni seguenti altri due autori, William Osler e Sigmund Freud, si occuparono dello studio dell’eziologia di questi disordini motori. Freud, rispetto a Little, attribuì maggior importanza alla nascita prematura e ad anomalie dello sviluppo intrauterino piuttosto che alla sofferenza insorta al momento del parto.
Nei decenni successivi l’interesse per la patologia spastica del bambino si mantenne basso fino a dopo la seconda guerra mondiale quando, a seguito del miglioramento dell’ assistenza ostetrica e delle cure intensive neonatali, si ridusse la mortalità infantile consentendo la sopravvivenza di un maggior numero di neonati a rischio di disabilità. [7]
La paralisi cerebrale infantile è costituita da un gruppo di condizioni caratterizzate da disordini cronici dei movimenti o della postura che compare in epoca neonatale e non è correlata ad una malattia neurologica progressiva. Dopo l’epilessia ed il ritardo mentale, costituisce la forma di patologia più frequente in neuropediatria (2-3 casi su 1000 nati vivi) ed è l’esito di una lesione
del sistema nervoso centrale che ha comportato la perdita di tessuto cerebrale [9]. Tale lesione si può verificare durante le prime fasi dello sviluppo del sistema nervoso centrale: nel corso della gravidanza, al momento del parto o nei primi due anni di vita post natale.
Le manifestazioni cliniche, che possono variare da un lieve danno motorio sino al coinvolgimento di tutto il corpo, dipendono dalla gravità ed estensione del danno e dalla sua localizzazione (cervello, tronco cerebrale, midollo spinale); alla paralisi cerebrale si accompagnano infatti frequentemente un ritardo delle acquisizioni, epilessia, ritardo mentale, sordità, disturbi della vista e del linguaggio.
La paralisi cerebrale infantile è definita come “una turba persistente ma non immutabile della postura e
del movimento, dovuta ad una alterazione organica e non progressiva della funzione cerebrale, per cause pre-peri e post natali, prima che se ne completi la crescita e lo sviluppo” (M. Bax 1964, Spastic Society Berlino,
1966, Edimburgo, 1969).
Il disturbo è “persistente” in quanto la lesione a carico dell’encefalo non è suscettibile di guarigione in senso stretto perché viene sostituita da tessuto cicatriziale e non peggiora perché non si verificano fenomeni degenerativi.
Sebbene le lesioni siano statiche nel tempo, le manifestazioni cliniche si modificano notevolmente mano a mano che il bambino cresce con progressivo miglioramento delle capacità motorie che possono trarre beneficio da trattamenti riabilitativi o chirurgici.
Una descrizione della paralisi cerebrale infantile sembra ritrovarsi anche in una descrizione del futuro re Riccardo III fatta da William Shakespeare:
“I, that am curtail'd of this fair proportion, cheated of feature by dissembling nature, deformed, unfinish'd, sent
before my time into this breathing world, scarce half made up, and that so lamely and unfashionable that dogs bark at me as I halt by them”
“Io, che una perfida natura ha defraudato d’ogni armonia di tratti e d’ogni lineamento aggraziato, mandandomi
anzitempo, deforme e incompleto in questo mondo che respira, solo per metà sbozzato, e talmente claudicante e goffo che i cani mi abbaiano quando gli passo accanto arrancando” William Shakespeare, Richard III
3.1 FISIOPATOLOGIA DELLA PARALISI CEREBRALE INFANTILE
Dal punto di vista fisiopatologico, nella paralisi cerebrale si crea un danno ai motoneuroni corticali superiori (1° motoneurone) con diminuzione degli input eccitatori e regolatori che dalla corteccia viaggiano attraverso i tratti reticolospinale e corticospinale per giungere ai motoneuroni del tronco cerebrale e del midollo spinale (2° motoneurone) che comandano i gruppi muscolari periferici.
Questa diminuzione di input interferisce con il controllo motorio e causa il deficit del controllo muscolare e l’ipostenia.
Allo stesso tempo, la perdita degli input inibitori discendenti, mediati dai tratti reticolospinali e da altri sistemi, causa spasticità (definita come un tipo di resistenza muscolare allo stiramento o come un’attività muscolare eccessiva o involontaria). La spasticità può, a sua volta, essere responsabile di alcune complicanze associate con la paralisi cerebrale, e cioè le contratture, il dolore e le sublussazioni. L’eliminazione della componente spastica permette a molti soggetti con paralisi cerebrale di poter utilizzare, in maniera più effettiva e funzionale, quella componente residua di controllo motorio selettivo che ancora possiedono.
Il danno ai sistemi extrapiramidali (spesso provocato da iperbilirubinemia) causa invece disturbi del movimento quali atetosi, corea, distonia o rigidità, mentre la diplegia è associata a leucomalacia periventricolare. L’emiplegia è associata a lesioni in un singolo emisfero e la quadriplegia a lesioni più diffuse.
Sono quindi il tipo, l’estensione del danno al sistema nervoso centrale (SNC), la localizzazione dell’insulto (irreversibile) e le capacità di adattamento e riorganizzazione del SNC, dopo aver subito il danno, a regolare il tipo, la gravità delle manifestazioni cliniche e la storia naturale del deficit neurologico nella paralisi cerebrale. [9]
3.2 EZIOLOGIA DELLA PARALISI CEREBRALE INFANTILE
Le cause della paralisi cerebrale sono di diversa natura e possono agire in varie epoche dello sviluppo potendosi quindi distinguere in pre, peri e postnatali [15-17]:
• prenatali (fattori che agiscono prima della nascita): fattori genetici, infezioni materne nel primo o secondo trimestre della gravidanza (rosolia, citomegalovirus, toxoplasmosi),
malattie croniche materne (cardiopatie, nefropatie, endocrinopatie), intossicazioni accidentali (farmaci) o voluttuarie (alcool, fumo, sostanze stupefacenti), disordini circolatori del circolo materno, placentare o fetale (malformazioni cardio-vascolari, discrasie ematiche, gemellarità);
• perinatali (che agiscono durante il parto o nella prima settimana di vita): condizioni che causano distocia del parto (distacco di placenta, distocie del funicolo, anomalie di presentazione del feto, inerzia uterina, …), situazioni che incidono nell’immediato post partum (difficoltà respiratorie neonatali, ittero, disturbi metabolici, …), emorragia intrapartum;
• postnatali (dopo la prima settimana di vita): infezioni, traumi cranici, intossicazioni, disturbi metabolici. [15]
Un fattore di rischio importante per lo sviluppo di paralisi cerebrale è rappresentato dalla nascita prematura che, negli ultimi decenni, grazie alle unità di terapia intensiva neonatale, è incrementata portando anche ad un aumento della prevalenza di paralisi cerebrale soprattutto nel caso in cui sia associata a basso peso e/o ritardo di crescita intrauterina.
Al potenziale nocivo della nascita prematura nel causare danno cerebrale contribuiscono vari elementi tra cui gli stessi eventi che hanno portato alla prematurità (patologia genetica, malformativa, infettiva, ipossica, …). Si deve inoltre tenere in considerazione che l’immaturità del sistema nervoso e quella degli altri organi (soprattutto apparato cardiovascolare e respiratorio) rendono il cervello maggiormente vulnerabile agli insulti ed in particolar modo a quelli vascolari. Un ultimo aspetto è rappresentato dal ruolo svolto dalle infezioni nel prematuro: una corioamniosite (infezione della membrana amniocoriale) materna aumenta il rischio di nascita prematura ed è frequentemente associata a danno encefalico e paralisi cerebrale. [7]
3.3 PARALISI CEREBRALE INFANTILE AD EZIOLOGIA ASFITTICA
INTRAPARTUM
L’erronea convinzione, in passato, che la causa principale della PCI fosse l’asfissia intrapartum [4], ha portato ad un incremento del parto cesareo che non ha tuttavia ridotto l’incidenza della patologia.
In realtà, come dimostrato da diversi studi epidemiologici, solo il 10% dei casi di paralisi cerebrale sono conseguenti ad una causa ipossica acuta intrapartum e, anche in alcuni di questi casi, può coesistere una componente prenatale [2].
L’International Cerebral Palsy Task Force [5] ha definito dei criteri che consentono di classificare come “intrapartum” un evento ipossico-ischemico acuto causa di una successiva paralisi cerebrale:
• criteri essenziali:
1. evidenza di acidosi metabolica (pH < 7 e deficit di basi > o = 12mmol/L) nell’arteria ombelicale entro 1 ora dalla nascita;
2. esordio precoce di encefalopatia moderata o severa in neonati >=34 settimane di età gestazionale;
3. paralisi cerebrale del tipo quadriplegia spastica o discinetica;
• criteri accessori (che suggeriscono il timing intrapartum ma non sono sufficienti da soli):
1. un eventuale evento ipossico sentinella immediatamente prima o durante il parto;
2. un’improvvisa rapida e prolungata alterazione della frequenza cardiaca fetale, precedentemente normale, dopo un evento ipossico sentinella;
3. indice di Apgar 0-6 per più di 5 minuti;
4. precoce evidenza di coinvolgimento multiorgano;
5. immagini neuroradiologiche precoci indicative di insulto cerebrale acuto.
I tre criteri essenziali sono indispensabili perché la paralisi cerebrale possa essere ricondotta ad un evento asfittico acuto intrapartum; in assenza anche di uno solo di questi criteri deve sorgere il sospetto che la causa della patologia sia differente. [8, 12]
La presenza di acidosi metabolica alla nascita è indicativa di un evento acuto, accaduto da poco, mentre la sua assenza consente di collocare lo stesso evento a distanza di tempo evidenziando che il feto ha avuto tempo di adattarsi ad una condizione cronica di ipossia.
Nel 2003, l’ACOG (American College of Obstetricians and Gynecologists) e l’APA (American Academy of Pediatrics) hanno introdotto un quarto criterio essenziale ed hanno ridefinito due dei cinque accessori. Il nuovo criterio essenziale è rappresentato dall’esclusione di altre identificabili eziologie di paralisi cerebrale, mentre le modifiche a quelli accessori sono le seguenti:
• indice Apgar nei primi 5 minuti dalla nascita tra 0 e 3;
• individuazione del timing dell’insorgenza del danno multiorgano.
Il calcolo del punteggio di Apgar è un metodo veloce ma soggettivo per verificare le condizioni del neonato, però è importante evidenziare che un basso punteggio non indica la causa della condizione (che può risultare da molti fattori di cui l’ipossia è solo uno) e, soprattutto quello ottenuto nei primi 5 minuti dalla nascita, non è esplicativo del successivo esito neonatale (il 75% dei bambini con paralisi cerebrale hanno normale indice di Apgar).
Alcuni autori hanno evidenziato una buona correlazione tra un Apgar estremamente basso a 15 e 20 minuti e complicanze neurologiche: un punteggio minore di 3 a 15 minuti è associato nel 53% dei casi a morte e nel 36% a sviluppo di paralisi cerebrale. Un punteggio persistentemente basso per 20 minuti, sarà seguito, nel 60% dei casi a morte e la metà dei neonati sopravvissuti presenterà paralisi cerebrale.
Un criterio essenziale per classificare come intrapartum una paralisi cerebrale è rappresentato dalla presenza di paralisi cerebrale del tipo tetraplegia spastica o discinetica [18].
La tetraplegia spastica, che interessa neonati a termine piccoli per l’età gestazionale e neonati di peso molto basso, è la più grave tra tutte le paralisi cerebrali poichè interessa tutti e quattro gli arti e si associa spesso a distonia, ritardo psicomotorio, paralisi pseudobulbare e microcefalia. Sono frequenti: sublussazione dell’anca, contratture, scoliosi così come crisi convulsive e anomalie oculari. Si può rinvenire sia l’atteggiamento tipico di adduzione-flessione delle anche ed equinismo del piede, che un atteggiamento in flessione del gomito, del polso e delle dita a livello metacarpo-falangeo. I bambini presentano inoltre un interessamento marcato degli arti superiori, incapacità a raddrizzare il capo, girarsi o sedersi per l’impossibilità di flettere le ginocchia e le anche.
La tetraplegia può essere anche discinetica, ovvero caratterizzata da movimenti involontari, incompleti o frammentari, talvolta bizzarri, di tipo atetosico, coreico o distonico. Il tono nelle sindromi discinetiche è variabile, inizialmente vi può essere ipotonia e successivamente ipertono; gli arti presentano spesso distonia di posizione. [9]
Oltre alla clinica anche la diagnostica per immagini (ecografia cerebrale e RMN) è importante per orientare sull’epoca in cui è avvenuto l’insulto: prenatale o perinatale.
L’ecografia cerebrale transfontanellare, in caso di asfissia acuta, permette di evidenziare edema cerebrale che insorge dopo 6-12 ore dal danno ipossico-ischemico e raggiunge la sua massima manifestazione dopo 2-4 giorni.
La Risonanza Magnetica Cerebrale può fornire indicazioni utili sul timing dell’insulto. Nel caso di un danno antepartale si possono osservare alterazioni differenti a seconda delle fasi di sviluppo neurologico. I segni neuroradiologici presenti dopo la nascita possono essere indicativi di un insulto antenatale o perinatale.
Per quanto riguarda l’insulto antenatale: lesioni cistiche (poroencefalia e leucomalacia periventricolare), atrofia, dilatazione scissura interemisferica e spazi extracerebrali, dilatazione o marcata asimmetria ventricolare, emorragie in via di organizzazione, displasia corticale, difetti della linea mediana o cerebellare.
I segni orientativi per insulto perinatale acuto: edema cerebrale, perdita di differenziazione della sostanza bianca e grigia, anormalità del segnale nei gangli basali, talami o braccio posteriore della capsula interna, segni di emorragia acuta o infarto nel territorio di un’arteria cerebrale o nelle zone arteriose di confine (dove la vascolarizzazione assume le caratteristiche di circolo terminale e il tessuto nervoso è più sensibile all’evento ischemico). [12]
Importante è la valutazione anatomo-istologica della placenta e, in caso di morte neonatale, l’esame autoptico. In caso di morte feto-neonatale, reperti placentari di microcalcificazioni, necrosi neuronale ed atrofia cerebrale sono suggestivi di insulto non recente mentre lesioni placentari quali villite, trombosi, infarti acuti, presenza di meconio e di fibrina perivillosa, indicano un insulto acuto recente.
L’insulto cerebrale nel neonato a termine si può esprimere con: emorragia subaracnoidea, subdurale, intraparenchimale e intraventricolare, infarto cerebrale focale, danno cerebrale secondario all’ipossia ischemica.
Le emorragie subaracnoidee e subdurali sono solitamente conseguenti al trauma del parto, le lesioni emorragiche intraparenchimali ed intraventricolari fortemente correlate alle modificazioni del flusso cerebrale secondarie ad ipossia, ipercapnia o scompenso congestizio. L’infarto cerebrale è conseguente ad eventi trombo-embolici di eziologia non chiara (ad esempio: trombofilia, policitemia, …). Sia l’emorragia intracranica che l’infarto cerebrale vengono diagnosticati dopo la comparsa di sintomi quali convulsioni ed apnea per cui la prevenzione dell’evoluzione di queste lesioni è limitata.
Le tipologie di insulti correlate ad un insulto cerebrale ipossico-ischemico sono le seguenti: danno a carico dei gangli della base, talamo e tronco cerebrale nel caso di anossia acuta; lesioni della corteccia parasagittale e delle zone di confine (sono le più frequenti nel neonato a termine) in caso di anossia più prolungata.
3.4 COME PREVENIRE LA PARALISI CEREBRALE
La paralisi cerebrale in alcuni neonati è conseguente non ad un’unica causa, ma ad una sequenza di eventi correlati tra loro che culminano nella patologia [19].
L’incidenza della paralisi cerebrale potrebbe essere ridotta almeno in parte intervenendo su alcune potenziali cause:
• ictus perinatale;
• infezioni intrauterine;
• gravidanze gemellari;
• asfissia alla nascita.
L’incidenza di ictus perinatale, evento che si verifica tra la 28° settimana di gestazione e 28 giorni post natali, è di 17-20 su 100.000 nati vivi. Alcuni fattori che contribuiscono alla vulnerabilità del feto o del neonato all’ictus ed alla successiva insorgenza di paralisi cerebrale sono rappresentati da: trombofilia ereditaria o acquisita fetale o neonatale, asfissia perinatale,
malattie cardiache, disturbi della coagulazione, infezioni sia neonatali (ad esempio meningite) che materne, pre-eclampsia, diabete materno, ritardo di crescita intrauterino, trombosi placentare, cateteri intravascolari (associati a complicanze tromboemboliche). [15, 20]
L’esposizione intrauterina ad infezione, soprattutto alla corioamniosite (infezione della placenta) sia nelle ultime fasi della gravidanza che durante il parto, è associata ad un aumento del rischio di paralisi cerebrale in neonati del peso alla nascita uguale o maggiore di 2500gr. In neonati molto prematuri l’associazione con paralisi cerebrale è meno frequente. L’esposizione intrauterina a toxoplasmosi, rosolia, citomegalovirus ed herpes symplex risulta responsabile del 12% dei casi di paralisi cerebrali di tipo spastico altrimenti inspiegabili in neonati di normale peso alla nascita. Sono stati effettuati diversi studi per valutare se la somministrazione di antibiotici durante la gravidanza poteva ridurre il rischio di paralisi cerebrale ma non hanno portato a risultati certi sia perché i campioni erano troppo piccoli sia perché i neonati erano stati seguiti per un periodo di tempo troppo breve. [21]
L’incidenza di paralisi cerebrale è maggiore nelle gravidanze gemellari rispetto a quelle singole (soprattutto nel caso in cui ci sia la morte intrauterina di un gemello): un bambino nato da gravidanza trigemellare ha una probabilità 47 volte maggiore, ed uno nato da una gravidanza gemellare 8 volte maggiore, rispetto ad uno nato da una gravidanza singola, di sviluppare paralisi cerebrale [22]. Tale aumento di rischio sembra essere correlato all’elevata frequenza di prematuri con basso peso alla nascita nei parti gemellari, ma soprattutto alla gravidanza gemellare in sé per sé in considerazione del fatto che, anche nei gemelli con peso alla nascita di 2500gr o più, il rischio di paralisi cerebrale è maggiore rispetto a neonati singoli dello stesso peso [23]. E’ stato inoltre evidenziato che nelle gravidanze gemellari monocoriali, la morte di un gemello è un importante fattore di rischio per la paralisi cerebrale dell’altro.
La presenza di asfissia alla nascita può essere dedotta dal rilievo di: basso indice di Apgar, respirazione spontanea assente o insufficiente dopo 2 ½ minuti, acidosi (pH < 7,15 su sangue capillare dopo 15-30 minuti dal parto), frequenza cardiaca fetale minore o uguale a 100bpm dopo 2 ½ minuti dalla nascita e convulsioni neonatali. Si deve però tenere in considerazione che tali condizioni non sono specifiche per l’asfissia visto che anche l’esposizione ad infezioni intrauterine e ad ipertermia materna può essere accompagnata da un basso indice di Apgar.
La diagnostica per immagini può aiutare nell’indicare il timing dell’insulto ipossico-ischemico e nel descrivere le anomalie conseguenti ma la maggior parte delle volte non servirà ad indentificare la causa dell’insulto.
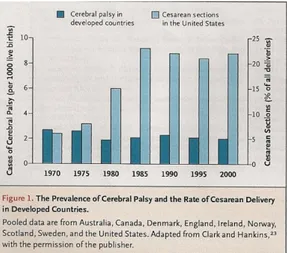
L’indicatore principale di un possibile evento asfittico durante il parto è rappresentato dalla frequenza cardiaca fetale che può essere valutata attraverso l’auscultazione o il monitoraggio fetale elettronico. Tuttavia numerosi studi non hanno dimostrato una riduzione della frequenza della paralisi cerebrale in casi in cui durante il parto era stato effettuato il monitoraggio, ma solo un aumento dell’esecuzione di tagli cesarei. A questo proposito, nel grafico sottostante, si riportano i risultati ottenuti da uno studio condotto all’inizio del 2000 in cui è stata confrontata, per un periodo di 30 anni, la prevalenza della paralisi cerebrale infantile e dei tagli cesarei in nove Paesi industrializzati. [15]
Figura 3. Prevalenza di paralisi cerebrale e percentuale di parti cesarei
Gli autori di tale studio hanno sono arrivati alle seguenti conclusioni: “despite a 5-fold increase in
the rate of cesarean section based, in part, on the electronically derived diagnosis of ‘fetal distress,’ cerebral palsy prevalence has remained stable” ovvero “nonostante un aumento di 5 volte della percentuale di tagli cesarei basata, in parte, sulla diagnosi elettronica di sofferenza fetale, la prevalenza della paralisi cerebrale è rimasta stabile”. [15]
4. MONITORAGGIO FETALE
Il controllo delle condizioni di benessere del feto è uno dei momenti fondamentali dell’assistenza ostetrica alla gravidanza ed al parto ed è un campo in continua evoluzione con importanti riflessi in ambito di responsabilità professionale.
Nella gravidanza a termine, il monitoraggio fetale, si pone come obiettivo quello di riconoscere tempestivamente feti a rischio di ipossia o di documentarla il più precocemente possibile, prima che evolva in acidosi esponendo il prodotto del concepimento a morte intrauterina o ad esiti neurologici permanenti [24].
Criteri utili per porre diagnosi di asfissia pre-parto sono rappresentati da: alterazione della frequenza cardiaca fetale, acidosi fetale (su sangue prelevato dalla parte presentata) e liquido amniotico tinto di meconio.
Dobbiamo tenere in considerazione che, anche durante un travaglio di parto in assenza di complicanze, le contrazioni dell’utero portano ad una riduzione del flusso ematico utero-placentare e quindi ad un minor apporto di ossigeno al feto. A questo punto possono manifestarsi due evenienze: se il feto non ha gli scambi gassosi compromessi le contrazioni non hanno conseguenze ma, se gli scambi sono alterati, l’ipercapnia e la riduzione della pO2 e del pH presenti possono superare la soglia critica inducendo modificazioni del ritmo cardiaco.
Il monitoraggio fetale consta delle seguenti metodiche [25, 26]:
1. valutazione materna dell’attività fetale (conta dei movimenti); 2. cardiotocografia con o senza induzione di contrazioni;
3. ecografia ostetrica;
4. dopplerflussimetria feto-placentare; 5. profilo biofisico fetale. 39-55
La scelta di quale tecnica utilizzare dipende dal rischio cui è esposto il feto, dall’esperienza e dalle risorse disponibili.
Questi test possono individuare uno stato ipossico cronico o un evento acuto permettendoci quindi di intervenire con il parto prima che si instauri un’acidosi metabolica progressiva, ma non servono per prevedere eventi acuti importanti quali quelli conseguenti a distacco di
placenta o a compressione del funicolo per cui la mortalità o la morbidità correlate a queste condizioni non sono né prevedibili né evitabili.
4.1 CONTA DEI MOVIMENTI FETALI
La conta dei movimenti fetali è l’unica metodica che la madre può utilizzare da sola senza ricorrere a personale medico.
Si possono distinguere varie tecniche per contare i movimenti fetali tra cui quella di Cardiff e quella di Sadovsky.
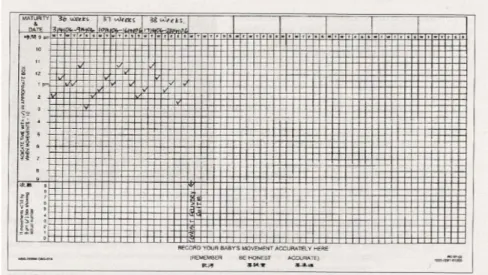
Nella prima la madre deve contare i movimenti fetali iniziando alle 9 di mattina continuando per 12 ore e segnare in un grafico l’ora a cui ne ha contati dieci (figura 4), se in 12 ore ne conta meno di dieci deve eseguire altri accertamenti (cardiotocografia, quantificazione del liquido amniotico, velocimetria doppler dell’arteria ombelicale). [27]
Figura 4. Conta dei movimenti fetali secondo il metodo Cardiff
Nella seconda tecnica la partoriente deve contare i movimenti che si verificano entro la prima ora dopo i pasti che dovrebbero essere almeno quattro, ma nel caso in cui fossero meno dovrebbe contarli per un’altra ora e, se anche dopo due ore fossero sempre meno di quattro si dovrebbe sottoporre ad ulteriori accertamenti perché il feto potrebbe essere a rischio. [11]
Sono stati effettuati due studi randomizzati su campioni di donne che hanno effettuato la metodica delle conta dei movimenti fetali. Il primo studio su 3111 donne danesi di cui 39% ad alto rischio e 61% a basso rischio, ha dimostrato una riduzione della mortalità fetale da 12/1569
a 3/1583. Il secondo studio effettuato su 68.000 donne a 28-32 settimane di gestazione, non ha dimostrato utilità del test (2,9‰ contro 2,7‰) [28].
Il conteggio dei movimenti fetali è raccomandato in gravidanze considerate a rischio per la salute del feto mentre non è consigliato di routine anche perché potrebbe indurre un aumento del livello d’ansia nelle madri ed avere di conseguenza un effetto negativo [27].
4.2 ECOGRAFIA OSTETRICA
L’ecografia è una tecnica che utilizza ultrasuoni il cui eco, che si verifica alla interfaccia tra tessuti a diversa eco-consistenza, captato dal trasduttore, viene trasformato in segnali elettronici che vengono evidenziati su uno schermo determinando delle immagini lette dall’operatore.
L’ecografia nel III trimestre viene effettuata, secondo le linee guida della SIEOG (Società Italiana di Ecografia Ostetrica e Ginecologica e Metodologie Biofisiche correlate), essenzialmente per valutare l’accrescimento del feto ed il volume del liquido amniotico e andrebbe eseguita, in assenza di fattori di rischio, tra la 32 e la 34 settimana di amenorrea.
In caso di rischio accertato o presunto di alterazione della crescita fetale, è consigliabile anticipare l’ecografia a 27-28 settimane. [29]
L’utilità dell’ecografia in tutte le gravidanze al terzo trimestre è controversa ed il razionale per tale screening è rappresentato dalla possibilità di individuare feti macrosomici o con ritardo di crescita, condizioni in cui un intervento migliorerebbe l’esito perinatale.
4.3 DOPPLERFLUSSIMETRIA FETO-PLACENTARE
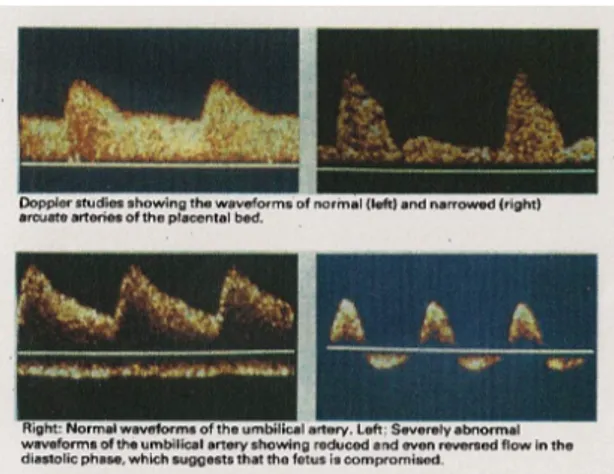
La velocimetria doppler studia il flusso di sangue nei rami dell’arteria uterina sul lato materno della placenta e nell’arteria ombelicale sul lato fetale utilizzando il principio Doppler.
Tale metodica è importante nel ridurre la morbidità e mortalità fetale in gravidanze a rischio di asfissia: le caratteristiche del flusso di sangue nell’arteria ombelicale sono diverse nel caso di un feto sano (velocità elevata del flusso diastolico) e di uno con ritardo di crescita su base ipossica (flusso ridotto, assente o invertito). [30]
Nel caso di un feto piccolo per l’età gestazionale, la forma delle onde dell’arteria ombelicale permette di distinguere un feto patologico da uno costituzionalmente piccolo. L’assenza o l’inversione del flusso nell’arteria ombelicale durante la diastole è correlata ad una mortalità nel
25-40% dei casi mentre un quarto dei neonati sopravvissuti svilupperanno importante morbidità; un feto piccolo con onde ombelicali normali non andrà incontro a complicanze alla nascita.
Figura 5. Dopplerflussimetria feto-placentare
L’ACOG, in una review del 2000 [31], suggerisce di utilizzare la velocimetria doppler solo in caso di sospetta restrizione della crescita uterina o in caso di gravidanze complicate da ipertensione poichè non è di alcuna utilità in presenza di altre patologie né come metodica di screeening per gravidanze a basso rischio.
L’incidenza di mortalità perinatale in gravidanze a rischio è stata ridotta del 38% a seguito di interventi basati sull’identificazione di un flusso alterato dell’arteria ombelicale. [26]
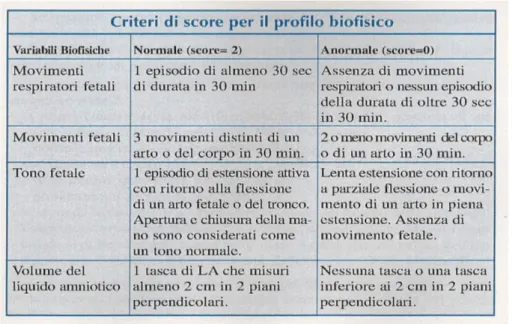
4.4 PROFILO BIOFISICO FETALE
Il profilo biofisico fetale (BPP) consiste nell’effettuazione, in un intervallo di tempo di 30 minuti, di un “non stress test” (rilevazione contemporanea del battito cardiaco fetale e delle contrazioni uterine al di fuori del travaglio di parto per un periodo di almeno 20 minuti) e nella valutazione ecografica dei seguenti parametri [27]:
• tono fetale: uno o più episodi di estensione di un’estremità fetale con ritorno alla flessione o di apertura o chiusura di una mano;
• movimenti grossolani del tronco o degli arti (tre o più movimenti entro trenta minuti); • movimenti fetali respiratori (uno o più episodi di movimenti respiratori fetali ritmici di
almeno 30 secondi in un periodo di 30 minuti. Sono rappresentati da flussi di liquido tracheale in entrata ed in uscita e sono stati definiti movimenti paradossali della parete toracica);
• volume del liquido amniotico (è sufficiente una singola tasca verticale di liquido amniotico maggiore di 2 cm).
Figura 6. Criteri per la valutazione del profilo biofisico fetale
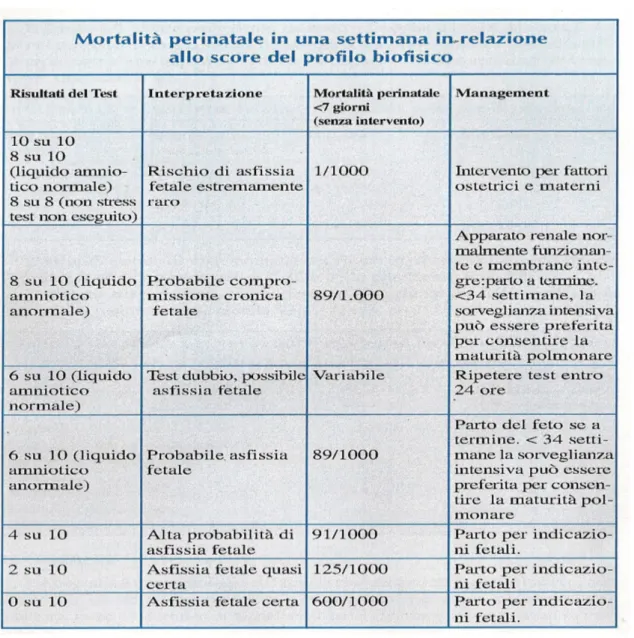
Come riportato nella tabella soprastante [28], ad ognuno dei parametri viene attribuito un punteggio che va da 0 a 2, quindi si fa la somma totale e, se il punteggio complessivo raggiunge un valore da 8 a 10, c’è un’elevata probabilità che il feto non vada incontro a sofferenza asfittica, mentre se varia tra 0 e 2 la probabilità di asfissia è elevata.
Nelle pazienti con score 8-10 o 6-10 (e liquido amniotico anormale) è indicato l’espletamento del parto quando il feto è a termine. Nei feti pretermine fino a 34 settimane è consigliata una sorveglianza intensiva con l’induzione terapeutica della maturità polmonare fetale. [28]
Figura 7. Correlazione tra mortalità perinatale e profilo biofisico fetale
In Italia è più diffuso il BPP modificato che considera soltanto frequenza cardiaca fetale ed il volume di liquido amniotico. Il test, che è molto attendibile (il valore predittivo negativo è 99.8%), è normale se sia il non stress test (NST) che l’amniotic fluid index (AFI) sono nella norma.
Durante il secondo ed il terzo trimestre il liquido amniotico è indicativo della diuresi fetale e quindi della funzione utero-placentare. Una disfunzione della placenta può causare diminuzione della perfusione fetale renale e di conseguenza oligoamnios con alterazione del profilo biofisico fetale; ciò ci fa comprendere come la quantificazione del liquido amniotico permetta di valutare anche la funzione utero-placentare. In assenza di perdita di liquido da rottura delle membrane, la sua diminuzione (ologoamnios) viene interpretata come segno di sofferenza fetale. Anche l’eccessivo aumento di liquido amniotico (polidramnios) può essere espressione di
malformazioni dell’apparato gastroenterico (diminuzione della deglutizione) ed è risultato essere associato anche ad altre malformazioni.
Il calcolo dell’AFI si esegue suddividendo l’utero in quattro teorici quadranti, misurando in ogni quadrante la tasca amniotica verticale più profonda ed effettuandone quindi la somma in cm: un AFI di almeno 5 cm è considerato un volume adeguato di liquido amniotico. [32, 33]
Secondo le linee guida ACOG del 1999, l’oligoamnios è comune nelle gravidanze post-termine ed è considerato un’indicazione all’espletamento del parto in quanto è solitamente associato ad un rischio aumentato di compressione del cordone ombelicale con conseguente sofferenza fetale e quindi necessità di taglio cesareo.
In caso di una gravidanza vicino al termine complicata da oligoamnios, il parto costituisce l’opzione più appropriata, ma si deve valutare il singolo caso perché il parto, in presenza di altri test rassicuranti, può essere differito senza rischio.
Nelle gravidanze non ancora a termine la condotta clinica va adeguata alle condizioni materno-fetali: formulata una diagnosi di oligoamnios, se non è consigliato l’espletamento del parto, si deve effettuare il follow-up del volume del liquido amniotico e della crescita fetale. [34]
Il Non Stress Test (NST) valuta la capacità di risposta del cuore fetale a stimoli non invasivi; se il NST è reattivo, cioè normale (quando il feto si muove aumenta la sua frequenza cardiaca), esiste un’elevata probabilità che il feto sia in buone condizioni; se il NST è non reattivo, cioè alterato, non significa che il feto sia sicuramente in condizioni di sofferenza, ma che sono necessarie altre indagini.
Tale test consiste nella rilevazione contemporanea del battito cardiaco fetale e delle contrazioni uterine al di fuori del travaglio e dovrebbe essere effettuato per almeno 20 minuti durante i quali: il battito cardiaco fetale di base dovrebbe mantenersi tra 120 e 160 bpm, si dovrebbero verificare almeno due accelerazioni di almeno 15bpm per 15 secondi. Se il test è non reattivo, il monitoraggio dovrebbe continuare per altri venti minuti, se anche dopo questo periodo il risultato non cambia sarebbe consigliabile eseguire ulteriori test come lo “stress contraction test”.
Nonostante tale test sia in uso nella pratica clinica da oltre 30 anni, non ci sono sufficienti studi che ne valutino l’efficacia nel ridurre gli esiti perinatali sfavorevoli; inoltre non può essere
utilizzato da solo in gravidanze a rischio medio-alto perché ha sia una bassa percentuale di falsi negativi, che un’alta di falsi positivi. Il valore predittivo del non stress test nell’individuare l’acidosi metabolica alla nascita è solo del 44%. Per tali motivi è necessario che venga associato ad altre indagini.
E’ importante tenere in considerazione che circa il 50% dei feti normali tra la 24 e la 28 settimana di gestazione avrà un test non reattivo a causa dell’immaturità del sistema simpatico fetale. [26]
Il profilo biofisico fetale dovrebbe essere utilizzato solo nel caso di feti a rischio mentre le opinioni sono controverse riguardo il suo impiego come test di screening in tutte le gravidanze al terzo trimestre. Il razionale di tale screening è rappresentato dalla possibilità di individuare feti con crescita ridotta o macrosomici, casi in cui un intervento migliorerebbe l’esito perinatale.
4.5 CONTRACTION STRESS TEST
Il “contraction stress test” è una valida alternativa in centri in cui non si può ricorrere al profilo biofisico fetale ed ha lo scopo di valutare la risposta fetale allo stress indotto da contrazioni uterine e la relativa insufficienza feto-placentare.
Consiste nell’indurre contrazioni uterine iniettando ossitocina o stimolando il capezzolo mentre continua il monitoraggio cardiotocografico. L’obiettivo è indurre tre contrazioni che durino almeno un minuto entro un periodo di 10 minuti. Se in più del 50% delle contrazioni si presenta una decelerazione tardiva, allora il test sarà positivo (indicativo di ridotta ossigenazione fetale), un test negativo è caratterizzato dall’assenza di decelerazioni mentre un test sospetto è rappresentato da decelerazioni tardive intermittenti, decelerazioni variabili o un’anomala linea di base (<110bpm o >160bpm). [26-35]
Tale test non dovrebbe essere utilizzato in pazienti in cui è controindicato il parto vaginale (ad esempio per placenta previa), in caso di pregresso taglio cesareo o interventi a livello dell’utero (con rischio di rottura utero) e si dovrebbe far attenzione se si effettua prima della 37 settimana di gestazione in pazienti a rischio di parto pretermine. Deve essere preceduto da un non stress test per 20 minuti.
5. MONITORAGGIO DELLA FREQUENZA CARDIACA FETALE
Una delle metodiche più utilizzate per il monitoraggio fetale, come già ricordato, è la registrazione del battito cardiaco fetale che ha l’obiettivo di rilevare una sua alterazione grazie alla quale riconoscere tempestivamente una condizione di ipossia e prevenirne la possibile evoluzione verso una situazione di acidosi metabolica ed una conseguente morte fetale o un danno cerebrale del neonato.
L’importanza della valutazione della frequenza cardiaca fetale è correlata alla peculiarità delle variazioni di tale parametro che si verificano in seguito all’ipossia.
L’ipossia intrapartum, come precedentemente ricordato, può svilupparsi in seguito ad eventi acuti (ipercinesia uterina, distacco di placenta o compressione funicolare) o cronici (patologie vascolari ad es. nella restrizione della crescita intrauterina).
L’ipoperfusione placentare cronica può essere esacerbata dalla ridotta perfusione intervillosa durante le contrazioni uterine o dall’ipotensione materna e l’iniziale risposta all’ipossia cronica è rappresentata dall’aumento della gittata cardiaca (attraverso l’aumento della frequenza cardiaca) e dalla sua ridistribuzione al cervello ed al cuore. A tale meccanismo di compenso può seguire una riduzione nella variabilità della frequenza cardiaca dovuta all’ipossia del tronco encefalico. L’ipossia continuata e progressiva determina danno miocardico e decelerazioni del battito cardiaco. Al contrario, l’ipossia acuta determina una diminuzione della frequenza cardiaca fetale (decelerazioni o bradicardia) inizialmente prodotta dalla stimolazione vagale mediata dai chemocettori, e successivamente anche dall’ischemia miocardica.
Il battito cardiaco fetale può essere controllato utilizzando uno stetoscopio di Pinard, un ecodoppler, oppure il cardiotocografo. [36]
La cardiocotografia è un esame che serve per controllare lo stato di salute del feto e consiste nella registrazione contemporanea, per un lasso di tempo che può variare dai 30 ai 90 minuti, della frequenza del battito cardiaco fetale (cardiografia) e delle contrazioni uterine (tocografia) tramite due trasduttori applicati sull’addome materno: un doppler ad ultrasuoni ed un tocografo. In questo caso si parla di cardiotocografia esterna ma si può ricorrere anche alla cardiotocografia interna in cui è necessaria la rottura del sacco amniotico per applicare un elettrodo alla parte presentante del feto (solitamente il capo) registrando direttamente i
complessi elettrocardiografici del feto, mentre i potenziali materni non vengono rappresentati. I risultati di questo esame vengono registrati costantemente su due tracciati di tipo ondulatorio e confrontati parallelamente.
I vantaggi della cardiotocografia interna sono rappresentati da:
− qualità del tracciato ottimale anche in situazioni non ideali per il trasduttore esterno (per es. in donne obese od insofferenti al monitoraggio esterno);
− possibilità di maggiore movimento materno e quindi maggiore tollerabilità, anche nel caso di monitoraggio molto prolungato.
Gli svantaggi di tale tecnica sono i seguenti:
− necessità di una minima dilatazione della cervice uterina e di sacco amniotico rotto; − parte presentata chiaramente identificabile;
− la frequenza cardiaca fetale (FCF) non viene registrata se inferiore a 30 bpm mentre, se superiore a 240 bpm, viene automaticamente dimezzata;
− è una tecnica invasiva ed è presente il rischio, anche se minimo, di infezione fetale; − in caso di morte fetale viene registrata la frequenza cardiaca materna (per tale motivo è
necessario il controllo del BCF con il polso materno, come per la registrazione addominale con gli ultrasuoni).
Si devono considerare anche alcune controindicazioni: madre HIV ed HCV positiva, fattori ostetrici che impediscano l’amniorexi, presentazioni anomale (podice, faccia).
La cardiotocografia, anche se è conosciuta come una metodica di monitorizzazione continua della frequenza cardiaca fetale durante il parto, a volte può essere utilizzata in maniera intermittente. [36]
Il battito cardiaco fetale fu rilevato per la prima volta nel 1600 in Francia da Marsac ma questa scoperta passò inosservata fino al 1818, quando Mayor e Kergaradec descrissero il suono del cuore fetale appoggiando un orecchio sull’addome materno.
Nel 1819 Kergaredec cominciò ad utilizzare il cilindro di Laennec4 (fig. 9) per auscultare il
battito cardiaco fetale e ipotizzò che le variazioni del benessere del feto fossero correlate a variazioni nella frequenza e nella forza dei battiti fetali.
Figura 9. Stetoscopio di Laennec
Nel 1847 Depaul evidenziò l’importanza dei rallentamenti transitori della frequenza cardiaca fetale durante le contrazioni dell’utero ed il fatto che la compressione del cordone o della placenta e le contrazioni irregolari e tetaniche dell’utero conducessero agli stessi risultati, ovvero ad una specie di asfissia. Egli inoltre affermò che in caso di asfissia, mentre nell’adulto la risposta cardiaca è la tachicardia, nel feto compare la bradicardia. Vennero anche identificati i vari gradi del distress fetale:
1. decelerazioni sincrone con le contrazioni, pericolose se intense; 2. decelerazioni tardive più pericolose;
3. progressiva o permanente bradicardia frequentemente associata alla morte fetale.
Nel 1890 Pinard modificò il cilindro di Laennec creando il primo stetoscopio per l’auscultazione fetale che è tuttora in uso (fig.10).
4 Nel 1816 René Theophile-Hyacinthe Laennec utilizzò per primo un quaderno arrotolato appoggiato al torace e successivamente un
cilindro di legno svasato alle due estremità e cavo all’interno, in modo da creare una camera d’aria attraverso la quale i suoni venivano amplificati. Tale cilindro venne chiamato stetoscopio “(stethos=pectus), tubus acusticus, cilindro, bastone o cornetto”.
Figura 10. Stetoscopio di Pinard
Sempre nel XIX secolo Andreas Doppler identificò l’effetto doppler che venne usato per il monitoraggio elettronico della frequenza cardiaca fetale e per lo studio ecografico del flusso ematico nel distretto vascolare materno-fetale.
Nel 1954 Caldeyro Barçia effettuò i primi tentativi di registrazione elettrocardiografica della frequenza cardiaca fetale posizionando gli elettrodi sul corpo fetale e sull’addome materno; nel 1963 Edward Henry Hon decise di porre gli elettrodi sullo scalpo fetale per ridurre i segnali di disturbo. Negli stessi anni fu introdotta la registrazione fonocardiografica della frequenza cardiaca fetale mettendo un microfono sull’addome materno.
Nel 1968, grazie alla decisione di sfruttare la tecnica ultrasonica per registrare la frequenza cardiaca fetale, nacque la cardiotocografia che consentiva di registrare contemporaneamente la frequenza cardiaca fetale e la contrazione uterina. [37]
In Germania negli anni ’60 fu sviluppata la tecnica di monitoraggio dell’equilibrio acido-base ricorrendo al prelievo di sangue dal cuoio capelluto del feto, metodica poi introdotta nella pratica clinica in aggiunta al monitoraggio elettronico.
Agli inizi degli anni ’70, quando si riteneva che la maggior parte dei casi di paralisi cerebrale infantile fosse conseguente ad asfissia intrapartum, venne introdotto il monitoraggio elettronico della frequenza cardiaca fetale durante il travaglio di parto con l’obiettivo di riconoscere tempestivamente una condizione di ipossia e prevenirne, attraverso la rapida estrazione del feto, l’ulteriore possibile aggravamento verso l’acidemia metabolica e l’eventuale conseguente danno cerebrale, con morte o paralisi cerebrale.
L’esperienza raccolta da vari studi effettuati negli ultimi decenni non ha tuttavia confermato l’utilità del monitoraggio cardiotocografico della frequenza cardiaca fetale in travaglio.
In uno studio eseguito da Nelson su 155.636 nati tra il 1983 ed il 1985, sono stati identificati 78 bambini di peso alla nascita superiore a 2500gr che a tre anni presentavano paralisi cerebrale e sono stati comparati con 300 bambini che avevano avuto le stesse caratteristiche durante il travaglio ma non avevano sviluppato paralisi cerebrale. Da tale studio è risultato che l’alterazione cardiotocografica che più frequentemente si associava alla paralisi cerebrale era rappresentato da multiple decelerazioni tardive e dalla riduzione della variabilità battito-battito. [12, 36]
Il rilievo di tali parametri cardiotocografici non poteva però essere utilizzato come indice di predizione di paralisi cerebrale a causa dell’elevata frequenza di falsa positività (quasi del 99%) dei tracciati che faceva sì che frequentemente, feti con patterns cardiotocografici non rassicuranti nascessero perfettamente normali.
I tracciati cardiotocografici sono inoltre caratterizzati da un’elevata variabilità inter e intra-operatore, ovvero possono essere interpretati in maniera differente da operatori differenti ed anche dallo stesso operatore in momenti diversi. [8]
Nel 1986 Thacker e Berkelman hanno rilevato che la cardiotocografia antepartale non ha capacità predittiva riguardo all’ipossia acuta a meno che non si verifichi durante l’esecuzione del test, mentre ha una discreta capacità predittiva per l’ipossia cronica sempre che la durata della registrazione cardiotocografica sia sufficiente. Gli autori hanno concluso suggerendo l’uso della cardiotocografia non “a tappeto” in tutte le gravidanze, che aumenterebbe solo l’incidenza di indagini e di tagli cesarei inutili, bensì nelle gravidanze ad alto rischio ipossico anche se non come unico test diagnostico. Tali risultati sono stati successivamente confermati da altri studi tra cui quello di Malcus del 2004. [8]
La CTG antepartum viene solitamente effettuata dopo la 30 settimana di gestazione con frequenza variabile a seconda del tipo di patologia materno-fetale.
E’ un buon test di screening utile più per escludere che per diagnosticare sofferenza fetale in quanto, pur non riuscendo a predire con certezza il fetal distress per la scarsissima specificità, quando non ci sono anomalie, ha un valore predittivo negativo eccellente. Si deve tener presente che essa non può prevedere l’instaurarsi di un evento acuto ma lo può identificare solo se si presenta durante la registrazione del battito cardiaco fetale [38].
Figura 11. Correlazione tra monitoraggio elettronico fetale intrapartale e morbidità neurologica neonatale.
A dimostrazione dei risultati deludenti degli studi riportati nella tabella soprastante [39], il fatto che, dopo circa 30 anni di uso della cardiotocografia, l’incidenza della paralisi cerebrale è
rimasta stabile nel tempo mentre si è verificato un aumento dei tagli cesarei.
5.1 AUSCULTAZIONE INTERMITTENTE VS MONITORAGGIO FETALE ELETTRONICO CONTINUO IN TRAVAGLIO DI PARTO
La sorveglianza della frequenza cardiaca fetale durante il travaglio può essere effettuata in maniera intermittente (con lo stetoscopio di Pinard, con uno strumento doppler o con il cardiotocografo) o continua (con il cardiotocografo). Ogni evento intrapartum che altera il BCF (fasi sonno-veglia, postura della madre, ipotensione, …) dovrebbe essere annotato sul tracciato cardiotocografico (se utilizzato il CTG) o in cartella clinica (ad esempio nel partogramma).
L’auscultazione intermittente del BCF in travaglio nella gravidanza a basso rischio dovrebbe essere effettuata immediatamente dopo una contrazione per 60 secondi e ogni 15 minuti nel primo stadio del travaglio ed ogni 5 minuti nel secondo stadio. Tale monitoraggio, se eseguito con lo stetoscopio o con il doppler, permette di rilevare le seguenti caratteristiche della FCF: il ritmo, l’aumento o diminuzione della frequenza cardiaca di base, la tonalità e l’intensità. [2, 12]
L’auscultazione dovrebbe riuscire ad identificare: la FCF basale (livello medio della FCF per un determinato periodo di tempo), le oscillazioni rapide (variazioni di breve durata della FCF), le variazioni periodiche e transitorie della FCF (periodiche perché frequentemente sono correlate alla contrazione uterina), le variazioni prolungate della FCF (tachicardia e bradicardia).
Tale tipologia di monitoraggio non consente tuttavia di valutare la variabilità della FCF o il tipo di decelerazione come invece si può fare con il CTG.
La Cochrane Library ha revisionato molti studi che si occupavano di confrontare l’utilità dell’auscultazione intermittente rispetto al monitoraggio elettronico in continuum ed ha concluso evidenziando che la CTG in continuum non è indicata in gravidanze a basso rischio perché si associa frequentemente ad un aumento dei tagli cesarei e dei parti vaginali strumentali con conseguente aumento di possibili complicanze (lesioni vescicali materne, tromboembolia, placenta previa in gravidanze future) anche se questo aumento potrebbe essere ridotto ricorrendo ad esami ematici fetali [40, 41]. Secondo questi studi, il solo beneficio clinico significativo correlato al monitoraggio elettronico fetale (EFM) continuo è rappresentato dalle riduzione delle convulsioni neonatali mentre tale sorveglianza non è associata a differenze rilevanti nell’incidenza di paralisi cerebrale e morte neonatale.
Quanto appena affermato riguarda le gravidanze a basso rischio mentre in caso di gravidanze ad alto rischio non è indicata l’auscultazione intermittente bensì il monitoraggio elettronico continuo.
L’auscultazione intermittente dovrebbe essere convertita in monitoraggio continuo in caso di:
− presenza all’auscultazione di una linea di base <110 o >160 bpm; − presenza di ogni tipo di decelerazione;
− comparsa di fattori di rischio intrapartum.
5.2 MONITORAGGIO FETALE ELETTRONICO INTERMITTENTE VS CONTINUO IN TRAVAGLIO DI PARTO
Uno studio clinico randomizzato (RCT) del 1994 ha confrontato l’utilità del monitoraggio cardiotocografico continuo rispetto a quello intermittente analizzando 4.044 donne a basso rischio di complicanze ostetriche di cui una metà era stata monitorizzata con cardiotocografia continua e l’altra con cardiotocografia intermittente. Entrambi i gruppi erano stati sottoposti a monitoraggio continuo durante il secondo stadio del travaglio.
Non sono state rilevate differenze significative fra i due gruppi per quanto riguarda la modalità del parto, il pH dell’arteria ombelicale, i punteggi Apgar o il trasferimento in terapia intensiva neonatale.
![Figura 1. Rappresentazione schematica dei principali meccanismi alla base del danno ischemico cerebrale dopo asfissia perinatale [7]](https://thumb-eu.123doks.com/thumbv2/123dokorg/7541819.108278/5.892.84.513.107.429/rappresentazione-schematica-principali-meccanismi-ischemico-cerebrale-asfissia-perinatale.webp)