- 3 -
- 4 -
Ossido Nitrico Sintetasi (NOS)
La funzionalità dell’NO è regolata dall’attività dell’enzima ossido nitrico sintetasi (o nitric oxide sinthase o NOS) che catalizza la sintesi dell’NO attraverso una reazione multi-step di conversione dell’amminoacido L-Arginina in L-Citrullina ed NO: si tratta di due reazioni di ossidazione consecutive con NG-idrossi-L-Arginina come intermedio. In alternativa, NO può essere prodotto per via non enzimatica per disproporzione dei nitriti e loro riduzione, reazione che avviene quando il pH tissutale tende ad abbassarsi (pH acido), per esempio in condizioni di ischemia.
La famiglia delle ossido nitrico sintetasi (NOSs) è stata identificata per la prima volta nel 1989 e le tre principali isoforme sono state clonate e purificate tra il 1991 e il 1994; la prima struttura cristallina è stata descritta tra il 1998 e il 1999 ma l’importanza dell’ossido nitrico fu riconosciuta nel 1998 con l’assegnazione del Premio Nobel a R. Furchgott, L. Ignarro e F. Murad per la scoperta del ruolo dell’ossido nitrico come mediatore biologico nelle cellule dei mammiferi [1]. Le tre isoforme della NOS sono prodotte da geni distinti e che hanno diverse localizzazioni, regolazioni, proprietà catalitiche e sensibilità agli inibitori. Esse presentano il 51-57% di omologia tra le forme umane e sono comunemente chiamate:
NOS neuronale o nNOS o NOS-1, identificata per prima e situata nei tessuti neuronali;
NOS inducibile o iNOS o NOS-2, l’isoforma inducibile in una vasta gamma di cellule e tessuti;
NOS endoteliale o eNOS o NOS-3, identificata per la prima volta nel sistema vascolare.
Sia la nNOS che la eNOS sono costitutivamente espresse mentre la iNOS necessita dell’induzione da parte di citochine per essere espressa. Le NOS costitutive sono capaci di produrre NO a concentrazioni nanomolari per tempi limitati (minuti) mentre la eNOS è capace di produrre NO a concentrazioni micromolari per un periodo di almeno 48-72 ore. Queste isoforme sono state anche distinte in passato della loro calcio-dipendenza (eNOS e nNOS) o calcio-indipendenza (iNOS). Infatti sia la nNOS che la eNOS catalizzano la sintesi di NO in presenza di variazioni transitorie della concentrazione intracellulare di ioni calcio mentre la iNOS produce NO finché è presente il substrato naturale e per questo può essere definita calcio-indipendente.
- 5 -
Le NOS sono sottoposte ad un controllo inibitorio (feedback negativo) da parte dell’NO stesso, che permette di ridurre la sintesi dell’enzima in presenza di elevate concentrazioni locali di NO. Per quanto riguarda l’espressione dell’isoforma iNOS, si ha l’induzione dell’iNOS sia indiretta attraverso le citochine, sia diretta dall’NF-kB (fattore nucleare kappa B). Quest’ultimo è un fattore di trascrizione che regola l’espressione di circa 150 geni, specialmente quelli riguardanti i processi infiammatori e la risposta acuta allo stress. Quando è attivato, eccita sia i geni delle citochine infiammatorie sia il gene della iNOS: in presenza di elevate concentrazioni di NO, questo è in grado di legarsi al fattore NF-kB impedendone la traslocazione dal nucleo e quindi bloccando la traduzione del gene della iNOS.
La nNOS è stata clonata a partire da cDNA cerebellare umano e di ratto [2]; è localizzata a livello dei neuroni (in particolare astrociti), nelle cellule secernenti, nel muscolo scheletrico e nel muscolo cardiaco, nelle isole pancreatiche e negli epiteli polmonare e gastrico. L’attività della NOS neuronale a livello cerebrale è legata alla plasticità sinaptica NO-mediata mentre a livello del sistema nervoso periferico la nNOS provoca rilasciamento della muscolatura liscia [3].
La iNOS è l’unica tra le isoforme di questo enzima ad essere prodotta in seguito a stimoli infiammatori e, a differenza delle altre isoforme, la sua attività dipende dai livelli intracellulari di Ca2+ [4]. E’ localizzata nei monociti/macrofagi, nelle cellule endoteliali, nei mastociti, nel muscolo cardiaco e nel muscolo liscio, nei cheratinociti e negli epatociti. Come nNOS e eNOS, la iNOS si lega alla calmodulina ma con un’affinità superiore anche a basse concentrazioni di Ca2+ : quindi una volta indotta ed espressa, la iNOS sintetizza continuamente NO.
Infine la eNOS è stata clonata a partire da cellule endoteliali aortiche bovine e umane [2]; è miristilata e palmitoilata e questo spiega la sua localizzazione a livello delle membrane biologiche. Inoltre la eNOS viene fosforilata in seguito a stimolazione delle cellule endoteliali causato da stress da attrito, mediatori dell’infiammazione, bradichinina e altri agenti vasorilassanti: la eNOS fosforilata viene traslocata dalla membrana al citosol quindi la fosforilazione è stata proposta come meccanismo di regolazione dell’attività della eNOS [5]. La eNOS è espressa nei neuroni, nel muscolo cardiaco, nell’epitelio renale, negli epatociti, nei linfociti T e B e nelle cellule endoteliali; a livello delle cellule endoteliali è responsabile della produzione di EDFR (endothelium derived releasing factor), sostanza vasodilatante che nel 1980 Furchgott e Zawadzki scoprirono coincidere con l’NO.
- 6 -
Oltre alle tre canoniche forme di NOS, esiste anche un'altra isoforma dell’enzima denominata NOS mitocondriale (mtNOS), legata alla membrana interna dei mitocondri ed espressa costitutivamente. Interagisce attraverso il suo dominio PDZ con la citocromo c ossidasi e con il complesso I della catena di trasporto mitocondriale. Recenti studi hanno dimostrato che la mtNOS è l’isoforma nNOS dell’enzima con successive modificazioni post-traduzionali come la fosforilazione della Ser1412 e miristilazioni di alcuni residui della proteina [6]. In condizioni fisiologiche la produzione di NO, da parte della mtNOS, è importante nel mantenimento del metabolismo cellulare, poiché è in grado di modulare il consumo di O2 nei mitocondri, attraverso il suo legame reversibile con la citocromo c ossidasi. Al contrario, elevate concentrazioni di NO o dei suoi derivati (perossinitrito, ONOO-; nitrosotioli, SNO) possono causare l’inibizione irreversibile della catena di trasporto mitocondriale, indurre stress ossidativo/nitrosativo e portare anche a morte cellulare.
Struttura della NOS
Esistono tre diversi geni che codificano per le NOS neuronale, inducibile ed endoteliale e ognuno di questi geni è presente in singola copia nel genoma umano aploide. I geni delle NOS hanno struttura genomica simile e questo suggerisce una loro derivazione da un unico gene NOS ancestrale.
Isoforme umane della NOS Dimensione e struttura del gene Locazione cromosomiale Numero di amminoacidi e dimensione
nNOS (NOS-1) 29 esoni, 28 introni, >200 kpb
12q24.2-12q24.3 del cromosoma 12
1433 aa, 160 kDa
iNOS (NOS-2) 26 esoni, 25 introni, 37 kpb
17cen-q12
del cromosoma 17
1153 aa, 131 kDa
eNOS (NOS-3) 26 esoni, 25 introni, 21-22 kpb
7q35-7q36 del cromosoma 7
1203 aa, 133 kDa
Figura 1 Ossido nitrico sintetasi umane
L’ossido nitrico sintetasi è un enzima multidominio in cui si possono individuare:
Un dominio ossigenasico N-terminale che contiene i siti di legame per l’eme, la BH4 (tetraidrobiopterina) e la L-Arginina;
- 7 -
Un dominio reduttasico C-terminale che contiene i siti di binding per FAD, FMN e NADPH;
Il sito di binding della calmodulina (CaM) che fa da ponte tra dominio ossigenasico e reduttasico.
Figura 2 Struttura dei domini delle tre isoforme della NOS umana
In generale tutte e tre le isoforme della NOS hanno una struttura dimerica allo stato attivo e l’interfaccia di associazione tra i due monomeri coinvolge il dominio ossigenasico e include il sito di legame per la BH4 favorendo così la formazione della tasca del sito attivo che contiene l’eme e L-arginina. Si forma un canale aperto esposto ai solventi che offre un accesso facilitato al substrato naturale, l’amminoacido L-Arginina. In letteratura sono stati descritti i domini catalitici della iNOS e della nNOS.
Dominio catalitico della iNOS
Il dominio catalitico della iNOS (amminoacidi 85-508) presenta una forma allungata con una tasca distale con struttura secondaria a foglietto β che differisce dalle tasche distali di altri enzimi contenenti il gruppo eme (quali il citocromo P450, perossidasi e catalasi) che sono generalmente α-eliche. Le caratteristiche del sito catalitico della iNOS si ritrovano senza grosse variazioni anche nella eNOS umana [7].
- 8 -
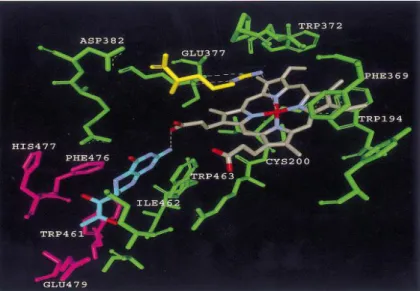
Figura 3 Sito catalitico della iNOS umana. Il ferro del gruppo eme (grigio) è pentacoordinato con la Cys200 della iNOS; l’anello porfirinico è racchiuso tra i residui Trp194 e Phe369. Il gruppo guanidinico della L-Arginina (giallo) forma due legami a idrogeno, uno con il carbonile del Glu377 e uno con il carbonile del Trp372. In celeste è rappresentata la BH4 che si sovrappone all’anello indolico del Trp463.
Nella iNOS umana il ferro del gruppo eme è pentacoordinato e assialmente co-coordinato con la Cys200 prossimale [8]. Il gruppo eme è inserito all’interno dell’enzima e forma forti interazioni di Van der Waals con le catene laterali idrofobiche e alifatiche dei residui amminoacidici. Due residui aromatici, Trp194 e Phe369, racchiudono l’anello porfirinico; la dimerizzazione crea un canale a forma di imbuto, profondo ≈ 30Å che funge da sito attivo. La L-Arginina si lega saldamente alla parte più stretta della cavità del sito attivo attraverso la catena laterale e attraverso il gruppo guanidinico che giace coplanare rispetto all’eme. Nella iNOS umana il gruppo guanidinico della L-Arginina forma due legami a idrogeno con due gruppi carbonilici: uno con il carbonile del Glu377 e uno con il carbonile del Trp372 [9]. Il Glu377 sembra essere fondamentale per il legame della Arginina all’enzima. Ulteriori legami a idrogeno si formano tra il carbonile della L-Arginina e la Tyr367 e il carbonile dell’Asp376, che nella eNOS è sostituito da un Asn (Asparagina).
Vicino all’interfaccia del dimero è presente inoltre la cavità BH4 (tetraidrobiopterina) localizzata all’interno dell’enzima.
Dall’analisi della struttura cristallina dell’enzima è stata scoperta la presenza di uno zinco sull’estremità inferiore della superficie del dimero, tetracoordinato con due cisteine (Cys110 e Cys115). Questo centro risulta presente in tutte le sequenze di NOS conosciute fino ad oggi. Lo zinco è equidistante dai gruppi eme e ciascuna Cys115 è separata mediante solo 4 residui amminoacidici dalla Ser119, che viene direzionata verso BH4 da
- 9 -
una serie di legami a idrogeno: questo significa che lo zinco è importante per la stabilizzazione del dimero ma non influenza l’attività dell’enzima [10].
Un confronto tra eNOS e della iNOS umana rivela la loro similitudine riguardo a struttura molecolare, orientazione relativa dei cofattori e stechiometria all’interno del sito catalitico [11]. La sola differenza significativa sta nel sito di binding della L-Arginina: l’Asp382 presente nella iNOS umana è sostituito da un Asn nella eNOS umana.
Dominio catalitico della nNOS
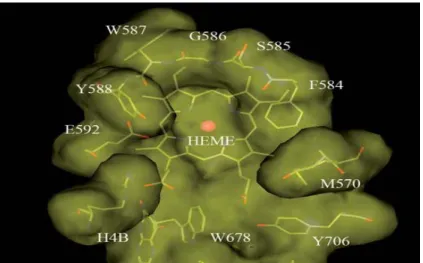
Figura 4 Visione dall’alto della tasca di binding del substrato nella nNOS del ratto; W=Triptofano, G=Glicina, S=Serina, F=Fenilalanina, M=Metionina, E=Acido glutammico, Y=Tirosina, H=Istidina. E’ presente una tasca idrofobica costituita dagli amminoacidi S585, F584 e M570;i residui W587 ed E592 giocano un ruolo fondamentale nel binding degli inibitori. Nella tasca di binding della nNOS infine è possibile individuare la “selectivity modulating region”.
I residui amminoacidici attorno alla tasca di binding della nNOS presentano una ricca collezione di interazioni che offrono un buon potenziale per lo structure-based drug design. Adiacente al gruppo eme è possibile individuare una tasca idrofobica formata dai carboni α e β del residuo S585 (Serina) e dalla catena laterale della F584 (Fenilalanina) e della M570 (Metionina). Il carbonile del W587 (Triptofano) e la catena laterale dell’E592 (Acido glutammico) formano legami ad idrogeno con gli inibitori che interagiscono con la tasca di binding della nNOS.
Il contributo sia dei legami a idrogeno che della tasca idrofobica al binding del substrato all’enzima è comune alle tre isoforme della NOS e non è specifica per la nNOS.
Recentemente è stata individuata nella nNOS e nella iNOS una “selectivity modulating region” [12]: questa è composta da 4 residui amminoacidici L337 (Leucina), M570 (Metionina), W678 (Triptofano), Y706 (Tirosina).
- 10 -
Dimerizzazione della NOS
La dimerizzazione della ossido nitrico sintetasi coinvolge un’ampia interfaccia del dominio ossigenasico contenente due porzioni della struttura primaria della NOS. Questa interfaccia contiene il sito di binding per la BH4 e aiuta a definire il sito attivo dell’enzima contenente il gruppo eme e il sito di binding per l’Arginina.
Ogni monomero presenta due residui di cisteina che possono formare un ponte disolfuro tra i due monomeri oppure possono legare lo zinco tra i due monomeri [13].
Nonostante non sia stata ancora pubblicata la struttura ai raggi X del dominio reduttasico delle NOSs, sono stati applicati altri metodi per capire il coinvolgimento di questo dominio nella formazione del dimero dell’enzima. Studi di ibridazione sui domini reduttasico e ossigenasico hanno dimostrato che, per la iNOS, solo il dominio ossigenasico è coinvolto nella dimerizzazione, mentre per la eNOS e la nNOS ci sono interazioni tra il dominio reduttasico e tra quest’ultimo e quello ossigenasico. Questo spiegherebbe perché nella iNOS la dimerizzazione è più dipendente dalla presenza della BH4. Anche la presenza del gruppo eme sembra essere obbligatoria, mentre la BH4 e la L-Arginina promuovono la formazione del dimero e la stabilizzazione dello stesso una volta che si è formato.
Inoltre, per quanto riguarda la nNOS, l’aggiunta di BH4 e L-Arginina alla NOS già in forma dimerica induce la formazione di un dimero ancora più stabile [14].
Biosintesi dell’NO catalizzata dalla NOS
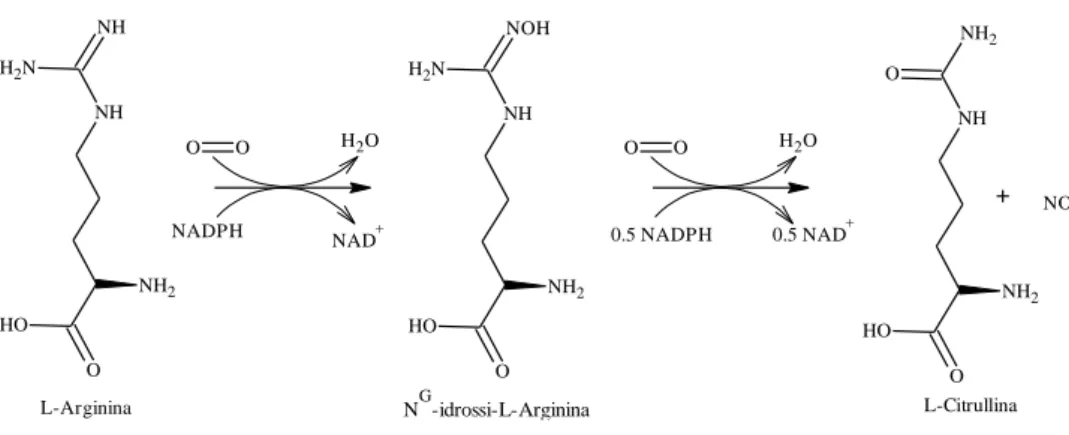
NH O NH N H2 NH2 O H O O H2O NOH O NH N H2 NH2 O H NADPH NAD+ L-Arginina NG-idrossi-L-Arginina O O H2O 0.5 NADPH 0.5 NAD+ NH2 O NH O NH2 O H + NO L-Citrullina
Figura 5 Schema sintetico dell’Ossido Nitrico a partire dal substrato naturale L-Arginina.
Tutte e tre le NOS catalizzano una reazione a cinque elettroni di ossidazione dell’Arginina ad NO ed L-Citrullina meccanismo Ca2+/calmodulina-dipendente. Il flusso di elettroni parte dal NADPH (nicotinammide-adenina-dinucleotide fosfato ridotta); sono
- 11 -
inoltre coinvolti come cofattori la (6R)-5,6,7,8-tetraidrobiopterina (BH4), il flavin adenin dinucleotide (FAD), il flavin mononucleotide (FMN) ed il nucleo protoporfirinico IX (eme).
Nel 1988 fu ipotizzato per la prima volta che la NG-idrossi-L-Arginina (NOHArg) fosse un intermedio nella biosintesi dell’NO; nel 1999 furono sintetizzati sia la NOHArg che i suoi analoghi [15N]guanidinici [15]. In questi stessi studi si dimostrò che l’ossidazione dell’Arginina ad NOHArg necessitava dell’ossidazione di 1 equivalente di NADPH mentre la conversione della NOHArg in L-Citrullina necessita di 0.5 equivalenti di NADPH. Inoltre, l’ossigeno della NOHArg sembra essere quello responsabile della produzione di NO.
Per quanto riguarda la nNOS, in essa possiamo riconoscere un dominio ossigenasico C-terminale che lega NADPH, FAD e FMN e serve come risorsa e deposito degli elettroni che vengono trasferiti al gruppo eme. L’NADPH funge da donatore mentre il FAD e l’FMN da accettori. Nonostante il dominio ossigenasico della NOS non presenti omologia con nessun’altra proteina enzimatica umana, in tutte e tre le isoforme della NOS possiamo ritrovare una regione altamente conservata di 320 amminoacidi che dovrebbe rappresentare il binding site per BH4, Arginina e gruppo eme.
Ruolo dei cofattori flavinici della NOS
Il FAD e l’FMN nel dominio reduttasico accettano elettroni dall’NADPH e quindi li passano al gruppo eme. Il ruolo del dominio reduttasico della NOS può essere paragonato a quello della reduttasi del citocromo P450, che dona elettroni agli enzimi della famiglia del citocromo P450. Il ruolo essenziale dei cofattori flavinici è quello di consentire al donatore di due elettroni, cioè l’NADPH, di donare questi elettroni all’accettore di un solo elettrone cioè il gruppo eme, attraverso la formazione di intermedi radicalici semichinonici.
NADPH FAD FMN eme
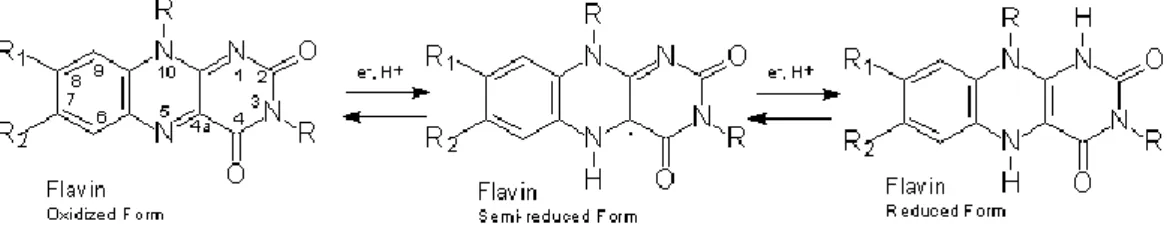
Il flusso di elettroni segue questa sequenza perché i cofattori flavinici hanno un potenziale d’azione più basso. Questa considerazione in realtà è un po’ troppo generale in quanto non tiene conto del fatto che ciascun cofattore può esistere in tre forme diverse: ridotta (FAD, FMN), semichinonica parzialmente ossidata (forma radicalica, FADH• e FMNH•) e completamente ossidata (FADH2 e FMNH2).
- 12 -
Figura 6 Struttura delle tre forme dei cofattori flavinici: ossidata, radicalica e ridotta.
Quindi in ogni subunità della NOS si possono avere nove forme (3x3) corrispondenti ai diversi stati di ossidazione dei cofattori flavinici (per la molecola dimerica non simmetrica si hanno 81 stati). Se c’è un equilibrio tra queste forme, la frazione di ciascuna forma può essere determinata applicando l’equazione di Nerst.
Il flusso di elettroni tra i due cofattori flavinici sembra essere il punto di controllo della calmodulina (CaM): infatti il flusso di elettroni da FAD a FMN risulta più lento in assenza di Ca2+/CaM.
Un’altra delle ragioni della necessità di FAD e FMN è rappresentata dalla necessità da parte dell’eme di ricevere singoli elettroni ad ogni step della biosintesi dell’NO: i cofattori flavinici possono donare un solo elettrone mentre l’NADPH ne può donare obbligatoriamente due.
Il flusso di elettroni sembra attraversare le diverse componenti del dimero: il dominio flavinico di un polipeptide sembra donare i propri elettroni al gruppo eme di un’altra catena polipeptidica. Le ragioni fisiologiche di questo meccanismo non sono state ancora chiarite ma è chiara la ragione principale per cui il monomero della NOS risulta inattivo. In conclusione, la presenza di FAD e FMN è una caratteristica unica della NOS.
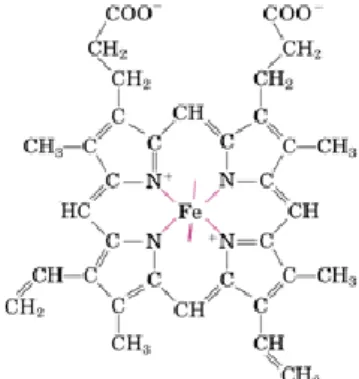
Ruolo dell’eme nella NOS
Il dominio eme della NOS presenta delle somiglianze con gli enzimi della famiglia del citocromo P450. Entrambi i gruppi eme hanno un ligando tiolato (cisteina) e simile potenziale redox; entrambi gli enzimi catalizzano l’ossidazione del substrato strettamente ma non direttamente legato al gruppo eme. Tuttavia ci sono delle fondamentali differenze strutturali tra i gruppi eme dei due enzimi. A differenza del P450, nella NOS abbiamo un triptofano legato con legame a idrogeno alla cisteina dell’eme. Funzionalmente la NOS catalizza un’ossidazione multielettrone e non a due elettroni; quindi esegue due cicli successivi di ossidazione, uno per formare NOHArg (monossigenasi I) e uno (monossigenasi II) per convertire NOHArg ad NO (o NO-).
- 13 -
Figura 7 Ferroprotoporfirina IX (gruppo eme)
Ruolo della tetraidrobiopterina BH4
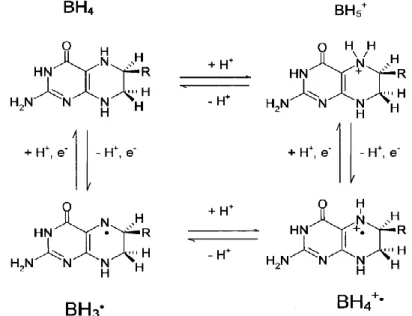
A differenza degli altri enzimi della famiglia del citocromo, la NOS necessita della tetraidrobiopteina come cofattore. Da molti anni è nota l’importanza della BH4 per l’espressione dell’attività della NOS ma è stata anche oggetto di controversie su quale potesse essere il ruolo nella biosintesi dell’NO, e in particolare se essa svolge o meno un ruolo redox nel meccanismo di reazione.
Il primo ciclo di ossidazione sicuramente necessita dell’azione riducente della BH4 ma la stessa certezza non si ha per il secondo ciclo di ossidazione. Questo cofattore nella NOS presenta diverse funzioni [16]:
Promuove l’accoppiamento dell’ossidazione dell’NADPH con la sintesi dell’NO e inibisce la formazione del radicale superossido e del perossido di idrogeno;
Promuove la formazione del dimero e garantisce la tenuta/stabilità del dimero; Esercita effetti allosterici vincolanti nel legame tra due arginine successive e nel
legame di una seconda molecola di BH4;
Protegge verso inattivazione e autoinattivazione; Esercita un ruolo redox nella catalisi.
Studi di mutagenesi sito-specifica e cristallografia a raggi X hanno fornito una base strutturale per molte di queste osservazioni. La BH4 si lega al dominio della NOS contenente l’eme, interagendo con il propionato dell’eme e quindi legandosi al sito attivo adiacente a cui è legata la L-Arginina: quindi va a costituire parte della superficie del dimero. Anche se ci sono dati che confermano il ruolo redox della BH4 nelle reazioni della NOS, è stato pubblicato poco a supporto del ciclo BH4-chinoide BH2, a differenza di
- 14 -
quanto era successo per le idrossilasi degli amminoacidi aromatici e per la diidropteridina reduttasi.
E’ stato proposto che sia la forma radicalica BH3• sia la BH4 potessero trovarsi nella loro forma cationica protonata (rispettivamente BH4+• e BH5+): BH5+ donerebbe un elettrone all’eme trasformandosi in BH4+• che ritorna quindi allo stato ridotto accettando un elettrone dal cofattore flavinico del dominio reduttasico. Le altre funzioni proposte per la BH4 dovrebbero promuovere la sintesi dell’NO, in aggiunta al suo ruolo catalitico.
Figura 8 Strutture del cofattore BH4 nella biosintesi dell’NO; R=-CH(OH)-CH(OH)-CH3.
Meccanismo dettagliato della reazione catalizzata dalla NOS
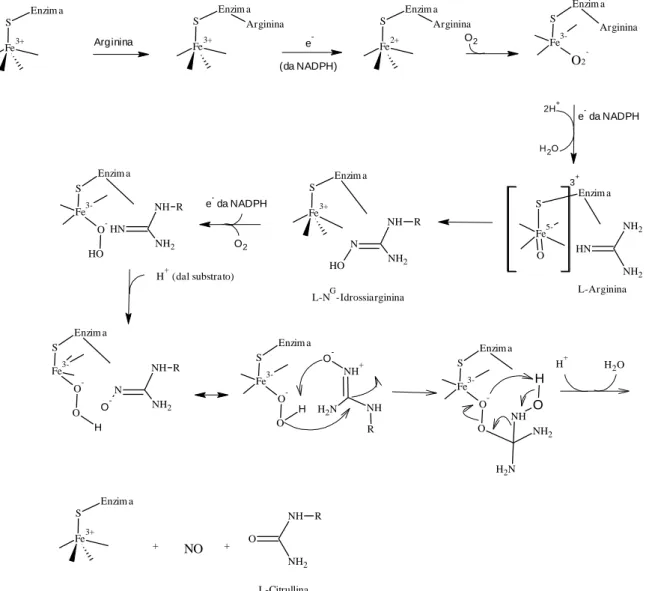
Sulla base dei dati accumulati sulla NOS e delle sue somiglianze con il Citocromo P450, è stato proposto un meccanismo a due step per la biosintesi dell’NO a partire dall’amminoacido naturale L-Arginina.
Nel primo step, l’ossidazione dell’Arg ad NOHArg a livello del gruppo eme della NOS richiede due elettroni, che vengono donati dall’NADPH, in modo da attivare l’ossigeno e ossidare l’Arg ad NOHArg. Inizialmente si ha la donazione di un elettrone allo ione ferrico dell’eme per formare la forma ferrosa dell’eme. A questo punto la forma ferrosa lega un ossigeno per formare il complesso stabile dell’ossigeno [Fe2+=O2- Fe3+=O2•-]. Quindi l’eme in questa forma interagisce con l’NH della guanidina dell’Arginina per formare il radicale cationico guanidinico. La ricombinazione dei due radicali, [FeOH]2+ e radicale cationico guanidinico, porta a NOHArg ed eme ferrico.
- 15 -
Il secondo step rappresenta la conversione di NOHArg in NO e L-Citrullina; questo step è unico per la NOS, infatti non ci sono precedenti in altri sistemi biologici. Lo ione ferrico viene ridotto a ferroso e lega un atomo di ossigeno. Questa forma dell’enzima quindi reagisce direttamente con la NOHArg per formare il radicale della NOHArg ed un complesso eme-perossido. Il radicale della NOHArg e il complesso eme-perossido reagiscono quindi tra di loro in un meccanismo di “radical rebound” che genera NO ed L-Citrullina e riporta l’eme allo stato di ossidazione ferrico.
Fe3+ S Enzim a Arginina Fe3+ S Enzim a Arginina e -(da NADPH) Fe2+ S Enzim a Arginina O2 Fe 3-O2 -S Enzim a Arginina e- da NADPH 2H+ H2O Fe 5-S O Enzim a 3+ N H NH2 NH2 L-Arginina Fe3+ S Enzim a N NH2 NH R O H L-NG-Idrossiarginina e- da NADPH O2 Fe 3-O -S Enzim a O H N H NH2 NH R H+ (dal substrato) Fe 3-O -S Enzim a O H N NH2 NH R O -Fe 3-O -S Enzim a O H NH+ N H2 NH R O -Fe 3-O -S Enzim a O N H2 NH2 NH O H H+ H2O Fe3+ S Enzim a + NO + O NH2 NH R L-Citrullina
Figura 9 Meccanismo proposto della biosintesi dell’Ossido Nitrico catalizzata dalla NOS
Regolazione dell’attività della NOS: la Calmodulina
La calmodulina fu la prima proteina di cui si scoprì l’interazione con la NOS in tutte e tre le isoforme [17]. La dipendenza della biosintesi dell’NO dalla concentrazione di ioni Ca2+ è un punto di distinzione tra le isoforme della NOS; inoltre il sito di binding
- 16 -
Ca2+/calmodulina al livello della porzione centrale della nNOS ha una funzione allosterica in quanto allinea il dominio reduttasico C-terminale col dominio ossigenasico N-terminale e promuove il trasferimento di elettroni da FAD e FMN al gruppo eme. Quando il complesso Ca2+/calmodulina non è legato, i due domini non sono allineati e il trasferimento di elettroni non può avvenire. Questo meccanismo di regolazione dimostra come l’attività di eNOS ed nNOS dipenda dal flusso intracellulare di ioni Ca2+. L’aumento dei livelli di Ca2+ intracellulare provoca un aumento di formazione del complesso Ca2+/calmodulina che lega eNOS o nNOS e quindi consente l’inizio della biosintesi di NO [18].
Infine nNOS ed eNOS differiscono dalla iNOS nella loro struttura primaria in quanto presentano un frammento di 40-50 amminoacidi inseriti in mezzo al sito di binding dell’FMN: questo frammento destabilizza il binding della calmodulina a basse concentrazioni intracellulari di Ca2+ e inibisce il trasferimento di elettroni dal cofattore FMN al gruppo eme in assenza del complesso Ca2+/calmodulina.
- 17 -
Ruolo biologico dell’NO
Generalità
L’ossido nitrico, di formula molecolare NO, è un gas incolore in condizioni standard di pressione e temperatura. E’ una specie chimica reattiva di natura radicalica centrata sull’azoto; fatta eccezione per il polmone (quindi in presenza di una fase gassosa), l’NO si comporta da non-elettrolita disciolto in tutte le attività biologiche. E’ moderatamente solubile in acqua mentre risulta molto più solubile nei solventi polari; quindi tenderà a sciogliersi selettivamente nelle membrane biologiche e nei lipidi delle cellule. La costante di diffusione D dell’ossido nitrico in acqua è compresa tra 2 e 4 x 10-5
cm2/s e incrementa notevolmente con la temperatura [19].
Figura 10 Ossido nitrico e lunghezza del legame
NO è un ossido neutro con undici elettroni di valenza; presenta un elettrone spaiato che conferisce al gas un comportamento paramagnetico. E’ però diamagnetico allo stato solido e liquido in quanto dimerizza a N2O2. Le principali reazioni dell’NO riguardano la stabilizzazione dell’elettrone spaiato: questo può avvenire sia mediante complessazione con un metallo sia per reazione con altri nuclei paramagnetici (O2,O2•-, radicale perossido).
Reazione dell’NO con Metalli
L’NO presenta un doppietto di non legame quindi reagisce facilmente con i metalli biologicamente rilevanti che presentano orbitali d parzialmente occupati per dare dei complessi metallo–nitrosile non particolarmente reattivi. Infatti in ambiente biologico questi complessi possono liberare NO o l’anione nitrosile NO
oppure possono agire come donatori di NO2+ nella reazione di nitrosazione.
L’NO viene usato come sostituto dell’ossigeno molecolare (o diossigeno; O2) nell’interazione con una grande varietà di metalloproteine biologiche: questa interazione comporta l’inibizione reversibile o irreversibile di enzimi che possono contenere o meno il gruppo eme. Tra queste si ha la ossido nitrico sintetasi NOS [20].
- 18 -
Reazione dell’NO con specie ossigenate
La reazione dell’ossido nitrico con specie ossigenate genera specie diamagnetiche stabilizzate. L'ossido di azoto reagisce spontaneamente con l'ossigeno per dare il diossido di azoto NO2. Questa reazione è stata studiata per molti anni per la sua importanza nell’inquinamento atmosferico: due molecole di NO reagiscono con una molecola di O2per dare un’altra specie paramagnetica radicalica, il diossido di azoto:
2NO + O2 2NO
2
In fase gassosa , l’NO2 può reagire ulteriormente sia con un’altra molecola di NO2 per formare il tetrossido di diazoto N2O4 sia con una molecola di NO per formare il triossido di diazoto N2O3:
NO2 + NO2 N2O4
NO2 + NO N2O3
Queste specie, così come l’acido nitroso HNO2, sono altamente reattive e in soluzione acquosa possono essere considerati donatori di ione nitroso [NO+].
Inoltre, per reazione con il superossido O2•-, NO produce la specie reattiva perossinitrito ONOO- che condivide alcune proprietà dell’NO quali la capacità di diffondere liberamente nello spazio intracellulare e l’elevato potere ossidante. Il perossinitrito è capace di ossidare i tioli e le basi del DNA [21] e di dare inizio alla perossidazione metallo-dipendente dei lipidi.
Quindi l’NO può esistere in diverse forme redox dotate di proprietà distinte e di elevata reattività: il catione nitrosonio NO+, l’anione nitrossile NO- ed il radicale libero NO•. L’NO e i suoi derivati sono tra i maggiori rappresentanti delle RNS (Reactive Nitrogen Species).
Tossicità
La tossicità dell’NO è legata essenzialmente alle sue caratteristiche chimico-fisiche: l’atomo d’azoto realizza due legami covalenti con l’atomo di ossigeno impegnando solo due dei tre elettroni di cui dispone. Il terzo elettrone dell’atomo d’azoto rimane pertanto spaiato e per questo l’NO può essere definito radicale libero.
I radicali liberi sono uno dei meccanismi di danno cellulare più importante, sebbene assolvano a molte funzioni fondamentali dell'organismo quando controllati. Sono molecole caratterizzate da un elettrone spaiato sull'orbitale più esterno e questa configurazione
- 19 -
elettronica le rende altamente instabili e particolarmente reattive. Esistono due classi principali di radicali liberi:
Le specie reattive dell'ossigeno dette ROS (da Reactive Oxygen Species). I più importanti ROS sono l'anione superossido O2-, il perossido d'idrogeno H2O2 e il radicale ossidrilico OH •;
Le specie reattive dell'azoto dette RNS (Reactive Nitrogen Species). Le RNS di maggior interesse sono l’ossido nitrico NO e il suo derivato perossinitrito ONOO -che deriva dalla reazione dell’ossido nitrico con l’anione superossido.
Reagiscono facilmente con una qualsiasi molecola si trovi in loro prossimità (carboidrati, lipidi, proteine, acidi nucleici) danneggiandola e spesso compromettendone la funzione. Inoltre, reagendo con altre molecole, hanno la capacità di autopropagarsi trasformando i loro bersagli in radicali liberi e scatenando così reazioni a catena che possono provocare danni estesi nella cellula. In condizioni normali, ciascuna cellula produce radicali liberi tramite vari processi, come: reazioni enzimatiche (ad esempio la xantina ossidasi o la NO sintetasi), fosforilazione ossidativa o difesa immunitaria (granulociti neutrofili e macrofagi).
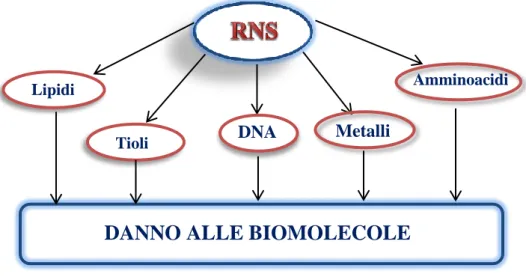
Quando si ha una eccessiva produzione di ROS si parla di stress ossidativo; in caso di sovrapproduzione di RNS si parla di stress nitrosativo. Gli RNS possono interagire con tutte una serie di molecole: il DNA, i tioli, i lipidi, gli amminoacidi, i metalli. L’interazione con queste specie porta al danneggiamento delle biomolecole cellulari: il DNA, le proteine strutturali, le metallo-proteine, le membrane.
Figura 11 Effetti dannosi delle RNS sulle macromolecole biologiche
Lipidi
DANNO ALLE BIOMOLECOLE
Tioli DNA
Amminoacidi
- 20 -
I radicali liberi tendono a danneggiare particolarmente tre componenti della cellula: i lipidi, le proteine e gli acidi nucleici mediante i seguenti meccanismi:
La perossidazione lipidica, in particolare della membrana plasmatica e delle membrane degli organelli intracellulari; è un danno cellulare comune dovuto ai ROS e agli RNS. Il ROS più temibile in questo caso è •OH;
L'ossidazione delle proteine: in particolare i radicali liberi agiscono ossidando i gruppi laterali degli amminoacidi, danneggiando la funzione della proteina, promuovono la formazione di legami crociati come il legame disolfuro, alterandone la struttura o il ripiegamento. Possono anche dare origine ad amminoacidi modificati (per esempio diidrossifenilalanina e ditirosina);
Il danno al DNA, dal momento che i radicali liberi possono determinare mutazioni o danneggiare macroscopicamente lo stesso DNA e alterare la struttura chimica delle basi azotate formandone di nuove
Lo stress ossidativo indotto da un eccesso di radicali liberi è implicato in patologie quali il cancro, l'invecchiamento cellulare, malattie degenerative, infiammazioni e malattie cardiovascolari.
Figura 12 Cause ed effetti dello stress ossidativo
Dopo che ha agito, l’NO viene trasformato in una serie di derivati, quali i nitriti ed i nitrati, che si accumulano, in funzione della quantità del mediatore primario prodotto, nel sangue ed in altri fluidi extracellulari per poi essere definitivamente allontanati dall’organismo attraverso le urine. Infatti, numerosi studi sperimentali e clinici hanno
- 21 -
documentato che i livelli plasmatici ed urinari di nitriti/nitrati correlano abbastanza bene con la produzione endogena di NO, anche dopo particolari terapie [22].
L’NO ha anche un ruolo fondamentale nell’induzione della morte cellulare in dipendenza della sua concentrazione. In genere, l’induzione all’apoptosi richiede dosi elevate di NO e l’effetto proapoptotico è indipendente dall’accumulo di GMPc. L’induzione all’apoptosi da parte dell’ossido nitrico fu descritta per la prima volta nei macrofagi; in seguito è stato dimostrato che elevate concentrazioni di NO e del suo derivato ONOO- possono stimolare il processo apoptotico in molti altri tessuti tra cui il sistema nervoso. Questo è particolarmente importante per spiegare la morte delle cellule nervose osservata nelle malattie neurodegenerative. In queste patologie l’NO esplica la propria tossicità nei confronti dei mitocondri agendo su tre fronti:
1. Inibizione reversibile della catena di trasporto degli elettroni della respirazione mitocondriale: in questo caso l’NO si lega alla citocromo c ossidasi inattivandola; 2. Inattivazione irreversibile degli enzimi mitocondriali (complessi I,II,III della catena
respiratoria);
3. Induzione del “mitochondrial permeability transition pore” (PTP) che media il rilascio del contenuto della matrice mitocondriale nel citoplasma.
Ruolo dell’NO nel sistema cardio-vascolare
Nei sistemi biologici, L’NO, è una molecola ad elevata reattività che pur essendo potenzialmente tossica è implicata in una vasta gamma di processi fisiologici come la neurotrasmissione, la regolazione del sistema immunitario, la regolazione del sistema cardiovascolare, il rilassamento della muscolatura involontaria, l’aggregazione piastrinica. Questi processi condividono fondamentalmente i seguenti meccanismi biochimici:
la sintesi enzimatica dell’NO da parte delle NOSs, a partire dall’aminoacido L-arginina;
la formazione di un complesso ferro-NO nell’eme di una proteina bersaglio allo scopo di promuovere la sua funzione.
Il ruolo fisiologico più importante dell’NO è sicuramente quello svolto nell’endotelio vascolare: infatti l’NO prodotto dalla eNOS è il più importante vasodilatatore endogeno. In condizioni fisiologiche, l’attivazione della eNOS dipende dai livelli intracellulari di ioni calcio e dalla stimolazione da parte di acetilcolina e bradichinina.
- 22 -
Nella cellula endoteliale l’attivazione della eNOS in seguito ad adeguata stimolazione (meccanica o chimica) è dovuta all’aumento del Ca2+ intracellulare; le cellule endoteliali producono l’NO che, in parte diffonde nel compartimento ematico, riducendo l’aggregabilità delle piastrine e l’adesività dei leucociti alle pareti dei vasi sanguigni, e in parte, raggiunge la sottostante muscolatura liscia vascolare.
Diffondendo attraverso le cellule della muscolatura liscia del vaso, l’NO attiva la guanilato ciclasi solubile GCs, una proteina eterodimerica formata da una subunità α e una β, ciascuna con un gruppo eme che è in grado di legarsi all’NO formando un complesso Fe-NO. La formazione di questo complesso induce un cambiamento conformazionale dell’eNOS tale da attivarla e portare all’accumulo di GMPc (guanosina 3’5’ monofosfato), un noto secondo messaggero in grado di stimolare la protein-chinasi G (PKG) ed i canali ionici GMPc-dipendenti. La PKG fosforila i recettori dell’IP3 (inositolo trifosfato) noti come InSP-3, situati sulla superficie del reticolo sarcoplasmatico (SR) delle cellule muscolari lisce e sul reticolo endoplasmatico (RE) delle cellule endoteliali, impedendone il legame con l’IP3. Ciò impedisce il rilascio del calcio dall’SR o dal RE, inibendo la contrazione della muscolatura liscia e inducendo cosi il rilassamento della muscolatura liscia vascolare.
I conseguenti effetti anti-aggreganti, anti-infiammatori ed anti-ipertensivi sono ritenuti di grande importanza nella prevenzione dell’aterosclerosi che è la causa più frequente di ischemia cerebrale.
- 23 -
Ruolo dell’NO nel sistema immunitario
Nel sistema immunitario, l’NO è prodotto in vari tipi cellulari dalla iNOS, la quale è attivata da una serie di citochine infiammatorie come TNF-α (Tumor Necrosis Factor alpha) o i lipopolisaccaridi (LPS), attraverso una regolazione di tipo trascrizionale. Infatti, il promotore del gene per la iNOS contiene siti di legame per il fattore di trascrizione NF-kB (Nuclear Factor-kappaB), il quale è in grado di avviare la trascrizione della iNOS per azione dei macrofagi. La cascata del segnale che porta alla sintesi della iNOS può avvenire anche in cellule non macrofagiche (es. cellule muscolari, cellule epatiche) ed è cellula-specifica. L’iNOS una volta espressa, diventa costitutivamente attiva e i suoi livelli vengono abbassati per mezzo dei sistemi proteolitici intracellulari [23].
Ruolo dell’NO nel processo infiammatorio
L’NO prodotto da nNOS e iNOS è coinvolto nell’insorgenza del dolore neuropatico e nel processo infiammatorio. Per quanto riguarda l’infiammazione, sembra che l’ossido nitrico interagisca con mediatori dell’infiammazione quali citochine, metaboliti ossidati dell’acido arachidonico, istamina e PAF: a livello epidermico e in altri tessuti quindi l’NO provoca vasodilatazione locale e alterazione della permeabilità microvascolare che determinano edema ed eritema. I danni provocati dall’ossido nitrico possono essere [24]:
indiretti, quali alterazione della perfusione vasale e edema tissutale;
diretti, per reazione dell’NO con l’anione superossido per dare la specie altamente reattiva e citotossica ONOO- (perossinitrito) che promuove l’ossidazione dei lipidi e successivamente dei gruppi sulfidrilici; infatti l’NO si trova comunemente nei campioni di plasma o di tessuti di pazienti affetti da malattie infiammatorie croniche quali artrite, colite ulcerosa e infiammazione cronica del colon.
Recenti studi hanno mostrato che l’NO stimola la sintesi di prostaglandine infiammatorie per l’attivazione dell’isoenzima II della ciclossigenasi (COX-2) [25].
Altri ruoli dell’NO in altri sistemi e apparati umani
A livello cerebrale controlla l’apprendimento e la memoria;
Apparato respiratorio: l’NO favorisce il trasferimento di ossigeno ai tessuti e può alleviare gli episodi acuti di asma in quanto sembra espandere i tubi bronchiali; Organi sessuali: aumenta il flusso di sangue nei genitali maschili e femminili,
risolve i problemi di disfunzione erettile anche dopo un lungo periodo di impotenza e sembra aumentare il numero di spermatozoi;
- 24 -
Pancreas: sembra aumentare la capacità di secrezione di insulina e quindi protegge dall’insorgenza del diabete;
Apparato muscolo-scheletrico: stimola la costruzione della massa magra e aumenta considerevolmente la densità ossea;
Ritarda l’invecchiamento precoce: infatti stimola il rilascio dell’ormone umano della crescita e contribuisce a rigenerare la parete dei vasi sanguigni e gli epiteli cardiaco, renale ed epidermico;
A livello del tratto gastro-intestinale modula le secrezioni e la motilità.
NO e sistema nervoso centrale
Figura 14 Neurotrasmissione nitrergica (NO-mediata)
L’NO nel sistema nervoso centrale ha un ruolo fondamentale come neuromodulatore e come neurotrasmettitore. La neurotrasmissione mediata da NO è definita nitrergica e media il rilassamento della muscolatura liscia dei sistemi respiratorio e gastrointestinale, e del tratto urogenitale.
La prima evidenza che ha portato a includere l’NO tra i neurotrasmettitori deriva dall’osservazione che il glutammato, che agisce attraverso i recettori NMDA (N-methyl D-aspartate), aumenta rapidamente la conversione dell’arginina in citrullina e NO nei tessuti cerebellari [26] e contemporaneamente aumenta i livelli di GMPc. Questo fenomeno è dovuto al fatto che la stimolazione dei recettori NMDA comporta un aumento del flusso intracellulare di ioni Ca2+; di conseguenza viene attivata la nNOS che è un enzima calcio-dipendente e si ha un aumento della sintesi di NO. L’NO liberamente diffusibile raggiunge le molecole bersaglio che sono principalmente proteine contenenti il gruppo eme.
- 25 -
L’interazione dell’ossido nitrico con queste proteine determina un loro cambiamento conformazionale e quindi la loro attivazione o inattivazione.
La nNOS interagisce con il recettore del glutammato (NMDA) attraverso la proteina PSD-95. Quando il potenziale d’azione raggiunge le terminazioni nervose, la stimolazione dei recettori NMDA determina l’entrata degli ioni calcio attraverso i canali del Ca2+
voltaggio-dipendenti. Di conseguenza si ha l’attivazione della nNOS localizzata a livello citoplasmatico con un meccanismo Ca2+/Calmodulina (CaM)/dipendente. L’NO prodotto si lega all’eme della guanilato ciclasi (GCs) stimolando la produzione del secondo messaggero GMPc. Al contrario degli altri neurotrasmettitori (ad es. acetilcolina), l’NO prodotto non viene depositato nelle vescicole sinaptiche ma è immediatamente rilasciato: questo perché si tratta di un neurotrasmettitore sufficientemente piccolo, sia idro- sia liposolubile e per questo facilmente diffusibile attraverso la membrana cellulare dei neuroni.
NO e neuroprotezione
Nonostante gli effetti dannosi espressi dall’NO ad alte concentrazioni, attualmente l’NO ha dimostrato effetti citoprotettivi a basse concentrazioni (dell’ordine del nM) attraverso la sua interazione diretta o indiretta con il meccanismo apoptotico. L’NO è in grado di stimolare l’attività della GCs ed indurre l’accumulo del secondo messaggero GMPc. Il GMPc induce un calo della concentrazione del Ca2+ intracellulare che rappresenta un segnale chiave utile all’instaurarsi del processo apoptotico. I meccanismi molecolari alla base dell’inibizione dell’apoptosi NO/GMPc-dipendente coinvolgono l’attivazione delle protein chinasi e l’inibizione dell’attivazione delle caspasi [27]. Le caspasi sono proteasi essenziali per l’attivazione dell’apoptosi; L’NO è in grado di S-nitrosilare la cisteina del sito attivo delle caspasi esecutrici del programma apoptotico portando alla loro inattivazione. Questo fenomeno impedisce la degradazione della proteina antiapoptotica Bcl-2 ed il rilascio dal mitocondrio del citocromo c utile all’attivazione delle caspasi. Sempre a basse concentrazioni l’NO esplica effetti benefici come antiossidante intracellulare in molti sistemi biologici. L’NO svolge la sua funzione di antiossidante principalmente contro tre tipi di specie reattive: il perossido di idrogeno (H2O2), il O2-• e contro gli idroperossidi.
- 26 -
Figura 15 Effetto antiapoptotico dell’NO
L’NO può bloccare lo stress ossidativo a livello della reazione di Fenton, prevenendo la formazione di H2O2 e eliminando gli equivalenti riducenti prodotti a partire dall’ O2-•. Per quanto riguarda il O2-• questo può reagire con l’NO portando alla formazione di ONOO-, il quale rapidamente può essere convertito in nitrato in assenza di altre specie reattive. In questo modo l’NO inibisce la riduzione dello ione ferro e previene la formazione di ROS. Infine l’NO è in grado di proteggere le cellule anche dal danno ossidativo, mediato dalla perossidazione lipidica, che consiste nella formazione di una varietà di idroperossidi [28], i quali provocano numerosi danni alle membrane cellulari. La reazione di questi radicali con l’NO provoca l’inibizione della perossidazione lipidica.
Quindi l’NO mostra azioni diverse a seconda della concentrazione: citoprotettivo e antiossidante a basse concentrazioni, citotossico e proapoptotico ad alte concentrazioni.
NO e patologie neurodegenerative
Il sistema nervoso centrale è caratterizzato da un continuo flusso di ROS generato durante le reazioni neurochimiche, inoltre, è altamente aerobico e contiene un alto livello di substrati facilmente ossidabili (lipidi polinsaturi delle membrane cellulari).Inoltre possiede bassi livelli di difese antiossidanti, quindi la sopravvivenza delle cellule nervose è associata ad un delicato equilibrio fra produzione di specie ossidanti e difesa antiossidante. L’alterazione di questo equilibrio genera lo stress ossidativo con attivazione impropria di alcuni processi metabolici o diminuzione della difesa antiossidante. Questo può portare a neurodegenerazione che caratterizza diverse malattie come la malattia di Huntington, il morbo di Parkinson, l’Alzheimer e la sclerosi laterale amiotrofica (SLA) [29].
- 27 -
Per quanto riguarda il morbo di Parkinson, studi passati hanno dimostrato che l’NO gioca un ruolo nella neurotossicità dell’MPTP (1-metil-4-fenil-1,2,3,6-tetraidropiridina) [30]. L’MPTP viene convertito in MPP+
(1-metil-4-fenil piridinio) dalle MAO-B e subito viene captato dal trasportatore della dopamina presente nei mitocondri dei neuroni contenenti dopamina. Questo si traduce in una riduzione dei livelli di ATP disponibili che causa un aumento di produzione di radicali liberi [31]. Per cui la causa principale di neurodegenerazione dopaminergica dovrebbe essere lo stress ossidativo: studi postmortem su cervelli di pazienti affetti da questa patologia hanno mostrato aumentati livelli di ferro, diminuiti livelli di GSH, indebolimento delle funzioni mitocondriali del SNC, come ampia diffusione di lipidi, prodotti delle proteine e della ossidazione del DNA.
Lo stress ossidativo agisce anche nelle fasi iniziali di un’altra malattia neurodegenerativa, il morbo di Alzheimer. Questa patologia è associata con le placche β-amiloidi adagiate sulla membrana dei neuroni. Nel 95% dei casi si ha un’insorgenza tardiva della malattia quindi sono considerati causa di insorgenza del morbo l’invecchiamento e il conseguente aumento della produzione di radicali liberi.
La nitrazione delle tirosine è uno dei primi marker trovati nei tessuti cerebrali dei malati di Alzheimer, nelle placche caratteristiche della sclerosi multipla e nei motoneuroni dei pazienti affetti da SLA [32]. Questi markers potrebbero semplicemente dipendere da fenomeni secondari e non essere la causa della degenerazione. Non esiste ancora una dimostrazione inequivocabile di una relazione causa-effetto fra la presenza dei segni dell’ossidazione e la neurodegenerazione, ma un numero sempre maggiore di dati sperimentali indica che gli agenti ossidanti inducono conseguenze patologiche che amplificano e propagano il danno, portando alla degenerazione irreversibile del tessuto nervoso [33].
NO ed Ischemia Cerebrale
L’ischemia cerebrale è la riduzione o l’abolizione permanente o transitoria del flusso ematico in un determinato distretto dell’encefalo; la causa più frequente di questa patologia è l’aterosclerosi (accumuli di sostanze grasse sulle pareti arteriose interne, che tendono a restringere il lume del vaso).
Durante l’ ischemia cerebrale, il tessuto nervoso , a causa dell’equilibrio alterato dallo stress ossidativo, non riesce più a mantenere un adeguato metabolismo aerobico in quanto il primo evento che si realizza è l’inibizione della catena di trasporto di elettroni
- 28 -
mitocondriale e della fosforilazione ossidativa. La produzione energetica viene in parte affidata alla glicolisi anaerobica responsabile di una produzione di ATP insufficiente a mantenere le funzioni neuronali. Come conseguenza, la popolazione neuronale ischemica va incontro ad alterazioni funzionali che sono, in genere, di tipo deficitario. La glicolisi anaerobica porta, come tappa finale, alla formazione di acido lattico e, quindi, ad un accumulo locale di ioni H+ (acidosi locale) che è responsabile di vasodilatazione nella regione ischemica. A seguito della vasodilatazione e della caduta locale di pressione provocata dalla occlusione arteriosa, il territorio vascolare del tessuto ischemico richiama sangue dalle regioni circostanti, con aumento del flusso ematico locale. Se i meccanismi di compenso locale non sono sufficienti a garantirne l'integrità, cellule endoteliali, neuroni e glia vanno incontro ad edema citotossico e, successivamente, a morte.
Figura 16 Conseguenze di un insulto ischemico
Se a questo punto si realizza il ripristino del flusso ematico, il danno cellulare che si è realizzato sino a quel momento è ancora reversibile altrimenti il processo della cascata neurotossica continua e porta al fenomeno della eccitotossicità da glutammato. Infatti i canali del calcio voltaggio-dipendenti delle strutture somato-dendritiche e presinaptiche si aprono e si realizza un accumulo extracellulare di amminoacidi eccitatori. Il più importante amminoacido eccitatorio è il glutammato. I recettori a cui si lega il glutammato sono di due tipi:
ionotropici, che controllano l’apertura di canali ionici: NMDA (Ca++
), AMPA (Na+), Kainato (Na+);
metabotropici, che controllano modificazioni dei nucleotidi ciclici o del metabolismo del fosfoinositolo.
- 29 -
Il rapido incremento di glutammato extrasinaptico causa una eccessiva stimolazione dei recettori NMDA e AMPA innescando il meccanismo della neurotossicità. Infatti, l'attivazione dei recettori AMPA contribuisce alla depolarizzazione che è ritenuta responsabile dell’aumento del magnesio del recettore canale NMDA con la conseguente apertura del recettore che permette un elevato flusso intracellulare di ioni calcio.
Il fenomeno della eccitotossicità da glutammato con il conseguente incremento intracellulare di ioni Calcio è responsabile del processo di necrosi delle cellule cerebrali ischemiche.
L'aumento della concentrazione intracitoplasmatica del calcio non solo disattiva, a livello mitocondriale, la fosforilazione ossidativa che conduce ad un ulteriore decremento dell'energia fornita e all'aumento dei radicali liberi ma è essa stessa causa di tutta una serie di eventi tossici nucleari e citoplasmatici.
Tra questi:
1. l’attivazione di enzimi proteolitici calcio-dipendenti (lipasi, proteasi,etc.) che inducono alterazioni della funzionalità cellulare, perdita della struttura della membrana ed il citoscheletro e necrosi;
2. l’attivazione della fosfolipasi A2 e della ciclossigenasi che stimolano la produzione di specie reattive dell'ossigeno attraverso l'attivazione della ossido nitrico sintetasi (NOS) e l’iperproduzione di NO causando perossidazione dei lipidi endocellulari e ulteriore danno delle membrane eso- ed endocellulari.
Inibitori della Ossido Nitrico Sintetasi
L’iperproduzione di NO in vivo è un potenziale meccanismo fisiologico in una vasta gamma di stati patologici tra cui l’ischemia cerebrale.
Il ruolo dell’NO nell’ischemia cerebrale può essere distruttivo o benefico a seconda dello stadio di evoluzione del processo ischemico e a seconda del sito di produzione. Studi su animali hanno dimostrato che l’NO prodotto dalla eNOS ha un effetto benefico in quanto agisce da vasodilatatore aumentando la riperfusione dell’area ischemica mentre l’NO prodotto dalla nNOS contribuisce al deterioramento metabolico dell’area ischemica portando alla necrosi della stessa (infarto ischemico). Questo deterioramento è legato all’espressione di diverse citochine che attivano la iNOS in molti distretti cellulari compreso quello cerebrale.
- 30 -
In base a queste osservazioni sono stati proposti numerosi approcci per inibire la sintesi di NO mediata dalla NOS. Gli inibitori della NOS competono con il substrato naturale per il legame con il sito attivo dell’enzima; in questo modo si ha una riduzione della sintesi di NO catalizzata dalla NOS e quindi anche una riduzione degli effetti dannosi che ne conseguono. Tuttavia inibitori non selettivi delle isoforme della NOS non sono utilizzati come farmaci di prima scelta nell’ischemia cerebrale in quanto si perderebbe l’effetto benefico della eNOS. Inibendo anche questa isoforma della NOS, possono indurre adesione e aggregazione piastrinica aggravando il danno ischemico.
Il primo inibitore NOS sintetizzato fu la L-N-metilarginina (NMA) che riusciva a prevenire la sintesi di NO mediata dai macrofagi e a ridurre il potenziale effetto dannoso delle cellule tumorali [34]. Si tratta di un inibitore non selettivo irreversibile che agisce sia contro la nNOS che contro la iNOS con una selettività 250 volte maggiore verso la nNOS. Studi in vivo hanno dimostrato che la mancanza di selettività nei confronti della e-NOS provoca ipertensione con conseguenti effetti collaterali.
L’approccio del drug discovery design più promettente si basa comunque su analoghi mimetici del substrato naturale L-Arginina. Altri inibitori analoghi dell’Arg sintetizzati prendendo come composto modello l’NMA sono la nitroarginina (NNA, 1), la L-N-amminoarginina (NAA, 2) e l’L-N-nitroarginina metil estere (NAME, 3).
NH O NH NH NH2 O H C H3 NMA NH O NH NH NH2 O H O2N NOH O NH NH NH2 O H N H2 N O NH NH2 O C H3 C H3 NO2
1, NNA 2, NAA 3, NAME
Figura 17 NOS inibitori con struttura mimetica della L-Arginina
Il derivato 3 ha una maggiore lipofilicità rispetto agli altri analoghi quindi penetra meglio nelle membrane biologiche; il NAME viene rapidamente idrolizzato dalle esterasi intracellulari in NNA 1 che rappresenta quindi il suo metabolita attivo. L’NNA è l’unico tra gli analoghi dell’arginina ad aver mostrato una selettività 300 volte superiore verso la nNOS bovina rispetto alla iNOS. Una caratteristica comune della maggior parte degli
- 31 -
analoghi è la presenza di un sostituente che lega il gruppo amminico della catena laterale dell’Arginina.
Per migliorare la selettività di azione, è stato operato un irrigidimento della struttura modello della L-Arginina: questo approccio non ha portato ad un significativo miglioramento in termini di attività, selettività e potenza, ad eccezione del composto 4. La sostituzione del gruppo diaminobutiramide con la pirrolidina provoca una maggiore potenza e selettività verso le isoforme della NOS.
NH O NH NH NH2 NH O2N N H N H2 O 4
Uno studio condotto da Maddaford e altri del 2006 ha proposto una nuova classe di inibitori con scaffold ammidinotiofen-indolico in quanto si è scoperta l’importanza della presenza dell’anello tiofenico per l’attività neuroprotettiva della NOS.
S NH NH N H N CH3 5 IC50 n-NOS= 1.88 μM IC50 e-NOS= 32.6 μM IC50 i-NOS= 58 μM e-NOS/n-NOS= 17
- 32 - S NH NH N H N CH3 6 S NH NH N H N 7 S NH NH N H N S N H 8
In uno studio recente (2010) di Liang e altri, partendo dallo scaffold ammidinotiofen-idrossipiperidinico sono state operate delle ottimizzazioni e sono stati sperimentati diversi linker che legano la porzione ammidino tiofenica all’anello idrossipiperidinico. NH NH S N HO R X
Figura 18 Inibitori ammidinotiofen-idrossipiperidinici come nNOS inibitori.
Composto X R IC50 (nM) 9a -SO2- -CH2(CH3)2 551 9b -(C=O)- -OCH2C6H5 376 9c -(CH2)2- -m, p-diclorofenil 17 IC50 n-NOS= 0.92 μM IC50 e-NOS= 51.1 μM IC50 i-NOS= 20 μM e-NOS/n-NOS= 0.051 IC50 n-NOS= 2.20 μM IC50 e-NOS= 43.4 μM e-NOS/n-NOS= 119.7 IC50 n-NOS= 0.717 μM IC50 e-NOS= 4.44 μM e-NOS/n-NOS= 6.19
- 33 -
Sono stati sperimentati tre linker: ammidico X= -(C=O)-, solfonammidico X= SO2 e ammina alifatica X= -(CH2)2- . Il composto 9c con il linker amminico alifatico lineare ha mostrato un’attività superiore rispetto agli altri due composti (9a e 9b). Quindi gli inibitori con il miglior profilo di attività contro la nNOS e la eNOS sono quelli con scaffold ammidinotiofene-idrossipiperidinico che presentano un’ammina alifatica lineare come linker e coda clorofenilica (R= m-clorofenile; o-,m-diclorofenile; m-,p-diclorofenile). Questi inibitori hanno dimostrato una buona efficacia nel trattamento dell’ischemia cerebrale [35].
- 34 -
Bibliografia Introduzione Generale
[1] Anon (1999) Citation Superstars of the UK. Science Watch 10, 1-2[2] Forstermann, U. Biochemistry and molecular biology of nitric oxide synthases.
Arzneimittelforschung 1994, 44, 402-7.
[3] Andersson, K. E.; Persson, K. Nitric oxide synthase and nitric oxide-mediated effects in lower urinary tract smooth muscles. World J. Urol. 1994, 12, 274-80.
[4] Stuehr, D. J.; Grifith, 0. W. Mammalian nitric oxide synthases. Adv. Enzymol. Relat.
Areas Mol. Biol. 1992, 65, 287-346.
[5] Michel, T.; Li, G. K.; Busconi, L. Phosphorylation and subcellular translocation of endothelial nitric oxide synthase. Proc. Natl. Acad. Sci. USA. 1993, 90, 6252-6.
[6] Carreras MC, Poderoso JJ. (2007) Mitochondrial nitric oxide in the signaling of cell integrated responses. Am J Physiol Cell Physiol. 292:1569-80.
[7] Crane, B. R., Arvai, A. S., Gachhui, R., Wu, C., Ghosh, D. K., Getzoff, E. D., Stuehr, D. J. and Tainer, J. A. (1997) The structure of nitric oxide synthase oxygenase domain and inhibitor complexes. Science 278, 425-431.
[8] Cubberley, R. R., Alderton, W. K., Boyhan, A., Charles, I. G., Lowe, P. N. and Old, R.W. (1997) Cysteine-200 of human inducible nitric oxide synthase is essential for dimerization of haem domains and for binding of haem, nitroarginine and tetrahydrobiopterin. Biochem. J. 323, 141-146.
[9] Stuehr, D. J.; Marletta, M. A. Mammalian nitrate biosynthesis: Mouse macrophages produce nitrite and nitrate in response to Escherichia coli liwaolvsaccharide. Pruc. Natl.
Acad. Sci. U.SA. 1986, 82, 7738-7742.
[10] Hemmens, B., Goessler, W., Schmidt, K. and Mayer, B. (2000) Role of bound zinc in dimer stabilization but not enzyme activity of neuronal nitric-oxide synthase. J. Biol.
Chem. 275, 35786-35791.
[11] Fischmann, T. O., Hruza, A., Niu, X. D., Fossetta, J. D., Lunn, C. A., Dolphin, E., Prongay, A. J., Reichert, P., Lundell, D. J., Narula, S. K. and Weber, P. C. (1999) Structural characterization of nitric oxide synthase isoforms reveals striking activesite conservation. Nat. Struct. Biol. 6, 233-242.
[12] F. Xue, H. Li, J. Fang, L. J. Roman, P. Martasek, T. L. Poulos and R. B. Silverman,
- 35 -
[13] Crane, B. R., Rosenfeld, R. J., Arvai, A. S., Ghosh, D. K., Ghosh, S., Tainer, J. A., Stuehr, D. J. and Getzoff, E. D. (1999) N-terminal domain swapping and metal ion binding in nitric oxide synthase dimerization. EMBO J. 18, 6271-6281.
[14] Watmough, N. J., Butland, G., Cheesman, M. R., Moir, J. W., Richardson, D. J. and Spiro, S. (1999) Nitric oxide in bacteria : synthesis and consumption. Biochim. Biophys.
Acta 1411, 456-474.
[15] Feldman, P. L. Synthesis of the putative L-arginine metabolite L-NO-hydroxyarginine. Tetrahedron Lett. 1991, 32, 875-8.
[16] Wendy K. Alderton, Chris E. Cooper and Richard G.Klowes: Nitric oxide synthases : structure, function and inhibition; Biochem. J. (2001) 357, 593-615).
[17] Gachhui, R., Abu-Soud, H. M., Ghosha, D. K., Presta, A., Blazing, M. A., Mayer, B., George, S. E. and Stuehr, D. J. (1998) Neuronal nitric-oxide synthase interaction with calmodulin-troponin C chimeras. J. Biol. Chem. 273, 5451-5454.
[18] Abu-Soud, H. M.; Stuehr, D. J. Nitric oxide synthases reveal a role for calmodulin in controlling electron transfer. Proc. Natl. Acad. Sci. U.SA. 1993, 90, 10769-72.
[19] Wise. D. L.; Houghton, G. Diffusion Coefficients of Neon, Krypton, Xenon, Carbon Monoxide and Nitric Oxide in Water at 10-60°C. Chem. Eng. Sei. 1968,23, 1211-1216. [20] Griscavage, J. M.; Fukuto, J. M.; Komori, Y.; Ignarro, L. J. Nitric oxide inhibits neuronal nitric oxide synthase by interacting with the heme prosthetic group. J. Biol.
Chem. 1994,269, 21644-21649.
[21] King. P. A.; Jamison, E.; Strahs, D.; Anderson, V. E.; Brenowitz, M. 'Footprinting' proteins on DNA with peroxonitrous acid. Nucleic Acids Res. 1993, 21, 2473-2478.
[22] Moncada, S. and Higgs, A. (1993) The L-arginine-nitric oxide pathway. N. Engl.
J. Med. 329, 2002-2012.
[23] Musial A, Eissa NT. (2001) Inducible nitric-oxide synthase is regulated by the proteasome degradation pathway. J Biol Chem 276, 24268-24273.
[24] Laskin, J. D.; Heck, D. E.; Laskin, D. L. Multifunctional role of nitric oxide in inflammation. Trends Endocrinol. Metab. 1994, 5, 377-82.
[25] Perkins DJ et al., J Leukoc Biol 1999, 65, 792.
[26] Garthwaite J, Garthwaite G, Palmer RM, Moncada S. (1989) NMDA receptor activation induces nitric oxide synthesis from arginine in rat brain slices. Eur J Pharmacol, 172, 413-416.
- 36 -
[27] Kim YM, Talanian RV, Billiar TR. (1997) Nitric oxide inhibits apoptosis by preventing increases in caspase-3-like activity via two distinct mechanisms. J Biol Chem 272, 31138-31148.
[28] Wink DA, Miranda KM, Espey MG, Pluta RM, Hewett SJ, Colton C, Vitek M, Feelisch M, Grisham MB. (2001) Mechanisms of the antioxidant effects of nitric oxide.
Antioxid Redox Signal 3, 203-13.
[29] Danielson SR, Andersen JK. (2008) Oxidative and nitrative protein modifications in Parkinson's disease. Free Radic Biol Med. 44, 1787-94.
[30] Yelin, R. et al., 1995; FEBS Lett. 377, 201-217.
[31] Greenamyre, J.T. et al., 1999; Biochem. Soc. Symp. 66, 85-97.
[32] Reynolds A, Laurie C, Mosley RL, Gendelman HE. (2007) Oxidative stress and the pathogenesis of neurodegenerative disorders. Int Rev Neurobiol 82, 297-325.
[33] Perry G, Taddeo MA, Nunomura A, Zhu X, Zenteno-Savin T, Drew KL, Shimohama S, Avila J, Castellani RJ, Smith MA. (2002) Comparative biology and pathology of oxidative stress in Alzheimer and other neurodegenerative diseases: beyond damage and response. Comp Biochem Physiol C Toxicol Pharmacol. 133, 507-13.
[34] Hibbs, J. B.; Taintor, R. R.; Vavrin, 2. Macrophage Cytotoxicitv: Role for L-Arginine Deiminase and imino nitrogen oxidation to nitrite. Science 1987, 235, 473-476.
[35] Guyan Liang, Kent Neuenschwander, Xin Chen,a Linli Wei, Randall Munson, Gerardo Francisco, Anthony Scotese, Gregory Shutske, Mark Black, Sharkir Sarhan, Jason Jiang, Isabelle Morizea and Roy J. Vaza, Structure-based design, synthesis, and profiling of potent and selective neuronal nitric oxide synthase (nNOS) inhibitors with an amidinothiophene hydroxypiperidine scaffold, Med. Chem. Commun., 2011, 2, 201.