Capitolo 4
ANESTETICI LOCALI ED ANESTESIA EPIDURALE
4.1 ANESTETICI LOCALI (AL)
Gli anestetici locali (AL) sono sostanze che a contatto con le fibre nervose bloccano reversibilmente i potenziali d'azione responsabili della conduzione nervosa. Essi agiscono su qualsiasi parte del sistema nervoso e su ogni tipo di fibra nervosa. Il loro sito primario di azione è la membrana cellulare, dove interagiscono direttamente con i canali del Na+, voltaggio dipendenti. Gli anestetici locali posso legarsi ad altre proteine di membrana, oltre ai canali del Na+, in particolare possono bloccare i canali del K+ quando sono presenti in elevate concentrazioni. La scelta degli anestetici locali utilizzati nell'anestesia locoregionale dipende da vari fattori quali il tipo di blocco, la procedura chirurgica e le condizioni cliniche del paziente. Le proprietà clinicamente importanti dei vari anestetici locali sono costituiti dalla loro velocità di inizio d'azione (“onset time”), dalla durata del blocco, dalla presenza di un blocco differenziale sensitivo/motorio, dalla potenza e dalla tossicità del farmaco (Veering, 1996). Buona parte di queste proprietà sono determinate dalle caratteristiche fisico-chimiche delle molecole anestetiche quali la liposolubilità, il legame proteico, il pKa e la presenza di diverse forme spaziali (stereoisomeri) della stessa molecola, che a loro volta dipendono dalla struttura chimica. Per comprendere il meccanismo d'azione degli anestetici locali ed utilizzare al meglio le loro proprietà bisogna poi considerare il rapporto tra concentrazione (dose) dell'anestetico e blocco nervoso (concentrazione minima efficace, blocco decrementale e blocco differenziale).
4.2 PROPRIETA' FISICO-CHIMICHE DEGLI AL
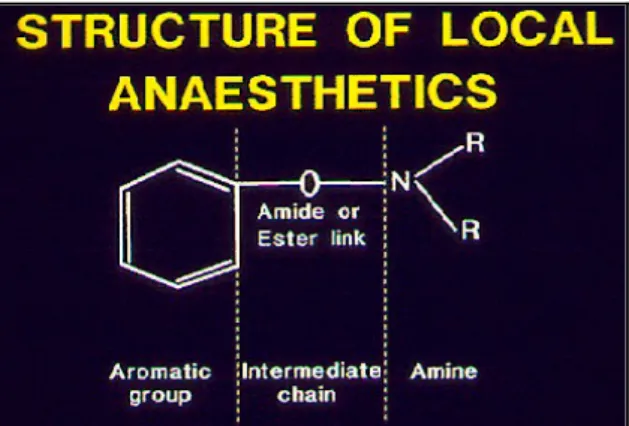
Gli anestetici locali sono una classe relativamente omogenea di farmaci sia per quanto riguarda le loro proprietà biologiche che la loro struttura molecolare. La struttura chimica degli anestetici locali è costituita da tre entità: un anello aromatico, un terminale alifatico, che contiene un'amina terziaria, e una catena intermedia costituita da un estere o un amide. La catena intermedia separa quindi la porzione aromatica lipofilica dalla porzione idrofila aminica secondaria o terziaria.
Figura 4.1:Struttura chimica generale di un anestetico locale.
La parte aromatica deriva dall'acido benzoico (per es. la famiglia degli esteri) o dall'anilina (per es. la famiglia degli aminoacidi). La catena intermedia può presentarsi o con un legame estereo, e gli anestetici locali così strutturati vengono definiti aminoesteri (es. procaina, clorprocaina, tetracaina) o con un legame amidico e vengono definiti aminoamidi (es. lidocaina, mepivacaina, bupivacaina, ropivacaina); ciò comporta un conseguente differente metabolismo per le due forme: quelle esteriche vengono idrolizzate in sede plasmatica, dalle pseudo-colinesterasi quelle amidiche vengono degradate dal fegato. Ne risulta che la differenza fondamentale tra i composti amidici ed esterei risiede nella loro stabilità chimica (Catterall & Macie, 2001). Oltre al tipo di legame vi sono altre caratteristiche che possono distinguere i vari anestetici locali quali la liposolubilità e il legame proteico che determinano la potenza, la diffusione, la durata e la tossicità del farmaco ed il pKa.
Liposolubilità
La potenza di un anestetico è proporzionale alla sua liposolubilità: più è solubile più è potente. La membrana nervosa è essenzialmente costituita da lipoproteine. L'assolemma è costituito per il 90% da lipidi e per il 10% da proteine (Covino, 1986). Di conseguenza i composti chimici che sono altamente lipofili tendono a penetrare nella membrana nervosa più facilmente; meno molecole sono quindi necessarie per bloccare la conduzione e la potenza dell'anestetico sarà maggiore. Il gruppo aromatico è il maggior determinante della liposolubilità degli anestetici locali, ad essa è correlata la potenza dell'anestetico, maggiore è la solubilità,
maggiore è la potenza. Tuttavia, nonostante un composto sia altamente liposolubile, in vivo è opportuno tenere conto di elementi come il tessuto adiposo e i vasi perineurali, che determinano una minore disponibilità della quota di anestetico per il blocco nervoso, infatti il primo ne immagazzina una parte, mentre i secondi contribuiscono all'allontanamento del composto. La ropivacaina ha una minore liposolubilità rispetto alla bupivacaina. Nel caso di somministrazione epidurale il grasso perineurale può fungere da deposito per la bupivacaina più che per la ropivacaina, facilitando il riassorbimento dell'anestetico da questo compartimento; questa minore lipofilicità può essere il motivo della più breve emivita plasmatica della ropivacaina rispetto alla bupivacaina (Datta et al., 1995). Oltre a questo anche la vasodilatazione indotta dagli anestetici locali ne influenza la potenza. Ad esempio la lidocaina, causando un maggior grado di vasodilatazione rispetto alla mepivacaina, determina un maggior riassorbimento vascolare, con la conseguenza di avere un minor numero di molecole disponibili per il blocco nervoso in vivo.
Legame proteico
Gli anestetici locali si possono legare sia alle proteine plasmatiche che a quelle tissutali. Generalmente maggiore è il legame proteico, maggiore è la durata d'azione dell'anestetico locale. Il legame con le proteine, determinando la quota libera non legata di farmaco, può influenzare il metabolismo e la tossicità degli anestetici locali in quanto è farmacologicamente attiva solo la frazione libera della molecola. Le proteine, cui gli anestetici locali si legano in maggior misura, sono costituite dall'albumina e dall' α1-glicoproteina acida, che possiede alta affinità ma scarsa capacità di legame, mentre l'albumina possiede scarsa affinità ma una grande capacità di legame. In altre parole gli anestetici locali si legano all'albumina solo dopo che tutti i siti di legame con α1-glicoproteina acida sono stati saturati. Se durante un’infusione continua di anestetico locale (ad esempio nello spazio epidurale) si ha la progressiva saturazione di questi tamponi, la concentrazione totale del farmaco nel plasma dovrebbe aumentare con un parallelo incremento della quota libera.
PKa
concentrazioni della forma ionizzata e di quella non ionizzata sono identiche.
A pH fisiologico gli anestetici locali si trovano in forma ionizzata protonata, a carica positiva. La forma non ionizzata invece, è liposolubile e permea più facilmente l'ambiente idrofobico che avvolge la membrana stessa, quindi gli anestetici locali con valori meno elevati di pKa raggiungono più facilmente il sito di legame. Tuttavia, una volta dentro la cellula, la molecola dell'anestetico locale probabilmente si ionizza di nuovo, poiché la forma cationica è quella più attiva sul sito recettoriale (Mama & Steffey, 2001). Una volta all'interno dell'assone la frazione ionizzata interagisce con i canali del sodio bloccando la conduzione dell'impulso nervoso. Il rapporto tra la parte ionizzata e non ionizzata è quindi critico per il blocco della conduzione nervosa. Se l'anestetico indissociato è troppo poco vi saranno poche molecole che arrivano al target, quindi pochi cationi disponibili per il blocco dei canali del sodio. Un farmaco troppo ionizzato viceversa, non arriverebbe al bersaglio; ad esempio la benzocaina, con un pKa 3.5 deve essere usata ad alte concentrazioni (10 – 20%) per poter essere attiva sulle mucose. Situazioni simili si verificano nei tessuti infiammati dove la diminuzione del pH aumenta la dissociazione del farmaco rendendo difficile la realizzazione del blocco. Normalmente il pKa degli anestetici è compreso entro un ristretto range (7.7 – 9.8) ad eccezione della benzocaina (Gullo, 1998).
4.3 VELOCITA' DI INDUZIONE DI UN BLOCCO ANESTETICO
La velocità di induzione del blocco in fibre nervose isolate è determinata dalle caratteristiche fisico-chimiche del farmaco ed in particolare dal pKa dell'anestetico locale. Poiché la forma non dissociata dell'anestetico locale che attraversa la guaina mielinica e la membrana nervosa, “l'onset time” (potenza e durata d'azione) è direttamente correlato con la quantità di farmaco che esiste sotto forma di base. La percentuale di anestetico locale, che è presente sotto forma di base quando iniettato in un tessuto a pH 7.4, è inversamente proporzionale al pKa del farmaco. Ad esempio, lidocaina e mepivacaina hanno un pKa di circa 7.7; quando questi agenti sono iniettati in un tessuto con un pH 7.4, circa il 65% del farmaco è presente sotto forma ionizzata e il 35% in forma non ionizzata. La bupivacaina e la ropivacaina hanno un pKa 8.1 e ad un pH 7.4 presentano 85% in forma ionizzata e il 15% in forma non ionizzata. La lidocaina e la mepivacaina hanno un “onset time”inferiore rispetto alla bupivacaina e alla ropivacaina.
4.4 DURATA D'AZIONE DI UN BLOCCO
La durata d'azione del blocco varia notevolmente da un anestetico all'altro. Questo parametro è principalmente correlato con il grado di legame proteico delle varie molecole. Le molecole con una maggiore affinità per le molecole proteiche si lega più tenacemente a questi recettori, con il risultato di un blocco della conduzione nervosa prolungato. Gli anestetici locali agiscono bloccando, a livello di membrana cellulare, i canali ionici per il Na+ attivati dal voltaggio, probabilmente in un sito intracellulare corrispondente il poro del canale, impedendo la conduzione degli assoni dei nervi periferici. Questo avviene su ogni tipo di fibra nervosa, con una completa restitutio ad integrum, una volta esauritosi l'effetto. Il blocco dei canali ionici per il Na+ impedisce una rapida depolarizzazione nella prima fase del potenziale d'azione. I canali ionici per il Na+, che in condizioni normali con potenziale di membrana a riposo (-60/ -90 m/V) sono chiusi, a seguito della depolarizzazione si aprono permettendo un rapidissimo trasferimento di ioni sodio dallo spazio extracellulare a quello intracellulare e una contemporanea fuoriuscita di ioni potassio. Successivamente i canali ionici per il Na+ s'inattivano rapidamente, determinando la breve durata del potenziale d'azione e un periodo di refrattarietà a una nuova depolarizzazione. Una volta esauritosi il potenziale d'azione, le condizioni iniziali di equilibrio ionico si ricostituiscono attraverso la pompa sodio-potassio ATPasi-dipendente. Solo il passaggio conformazionale dallo stato inattivo allo stato
chiuso consente, con la ripolarizzazione della membrana, a una nuova
depolarizzazione di aprire il canale. Gli anestetici locali interrompono la propagazione del potenziale d'azione, rallentando la velocità di depolarizzazione della membrana, fino ad impedire il raggiungimento del potenziale soglia, ma questa inibizione non viene raggiunta subito ad apertura di canale chiuso (blocco tonico) bensì aumenta gradualmente con le successive depolarizzazioni a canale aperto (blocco fasico). Ciò giustifica l'ipotesi di un sito di legame per gli anestetici locali intracellulare, posto entro il poro ionico, non accessibile quando il canale è allo stato chiuso. Caratteristica del blocco fasico è la dipendenza d'uso, responsabile dell'aumento di blocco con l'aumento delle stimolazioni. Ciò si traduce in una maggior rapidità del blocco, in relazione ad una più alta frequenza di eccitazione del nervo. Una volta trovato il sito di legame all'interno del canale, gli anestetici locali stabilizzano e prolungano la durata dello stato inattivo, inibendo l'apertura del canale
per ulteriori depolarizzazioni (Fonda, 2009).
4.5 BLOCCO DIFFERENZIALE
Il blocco differenziale è il blocco della conduzione nervosa, da parte dell'anestetico locale, che interessa solo alcuni tipi di fibre nervose lasciando inalterata la funzione di altre. In altre parole, il paziente può non avvertire il dolore ma può ancora contrarre i muscoli. Le fibre nervose sono catalogate come A, B e C in relazione alla presenza o assenza della guaina mielinica; le fibre A e B sono mielinizzate e le fibre C no. Le fibre possono essere ulteriormente divise in Aα, Aβ, Aγ, Aδ in relazione alla loro velocità di conduzione e di diametro. Infatti, il diametro delle fibre nervose e il grado di mielinizzazione influenzano notevolmente la funzionalità e la modalità di trasmissione nervose, ma anche la sensibilità nei confronti degli anestetici locali; in generale la Concentrazione Minima Efficace (Cm, concentrazione minima di farmaco in grado di determinare, entro 5 minuti, una riduzione del 50% del potenziale d'azione di una fibra nervosa immersa in una soluzione a pH 7.2-7.4 e stimolata con una frequenza di 30 cicli al secondo) richiesta per il blocco nervoso di una fibra di piccolo diametro è minore rispetto a quella necessaria per il blocco di una fibra di diametro maggiore. Va ricordato inoltre che la quantità totale di anestetico influenza la profondità, la durata e, in parte, l'onset time dell'anestesia, mentre la concentrazione determina il tipo di blocco.
Le fibre più fini (Aδ, B e C), dotate di conduzione lenta, sono più sensibili all'azione dell'anestetico locale rispetto a quelle di maggiore diametro (Aβ e Aα), a conduzione rapida; le fibre fini necessitano di una Cm inferiore rispetto a quelle più grosse. Questo fenomeno è legato al numero di molecole disponibili per il blocco: a basse concentrazioni, le poche molecole disponibili sono sufficienti per il blocco nervoso delle fibre fini e non per le altre di grosso calibro. Una possibile spiegazione risiede nel fatto che affinché si instauri un blocco completo della conduzione nervosa, è necessario che almeno tre nodi di Ranvier successivi siano bloccati. Poiché all'aumentare del calibro della fibra si incrementa la distanza tra un nodo di Ranvier e il successivo, basse concentrazioni di anestetico locale saranno in grado tre nodi successivi di Ranvier solo nelle fibre di piccolo diametro (Gullo, 1998). Questo fenomeno è alla base del blocco differenziale sensitivo-motorio ed è evidenziabile sopratutto con gli anestetici locali più lipofili e con pKa più elevato, come
bupivacaina, ropivacaina e levobupivacaina. Al blocco differenziale può inoltre contribuire una diffusione radiale non omogenea o incompleta dell'anestetico locale nel fascio di fibre nervose (Mogensen et al., 1998). Nel corso di anestesie subaracnoidee ed epidurali è comune esperienza clinica riscontrare un blocco differenziale probabilmente dovuto alla specifica situazione anatomica: in questo caso, se un lungo tratto di fibra nervosa viene esposto a basse concentrazioni di anestetico locale si può avere un blocco preferenziale delle fibre sensitive rispetto alle motorie.
Un basso pKa e una elevata liposolubilità sembrano associati con un blocco preferenziale delle fibre A, mentre un elevato pKa e una bassa liposolubilità sono associati con un blocco preferenziale delle fibre C. Un pKa relativamente alto determina una diminuzione del numero di molecole non ionizzate che sono in grado di attraversare la membrana mielinica delle grosse fibre A, numero insufficiente a determinare un blocco nella conduzione. L'assenza di barriere attorno alle fibre C permette di avere un sufficiente apporto di molecole di anestetico in grado di instaurare un blocco sensoriale. Questo effetto è maggiore con gli anestetici locali amidici con un elevato pKa e una bassa liposolubilità che possono essere usati per produrre un blocco differenziale delle fibre C,come nel caso della ropivacaina.
4.6 TOSSICITA'
La somministrazione di anestetici locali può accompagnarsi a manifestazioni di tossicità a livello locale, sistemico e reazioni di tipo allergico.
EFFETTI COLLATERALI DEGLI ANESTETICI LOCALI Irritazione tessutale locale (danno) Tossicità sistemica
Sistema nervoso centrale Eccitazione Depressione Sistema cardiovascolare Ipertensione Ipotensione Disritmie Collasso cardiovascolare Altro Allergie Metemoglobina
Tab4.1. Effetti collaterali degli anestetici locali (Adams H;)
Tossicità sistemica
La tossicità sistemica degli anestetici locali è dose dipendente: più elevata è la concentrazione dell'anestetico nel sangue, o meglio la concentrazione della sua frazione libera, più importanti sono le conseguenze a livello sistemico (Nancarrow et al., 1989). Gli effetti collaterali più acuti e pericolosi sono a carico del sistema nervoso centrale (SNC) e del sistema cardiovascolare. I sintomi e i segni di tossicità a carico del SNC si verificano solitamente prima di quelli cardiovascolari e includono: intorpidimento della lingua, testa leggera, disturbi visivi, cloni muscolari, mentre segni più seri sono dati da convulsioni, insorgenza di coma, arresto respiratorio e depressione cardiorespiratoria. La struttura spaziale della molecola è importante ai fini della tossicità sistemica, gli S-enantiomeri di mepivacaina, bupivacaina e ropivacaina sono tutti meno tossici delle corrispondenti molecole destrogire. La ropivacaina, pur avendo caratteristiche farmacocinetiche sovrapponibili a quella della bupivacaina, presentandosi come un S-enantiomero puro e con liposolubilità minore, ha i presupposti per una minore tossicità. La tossicità degli anestetici locali a livello del SNC è aumentata significativamente in condizioni di acidosi ed ipercapnia, in particolar modo quando ad una acidosi
respiratoria si accompagna una acidosi metabolica. La situazione di acidosi determina una maggior frazione di farmaco ionizzato responsabile del legame ai canali del Na+. In situazione di acidosi vi è anche una minor clearence plasmatica del farmaco ragion per cui nel trattamento delle convulsioni è importante ristabilire una adeguata ossigenazione e un corretto equilibrio di acido-base.
Gli anestetici locali posso determinare variazioni sia sulla conducibilità che sulla contrattilità del miocardio, anche se tali effetti possono essere notati solo quando si raggiungono concentrazioni plasmatiche molto elevate, molto più alte di quelle che possono provocare convulsioni. Un’eccezione si verifica quando accidentalmente una dose di anestetico locale viene iniettata a livello vascolare; tale modalità era probabilmente alla base dei casi descritti da Albright nel 1979, dove la somministrazione di bupivacaina ed etidocaina nel corso di anestesie loco-regionali era associata ad arresto cardiaco caratterizzato da rianimazione cardiopolmonare particolarmente difficile, quasi contemporaneamente alla comparsa di convulsioni. Dopo una iniezione accidentale intravascolare, la massa delle proteine plasmatiche che può legare l'anestetico (α1- glicoproteine acide e albumina) viene rapidamente saturata lasciando una significativa quota di anestetico libero di diffondere nel tessuto di conduzione cardiaco e nervoso. Questi elevati tassi plasmatici deprimono l'attività pacemaker spontanea del nodo del seno e possono determinare l'insorgenza di bradicardia sinusale ed arresto cardiaco. Disfunzioni simili nel nodo AV determinano l'allungamento dell'intervallo PQ/PR e una dissociazione parziale o completa AV (Tucker, 1986).
4.7 ROPIVACAINA
La ropivacaina è un anestetico locale di tipo amidico e appartiene alla serie N-achil-pipecolil-xilidide, come la bupivacaina e la mepivacaina. I pipecolossilididi presentano nella loro struttura un atomo di carbonio asimmetrico che conferisce alla molecola caratteristiche chirali e, di conseguenza, essi possono avere una configurazione enantiomerica sinistra (L) o destra (D). La ropivacaina è il primo anestetico amidico prodotto per uso clinico sotto forma di puro enantiomero-L. Questo è importante poiché le forme enantiomeriche L o D hanno differenti attività biologiche, talora opposte tra di loro. In particolare le forme enantiomeriche-L sia di ropivacaina sia della mepi- e bupivacaina risultano possedere una durata d'azione maggiore. L'azione della ropivacaina a livello della fibra nervosa si manifesta con un blocco di lunga durata della trasmissione del potenziale d'azione. La ropivacaina possiede un pKa di 8,07 simile a quello della bupivacaina ma presenta una solubilità lipidica nettamente inferiore (Markham & Faulds, 1996). Questo fa sì che la ropivacaina abbia una affinità minore per le fibre Aβ, una maggior selettività per di blocco per le fibre Aδ e una più rapida insorgenza del blocco rispetto alla bupivacaina. Infatti, avendo la ropivacaina un legame più debole con il grasso extraneuronale e i tessuti, si dovrebbe avere una maggior quota di anestetico disponibile a raggiungere il sito d'azione sui nervi. Anche la minor durata dell'anestesia peridurale e subaracnoidea con la ropivacaina rispetto alla bupivacaina troverebbe una giustificazione nella minor liposolubilità, in quanto renderebbe più veloce la dissociazione dell'anestetico dal tessuto nervoso (Akerman et al., 1988). L'impiego della ropivacaina per via peridurale rappresenta probabilmente l'impiego principale del farmaco, in quanto ha dimostrato di possedere un profilo clinico particolarmente utile in questo tipo di anestesia. Dalla gran parte degli studi sino ad oggi pubblicati risulta infatti che la ropivacaina impiegata a concentrazioni ≤ 0,5% determina un blocco motorio meno intenso, di più lenta insorgenza e di minore durata della bupivacaina. Ciò risulta particolarmente utile in tutte quelle condizioni cliniche in cui non è necessario raggiungere un elevato blocco motorio, oppure quando è fondamentale evitarlo (analgesia in travaglio di parto, analgesia post operatoria), o quando è auspicabile una sua rapida risoluzione (one Day surgery). D'altro canto per ottenere un blocco motorio di grado elevato è sufficiente aumentare la concentrazione e/o il dosaggio dell'anestetico (Zaric et al., 1991).
4.8 ANALGESIA INTRARACHIDEA: ANALGESIA EPIDURALE
L'anestesia epidurale è ottenuta mediante deposizione d'anestetico locale a livello dello spazio epidurale dorsale, in modo da desensibilizzare le radici dorsali e/o ventrali di uno o più nervi spinali e le aree corporee da questi ultimi innervate. Conseguentemente a un accesso dorsale, preferibilmente lombosacrale oppure sacrococcigeo, il primo sito d'azione dell'anestetico locale introdotto nello spazio epidurale è per gravità rappresentato dalle radici prima dorsali e poi ventrali dei nervi spinali, sebbene l'anestetico possa agire anche a livello di midollo spinale e di nervi paravertebrali (Catterall & Mackie, 2001). La somministrazione epidurale di un anestetico locale produce una paralisi sensitivo-motoria o eventualmente solo sensitiva, se si utilizzano basse concentrazioni o anestetici locali selettivi (BVC e RCV). La permeabilità delle meningi e in particolare della meninge dura madre è essenziale per l'azione di una somministrazione epidurale dorsale. Tradizionalmente si riteneva che la dura madre fosse impermeabile agli anestetici locali e che, quando somministrati per blocco epidurale, questi farmaci agissero a livello di nervi misti o del ganglio della radice dorsale aggirando la dura. Studi con tracciati radioattivi hanno permesso di dimostrare che la dura madre non è impermeabile e che gli anestetici locali depositati nello spazio epidurale od in quello subaracnoideo agiscono precisamente sugli stessi siti, cioè sulle radici spinali, sui nervi spinali misti e sulle lamine superficiali del midollo spinale, a una profondità (1 mm o più) in relazione alla liposolubilità dell'anestetico stesso (Bromage et al., 1963). La somministrazione invece, di oppioidi nello spazio epidurale produce esclusivamente analgesia, senza compromettere la funzionalità motoria.
La somministrazione epidurale di anestetici locali viene effettuata a livello lombo-sacrale. Nella maggior parte delle specie canine, a questo livello le uniche strutture presenti nel canale vertebrale sono la cauda equina, i seni venosi vertebrali ed il grasso epidurale. Nel cane, il midollo spinale vero e proprio si estende fino a circa L5-L6, mentre, nel gatto e nelle razze canine di taglia piccola e nei cani giovani, può raggiungere le prime vertebre sacrali (Corletto, 2004).
Nel cane e nel gatto, in caso di accesso lombosacrale, il paziente può essere posizionato in decubito laterale o sternale, con l'accortezza d'ottenere un certo grado di cifosi al fine di aumentare la distanza tra i processi spinali dorsali a livello lombare. I punti di repere per eseguire l'iniezione epidurale sono la sommità delle ali
dell'ileo e i processi spinali dorsali della vertebra lombare L7 e della vertebra sacrale S1. La cute viene preparata sterilmente, così come sterile deve essere l'equipaggiamento dell'operatore (Fonda, 2009).
Figura 4.2:Localizzazione dell'accesso lombosacrale
Lo spazio epidurale viene raggiunto facendo passare un ago tipo di Tuohy attraverso lo spazio tra i due archi vertebrali, sul piano sagittale mediano con una inclinazione a 45°- 60° in direzione craniale. Quest'ago possiede una punta arrotondata verso l'alto e poco tagliente per ridurre il rischio di puntura durale e per facilitare la fuoriuscita di un eventuale catetere che può essere fatto scorrere dentro l’ago ed il suo direzionamento. In genere gli aghi sono graduati in centimetri per permettere la misurazione della profondità raggiunta. Il calibro dell'ago varia tra 16 e 18 gauge. Attraversando il legamento interarcuato si percepisce una tipica ed improvvisa diminuzione di resistenza all'avanzamento dell'ago, come quando si trapassa una pergamena.
Il mandrino a questo punto può essere rimosso e l'ago avanzato attraverso il legamento. Se l'ago non può essere avanzato e sembra probabile che la punta sia a ridosso di strutture ossee, è necessario inserire nuovamente il mandrino e riposizionare l'ago, senza uscire dalla cute. Una volta raggiunto lo spazio epidurale, l'ago può essere ulteriormente avanzato per qualche millimetro ed il corretto posizionamento dell'ago può essere verificato attraverso l'inoculazione di una piccola quantità d'aria (0,5 - 1 ml) mediante siringa a bassa resistenza. Tali siringhe differiscono dalle siringhe normali, poiché, in queste ultime, parte della resistenza all'iniezione deriva dalla gomma alla fine del pistone, mentre nelle prime la resistenza dipende dalla pressione nello spazio in cui si inietta. Può essere impiegata anche una siringa normale, ma per verificare la resistenza è necessario riempirla in parte con aria ed in parte con una soluzione di fisiologica sterile ed osservare l'eventuale riduzione di volume della bolla d'aria durante l'iniezione. Ogni qualvolta una siringa è connessa all'ago e durante l'iniezione, l'anestesista deve mantenere in posizione l'ago di Tuohy con una mano, mentre con l'altra può effettuare l'iniezione. La somministrazione di un anestetico epidurale deve essere eseguita dopo aver confermato il corretto posizionamento dell'ago e l'assenza di sangue e liquido cefalo rachidiano (LCS) nell'ago. Il passaggio di sangue e LCS avviene lentamente e l'aspirazione con una siringa presenta il rischio di falsi negativi. È indicato perciò, attendere spontaneamente (in 4-5 sec) e, quindi, riconfermare il corretto posizionamento, provando ad aspirare prima di iniettare la soluzione anestetica. La soluzione anestetica o analgesica deve essere somministrata molto lentamente, monitorando l'apparato cardiocircolatorio accuratamente, per identificare precocemente eventuali effetti collaterali. Al termine della somministrazione, l'ago e la siringa saranno rimossi insieme (Corletto, 2004).
4.9 CONTROINDICAZIONI NELL'UTILIZZO DEL METODO EPIDURALE
Gli anestetici locali somministrati per via epidurale bloccano anche l'attività del sistema nervoso simpatico, causando perdita del controllo vasomotorio nell'area anestetizzata. Tale fenomeno predispone all'insorgenza di ipotensione, conseguente alla vasodilatazione indotta dall'anestetico. Il blocco simpatico solitamente si estende almeno 2 neuromeri al di sopra del blocco sensorio. L'ipotensione è tanto più grave, quanto più ampia è l'area anestetizzata e normalmente non è significativa dopo
somministrazione a livello lombosacrale in pazienti normovolemici e sani. In pazienti ipovolemici o con problemi cardiovascolari, la pressione arteriosa viene mantenuta nell'intervallo di normalità grazie all'aumento del tono simpatico ed alla vasocostrizione conseguente. In tali pazienti, l'ipotensione conseguente alla somministrazione di anestetici locali può essere importante e può richiedere la somministrazione di fluidi o vasocostrittori per essere corretta.
Altre complicazioni dell'anestesia epidurale sono legate alla somministrazione intravascolare del farmaco (depressione cardiocircolatoria, effetti sul SNC), oppure al danneggiamento delle strutture presenti nel canale vertebrale (formazione di ematomi e conseguente sintomatologia neurologica, oppure danno diretto a carico dei nervi che decorrono nel filum terminale e nella cauda equina). Il mancato rispetto dell'aspesi può causare complicazioni settiche. L'incidenza delle complicazioni è, comunque, relativamente bassa. Un'altra possibile complicazione è il mancato effetto dell'anestetico, somministrato al di fuori dello spazio epidurale. La penetrazione nello spazio subdurale (spinale) non è una controindicazione assoluta. L'anestetico può essere comunque somministrato, ma in dose ridotta del 50-60 per cento. Se la dose completa viene somministrata per via spinale, il blocco si estenderà molto più cranialmente di quanto desiderato, compromettendo l'attività dei muscoli respiratori della cassa toracica e determinando ipotensione. Per compromettere la funzionalità del diaframma, il blocco deve raggiungere la regione cervicale (C5). La diffusione di anestetico locale fino alla parte craniale del segmento toracico (T1 -. T4) del midollo spinale può compromettere la funzionalità del nervo cardioacceleratore e determinare bradicardia. Il posizionamento del paziente in posizione inclinata, con la parte craniale del corpo elevata rispetto a quella caudale, non influenza significativamente la migrazione in senso caudocraniale dell'anestetico, ma può al contrario, influenzare significativamente il ritorno venoso al cuore: pertanto, non è consigliabile.
La presenza di coagulopatie (anche la sola trombocitopenia < 100 x 109/l) e la somministrazione di anticoagulanti aumenta il rischio che l'eventuale puntura di un vaso nel canale vertebrale induca la formazione di un ematoma, in grado di causare una sintomatologia neurologica. Il mancato riconoscimento dell'ematoma e l'assenza di una tempestiva decompressione del midollo spinale possono causare un danno permanente. Il blocco dell'innervazione simpatica può aggravare la sintomatologia, causata da diminuzione del volume ematico circolante, o decompensare il sistema
cardiocircolatorio in un paziente cardiopatico (per esempio, con stenosi valvolare). In un paziente ipovolemico, è sufficiente correggere la volemia prima di somministrare l'anestetico, mentre in un paziente nel quale sia necessario mantenere le resistenze periferiche può essere indicata la somministrazione di vasocostrittori. La presenza di stenosi valvolare aortica grave è una controindicazione relativa per la somministrazione di anestetici locali per via epidurale e spinale.
L'esecuzione di una anestesia epidurale è controindicata anche in presenza di infezioni della cute a livello dell'area in cui si deve inserire l'ago spinale, poiché esiste un significativo rischio di contaminazione del canale vertebrale (Corletto, 2004) .
4.10 CALCOLO DELLA DOSE DELL'ANESTETICO PER VIA EPIDURALE
Gli anestetici locali impiegati a concentrazioni e dosi differenti, determinano per via epidurale, blocchi sensitivi e motori diversi. La scelta dell'anestetico e della dose (concentrazione e volume) dipende dalla mole del paziente, dall'estensione dell'area, onset e durata che con l'epidurale si vuole ottenere. L'esperienza clinica ha dimostrato che un buon livello di anestesia per interventi sull'addome e di ortopedia sul treno posteriore si ottengono con la somministrazione di 1 ml/5Kg (massimo, 20 ml) di lidocaina 2% o Bupivacaina 0.5%. In corso di cesareo in cane una soddisfacente analgesia epidurale si ottiene con 1 ml/6Kg .
Recenti studi hanno voluto dimostrare che è possibile determinare il volume di iniezione, calcolato come ml per lunghezza occipito-coccigea (LOC), correlata alla migrazione cefalica dopo somministrazione epidurale nello spazio lombosacrale di iopamidolo diluito in ropivacaina nel cane. L'estensione della migrazione dorso-craniale è stata misurata in cm osservando la diffusione della soluzione radiopaca ottenuta e quindi calcolata la LOC in percentuale. Una semplice regressione lineare ha dimostrato che esiste una relazione lineare tra il volume di ropivacaina iniettato e la migrazione cefalica espressa il percentuale LOC ottenuta con il contrasto radiopaco (Otero et al., 2009). Secondo questo studio stabilita l'area coinvolta nella chirurgia e il metamero della colonna vertebrale da raggiungere, il volume verrà così calcolato:
1° misurazione lunghezza in cm Occipito-coccigea (lunghezza totale colonna) 2° misurazione lunghezza T1-coccigea (lunghezza della colonna fino
all'altezza d'interesse, nel nostro caso volevamo raggiungere T1)
Attraverso una semplice equazione si metteranno in correlazione questi due valori ottenendo la percentuale di area che verrà interessata dall'analgesia.
Successivamente utilizzando il normogramma di Otero otterremo gli mL del volume da iniettare a livello dello spazio epidurale.