27
CAPITOLO 3
3 Catecolo (1,2-diidrossibenzene)
Figura 1: catecolo (1,2-diidrossibenzene).
Il catecolo, (C6H6O2, PM = 110.11) è un composto cristallino bianco, dall’odore tipicamente
fenolico[1], debolmente acido (pKa=10), caratterizzato da un punto di ebollizione a 245,5°C e
un punto di fusione a circa 105°C; la sua solubilità in solventi polari è molto elevata, in acqua è pari a circa 450 g/l, mentre nei solventi apolari è praticamente insolubile. Ottenuto per la prima volta nel 1839, da Reinsch, per distillazione secca della catechina, il catecolo, oggi, è prodotto a livello industriale principalmente a partire da fenolo; può inoltre essere ottenuto dalla distillazione a secco dei tannini, dalla lignina e prodotti bitumosi. Le applicazioni di questo prodotto sono molteplici: viene infatti utilizzato come materia prima nella sintesi degli inibitori di polimerizzazione, nell’industria farmaceutica come precursore di molti farmaci importanti, (un esempio fra tutti è l’L-dopa), nella produzione di profumi, sostanze aromatizzanti (vanillina), pesticidi, prodotti per lo sviluppo fotografico, agenti antiossidanti e reagenti analitici (figura 2). Date le sue molte applicazioni, il catecolo può essere classificato come una semi-commodities: la sua produzione annua era stata stimata, nel 1990, di circa 20.000 tonnellate, di cui il 50 % è impiegato per la produzione di pesticidi e di insetticidi (Furadan e Baygon), il 35-40 % viene utilizzato dall’industria degli aromatizzanti e profumi ed il restante 10-15 % dedicato a produzioni di minor entità, ma non meno importanti.
Attualmente la richiesta per il catecolo sta notevolmente aumentando, conseguentemente al suo impiego per la produzione della vanillina, via guaiacolo (3-metossi-fenolo): per questo motivo si stanno sviluppando molte ricerche che hanno lo scopo di migliorare ed economizzare gli attuali processi industriali di produzione dell’1,2-diidrossibenzene. Tali processi infatti, come vedremo nei prossimi paragrafi, presentano ancora problematiche di sicurezza dovute all’impiego di sostanze tossiche come il benzene, prodotto di partenza, e in
28
più sono caratterizzate da alti costi di gestione dovuti all’utilizzo del perossido di idrogeno concentrato, che è un reagente che necessita di notevoli precauzioni di sicurezza non solo durante la manipolazione, ma anche per lo stoccaggio.
Le nuove tecniche proposte sono caratterizzate dall’obiettivo comune di utilizzare materiali di riciclo, ad esempio il protossido di azoto derivante dalla produzione dell’acido nitrico, materie prime rinnovabili, come le biomasse, e i biocatalizzatori. La ricerca per lo sviluppo di tecniche di produzione alternative incoraggia ad identificare il catecolo come una materia prima ecologica e relativamente a basso costo per processi ad alta produttività, come ad esempio quello dell’acido adipico.
29
3.1 Produzione industriale
In passato il catecolo veniva prodotto per distillazione del carbone a bassa temperatura, tale processo è stato del tutto abbandonato ed attualmente i processi utilizzati sono due:
• l’idrolisi del 2-clorofenolo
• l’idrossilazione del fenolo
3.1.1 Idrolisi del 2-clorofenolo
Figura 3: idrolisi del 2-clorofenolo.
La reazione di idrolisi del 2-clorofenolo veniva condotta in una soluzione acquosa di idrossido di bario ed idrossido di sodio. Il bario, una volta completata la reazione, doveva poi essere recuperato come carbonato e trasformato nuovamente in idrossido per essere reintegrato nel ciclo produttivo. Al fine di evitare il trattamento di recupero del bario, più recentemente sono stati sviluppati processi che utilizzano solamente idrossidi alcalini. Facendo avvenire la reazione in soluzione acquosa di NaOH (8 % in peso), in presenza di solfato rameico ed ossido di rame (I), ad esempio, una mole di 2-clorofenolo reagisce con 2.3 moli di tale idrossido; la reazione viene condotta in un autoclave di rame, alla temperatura di 190°C per 3 ore. La miscela così ottenuta viene neutralizzata con acido solforico, il prodotto grezzo viene estratto e purificato per distillazione ed il solvente recuperato. La conversione del 2-clorofenolo varia tra il 96 e il 99 %, mentre la selettività in catecolo è compresa tra l’81-86 %[3].
Questo processo è entrato in uso a livello industriale nel 1973, attualmente però non è più utilizzato per motivi economici, in quanto comporta la coproduzione dell’o,o’-diidrossifenil etere; il processo potrebbe venir nuovamente preso in considerazione se l’interesse nel coprodotto aumentasse nella stessa misura del prodotto.
30
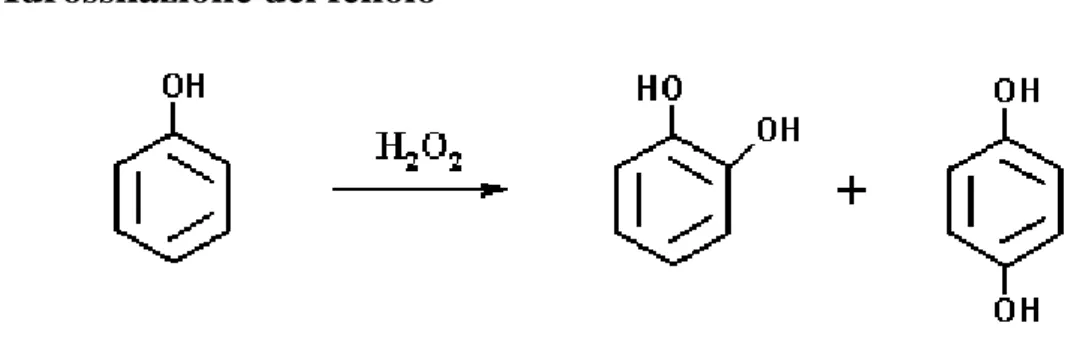
3.1.2 Idrossilazione del fenolo
Figura 4: idrossilazione del fenolo.
I processi industriali di produzione del catecolo, attualmente, si basano tutti sulla reazione di idrossilazione del fenolo per mezzo di perossidi come agenti ossidanti, per ottenere una miscela dei due isomeri orto e para benzendioli. I grandi impianti di produzione del catecolo utilizzano tutti questa sintesi, ma si differenziano per i sistemi catalitici impiegati e, di conseguenza, il diverso rapporto ottenuto tra catecolo (Tb = 245°C) ed idrochinone (1,4-benzendiolo, Tb = 287°C). Il processo di idrossilazione del fenolo comporta notevoli sforzi economici sia per la messa in sicurezza dell’impianto, a causa dell’utilizzo di perossidi, sia per il riciclo: infatti, a causa dell’elevata predisposizione dei prodotti di interesse alle reazioni di ossidazione consecutive, è necessario lavorare con largo eccesso del substrato di partenza, ovvero in difetto di ossidante.
3.1.2.1 Processo Rhone-Poulenc
Nel processo Rhone-Poulenc il fenolo viene fatto reagire con perossido di idrogeno al 70 % v/v (rapporto molare fenolo/H2O2 = 20:1), in presenza di acido fosforico, H3PO4, ed una
quantità catalitica di acido perclorico, HClO4, mantenendo la temperatura di esercizio a 90°C.
I prodotti di reazione, catecolo ed idrochinone, sono ottenuti con un rapporto rispettivamente di 3:2, per una conversione totale di fenolo pari al 5 %[4]. Il ruolo dell’acido fosforico è di agire da agente complessante per gli eventuali ioni metallici presenti in soluzione: la reazione, infatti, procede attraverso la formazione di intermedi elettrofilici, per cui la presenza di eventuali cationi potrebbe dar luogo a reazioni radicaliche secondarie che comporterebbero la formazione di resorcinolo (1,3 benzendiolo), come ulteriore sottoprodotto. Gli acidi fosforico e perclorico sono rimossi dalla miscela di reazione tramite lavaggio con acqua ed infine i prodotti sono estratti con etere diisopropilico, distillati e separati.
31 3.1.2.2 Processo Birchimia
Il processo Birchimia utilizza composti metallici, ferrocene e sistemi di cobalto, come catalizzatori; il fenolo viene idrossilato con una soluzione acquosa di perossido di idrogeno al 60 % v/v, mantenendo la temperatura di lavoro a 40°C, la reazione avviene per via radicalica ed è molto veloce. La conversione di fenolo per passaggio ottenuta in questo processo è pari a circa il 10 % e il rapporto catecolo/idrochinone è compreso tra 1.5 e 4.1[5].
3.1.2.3 Processo Ube Industries
Nel processo Ube Industries l’idrossilazione diretta del fenolo viene effettuata con perossidi chetonici, i quali vengono sintetizzati in situ dai chetoni corrispondenti ossidati con acqua ossigenata in presenza di catalizzatori metallici[6][7]. La sintesi viene condotta a 70°C, in presenza di tracce di acido solforico, un piccolo quantitativo di chetone ed una soluzione di H2O2 al 60 % v/v: si ottengono in questo modo catecolo ed idrochinone in un rapporto molare
di 3:2, con una conversone di fenolo del 90 %. Il processo utilizza una piccola quantità di catalizzatore in modo da minimizzare i fenomeni di corrosione e poter distillare direttamente la miscela di reazione; il componente chetonico viene recuperato durante la distillazione e riciclato.
3.1.2.4 Processo Enichem
Il processo Enichem, più recente e sicuramente innovativo, utilizza come catalizzatore la titanio silicalite (TS-1)[8], un sistema molto attivo per le reazioni di idrossilazione, in presenza di perossido di idrogeno al 30 % v/v come agente ossidante, evitando l’utilizzo di acidi e perossichetoni, in maniera da avere una sintesi più pulita. La reazione può essere condotta in diversi solventi, come acqua, metanolo o una miscela acqua/acetone 60/40, alla temperatura di riflusso, utilizzando un rapporto substrato/ossidante compreso tra 0.25 e 0.35; le rese di benzendioli così ottenute sono del 92 % rispetto ad una conversione di fenolo che varia tra il 20 e il 30 %, e dell’82 % rispetto alla conversione totale di perossido di idrogeno. Il rapporto molare tra catecolo e idrochinone varia tra 1.3 e 0.5[9]. In Italia è stato costruito un impianto, a Ravenna, per la produzione dell’idrochinone ed il catecolo da 10.000 tonnellate/anno, il processo che vi viene realizzato offre queste buone performances grazie all’alta selettività ed efficienza ottenute con i catalizzatori di titanio-silicalite.
32
I metodi di separazione e purificazione dei prodotti sono essenzialmente gli stessi per tutti i processi descritti: i prodotti sono separati dalla miscela di reazione per distillazione realizzata in una serie di colonne, l’acqua viene rimossa, quindi le frazioni bassobollenti ed il fenolo vengono recuperati e riciclati. Il catecolo, una volta separato, viene direttamente stoccato, mentre l’idrochinone è invece purificato tramite ricristallizzazione.
Altri processi per la produzione del catecolo sono stati brevettati, ma mai sviluppati su scala industriale a causa dei problemi di separazione dei prodotti o della corrosione delle apparecchiature: tali processi prevedono, infatti, di far avvenire l’idrossilazione del fenolo con peracidi, come ossidanti, e acidi forti o SO2, come catalizzatori[10][11].
In letteratura sono riportati ancora altri metodi per l’ottenimento del catecolo, partendo da 1,2-cicloesandiolo[12] via deidrogenazione, da salicilaldeide, per fusione alcalina degli acidi 2-fenilsolfonico e fenol-1,4-disolfonico, via demetilazione del guaiacolo (2-metossifenolo) con acido cromico e cloruro di alluminio, via idrolisi di amminofenolo con acidi alogenidrici. Tuttavia questi processi non sono realizzabili industrialmente in quanto partono da substrati ad alto valore aggiunto e non sono economicamente competitivi con l’idrossilazione diretta del fenolo.
3.2 Sintesi eco-compatibili del catecolo
I processi industriali per la sintesi del catecolo sono ben lontani dall’essere stati ottimizzati e sono invece caratterizzati da varie problematiche quali le conversioni relativamente basse che si riescono ad ottenere e l’utilizzo di agenti idrossilanti costosi e corrosivi, che richiedono costi di gestione di impianto e messa in sicurezza molto elevati. Essendo il catecolo un intermedio chimico che trova applicazione negli ambiti industriali più disparati, la sua produzione ha destato l’interesse nell’ambito della ricerca scientifica, che si è indirizzata verso lo sviluppo di nuovi processi che permettano di produrlo da fonti rinnovabili, come le biomasse, o da agenti ossidanti di riciclo, come protossido di azoto.
3.2.1 Produzione del catecolo da processi di pirolisi di biomasse
In natura il catecolo è presente in molte specie vegetali, come ad esempio nell’eucalipto, nel thè, lo zucchero grezzo, nel legno in generale e nei residui carboniosi: per cui, dato il rinnovato interesse nell’utilizzo delle biomasse come fonti energetiche alternative, è possibile
33 pensare di recuperare il catecolo dalla frazione liquida della pirolisi della lignina e dai residui bitumosi dei vegetali. Il processo di recupero di intermedi chimici dal residuo bitumoso ottenuto dalla carbonizzazione del legno in passato è stato sviluppato industrialmente, poi del tutto soppiantato dall’avvento dei processi petrolchimici: in alcuni paesi, invece, come il Brasile[13], dove la carbonizzazione del legno per la produzione del carbone e del vapore è rimasta utilizzata, la sua importanza economica potrebbe ancora crescere grazie allo sviluppo di nuove tecnologie di estrazione di intermedi ad alto valore aggiunto dai residui ottenuti. Un esempio di valorizzazione dei residui delle biomasse utilizzate nella produzione del bioetanolo è descritta da Foster, che ha brevettato un metodo per estrarre da essi composti fenolici in presenza di basi forti, lavorando tra i 400 e i 600°C per un tempo di reazione di 5 minuti[14].
Il processo di degradazione termica della biomassa inizia tra i 100 e i 105°C a pressione atmosferica, con l’evaporazione dell’acqua contenuta all’interno, in assenza di ossigeno; prosegue poi con una serie di reazioni eso e endotermiche, passando da 200-250 °C dove si ha la degradazione dell’emicellulosa, a 280-320°C dove si degrada la cellulosa, fino ad arrivare intorno ai 400°C dove si ha la depolimerizzazione della lignina[15][16][17]. Le condizioni di esercizio possono poi essere variate: la composizione dei prodotti ottenuti attraverso la pirolisi del legno, o delle biomasse in generale, infatti, è influenzata da molte variabili: il tipo di biomassa, la velocità di riscaldamento, la temperatura e la pressione di esercizio e la configurazione del reattore[18][19][20]. In seguito si riportano alcuni studi fatti sulla composizione della frazione liquida della pirolisi a proposito del recupero del catecolo attraverso tale processo.
Murwanashyaka et al.[21] hanno studiato la composizione della frazione liquida (“oil”: liquido marrone scuro, viscoso, composto dal 15-20 % d’acqua) della pirolisi della biomassa, fatta sotto vuoto a varie temperature di esercizio: la composizione dell’Oil risulta più ricca in fenoli, quando la temperatura di esercizio della pirolisi avviene a una temperatura compresa tra i 275 e i 350°C, un ulteriore trattamento a temperature comprese tra 350 e 450°C permette la degradazione dei composti fenolici a catecoli attraverso la loro degradazione (demetilazione-demetossilazione). I risultati ottenuti sono in accordo con quelli riportati da Petrocelli e Klein[22], i quali hanno verificato che la degradazione del guaiacolo (2-metossifenolo) a catecolo avviene lavorando ad alte temperature e con lunghi tempi di reazione.
34
Amen-Chien et al.[23] hanno studiato la separazione dei composti fenolici dal materiale bitumoso ottenuto dal processo di carbonizzazione del legno di eucalipto; la procedura di recupero consiste in quattro passaggi: a) dissoluzione in etilacetato, b) trattamento con soluzione alcalina acquosa, per convertire i fenoli in fenolati solubili in acqua c) rigenerazione dei fenoli via acidificazione con acido solforico e d) estrazione di una frazione ricca in fenoli con etilacetato dalla soluzione acida. Lo stadio di basificazione è stato indagato utilizzando soluzioni a diverso pH, ne è risultato che lavorando a valori di pH intorno a 10.5 si ha un recupero completo del catecolo grazie alle sue proprietà acide.
A proposito della separazione del catecolo dalla frazione fenolica, ottenuta dai residui bitumosi della carbonizzazione del legno, esistono vari brevetti, risalenti al periodo in cui l’industria chimica si basava sul carbone, che riportano vari metodi per il suo ottenimento[24]:
• alcuni si basano sulla diversa solubilità dei sali del catecolo ottenuti con cationi dei metalli alcalini ed alcalino-terrosi, che una volta filtrati venivano ripresi con acido cloridico e il catecolo recuperato per ricristallizzazione dalla soluzione cloridrica;
• altri metodi sfruttano la tendenza del catecolo a co-distillare con altri composti organici, ad esempio il toluene e il clorobenzene.
In un brevetto più recente[24] (1997) è descritto un metodo per separare il catecolo, proveniente dagli scarti della biomassa, dal 3-metil-catecolo e il 4-metil-catecolo, che hanno punti di ebollizione molto vicini tra loro, attraverso una serie di distillazioni ed estrazioni con glicerolo, evitando il processo di ricristallizzazione:
− con la prima distillazione viene separato il 4-metilcatecolo;
− il secondo stadio consiste invece in una distillazione estrattiva con glicerolo, per eliminare, di testa alla colonna, le impurezze presenti in soluzione;
− la miscela di glicerolo, catecolo e 3-metilcatecolo è nuovamente distillata per rimuovere questa volta il 3-metilcatecolo di testa;
− l’ultima distillazione viene effettuata per separare il catecolo dal glicerolo.
Ad oggi questi metodi di produzione del catecolo non sarebbero sufficienti a soddisfare l’elevata richiesta, ma il rinnovato interesse nella produzione del bioetanolo e, quindi, lo sfruttamento di biomasse fa però ben sperare di poter aumentare la produzione di questo intermedio attraverso tali risorse rinnovabili, eventualmente attraverso altri processi catalitici, quali l’idrogenolisi o la degradazione ossidativa dei derivati ligninici.
35
3.2.2 Biotecnologie per la sintesi del catecolo
La ricerca di nuove vie di sintesi per la produzione del catecolo da fonti rinnovabili si sta allargando anche al campo delle biotecnologie: la proposta comune di molti studi è quella di partire dal D-glucosio, o suoi derivati, e procedere nella sintesi del catecolo attraverso biocatalizzatori, cioè batteri geneticamente modificati, creati “ad hoc” per questo tipo di reazione.
Il D-glucosio, al contrario del benzene, può essere prodotto da fonti rinnovabili per idrolisi o saccarificazione, non è tossico ed i processi che lo coinvolgono per la produzione di alcuni chemicals utilizzano condizioni di reazione molto blande: acqua come solvente e temperature blande, a differenza dei processi che utilizzano il benzene come materiale di partenza, dove si raggiungono temperature molto elevate e si utilizzano solventi organici. I problemi dello scale-up di processi di questo tipo sono fondamentalmente due:
• riuscire ad offrire prodotti con un costo simile a quello dei prodotti ottenuti per via chimica;
• la reperibilità del materiale di partenza da fonti rinnovabili.
Nel primo caso è possibile dire che il catecolo e l’idrochinone ottenuti da processi biotecnologico hanno un costo simile a quello attuale, che è abbastanza elevato (2 €/Kg), a causa dell’utilizzo di perossido di idrogeno, molto costoso, nei processi di produzione “chimici”.
La chiave dei processi che si basano su materie prime derivanti dalle biomasse sta, invece, nello sviluppo di colture apposite per garantire l’estrazione del glucosio in grandi quantità: la specie vegetale migliore per tale proposito sembra il panico ed in generale le piante erbacee, ovvero piante in grado di crescere in ampie varietà di clima e che permettono di ottenere più raccolti stagionali. Poiché questo tipo di coltivazioni sono importanti e necessarie anche per garantire lo sviluppo della produzione del bioetanolo e dei biofuels, per i quali esiste un grande e rinnovato interesse scientifico ed economico, si può ben sperare che in un prossimo futuro vi sia un ampio sviluppo di questo tipo di filiera.
La grande risorsa ambientale dei processi biotecnologici, proposti per la produzione del catecolo, consiste nell’unire i vantaggi derivanti dall’utilizzo di fonti rinnovabili come le biomasse a quelli derivanti dall’uso di batteri come biocatalizzatori, che permettono di evitare l’impiego di sistemi a base di metalli ed alte temperature. Per poter utilizzare i batteri come
36
catalizzatori è però necessario modificarne il DNA: i microorganismi, infatti, in natura, consumano il glucosio facendo avvenire una combustione che produce CO2 e energia per la
loro crescita e riproduzione, modificandone il metabolismo è possibile fare in modo che essi immagazzinino il glucosio e lo “lavorino” per produrre la molecola di interesse[25].
Alcuni esempi di studi su processi biotecnologici per la produzione del catecolo sono riportati in seguito.
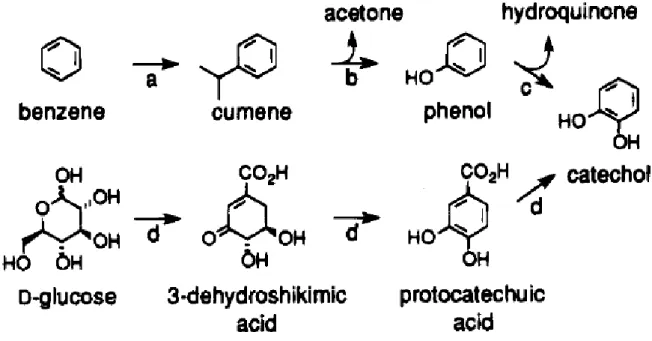
Frost e Draths[26][27] riportano la biosintesi del catecolo condotta a 37°C, in acqua, con Escherichia Coli modificata (figura 5): gli intermedi di reazione sono l’acido 3-deidroshikimico e l’acido protocatecoico, entrambi non tossici. Con questo metodo si elimina completamente l’uso del benzene e degli intermedi tossici da esso derivanti, e l’impiego del perossido di idrogeno; inoltre la temperatura utilizzata di 37°C è molto inferiore ai 250°C necessari per far avvenire la reazione
a
e i 100°C circa necessari per le reazionib
ec
. Il catecolo, ottenuto con una resa del 77 % rispetto alla massima teorica calcolata, è isolato facilmente dalla coltura batterica in cui è accumulato e risulta essere l’unico prodotto della reazione. Il processo di recupero avviene per estrazione con etilacetato e successivamente la frazione organica, così ottenuta, viene seccata su MgSO4 e concentrata a pressione ridotta.Figura 5: confronto schema di sintesi del catecolo a partire da benzene e da D-glucosio.
Le rese assolute di questi processi si aggirano, generalmente, attorno al 5-10 %, a causa della tossicità dei composti aromatici nei confronti dei microorganismi necessari alla reazione: Li e Frost[28], in uno studio pubblicato nel 2005, riportano alcune indagini su possibili approcci alternativi per condurre la biosintesi con rese maggiori:
37
• una possibile soluzione proposta è di estrarre continuamente il catecolo dal mezzo di reazione, con una resina sintetizzata in situ, in maniera da ridurre l’effetto tossico del catecolo;
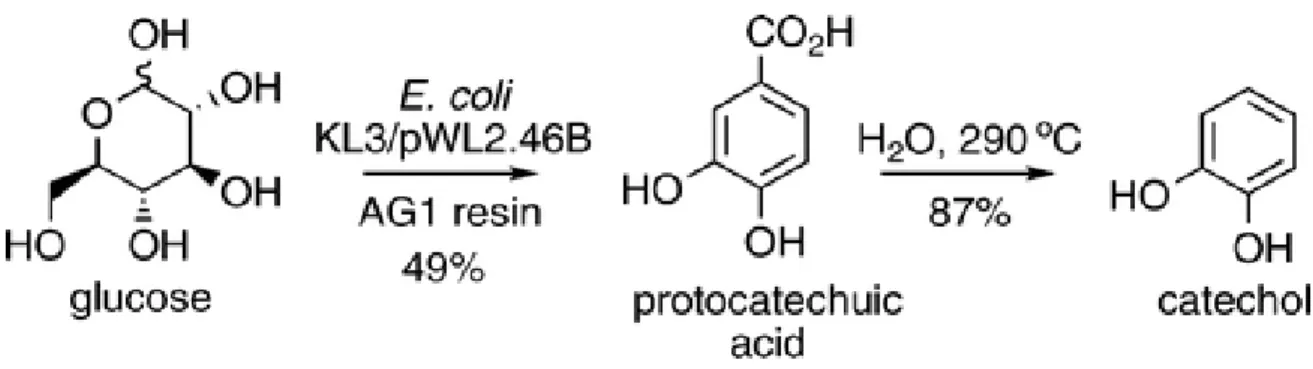
• l’altra soluzione proposta è quella di fermare la biosintesi al primo o al secondo intermedio di reazione, che non risultano essere tossici nei confronti dei microorganismi, e procedere poi con una decarbossilazione in acqua in fase supercritica, a 290°C, per ottenere il catecolo.
La miglior resa di catecolo, 43 % sul glucosio alimentato in partenza, è ottenuta estraendo l’intermedio protocatecoico, con la resina e proseguendo con la decarbossilazione ad alta temperatura per ottenere la molecola desiderata. In figura 6 viene riportato uno schema semplificato della reazione:
Figura 6: schema della sintesi del catecolo con biotecnica interfacciata con metodo chimico.
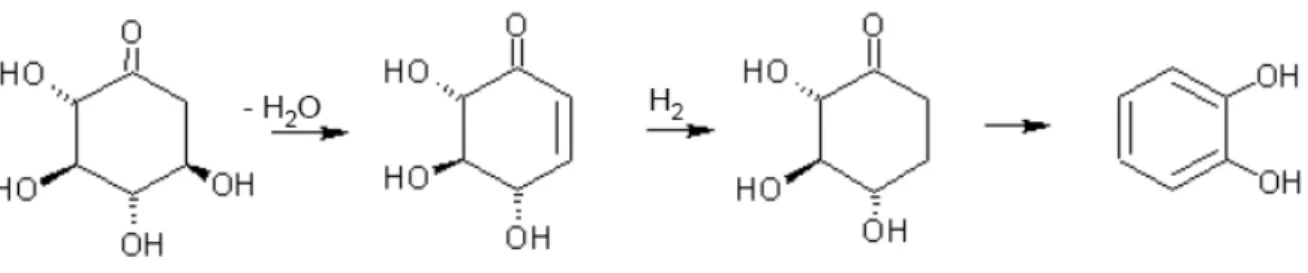
Suzuki et al.[29] propongono un processo, brevettato nel 2011, per sintetizzare il catecolo a partire da (4S,5R,6S)-4,5,6-triidrossi-2-cicloesen-1-one (figura 7):
Figura 7:(4S,5R,6S)-4,5,6-triidrossi-2-cicloesen-1-one.
Tale molecola a sua volta viene prodotta dalla disidratazione del 2-deossi-scyllo-inososo (figura 8 ), un intermedio derivante dal D-glucosio[30], attraverso un processo biotecnologico.
38
Figura 8: 2-deossi-scyllo-inososo.
La successiva reazione di sintesi del catecolo proposta nel brevetto consiste in un processo one-pot di idrogenazione e disidratazione del (4S,5R,6S)-4,5,6-triidrossi-2-cicloesen-1-one: i solventi proposti per la reazione sono vari, tra cui acqua, metanolo, etanolo, butanolo. La temperatura di esercizio è compresa tra i 30 e i 300°C e la pressione di idrogeno tra 1 e 10 atm, i tempi di reazione variano tra i 30 minuti e le 24 ore. La reazione avviene in presenza di sistemi catalitici a base di metalli nobili, come Pd, Rh, Ru, Pt, Ir, e di metalli del gruppo del ferro, come Ni ,Co, oppure Cu; tali metalli possono essere usati tal quali o supportati, anche la scelta del supporto è ampia,essendo proposto carbone, gel di silice, montmorilloniti, zeoliti, allumina e silice.
In alternativa ai sistemi metallici, la reazione è stata indagata anche in presenza di acidi, come trifluoroacetico, dodecilbenzensulfonico, bromidrico, e resine funzionalizzate con gruppi acidi, come il nailon. Le rese di catecolo ottenute variano dal 25 % al 57 %.
In figura 10 si riporta uno schema semplificato della reazione:
Figura 9: schema semplificato per la sintesi del catecolo da 2-deossi-scyllo-inososo.
3.2.3 Sintesi del catecolo con N
2O
Un’alternativa molto interessante proposta per sintetizzare il catecolo è utilizzare l’N2O come
agente idrossilante per il fenolo o il benzene. Come è stato descritto nel capitolo precedente il protossido di azoto, o ossido nitroso, è un agente inquinante, derivante dalla produzione
39 dell’acido adipico o dalla produzione dell’acido nitrico, che necessita di molti costosi trattamenti per essere smaltito; il suo impiego in processi alternativi è stato proposto per risolvere tale problematica. Gli studi effettuati sull’idrossilazione del benzene a fenolo, con ossido nitroso, hanno evidenziato che il miglior sistema catalitico per tale sintesi è la zeolite ferro modificata Fe-ZSM-5, che garantisce una selettività in fenolo molto vicina al 100 %; il Boreskov Institute of Catalysis ha sviluppato con successo un impianto pilota che sfrutta tale tecnologia[31].
I primi tentativi di estendere la reazione in oggetto all’ulteriore idrossilazione del fenolo a benzendioli (DHB) sono stati riportati da Tirel et al.[32] e Panov et al.[33]:
• i primi utilizzano il sistema catalitico HZSM-5 a 400°C, ottenendo il 5 % di conversione del fenolo, con una selettività in diidrossibenzene dell’87 %;
• nel secondo studio, la reazione è stata indagata a 350°C in presenza di Fe-ZSM-5 come catalizzatore, in questo caso la conversione di fenolo ottenuta è di circa l’11,5 %, con una selettività in benzendioli pari al 92 %.
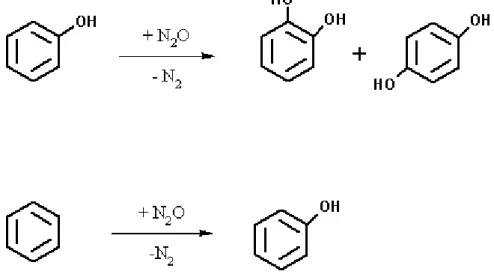
Il fattore limitante di questi processi consiste nella disattivazione del catalizzatore, tale svantaggio è stato superato per l’ossidazione del benzene a fenolo, lavorando in largo eccesso del substrato di partenza: tale soluzione non può essere applicata a processi di idrossilazione successiva del fenolo però, a causa degli elevati costi di riciclo necessari per tale substrato. Ivanov et al.[34] propongono di effettuare la reazione di idrossilazione del fenolo in presenza di un eccesso di benzene, dando luogo contemporaneamente alla reazione di idrossilazione dei due substrati, (figura 10), con generazione del fenolo.
40
Come si evince dallo schema di reazione, rappresentato in figura 10, si unisce il vantaggio di produrre il fenolo e il catecolo impiegando un materiale di scarto, N2O, che altrimenti
dovrebbe essere smaltito, trasformandolo in N2, un gas inerte. La reazione è condotta in
presenza della zeolite Fe-ZSM-5 (conc. Fe = 0,02 % in peso), per 12 ore a 450°C, utilizzando alimentazioni con eccesso di benzene e varie concentrazioni di fenolo: la formazione di DHB avviene anche quando l’alimentazione è solo benzene e aumenta con l’aumento della concentrazione di fenolo presente nell’alimentazione, in ogni caso i sottoprodotti di ossidazione successiva, COx, si formano in quantità non rilevanti. Le selettività nei prodotti
desiderati sono elevate per entrambe le reazioni, quella in fenolo, da benzene, varia tra il 97 e il 98 %, mentre quella in diidrossibenzene (isomero orto e isomero para) da fenolo, tra l’82 e il 92 %, il sottoprodotto principale è coke. La distribuzione degli isomeri dei benzendioli, orto, meta e para, varia con la quantità di catalizzatore, con la composizione dell’alimentazione e la temperatura:
• la selettività in catecolo varia tra 26-35 %
• la selettività in idrochinone e del benzochinone variano tra il 25 e il 57 % e tra il 45 e il 4,5 % rispettivamente
• la selettività in resorcinolo varia tra 3,5 e 5 %
La formazione del resorcinolo, isomero fortemente sfavorito, che non avviene nel processo di idrossilazione con perossido di idrogeno, è dovuta alla forte attivazione dell’ossigeno da parte della zeolite, che gli consene di attaccare il fenolo nella posizione meta disattivata.
Prolungando il tempo di reazione da 12 ore a 40 ore è possibile variare il rapporto idrochinone/catecolo da 10-12 a 1.6, si presuppone a causa della reazione di isomerizzazione dell’idrochinone a catecolo.
A confronto della reazione classica di idrossilazione del fenolo con perossido di idrogeno si hanno diversi vantaggi, quali il costo nullo dell’ossido nitroso, che è un prodotto di scarto, inoltre la bassa selettività in DHB, 15 %, è compensata dal fatto che il fenolo, principale co-prodotto, può essere riciclato per il 15 % all’alimentazone e il restante 75 % venduto come prodotto (figura 11).
41
Figura 11: schema semplificato del processo di idrossilazione del benzene con N2O.
Un altro vantaggio di questo tipo di processo deriva dal fatto che la materia prima è benzene, che ha un costo di 0,4 €/Kg, mentre il fenolo, che ha un prezzo di 0,9 €/Kg, viene integrato man a mano che viene prodotto, consentendo di ottenere il catecolo con un prezzo minore di quello attuale, 2€/Kg, considerando anche la possibilità di convertire il principale sottoprodotto, idrochinone, in fenolo (riciclabile e con maggior richiesta) con una reazione di deidrossilazione idrogenativa[35]: questa prospettiva aumenta le possibilità di inserire il catecolo nel processo di produzione dell’acido adipico, tramite la sua idrogenazione a cicloesandiolo, unendo i vantaggi ambientali derivanti da un processo effettuato con un ossidante di scarto a quello economico di ottenere il catecolo ad un prezzo minore[36].
Questo tipo di approccio rientra nella più generale tendenza di cercare processi innovativi “integrati” capaci di valorizzare prodotti e sottoprodotti di scarto, che sicuramente contraddistingue i processi chimici industriali più innovativi.
42
Bibliografia
[1] Ullmann’s, Encylopedia of Industrial Chemistry, A19, (2002) 342.
[2] Fahlbush K.G., Hammerschmidt F.J., Panten J., Pickenhagen W., Shatkawski D., Bauer K., Garbe D., Surburg H., Ullmann’s Encyclopedia of Industrial Chemistry, 6th edition, vol.4 (2003) 73.
[3] Nagaoka T., JP Patent 4,739,039 (1971) (Assegnato a Ube Industries). [4] Varagnat J., IEC Prod. Res. Dev.,15 (1976) 212.
[5] Maggiani P., Minisci F., Chim. Ind.(Milano), 59 (1977) 239.
[6] Umemura S, Takamitu N., Hamamoto T., Kuroda N., U.S. Patent 4,078,006 (1976) e JP Patent 5,0130,727 (1974) (Assegnato a Ube Industries).
[7] Hamamoto T., Kuroda N., Takamitu N., Umemura S., Nippon Kagaku Kaishi, (1980) 1850.
[8] Horsely J.A., Vatcha S.R., Trifirò F., Cavani F., Catalytica Division, 4193, SO (1994). [9] Romano U., Esposito A., Maspero F., Neri C., Clerici M.G:, La Chimica e l’Industria, 72 (1990) 610.
[10] Seifert H., Waldmann H., Shwerdtel W., Swodenk W., U.S. Patent 4,053,523 (1975) (assegnato a Bayer).
[11] Drauz K., Kleeman A., U.S.Patent 4,618,730 (1984) (Assegnato a Degussa AG co). [12] Maki T., Murayama K., JP Patent 5,855,439 (1981) (Assegnato a Mitsubishi Kasei Co.). [13] Luengo C.A., Cencing M.O., Applied Science Essex,(1991) 299.
[14] Foster A., U.S. Patent 5,807,952 (1998) (assegnato a MldWest Research Institute Kansas City).
[15] Fegel D., Wegener G., Wood: Chemistry, Ultrastructure, Reactions, (1984) 319. [16] Alén R., Rytkanen S., Mckeough P., J. Anal. Appl. Pyrol., 31 (1995) 1.
43 [17] Rahmiah M.V., J. Appl. Polym. Sci., 14 (1970) 1323.
[18] Pakdel H., Roy C., Lu X., Developments in Thermochemical Biomass Conversion, 24 (1997) 124.
[19] Samolada M.C., Stoicos T., Vasalos I.A., J. Anal. Appl. Pyrol., 18 (1990) 127. [20] Shafizadeh F., The Chemisrty of Solid Wood, ACS (1984) 489.
[21] Murwanashyaka J.N., Pakdel H., Roy C., J. Anal. Appl. Pyrol., 60 (2001) 219.
[22] Petrocelli F.P., Klein M.T:, Foundamentals of Thermochemical Biomass Conversion, (1985) 257.
[23] Amen-Chien C., Pakdel H., Roy C., Biomass and Bioenergy, 13 (1997) 25.
[24] Duncan D.H., Baker G.G., Maas D.J., Mohl K.M., U.S. Patent 5,679,223 (1997) (Assegnato a Dakota Gasification Company).
[25] Frost J.W., Green Chemistry at work, EPA Journal, 20 (1997) 22. [26] Frost J.W., Draths K.M., J. Am. Chem. Soc., 117 (1995) 2395.
[27] Frost J.W., Draths K.M, WO Patent 95/07979 (1995) (Assegnato a Purdue Research Foundation).
[28] Li W., Xie D.,Frost J.W., J. Am. Chem. Soc., 127 (2005) 2874.
[29] Suzuki T., Hayashi T., Kitagawa H., Yoshimura N., U.S. Patent 2011/034735 (2011) (Assegnato a Mitsui Chemical, Inc.).
[30] Takagi M., Kogure T., Wakisaka N:, Takaku H., Kakinuma K., Agisaka K., WO Patent 2006/112000 (Assegnato a The Nigota Institute of Science and Thecnology).
[31] Uriarte A.K., Rodkin M.A., Gross M.J., Kharitonov A.S., Panov G.I:, Stud. Surf. Sci.
Catal., 110 (1997) 857.
[32] Tirel P.J., Gubelmann M.H., Pope J.M., in Extended Abstracts 9th Inter, Zeolite Conf.,
Montreal (1992) RP61.
44
[34] Ivanov D.P., Sobolev V.I., Pirutko L.V., Panov G.I., Adv. Synth. Catal., 344 (2002) 986. [35] Dalloro L., Cesana A., Buzzoni R., Rivetti F., European Patent 1,411,038 (2004)
(Assegnato a Polimeri Europa).