INDICE
INTRODUZIONE……….-3-
CAPITOLO 1 Health Technology Assessment……….………..-6-
1.1 Definizioni e caratteristiche…………...……….-6-
1.2 Origini storiche dell’HTA ……….-10-
1.3 Principi e momenti del processo………...…-13-
1.5 Gli elementi della valutazione………..-19-
1.4 Hospital- Based HTA………..-22-
CAPITOLO 2 Diffusione e sviluppo dell’HTA in Europa: l’esperienza di sei Paesi europei………..-30-
2.1 Svezia……….…-34- 2.2 Danimarca………...……….-36- 2.3 Regno Unito………..-37- 2.4 Francia………..……….…..-39- 2.5 Spagna………...…...-42- 2.6 Germania……….……….……-44- CAPITOLO 3 Sviluppo e diffusione dell’HTA in Italia: l’esperienza di sei Regioni……….………..…..-45- 3.1Emilia Romagna……….…..-52- 3.2 Veneto………..………..…-54- 3.3 Lombardia………...………...-57- 3.4 Piemonte………...-60- 3.5Lazio………-65- 3.6 Toscana………..………...-68- CAPITOLO 4 L’esperienza dell’ Azienda Ospedaliero Universitaria Pisana (AOUP): una realtà Hospital- Based HTA?………..……….………...-70-
4.1 Contesto di riferimento………..………-70-
4.2 Il gruppo di valutazione e le attività divalutazione aziendali….……….…..…-73-
4.3 La riorganizzazione di un processo di supporto manageriale: il processo di programmazione e acquisto delle attrezzature elettromedicali………....-75-
4.3.1 Mappatura dell’esistente……….…...…-80-
4.3.1.1 Macro attività del processo di programmazione e acquisto delle attrezzature elettromedicali………...……….…...…-81- 4.3.2 Fase dell’Assessment…………..………..…...-87- 4.3.3 Progetti……….…....…-89- 4.3.4 Conclusioni……….…….-98- BIBLIOGRAFIA……….…..-101-APPENDICE Carta di Trento………....…-106-
INTRODUZIONE
Negli ultimi decenni si è assistito ad un aumento della spesa sanitaria e allo sviluppo di nuove e costose tecnologie. Le tecnologie innovative hanno contribuito a migliorare l’efficacia delle cure e la qualità di vita dei pazienti ma hanno portato ad un aumento dei bisogni sanitari e dei costi della spesa sanitaria.
L’aumento dei bisogni sanitari e dei costi è dovuto principalmente a tre cause (Fig. 1) che sono (1, 3):
- insorgenza di nuove malattie;
- invecchiamento della popolazione, grazie al miglioramento delle condizioni di vita e dell’assistenza sanitaria, legato ad un aumento delle patologie croniche, spesso invalidanti, tipiche delle età più anziane;
- sviluppo di tecnologie innovative, che spesso attivano nuovi bisogni e portano ad un aumento dei costi perché:
o consentono di trattare condizioni precedentemente non trattabili;
o spesso consistono in trattamenti costosi;
o possono consentire il trattamento di soggetti precedentemente esclusi dai trattamenti tradizionali.
Nell’ottica di una riduzione dei costi a fronte di risorse sempre più limitate, delle tre cause sopra esposte solamente lo sviluppo di nuove tecnologie può essere controllato dalla politica sanitaria.
Uno studio americano del 1993 ha sottolineato come nei sistemi sanitari in cui le risorse e la spesa non sono limitate i principali fattori di aumento dei costi controllabili dal management sanitario sono i cambiamenti del volume e dell’intensità della pratica clinica. Una cosa simile avviene anche nei sistemi in cui le risorse sono limitate, dove cambiamenti di volume e di intensità della pratica clinica possono portare ad un aumento dei costi e quindi ad uno spostamento delle priorità di politica sanitaria (2,3).
Fig. 1 Cause dell’aumento dei costi in sanità. 1997)
A livello internazionale e nazionale diffusa la consapevolezza che
nuovo modello organizzativo, ecc.) debba essere preceduto valutativa che consideri non solo
molto altro ancora. (4,5,6)
L’Health Technology Assessment (HTA)
Tecnologie Sanitarie, “si sviluppa come la complessiva e sistematica valutazione multidisciplinare delle conseguenze assistenziali, economiche, sociali ed etiche provocate in modo indiretto e diretto, nel breve e nel lungo periodo, dalle tecnologie sanitarie esistenti e da quelle di nuova introduzione” (
fondamentale per il potere decisionale in ambito sanitario (
17% 32%
Cause dell’aumento dei costi in sanità
(Fahey, 1995; Muir Gray J.A. 1997)
Cause dell’aumento dei costi in sanità. Fonte: Fahey, 1995; Muir Gray JA,
e nazionale tra professionisti, amministratori e politici si è la consapevolezza che l’introduzione di qualsiasi nuovo evento
nuovo modello organizzativo, ecc.) debba essere preceduto da una attenta analisi consideri non solo l’efficacia e la sicurezza ma anche
’Health Technology Assessment (HTA), traducibile come valutaz
“si sviluppa come la complessiva e sistematica valutazione multidisciplinare delle conseguenze assistenziali, economiche, sociali ed etiche provocate in modo indiretto e diretto, nel breve e nel lungo periodo, dalle tecnologie sanitarie esistenti e da quelle di nuova introduzione” (4) e rappresenta un supporto
per il potere decisionale in ambito sanitario (policy maker 9%
42%
Cause dell’aumento dei costi in sanità
(Fahey, 1995; Muir Gray J.A. 1997)
Cambiamenti demografici (invecchiamento della popolazione)
Inflazione generale dei prezzi
Inflazione dei prezzi sanitari
Cambiamenti del volume e dell'intensità della pratica clinica
Fahey, 1995; Muir Gray JA,
sti, amministratori e politici si è (nuovo farmaco, a attenta analisi l’utilità, i costie
alutazione delle “si sviluppa come la complessiva e sistematica valutazione multidisciplinare delle conseguenze assistenziali, economiche, sociali ed etiche provocate in modo indiretto e diretto, nel breve e nel lungo periodo, dalle tecnologie rappresenta un supporto policy maker) (Fig. 2).
Cause dell’aumento dei costi in sanità
Cambiamenti demografici (invecchiamento della popolazione)
Inflazione generale dei prezzi
Inflazione dei prezzi sanitari
Cambiamenti del volume e dell'intensità della pratica
Fig. 2 Modello ideale del potere decisionale in ambito sanitario (policy process)
CAPITOLO 1
HEALTH TECHNOLOGY ASSESSMENT
1.1 DEFINIZIONI E CARATTERISTICHE
Esistono molte definizioni per l’Health Technology Assessment (HTA) “riconducibili alla vasta gamma di attività che include; alcune si basano sulle metodologie utilizzate, altre si focalizzano sugli aspetti di ricerca ed altre ancora sulle attività di chi valuta le tecnologie” (7). Secondo R.N. Battista l’HTA “è uno strumento di valutazione multidisciplinare nato per dare una risposta operativa al divario fra le risorse limitate di cui il sistema sanitario dispone e la crescente domanda di salute e l’innovazione tecnologica”(8). L’European Network for Health Technology Assessment –EUnetHTA (9) definisce l’HTA “un approccio multidisciplinare che riassume le informazioni sugli aspetti medici, sociali, economici, etici collegati all’utilizzo di una tecnologia sanitaria in modo sistematico, trasparente, indipendente”. Per Carlo Favaretti “la valutazione delle tecnologie sanitarie o HTA costituisce un approccio multidimensionale e multidisciplinare per l’analisi e la valutazione multisettoriale delle conseguenze delle implicazioni medico-cliniche, sociali, organizzative, economiche, etiche e legali, provocate in modo diretto ed indiretto, nel breve e nel lungo periodo, dalle tecnologie sanitarie esistenti e da quelle di nuova introduzione” (10)
L’HTA come strumento di supporto per la politica sanitaria e non solo un nuovo campo di ricerca (8). A questo proposito la Carta di Trento (11), un documento prodotto a seguito del Primo Forum italiano per la valutazione delle tecnologie sanitarie organizzato a Trento nel 2006 dall’Azienda Provinciale per i Servizi Sanitari di Trento, dall’Università di Trento e dal Network Italiano di Health Technology Assessment (NI-HTA), cita “la valutazione delle tecnologie sanitarie permette una complessiva e sistematica valutazione multidisciplinare (descrizione, esame e giudizio) delle conseguenze assistenziali, economiche, sociali ed etiche provocate in modo diretto ed indiretto, nel breve e nel lungo periodo, dalle tecnologie sanitarie esistenti e da quelle di nuova introduzione, rappresentando il ponte tra il mondo tecnico-scientifico e quello dei decisori”.
Anche il concetto di tecnologia sanitaria si è modificato nel tempo e la prima definizioni del 1978 è dll’Office of Technology Assessment (OTA) (12) che considerava tra le tecnologie sanitarie “i farmaci, i dispositivi, le procedure mediche e chirurgiche usate
nella cura della salute, ed anche i sistemi di organizzazione e di supporto entro i quali tali cure devono essere prestate”. Questa definizione è stata modificata 1992 dallo Standing Group on Health Technology del National Health Service (NHS) del Regno Unito: “ tutti i metodi utilizzati dagli operatori sanitari per promuovere la salute, per prevenire e trattare la malattia, per migliorare la riabilitazione e le cure a lungo termine”. Nel 2006 sempre il NHS britannico ha definito l’Health Technology (tecnologia sanitaria) un termine internazionalmente riconosciuto che include “tutte le tecnologie utili alla promozione della salute, alla prevenzione e trattamento delle malattie e alla migliore gestione della riabilitazione e/o delle lungodegenze (12). In questo senso il concetto di tecnologia non sta ad indicare solamente i nuovi farmaci o particolari, sofisticate apparecchiature mediche, ma include procedure, setting di cura e programmi di prevenzione” (13).
Il concetto di tecnologia sanitaria è quindi molto ampio e comprende ogni aspetto dell’assistenza sanitaria:
- le attrezzature sanitarie; - i dispositivi medici;
- i farmaci;
- i sistemi diagnostici;
- le procedure mediche e chirurgiche;
- i percorsi assistenziali;
- i sistemi organizzativi e gestionali;
- le strutture sanitarie e gli assetti strutturali;
- i processi di supporto.
Le tecnologie sanitarie possono essere ulteriormente classificate in:
- emergenti, ovvero ancora in fase di studio e non ancora sul mercato;
- nuove, ad uno stadio ancora iniziale della diffusione;
- obsolete, per le quali si deve valutare l’opportunità di cessarne l’impiego o metterle in fuori uso.
Secondo una storica definizione del 1978 le caratteristiche fondamentali dell’ HTA sono (14)
− la multidisciplinareità/multidimensionalità: è necessario valutare l’impatto che potrà avere una tecnologia sanitaria da diverse angolazioni (Fig. 3);
− la strutturalità: metodo analitico rigoroso, ricerca di tutte le evidenze scientifiche e raccolta ed analisi dei dati dalla più ampia serie di fonti appropriate;
− l’orientamento politico: l’HTA è un “ponte” fra il mondo dei decisori (politico) e quello scientifico (policy driven).
Fig. 3 La multidisciplinarietà nel processo di HTA (Fonte: Francesconi, 2007)
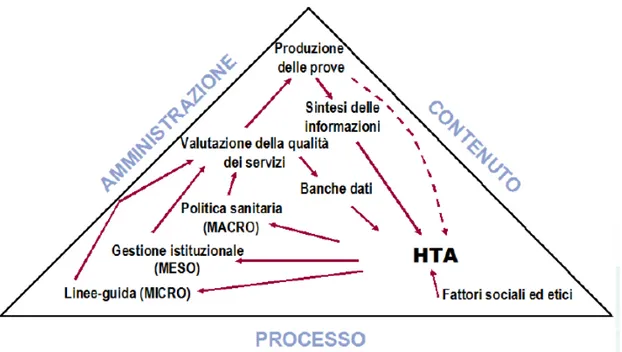
L’HTA si configura come uno strumento di supporto delle decisioni di politica sanitaria del management a cui deve trasferire tutte le informazioni scientifiche e tecniche raccolte e analizzate (15) e che permette di garantire l’appropriatezza nella scelta (e nell’utilizzo) di una tecnologia sanitaria, razionalizzando e contendo i costi sanitari agendo da “ponte” (Fig. 4 ) tra le evidenze scientifiche (efficienza, sicurezza, costo efficacia, impatto organizzativo, ecc.) e le decisioni politiche macro (immissione in
commercio, rimborso di una prestazione, ecc.), meso (acquisto di tecnologie) e micro (decisioni della quotidiana pratica clinica) (16).
L’attività di HTA è però insufficiente da sola per una corretta attività di programmazione sanitaria e deve essere supportata dall’attività di Horizon Scanning (HS) che permette l’individuazione precoce di nuove o emergenti tecnologie sanitarie ad elevato impatto sul sistema sanitario. “Non è soddisfacente reagire agli sviluppi tecnologici solo quando confrontati con le loro conseguenze” (6)
Schematizzando il processo di HTA in tre fasi abbiamo (7) :
- Horizon Scanning (HS): identificazione precoce delle tecnologie sanitarie emergenti o nuove;
- HealthTechnologyAssessment (HTA): valutazione di tutti gli aspetti della tecnologia sanitaria;
- Monitoraggio e revisione: revisione periodica e ri-valutazione della tecnologia durante a pratica clinica.
Fig. 4 L’HTA come “Ponte” fra le evidenze scientifiche e le decisioni politiche (Fonte RN Battista, 1994)
1.2 ORIGINI STORICHE
L’HTA nasce negli Stati Uniti alla fine degli anni ’60 quando il termine Technology Assessment viene introdotto al Congresso degli Stati Uniti dal deputato Emilio Q. Daddario, membro del Comitato per la Scienza e Astronautica (Committee on Science and Astronautics) della Camera dei Rappresentanti del Congresso, con queste parole “le informazioni tecniche di cui hanno bisogno i policymakers non sono frequentemente disponibili, o non sono nella giusta forma. Un policymaker non può giudicare i meriti o le conseguenze di un programma tecnologico all’interno di un contesto rigorosamente tecnico. Deve considerare le implicazioni sociali, economiche e legali di tutta la linea di condotta.” Il Technology Assessment nasce quindi come strumento di analisi per valutare l’impatto economico, sociale e legale delle nuove tecnologie e a supporto dei policymakers. Nel 1972 con il Technology Assessment Act, il primo decreto legge sulla valutazione delle tecnologie, viene creato l’Office of Technology Assesment (OTA) con il compito di sviluppare e diffondere il Technology Assessment e fornire a tutti i membri del Congresso le informazioni tecniche, economiche e sociali su una nuova tecnologia non solo sanitaria ma appartenete a molteplici settori strategici degli Stati Uniti (telecomunicazioni, medicina, agricoltura, trasporti, difesa, ecc.) L’esperienza dell’OTA terminò nel 1995, ma in seguito negli Stati Uniti nacquero molte agenzie simili, come la Agency for Healthcare Research and Quality.
Negli anni ‘70 nasce anche la Collaborazione Cochrane con lo scopo di raccogliere, valutare e disseminare tutte le informazioni sulla efficacia degli interventi sanitari. Secondo il fondatore Archie Cochrane “selezionare una tecnologia sulla base dell’efficacia (capacità di trarre beneficio da parte dei pazienti) rappresenta anche una via per allocare in maniera efficiente le risorse”. La Collaborazione Cochrane è fondamentale per lo sviluppo dell’ Evidence Based Medicine (EBM) o Medicina Basata sull’Evidenza, che viene definita come “l’integrazione dell’esperienza del medico con le migliori evidenze scientifiche disponibili in letteratura” e rappresenta uno strumento utilissimo per l’HTA. Secondo l’EBM nelle scelte cliniche e terapeutiche deve essere attribuito un ruolo fondamentale alle “evidenze” ovvero a tutte quelle informazioni scientifiche aggiornate e validate da meta-analisi, revisioni sistematiche o linee-guida (17, 18).
Nel 1985 viene fondata la prima rivista internazionale di HTA, l’International Journal of Technology Assessment in Health Care, grazie alla cooperazione di Stati Uniti ed
Europa. Nello stesso anno nasce anche l’International Society of Technology in Health Care (ISTACH), oggi Health Technology Assessment International (HTAi) (19), una società scientifica internazionale a cui aderiscono molte organizzazioni/agenzie di HTA e collega professionalmente tutti coloro che si occupano di valutazione delle tecnologie sanitarie nelle università, nei sistemi sanitari, nell’Industria e nel volontariato. Nel 1993 viene fondato da tredici membri fondatori l’International Network of Agencies for Health Technology (INAHTA) (20), un network internazionale di organizzazioni di HTA, che coordina le attività e promuove la cooperazione fra le 52 organizzazioni internazionali no-profit appartenenti a 26 Paesi (inclusi Nord e Sud America, Europa, Australia e la Nuova Zelanda) che ne fanno parte (Fig. 5 e 6). Di queste 52 agenzie:
- undici sono nate prima del 1995 le altre trentadue sono nate successivamente - tutte sono organizzazioni no-profit, finanziate esclusivamente (o quasi)
attraverso risorse pubbliche. Solo cinque di queste (IHE, IQWIG, HSAC, ZonMw e CAHTA) sono in parte finanziate da privati, pur rimanendo enti no profit;
- ventiquattro sono espressione delle autorità di governo (organi tecnici) - tutte elaborano valutazioni anche su dispositivi medici
Fig. 5 International Network of Agencies for Health Technology (INAHTA); 52 agenzie internazionali no-profit appartenenti a 26 paesi (www.inahta.org)
Tabella 1 Organizzazioni internazionali di HTA membri di INAHTA (http://www.inahta.org)
1.3
PRINCIPI E MOMENTI DEL PROCESSO
I principi e i metodi dell’Health Technology Assessment sono ormai internazionalmente affermati perché considerati idonei a fornire risposte ai problemi che l’evoluzione tecnologica pone alla gestione dei sistemi sanitari (21,22)
Le attività di HTA dovrebbero essere trasparenti, imparziali e includere tutte le tecnologie sanitarie importanti. Gli scopi della valutazione dovrebbero essere sempre esplicitati e analizzate tutte le evidenze scientifiche disponibili sulla tecnologia in oggetto. Dovrebbe essere condotta un’attenta valutazione dell’efficacia e dei rischi e un’accurata analisi dei costi. Infine, dovrebbe sempre esserci la diffusione dei contenuti informativi del processo di valutazione (Fig. 6).
Secondo la Carta di Trento (11) la valutazione delle tecnologie sanitarie dovrebbe articolarsi secondo sei principi fondamentali, che rispondono alle seguenti domande:
1) Chi valuta? Tutte le parti coinvolte nell’assistenza sanitaria devono essere coinvolte nella valutazione delle tecnologie sanitarie? Le parti coinvolte nell’assistenza sanitaria sono molte e vanno dai professionisti, ai malati e i loro familiari, alle strutture sanitarie fino all’Industria e a molti altri soggetti ancora. La valutazione delle tecnologie sanitarie può diventare quindi anche una occasione di incontro costruttivo e di scambio fra le parti interessate, fra le loro esigenze ed aspettative;
2) Cosa si valuta? Qual è l’oggetto della valutazione? Tutti gli elementi che concorrono all’assistenza sanitaria possono essere sottoposti a valutazione. La definizione di tecnologia sanitaria come abbiamo visto è molto ampia ed è suddivisibile in immateriale e materiale:
- Le tecnologie immateriali, ovvero tutto ciò che non è efficace di per se ma che lo diventa in mano ai professionisti clinici o manager della sanità, quali:
o i modelli organizzativi e assistenziali: ospedale per intensità di cure, assistenza ospedaliera/ domiciliare, day service, day hospital, processi di supporto, ecc,
o i documenti di indirizzo clinico (percorsi assistenziali, linee guida, ecc.),
o i sistemi regolatori (nomenclatori tariffari, accreditamento, ecc.); - le tecnologie materiali comprendono:
o le attrezzature elettromedicali piccole e grandi,
o le strutture edilizie (ospedali, ambulatori, sale operatorie, ecc.)
o le sostanze chimiche (farmaci, vaccini, sistemi diagnostici, ecc.),
o tutti i dispositivi medici e gli impiantabili;
3) Dove avviene il processo di valutazione, a che livello decisionale? La valutazione delle tecnologie sanitarie deve riguardare tutti i livelli gestionali dei sistemi sanitari e delle strutture che ne fanno parte. Le scelte politiche e strategiche che avvengono ai vari livelli decisionali danno origine all’assistenza sanitaria organizzata:
− Macro o primo livello generale che riguarda le scelte legislative e le decisioni di politica sanitaria a livello nazionale e regionale. Sono scelte programmatiche economiche quali:
o l’inclusione dei servizi e delle prestazioni nei LEA,
o i prezzi di rimborso dei farmaci e copertura finanziaria,
o l’imposizione dei ticket sulle visite,
o l’adozione, finanziamento e allocazione sul territorio di nuove tecnologie;
− Meso o livello intermedio che riguarda le decisioni gestionali del management delle singole strutture sanitarie(vertice aziendale), quali:
o l’attivazione/ modificazione/ disattivazione di percorsi assistenziali o modelli organizzativi,
o l’adozione di nuove tecnologie a livello aziendale.
− Micro o livello professionale dove si collocano le decisioni operative prese quotidianamente dai singoli professionisti durante la pratica
assistenziale (decisioni cliniche) con l’ausilio di protocolli di diagnosi e cura;
4) Quando deve essere condotta la valutazione delle tecnologie? L’attività di HTA deve essere continua e l’impatto di una nuova tecnologia non deve essere analizzato solo prima della sua introduzione ma anche per tutto il periodo del suo utilizzo. Gli stadi in cui può essere condotto un processo di valutazione di una tecnologia possono essere diversi a seconda del suo ciclo di vita:
− Futuro, la tecnologia è in fase progettuale o nel primo periodo dello sviluppo, − Stadio sperimentale, prime fasi di test in vitro o in vivo,
− Stadio investigativo, prime sperimentazioni cliniche su esseri umani,
− Stadio stabile, la tecnologia da valutare è già utilizzata nella pratica quotidiana, − Abbandonate: tecnologia obsoleta, inefficace o rischiosa;
5) Perché valutare? La valutazione dell’impatto di una nuova tecnologia è un processo multidimensionale che conduce ad una condivisione delle scelte, integrando le diverse professionalità presenti nelle strutture sanitarie coinvolte nella valutazione (superamento dell’autoreferenzialità);
6) Come valutare? E’ un processo multidisciplinare e tutte le parti interessate devono essere coinvolte nella valutazione.
Fig. 6: Il ruolo della valutazione delle tecnologie in sanità (Fonte: Battista RN e al, 1999)
Un processo di HTA deve passare obbligatoriamente attraverso alcune fasi (Fig. 7) quali (24):
1. Richiesta/identificazione di un bisogno di valutazione,
2. Priority Setting (Prioritarizzazione), pianificazione delle priorità delle diverse tecnologie in studio. “È la scelta esplicita delle priorità per evitare le diseguaglianze nell’accesso, erogazione dei servizi e l’esclusione” “chi ottiene cosa a fronte di quale spesa” (23)
3. Identificazione della commissione del report (gruppo che procederà alla valutazione);
4. Conduzione dell’ assessment o fase della valutazione vera e propria:
- Definizione del problema (policy question): è necessario specificare chiaramente la domanda a cui si vuole dare una risposta,
- Elaborazione del protocollo/linee guida di HTA,
- Raccolta delle informazioni tecnico scientifiche sisponibili sulla tecnologia,
- Valutazione degli elementi della valutazione. Definizione della domanda di ricerca e raccolta delle evidenze, fase multidisciplinare e multidimensionale. Si valutano (4):
o proprietà tecniche
o sicurezza della tecnologia sanitaria oggetto di valutazione,
o efficacia teorica (efficacy) e reale (effectivess). Per efficacia in sanità si intende la capacità di un intervento di ottenere un effetto (outcame). L’efficacy rappresenta i risultati ottenuti in condizioni ideali, quelli ottenuti in condizioni reali rappresentati invece dall’effectivess,
o aspetti sociali, psicologici, etici, legali. Etica, equità di accesso, consenso informato sono alcuni dei tantissimi aspetti da considerare nella valutazione di una nuova tecnologia sanitaria,
o aspetti organizzativi perché bisogna considerare l’organizzazione dell’offerta (regime di erogazione, professioni coinvolte, ecc), l’ottimizzazione dei percorsi e l sostenibilità economico finanziaria del sistema (corretto equilibrio fra risorse economiche limitate ed innovazione tecnologica),
o aspetti economici. Valutazioni di costo-utilità o di costo-efficacia e analisi di budget impact (stima dei costi che l’organizzazione dovrà sostenere a seguito dell’introduzione di una nuova tecnologia) sono sempre più utilizzate in sanità,
- Elaborazione di una prima bozza di report di HTA (draft report) e condivisione e discussione dei risultati con gli stakeholder,
- Revisione esterne del report, - Pubblicazione del report definitivo;
5. Disseminazione ed implementazione dei risultati, che devono essere diffusi affinché possano entrare nel processo decisionale del management (policy maker). Gli strumenti della diffusione dei risultati possono essere:
- report di HTA,
- pubblicazioni scientifiche,
- conferenze nazionali ed internazionali, - siti web che riguardano l’HTA,
- media;
6. Utilizzo dei report di HTA da parte dei decisori
7. Valutazione e feedback. Valutazione dell’impatto dovuto all’introduzione della nuova tecnologia ed eventuale aggiornamento. L’HTA è una attività flessibile che deve accompagnare la nuova tecnologia dall’introduzione fino all’obsolescenza.
1.4 GLI ELEMENTI DELLA VALUTAZIONE
L’introduzione delle tecnologie sanitarie nella pratica clinica deve essere condotta con appropriatezza e razionalizzando l’allocazione delle risorse, quindi l’utilizzo di tecniche di valutazione a sostegno delle decisioni diventa fondamentale.
Possiamo avere:
- Tecniche di valutazione economiche, che confrontano programmi alternativi per stabilire quale dei due sia il più vantaggioso in termini di costi e benefici;
- Tecniche di valutazione estese. Sono quelle utilizzate in un processo di HTA perché toccano molti aspetti della tecnologia e non solo quello economico. Fondamentali per la produzione della reportistica (o mini-HTA) e sono:
o proprietà tecniche, che devono essere descritte e valutate (caratteristiche, meccanismo d’azione, evidenze scientifiche, innovatività, ecc.);
o sicurezza clinica. Accurata analisi delle evidenze scientifiche disponibili sulla tecnologia;
o efficacia, ovvero il beneficio che si ottiene in termini di salute sia utilizzando una tecnologia in relazione a un preciso problema in “condizioni ideali” (efficacia clinica teorica o efficacy) sia in condizioni generali di routine (efficacia clinica pratica o effectiveness) (20),
• Efficacy: “the benefit of using a technology for a particular problem under ideal conditions, for example, in a laboratory setting, within the protocol of a carefully managed randomized controlled trial, or at “center of excellence””,
• Effectiveness: “the benefit (e.g. to health outcomes) of using a technology for a particular problem under general or routine conditions, for example, by a physician in a community hospital or by a patient at home” (cfr. INAHTA. Health Technology Assessment...).
o impatto economico, che ricopre un ruolo molto importante. La valutazione economica diventa un mezzo fondamentale per una corretta
allocazione delle risorse economiche. Possono essere adoperate diverse tecniche di valutazione (25, 26, 27):
• analisi dei costi (AC), “stima i costi complessivi della collettività per una certa patologia e rappresenta un’analisi economica parziale di tipo prevalentemente informativo,
• analisi di minimizzazione dei costi (ACM). È l’approccio più semplice, ma più limitato e viene spesso impiegata quando si valuta l’opportunità di introdurre una nuova tecnologia in sostituzione di una precedente e, studiati i risultati clinici delle tecnologie alternative, si arriva ad affermare che esse possono essere considerate equivalenti negli aspetti rilevanti (stessi effetti o effetti confrontabili). La valutazione si concentra allora sui costi e la scelta migliore è quella che consente di ottenere l’effetto al costo minore.
• analisi costo-efficacia (ACE). È necessario identificare la misura ed il valore sia dei costi che degli outcome delle tecnologie sanitarie a confronto (7). È una tecnica utile per confrontare alternative che producono risultati clinici simili, ma raggiunti con diverso successo. I costi sono quantificati in termini monetari, mentre i risultati attesi o effetti clinici sono espressi in termini fisici (anni di vita guadagnati, numero di casi diagnosticati, successi della terapia, giorni di malattia evitati, ecc.).
• analisi costo-utilità (ACU). La misura dell’outcome è corretta mediante un fattore di qualità della vita e l’indicatore più utilizzato in questo caso è il QALY (Quality Adjusted Life Year, anni di vita ponderati secondo la loro qualità). L’utilità non però va intesa tanto come sinonimo di qualità della vita, quanto di desiderabilità, soggettivamente manifestata, di un certo stato di salute in quanto dotato di un determinato livello di qualità di vita (7). Il valore degli effetti dei programmi è ponderato non in termini monetari, bensì come utilità, solitamente attraverso
“punteggi”, che esprimono le preferenze individuali o collettive per diversi stati di salute, o tramite “pesature” matematiche che riflettono il livello di utilità. Diversi stati di salute possono essere confrontati con un unico sistema di misura: ciò consentirebbe di calcolare, ad esempio, gli anni di vita guadagnati non solo in termini quantitativi (ACE) ma anche qualitativi. Nel calcolo del QALY è necessario i servizi sanitari e le tecnologie possono influenzare la vita attesa (mortalità) sia la qualità di vita negli anni (morbilità).
• analisi costo-benefici (ACB). Valuta i risultati clinici del programma o di una tecnologia in termini monetari e quindi le alternative in esame possono anche essere non omogenee. La scelta cade sull’intervento che risulta migliore dal confronto fra risorse impiegate e risultati ottenuti. Rappresenta la forma più generale e completa di valutazione economica perché, indipendentemente dalla patologia, permette di confrontare qualsiasi programma sanitario. La critica più frequente riguarda l’opportunità e la possibilità di attribuire un valore monetario alla vita umana”.
Una valutazione economica dovrebbe sempre affiancarsi ad un’analisi di budget impact, che stima i costi che l’organizzazione sanitaria dovrà sostenere con l’introduzione di una nuova tecnologia.
o aspetti organizzativi. L’introduzione di tecnologia produce sempre degli effetti sull’organizzazione sanitaria che possono essere diretti o indiretti, a breve o a lungo termine oppure è l’organizzazione che deve attuare dei cambiamenti al suo interno affinché la tecnologica sia adoperata,
o implicazioni etiche, legali e sociali che l’uso delle tecnologie sanitarie comporta.
1.5 HOSPITAL- BASED HTA
L’HTA nasce come attività centralizzata a supporto delle decisioni politiche e gestionali nazionali. Negli ultimi anni, a causa dei mutamenti avvenuti in molti sistemi sanitari a livello internazionale e nazionale, l’attività di HTA è andata decentralizzandosi (Tabella 1) e sono aumentate le realtà di HTA localizzate a livello di singole Aziende sanitarie definite Hospital Based HTA o HB-HTA) (Fig 8).
Tabella 2 Le esperienze negli ospedali (Fonte: Favaretti C, Guarrera GM)
Fig. 8 Hospital Based HTA worldwide: the results of an international survey Interest Sub-Group Hospital Based HTA Montreal, July 9, 2008 (Fonte: Cicchetti C, Marchetti M e al. 2008)
In Italia l’introduzione del processo di aziendalizzazione (D.lgs n.502/1992 e D.lgs 229/1999) ha aumentato la pressione economica e sociale sulle Aziende sanitarie che, insieme alla necessità di aumentare l’efficacia e l’efficienza “microeconomica”(28), ha contribuito a far emergere l’esigenza di attività di valutazione delle tecnologie sanitarie localizzate a livello aziendale o HB-HTA (Fig. 9).
Fig.9 L’HTA a livello aziendale (Hospital Based HTA), Fonte: Marchetti,Catananti, Cicchetti, 2005
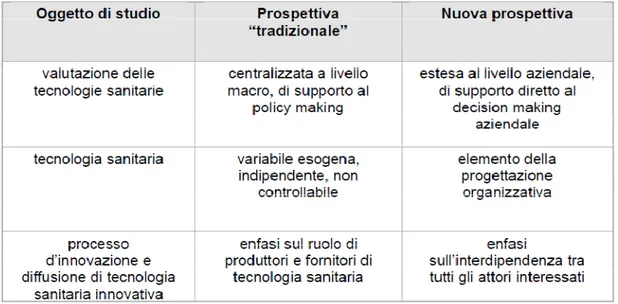
Il processo di HTA a livello aziendale è diverso dal tradizionale approccio di valutazione delle tecnologie sanitarie svolto a livello centrale e cambia anche il destinatario della valutazione che non è più il policy maker nazionale o regionale ma il Vertice Aziendale, che deve decidere sulla base a obiettivi economico-finanziari di breve e medio periodo, a obiettivi di efficacia ed efficienza organizzativa e alla soddisfazione di utenti e dipendenti.
Secondo A. Cicchetti (29) “anche in relazione alla complessità organizzativa dell’azienda a cui si fa riferimento è possibile immaginare un modello organizzativo meno strutturato più agile, oppure un modello più articolato e completo. Nel primo caso, adatto forse per le strutture di minore dimensione o con complessità clinica e dotazione tecnologica di medio livello, potrebbe essere indicato avere un ruolo di
coordinamento delle attività di programmazione e gestione corrente affidato a un dirigente. Le attività di valutazione potrebbero in questo caso essere affidate a gruppi di valutazione da costituire sulla base delle esigenze con assegnazione di incarichi a personale strutturato o attraverso consulenze esterne affidate a specialisti su specifici progetti. La seconda opzione, adatta in contesti di massima complessità (ad esempio le grandi AO, AOU o gli IRCCS), potrebbe prevedere una struttura stabile dotata di personale amministrativo e tecnico dipendente con tutte le competenze integrate nella struttura organizzativa. Indipendentemente dal livello di formalizzazione e complessità organizzativa della struttura, la capacità di realizzare attività di Health Technology Assessment comunque dovrebbe fondarsi sui seguenti elementi:
- la presenza di una specifica responsabilità organizzativa a livello aziendale per l’attività di HTA;
- l’identificazione di un chiaro modello di organizzazione caratterizzato dal requisito dell’essenzialità e non ridondante, teso a mobilitare e coordinare il lavoro di tutte quelle competenze già presenti in azienda e che sono chiamate a partecipare per realizzare la valutazione multidimensionale necessaria nell’ambito delle tecnologie sanitarie (multidisciplinarietà);
- la presenza di competenze professionali idonee nelle diverse discipline riferite alle dimensioni delle valutazione di HTA;
- l’esplicitazione di meccanismi operativi e procedure formalizzate per definire le priorità delle valutazioni e le modalità di realizzazione delle stesse;
- l’orientamento alla produzione di specifici output (raccomandazioni, report e altro) capaci di supportare le decisioni di manager e clinici.
L’approccio operativo dovrebbe a ogni modo caratterizzarsi:
- per l’adozione di una concezione ampia di tecnologia comprendendo quindi, nell’ambito delle valutazioni, i farmaci, i devices, le apparecchiature elettromedicali, procedure e i modelli di organizzazione;
- per l’adozione dei principi, dei metodi e degli strumenti dell’HTA così come condivisi a livello internazionale (ad esempio, in ambito INAHTA o EUNetHTA) e in Italia sintetizzati nella Carta di Trento per la Valutazione delle Tecnologie Sanitarie;
- per l’adozione di un approccio “partecipato” in grado di incorporare nelle valutazioni la prospettiva e i valori portati dai diversi stakeholders (pazienti, clinici,
manager, terzo pagante, industria) e radicato su valori etici condivisi… l’attività di HTA aziendale deve integrare e non sostituire un modello generale e sistemico capace di favorire la divisione del lavoro nella produzione di informazioni utilizzabili in tutte le Regioni e adattabili ai diversi contesti di riferimento”.
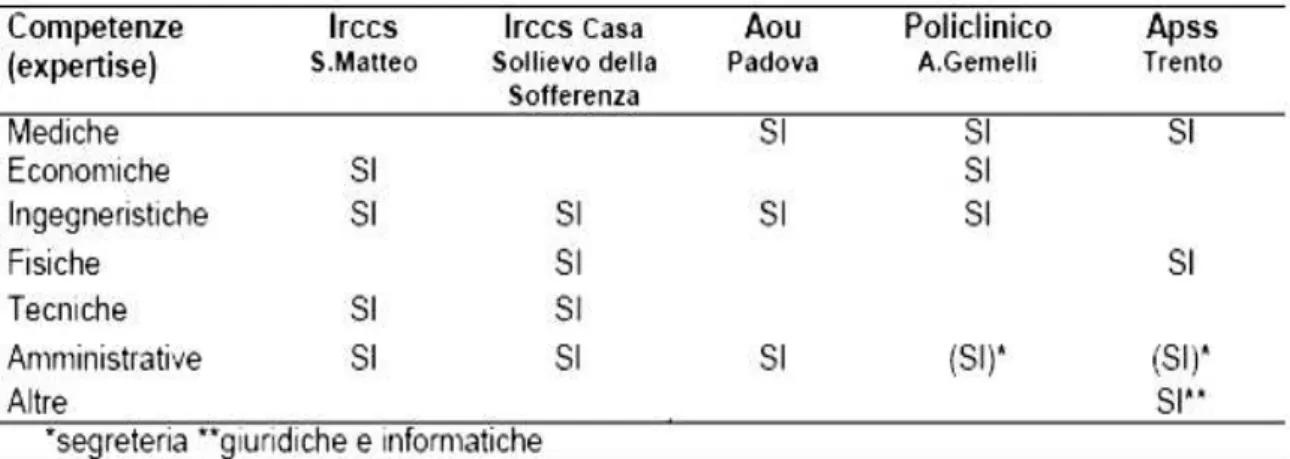
In Italia non esiste ancora un’importante attività di HTA a livello centrale ma sono molto attive e in progressivo aumento le realtà di HB-HTA. Alcune esperienze aziendali hanno prodotto le Unità di Valutazione delle Tecnologie (UVT), strutture organizzative con competenze multidisciplinari (ingegneristiche, economiche, mediche, ecc.) dedicate alla gestione della tecnologia sanitaria. Le UVT svolgono attività di formazione, elaborano report e mini- HTA, linee guida interne, ecc. Le principali esperienze italiane di HB-HTA sono localizzate in realtà ad elevata complessità organizzativa, come le Aziende Ospedaliere, gli IRCCS, le Aziende Ospedaliero- Universitarie e le grandi Aziende Sanitarie, che si sono dotate di unità organizzative dedicate stabilmente alla valutazione delle tecnologie sanitarie e con competenze multidisciplinari (Tabella 3) prevalentemente interne, quali:
- Policlinico Universitario “A. Gemelli” di Roma (1625 posti letto); - Azienda Ospedaliera Universitaria di Padova (2000 posti letto);
- Azienda Provinciale per i Servizi Sanitari di Trento (attraverso 7 ospedali e altre strutture convenzionate gestisce un bacino di utenza di 490.000 persone); - IRCCS Policlinico S. Matteo di Pavia (1350 posti letto);
- IRCCS “Casa Sollievo della Sofferenza” di S. Giovanni rotondo, Foggia (1081 posti letto ordinari e 33 posti letto di Day Hospital e Day Surgery).
Un’analisi cross (7, 28) delle cinque realtà elencate ha permesso di rilevare similitudini, differenze e criticità sulle scelte organizzative per quanto riguarda strumenti e meccanismi operativi adottati; responsabilità, obiettivi, competenze (il ruolo) dell’unità organizzativa di valutazione (UVT) e la sua collocazione formale all’interno della struttura aziendale. In tutte le realtà analizzate l’UVT riporta direttamente (indirettamente solo nella APSS di Trento) alla Direzione Sanitaria (preminenza clinica sulla tecnica nell’attività di valutazione delle tecnologie) e tutte le UVT sono collocate in Staff alla Direzione aziendale. Inoltre, i meccanismi operativi sono scarsamente formalizzati, con procedure poco sviluppate e, di conseguenza, è molto difficile il corretto monitoraggio delle performance della tecnologia sanitaria introdotta per tutto il suo ciclo di vita. Il ruolo delle UVT cambia a seconda di chi coordina le attività di valutazione; un medico in tre casi su cinque, con un orientamento prevalentemente sanitario della UVT e un ingegnere biomedico negli altri due casi (IRCCS), con orientamento in prevalenza tecnico-ingegneristico. Infine il sistema di reporting appare in alcune delle realtà descritte poco strutturato e standardizzato mentre dovrebbe essere la base dell’HB-HTA garantendo il coordinamento fra le professionalità e le Unità Operative coinvolte nelle attività di valutazione delle tecnologie e supportare il Vertice Aziendale nelle decisioni.
Nelle realtà analizzate ma anche in tutte le realtà aziendali che hanno attivato funzioni di HTA vengono sempre rispettate quattro macrofasi principali nel processo valutativo (Fig. 10) e sono (7):
-raccolta dei bisogni e definizione della proposta di valutazione. Inizia con un “evento” che può portare a una proposta valutativa. Necessita di alcune regole fondamentali:
o definire chi può inviare la richiesta di proposta di valutazione di una tecnologia (precisare ruoli e responsabilità),
o chi deve decidere se dare o meno seguito alla richiesta,
o definizione delle proposte.
Questa fase è particolarmente critica e può dar luogo a una fase potenzialmente costosa (technology assessment). In questa fase bisogna porre uparticolare
attenzione nel:
o disegnare la scheda di pre-assessment (breve checklist o questionario che dovrà essere compilato dal richiedente) definendone struttura e
contenuti così da formalizzare e standardizzare il processo di raccolta delle richieste. Questa scheda rappresenta un primo filtro per le successive attività di valutazione (fase di istruttoria) e se su supporto elettronico potrebbe consentire la riduzione dei tempi della richieste e migliorare la “tracciabilità” delle stesse. La scheda deve contenere almeno queste aree:
• Tecnologia: area di applicazione e principali caratteristiche tecniche/procedurali, grado d’innovatività, layout e collocazione fisica prevista per le apparecchiature;
• appropriatezza/efficacia: esistenza di evidenze scientifiche di supporto secondo l’EBM , impatto previsto sui pazienti;
• Impatti organizzativi previsti/ipotizzati: risorse umane coinvolte, impatti previsti sulla struttura organizzativa esistente ecc.;
• Impatto economico/finanziario: costo ipotizzato/stimato, Bacino di utenti attuale e potenziale
o rispettare gli obiettivi aziendali (coerenza);
o coinvolgere i clinici dall’inizio
- istruttoria (technology assessment in senso stretto), produzione della reportistica (report di HTA o mini HTA) e decisione del vertice aziendale se adottare o meno la tecnologia valutata;
- selezione delle modalità di adozione e/o acquisizione, carattere di esclusività o meno della tecnologia, procedure di gara, tipologia di acquisizione (service, noleggio, acquisto) e di negoziazioni con i fornitori;
- selezione delle modalità di acquisizione delle tecnologie sanitarie per garantire qualità e sicurezza delle prestazioni;
- la gestione delle tecnologie sanitarie, al fine di mantenere e sviluppare la tecnologia, diminuire i rischi e garantire sicurezza e qualità e il monitoraggio delle prestazioni delle tecnologie introdotte, e in particolare degli indicatori e dei parametri (key performance indicator, KPI) definiti nel corso della macrofase istruttoria.
Fig.10 Prospettiva di processo e interdipendenze nell’HB-HTA (Fonte Francesconi, 2007)
Il processo valutativo nella realtà si svolge con delle sovrapposizioni (loop) decisionale che possono portare a ripercorrere alcune fasi del processo. L’azione che deve svolgere primariamente l’UVT aziendale è di coordinamento e di integrazione interfunzionale e di definizione delle linee guida interne necessarie per orientare il processo di valutazione (raccolta delle evidenze scientifiche, sostenibilità economica finanziaria, aspetti etici, legali, ecc.).
Nell’organizzare un’attività di valutazione delle tecnologie sanitarie aziendale non esiste un percorso che sia migliore di altri (“one best way”) ma sarà l’Azienda a disegnare sul proprio modello organizzativo una realtà di HTA o UVT, in anche in considerazione dei seguenti fattori:
- risorse investite (umane, finanziarie, tecnologiche, ecc.);
- competenze presenti o multiprofessionalità (mediche, ingegneristiche, economiche, ecc.);
- obiettivi che si vogliono perseguire.
Tuttavia, è sempre consigliabile sempre rispettare alcuni requisiti minimi di carattere organizzativo, professionale e metodologico identificati nel 2006 dal NI-HTA (Fig. 11):
- Responsabilità organizzativa e competenze, con funzione di HTA in Staff alla
Direzione svolta con competenze idonee;
- Formalizzazione e standardizzazione di procedure condivise per la
- Pianificazione, con stesura del Piano pluriennale degli investimenti,
- Sistema informativo, con produzione e diffusione di un report o Mini-HTA database con le evidenze scientifiche e tecnologiche.
Fig.11 Requisiti minimi per la strutturazione di una funzione aziendale di HTA in senso stretto (UVT); (Fonte: NI-HTA (2006) e A. Francesconi, 2007)
CAPITOLO 2
DIFFUSIONE E SVILUPPO DELL’HTA IN EUROPA:
L’ESPERIENZA DI SEI PAESI EUROPEI
La raccomandazione dell’Organizzazione Mondiale della Salute (OMS), all’interno del programma Health for Hall (30), di individuare un mezzo formale per la valutazione sistematica delle tecnologie sanitarie ha contribuito all’introduzione e allo sviluppo dell’HTA in Europa. E che ha coinciso con una “maggiore enfasi posta sulle politiche e le pratiche di misurazione, di responsabilità, del value for money, basate sulle evidenze … l’aumento del bisogno deriva dai progressi compiuti nel campo della ricerca medica e dell’ Information Technology, dalla decentralizzazione del processo decisionale” (31). In Europa, negli anni ’80 e ‘90 nascono molte organizzazioni (Agenzie e Istituti) di HTA, per lo più finanziate con risorse pubbliche e rappresentanti le Autorità di Governo (Tabella 4).
Nel 2004 l’Unione Europea ha inserito formalmente l’HTA tra le sue priorità politiche, ma aveva già contribuito alla sua diffusione promuovendo negli anni numerosi progetti sulla valutazione delle tecnologie sanitarie:
- EUR-ASSESS: dal 1994 al 1997, con produzione di report pubblicati sull’International Journal of HTA (1997);
- HTA Europe: dal 1998 al 2000, con produzione di documenti sui sistemi sanitari e sulle attività di HTA in Europa, poi pubblicati sull’International Journal of HTA (2000);
- European Collaboration for Health Technology Assessment (ECHTA)/The European Collaboration for Health Interventions (ECAHI): dal 2000 al 2002.
Sempre nel 2004 il Consiglio dei Ministri della Salute e la Commissione Europea co-finanziano e promuovono la creazione del Progetto European Network for Health Technology Assessment (EUnetHTA), un network europeo di Agenzie di HTA al quale tra il 2006 e il 2008 aderiscono circa 60 organizzazioni di HTA. Il Progetto, durato dal 1 gennaio 2006 al 31 dicembre 2008, voleva collegare in un network europeo permanente di HTA tutte le agenzie pubbliche, i Ministeri della Salute e gli Istituti di ricerca
coinvolti in attività di valutazione delle tecnologie sanitarie per favorire lo scambio di informazioni la diffusione delle attività di HTA negli Stati membri.
Le attività del Progetto EUnetHTA si sono articolate in otto gruppi di lavoro o Work Packages (WPs) interconnessi e centrati su una tematica del processo di HTA e coordinati ognuno da una organizzazione di HTA o Lead Partners (LPs) (32, 33):
− Work Packages 1: coordinamento generale; − Work Packages 2: comunicazione nell’HTA; − Work Packages 3: valutazione;
− Work Packages 4 o Common Core Model: analisi ed identificazione della parte più importante ed esportabile delle informazioni contenute in un documento;
− Work Packages 5: elaborare strumenti funzionali necessari per adattare i documenti di HTA esistent e il common core dei report di HTA ai vari contesti;
− Work Packages 6: traduzione nelle politiche sanitarie dei documenti di HTA; − Work Packages 7: monitoraggio delle tecnologie nuove/emergenti (Horizon
Scanning);
− Work Packages 8: creazione di sistemi di tutoraggio e supporto negli Stati Membri senza attività di HTA istituzionalizzata.
Terminato il Progetto EUnetHTA la Commissione europea ha finanziato il Progetto EUnetHTA Joint Action on HTA (2010-2012), le cui attività sono iniziate nel 2010, con i seguenti obiettivi:
- ridurre le duplicazioni inutili delle attività di HTA;
- massimizzare l’utilizzo delle poche risorse per le attività di HTA;
- sviluppare e promuovere le buone pratiche nei metodi e nel processo dell’HTA; - condividere tutto quello che si può condividere;
- facilitare l’adattamento ai vari contesti locali delle informazioni di HTA.
Nel giugno del 2008 durante la European Ministerial Conference on Health System dell’ OMS i Ministri della Salute di 53 Paesi hanno adottato la Carta di Tallin: Health
System for Health and Wealth (34) che definisce l’HTA uno strumento fondamentale per il governo delle risorse dei sistemi sanitari: “Fostering health policy and systems research and making ethical and effective use of innovations in medical technology and pharmaceuticals are relevant for all countries; health technology assessment should be used to support more informed decisionmaking”.
Modello del Paese
Caratteristiche Paesi/Regioni
Integrato Sono presenti una o più agenzie che operano
nell’ambito di un unico progetto nazionale di valutazione integrato nel processo decisionale
Regno Unito,
Francia, Germania, Svezia, Danimarca
Quasi integrato Presenza di una o più agenzie che
producono evidenze scientifiche a supporto delle decisioni ma senza una esplicita integrazione tra valutazione e processo decisionale
Norvegia, Olanda, Belgio, Finlandia (Australia)
Federale Presenza di diverse agenzie che operano con
valenza nazionale o regionale/provinciale
Spagna, (Canada)
Rete Presenza di agenzie a diversi livelli del
sistema sanitario (nazionale, regionale, ecc) in una logica di cooperazione
Danimarca (Canada-Quebec)
Tabella 4 Modelli organizzativi delle attività di HTA a livello europeo. (Fonte: Cicchetti A, Ruggeri M.)
Nel 1999 viene creata la rete EuroScan (35), un network internazionale di organizzazioni di HTA con sede presso l’Università di Birmingham, che si occupa essenzialmente di Horizon Scanning (HS), ovvero delle tecnologie nuove e/o emergenti. Il network EuroScan permette la condivisione delle informazioni sulle nuove/ emergenti tecnologie (farmaci, dispositivi medici, procedure e processi), la valutazione di alcune di queste e l’analisi del loro impatto nei diversi Paesi. Attualmente nove Paesi europei e quattro extraeuropei fanno parte di EuroScan (Fig. 12). I criteri di selezione sono molto rigidi e le organizzazioni che vogliono entrare a far parte della rete devono essere no profit e non avere rapporti diretto con l’Industria e/o i Centri di Ricerca e di Sviluppo.
Fig.12 La rete EuroScan (Fonte: Euroscan www.euroscan.bham.ac.uk.technology.htm)
Le agenzie di HTA dei Sistemi Sanitari europei si differenziano per: - livello operativo (setting) al quale agiscono e che può essere:
o nazionale,
o regionale,
o aziendale;
- fonti di finanziamento, che sono:
o pubbliche,
o semi pubbliche,
o mai completamente private; - tipologia e ampiezza delle valutazioni:
o ampia attività di HTA. Possono essere valutate tutte o quasi le tecnologie sanitarie,
o attività focalizzata di HTA. L’attività di valutazione si rivolge solo a specifiche tipologie di tecnologie sanitarie,
o HTA e qualità
o Ecc.
- Le relazioni con i decision maker; - Le funzioni istituzionali. Paesi coinvolti: Danimarca Inghilterra e Galles Finlandia Francia Olanda Norvegia Spagna Svezia Svizzera Australia Canada Israele Nuova Zelanda
2.1 SVEZIA
Il sistema sanitario svedese è simile a quello italiano, finanziato prevalentemente attraverso la fiscalità generale e decentrato a livello di diciotto contee e due regioni. Nei primi anni ’70 il Ministero della Salute, attraverso Consiglio Nazionale per la Salute e il Benessere, invitava importanti medici svedesi ad effettuare delle valutazioni cliniche su alcune tecnologie sanitarie. Nel 1987, con la creazione del Comitato nazionale svedese per la valutazione delle scelte tecnologiche (SBU, Stätens Beredning för medicinsk Utvärdering) (36), nasce la prima agenzia governativa europea di HTA che nel 1992 diventerà agenzia governativa indipendente. La direzione della SBU è affidata ad un Consiglio di rappresentanti delle maggiori organizzazioni del Sistema Sanitario Svedese, mentre le attività di ricerca sono condotte da un apposito Comitato scientifico composto da più di 300 esperti (collocati su tutto il territorio nazionale). Il Consiglio decide quali siano le priorità di intervento nella valutazione delle tecnologie sanitari, dopo aver consultato il Comitato scientifico.
La SBU si occupa soprattutto di (37, 38):
− promuovere l’assessment delle tecnologie sanitarie e la valutazione di tutte le implicazioni correlate al loro utilizzo (cliniche, economiche, sociali, etiche, ecc) per un corretto utilizzo delle risorse sanitarie;
− monitorare le attività di HTA nazionali ed internazionali; − diffondere i dati (raccolti e prodotti):
o con la produzione di report da diffondere ampiamente a tutti i soggetti interessati, inclusi i cittadini e la stampa;
o organizzando incontri e convegni per gli operatori del settore (attività di formazione). Dal ‘96 è attivo il“Programma Ambassador” che prevede che alcuni “ambasciatori” (soprattutto medici) attraverso incontri e seminari presentino e discutano i risultati degli studi condotti con i colleghi.
Alcuni dei progetti di lavoro portati avanti negli ultimi anni dalla SBU: - Obesità
- Trattamento degli stati di ansia - Terapia dell’asma
- Trattamento dei problemi legati al consumo di alcool e droghe - Relazione medico-paziente
Nonostante il sistema svedese sia caratterizzato da un forte decentramento l’attività di valutazione delle tecnologie sanitarie rimane un’attività centralizzata (SBU). Anche se la normativa svedese prevede la creazione di Unità Organizzative di HTA decentrate (livello ospedaliero, HB-HTA) non prevede che le contee abbiano proprie organizzazioni di HTA.
2.2 DANIMARCA
La Danimarca si dota di un programma strategico nazionale per l’HTA nel ’96 e nel 1997 istituisce il Danish Institute for Health Technology Assessment (DIHTA) (37, 38, 39). Il DIHTA è finanziato dal Ministero della Salute e ha tra i suoi scopi la promozione dell’HTA, facendo anche formazione e svolgendo attività di valutazione delle tecnologie in collaborazione con le Autorità Sanitarie Locali. Nel 2001 dalla fusione del DIHTA con il soggetto valutatore delle prestazioni sanitarie ospedaliere, il Danish Hospital Evaluation Centre (DHEC), nasce il Danish Centre for Evaluation and Health Technology Assessment (DACEHTA) che svolge una duplice funzione di valutatore:
- delle tecnologie sanitarie, nuove e consolidate,
- delle prestazioni sanitarie offerte.
L’Istituto Danese per la Ricerca nei Servizi Sanitari (DSI- Institut for Sundhedsvæsen) (40) è un’organizzazione indipendente fondata nel 1975, che svolge attività di HTA e che ha contribuito allo sviluppo del Sistema Sanitario Danese e prima della costituzione del DIHTA/DACEHTA era il solo punto di riferimento per l’HTA nel Paese. Oggi il DSI conduce attività di ricerca in vari ambiti e ha una funzione di supporto per il DACEHTA e per le autorità regionali, gli Ospedali, ecc.
Il modello di report di HTA danese poggia su alcuni importanti criteri, che devono essere sempre contenuti in qualsiasi report di valutazione delle tecnologie sanitarie (report o mini HTA):
- la tecnologia sanitaria. Deve essere condotta un’attenta analisi della tecnologia da valutare per definire destinazione, area di applicazione e valutare se esistono alternative valide già disponibili;
- i pazienti. Si considerano tutti gli aspetti legati all’uso della tecnologia in studio e che coinvolgono il paziente; si identificano il target di riferimento, le conseguenze derivanti dall’uso della tecnologia, ecc;
- la valutazione economica. Vengono esaminate le conseguenze economiche derivanti dall’introduzione della tecnologia in esame;
- l’Organizzazione. Si valuta come l’introduzione di una tecnologia possa modificare l’organizzazione della struttura in cui viene introdotta.
2.3 REGNO UNITO
Il National Health Service (NHS) (12) è il primo sistema sanitario di tipo universalistico nato in Europa ed composto da tre “sotto-sistemi”, che sono:
- Inghilterra e Galles, - Scozia
- Irlanda del Nord.
In Inghilterra e Galles le attività di HTA iniziano negli anni ’90 ma si consolidano nel ‘99 con la creazione del National Institute for health and Clinical Excellence (NICE) (41), una tra le più importanti organizzazioni di HTA europee (37, 38). Il programma nazionale di HTA ha come obiettivi la produzione e la disseminazione dei risultati, la valutazione e l’utilizzo delle tecnologie sanitarie ed è finanziato dal Programma di Ricerca e Sviluppo del NHS. L’HTA viene definito dal NHS “un modo per dare risposta a domande su come funziona una tecnologia, per chi, a quali costi e comparata a quali alternative” (42). Il programma di HTA è coordinato dal National Coordinating Centre for HTA (NCCHTA), istituito presso il Wessex Institute for Health Research and Development dell’Università di Southampton, che agisce sinergicamente con il NICE, e che ha tra le sue attività principali:
- la realizzazione di linee guida;
- la valutazione delle tecnologie sanitarie nuove e consolidate, nella loro accezione più ampia: farmaci, dispositivi medici, test diagnostici, procedure cliniche, interventi di salute pubblica, ecc. L’approvazione del NICE non è comunque vincolante per l'immissione sul mercato di nuove tecnologie da parte delle imprese.
Il lavoro del NICE si svolge per lo più attraverso una rete virtuale di esperti appartenenti al mondo sanitario, universitario e all’ Industria. Le tecnologie sanitarie da sottoporre ad analisi vengono decise annualmente dal Dipartimento di Sanità inglese (Department of Health, DH) e dall’Assemblea Nazionale del Galles (National Assembly for Wales, WA) e sottoposte al NICE che si interfaccia con il Programma di HTA e con i gruppi di lavoro che devono elaborare report di HTA e linee guida sulla tecnologia che saranno sottoposte al NHS. Il NICE nella preparazione delle valutazioni considera tutti gli aspetti delle tecnologie analizzate, sia in termini di efficacia clinica che di costo-efficacia, per riuscire a stimare il potenziale risparmio e/o guadagno del NHS a seguito dall’adozione di una determinata tecnologia.
Il sistema di valutazione inglese delle tecnologie sanitarie è caratterizzato da una forte integrazione tra i processi e da un’alta proceduralizzazione del processo decisionale, che garantisce trasparenza ma rallenta molto i tempi decisionali.
Gli utilizzatori ( Aziende Sanitarie), le Società Scientifiche, L’Industria (“sponsoring compagnie”) e le associazioni di pazienti sono sempre invitate a presentare dati ed informazioni utili per integrare i report di HTA (è molto attivo il coinvolgimento degli stakeholder).
Il NICE assicura assoluta indipendenza dalle attività delle organizzazioni coinvolte, trasparenza in tutte le fasi del processo valutativo e produce in seguito all’attività di valutazione delle raccomandazioni (appraisal) a carattere informativo. Le appaisal non hanno carattere vincolante, tranne che per le Aziende Sanitarie pubbliche che sono obbligate a dotarsi in breve tempo (entro tre mesi) delle tecnologie “raccomandate” e a trovare i fondi per la loro copertura finanziaria.
In Scozia troviamo lo Scottish Medicines Consortium (SCM), un sistema strutturato di HTA fondato nel 2001. SCM è una associazione di quattordici Comitati Sanitari scozzesi che ha il compito di produrre raccomandazioni su:
- nuovi farmaci, nuove indicazioni terapeutiche,nuove formulazioni per il NHS e le Commissioni Terapeutiche Scozzesi;
- dispositivi medici che rilasciano farmaco (solo con registrazione EMEA).
Non si occupa di dispositivi medici, vaccini, farmaci generici e senza obbligo di ricetta, derivati del plasma, dispositivi diagnostici.
Alcuni dei criteri valutativi dello utilizzati dal SCM:
- studi di efficacia e sicurezza rispetto alle alternative terapeutiche principali, - analisi costo efficacia: la ditta farmaceutica deve presentare un’analisi
economica sul farmaco, eccettuati ovviamente quei farmaci con efficacia sovrapponibile ai prodotti di riferimento e costo inferiore o simile;
- budget impact, con orizzonte temporale a 5 anni; - costi comparativi con i farmaci alternativi; - giudizio sulla rimborsabilità.
2.4 FRANCIA
Nonostante che il Sistema Sanitario francese si fondi sul modello delle assicurazioni sociali, il Ministero della Salute ha un ruolo molto forte nella gestione e nel controllo della spesa sanitaria, regolamentando il prezzo dei farmaci e delle tecnologie e stipulando gli accordi tra i sindacati dei vari professionisti e le assicurazioni sociali (37, 38).
Nel 1989 viene istituita un’agenzia nazionale per la promozione della valutazione delle tecnologie mediche e nasce l’ANDEM, un’associazione indipendente con il compito di svolgere attività di valutazione delle tecnologie sanitarie o HTA (tranne i farmaci. L’ANDEM aveva vari scopi, quali:
- promozione delle attività di HTA;
- creazione di un archivio con tutte documenti nazionali e internazionali;
- diffusione dei risultati e delle evidenze scientifiche in merito a sicurezza, efficacia, costo-utilità, ecc. delle tecnologie;
- produzione e pubblicazione di report.
Con la riforma del Sistema Sanitario francese del 1996 l’Agence Nationale d’Accréditation et d’Évaluation en Santé (ANAES) prende il posto dell’ANDEM, occupandosi di tutte le attività principali del Servizio Sanitario (dall’accreditamento delle strutture sanitarie fino alle attività di HTA e alla pianificazione degli investimenti nelle tecnologie sanitarie). Successivamente l’ANAES è stata chiusa e tutte le sue attività sono confluite nella Haute Autorité de Santé (HAS) (43) istituita il 13 agosto 2004. L’HAS è un’autorità pubblica indipendente a carattere scientifico dotata di autonomia finanziaria; tra i suoi compiti:
- svolgere valutazioni di tipo clinico- economico e valutare periodicamente i dispositivi medici, le pratiche cliniche e terapeutiche, i farmaci (tecnologie sanitarie) proponendone o meno la rimborsabilità da parte delle assicurazioni sanitarie;
- promuovere le buone pratiche cliniche e il buon uso delle cure tra tutti gli operatori sanitari. Diffondere raccomandazioni professionali e linee guida sulla presa in carico dei pazienti con patologie croniche di lunga durata (affections de longue durée, ALD);
- migliorare la qualità delle cure nelle strutture ospedaliere e territoriali, tramite l’accreditamento delle strutture sanitarie (ospedali, cliniche,ecc.) e promuovendo la valutazione della pratica professionale (attualmente obbligatoria per i medici, ma progressivamente estesa a tutte gli altri operatori sanitari)
- informare gli operatori sanitari e i cittadini e monitorizzare e migliorare la qualità delle informazioni mediche diffuse;
- produrre report annuali di attività;
- sviluppare la concertazione e la collaborazione con gli attori del sistema sanitario nazionale e internazionali.
Alcuni criteri utilizzati dall’HAS nelle valutazioni delle tecnologie sanitarie:
- descrizione delle caratteristiche del prodotto e indicazioni d’uso; - inquadramento della patologia e cenni di epidemiologia;
- trattamenti alternativi; - dati di efficacia e sicurezza;
- valore aggiunto in termini di efficacia clinica e qualità della vita rispetto alle alternative terapeutiche;
- nessuna analisi di tipo farmaco-economica;
- no analisi di budget impact (viene solo indicata la popolazione eleggibile);
- giudizio sulla rimborsabilità e sul grado di innovazione.
A supporto dell’ HAS, per un’analisi approfondita delle nuove tecnologie, inclusa la dimensione economica, è stata creata nel 2008 la Commission de Évaluation Économique et de Santé Publique (CEESP). Comunque, ad oggi l’attività di valutazione delle tecnologie sanitarie si è limitata quasi solamente ad aggiornare la lista positiva del sistema assicurativo obbligatorio.
Storicamente, il Comité d’Evaluation et de Diffusiondes Innovations Technologiques (CEDIT) (44), istituito nel 1982 dalla rete ospedaliera parigina Assistance Publique-Hôpitaux de Paris (AP-HP), è la prima organizzazione ad essersi occupata di HTA in Francia. È membro con l’HAS dell’INHTA, ha partecipato come Lead Partner al progetto europeo EUnetHTA e si occupa di:
- preparare le raccomandazioni degli studi clinici o medico-economici;
- predisporre raccomandazioni di studi complementari (bibliografia, medico economici, organizzazione);
- organizzare gruppi di esperti.
Altre organizzazioni sanitarie che effettuano valutazioni, particolarmente di tipo medico economico, sono:
− Istitute National de la Santè et la RechercheMèdicale (INSERM), l’Istituto Nazionale per la Ricerc, specializzato in ricerca biomedica e sanità pubblica;
− Agence Française des Sècuritè Sanitaire des Produits de Sante (AFSSAPS), che si occupa della farmacovigilanza e della sorveglianza dei dispositivi medici. Ha al suo interno una commissione di valutazione dei prodotti e delle prestazioni, Commission d’ÉvaluationdesProduits et Prestations(CEPP) che ha il compito di aggiornare costantemente il Comitè Economique des Produits de Santè (CEPS), l’organismo responsabile della definizione delle tariffe di rimborso (LPP, Liste des Produits et Prestations remboursables) di alcune categorie di dispositivi medici, sui prodotti disponibili sul mercato;
− Societè Française pour l’Evaluation des Soins et des Technologies Mèdicales (SOFESTEC) è la società scientifica francese per l’HTA. Nata nel 1986 raggruppa gli esperti del settore e diffonde metodi e risultati delle attività di HTA nazionali ed internazionali.