Al mio fidanzato Massimiliano, alla mia famiglia e a chi ha creduto in quello che facevo, incoraggiandomi a perseguire questo obiettivo.
INDICE
1
INTRODUZIONE
1
1.1 CARATTERISTICHE DEI MICETI 1
1.2 LE INFEZIONI FUNGINE 3
1.2.1 Epidemiologia delle micosi 6
1.2.2 Fattori di rischio 7
1.3 IL GENERE CANDIDA 9
1.3.1 Specie di Candida di più frequente isolamento in ambito
nosocomiale 11 1.3.1.1 Candida albicans 11 1.3.1.2 Candida glabrata 14 1.3.1.3 Candida parapsilosis 15 1.3.1.4 Candida tropicalis 19 1.3.1.5 Candida krusei 19
1.3.2 Specie di Candida di più raro isolamento clinico 20
1.3.2.1 Candida guilliermondii 20 1.3.2.2 Candida kefyr 21 1.3.2.3 Candida famata 21 1.3.2.4 Candida dubliniensis 21 1.3.3 Saccharomyces cerevisiae 22 1.4 I FARMACI ANTIMICOTICI 23
1.4.1 Suscettibilità delle specie del genere Candida ai farmaci
antifungini 27
1.5 LE INFEZIONI IN AMBITO NOSOCOMIALE 29
1.5.1 Correlazione tra le micosi e alcuni reparti dell’Azienda
Ospedaliera Universitaria Pisana 30
Indice
1.5.1.1 Reparto centro ustioni 30
1.5.1.2 Reparto di medicina generale 31
1.5.1.3 Reparto infezioni nei diabetici, ambulatorio piede
diabetico 31
1.5.1.4 Reparto di pneumologia endoscopica
ambulatoriale 32
1.6 OGGETTO E SCOPO DELLA TESI 33
2
MATERIALI E METODI
35
2.1 ALLESTIMENTO ED ANALISI DELLE COLTURE 35
2.2 IDENTIFICAZIONE DEI LIEVITI 40
2.3 ANTIMICOGRAMMA 43
2.3.1 I sistemi Sensititre® Yeast One e E-test 44
2.4 CARATTERIZZAZIONE MOLECOLARE DEL GRUPPO
“PSILOSIS” 48
2.4.1 Estrazione del DNA genomico da C. parapsilosis 50
2.4.2 Amplificazione del frammento SADH 51
2.4.3 Digestione del frammento SADH con l’enzima di restrizione BanI ed identificazione delle specie
appartenenti al gruppo “psilosis” 52
2.4.4 Analisi statistica 53
3
RISULTATI
54
3.1 ISOLAMENTO ED IDENTIFICAZIONE DEI CEPPI DI LIEVITO 54
3.1.1 Distribuzione dei principali ceppi di lievito nei reparti
esaminati. 67
3.2 FREQUENZA DI ISOLAMENTO DEI CEPPI DI LIEVITO IN
Indice
3.2.1 Distribuzione dei principali ceppi di lievito esaminati nei
differenti siti corporei 74
3.3 SUSCETTIBILITÀ AI FARMACI ANTIFUNGINI 76
3.4 IDENTIFICAZIONE MOLECOLARE DELLE SPECIE DEL
GRUPPO “PSILOSIS” 78
3.4.1 Amplificazione del frammento del gene alcool
deidrogenasi secondaria (SADH) 78
3.4.2 Digestione del frammento SADH con l’enzima di restrizione BanI ed identificazione delle specie del
gruppo “psilosis” 80
4
DISCUSSIONE
82
RIASSUNTO
Negli ultimi due decenni, è stato osservato un incremento delle infezioni sostenute da miceti, anche in relazione al crescente numero di soggetti immunocompromessi, quali pazienti affetti da Sindrome da Immuno deficienza acquisita (AIDS) o sottoposti a terapie immunosoppressive.
La necessità di pervenire a diagnosi rapide e terapie appropriate ha dato un grande impulso al potenziamento di nuove tecniche diagnostiche, per l’identificazione dei miceti e l’analisi della suscettibilità ai farmaci. Nonostante ciò, lacunose sono le informazioni circa l’epidemiologia delle infezioni fungine nel nostro paese e la frequenza di ceppi resistenti ai più comuni farmaci antimicotici.
Lo studio svolto nella presente tesi si inserisce in un più ampio studio che mira alla definizione della epidemiologia delle infezioni fungine in ambito nosocomiale.
In particolare sono stati isolati e successivamente identificati ceppi di lievito da campioni biologici vari di pazienti ricoverati in alcuni reparti dell’Azienda Ospedaliera Universitaria Pisana, quali il centro ustioni, i reparti di medicina generale, l’ambulatorio del piede diabetico e la pneumologia endoscopica ambulatoriale. Le specie di lieviti identificate appartenevano, quasi tutte, al genere Candida, con percentuali di isolamento diverse a seconda del reparto preso in esame e del distretto anatomico di prelievo. Mentre, ad esempio, C. albicans è risultata la specie di prevalente isolamento tra i soggetti ustionati e i pazienti ricoverati in medicina generale,
C. parapsilosis è stato il lievito maggiormente rappresentativo tra soggetti
affetti da diabete 1 o 2.
Di ogni ceppo di lievito identificato è stata valutata la suscettibilità ai più comuni farmaci antimicotici, utilizzando il sistema di microdiluizione in brodo, Sensititre® Yeast One 9 e il metodo in agar diffusione, E-Test.
A parte C. albicans, specie risultata suscettibile a quasi tutti i farmaci testati, C. glabrata e C. krusei invece sono risultate poco suscettibili agli
Riassunto, II
azoli e in particolare modo quest’ultima specie ha mostrato una totale resistenza all’itraconazolo e al fluconazolo, in accordo con quanto riportato in letteratura. C. krusei e C. tropicalis hanno mostrato ridotta suscettibilità nei confronti di 5-fluorocitosina.
Le echinocandine sono, invece, risultate attive nei confronti delle varie specie di Candida, ad eccezione di C. parapsilosis e C. guilliermondii, che hanno riportato valori di sensibilità minore.
Inoltre, per meglio comprendere l’epidemiologia delle specie di
Candida orthopsilosis e Candida metapsilosis, ancora indistinguibili
fenotipicamente dalla specie C. parapsilosis, è stata condotta una indagine retrospettiva basata su metodi molecolari. In particolare, l’analisi di restrizione del frammento SADH (alcool deidrogenasi secondaria) ha confermato l’identificazione condotta con metodi biochimici per tutti i 23 ceppi di C. parapsilosis testati.
1 INTRODUZIONE
1.1 CARATTERISTICHE DEI MICETI
I miceti o funghi includono sia organismi macroscopici (funghi eduli), sia microscopici, i lieviti o blastomiceti e le muffe o ifomiceti.
A differenza dei batteri, i miceti sono organismi eucarioti, chemiosintetici, generalmente aerobi o anaerobi facoltativi, eterotrofi e presentano dimensioni maggiori (5 µm circa contro 0,5 - 3 µm dei batteri).
I funghi non possiedono clorofilla (classificati, infatti, in un regno a sé) e non sono mobili. La loro parete cellulare contiene glucani, mannani, chitina, un polisaccaride presente anche nell’esoscheletro degli artropodi. Hanno una membrana ricca di ergosterolo e presentano la tipica compartimentalizzazione intracitoplasmatica dalle varie funzioni, propria delle cellule eucariotiche (lisosomi, mitocondri, nucleo) (Figura 1).
Figura 1. Struttura di una cellula fungina, con gli organuli propri di una cellula eucariotica.
Introduzione, 2
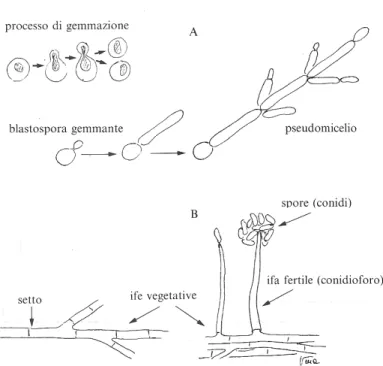
I lieviti sono microrganismi unicellulari, costituiti da cellule ovali che si riproducono per gemmazione, a seguito della quale le cellule neo formate possono staccarsi dalla cellula madre o rimanere unite nel punto di gemmazione, formando lo pseudo micelio o pseudoifa (Figura 2 A).
Le muffe (miceti filamentosi) sono costituite da un tallo tubulare, denominato ifa la quale si sviluppa per allungamento apicale, con setti trasversali e ramificandosi. I funghi filamentosi presentano un elevato grado di differenziazione, sviluppando ife vegetative che, infiltrando il substrato, sono deputate alla nutrizione e ife aeree che si differenziano in strutture riproduttive, con produzione di spore (riproduzione sessuata) o conidi (riproduzione asessuata) (Figura 2 B).
Figura 2 A. Lieviti, gemmazione della blastopora, formazione dello pseudo micelio. B. Muffe, ife vegetative, ife fertili con spore o conidi.
Mentre i lieviti formano colonie dall’aspetto cremoso sui terreni di coltura, le muffe, organismi pluricellulari, si sviluppano in colonie dall’aspetto
Introduzione, 3
cotonoso o polveroso, in rapporto alla maggiore o minore produzione di ife aeree e di spore o conidi.
I funghi possono danneggiare la salute dell’uomo, inducendo
Ipersensibilità, reazione allergica che si sviluppa in seguito a sensibilizzazione per inalazione o ingestione di materiale fungino; Micotossicosi, da ingestione di cibo contaminato da miceti produttori
di tossine, quali le aflatossine;
Micetismo, avvelenamento da ingestione diretta di funghi tossici, ritenuti erroneamente eduli (Amanita phalloides);
Micosi, infezione fungina, la cui gravità varia in relazione al tipo di microrganismo infettante e al distretto corporeo interessato (superficiali, cutanee, sottocutanee, sistemiche).
La micologia medica è quella branca della microbiologia che si occupa di studiare i funghi che provocano malattia negli uomini e negli animali.
1.2 LE INFEZIONI FUNGINE
Numerose sono le specie fungine descritte in letteratura, oltre 100.000, anche se solamente un numero limitato di esse è responsabile di micosi o patologie nell’ospite umano (De Pauw, 2011).
Queste si riferiscono a specie fungine microscopiche che esplicano il loro potenziale patogeno attraverso parassitismo diretto o mediante produzione di metaboliti tossici (micotossine) (Bendinelli et al., 2005). La maggior parte delle specie fungine sono rappresentate da saprofiti che si riproducono nel loro habitat naturale come lieviti o muffe, non sono capaci di sopravvivere nei tessuti umani e determinano malattia solamente a seguito di produzione di sostanze tossiche che vengono ingerite nell’uomo (Levitz, 1992). In netto contrasto si pongono i dermatofiti antropofili, parassiti della cute, la cui trasmissione ha luogo per contatto interumano. Tra questi due estremi esistono numerosi esempi di funghi saprofiti che si sono adattati a vivere nell’uomo e che sono capaci, quindi, di causare
Introduzione, 4
infezioni nell’ospite umano. Tra quest’ultimi troviamo alcune specie del genere Candida che, in ospiti sani, vivono come commensali in equilibrio con la flora endemica di vari distretti, mentre in condizioni di alterata reattività immunitaria possono causare infezioni il cui quadro clinico dipende dallo stato di immunocompromissione dell’ospite. Tale comportamento è indicativo di un fenomeno definito “opportunismo”, che consente al microrganismo di passare da una fase di commensalismo ad una di patogenicità, qualora si verifichino condizioni di alterata funzionalità della risposta immunitaria.
L’eventuale rottura del delicato equilibrio instauratosi tra i microrganismi che convivono in un dato ospite e la risposta immunitaria dell’ospite è alla base dell’opportunismo, che determina l’insorgenza di un processo patologico. Un’alterata reattività immunitaria dell’ospite, quale immunodepressione di origine iatrogena (riceventi trapianto d’organo, terapia radiante, trattamento con corticosteroidi) o in seguito ad infezione con virus immunosoppressivi, quali il virus dell’immunodeficienza umana sono condizioni che consentono la transizione dalla fase di commensale a quella di patogeno. Parallelamente, all’ aumentato numero di individui gravemente immunocompromessi è stato registrato un aumento di incidenza di micosi locali e sistemiche (Fridkin e Jarvis, 1996).
Anche la diversa virulenza del ceppo infettante può influenzare il processo patologico e la sintomatologia clinica associata all’infezione.
Recentemente, è stato sottolineato come la suscettibilità ad infezioni fungine invasive possa essere dovuta a variazioni genetiche del sistema immunitario, le quali hanno portato alla mancanza nella produzione dell’IL-10 e a polimorfismi dei recettori Toll–like (Carvalho, et al., 2008 ; Bochud et
al., 2008).
Le micosi possono venire classificate usando come criteri
Introduzione, 5
• acquisizione del patogeno (Dupont et al., 1992);
• grado di virulenza espressa dal micete infettante (Kwon– Chung e Bennett, 1992).
In base alla profondità e gravità dell’infezione fungina nei vari distretti anatomici dell’organismo, le micosi possono venire distinte nelle seguenti categorie:
I. Micosi superficiali II. Micosi cutanee III. Micosi sottocutanee
IV. Micosi profonde o sistemiche.
Al primo tipo appartengono infezioni che interessano esclusivamente gli strati superficiali di cute e annessi e provocano un danno quasi esclusivamente estetico, con nessuna reazione immunitaria da parte dell’ospite. I principali agenti eziologici delle micosi superficiali sono
Exophalia werneckii, Trichosporon beigelii, Piedraia hortae, Malassezia furfur, responsabile quest’ultima specie della pitiriasi versicolor, malattia
cosmopolita, caratterizzata dalla comparsa di zone diversamente pigmentate, di varie dimensioni, localizzate sulla parte superiore del dorso (Odds, 1996).
Per micosi cutanee si intendono le infezioni fungine che interessano i tessuti cheratinizzati della cute, gli annessi cutanei e le mucose, provocando danno tissutale e una significativa reazione immunitaria da parte dell’ospite. I dermatofiti (generi Microsporum, Trichophyton ed
Epidermophyton) e specie del genere Candida sono le specie
principalmente coinvolte. I dermatofiti sono responsabili della tinea le cui varie forme sono contraddistinte in base alla sede dell’infezione (ad
Introduzione, 6
esempio tinea barbae, tinea capitis, tinea manum, tinea pedis) (Odds, 1996).
Le micosi sottocutanee (Sporotricosi, Cromoblastomicosi e Maduromicosi) coinvolgono inizialmente gli strati più profondi del derma, i tessuti sottocutanei e possono diffondere per contiguità o per via linfatica, andando ad interessare anche l’apparato osteomuscolare. Hanno un decorso cronico, con rilevante reazione immunitaria da parte dell’ospite. La porta d’entrata è generalmente rappresentata da un trauma (Odds, 1996).
Vengono denominate micosi profonde le infezioni, la cui localizzazione primaria è generalmente a livello polmonare, con possibile disseminazione sistemica. Massima è la reazione immunitaria dell’ospite nei riguardi degli agenti infettivi responsabili, tra i quali ad esempio i funghi dimorfici Histoplasma capsulatum, Coccidioides immitis, Blastomyces
dermatitidis, Paracoccidioides brasiliensis, ed il lievito Cryptococcus neoformans (Odds, 1996).
1.2.1
Epidemiologia delle micosi
I miceti, con la possibile eccezione dei dermatofiti antropofili, non necessitano di parassitare l’uomo o gli animali per diffondersi; pertanto l’infezione è, quasi sempre, un evento casuale. La maggior parte dei miceti potenzialmente patogeni per l’uomo ha una nicchia ecologica ben definita, con distribuzione geografica ubiquitaria o circoscritta. Da un punto di vista strettamente epidemiologico, alcune micosi possono essere considerate endemiche in determinate aree geografiche; altre possono essere correlate allo stato socio economico della popolazione; altre ancora possono essere
Introduzione, 7
ritenute malattie professionali, in quanto individui appartenenti a particolari categorie lavorative sono esposti più di altri soggetti.
Inoltre, molte specie fungine che causano micosi sottocutanee, ad esempio, vivono allo stato saprofitario (vegetativo) su materiali vegetali in decomposizione e, per le loro modalità di contagio mediante innesto traumatico accidentale tramite ferite con rovi, spine e schegge, infettano preferenzialmente le estremità degli arti di individui negli umidi paesi tropicali.
Le infezioni fungine possono inoltre essere di natura esogena o endogena, quest’ultime dovute a colonizzazione da parte della normale flora microbica o da riattivazione di un fungo da un’infezione latente.
Candida albicans è il più comune agente eziologico di micosi endogena
nell’uomo, essendo un abituale commensale della mucosa del cavo orale, del tratto gastro-intestinale e vaginale (Bendinelli et al., 2005).
1.2.2
Fattori di rischio
Negli ultimi dieci anni, si è osservato un incremento delle infezioni micotiche, anche in conseguenza dei progressi nelle terapie medico chirurgiche. Infatti, l’evoluzione delle tecniche a disposizione nel trattamento di patologie degenerative come ad esempio i trapianti di organo solido o di midollo, l’impiego di nuovi agenti chemioterapici o la pandemia nella diffusione dell’HIV hanno portato ad un incremento nel numero di individui immunocompromessi, esposti al rischio di micosi invasive (Fridkin, 2005).
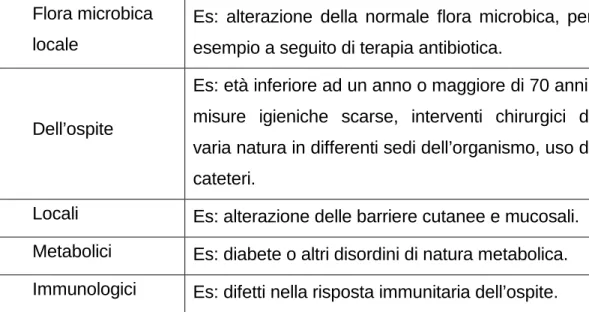
I fattori di rischio che possono predisporre a micosi invasive sono molteplici, riconducibili ad esempio a neutropenia, anormalità nella risposta immunitaria cellulo–mediata, non integrità delle barriere meccaniche, rappresentate da cute e mucose (Segal, et al, 2006), sistema immunitario immaturo (neonati o senescenti), come riportato in Tabella 1.
Introduzione, 8
Inoltre, un aumento di pratiche invasive, quali ad esempio l’impianto di cateteri intravascolari ha contribuito all’incremento di infezioni del circolo sanguigno, come le candidosi disseminate (Hidron, et al, 2008; Wisplinghoff
et al., 2004). Nei soggetti affetti da neoplasie, la terapia chemioterapica può
portare a neutropenia con conseguente aumento del rischio di contrarre micosi di origine endogena (Nucci e Anaissie, 2001).
Ulteriori fattori di rischio comprendono interventi chirurgici, soprattutto addominali, pazienti in dialisi, l’uso massiccio di antibiotici a largo spettro, corticosteroidi o farmaci immunosoppressivi.
La prolungata terapia antibiotica può infatti alterare la composizione della flora residente nei vari distretti, favorendo la replicazione fungina.
Tabella 1. Principali fattori di rischio correlati all’insorgenza di micosi.
Flora microbica locale
Es: alterazione della normale flora microbica, per esempio a seguito di terapia antibiotica.
Dell’ospite
Es: età inferiore ad un anno o maggiore di 70 anni, misure igieniche scarse, interventi chirurgici di varia natura in differenti sedi dell’organismo, uso di cateteri.
Locali Es: alterazione delle barriere cutanee e mucosali.
Metabolici Es: diabete o altri disordini di natura metabolica.
Introduzione, 9
1.3 IL GENERE CANDIDA
Il genere Candida comprende più di 200 differenti specie, di cui solamente alcune sono in grado di causare malattia nell’uomo; infatti circa il 65% delle specie appartenenti al genere Candida non è in grado di moltiplicarsi a 37°C, requisito fondamentale affinc hè un microrganismo possa colonizzare ed eventualmente instaurare un processo patologico che coinvolga diversi distretti corporei (Schauer and Hanschke, 1999).
Per questo motivo, le specie di rilevanza clinica più comunemente isolate nell’uomo risultano un numero molto esiguo (Hazen, 1995; Faller e Diekema, 2004). Sebbene più del 90% di infezioni profonde siano da attribuire principalmente a 5 specie del genere Candida (C. albicans, C.
glabrata, C. parapsilosis, C. tropicalis e C. krusei) negli ultimi anni sono in
aumento anche altre specie, quali C. guilliermondii, C. lusitaniae, C. kefyr,
C. rugosa, C. famata, C. incospicua, C. norvegensis (Pappas, et al., 2004;
Faller e Diekema, 2004; Rex e Faller, 2002; Spellberg, et al., 2006) grazie anche alle migliorate capacità diagnostiche dei nuovi sistemi commerciali e di metodi classici di identificazione (Hazen, e Howell, 2003). Inoltre, fenomeni pandemici (diffusione di HIV), progressi nella pratica chirurgica (trapiantologia) ed il crescente utilizzo di molecole antimicotiche hanno portato ad un’inversione di tendenza, con un crescente aumento nella frequenza di isolamento delle specie non-albicans (Nucci, e. Marr, 2005; Pfaller e Diekema, 2004).
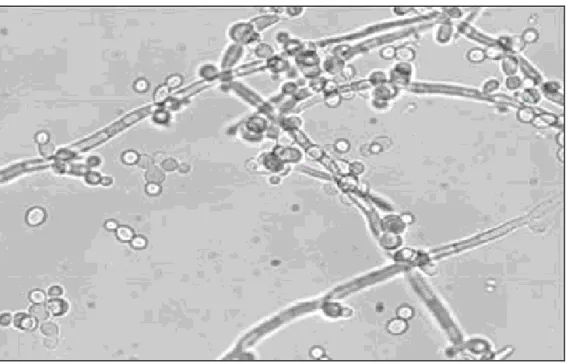
Il genere Candida comprende un eterogeneo gruppo di microrganismi che crescono prevalentemente sotto forma di lieviti, blastoconidi ovali e che si replicano per gemmazione, in varie condizioni di pH e temperatura (Odds, 1998). Alcune specie del genere Candida sono in grado di crescere anche in forma filamentosa. Dal blastoconidio possono formarsi delle pseudoife e/o ife propriamente dette, differenziandosi in base alla modalità con cui si originano. Le pseudoife si formano a partire dal blastoconidio per gemmazione, la nuova cellula rimane adesa alla cellula
Introduzione, 10
madre e si allunga, producendo un filamento tozzo, con una costrizione tra le due cellule (Figura 3 A). Le seconde, invece, si accrescono per crescita apicale, sviluppandosi dal blastoconidio o da porzioni di ife già esistenti. Inoltre, le ife risultano essere più sottili, uniformi e hanno pareti parallele, rispetto alle pseudoife (Figura 3 B).
Figura 3 A. Cellule lievitiformi, pseudoife ed ife di C. albicans Ingrandimento 200 X.
Introduzione, 11
B. Aspetti morfologici del lievito Candida albicans: l’ifa propriamente detta e la pseudoifa costiuita da catenelle di cellule allungate, separate da restringimenti ed il blastoconidio, una piccola sfera dal diametro di 4-6 µm.
1.3.1
Specie di Candida di più frequente isolamento in
ambito nosocomiale
1.3.1.1 Candida albicans
Si tratta di un lievito opportunista, comunemente presente come commensale in distretti corporei, quali tratto gastrointestinale, distretto vaginale e cute, in equilibrio con la flora endemica di tali distretti (Figura 4). Essendo un fungo dimorfico, è in grado di crescere sotto forma di lievito o di originare pseudoife e/o ife propriamente dette.
Questo equilibrio fra ospite e commensale può repentinamente evolvere, passando dallo stato di colonizzazione ad una vera e propria infezione. I fattori predisponenti sono generalmente correlati al livello di deficit immunitario: C. albicans può causare, ad esempio:
25 °C
37 °C
Lievito
Ifa
37 °C
Introduzione, 12
• Infezioni muco cutanee spesso correlate a fattori predisponenti come l’età (ad esempio, il mughetto infantile e la stomatite da apparecchi odontoiatrici), disordini ormonali (ad esempio: vaginiti ricorrenti) e sindromi da immunodeficienza acquisita o congenita (ad esempio: candidosi cronica muco cutanea) (Ashman e Papadimitriou, 1995; Naglik et al., 1999);
• infezioni cutanee, frequentemente localizzate all’unghia, spazio interdigitale, piega inguinale o, nel bambino, nella parte ricoperta dal pannolino (candidosi da pannolino), essendo questo microrganismo in grado di vivere in condizioni di caldo-umido;
• infezioni profonde e/o sistemiche, che interessano principalmente individui immunosoppressi affetti da neoplasie, malattie metaboliche.
C. albicans risulta essere la specie del genere Candida
maggiormente isolata da campioni clinici, responsabile di circa il 90– 100% di infezioni di mucose e del il 50–70 % di candidosi invasive (Visolinghoff et al., 2004; Trick et al., 2002; Pappas et al., 2003; Hajjeh et al., 2004; Kao et al., 1999; Pfaller et al., 2002; Lockhart et
al., 1999; Antoniadou et al., 2003). La frequenza di C. albicans e di
specie non-albicans varia, a seconda delle zone geografiche (Trick et
al., 2002; Abi – Said et al., 1997; Kao et al., 1999; Eggimann et al.,
2003; Pfaller et al., 2002; Antoniadou et al., 2003; Pfaller et al., 2005; Goldman et al., 2000; Hope et al., 2002; Laverdiere et al., 2000; Pfaller et al., 2005). A livello globale, C. albicans ha subito un decremento epidemiologico del 10–11% in 39 paesi (Pfaller et al., 2005), anche se le infezioni sistemiche causate da C. albicans in Europa sono risultate più frequenti, rispetto a quelle registrate in America Latina (Pfaller et al., 2005a; Pfaller et al., 2005b).
Introduzione, 13
C. albicans è frequentemente causa di infezione endogena, ma è
stata recentemente dimostrata anche la via di trasmissione esogena (Eggimann et al., 2003; Marco et al., 1999).
Figura 4. Colonie della specie Candida albicans su Dextrose Agar Sabouraud.
Introduzione, 14
1.3.1.2 Candida glabrata
La specie Candida glabrata, un tempo conosciuta come Torulopsis
glabrata, è un lievito di particolare interesse medico, poiché responsabile di
frequenti infezioni del tratto urogenitale e sistemiche, in particolare in individui immunocompromessi (Sobel et al., 1999). L’incidenza delle infezioni causate da questo microrganismo ha subito un drammatico incremento a partire dagli anni’ 90: negli Stati Uniti è seconda solo a C.
albicans quale agente eziologico di infezioni sistemiche. L’aumento delle
micosi sistemiche causate da C. glabrata è da attribuirsi alla resistenza intrinseca di C. glabrata ai farmaci azolici. Ciò ha particolare rilevanza per la terapia delle infezioni del distretto ematico (Malani et al., 2005).
La frequenza di isolamento di questo micete nel sangue varia dal 22% nel Nord America, al 4–6% in America Latina (Faller e Diekema, 2004; Faller et al., 2005; Faller et al., 2004), mentre in Europa si è registrato un decremento nella frequenza di questa specie, a partire dagli ultimi 4 anni (dal 12,3% al 8,8%) (Faller, et al., 2005).
A tale riguardo, studi epidemiologici condotti in alcuni paesi europei, quali Francia (Richet, et al., 2002), Svizzera (Marchetti, et al., 2004), Finlandia (Poikonen, et al., 2003), Islanda (Asmundsdottir, et al., 2002) e nel nostro paese (Luzzati, et al., 2000; Tortorano, et al., 2002) hanno confermato la diminuzione delle infezioni causate da C. glabrata. Uno studio recente ha sottolineato l’isolamento di C. glabrata in Australia (Chen et al., 2008).
Numerosi studi hanno evidenziato che la colonizzazione e successiva infezione da parte di C. glabrata è rara tra i neonati e i bambini mentre aumenta con l’innalzamento dell’età (Faller e Diekema, 2004; Kauffman, 2001; Hajjeh et al., 2004; Faller e Diekema, 2002; Diekema et
al., 2002; Faller et al., 2002; Malani et al., 2005; Rangel–Frausto et al.,
Introduzione, 15
1.3.1.3 Candida parapsilosis
Candida parapsilosis è un lievito che, in vitro, si sviluppa a 25°C e
37°C, producendo su Agar Sabouraud colonie bianche, dall’aspetto cremoso ed emisferiche.
Su CHROMagar, terreno di isolamento primario che consente la discriminazione delle specie patogene del genere Candida, in base alla produzione di una diversa pigmentazione della colonia, C. parapsilosis forma colonie di colore rosa pallido (Calderone, 2002).
Fenotipicamente la forma di lievito può presentare colonie dal caratteristico aspetto liscio o formare delle cavità, mentre le forme pseudoifali originano colonie rugose o concentriche (Laffey e Butler, 2005).
C. parapsilosis è la terza specie più comunemente isolata da
emocolture in Europa (12%) e in Asia (17%). Inoltre, è stato riscontrato un aumento nelle percentuali di isolamento dal 14 al 20% in America Latina a partire dagli ultimi 4 anni (Pfaller et al., 2005).
Infezioni causate da questa specie sono frequenti in pazienti ospedalizzati sottoposti a procedure di cateterizzazione (Clark, et al., 2004; Sarvikivi et al., 2005). Questo aspetto è correlato al fatto che C. parapsilosis è la specie più frequentemente isolata dalle mani di operatori sanitari (Strausbaugh et al., 1994), attraverso le quali può verificarsi una trasmissione del lievito a neonati ricoverati presso le Unità di Terapia Intensiva Neonatale e a pazienti adulti nutriti per via parenterale (Clark, et
al., 2004; Sarvikivi, et al., 2005).
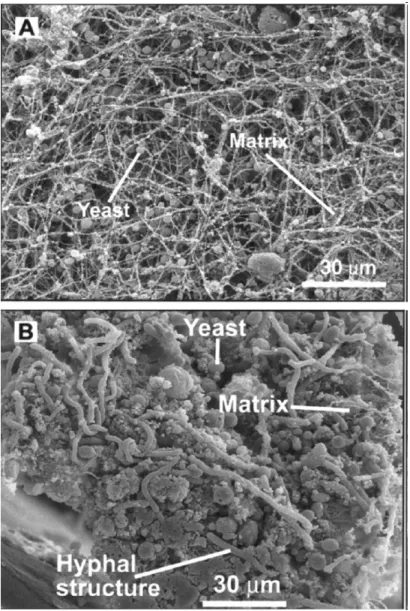
C. parapsilosis è in grado di formare biofilm sulla superficie e
all’interno dei cateteri o dispositivi bio–protesici (Kuhn et al., 2002; Shin et
al., 2002), caratteristica che rende particolarmente difficile l’eradicazione
dell’infezione, a causa di un’aumentata resistenza agli antimicotici del lievito all’interno del biofilm ( Kuhn et al., 2002).
Con il termine di biofilm o slime si indica infatti una organizzazione cellulare in cui le forme di lievito sessili sono rivestite da una ricca matrice extracellulare polisaccaridica (Figura 5 A, B) la cui architettura può subire
Introduzione, 16
variazioni, in risposta a fattori ambientali, quali il pH e la disponibilità di nutrienti (Ramage et al., 2005).
Figura 5 A, B. Esempio di un denso biofilm prodotto da specie del genere Candida.
Introduzione, 17
Considerata precedentemente una specie caratterizzata da elevata variabilità genotipica, oggi Candida parapsilosis appartiene al cosiddetto gruppo”psilosis”. La definizione di questo gruppo risale al 2005, quando i gruppi
II
eIII
considerati fino ad allora varianti intraspecifiche di C.parapsilosis sono stati elevati a rango di specie e, rispettivamente,
denominati C. orthopsilosis e C. metapsilosis in base ad estese differenze genomiche ed a studi di filogenetica molecolare (Tavanti et al., 2005).
La specie C. parapsilosis in senso stretto include attualmente soltanto ceppi di gruppo
I
, comprende la maggior parte degli isolati clinici e rappresenta quella, fra le tre specie “psilosis”, meglio adattata all’uomo (Tavanti et al., 2005).Queste tre specie sono attualmente indistinguibili, mediante sistemi, quali API o VITEK 2, basati su una caratterizzazione fenotipica; pertanto, in seguito alla riorganizzazione del gruppo, sono disponibili sistemi di identificazione basati sull’analisi del DNA, ad esempio:
Sequenziamento delle regioni ITS e di altre regioni genomiche conservate come D1–D2 nell’rRNA 28S (Fell et al., 1993); il pirosequenziamento, applicato a 20 nucleotidi della regione
ITS2 (Borman et al., 2009).
Profili di restrizione del gene SADH, digerito con l’enzima Ban
I
(Tavanti et al., 2005) (Figura 6 A, B) o NIaIII (Mirhendi et al., 2009).
AFLP (Amplification Fragment Lenght Polymorphism) (Tavanti
et al., 2007; Hengens et al., 2009).
La tecnologia microarray, che prevede l’impiego di sonde disegnate su sequenze altamente conservate e specie specifiche, presenti nelle regioni ITS1 e ITS2 (Campa et al., 2008).
Introduzione, 18
Figura 6 A. Amplificazione del frammento genico SADH (alcool deidrogenasi secondaria , PM atteso 716 pb) in diverse specie del genere Candida : linea 1, C.
albicans, linea 2, C. dubliniensis, linea 3, C. famata, linea 4, C. glabrata, linea 5, C. guilliermondii, linea 6, C. kefyr, linea 7, C. krusei, linea 8, C. lusitaniae, linea 9, C. metapsilosis, linea 10, C. orthopsilosis, linea11, C. parapsilosis, linea 12, C. tropicalis, linea 13, Saccharomyces cerevisiae. M, marker di peso molecolare.
B. Profili di restrizione delle tre specie, ottenuti mediante digestione enzimatica del frammento di PCR SADH con l’enzima BanI. Linea 1, C. metapsilosis, 3 siti di restrizione, 4 frammenti (370, 188, 93 e 60 bp), linea 2, C. orthopsilosis, nessun sito di taglio, 1 frammento (716 bp), linea 3, C. parapsilosis, 1 solo sito di restrizione, 2 frammenti (512 e 196 bp). M, marker di peso molecolare.
Introduzione, 19
1.3.1.4 Candida tropicalis
Candida tropicalis fa parte della normale flora microbica muco
cutanea, in condizioni di alterata reattività immunitaria può essere causa di gravi infezioni (setticemia e candidosi disseminata), soprattutto nei pazienti affetti da leucemia, linfoma e diabete mellito. C. tropicalis è considerata la terza specie non-albicans (C. glabrata, C. parapsilosis, C. tropicalis) più frequentemente isolata dal sangue e dalle urine (Kauffman et al., 2000; Alvarez-Lerm et al., 2003).
Un recente studio epidemiologico ha sottolineato come C. tropicalis sia la seconda specie di Candida più frequentemente responsabile di casi di candidosi in Brasile, con percentuali del 33–48% (Colombo et al., 2007; Miranda et al., 2009).
Le infezioni sistemiche causate da C. tropicalis sono associate ad elevato tasso di mortalità, se comparate con i dati relativi a C. albicans e ad altre specie non-albicans (Kremery, 1999a; Kontoyiannis et al., 2001; Eggimann et al., 2003; Colombo et al., 2007). I principali fattori di virulenza di C. tropicalis sono da ricercare nella formazione del biofilm, secrezione di proteinasi e nel dimorfismo (Kremery, 1999b; Negri et al., 2010).
Il trattamento delle infezioni sostenute da C. tropicalis in soggetti neutropenici avviene pricipalmente utilizzando il fluconazolo (Abi-Said et al., 1997; Marr, et al., 2000; Antoniadou et al., 2003), tuttavia la specie, come evidenziato da un ampio studio condotto da Pfaller e collaboratori mostra livelli intermedi di resistenza a questo azolo (Pfaller et al, 2009), in accordo con precedenti studi (Tortorano et al., 2003; Yang et al., 2004; Myoken et
al., 2004).
1.3.1.5 Candida krusei
Questa specie del genere Candida è raramente causa di infezioni del distretto ematico (2-4%) e principalmente provoca infezioni in pazienti con grave neutropenia o leucemia. La mortalità associata a fungemia in questi pazienti è particolarmente elevata (60-80%) (Pfaller, Diekema, 2004a;
Introduzione, 20
Pfaller, Diekema, 2002; Faller, Diekema, 2004b; Abi-Said et al., 1997; Marr
et al., 2000; Antoniadou et al., 2003; Hope W et al., 2002). Sebbene, tale
specie sia intrinsecamente resistente al fluconazolo, può presentare ridotta suscettibilità anche nei confronti di amfotericina B e 5-fluorocitosina (Faller, Diekema, 2004; Hajjeh et al., 2004; Antoniadou et al., 2003).
Questo aspetto complica il trattamento delle infezioni sostenute da C.
krusei e sembra che l’alta mortalità associata a tale infezioni sia correlata
alla scarsità di risposta al trattamento antifungino (Antoniadou et al., 2003; Viudes et al., 2002).
1.3.2
Specie di Candida di più raro isolamento clinico
1.3.2.1 Candida guilliermondii
La specie Candida guilliermondii è a distribuzione ubiquitaria: si ritrova nell’acqua, nel suolo, nelle feci di animali ed in alcuni alimenti; fa parte della normale flora microbica dell’uomo ed è frequentemente isolata dalle unghie di individui sani. Ad oggi è considerato un patogeno opportunista emergente, infatti può causare candidosi sia cutanee che sistemiche, prevalentemente in pazienti immunocompromessi. Al momento è noto poco sull’epidemiologia (percentuale di isolamento <5%) e sulla suscettibilità ai farmaci antimicotici di C. guilliermondii (Girmenia, et al., 2006; Pfaller e Diekema, 2004).
Un progetto di sorveglianza globale sulla epidemiologia e suscettibilità ai farmaci condotto da Pfaller e colleghi (Pfaller, et al., 2005) ha evidenziato un aumento di questo patogeno opportunista in America Latina, ma non nelle altre regioni del mondo. Questa specie ha mostrato una suscettibilità ridotta al fluconazolo e generalmente è risultata suscettibile al voriconazolo e alla caspofungina. Seppure raramente, C.
Introduzione, 21
in pazienti portatori di cateteri. Quando viene isolata dalla cute o annessi cutanei, questa specie mostra un ridotto grado di suscettibilità al fluconazolo (Pfaller, et al., 2005).
1.3.2.2 Candida kefyr
Negli ultimi anni C. kefyr è stata indicata quale patogeno opportunista emergente, associato ad infezioni sistemiche e caratterizzato da elevate resistenze al farmaco amfotericina B (Gomez-Lopez, et al., 2010).
C. kefyr è maggiormente associata a manifestazioni cutanee
superficiali. La specie si riscontra con bassa frequenza (<5%) nel tratto gastroenterico, genito-urinario e sulle mucose.
1.3.2.3 Candida famata
Nonostante Candida famata sia considerata una specie non patogena per l’uomo, è stata isolata in diversi distretti anatomici e tessuti, quali sangue, tessuto osseo, mucose e cute. Dati recenti suggeriscono che
C. famata sia l’agente eziologico di infezioni oculari, quali AZOOR (Acute zonal occult outer retinopathy) (Pisa, et al., 2007).
1.3.2.4 Candida dubliniensis
Identificata nel 1995, questa specie è principalmente associata allo stato di portatore sano e all’infezione in soggetti sieropositivi per HIV e con AIDS conclamata (Sulevon et al., 1995). Più raramente è isolata dalla cavità orale di soggetti sani. Su agar Sabouraud forma colonie colore crema, rotondeggianti e convesse. Questa specie cresce bene sia alla temperatura di 30°C, sia di 37°C.
Infine, tra le specie isolate con minore frequenza si trova ad esempio:
• Candida utilis;
• Candida haemulonii, isolata molto raramente, le cui colonie sono sferiche o ovali, non produce pseudoife. Inoltre, la
Introduzione, 22
distinzione tra questa specie e C. famata può risultare difficoltosa, utilizzando le procedure diagnostiche commerciali che si impiegano comunemente con i miceti lievitiformi;
• Candida sphaerica, Candida lusitaniae, Candida rugosa,
Candida norvegensis e Candida intermedia. Diversi casi di
infezioni sostenute da C. lusitaniae sono stati riscontrati in pazienti con condizioni predisponenti, quali ad esempio, leucemia, mieloma multiplo, epatite alcolica, trapianto di midollo osseo (Blinkhorn, et al., 1989; Hadfield, et al., 1987).
1.3.3
Saccharomyces cerevisiae
Saccharomyces cerevisiae è il lievito più importante nell’ambito
dell’alimentazione umana e il suo utilizzo è noto fin dall'antichità per la panificazione e la produzione di birra e vino. Si pensa che sia stato isolato per la prima volta dalla superficie di acini d'uva.
Non è considerato un patogeno umano, sebbene siano stati descritti alcuni casi di setticemia da S. cerevisiae (Cimolai et al., 1987; Eschete West, 1980; Nielsen et al., 1990). In soggetti gravemente immunocompromessi è stato inoltre riscontrato un caso di polmonite polimicrobica, in soggetto con AIDS (Tawfik et al., 1989). Casi di infezioni sostenute da questo lievito sono stati osservati in pazienti dializzati, con infezioni polmonari e in un soggetto ustionato (Tawfik et al., 1989).
Introduzione, 23
1.4 I FARMACI ANTIMICOTICI
I principali farmaci antifungini comprendono i polieni, gli azoli, le echinocandine e vengono classificati in base alla struttura chimica, al meccanismo d’azione o all’uso clinico.
In contrasto con il grande numero di antibiotici e chemioterapici efficaci nel trattamento delle infezioni batteriche, l’individuazione e lo sviluppo dei farmaci antifungini ha incontrato grande difficoltà, riferibile principalmente alla comune struttura eucariotica di cellule fungine e umane, che rende difficile l’individuazione di bersagli metabolici o strutturali specifici in grado di garantire la tossicità selettiva.
Tra i farmaci attualmente disponibili per il trattamento delle infezioni fungine, si trovano i seguenti antimicotici: i polieni prodotti da specie del genere Streptomyces, sono fungicidi e sono caratterizzati dal più ampio spettro di attività (Gallis et al., 1990; Bolard, 1996).
I polieni hanno come bersaglio l’ergosterolo, principale costituente della membrana plasmatica dei miceti, causano distruzione della medesima, aumentando la permeabilità di essa, con conseguente perdita di sostanze come potassio, sodio, zuccheri, e compromissione delle funzioni cellulari e successiva lisi (Varnock, 1991).
Nella pratica clinica, i polieni usati sono amfotericina B, nistatina e natamicina (pimaricina), hanno un’alta affinità per l’ergosterolo della membrana micotica che rappresenta la controparte del colesterolo nelle cellule umane risultando così meno tossiche per quest’ultime (Fromtling, 1988).
Gli azoli sono chemioterapici di sintesi, scoperti negli anni sessanta e hanno avuto il più rapido sviluppo fra tutti gli antimicotici (Vanden Bossche, 1985; Barrett-Bee et al.,1991). Gli azoli alterano la via biosintetica dell’ergosterolo della membrana citoplasmatica, del reticolo endoplasmico e mitocondriali dei miceti sensibili alterandone la fluidità, in funzione della loro
Introduzione, 24
attività sull’enzima citocromo P450 dipendente, una emoproteina che catalizza la demetilazione di un precursore specifico, il lanosterolo (lanosterolo-C-14-α demetilasi).
Comprendono gli imidazoli, con 2 atomi di azoto nell’anello azolico, quali chetoconazolo, econazolo, miconazolo e i triazoli, con 3 atomi, rappresentati da itraconazolo, fluconazolo, posaconazolo, voriconazolo.
Allilamine : agiscono inibendo la sintesi dell’ergosterolo di membrana, agendo sull’enzima squalene epossidasi (Baloch, Mercer, 1987; Polak, 1990).
Le echinocandine, quali caspofungina, anidulafungina e micafungina (Figura 7 A, Figura 7 B, Figura 7 C) sono una classe di antifungini (molecole lipopeptidiche) che interferiscono con la biosintesi della parete cellulare, attraverso una inibizione non competitiva dell’ 1,3-ß-D-glucano sintetasi, un enzima presente nei miceti, non nei mammiferi, indispensabile per l’integrità della parete fungina. Tale enzima è deputato alla sintesi dell’1,3-ß-D-glucano, polimero del glucosio, determinante per la rigidità della parete cellulare fungina. Tali farmaci alterano e destabilizzano la struttura della parete e come risultato finale, si ha la lisi cellulare. Presentano, quindi, un’azione fungicida. Sono scarsamente attive nei confronti di funghi con ridotto contenuto di glucani. Le echinocandine sono lipopeptidi di notevole interesse terapeutico con effetto nei confronti di specie del genere Candida, produttori di slime, in particolar modo su C.
albicans (Kuhn, et al., 2002; Kuhn, and Ghannoum, 2004; Mukherjee, and
Chandra, 2004; Ramage, et al., 2001; Seneviratne, and Samaranayake, 2008).
Introduzione, 25
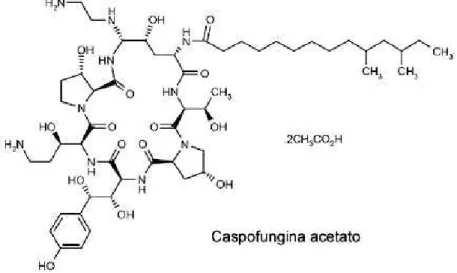
Figura 7 A. Caspofungina, la prima echinocandina prodotta, attiva contro alcune specie di Candida e Aspergillus.
B. Anidulafungina, echinocandina semi–sintetica, con attività fungicida nei confronti di varie specie del genere Candida.
Introduzione, 26
C. Micafungina, echicandina indicata nel trattamento di varie infezioni fungine.
Poliossine: gruppo di farmaci che agiscono bloccando la sintesi della chitina.
Antimetabolici: la 5-fluorocitosina agisce come inibitore della sintesi sia del DNA che dell’ RNA tramite conversione intracitoplasmatica (la 5-fluorocitosina viene deaminata) in 5-fluorouracile. All’interno delle cellule fungine il 5-fluorouracile, una volta incorporato provoca un blocco della sintesi di acidi nucleici. Questo composto, relativamente poco tossico, ha la peculiarità di oltrepassare la barriera ematoencefalica rendendo il farmaco un antifungino di elezione per la terapia delle meningiti sostenute da
Candida, Aspergillus, Cryptococcus neoformans. Spesso è utilizzato in
Introduzione, 27
1.4.1
Suscettibilità delle specie del genere Candida ai
farmaci antifungini
La valutazione della sensibilità in vitro ai farmaci antimicotici sta assumendo un’importanza sempre maggiore, nell’ambito della scelta della terapia più adeguata, per studi sperimentali sullo sviluppo di farmaci e per il monitoraggio dell’andamento della resistenza mediante studi epidemiologici (Alexander et al, 2006; Spellberg et al, 2006; Pfaller 2005; Rex.et al., 2002). I metodi utilizzati per la valutazione della sensibilità in vitro delle specie del genere Candida approvati da CLSI (Clinical and Laboratory
Standard Institute) sono il sistema di micro diluizione in brodo (National
Committee for CLSI, 2002) e quello dell’agar diffusione (National Committee for CLSI, 2004).
C. albicans mostra, nei confronti di amfotericina B, una sensibilità
maggiore, rispetto a C. glabrata e C. krusei, infatti, per queste ultime specie sono infatti consigliati dosaggi di amfotericina B più elevati (Pappas et al., 2004; Spellberg et al., 2006). Casi di resistenza all’amfotericina B sono stati riscontrati anche nelle specie C. guilliermondii e C. rugosa (Pfaller. et al., 2007).
Gli azoli, in particolare i triazoli (fluconazolo, itraconazolo, voriconazolo e posaconazolo) sono considerati farmaci efficaci e sicuri nel trattamento delle candidosi invasive. Tra le 10 specie di Candida più frequentemente isolate (Pfaller et al., 2005; Pfaller et al., 2007), la resistenza a fluconazolo è bassa per C. albicans (0,8-1,5%), C. tropicalis (3-6,6%), C. parapsilosis (2-4,2%), C. lusitaniae (1,6-6,6%) e C. kefyr (0-5,7%), mentre sono stati registrati livelli più elevati di resistenza per C.
glabrata (14,3-22,8%), C. guilliermondii (6,3-26,1%), C. krusei (arrivando
anche al 40%), C. rugosa (14,3-66%) e C. famata (9,8-47,4%) (Pfaller et al., 2005). C. krusei è naturalmente resistente al fluconazolo.
Introduzione, 28
Come descritto precedentemente, C. glabrata presenta una intrinseca resistenza al fluconazolo ed è spesso associata ad infezioni sistemiche. C. glabrata spesso mostra ridotta suscettibilità, anche nei confronti degli altri triazoli, mentre C. guilliermondii, C. incospicua, C.
norvegensis risultano sensibili a voriconazolo, a differenza di C. rugosa,
resistente sia al fluconazolo, sia al voriconazolo (Pfaller, et al., 2005).
Una ridotta sensibilità alle echinocandine (anidulafungina, caspofungina, micafungina) da parte di alcune specie del genere Candida, è stata associata a mutazioni nel gene FKS1, che codifica il target delle echinocandine (Odds et al., 2004; Pfaller et al., 2006). In particolare, le specie C. albicans, C. glabrata, C. tropicalis sono generalmente suscettibili a questa classe di farmaci, a differenza di C. parapsilosis e C. guilliermondii, le cui MIC possono arrivare a 4 µg/ml (Mora-Duarte et al., 2002).
Negli ultimi anni, è stata osservata una elevata frequenza di isolamento di C. parapsilosis in Spagna e in America Latina (Lockhart et al., 2008) Delle tre specie del gruppo”psilosis”, sono stati riportati casi di infezioni ematiche da parte di C. orthopsilosis e C. metapsilosis (Gomez-Lopez et al., 2008; Lockart et al., 2008; Tavanti et al., 2007).
Studi riguardanti la suscettibilità agli antifungini di C. orthopsilosis e
C. metapsilosis (Gomez-Lopez et al., 2008; Tavanti et al., 2007; Van
Asbeck, et al., 2008) indicano che queste specie sono più suscettibili alle echinocandine e all’amfotericina B, ma meno sensibili al fluconazolo rispetto a C. parapsilosis. Riguardo all’attività della caspofungina nei confronti del gruppo “psilosis”, Varga e colleghi (2008) hanno indicato il seguente ordine di suscettibilità alla caspofungina: C. metapsilosis > C.
orthopsilosis > C. parapsilosis.
Uno studio multicentrico ha evidenziato come quasi tutte le specie di
Candida prese in esame venivano inibite da concentrazioni delle tre
echinocandine uguali o inferiori a 2 µg/ml, indipendentemente dalla distribuzione geografica di raccolta dei ceppi (Pfaller, et al., 2008).
Introduzione, 29
Inoltre, il 100% degli isolati fluconazolo-resistenti di C. krusei sono inibiti da concentrazioni di anidulafungina ≤ 0,5 µg/ml e anidulafungina, micafungina e caspofungina posseggono anche un’attività verso ceppi di C.
rugosa e C. incospicua fluconazolo-resistenti (Pfaller et al., 2006; Majoros et al., 2005).
1.5 LE INFEZIONI IN AMBITO NOSOCOMIALE
Negli ultimi decenni, è stato osservato un rapido aumento dell’incidenza delle infezioni fungine sistemiche (i cui agenti eziologici sono rappresentati non solo da specie del genere Candida) con percentuali drammaticamente in aumento nei paesi sviluppati (Dromer et al., 2004; Van Elden et al., 2000) mentre in altri paesi, Africa sub-sahariana (French N et
al., 2002; McCarthy KM, et al., 2006) e in zone dell’Asia si continuano a
osservare, costantemente, frequenze elevate (Klotz et al., 2007; Kumarasamy et al., 2003).
Le specie del genere Candida rappresentano il più comune agente fungino nel reparto di terapia intensiva, tra i riceventi il trapianto di midollo osseo o di organo solido (Wisplinghoff, et al., 2004; Trick, et al., 2002; Pappas, et al., 2003; Pappas, et al., 2004). In tali pazienti, le candidemie sono associate ad un elevato tasso di mortalità (dal 10 al 49%) e da una permanenza ospedaliera dei soggetti colpiti che può variare tra i 3 e i 30 giorni (Gudlaugsson et al., 2001; Morgan et al., 2005; Zaoutis et al., 2005; Wey et al., 1988).
Introduzione, 30
1.5.1
Correlazione tra le micosi e alcuni reparti
dell’Azienda Ospedaliera Universitaria Pisana
1.5.1.1 Reparto centro ustioni
Per quanto concerne l’incidenza di infezioni fungine sistemiche e conseguente mortalità tra i pazienti ustionati, dati in letteratura sottolineano come specie del genere Aspergillus e Candida rappresentino le più comuni specie fungine riscontrabili in tale gruppo di pazienti (Blot e Vandewoude, 2004; Vandewoude, et al., 2006; Murray, et al., 2008).
Altri funghi opportunisti considerati patogeni emergenti includono i generi Alternaria, Fusarium, Mucor e microrganismi considerati una volta come contaminanti di laboratorio, quali Penicillium e Cladosporium (De Hoog, et al., 2000).
Nei pazienti ustionati, la mortalità delle infezioni causate dai generi
Mucor, Fusarium, Aspergillus e Candida è stata stimata pari a 100%, 86%,
62%, 60%, rispettivamente (Schofield, et al., 2007)
La non integrità, che costituisce un importante meccanismo di difesa aspecifico, favorisce nei soggetti gravemente ustionati la diffusione dell’infezione, con possibile insorgenza di sepsi (Richard., et al., 2001; Schwacha, 2003). Specie del genere Candida risultano essere i più comuni agenti di sepsi fungine in questi individui (Wisplinghoff, et al., 2004).
Inoltre, il catetere venoso centrale rappresenta un ulteriore fattore di rischio per sviluppare infezioni invasive (Richards., et al., 2001; Pruitt, et al., 1998).
Nei soggetti ustionati, il sito più comune di infezione è la zona ustionata sebbene ci sia anche il rischio di infezione del tratto respiratorio, urinario e gastro–intestinale (Gallagher, Williams–Bouyer, Villarreal, et al., 2007).
Introduzione, 31
1.5.1.2 Reparto di medicina generale
Il reparto di medicina generale si occupa di pazienti affetti da malattie inerenti la medicina interna e la geriatria, in particolare patologie cardiovascolari, pneumologiche, ematologiche, oncologiche.
Le micosi si instaurano, infatti, in conseguenza dell’alterazione dell’equilibrio bio-fisiologico dell’individuo: neoplasie, tumori di organi solidi o leucemie e l’uso di presidi sanitari invasivi, quali catetere venoso centrale, catetere vescicale, drenaggi, sondini sono tutte condizioni che consentono il superamento della barriera cutanea, la quale può contribuire all’insorgenza di infezioni fungine.
Nei reparti di medicina generale, possiamo trovare soggetti neutropenici che ricevono chemioterapia e quelli non neutropenici, con cicli ripetuti di terapia antibiotica ad ampio spettro e/o pazienti che ricevono una alimentazione per via endovenosa; le linee venose e l’apparato gastro-enterico possono infatti rappresentare usuale porta d’ingresso per i funghi.
Ulteriori fattori di rischio per l’insorgenza di infezioni fungine riguardano tutte le condizioni disfunzionali metaboliche.
1.5.1.3 Reparto infezioni nei diabetici, ambulatorio piede
diabetico
Nell’ambito dello studio delle malattie metaboliche, in particolare del diabete mellito di tipo 1 e 2 si è sviluppato un reparto dedicato allo studio della patologia del piede diabetico. Le condizioni di microangiopatia, infatti, espongono tale categoria di pazienti a manifestazioni cliniche spesso inusuali. In questo tipo di affezioni si potrebbero in teoria identificare anche specie microbiche o fungine, raramente descritte in letteratura come agente eziologico di infezione.
Introduzione, 32
In tutto il mondo ci sono circa 60.000.000 di persone affette da diabete di tipo 1 o di tipo 2: in tali soggetti possono svilupparsi infezioni batteriche e fungine, nelle zone di cute ulcerata (Gupta, et al., 1999; Dogra,
et al., 2002). Le infezioni del piede diabetico rappresentano una
complicanza cronica del diabete che interessa circa il 15% dei pazienti, almeno una volta nel corso della loro vita.
1.5.1.4 Reparto di pneumologia endoscopica ambulatoriale
I principali agenti fungini responsabili di infezioni respiratorie comprendono funghi patogeni, come ad esempio Histoplasma capsulatum,
Cryptococcus neoformans e miceti opportunisti, quali le specie appartenenti
ai generi Aspergillus, Candida, Mucor.
In soggetti immunodepressi che presentano malattie ematologiche le candidosi respiratorie sono particolarmente frequenti.
Una riduzione nel numero dei polimorfonucleati neutrofili espone maggiormente l’individuo ad agenti patogeni invasori.
I farmaci citotossici aumentano la suscettibilità alle infezioni per leucopenia e trombocitopenia, causano una depressione della risposta immunitaria cellulo-mediata e inoltre determinano un'alterazione della risposta infiammatoria. La leucopenia è causa della maggiore parte delle infezioni opportuniste.
I corticosteroidi sono farmaci immunosoppressori che possono riattivare una tubercolosi polmonare quiescente, l'istoplasmosi, la coccidioidomicosi e la blastomicosi. Pazienti in trattamento corticosteroideo (specialmente se ad alto dosaggio) sono più suscettibili a sviluppare infezioni batteriche e/o fungine.
I pazienti affetti da infezione polmonare fungina a livello polmonare possono presentare una sintomatologia non specifica, senza segni o sintomi clinici caratteristici.
Introduzione, 33
1.6 OGGETTO E SCOPO DELLA TESI
Negli ultimi decenni è stato osservato un incremento nella frequenza di infezioni fungine, in ambito nosocomiale. Nonostante il grande impulso rivolto al potenziamento di nuove e più rapide tecniche diagnostiche per l’identificazione dei miceti, ancora lacunose sono le informazioni relative alla epidemiologia delle infezioni fungine nel nostro paese.
In tale ottica, in questo studio, è stata condotta un’analisi epidemiologica sulla frequenza di isolamento delle principali specie di lievito in pazienti ospedalizzati presso alcuni reparti del Presidio Ospedaliero di Cisanello (Pisa). In particolare, i reparti comprendevano: il centro ustioni, alcuni reparti di medicina generale, l’ambulatorio del piede diabetico e infine il reparto di pneumologia ambulatoriale endoscopica.
I campioni biologici esaminati comprendevano campioni respiratori, ematici, tamponi biologici e materiali vari, quali punte di catetere e urine.
Nel periodo agosto 2010-aprile 2011, sono stati collezionati 163 ceppi di lievito appartenenti a specie del genere Candida e Saccharomyces. Per ogni ceppo isolato ed identificato nei campioni biologici veniva successivamente eseguito l’antimicogramma, ovvero la valutazione della sensibilità/resistenza del lievito ai principali farmaci antimicotici.
Gli antifungini analizzati comprendevano gli azoli (posaconazolo, voriconazolo, fluconazolo, itraconazolo), le echinocandine (anidulafungina, caspofungina, micafungina), l’amfotericina B e la 5-fluorocitosina.
Successivamente, i ceppi di C. parapsilosis sono stati sottoposti ad una indagine retrospettiva, condotta su base molecolare, per identificare l’eventuale presenza anche delle specie C. metapsilosis e C. orthopsilosis. Queste ultime specie appartengono al gruppo”psilosis” e non sono distinguibili da C. parapsilosis con i comuni metodi diagnostici, basati su indagine biochimica.
Questo studio è stato svolto presso l’Unità Operativa di Microbiologia dell’Azienda Ospedaliera Universitaria Pisana e la caratterizzazione
Introduzione, 34
molecolare delle specie del gruppo “psilosis” presso il Dipartimento di Biologia dell’Università di Pisa.