L’Atomo di Carbonio a
ed i suoi Idrogeni
CH3CH2CH2CH O a b gOltre il carbonio carbonilico
c’è un altro centro reattivo nella molecola di una aldeide o di un chetone
L’atomo di riferimento è il carbonio carbonilico Gli altri atomi di carbonio sono designati a, b, g,
etc. sulla base della loro posizione rispetto al carbonio carbonilico.
Gli atomi di idrogeno sono indicati con la stessa lettera greca del carbonio a cui sono legati.
Terminologia CH3CH2CH2CH O a b g
Acidità degli Idrogeni
a
O •• R2C CR' • • H pKa = 19-20 + H+ R2C CR' O •• • • • • – •• R2C CR' O • • – •• Ione enolato Gli Idrogeni in a sono acidi perchè:
Il carbonile adiacente esercita un effetto induttivo elettron-attrattore che indebolisce il legame C-H l’anione risultante risulta
stabilizzato dalla risonanza
Acidità Relativa di Composti Carbonilici ed Acilici
aldeide chetone estere alcano
pKa ~17 ~19 ~25 ~50 H C CH O H R C CH O H RO C CH O H C H H R H
Enolizzazione
+ H+ R2C CR' O •• • • • • – •• R2C CR' O • • – •• Ione enolato
R
2C
CR'
H
O
R2C CR' OH + H+ + H+ Forma chetonica Forma enolica - H+ - H+Ogni composto carbonilico avente un atomo di H sul carbonio in a si equilibra con l’enolo corrispondente
Nei composti monocarbonilici l’equilibrio è spostato a favore della forma carbonilica
La percentuale di forma enolica è abitualmente molto piccola
La forma chetonica (carbonilica) è di solito 45-60 kJ/mol più stabile della forma enolica
Concentrazione della Forma Enolica
R2CHCR' O R2C CR' OH enolo chetone
Contenuto di Enolo CH3CH O H2C CH OH K = 3 x 10-7 CH3CCH3 O H2C CCH3 OH K = 6 x 10-9
2,4-Cicloesadienone? O H H H H H H OH H H H H H
La forma carbonilica è meno stabile di quella enolica
La forma carbonilica non è aromatica
La forma enolica è aromatica: FENOLO!
1,3-Dichetoni (
b
-dichetoni)La forma carbonilica è meno stabile di quella enolica
CH3CCH2CCH3 O O CH3C OH CHCCH3 O (20%) (80%) Esempio: 2,4-pentandione
Forma enolica del 2,4-pentandione 103 pm 133 pm 134 pm 141 pm 124 pm 166 pm H3C C C C CH3 H O O H
C=C e C=O sono coniugati
Meccanismo della Enolizzazione (generale) O •• CR' • • R2C H R2C CR' O •• • • H Tautomeria Cheto-Enolica
Meccanismo della Enolizzazione (catalisi basica) O •• R2C CR' H O H • • • • •• – • •
Meccanismo della Enolizzazione (catalisi basica) H O H • • •• O •• R2C CR' – • • • • O H H • • ••
Meccanismo della Enolizzazione (catalisi basica) O H H • • O •• R2C CR' – • • • • ••
Meccanismo della Enolizzazione (catalisi basica) H O •• R2C CR' • • O H • • – • • ••
Meccanismo della Enolizzazione (catalisi acida) O H H • • H R2C H O •• CR' • • +
Meccanismo della Enolizzazione (catalisi acida) O •• R2C CR' • • H O H H • • H +
Meccanismo della Enolizzazione (catalisi acida) O •• R2C CR' H H +
Meccanismo della Enolizzazione (catalisi acida) O •• R2C CR' H H + O H H • • • •
Meccanismo della Enolizzazione (catalisi acida) H O H H • • + O •• R2C CR' H • •
I
b
-Dichetoni sono molto più acidi CH3CCH2CCH3 O O pKa = 9 H3C C CH3 O C C O H H H3C C CH3 O C C O H H+ + •• – Ka = 10–9H3C C CH3 O C C O H •• –
I
b
-Dichetoni sono molto più acidi• L’enolato di un
b
-dichetone è
stabilizzato dall’effetto di 2 gruppi
carbonilici
• la carica negativa è delocalizzata su
entrambi gli atomi di ossigeno
I
b
-Dichetoni sono molto più acidi H3C C CH3 O C C O H •• – •• • • •• • • H3C C CH3 O C C O H – •• • • •• • • • •I
b
-Dichetoni sono molto più acidi H3C C CH3 O C C O H •• – •• • • •• • • H3C – H C CH3 O C C O •• • • •• • • • • H3C C CH3 O C C O H – •• • • •• • • • •Alcune Conseguenze Chimiche e
Stereochimiche
Conseguenze Stereochimiche della Enolizzazione C CC6H5 O H CH3CH2 H3C 100% R H3O+ H2O, HO– 50% R 50% S 50% R 50% S
O •• CR' • • R2C H R2C CR' O •• • • H Enolo achirale
L’enolo è achirale C CC6H5 O H CH3CH2 H3C R CC6H5 OH C H3C CH3CH2
L’enolo è achirale C CC6H5 O H CH3CH2 H3C R CC6H5 OH C H3C CH3CH2 C CC6H5 O H CH3CH2 H3C S 50% 50%
Risultati degli Studi Cinetici C CC6H5 O H CH3CH2 H3C
– Uguale velocità per: racemizzazione scambio H-D bromurazione iodurazione
•L’enolo è l’intermedio e
la sua formazione è
controlla la velocità di
reazione (stadio lento)
Ione enolato (ed enolo) potenziali nucleofili R2C CR' O •• • • • • – •• R2C CR' O • • – •• Ione enolato enolo
.
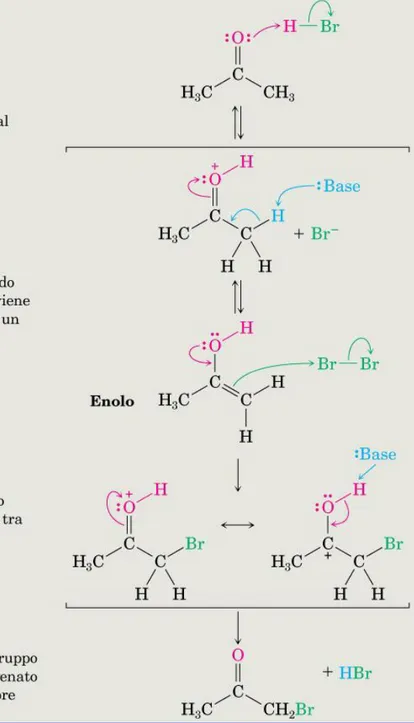
Figura 22.4 MECCANISMO:
Meccanismo della Alogenazione
catalizzata dalle basi
O •• R2C CR' H O H • • • • •• – • •
Meccanismo della Alogenazione
catalizzata dalle basi
H O H • • •• O •• R2C CR' – • • • •
Meccanismo della Alogenazione
catalizzata dalle basi
O •• R2C CR' – • • • • Br-Br
Meccanismo della Alogenazione
catalizzata dalle basi
O •• R2C CR' • • Br
Gli anioni enolato sono nucleofili e reagiscono con gli alogenuri alchilici
La reazione di alchilazione di semplici enolati, in generale, non è molto efficace perchè in presenza di basi deboli, la compresenza del carbonile e del suo enolato può provocare una reazione di condensazione aldolica
Impieghi Sintetici di Anioni Enolato in Reazioni SN2
In alternativa si può realizzare la reazione di a alchilazione tramite la formazione di enammine, oppure si utilizza una base molto forte che determina la
trasformazione quantitativa del composto carbonilico nel suo enolato
Base impiegata per la formazione quantitativa dello ione enolato
O •• R2C CR' – • • • • R-X O •• R2C CR' • • R
Gli enolati stabilizzati derivati da composti
b-dicarbonilici possono essere alchilati molto efficientemente
Esempio CH3CCH2CCH3 O O + CH3I K2CO3 CH3CCHCCH3 O O CH3 (75-77%) H3C C CH3 O C C O H •• – Via:
Scambio Idrogeno-Deuterio O H H H H + 4D2O O D D D D + 4DOH KOD, calore
Meccanismo OD • • – •• •• + HOD •• •• + H O H H • • •• • • – O H H H • • •• H
Meccanismo H O H H • • •• • • –
Meccanismo OD • • – •• •• + H O H H • • •• • • – O H H D • • •• H OD •• •• D
Una soluzione basica contiene quantità comparabili di aldeide e del suo enolato.
Le aldeidi subiscono addizioni nucleofile al carbonile. Gli anioni enolato sono nucleofili.
Cosa possiamo dire dell’addizione nucleofila dell’enolato all’aldeide? RCH2CH O + OH •• •• • • – RCHCH O + HOH •• •• – •• pKa = 16-20 pKa = 16
•• RCHCH O •• • • – RCH2CH O •• • •
•• RCHCH O •• • • – RCH2CH O •• • • – RCH2CH O •• • • •• • • RCHCH O • • RCH2CH O •• •• • • RCHCH O • • H
•• RCHCH O •• • • – RCH2CH O •• • • – RCH2CH O •• • • •• • • RCHCH O • • •• RCH2CH O •• • • RCHCH O • • H 2RCH2CH O NaOH RCH2CH OH CHCH O R
La reazione porta alla formazione di un nuovo legame C-C Il prodotto della reazione è chiamato "aldolo" perchè
contiene una funzione aldeidica ed una alcolica
Addizione o Condensazione Aldolica
RCH2CH OH
CHCH
O
Condensazione aldolica dell’acetaldeide (etanale) Acetaldolo (50%) NaOH, H2O 5°C 2CH3CH O CH3CH OH CH2CH O
Condensazione aldolica del butanale (75%) KOH, H2O 6°C 2CH3CH2CH2CH O CH3CH2CH2CH OH CHCH O CH2CH3
2RCH2CH O NaOH RCH2CH OH CHCH O R Condensazione Aldolica
2RCH2CH O NaOH RCH2CH OH CHCH O R Condensazione Aldolica Deidratazione dell’aldolo
2RCH2CH O NaOH RCH2CH OH CHCH O R Condensazione Aldolica calore RCH2CH CCH O R Deidratazione dell’aldolo enale
2RCH2CH O NaOH RCH2CH OH CHCH O R Condensazione Aldolica calore RCH2CH CCH O R NaOH calore Deidratazione dell’aldolo enale
Condensazione aldolica del butanale
NaOH, H2O 80-100°C 2CH3CH2CH2CH
Condensazione aldolica del butanale (86%) NaOH, H2O 80-100°C 2CH3CH2CH2CH O CH3CH2CH2CH CCH O CH2CH3
La disidratazione di
b
-idrossi aldeidi può essere catalizzata sia da acidi che da basiDisidratazione del Prodotto di Addizione Aldolica
C O C C OH H C O C C
In soluzione basica si forma lo ione enolato
Disidratazione del Prodotto di Addizione Aldolica
OH H C O C C NaOH OH C O C C • • –
L’enolato elimina idrossido e forma l’aldeide a,b -insatura
Disidratazione del Prodotto di Addizione Aldolica
OH H C O C C NaOH OH C O C C • • –
La Reazione di Eliminazione E1cB
Nella reazione E1 il primo stadio (lento) è la formazione del carbocatione per distacco del gruppo uscente,
seguito dall’eliminazione del protone
Nella reazione E1cB si verifica prima la rimozione di un protone con formazione di un anione (stabilizzato), che successivamente elimina il gruppo uscente
E1cB:
Eliminazione
unimolecolare (1)
Base