Capitolo 1 : Introduzione
1.1 Il muscolo scheletrico
1.1.1 Organizzazione e struttura del muscolo scheletrico
I muscoli scheletrici costituiscono circa il 40% del peso corporeo e sono formati da fasci di cellule muscolari, dette fibre muscolari, a causa della loro forma allungata. Le fibre muscolari scheletriche sono costituite da più nuclei immersi in un citoplasma comune, derivati, durante lo sviluppo embrionale, dalla fusione di elementi mononucleati, i mioblasti. I mioblasti, infatti, si fondono in elementi sinciziali detti miotubi, che in seguito si differenziano in fibre muscolari incapaci di moltiplicarsi. Successivamente, nelle fibre muscolari mature, i nuclei sono confinati alla periferia, in prossimità della membrana plasmatica o sarcolemma.
In un muscolo le fibre muscolari sono disposte parallelamente le une alle altre e connesse tra loro per mezzo di un tessuto connettivo fibrillare detto stroma muscolare. Il connettivo che riveste esternamente il muscolo scheletrico è detto epimisio e da esso si dipartono setti connettivali che si approfondano nel muscolo e suddividono i fasci di fibre, avvolgendoli e costituendo il perimisio. Dal perimisio, che inguaina ogni singolo fascio, si dipartono setti molto esili che si spingono tra le singole fibre muscolari, costituendo l’endomisio. L’endomisio costituisce la membrana basale di ciascuna fibra muscolare ed è formato da una trama di fibre reticolari, capillari sanguigni e qualche cellula connettivale (Rosati e Colombo, 1997). Grossi vasi ematici e nervi entrano nell’epimisio e si dividono per ramificarsi in tutto il muscolo, attraverso il perimisio e l’endomisio (Young e Heath, 2001).
Le fibre muscolari mostrano una lunghezza che può raggiungere in certi muscoli alcuni centimetri, e spessore variabile da 10 a 100 µm in rapporto all’età, allo stato di nutrizione e all’attività cui il muscolo è sottoposto (Pasqualino e
Panattoni, 2005). La membrana plasmatica della fibra, detta sarcolemma, ha un sottile spessore di circa 8 nm ed è circondata da una membrana basale dello spessore di circa 80 nm. Localizzate tra la membrana plasmatica e la membrana basale della fibra sono presenti le cellule staminali adulte del muscolo scheletrico, dette, a causa della loro localizzazione, cellule satelliti (Mauro, 1961). Esse risiedono nel muscolo in uno stato quiescente, e quando richiesto sono in grado di attivarsi, differenziare a mioblasti, che si fondono tra loro, o eventualmente con le fibre danneggiate, per dare origine a nuove fibre muscolari (Rudnicki, 2004).
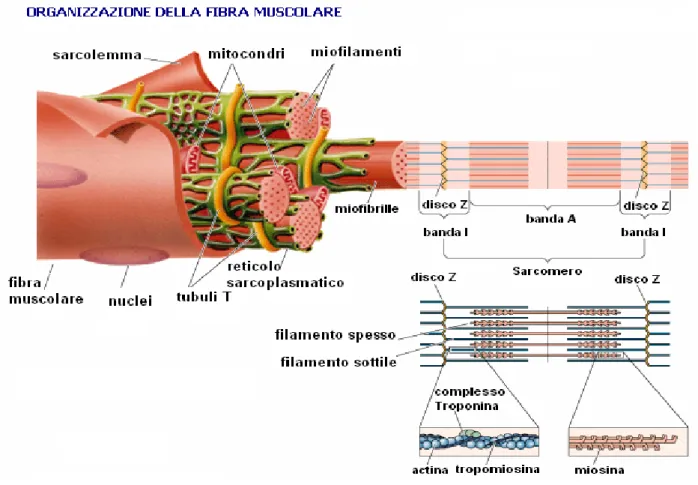
La struttura altamente organizzata ed allineata delle fibre muscolari è indispensabile ad esplicare la sua più importante funzione, la contrazione. Il citoplasma della fibra è detto sarcoplasma e all’interno di questo si trovano diversi organelli, come l’apparato di Golgi, il reticolo sarcoplasmatico, mitocondri disposti in coppie o in file longitudinali, oltre a granuli di glicogeno e gocce di lipidi utilizzati come substrato energetico. La maggior parte del citoplasma consiste di strutture filamentose e cilindriche, dette miofibrille, che percorrono la fibra muscolare per tutta la sua lunghezza, parallele tra loro e all’asse longitudinale della fibra. Esse sono costituite da piccole unità contrattili, chiamate sarcomeri, contenenti le proteine contrattili in una disposizione ordinata tale da conferire alla fibra muscolare scheletrica la tipica striatura regolare in senso trasversale. In sezioni traverse della fibra muscolare, esse appaiono come piccoli punti, molto fitti (circa 100 milioni per cm2); in sezione longitudinale, le miofibrille presentano una regolare alternanza di bande trasversali che, essendo allineate sempre sulla stessa linea determinano la striatura trasversale della fibra (Pasqualino e Panattoni, 2005). La banda A (scura) è dotata di un’intensa attività ATPasica e presenta una striscia centrale più chiara, detta H. La banda I (chiara) è divisa in due metà da una linea scura trasversale, detta linea o striscia Z. Il sarcomero, che rappresenta l’unità contrattile della fibra muscolare ha una lunghezza di circa 2,5 µm ed è il tratto compreso tra due linee Z della miofibrilla. Il reticolo sarcoplasmatico avvolge completamente ciascuna delle
miofibrille ed è costituito da una rete di tubuli situato nel sarcoplasma delle fibre muscolari e formata da due componenti: il sistema L e il sistema T. Il sistema L è il reticolo sarcoplasmatico liscio della fibra muscolare, è composto da tubuli longitudinali, anastomizzati tra di loro, che decorrono attorno alle miofibrille; il sistema T è composto da tubuli trasversali, in continuità tra loro. Ogni tubulo T, con i due elementi associati di ramificazioni del reticolo sarcoplasmatico, chiamate cisterne terminali, forma una triade a livello della giunzione fra le bande I e A di ogni sarcomero (Young e Heath, 2000) Fig.1.
Al microscopio elettronico, le miofibrille risultano composte da 2 tipi di microfilamenti formati da proteine contrattili: i miofilamenti spessi e i miofilamenti sottili. I miofilamenti spessi sono costituiti da molecole di miosina II (caratterizzate da un elevato peso molecolare di circa 480.000 Dalton), ciascuna delle quali è formata da 2 catene pesanti (200.000 Dalton) e 4 leggere (20.000 Dalton), mentre i miofilamenti sottili sono costituiti dalle proteine F-actina, tropomiosina e troponina. La F-actina è una proteina filamentosa, formata da due polimeri avvolti ad elica della proteina globulare G-actina nella isoforma α; la tropomiosina è formata da due polimeri avvolti ad elica, costituiti dall’unione testa-coda di molecole lunghe circa 40 nm, ciascuna delle quali è unita a una molecola di troponina. Quest’ultima è una proteina globulare formata da 3 subunità: TnT per l’interazione con la tropomiosina, TnA per l’interazione con l’actina e TnC per l’interazione con il calcio.
Il sistema di membrane specializzato costituito dai tubuli T e dal reticolo sarcoplasmatico ha un ruolo chiave nell’accoppiamento fra eccitazione e contrazione del muscolo. Durante il processo di contrazione i filamenti sottili scorrono lungo i filamenti di miosina determinando l’accorciamento del sarcomero. Questo movimento è determinato dalle presenza nelle molecole di miosina di strutture a forma di “gancio” con una testa in grado di legarsi ad un sito specifico della molecola di actina. Tale movimento avviene grazie all’apporto energetico di molecole di ATP e all’intervento di ioni Ca2+ (Tupling, 2004). Quando il potenziale
d’azione proveniente dagli assoni dei motoneuroni arriva ai terminali pre-sinaptici della giunzione neuromuscolare, il neurotrasmettitore acetilcolina viene rilasciato e propagato attraverso i tubuli T determinando la liberazione di ioni calcio dal reticolo endoplasmatico nel citoplasma. Nella prima fase l’ATP si lega alla testa della miosina, che si trova inizialmente in una configurazione a bassa energia, e viene scisso da quest’ultima in ADP e un gruppo fosfato, rilasciando l’energia che consente alla testa di muoversi. Nel frattempo gli ioni Ca2+, legandosi alla proteina regolatrice troponina, determinano lo spostamento della tropomiosina dal sito di legame dell’actina. In tal modo la testa della miosina è in grado di legarsi all’actina in una configurazione ad alta energia detta a “ponte crociato”, e, grazie al rilascio di ADP e del gruppo fosfato, la testa della miosina “tira” l’actina determinando il suo scorrimento verso il centro del sarcomero. Fino a quando un’altra molecola di ATP non si lega alla testa della miosina, quest’ultima rimane legata nella configurazione a ponte crociato; in presenza di un’altra molecola di ATP, il meccanismo di scorrimento si ripete determinando il progressivo accorciamento del sarcomero e, in definitiva, dell’intera miofibrilla e della fibra muscolare. Durante questo processo i filamenti sottili scorrono su quelli spessi, fino a sovrapporsi parzialmente, senza un accorciamento né dei filamenti di actina né di quelli di miosina; le linee Z invece si avvicinano.
In base al tipo di motoneuroni che le innervano, le fibre muscolari si distinguono rispettivamente in lente, per una contrazione duratura, e veloci, per una contrazione rapida. Dal punto di vista ultrastrutturale, tali fibre si distinguono in fibre muscolari denominate rosse perché ricche di mioglobina nel sarcoplasma a contrazione lenta, e bianche, per la presenza di una quantità inferiore di mioglobina, a contrazione rapida. Pertanto, i muscoli con prevalenza di fibre rosse possono contrarsi a lungo senza affaticarsi, come nel mantenimento del tono muscolare ai fini della stazione eretta. Al contrario le fibre bianche, che contengono un numero minore di mitocondri e hanno una minore attività respiratoria cellulare, tendono
all’accumulo di acido lattico nel sarcoplasma, con conseguente abbassamento del pH cellulare e affaticamento muscolare. Ciò comporta la cessazione della capacità del muscolo di contrarsi ulteriormente oppure la generazione di contrazioni spasmodiche (Pasqualino e Panattoni, 2005).
Fig. 1 Organizzazione della fibra muscolare (www.bodyweb.com)
1.1.2 Sviluppo embrionale del muscolo scheletrico
Durante lo sviluppo embrionale, tutti i muscoli scheletrici, ad eccezione di quelli della testa, derivano da precursori cellulari mesodermici che originano dai somiti, condensazioni di mesoderma parassiale localizzati ai lati del tubo neurale. In particolare, i somiti sono specializzati per produrre il dermomiotomo, da cui origineranno la pelle e il muscolo scheletrico, e lo sclerotomo, da cui prenderà origine lo scheletro (Shi e Garry, 2010). Durante l’embriogenesi i precursori
mesodermici del dermomiotomo migrano al di sotto di esso per generare il miotomo che darà origine al muscolo scheletrico. Questi precursori vengono indirizzati verso la linea miogenica in un processo altamente complesso che viene regolato da numerosi fattori di crescita e di trascrizione. Tra i fattori di trascrizione, un ruolo cruciale è detenuto dai fattori paired-box (Pax) e dalla famiglia proteica myogenic regulatory factors (MRFs), che comprende MyoD, Myf5, myogenin e MRF4 (Myf4).
Il fattore di trascrizione Pax3 interviene nella migrazione dei precursori muscolari alla formazione del miotomo. Esso induce l’espressione del recettore tirosin chinasico c-met a cui si legano il fattore di crescita dei fibroblasti (FGF) e il fattore di crescita degli epatociti (HGF) che danno il segnale di inizio per la migrazione (Punch et al. 2009). Una volta raggiunta la sede opportuna, i precursori miogenici ricevono dei segnali dai tessuti circostanti che inducono l’espressione dei MRFs primari, Myf5 e MyoD, responsabili dell’inizio della miogenesi. E’ ormai documentato il ruolo dei segnali Wnt e sonic hedgehog (Shh) nell’attivazione di Pax3 e conseguentemente di Myf5 e MyoD (Punch et al. 2009).
Le cellule miogeniche positive ai MRFs primari sono i mioblasti, cellule mononucleate che costituiscono i veri e propri precursori delle fibre muscolari. Dopo un periodo di proliferazione mitotica, in seguito all’attivazione degli MRFs tardivi, Myogenin e MRF4, i mioblasti attivano il differenziamento terminale a miociti, che esprimono anche geni muscolo-specifici come la catena pesante della miosina (MHC) e la creatina chinasi del muscolo (MCK) (Kalaraki, 2009). In presenza di opportuni stimoli, i miociti sono in grado di fondersi tra loro formando cellule multinucleate allungate, dette miotubi. La fusione coinvolge specifiche molecole di adesione cellula-cellula, come M-caderina e M-calpaina, che mediano il riconoscimento tra mioblasti differenziati. Avvenuta la fusione, inizia la sintesi delle proteine contrattili e i miotubi si organizzano in fibre muscolari (Young e Heath, 2000; Alberts, 2004). Durante l’ultima fase della miogenesi embrionale una parte dei
precursori cellulari fallisce nel completamento del differenziamento e rimane associata alla fibra muscolare in uno stato indifferenziato quiescente. Tali cellule prendono il nome di cellule satelliti. Esse funzionano nell’adulto da riserva di mioblasti. Infatti, in seguito a danno muscolare, escono dal loro stato di quiescenza, si attivano e proliferano, fungendo da compartimento staminale nel muscolo scheletrico adulto (Alberts, 2004). E’ l’intervento di un altro fattore di trascrizione Pax, Pax7, a regolare la specificazione dei precursori miogenici a cellula satellite (Punch, 2009; Kalaraki, 2009).
Una volta formate, le fibre muscolari crescono, maturano e modificano le loro caratteristiche secondo richieste funzionali specifiche. Infatti, le fibre sono in grado di produrre differenti isoforme delle componenti dell'apparato contrattile in risposta alle diverse richieste di velocità, allungamento e resistenza della contrazione muscolare nel feto, nel neonato e nell'adulto. Nella fase di crescita della massa muscolare post-natale, si ha un ingrandimento delle fibre, dovuto ad un aumento della lunghezza e/o larghezza delle fibre stesse. La crescita in lunghezza è dovuta al reclutamento di mioblasti in fibre multinucleate preesistenti, mentre l'allargamento è il risultato sia del reclutamento di mioblasti che dell'aumento di grandezza e numero delle miofibrille dell'apparato contrattile (Alberts, 2004).
1.1.3 Rigenerazione del muscolo scheletrico
Il tessuto muscolare scheletrico possiede la capacità di rigenerare nuove fibre, giornalmente o in seguito ad un danno tessutale. Fisiologicamente si tratta di un tessuto stabile che richiede un basso ricambio di mionuclei, ma in seguito ad un danno grave, come eccessivo esercizio fisico, traumi e malattie distrofiche, è in grado di effettuare una rapida ed estensiva rigenerazione. La rigenerazione del muscolo è un evento altamente sincronizzato a cui prendono parte diversi meccanismi molecolari e cellulari (Karalaki, 2009).
Nella sua totalità il processo di rigenerazione può essere suddiviso in due fasi distinte, degenerazione e rigenerazione, che sono finemente orchestrate e coinvolgono numerosi fattori. La prima fase di degenerazione è caratterizzata dalla necrosi del tessuto danneggiato e dall'attivazione di una risposta infiammatoria; a questa fase segue quella degenerativa caratterizzata da una rapida risposta delle cellule miogeniche pronte a proliferare, differenziare e fondersi tra loro per formare nuove fibre e quindi ristabilire l'apparato funzionale contrattile. La chiave di questo processo sono le cellule satelliti presenti nel tessuto muscolare che presiedono alla crescita postnatale del muscolo, al rinnovamento e alla riparazione cellulare ma anche all'ipertrofia muscolare (Sirabella, 2012).
L'evento iniziale è generalmente caratterizzato dall'iniziale distruzione del sarcolemma delle miofibrille, con conseguente aumento di permeabilità della fibra stessa e rilascio di alcune proteine citosoliche, come ad esempio la creatinin fosfochinasi (CK), enzima che interviene nella produzione di creatina ed energia sotto forma di ATP. Oltre alle proteine citosoliche, anche proteine strutturali come la miosina fetale (MHC) e la troponina I vengono usati come marker del danno all’apparato contrattile (Karalaki, 2009). I neutrofili sono le prime cellule infiammatorie ad invadere la zone lesionata, con un significativo aumento del loro numero con il passare delle ore, fino un picco massimo dopo 6 ore dal danno. I neutrofili rilasciano elevate quantità di radicali liberi e proteasi per rimuovere i detriti cellulari, e citochine pro-infiammatorie per richiamare nella sede del danno i macrofagi. Questi ultimi, le cellule predominanti a 48 ore dal danno, invadono il tessuto danneggiato, fagocitano i detriti cellulari e rimuovono i miofilamenti distrutti, il sarcolemma e tutte le altre strutture citosoliche danneggiate.
La fase rigenerativa vera e propria viene attivata durante la fase di degenerazione ed avviene grazie alla presenza nel muscolo di una popolazione di cellule staminali muscolo-specifiche, dette cellule satelliti (Mauro, 1961). In seguito al danno queste cellule, che in condizioni fisiologiche si trovavano in uno stato
quiescente, si attivano, proliferano e differenziano in mioblasti. Più mioblasti si fondono tra di loro per dare origine a nuove fibre o con le fibre danneggiate per ripararle. Diversi segnali sono coinvolti nell’attivazione delle cellule satelliti, provenienti sia dalle fibre danneggiate che dall’infiltrato cellulare, tra cui il fattore di crescita degli epatociti (HGF), il fattore di crescita dei fibroblasti (FGF), il fattore di crescita insulino-simile (IGF) e l’ossido nitrico (NO) (Tidball, 2005). Le cellule satelliti che si attivano non sono solo quelle presenti nella zona ristretta al danno, ma tutte quelle presenti lungo la fibra, che sono in grado di migrare al di sotto della lamina basale per raggiungere il sito da rigenerare (Tedesco, 2010). Uno degli aspetti più importanti relativo all’attività delle cellule satelliti è la loro capacità di ricreare un pool di cellule satelliti quiescenti che siano in grado di sopportare eventuali altri cicli di rigenerazione.
Questa fase iniziale di rigenerazione è facilmente riconoscibile su sezione trasversale del muscolo, sia dal punto di vista morfologico, data la formazione di miofibrille rigeneranti di piccolo calibro e con mionuclei allocati nel centro; e mediante immunoistochimica per la positività a particolari marker come la myosin heavy chain (MHC) fetale che riflette la sintesi de novo delle fibre (Schultz, 1985).
Una volta che la fusione delle cellule miogeniche è completata e che il numero delle nuove miofibrille formatesi aumenta considerevolmente, i mionuclei cominciano a muoversi verso le zone periferiche delle fibre. In condizioni normali il muscolo rigenerato è morfologicamente e funzionalmente indistinguibile da un muscolo sano, mai danneggiato (Hall-Crags, 1974). Al contrario, in presenza di un processo di rigenerazione anormale, e’ possibile osservare fibre che si dividono o si ramificano a causa di un’incorretta fusione delle fibre rigeneranti con la lamina basale, come accade nei muscoli dei pazienti che soffrono di disordini neuromuscolari e nei muscoli ipertrofici.
In aggiunta alle cellule satelliti, in realtà, sono stati identificati anche altri precursori in grado di differenziare verso la linea miogenica. Le cellule mSP
(muscolar Side Population cell), ad esempio, in vitro non sono in grado di sottoporsi a differenziamento miogenico, ma in seguito ad un trapianto intramuscolare, danno luogo sia a cellule muscolari differenziate che cellule satelliti (Gussoni, 1999; Asakura,2002). Inoltre, a differenza delle cellule satelliti, le mSP trapiantate per via endovenosa migrano attraverso il flusso sanguigno fino al muscolo malato dove contribuiscono alla rigenerazione (Bachrach, 2006); le MSDC (cellule staminali derivate dai muscoli) sono cellule purificate dal muscolo scheletrico adulto (Huard, 2003; Cao, 2003) aventi un elevata capacità di auto-rinnovamento e proliferazione e quando iniettate nei topi con deficit muscolare sono in grado di promuovere la rigenerazione muscolare (Payne, 2005) anche se la loro localizzazione nel muscolo adulto e la loro origine embrionale rimane ancora sconosciuta. Le cellule AC133-positive (Torrente, 2004), sono una sottopopolazione di cellule di derivazione ematica che esprimono un marcatore emopoietico ben differenziato AC133 ma possiedono potenziale miogenico. Oltre ad esse, le cellule staminali associate ai vasi del microcircolo del muscolo scheletrico i periciti e i mesoangioblasti, isolate nel 2007 da Dellavalle et al. (2007), che possono migrare attraverso il sistema vascolare e contribuire alla rigenerazione a lungo termine (Sampaolesi, 2003, 2006; Galvez, 2006; Dellavalle, 2007).
1.2 Patologie del muscolo scheletrico
1.2.1 Principali patologie del muscolo scheletrico
Miopatia è un termine generico con cui si indicano le malattie del sistema muscolare. Esistono vari tipi di miopatia, che possono riguardare un intero sistema di fibre muscolari, un gruppo di muscoli o l'intera muscolatura. Le forme dipendenti da un difetto della fibra muscolare sono dette miopatie primitive o distrofie
muscolari, mentre le miopatie secondarie si presentano in conseguenza di malattie a carico di altri organi od apparati (Treccani, 2010).
Il termine distrofia muscolare indica un gruppo di gravi patologie a livello muscolare che provocano una lenta ma progressiva perdita di tessuto muscolare, che generalmente viene sostituito da tessuto adiposo, e una conseguente condizione generale di debolezza. Nel tempo si assiste a una perdita sequenziale delle capacità motorie, respiratorie e cardiache (Chelly, 2013). Attualmente esistono circa 30 tipi di distrofie diverse, distinte per gravità, tipo di muscolo colpito, velocità di progressione e conseguente aspettativa di vita, che dipende dall’estensione della debolezza muscolare e dall’eventuale coinvolgimento cardiaco e respiratorio. Anche l’età d’insorgenza della patologia può essere utilizzata per classificare le distrofie muscolari: le distrofie congenite sono evidenti dalla nascita, mentre altri disordini muscolari non vengono diagnosticati se non nell’adolescenza o addirittura in età adulta. Le forme più diffuse sono la distrofia muscolare di Duchenne e quella di Becker; esistono però un'infinità di forme intermedie, e in pressoché ogni soggetto il decorso della malattia appare differente rispetto ad altri soggetti.
Con il termine atrofia muscolare invece, si indica il processo patologico che comporta la riduzione di volume come risultato della diminuzione del numero e dimensioni delle singole cellule che lo compongono. Poiché solo in rari casi si giunge alla scomparsa della struttura interessata, più correttamente si dovrebbe parlare di ipotrofia. L’atrofia può essere provocata da numerose cause come digiuno o disturbi della nutrizione, diminuita secrezione di ormoni trofici da parte dell’ipofisi, disturbi dell’innervazione o della vascolarizzazione o presenza di masse tumorali in accrescimento che esercitano pressione sul tessuto (Wolfe, 2006). Conseguentemente il tessuto muscolare va incontro a perdita delle funzioni che gli sono specifiche come diminuzione della forza muscolare, riduzione delle attività secretorie e delle funzioni nervose.
1.2.2 Distrofia muscolare di Duchenne (DMD)
La distrofia muscolare di Duchenne (DMD) è caratterizzata da perdita e debolezza muscolare a progressione rapida, e da degenerazione dei muscoli scheletrici, lisci e cardiaci. Colpisce quasi esclusivamente il sesso maschile durante i primi anni di vita e l'incidenza è stata calcolata a 1 su 3500 maschi. Le femmine non sono colpite dalla malattia, ma ne sono portatrici, in quanto la malattia si eredita come carattere recessivo legato al cromosoma X (Muntoni, 2003). L'alterazione del cromosoma X determina la mancata produzione della proteina distrofina che nel muscolo è localizzata sul versante citoplasmatico del sarcolemma dove interagisce con la F-actina del citoscheletro. Inoltre è strettamente legata ad un complesso di proteine del sarcolemma conosciute come proteine legate alla distrofina (DAPs) e glicoproteine legate alla distrofina (DAGs). La mancanza della distrofina conduce ad una perdita delle DAPs e alla rottura del complesso proteina-distroglicano. Questa rottura rende il sarcolemma suscettibile alla lacerazione durante la contrazione muscolare(Campbell, 1995; Ohlendieck, 1993; Howard, 1991).
La diagnosi si basa innanzitutto sull’osservazione clinica e su esami di laboratorio che mettono in evidenza il danno muscolare, come i valori di creatinchinasi (CK) (Zatz, 1991). Successivamente essa viene confermata attraverso biopsia muscolare e dall’analisi genetica per verificare la quantità di distrofina presente nel muscolo (Hoffman, 1988).
Al momento non esiste una terapia risolutiva per la malattia. La qualità di vita dei pazienti può notevolmente migliorare con trattamenti sintomatici e pluridisciplinari che gestiscano i vasi aspetti della malattia: motorio, respiratorio e cardiaco. Diversi approcci sono stati testati come potenziali terapie, quali: i) l’iniezione nel sangue di particolari cellule staminali denominate mesangioblasti, cellule che si sono dimostrate in grado di indurre un recupero della forza muscolare (Cossu, 2013), ii) la terapia con oligonucleotidi antisenso (Heemskerk, 2009). Essi sono analoghi strutturali del DNA, che permettono di saltare le parti difettose del
gene quando viene trascritto dall'RNA per la produzione della proteina distrofina in versione tronca ma ancora più funzionale. Tra gli oligonucleotidi antisenso utilizzati possiamo ricordare il 2'-O-metil fosfotioati noto come Drisapersen (Heemskerk, 2009) e Morfolino noto come Eteplirsen (Aoki, 2012). Quest’ultimo è stato somministrato a 19 bambini affetti di distrofia muscolare di Duchenne, e dosi elevate si sono dimostrate efficaci nell’indurre un aumento della distrofina in un breve periodo. Tuttavia, il farmaco si rende efficace solo nei pazienti affetti da una mutazione in una regione specifica e ulteriori studi saranno rivolti a capire i dosaggi appropriati del farmaco, il profilo di sicurezza e gli effetti a lungo termine (Cirak 2011).
1.3 Ingegneria del tessuto muscolare scheletrico
1.3.1 Limiti della medicina rigenerativa moderna
Il muscolo scheletrico può essere danneggiato in seguito a diversi tipi di lesioni, ad esempio, quelle derivate da malattie come le distrofie; in seguito ad esposizione da agenti miotossici o a temperature eccessivamente calde o fredde; dopo trauma acuto; in seguito ad ischemia conseguente a trapianto. Indipendentemente dai fattori responsabili, il modo in cui le lesioni si manifestano sembra essere lo stesso, variando solo nella gravità. Inoltre, i processi di riparazione e rigenerazione delle fibre sembrano seguire un percorso comune qualunque sia la natura dell'evento pregiudizievole (Tedesco, 2010).
Infatti, il tessuto muscolare scheletrico è in grado di auto-riparazione e rigenerazione per via delle cellule staminali residenti, principalmente le cellule satelliti muscolari (Ikada, 2006) o circolanti, come le cellule staminali mesenchimali (Koening, 2009).
Tuttavia, le malattie muscolari sono difficili da trattare, non solo a causa dell’elevata complessità fisiologica e strutturale del tessuto muscolare scheletrico ma anche perché la capacità di auto-rigenerarsi è limitata. Infatti, dopo una grave perdita di tessuto o in caso di degenerazione cronica il muscolo non è in grado di ripristinare la sua integrità (Rizzi, 2013). Tali fattori giustificano la necessità della ricostruzione esogena di modelli atti alla riparazione strutturale e funzionale del grande danno muscolare (Rizzi 2013). Fino ad ora, la medicina moderna, sebbene rappresenti il risultato di continui progressi che si sono sviluppati a partire dall'inizio del secolo scorso, presenta numerosi limiti in relazione alla sostituzione di organi danneggiati da traumi o malattie. Il trapianto di organi, per esempio, è limitato dalla scarsa disponibilità di donatori e problemi di incompatibilità. Anche con organi artificiali, ambito di ricerca ancora aperto, si incontrano severi problemi di rigetto cronico dovuto sia a incompatibilità con i materiali artificiali, sia al progressivo deterioramento o danneggiamento dell’organo impiantato e, di conseguenza, alla perdita delle sue originarie funzionalità. Questa forma di danneggiamento progressivo degli organi trapiantati implica la necessaria sostituzione degli stessi, soprattutto in pazienti giovani, per i quali l’intensità di attività e utilizzo dell’organo è maggiore. Le tecniche sviluppate per sostituire la funzionalità degli organi incontrano, in aggiunta, limiti di tipo biochimico: non si è in grado di sostituire le complesse reazioni che sono alla base del funzionamento degli organi originari con dispositivi artificiali e non è possibile riprodurre la minuziosa complessità delle funzioni cellulari che sottendono a tali reazioni biochimiche (Platt, 2013). Per questi motivi, molte speranze della medicina rigenerativa vengono riposte nel trapianto di tessuti o cellule (Rudnicki, 2004).
Il trapianto di tessuti può essere di tre tipi. Si parla di trapianto autologo quando il materiale da impiantare proviene dal paziente stesso; allotrapianto, quando il prelievo di tessuto utile è fatto da organismi della medesima specie ed infine, lo xenotrapianto caratterizzato da tessuti provenienti da specie animali
diverse. In questi ultimi due casi è necessario fronteggiare fenomeni acuti di rigetto attraverso terapie farmacologiche a base di immunosoppressori e altri farmaci che, oltre all’elevato costo, devono essere effettuate per lunghi periodi di tempo causando, a lungo andare, assuefazione, intolleranza o anche comparsa di neoplasie. Inoltre, in tutti i trapianti è assolutamente indispensabile controllare che il tessuto o il materiale di provenienza umana o animale utilizzato per l’innesto non sia veicolo di gravi infezioni virali come HIV e epatite (Schulz, 2007).
Strategie ricostruttive, come il trapianto autologo di muscolo (Torrente, 2007) e l'iniezione di cellule progenitrici del muscolo (Cannon, 2003), hanno ottenuto effetti terapeutici modesti dovuti ad una insufficiente adesione cellulare ed una limitata sopravvivenza e integrazione delle fibre muscolari rigenerate nel tessuto ospite. A questi effetti, si aggiungono quelli derivanti dal trapianto, come ad esempio le risposte immunitarie che da lievi possono arrivare fino al totale rigetto.
Per superare tali problemi, nel campo della rigenerazione muscolare si è capito che lo scopo non deve essere è più quello di rimpiazzare ciò che nel corpo umano non è più in grado di funzionare, ma quello di fornire gli elementi necessari per una sua riparazione in vivo, ovvero di creare sostituti e presidi in grado di fondersi con il corpo umano e di stimolare e sostenere le capacità intrinseche del nostro corpo a rigenerarsi ed a guarire da solo (Greenwood, 2006). Tra le nuove strategie terapeutiche per il trattamento di distrofie muscolari, infatti, è stato proposto di recente il trapianto di sostituti muscolari bioingegnerizzati, ovvero di matrici colonizzate da cellule staminali, supponendo che con questi metodi si possa fornire una veloce riparazione strutturale ed una prolungata sopravvivenza dell'impianto (Rossi, 2010; Pisconatti, 2012; Fuoco, 2012). Infatti, nel corso degli ultimi anni, è stato dimostrato che ricreare un costrutto su cui far crescere le cellule che ricrei un ambiente il più simile a quello fisiologico muscolare, sia determinante per la sopravvivenza, differenziazione e corretta maturazione funzionale del potenziale nuovo tessuto. Per ambiente paragonabile a quello fisiologico, si intende
un quadro che deve tener conto di tutti i fattori caratteristici del muscolo scheletrico.
1.3.2 Ingegnerizzazione del tessuto muscolare
L’enorme progresso delle conoscenze nel campo della biologia cellulare e delle biotecnologie ha consentito, negli ultimi anni, lo sviluppo di tecnologie mirate alla coltivazione ed alla ricostruzione in vitro di tessuti ed organi, definendo una nuova branca di scienze biomediche conosciuta con il temine di “ingegneria dei tessuti” (Lavik, 2004). L’ingegneria dei tessuti è “un campo interdisciplinare che applica i principi dell’ingegneria e delle scienze della vita allo sviluppo di sostituti biologici per ristabilire, mantenere o migliorare la funzione di tessuti e organi danneggiati” (Gerecht-Nir, 2003). L’obiettivo di questa tecnologia è quello di espandere cellule ex vivo su matrici polimeriche biocompatibili tridimensionali, denominate scaffolds, che una volta completamente colonizzati, daranno origine ad un costrutto pseudo-tessutale in vitro, che potrà essere impiantato in vivo nell’uomo per la riparazione di lesioni e rigenerazione dei tessuti (Ikada, 2006; Teebken, 2007).
Nel tempo il concetto d'Ingegneria dei Tessuti ha subito notevoli evoluzioni passando attraverso molteplici definizioni continuamente arricchite e perfezionate. La Tissue Engineering è caratterizzata dalle seguenti fasi di sperimentazione: i) scelta delle cellule da impiantare, le quali che devono essere identificate, isolate e moltiplicate in vitro in maniera sufficiente da poter garantire dopo una corretta proliferazione in vivo; ii) realizzazione di substrati su cui depositare le colture cellulari; in questa fase è importante la progettazione della composizione e della struttura dei materiali e la loro geometria; iii) coltivazione in vitro; in questa fase in cui le cellule sono uniformemente distribuite sul substrato e lasciate crescere in ambiente fisiologico simulato eventualmente anche all'interno di un bioreattore; iv) impianto in vivo quando la struttura ingegnerizzata, colonizzata dalle cellule, viene
collocata nel sito di interesse al fine di ottenere un'integrazione ottimale con i tessuti circostanti (Jackson, 2009).
L'ingegneria dei tessuti mira, pertanto, alla rigenerazione di tessuti danneggiati, grazie all'utilizzo di quattro fattori chiave: cellule, scaffolds e fattori di crescita. In particolare, le cellule hanno il ruolo di sintetizzare il nuovo tessuto, mentre lo scaffold deve fornire un supporto temporaneo alla crescita del nuovo tessuto, permettendo alle cellule di assolvere alla propria funzione. Inoltre gli scaffolds di ultima generazione mirano non solo a fornire un supporto strutturale alla crescita del nuovo tessuto, ma anche a guidare il processo di rigenerazione verso una struttura con geometria desiderata (Fig. 2).
Ingegneria tissutale in vitro Raccolta della biopsia muscolare muscol Isolamento di cellule staminali Espansione in vitro Generazione di un innesto in vitro e trapianto Semina su scaffold 3D
Ingegneria tissutale in vivo Raccolta della biopsia muscolare Isolamento di cellule staminali Trapianto Consegna di cellule staminali appena isolate su scaffold 3D
Fig. 2 Nello schema si può osservare la differenza tra l’ingegneria tissutale in vitro ed in vivo: in
vitro (a sinistra) le cellule staminali raccolte dalla biopsia vengono coltivate e seminate su uno
scaffold 3D generando cosi un innesto che poi viene trapiantato; mentre in vivo le cellule derivante dalla biopsia vengono isolate e immediatamente seminate su uno scaffold 3D che cosi risulta ad essere pronto all’impianto (modificato da Rossi, 2010)
1.3.2.1 Le cellule
Sulla base del successivo trapianto in vivo, in base alla specie di origine, le cellule applicabili possono essere classificate in autologhe (dal paziente proprio), allogeniche (umano diverso dal paziente) e xenogeniche (origine animale). Le cellule autologhe sono le più indicate per l’ingegneria tissutale del muscolo scheletrico in quanto la loro attività rimane elevata, mentre le cellule allogeniche e xenogeniche comportano caratteristiche immunogeniche e per questo motivo hanno bisogno di una terapia immunosoppressiva. Un problema associato alle cellule autologhe è la difficoltà nella raccolta di una quantità sufficiente, specialmente quando un paziente è anziano o gravemente malato. Se la quantità di cellule raccolte non è idoneo per il trattamento clinico si dovrebbe proseguire con l’espansione tramite la coltura cellulare, procedimento che richiede tempo e un ambiente altamente sterile per evitare le contaminazioni (Ikada, 2006).
La selezione del tipo di cellule richiede la considerazione di vari fattori che includono l'accessibilità della fonte cellulare, alta efficienza di miogenicità in vitro con la capacità di mantenere la differenziazione per lunghi periodi di tempo, suscettibilità alla manipolazione genetica, un modo adatto di consegna e infine differenziamento in vivo dando luogo a ripristino della morfologia strutturale e funzionale. Potenziali fonti di cellule staminali progenitrici non si limitano a cellule satelliti (Péault, 2007), mioblasti, mesoangioblasti, periciti, mSP, cellule CD133+, ma comprendono anche cellule embrionali staminali, cellule staminali mesenchimali, cellule staminali del liquido amniotico e staminali pluripotenti indotti (iPS)(Fishman,
2013). Nelle prove iniziali, sono stati trapiantati in pazienti affetti dalla distrofia muscolare di Duchenne (DMD) mioblasti allogenici però hanno portato ad un rigetto immunitario, rapida morte, e limita migrazione intramuscolare. In alternativa al trapianto di mioblasti, cellule staminali, come mesoangioblasti e CD133+, somministrate attraverso la circolazione del sangue di recente hanno dimostrato un grande potenziale nel rigenerare muscolo distrofico (Péault, 2007; Meregalli, 2010; Tedesco, 2010).
Le cellule staminali embrionali (ES), sono cellule staminali totipotenti derivate da blastocisti (Thomson, 1998) potrebbero essere una fonte affidabile per la terapia di rigenerazione muscolare (Tomonari, 2012). Inoltre, di recente, sono state generate le cellule pluripotenti staminali indotte (iPS), con proprietà equivalenti a quelle delle cellule ES, ma senza problemi etici (Takahashi 2006, 2007, 2008).
Le cellule staminali mesenchimali (MSC) sono in grado anche esse di differenziarsi in diversi tipi di cellule compresi i mioblasti (Dezawa, 2005; Hui 2005). Sono contenute nel midollo osseo (Kotobuki, 2004) e nel tessuto adiposo (Zuk, 2001).
Le cellule più adatte per l’ingegnerizzazione del muscolo scheletrico rimangono le cellule satelliti. Queste, a differenza delle MSC, sono già inclini al differenziamento miogenico, possono essere isolate dal tessuto muscolare, che è facilmente accessibile, e propagate in vitro. Purtroppo, indurre la loro differenziazione verso le miofibre ed il controllo in vitro risulta ancora difficile (Koening, 2009). Inoltre come cellule staminali se non sono raccolte in quantità sufficiente devono essere moltiplicate e questo rappresenta una sfida, poiché la loro capacità proliferativa non è elevata (Sirabella, 2013).
Pertanto, più frequentemente, per gli studi preliminari sono utilizzate le linee muscolari. Le cellule C2C12 sono una linea immortale di mioblasti scheletrici, originariamente derivanti dalle cellule satelliti del muscolo della coscia di topo C3H dopo una lesione da schiacciamento (Yaffe e Saxel, 1977; Blau, 1985). Questo tipo di
cellule sono facilmente reperibili e poco costose, inoltre la loro forte assomiglianza con le cellule muscolari giustifica la scelta (McMahon, 1994). Nella condizione indifferenziata, le cellule C2C12 mioblasti sono piatte, fusiforme o a forma di stella. Esprimono actina filamentosa e sarcomerica, localizzata principalmente alla periferia della cellula (Burattini, 2004), ma risultono essere positive anche per la miosina scheletrica (Kataoka, 2003). Nonostante la miosina sia uno dei principali componenti del apparato contrattile completamente formato, la sua presenza in cellule indifferenziate è un fenomeno ben documentato sia nel mioblasti (Salamon, 2003) che in altre linee cellulari (Ezzel, 1992).
Il differenziamento miogenico è riconoscibile da un progressivo cambiamento nella forma delle cellule che diventa allungata, e dall’assemblaggio progressivo delle strutture coinvolte nella contrazione. I miotubi appaiono dopo 5 giorni di differenziazione. Essi sono allungati (100-600 micron), con un spessore di 30-50 micron e con più di 20 nuclei. Occasionalmente possono mostrare una forma di Y e una certa rigidità, spesso determinando il loro distacco dal monostrato (Burattini, 2004; Berendse, 2003).
1.3.2.2 Gli scaffolds
La rigenerazione di tessuti richiede un supporto (scaffold), simile alla matrice extracellulare, che permetta alle cellule di organizzarsi in complesse strutture tridimensionali. Le cellule isolate infatti, sono difficilmente in grado di organizzarsi in nuovi tessuti spontaneamente.
Proprietà
Uno scaffold ideale per il muscolo scheletrico muscolare deve essere: i) biocompatibile, ovvero non deve determinare alcun tipo di alterazione nei tessuti con cui viene a contatto (Rossi, 2010), ii) biodegradabile e biassorbibile, ovvero deve favorire un’impalcatura temporanea per la crescita delle cellule, tale da degradarsi
in prodotti non tossici e riassorbibili in tempi sufficientemente lunghi da garantire la formazione di una matrice e nuovo tessuto da parte delle cellule completi e robusti, iii) poroso; la porosità è una condizione necessaria per garantire la sopravvivenza cellulare e la proliferazione in vitro. Essa infatti all’interno di una matrice tridimensionale, consente la diffusione di ossigeno, nutrienti e metaboliti (Hudlicka, 2011), nonché la migrazione delle cellule al suo interno (Koning, 2009), in maniera da garantire una colonizzazione omogenea, altrimenti proliferano solo nella periferia ma non al centro (Ishaug-Riley, 1998). Pertanto, tra le caratteristiche più importanti di una matrice tridimensionale possiamo menzionare la porosità che idealmente può essere circa il 90% (Freed, 1994), l'adeguata dimensione dei pori che è stata dimostrata ad essere efficace tra 50 – 200 micron (Lee, 2008; Bursac 2008), v) con proprietà meccaniche compatibili con quelle del tessuto sostituito. Nel caso del muscolo scheletrico, gli scaffols devono assumere un valore di modulo elastico, o stiffness, pari a quella del muscolo scheletrico sano, per esattezza intorno ai 12 kPa (Gilbert, 2010; Engler, 2004).
Numerosi studi hanno dimostrato che la stiffness è in grado di regolare il comportamento cellulare. In particolar modo, quando le cellule staminali mesenchimali pluripotenti vengono coltivate in vitro su un substrato con un modulo elastico simile a quello del tessuto muscolare, ovvero circa 12 kPa, esse seguono un differenziamento di tipo miogenico (Engler, 2011). Coltivate in presenza di un substrato più morbido (circa 1 kPa) o più duro (circa 35 kPa), danno origine ad differenziamento di tipo neurogenico e osteogenico, rispettivamente (Cosgrove, 2009; Guilak, 2009). L’importanza della realizzazione delle corrette proprietà meccaniche del muscolo si è resa evidente anche in altri studi, in qui le cellule satelliti, se coltivate su hydrogel di polietilenglicole caratterizzato da una stiffness di 12 kPa, non solo mostrano un tasso di sopravvivenza maggiore rispetto alle cellule coltivate in un substrato più rigido, come quello della plastica (circa 106 kPa), ma anche il mantenimento delle caratteristiche staminali. Infatti sebbene l’efficienza del
trapianto non sia paragonabile a quella delle cellule satelliti appena isolate da muscolo (non sottoposte a coltura), le cellule satelliti coltivate su substrati con stiffness di 12 kPa hanno maggiore abilità di trapianto in vivo rispetto alle cellule cresciute su substrati più rigidi. Inoltre, esse mostrano in vivo un comportamento simile a quello delle cellule appena isolate da muscolo, ovvero proliferano e si localizzano nella nicchia, fra la lamina basale e la miofibra, mostrando le stesse capacità proliferative. Questi risultati suggeriscono che la rigidità del tessuto è in grado di regolare la staminalità delle cellule satelliti (Gilbert, 2010). Inoltre, si osserva che le proprietà meccaniche possono variare con l’invecchiamento e in condizioni patologiche (Cosgrove, 2009).
Inoltre gli scaffolds dovrebbero mimare la matrice extracellulare del muscolo scheletrico, aumentando così la probabilità che le cellule che lo circondano vengano stimolate a proliferare, migrare e differenziarsi per produrre un nuovo tessuto funzionale (Beier, 2009). La matrice extracellulare è fondamentale nel conferire le caratteristiche peculiari del muscolo scheletrico. È composta da fibre proteiche insolubili (collagene, fibre elastiche e fibre reticolari) e sostanza fondamentale, formata da mucopolisaccaridi acidi, glicoproteine, proteoglicani, glucosamminoglicani e in minor misura da proteine, fra cui la fibronectina (Pasqualino e Panattoni, 2005). Oltre ad avere funzioni di sostegno meccanico, possiede un ruolo attivo nella regolazione del comportamento delle cellule che entrano in contatto con essa, influenzandone sopravvivenza, sviluppo, migrazione, proliferazione, forma e funzione (Alberts, 1995).
Oltre ai requisiti di base dei materiali, anche le loro proprietà macro e microstrutturali hanno un’elevata importanza. Queste proprietà influenzano non solo la sopravvivenza, la crescita, la diffusione e la riorganizzazione delle cellule, ma giocano un ruolo fondamentale nell'influenzare il tipo di forma delle cellule e l'espressione genica che è connessa con la crescita cellulare e con la conservazione dei fenotipi originari (Ngang, 2009). In particolar modo, la matrice extracellulare
naturale all’interno del tessuto muscolare scheletrico funzionale è altamente orientata. L’allineamento parallele della matrice extracellulare del tessuto muscolare scheletrico è il requisito più importante per l’efficace contrazione muscolare e generazione di forza lungo un asse longitudinale (Aubin, 2010).
Materiali
Una vasta gamma di materiali biodegradabili sono stati sviluppati e testati nelle applicazioni di ingegneria tessutale del muscolo scheletrico, materiali che per la loro natura possono essere divisi in due grandi classe. La prima è rappresentata da materiali naturali quali ad esempio collagene, fibronectina, elastina, fibrina, laminina, acido ialuronico (Beier, 2009) e gelatina derivata dalla denaturazione del collagene tramite bollitura. La seconda classe è data da materiali di origine sintetica tra cui i più noto sono polimeri come Poli (l-acido glicolico) (PLGA)( Watanabe, 2002; Ikada, 2006), Poli (l- acido lattico) (PLLA), Poli (Ɛ-caprolattone) (PCL) ed un blend, costituito da una miscela di PLLA 10% e PCL 20% (Beier, 2009; Knonig, 2009). Come caratteristiche presentano una buona maneggevolezza, non sono tossici e presentano una stabilità a lungo termine in vivo: PLLA 24 mesi, PLGA approssimativamente 6 mesi (Gunatillake e Adhikari, 2003), PCL di circa un anno (Park, 2009).
Gli idrogel sono una classe di biomateriali idrofili fatte di componenti idrosolubili che presentano elevata porosità ed alto assorbimento di acqua. La loro struttura è sostanzialmente una rete di macromolecole che può essere stabilizzata mediante reticolazione chimica o fisica. Le principali proprietà di questi materiali sono: i) Elevata bio-compatibilità; ii) Alto contenuto di acqua; iii) proprietà meccaniche e strutturali facilmente modulabili; iv) Diffusione efficiente di ossigeno, nutrienti e metaboliti; v) Incapsulamento uniforme delle celle; vi) Iniezione come precursore liquido e polimerizzazione in situ; vii) Modulazione di riassorbimento (Rizzi, 2012). Recentemente è emersa una nuova classe di idrogel, generata da auto-assemblaggio di blocchi a basso peso molecolare, che formano delle strutture
supramolecolari in particolari condizioni fisico-chimiche, come per esempio gel a base di peptidi che offrono un elevata versatilità in termini di modificazioni chimiche e biologiche (Li, 2011; Matson, 2011).
Essi rappresentano la categoria di maggio utilizzo nell’ingegneria dei tessuti (Seliktar, 2012). Possono anche essere utilizzati per incorporare cellule al loro interno. Il disegno degli idrogel deve considerare determinati parametri fisici, quali le proprietà meccaniche e di degradazione, e anche l'adesione cellulare e la biocompatibilità (Pratt, 2004). La degradazione degli idrogel può verificarsi a causa di idrolisi e / o degradazione enzimatica (proteolisi), e deve avvenire in un tempo sufficiente alla formazione del nuovo tessuto. Generalmente le proprietà meccaniche e di degradazione degli idrogel sono in genere strettamente collegati l’un l'altro: un materiale più reticolato e più rigido subirà un processo di degradazione più lenta. Per favorire l’adesione peptidi e fattori di crescita possono essere inclusi nella rete od adsorbiti sulla superficie del gel (Pratt, 2004). I materiali che possono essere usati per formare idrogel per scaffold sono molto vari e tra questi si annoverano polimeri sintetici: il polyethylene oxide (PEO), polivinil alcol (PVA), l’acido poliacrilico (PAA) e i polipeptidi; e naturali agarosio, alginato, chitosano, collagene, fibrina, acido ialuonico (HA).
Tra gli svantaggi derivanti dal utilizzo di prodotti di origine animale possiamo includere il rischio di infezione e antigenicità, la potenziale instabilità, la fornitura e il costo di produzione. I polimeri sintetici, d'altra parte, sono prodotti riproducibile ed economici e liberi dall'immunogenicità. Tuttavia, i polimeri sintetici mancano di segnali cellula-riconoscimento non supportano un’adesione cellulare ottimale o la migrazione e la proliferazione senza una qualche forma di modificazione chimica (Gunatillake, 2003). Complessivamente, un polimero ideale per una particolare applicazione dovrebbe essere configurato in modo tale da rispettare una serie di caratteristiche come avere proprietà meccaniche che combaciano con l'applicazione, rimanendo sufficientemente robusto fino a che i tessuti non sono in
buone condizioni; non provocare infiammazione o una risposta tossica; essere metabolizzato dal corpo dopo avere svolto il suo compito, senza lasciare alcuna traccia; essere facilmente processabile per giungere alla forma finale del prodotto; avere una durata accettabile; e infine essere facilmente sterilizzabile. I dispositivi che incorporano i polimeri biodegradabili non possono essere soggetti a un'azione in autoclave e devono quindi essere sterilizzati, per esempio, con irradiazioni UV oppure adoperando delle tecniche di sterilizzazione a freddo, prestando attenzione quindi che la temperatura sia tenuta più bassa rispetto a quella di transizione vetrosa dei polimeri; tutto ciò è molto importante per prevenire il cambiamento della geometria delle strutture polimeriche durante la sterilizzazione.
1.3.2.3 Tecniche di micro fabbricazione classiche
Le strategie di fabbricazione devono essere sviluppate in modo da rendere possibile l'inserimento di caratteristiche micro e nano-scala se necessario, capaci di migliorare le funzioni cellulari e subcellulari e rendere più confortevoli le condizioni dell'ambiente circostante (Leong, 2003). Tali tecniche devono permettere la realizzazione di un certo grado di porosità e quindi una dimensione dei pori ben controllata. Inoltre, esse devono contribuire all’allineamento parallelo della matrice extracellulare e delle fibre muscolari stesse (Rao, 2012), processo che rappresenta il pre-requisito fondamentale per un’efficace contrazione muscolare e adeguata vascolarizzazione.
Queste tecniche, perciò, rappresentano il futuro della medicina nell’ambito della rigenerazione di un tessuto muscolare completamente funzionante. Tra i primi metodo descritti possiamo nominare quello di Curtis e Wilkinson ( Curtis, 1997) detto anche “teoria di orientamento delle cellule” dove è stata studiata la crescita parallela delle cellule all’interno di una matrice con un disegno parallelo. Il fenomeno si è visto ad essere favorevole anche nelle colture di mioblasti (Choi ,2008; Huang, 2006; Huber, 2007) facilitando la formazione di miotubi allineati
(Gingras, 2009). Tuttavia le tecniche per indurre l’allineamento desiderato sono numerose e dipendenti dal tipo di materiale usato.
Le tecniche di microfabbricazione classiche attualmente usate sono:
Tecniche tessili - applicate per la progettazione e la fabbricazione di scaffold estremamente porosi (Kim e Mooney, 1998; Chen, 2002).
Solventi casting- particulate leaching - che utilizza un agente porogeno idrosolubile (Chun, 2001).
Utilizzo di laser - una metodologia di microfabbricazione che utilizza il laser per realizzare microstrutture. Con questa tecnica, uno strato di polvere polimerica è deposta su un substrato ed in seguito un laser all’infrarosso porta i vari grani polimerici localmente alla temperatura di transizione vetrosa facendoli fondere insieme (Berry, 1997);
Gas Foaming - prevede l'utilizzo di gas, come l'anidride carbonica, ad alta pressione per la realizzazione di spugne macroporose (Mooney, 2006; Harris, 1998).
La liofilizzazione - per la realizzazione di matrici spugnose a base di collagene (Madaghiele, 2008);
Elettrospinning - L’elettrospinning è un processo di produzione di fibre
polimeriche mediante l’utilizzo di una forza elettrostatica, capace di produrre fibre nanometriche (Bhattarai, 2006; Riboldi, 2005). Nel processo di elettrospinning viene utilizzata una tensione elevata per creare un getto elettricamente carico di una soluzione o di un fuso polimerico, il quale si secca o si solidifica formando così una fibra polimerica (Bian e Bursac 2008). Per ottenere fibre continue, il metodo richiede l’utilizzando di soluzioni contenenti concentrazioni relativamente elevate di polimero di solito circa il 10-15% in peso (Moroni, 2006). L'allineamento delle fibre elettrofilate è abilitato per indurre l’allineamento cellulare e tissutale (Buttafoco, 2006);
Sinterizzazione di micro-particelle - consente la realizzazione di strutture tridimensionali macroporose a seguito di una parziale fusione di particelle adiacenti indotta dalle condizioni fisiche imposte al sistema. In particolare opportune condizioni di temperatura e/o pressione possono avviare meccanismi di incipiente fusione del polimero a partire dalla superficie delle particelle, favorendo la loro parziale compenetrazione e dando origine, al contempo, ad interstizi interparticellari che determinano la porosità macroscopica all'interno della struttura (Tejal, 2000; Chen, 2002).
Litografia - Le tecniche litografiche tradizionali si basano su processi chimico-fisici che utilizzano il silicio come materiale di partenza, in particolare a partire da wafer di silicio e fondendo processi di addizione, sottrazione e drogaggio dei materiali, si riescono ad ottenere delle strutture finali con topologia e caratteristiche chimico- fisiche dei materiali appropriate allo scopo finale. Gli attuali processi di produzione litografica garantiscono elevata precisione, accuratezza e ripetibilità degli step tecnologici con conseguente ottima qualità della produzione. Lo schema tradizionale della litografia include i seguenti passaggi: i) trattamento chimico per rendere lucida la superficie del wafer di silicio; ii) coating con una maschera ad elevata risoluzione per definire la topologia della realizzazione finale della superficie del wafer; iii) esposizione ad una sorgente di energia per la promozione di specifiche reazioni chimico-fisiche del materiale sensibile; iv) sviluppo del materiale impressionato per eliminare tutto ciò che ha reagito; v) pulitura della superficie del wafer di silicio con la deposizione superficiale della topologia finale. Il materiale sensibile si differenzia non soltanto per la fonte energetica cui risulta essere sensibile, ma anche sulla tipologia che si riproduce sulla superficie del wafer di silicio distinguendo cosi tra negativo e positivo; solitamente si utilizzano polimeri sintetici tossici. Oltre alla tossicità del materiale utilizzato per la definizione della topologia finale, occorre porre attenzione sulla criticità di alcuni passaggi tecnologici quali l'esposizione e
lo sviluppo. Durante l'esposizione il materiale sensibile assorbe un grande quantitativo energetico per promuovere specifiche reazioni, pertanto il materiale deve mostrare spiccate caratteristiche di stabilità per non modificare la forma e le proprietà chimico-fisiche. La fase di sviluppo solitamente utilizza acidi forti, per eliminare qualsiasi residuo indesiderato a ottenere la topologia finale. La forma di litografia più diffusa è la fotolitografia. Questo è essenzialmente un processo di realizzazione di strutture bidimensionali planari su un wafer di silicio, utilizzando come sorgente energetica una fonte di raggi UV per impressionare lo strato di materiale fotosensibile (Tong, 2010)
Soft Lithography - è una una famiglia di tecniche di nanofabbricazione non convenzionale sviluppate a partire dagli anni ’90 generalmente adottate nel settore dell'Ingegneria Tessutale per fabbricare membrane con cui è possibile alterare la chimica superficiale dei substrati per l'adesione cellulare. Caratteristica fondamentale delle soft-lithography è la realizzazione di un contatto conforme a livello nanometrico tra uno stampo in materiale ‘soffice’ ed un substrato con particolari rilievi disegnati, consentendo il trasferimento del pattern dalla superficie, che nel nostro caso è una wafer in siliceo, allo stampo. Appartenente a questa famiglia di tecniche, in questo lavoro di tesi ha trovata applicazione quella che prevede l’utilizzo dell’ elastomero siliconico polidimetilsilossano (PDMS). Il termine “soft” si riferisce proprio all'uso di questo elastomero che rappresenta un materiale ideale per la soft lithography e che assume la forma dello stampo. Nonostante la grande varietà di materiali disponibili, è il più utilizzato grazie alle sue particolari proprietà che si possono così elencare: i) è trasparente alle lunghezze d'onda superiori ai 230 nm e può essere trattato con i raggi UV; ii) è un ottimo isolante elettrico; iii) il PDMS è inerte, non è né tossico né infiammabile; iv) ha notevole resistenza agli attacchi chimici oltre che all'ossidazione; v) non si lega al vetro né alla plastica in fase di solidificazione, e una volta solidificato, aderisce molto bene a tali superfici lisce;
vi) ha resistenza elevata alla temperatura fino a 150°C ed infine vii) ha alta resistenza meccanica e modulo tensile di 1.8MPa (Choi, 2003).
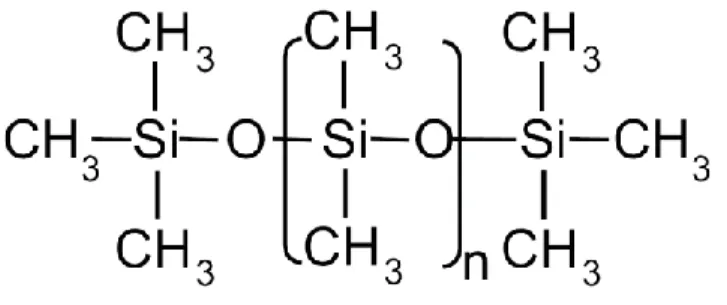
Fig. 3 Formula chimica del PDMS
l prepolimero liquido, è depositato per colata appunto sulla superficie del wafer in silicio con pattern desiderato, precedentemente realizzato, viene fatto degassare e poi lasciato reticolare per via termica fino ad ottenere l’elastomero finale con le proprietà desiderate. A questo punto, il PDMS ha assunto la forma desiderata e data la sua elasticità, è separato facilmente dal wafer e pronto per essere utilizzato nella fase di replica per realizzare le strutture polimeriche allineate con i polimeri di origine naturale.
La tecnica soffre comunque di alcune limitazioni; per esempio la difficoltà di creare processi multistrato con un accurato riposizionamento sulla superficie, la difficoltà di ottenere risoluzioni elevate connesse alla elasticità degli stampi ed alla loro distorsione, che però potrebbe essere aggirata con stampi più rigidi. In più anche la formazione di difetti deve essere tenuta sotto controllo come per esempio granelli di polvere, contatto non perfetto tra stampo e substrato, presenza di bolle, oligomeri a basso peso molecolare all’interno degli stampi che potrebbero essere rilasciati.
La soft-litografia è stata inizialmente applicata per l’ingegnerizzazione delle complesse strutture epatiche e tessuto vascolare (Tsang, 2007; Chrobak, 2006) trovando però presto applicazione anche nel campo del tessuto muscolare scheletrico grazie all’alta riproducibilità della geometria dell’idrogel o del materiale
sintetico ed alla sua caratteristica di permettere la progettazione di archittetura 3D tessuto-specifica (Bursac, 2008).
1.3.2.4 Altre tecniche per indurre allineamento
Un metodo alternativo a questo è rappresentato dallo stiramento meccanico che da tempo è noto ad essere un processo significativo volto ad indurre un aumento della sintesi proteica e a stimolare la crescita del muscolo scheletrico in vitro e in vivo. È stato visto che la forma 3D delle cellule che diffondono all’interno di una matrice può essere controllata mantenendo una tensione passiva, mentre quando essa è applicata in direzione monoassiale, può facilitare notevolmente l’allineamento e la fusione dei mioblasti con la successiva formazione di miotubi multinucleati (Vanderburg, 1989; Yang, 2003). Inoltre, è stato dimostrato che con questa tecnica si può aumentare il tasso di proliferazione dei mioblasti (Kook, 2008) e la produzione di forza del tessuto ingegnerizzato del muscolo scheletrico grazie all’aumento di diametro e densità della miofibre (Vanderburgh, 1989; Vanderburgh, 2002).
Oltre allo stiramento meccanico esiste un altro metodo alternativo alla soft-litografia, ovvero l’applicazione di una stimolazione elettrica nelle colture di mioblasti bidimensionali. Questo tipo di attività contrattile indotta si è dimostrata ad essere efficace nel promuovere la formazione del sarcomero e nell’indurre la maturazione dei miotubi. Di particolare importanza è il fatto che la differenziazione ottimale si è verificata su substrati aventi una rigidezza simile a quella del muscolo nativo (Bursac, 2008).
1.3.2.5 L’arte dell’ingegneria dei tessuti
Numerosi studi sono stati condotti nel corso di questo ultimo ventennio con lo scopo di rigenerare il muscolo scheletrico. Essi si diversificano per tipi di cellule utilizzati, tecnologie e materiali applicati.
Sin dal 1932, Sir Winston Churchill aveva previsto che sarebbe stato possibile, in futuro, crescere e progettare il tessuto muscolare in vitro. È stato però solo nel 1988, che ha iniziato a prendere forma il concetto di muscolo ingegnerizzato, quando Vandenburgh ha introdotto per la prima volta la coltura 3D di mioblasti in gel di collagene, mostrando una contrazione del tessuto muscolare ingegnerizzato in vitro (Vandenburgh, 1988). Solo un anno più tardi, nel 1989, il gruppo ha dimostrato che la stimolazione meccanica dei mioblasti embrionali in vitro facilita la crescita longitudinale del tessuto muscolare scheletrico ingegnerizzato (Vandenburgh, 1989). Questo rapido sviluppo ha sollevato grandi aspettative per le future applicazioni cliniche dell’ingegneria tissutale del muscolo scheletrico. Studi successivi condotti da Strohman e in seguito da Dennis hanno riguardato la realizzazione di tessuti muscolari contrattili 3D detti “myooids” di dimensioni limitate, intorno a 1 mm di diametro (Strohman, 1990; Dennis, 2001). Nel loro insieme questi studi in vitro hanno portato ad una migliore comprensione del differenziamento miogenico e della contrattilità.
Notevole importanza è però associata alla vascolarizzazione dei tessuti muscolari. Infatti, l'apporto di sostanze nutritive dipende esclusivamente dalla diffusione che è limitata a distanze inferiori a 500 µm (Kannan, 2005) ed è resa carente nella parte centrale dei costrutti 3D ingegnerizzati. Un passo successivo è stato fatto da Levenberg e collaboratori i quali hanno dimostrato che il tessuto muscolare vascolarizzato può essere ingegnerizzato in vitro utilizzando una co-coltura di mioblasti, fibroblasti embrionali e le cellule endoteliali in un scaffold polimerico 3D (Levenberg, 2005; Levenberg, 2010). Questo costrutto pre-vascolarizzato ha mostrato una minore apoptosi dei mioblasti dopo il suo trapianto in vivo (Levenberg, 2005).
Tuttavia, nell’applicazione clinica, il trasferimento richiede una vascolarizzazione assiale del tessuto muscolare ingegnerizzato.
Inoltre, l'utilizzo di fonti di cellule embrionali è un problema critico in medicina, così come in termini etici. Pertanto, molti studi in vivo (Messina, 2005; Hutmacher, 2009; Fiegel, 2010) hanno utilizzato il modello artero-venoso (AV) -loop ratto descritto per la prima volta da Spira nel 1980 (Spira, 1980) svolto a generare una vascolarizzazione assiale. Il modello, che sembrava di essere un passo promettente verso una futura applicazione di grandi costrutti tissutali nello scenario clinico (Kneser, 2006) nel 2010, è stato rivisto e trasformato nel modello AV-loop pecora, adatto per i grandi costrutti (Beier, 2009; Beier, 2010).
Un altro punto cruciale nell’ingegnerizzazione del muscolo scheletrico è rappresentato dalla sua innervazione. Affinché un tessuto ingegnerizzato sia efficace e possa diventare funzionale, la vascolarizzazione deve avvenire con innervazione. Nel 2011 Jianqun et al. ad esempio ha realizzato uno scaffold 3D a base di collagene in grado di favorire l’innervazione nel tessuto danneggiato, confermata da positività per analisi di immunoistochimica ai neurofilamenti (Jianqun, 2011). Questo è stato possibile creando un innesto 3D composto dallo scaffold seminato con le cellule C2C12 e disposto poi in un sistema “roller bottle”. L’innesto è stato successivamente impiantato nei siti difettosi nel muscolo scheletrico dei topi.
Recentemente Carosio et al. hanno generato in vitro un tessuto muscolare scheletrico il più possibile completo e dotato delle componenti sopra citate, denominato X-MET (eX-vivo Muscle Engineered Tissue). Per far ciò hanno utilizzato tre tipi di cellule coltivate in condizioni standard: i) cellule che presentano le caratteristiche dei miotubi differenziati con una struttura contrattile ben organizzata, ii) cellule indifferenziate, iii) cellule vascolari in grado di formare reti “nave-like”. X-MET, contraendosi in seguito a impulsi elettrici, si comporta come il muscolo dell’adulto; inoltre, è dotato di propri vasi sanguigni. X-MET può essere utilizzato per monitorare l’attività del muscolo in risposta a stimoli meccanici e chimici, semplificando lo studio di complessi processi cellulari e fornendo uno
strumento unico per lo studio di malattie come l’atrofia muscolare, per testare e sviluppare adeguate contromisure farmacologiche (Carosio, 2013).
Prima ancora, nel 2009 Vandenburgh et al. hanno usato l’ingegneria dei tessuti del muscolo distrofico come una piattaforma per lo screening dei farmaci utilizzati nella terapia per rallentare la distrofia di Duchenne (Vandenburgh, 2009). Così, si può analizzare una vasta gamma di possibili farmaci senza usare tempi lunghi e costosi modelli in vivo (Klumpp, 2011).
1.3.3 Biomateriali utilizzati: sintetici e naturali
In questo lavoro di tesi sono stati usati scaffolds ottenuti sia con polimeri di origine sintetica, sia polimeri di origine naturale.
1.3.3.1 Biopolimeri sintetici
Il primo polimero che descriviamo è il PLLA (acido Poli l-Lattico) ovvero PLA nella sua forma di L-isomero (fig. 4). Esso può essere trattato sotto forma di fibre, film e granuli attraverso le tecniche applicabili a vari polimeri dalle proprietà meccaniche superiori. Le catene polimeriche possono essere lineari, ramificate oppure reticolate e può essere cristallino o amorfo. Maggiore sarà la sua cristallinità e maggiore sarà l’ordine della struttura che, per così dire, risulterà più “stretta”. Questo tipo di organizzazione darà luogo ad uno scorrimento ristretto tra le catene polimeriche adiacenti, traducendosi così, in aumento delle sue proprietà meccaniche. Il PLLA è un polimero viscoelastico ed una riduzione del grado di cristallinità nella sua microstruttura tende ad aumentare la velocità di degradazione e quindi del riassorbimento dell’impianto. È soggetto a degradazione idrolitica totale, avendo come prodotti finali il diossido di carbonio e l’acqua. Le proprietà meccaniche possono variare in base al peso molecolare, cristallinità, metodo di conservazione e forma come fibre spugnose, fibra intrecciate, fibre a singolo e multi filamento, placche, film etc. Entrambi i suoi isomeri (L e D) esibiscono un’alta forza