CAPITOLO
4
Parte sperimentale
4.1 Materiale vegetale
Le parti aeree di Clerodendrum splendens G. Don sono state raccolte nel marzo del 2010 presso El Zoharia Research Garden al Cairo in Egitto. Un campione di materiale (n. 7191 Clerodendrum splendens G. Don/1) vegetale è stato depositato presso l’Herbarium Horti Botanici Pisani, Erbario
generale, Flora Aegyptiaca.
4.2 Estrazione
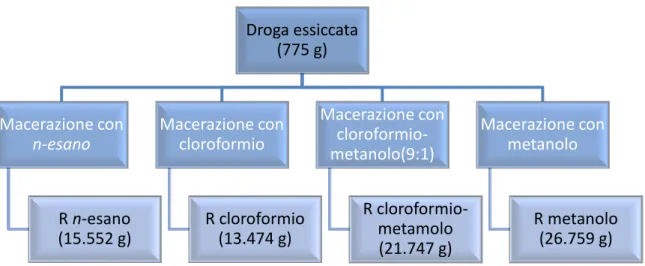
Le parti aeree (775 g) di Clerodendrum splendens G. Don essiccate sono state sottoposte ad estrazione a temperatura ambiente (macerazione) con solventi a polarità crescente. I solventi usati in successione sono stati i seguenti: n-esano, cloroformio, una miscela cloroformio-metanolo ( 9:1) e metanolo .
La droga è stata macerata in ogni solvente per circa tre settimane durante le quali il solvente è stato rinnovato ogni 72 h per un totale di quattro volte per ogni tipo di solvente.
Gli estratti ottenuti ad ogni cambio di solvente sono stati evaporati a pressione ridotta e a temperatura compresa tra i 35 e i 40 °C con l'ausilio del rotavapor, riuniti ed ulteriormente evaporati, fino ad ottenere ad estrazione conclusa le seguenti rese (Fig. 4.1 e 4.2):
Estratto n-esanico (RE): 15.552 g Estratto cloroformico (RC): 13.474 g
Estratto cloroformio-metanolo (RC-M): 21.747 g Estratto metanolico (RM): 26.759 g
Fig. 4.1 Procedura di estrazione del materiale vegetale
Droga essiccata (775 g) Macerazione con n-esano R n-esano (15.552 g) Macerazione con cloroformio R cloroformio (13.474 g) Macerazione con cloroformio-metanolo(9:1) R cloroformio-metamolo (21.747 g) Macerazione con metanolo R metanolo (26.759 g)
Fig. 4.2 Risultati delle estrazioni di C. splendens G. Don
Sulla base di un’analisi preliminare attraverso cromatografia su strato sottile, si è deciso di iniziare a studiare l’estratto cloroformio-metanolo, seguito dallo studio dell’estratto metanolico e cloroformico, i quali si son rivelati essere più interessanti.
4.3.Studio dell’estratto cloroformio-metanolo (R
C-M)
Il residuo cloroformio-metanolo (RC-M) ottenuto dopo completa evaporazione del solvente ha
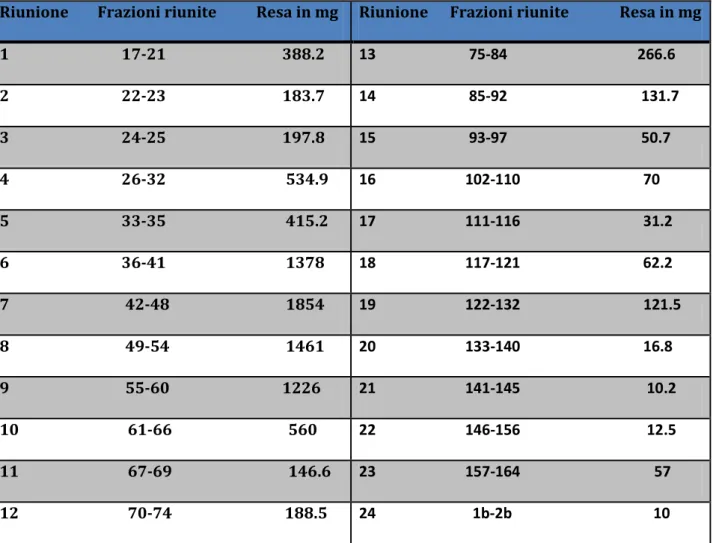
presentato un peso complessivo di 21.747 g . Una parte di residuo (10 g) è stata disciolta in circa 35 ml di MeOH. La sospensione è stata centrifugata ed il sopranatante è stato sottoposto a cromatografia di esclusione molecolare su una colonna di Sephadex LH-20 (i.d.= 5 cm, V = 19.6 ml/cm), eluendo con metanolo al flusso costante di 0,8 ml/min. Sono state raccolte 164 provette del volume di cica 20 ml ciascuna e 2 beute di circa 100 ml (1b e 2b). Queste sono state riunite in 24 frazioni principali (Tab. 4.1) sulla base delle caratteristiche cromatografiche evidenziate attraverso TLC su gel di silice 60 F 254 ed altre son state eliminate. Come fase mobile sono state
utilizzate una miscela di CHCl3-MeOH-H2O in rapporto 70:30:3, e una di n-BuOH-CH3COOH-H2O in
rapporto 60:15:25, per le frazioni da 1 a 20, ed una miscela toluene-HCOOH-AcOEt in rapporto 5:1:4, per le frazioni da 21 a 24. La rivelazione è stata condotta con il reattivo spray solfato di cerio, un reattivo universale che mette in evidenza la grande maggioranza dei metaboliti secondari e non.
R esano R cloroformio
R cloroformio-metanolo R metanolo
Tab. 4.1 Schema di riunione dell’estratto RC-M dopo cromatografia ad esclusione molecolare
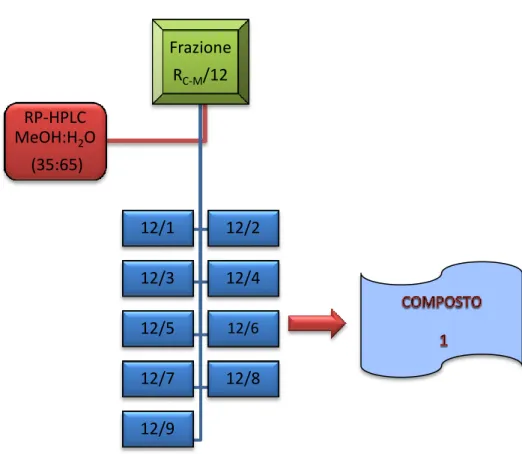
1.3.1 Analisi della frazione R
C-M/12
La frazione RC-M/12 (188.5 mg) è stata disciolta in 200 µl di una soluzione MeOH-H2O (35:65) e
centrifugata. Il sopranatante è stato sottoposto ad HPLC su colonna μ-Bondapak RP18 (30 cm x 7.8
mm). La colonna è stata eluita con una miscela MeOH-H2O (35:65) utilizzando le seguenti
condizioni: Attenuazione : 7x Solvente: MeOH-H2O (35:65) Iniettata: 100 µl Flusso: 2 ml/min Numero di iniettate: 9
Riunione Frazioni riunite Resa in mg Riunione Frazioni riunite Resa in mg 1 17-21 388.2 13 75-84 266.6 2 22-23 183.7 14 85-92 131.7 3 24-25 197.8 15 93-97 50.7 4 26-32 534.9 16 102-110 70 5 33-35 415.2 17 111-116 31.2 6 36-41 1378 18 117-121 62.2 7 42-48 1854 19 122-132 121.5 8 49-54 1461 20 133-140 16.8 9 55-60 1226 21 141-145 10.2 10 61-66 560 22 146-156 12.5 11 67-69 146.6 23 157-164 57 12 70-74 188.5 24 1b-2b 10
L’HPLC ha portato l’ottenimento di 23 frazioni più la frazione derivante dal lavaggio della colonna con MeOH. In seguito a completa evaporazione del solvente, le frazioni sono state sciolte nella minima quantità di MeOH e analizzate su TLC su lastra di gel di silice 60 F254 , utilizzando come fase
mobile una miscela CMW (70:30:3) e come reattivo spray solfato di cerio. Sulla base delle caratteristiche cromatografiche sono state eseguite 9 riunioni (Fig. 4.3) ed eliminate le frazioni non rilevanti.
La frazione 12/6 (11.9 mg, tR=22 min) cromatografata su TLC si presentava anch’essa come
singola macchia di colore bruno. La purezza del composto è stata confermata dagli studi spettroscopici che hanno portato all’identificazione della stessa come phlinoside B, un fenilpropanoide, che va a costituire il composto (1).
I dati chimico-fisici del composto (1) sono i seguenti:
Composto 1: solido amorfo bruno; 1H-NMR e 13C-NMR (Cap 3; Tab. 3.4); ESI-MS m/z 755 [M-H]-, 623 [M-H-132]-, 593 [M-H-162]-, 461 [M-H-162-132]-, 315 [M-H-162-132-146]-, 135 [M-H-162-132-146-180]-; 779 [M+Na]+, 647 [M+Na-132]+, 501 [M+Na-132-146]+, 321 [M+Na-132-146-180]+.
Fig. 4.3 HPLC della frazione RC-M/12 Frazione RC-M/12 12/1 12/2 12/3 12/4 12/5 12/6 12/7 12/8 12/9 RP-HPLC MeOH:H2O (35:65)
1.3.2 Analisi della frazione R
C-M/16
La frazione RC-M/16 (70 mg) è stata disciolta in 700 µl di una soluzione MeOH-H2O (2:3) e
centrifugata. Il sopranatante è stato sottoposto a cromatografia ad alta pressione (HPLC) su colonna μ-Bondapak RP18 (30 cm × 7.8 mm). La colonna è stata condizionata ed eluita con una
miscela MeOH-H2O (2:3) utilizzando le seguenti condizioni: Attenuazione : 7x
Solvente: MeOH-H2O (2:3) Iniettata: 100 µl
Flusso: 2 ml/min
Numero di iniettate: 6
Dalla cromatografia si sono ottenute 30 frazioni a cui si è aggiunta la frazione derivante dal lavaggio della colonna con MeOH. Tali frazioni, dopo completa evaporazione del solvente, sono state disciolte nella minima quantità di metanolo ed analizzate mediante TLC su lastra di gel di silice 60 F254 usando come fase mobile una miscela CMW (CHCl3-MeOH-H2O, 70:30:3) e come
reattivo spray il solfato di cerio.
Sulla base delle caratteristiche cromatografiche, sono state formate 5 riunioni, e si sono eliminate le frazioni non significative (Fig. 4.4).
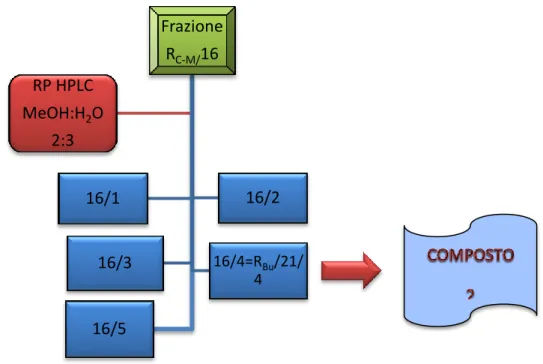
Fig. 4.4 HPLC della frazione RC-M/16 Frazione RC-M/16 16/1 16/2 16/3 16/4=RBu/21/ 4 16/5 RP HPLC MeOH:H2O 2:3
Come risultato di questa separazione cromatografica si è avuto l’isolamento del composto (2) presente nella frazione 16/4.
La frazione 16/4 (8.6 mg, tR=38 min), sottoposta a TLC si presentava come singola macchia di
colore giallo bruno. Le analisi spettroscopiche eseguite sul campione hanno confermato la purezza e portato all’identificazione del composto come ispidulina 7-O-β-D-glucopiranoside (2).
I dati chimico-fisici del composto (2) sono i seguenti:
Composto 2: polvere amorfa bianco crema ; 1H-NMR e 13C-NMR (Cap 3, Tab. 3.1); ESI-MS m/z 461 [M-H]-, 446 [M-H-15]-, 299 [M-H-162]-.
1.4 Studio dell’estratto metanolico (R
M)
Il residuo metanolico (RM), ottenuto per completa evaporazione del solvente a 40-50 °C,
presentava un peso complessivo di 26.759 g. Al fine di facilitare lo studio dei metaboliti secondari, eliminando in particolar modo la parte zuccherina, tale estratto è stato ripartito per mezzo dell’imbuto separatore, in una porzione n-butanolica RBu (5.7 g) ed in una porzione acquosa RW
(15.3 g).
Il residuo n-butanolico così ottenuto è stato disciolto in circa 25 ml di MeOH. La sospensione centrifugata ed il sopranatante sottoposto a cromatografia ad esclusione molecolare su colonna di Sephadex LH-20 (i.d.= 5 cm, V = 19.6 ml/cm), eluendo con metanolo al flusso costante di 0.8 ml/min.
Sono state raccolte 133 provette da 15 ml di volume e 7 beute da 100 ml (1b-7b). Queste frazioni a cui si è aggiunta la frazione ottenuta dal lavaggio della colonna, sono analizzate mediante TLC su gel di silice 60 F254 usando come eluente una miscela BAW (n-BuOH-CH3COOH-H2O, 60:15:25) , e
come reattivo spray di rivelazione il solfato di cerio.
In base alle caratteristiche cromatografiche così evidenziate, le frazioni sono state riunite in 29 frazioni principali, mentre quelle non significative sono state eliminate (Tab. 4.2).
Tab. 4.2 Schema di riunione dell’estratto RBu dopo cromatografia ad esclusione molecolare
Riunione Frazione riunita Resa in mg Riunione Frazione riunita Resa in mg 1 9-22 46.3 16 84-89 347.4 2 23-25 5.0 17 90-94 248.2 3 26-28 55.7 18 95-102 388.4 4 29-31 58.7 19 103-108 76.7 5 32-34 732 20 109-114 59.3 6 35-38 148.1 21 115-122 115 7 39-41 59.4 22 123-127 80.7 8 42-46 66.6 23 128-129 41.4 9 47-49 93.6 24 130-133 120 10 50-51 86 25 1b-2b 277.5 11 52-53 130 26 4b+5b 100.5 12 54-60 669.8 27 6b+7b 12.9 13 61-67 771.9 14 68-78 1.041g 15 79-83 358
1.4.1 Analisi della frazione R
Bu/14
La frazione RBu/14 (1.041 g) prima di essere ulteriormente cromatografata è stata ripartita in due
porzioni usando acqua e n-butanolo in quanto sembrava contenere ancora zuccheri. La porzione butanolica che ha presentato un peso di 780 mg, è stata disciolta in 7.8 ml di una soluzione MeOH-H2O (2:3). In seguito a centrifuga il sopranatante è stato sottoposto ad HPLC su una colonna
µ-Bondapack RP18 (30 cm x 7.8 mm).
La colonna è stata condizionata ed eluita con una miscela di MeOH-H2O (2:3) operando nelle
seguenti condizioni:
Attenuazione: 7x
Eluente: MeOH-H2O (2:3) Velocità di flusso: 2 ml/min
Iniettata: 100 µl
Numero di iniettate: 6
L’HPLC ha fornito 34 frazioni compresa quella derivante dal lavaggio con MeOH della colonna. Queste sono state completamente portate a secco e, ridisciolte nella minima quantità di MeOH per essere sottoposte a TLC su lastra di gel di silice 60 F254. La fase mobile impiegata è stata una
miscela BAW (n-BuOH-CH3COOH-H2O, 60:15:25) e come reattivo spray di rivelazione il solfato di
cerio.
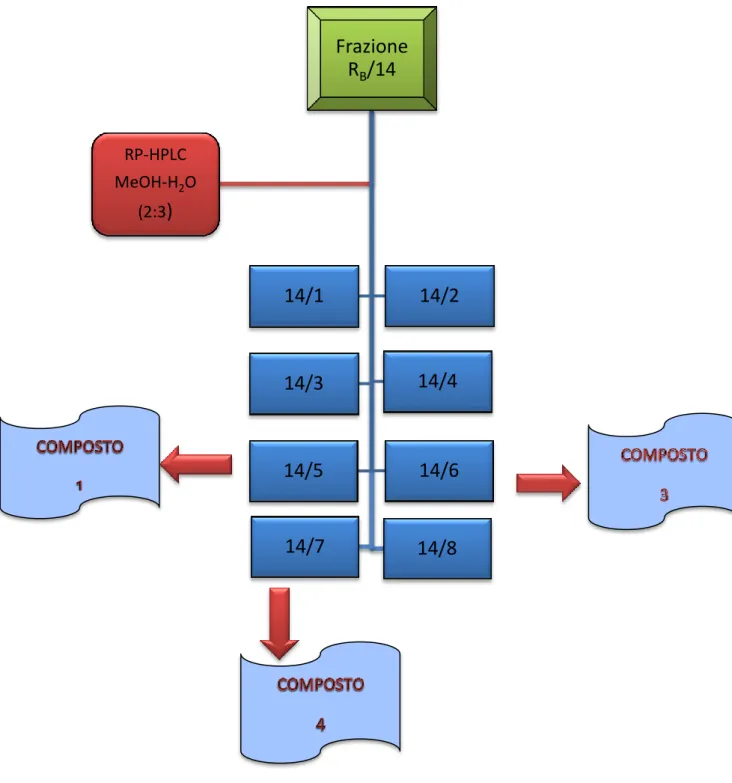
In base alle caratteristiche cromatografiche evidenziate si sono raggruppate le frazioni in 8 riunioni principali (Fig. 4.5) ed eliminato quelle non rilevanti.
La frazione 14/5 (9 mg, tR=13 min) cromatografata su TLC, si presentava come singola macchia.
Gli studi spettroscopici hanno evidenziato oltre alla purezza del campione, anche che essa conteneva il composto (1) già isolato dalla frazione RC-M/12/6.
La frazione 14/6 (1.1 mg, tR=20 min) caratterizzata mediante analisi spettroscopiche, ha
evidenziato essere un nuovo fenilpropanoide, (3,4- diidrossifenil)etil-O-β-D-xilopiranosil-(1→2)-α-L-ramnopiranosil-(1→3)-6-O-t-caffeoil-β-D-glucopiranoside (3).
La frazione 14/7 (1 mg, tR=38 min) cromatografata su TLC dopo analisi spettroscopiche, è stata
identificata come ispidulina 7-neoesperidoside (4). I dati chimico-fisici dei composti (3) e (4) sono i seguenti:
Composto 3: solido amorfo bruno ; [α]25= - 10.7 (c= 0.5, MeOH); UV λmax nm 1H-NMR e 13C-NMR
(Cap 3, Tab. 3.5); HR-ESIMS 757.2637 [M]+; ESI-MS m/z 779 [M+Na]+, 647 [M+Na-132]+, 501 [M+Na-132-146]+; 755 [M-H]-, 623 [M-H-132]-, 593 [M-H-162]-.
Composto 4: polvere amorfa giallo pallido; 1H-NMR e 13C-NMR (Cap 3, Tab. 3.2); ESI-MS m/z 607 [M-H]-, 299 [M-H-146-162]-, 284 [M-H-146-162-15]-; 609 [M+H]+, 463 [M+H-146]+, 301 [M+H-146-162]+, 286 [M+H-146-162-15]+.
Fig. 4.5 HPLC della frazione RBu/14
Frazione
R
B/14
14/1
14/2
14/3
14/4
14/5
14/6
14/7
14/8
RP-HPLC MeOH-H2O (2:3)
4.4.2 Analisi della frazione R
Bu/17
La frazione RBu/17 (248.2 mg) è stata disciolta in 2.5 ml di una soluzione MeOH-H2O (2:3) e
centrifugata. Il sopranatante è stato sottoposto a HPLC su una colonna µ-Bondapack RP18 (30 cm x
7.8 mm). La colonna è stata condizionata ed eluita con una miscela di MeOH-H2O (2:3) operando
nelle seguenti condizioni:
Attenuazione: 7x
Eluente: MeOH-H2O (2:3) Velocità di flusso: 2 ml/min
Iniettata: 100 µl
Numero di iniettate: 7
Dalla cromatografia si sono ottenute 26 frazioni, più il lavaggio della colonna con MeOH. Dopo la completa evaporazione del solvente, ogni frazione è stata sciolta nella minima quantità di MeOH e cromatografata su TLC su lastra di gel di silice 60 F254, impiegando come fase mobile una miscela
BAW (n-BuOH-CH3COOH-H2O, 60:15:25) e come reattivo spray di rivelazione il solfato di cerio.
Sulla base delle caratteristiche cromatografiche si sono state ottenute 5 riunioni (Fig. 4.6) e le frazioni non significative sono state eliminate.
Le caratteristiche cromatografiche, rilevate mediante TLC con la miscela eluente predetta, hanno sollecitato ulteriori indagini tramite analisi spettroscopica delle frazioni 17/2, 17/4 e 17/5.
La frazione 17/2 (2.4 mg, tR=13 min) si è rivelata essere il fenilpropanoide verbascoside (5).
L’analisi spettroscopica della frazione 17/4 (5.6 mg, tR=20 min) ha permesso la sua identificazione
come composto (3) presente anche nella frazione RBu/14.
La frazione 17/5 (7.4 mg, tR=35 min) è stata identificata come composto (4) presente anche nella
frazione 14/10.
I dati chimico-fisici del composto (5) sono i seguenti:
Composto 5: solido amorfo di colore giallo pallido ; 1H-NMR e 13C-NMR (Cap 3, Tab. 3.6); ESI-MS
Fig. 4.6 HPLC della frazione RBu/17
4.4.3 Analisi della frazione R
Bu/19
La frazione RBu/19 (76.7 mg) è stata disciolta in 1 ml di una soluzione MeOH-H2O (2:3) e
centrifugata. Il sopranatante è stato sottoposto poi a cromatografia ad alta pressione HPLC su una colonna µ-Bondapack RP18 (30 cm x 7.8 mm). La colonna è stata condizionata ed eluita con una
miscela di MeOH-H2O (2:3) operando nelle seguenti condizioni: Attenuazione: 7x
Eluente: MeOH-H2O (2:3) Velocità di flusso: 2 ml/min
Iniettata: 100 µl
Numero di iniettate: 7
Dalla cromatografia HPLC si sono ottenute diverse frazioni a cui si è aggiunta la frazione del lavaggio della colonna con MeOH. In seguito ad evaporazione del solvente, le frazioni sono state disciolte nella minima quantità di MeOH, e sottoposte a TLC su lastra di gel di silice 60 F254,
impiegando come fase mobile una miscela BAW (n-BuOH-CH3COOH-H2O, 60:15:25) e come
reattivo spray di rivelazione il solfato di cerio. Frazione RB/17
17/1
17/2
17/3
17/4
17/5
RP-HPLC
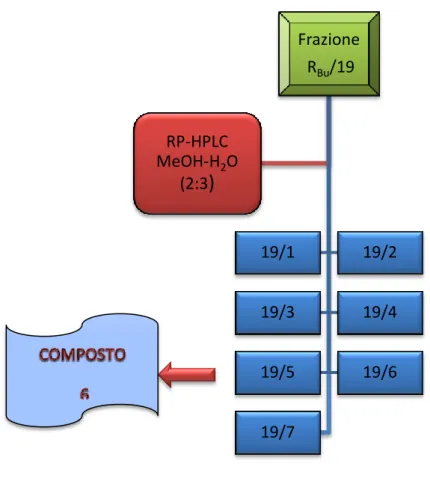
MeOH-H2O 40:60Sulla base delle caratteristiche cromatografiche sono state realizzate 7 riunioni (Fig. 4.7) eliminando quelle non significative.
Fig. 4.7 HPLC della frazione RBu/19
La frazione 19/5 (5.1 mg, tR=20 min) cromatografata su TLC si presentava sotto forma di singola
macchia marroncina. Le analisi spettroscopiche hanno confermato la purezza del campione ed hanno portato alla sua identificazione come isoacteoside,(6).
I dati chimico-fisici del composto (6) sono i seguenti:
Composto 6: solido amorfo bruno; 1H-NMR e 13C-NMR (Cap 3, Tab. 3.7); ESI-MS m/z 647 [M+Na]+, 501 [M+Na-146]+; 623 [M-H]-, 461 [M-H-162]-.
4.4.4 Analisi della frazione R
Bu/21
La frazione RBu/21 (115 mg) è stata sciolta in 1.2 ml di una soluzione MeOH-H2O (2:3). La soluzione
è stata centrifugata e, il sopranatante sottoposto ed HPLC su una colonna µ-Bondapack RP18 (30
cm x 7.8 mm). La colonna è stata condizionata ed eluita con una miscela di MeOH-H2O (2:3)
operando nelle seguenti condizioni:
Frazione RBu/19 19/1 19/2 19/3 19/4 19/5 19/6 19/7 RP-HPLC MeOH-H2O (2:3
)
Attenuazione: 7x
Eluente: MeOH-H2O (2:3) Velocità di flusso: 2 ml/min
Iniettata: 100 µl
Numero di iniettate: 6
La cromatografia ha fornito 35 frazioni più la frazione ottenuta dopo lavaggio della colonna con MeOH. Dopo completa evaporazione del solvente, le frazioni sono state disciolte nella minima quantità di MeOH e fatte correre su TLC 60 F254, usando come fase mobile una miscela BAW
(n-BuOH-CH3COOH-H2O, 60:15:25) e come reattivo spray di rivelazione il solfato di cerio. Sulla base
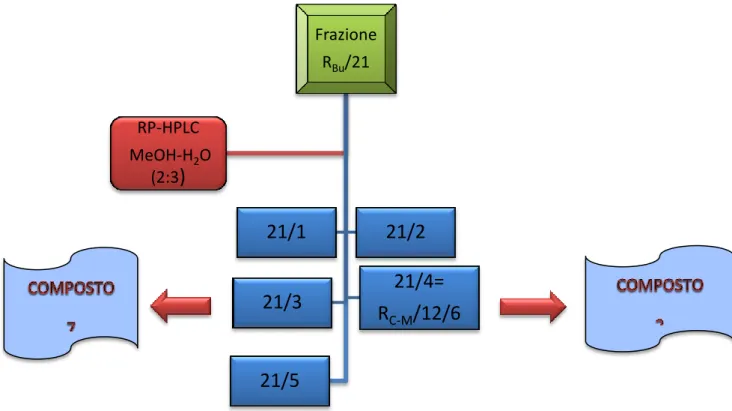
delle caratteristiche cromatografiche sono state realizzate 5 riunioni secondo lo schema riportato in (Fig. 4.8), e le frazioni non rilevanti sono state eliminate.
Fig. 4.8 HPLC della frazione RBu/21
Tra queste riunioni, la frazione 21/3 e 21/4 si presentavano come singole macchie dopo cromatografia su TLC, e questo ha sollecitato la loro ulteriore investigazione.
La frazione 21/3 (2.2 mg, tR=29 min) dalle analisi spettroscopiche si è rivelata essere il flavonoide
luteolina 7-neoesperidoside (7). Frazione RBu/21
21/1
21/2
21/3
R
21/4=
C-M/12/6
21/5
RP-HPLC MeOH-H2O (2:3)
Le analisi spettroscopiche della frazione 21/4 (2 mg, tR=45 min) hanno consentito di identificare il
composto come ispidulina 7-O-β-D-glucopiranoside (2) già precedentemente isolato dalla frazione RC-M/12.
I dati chimico-fisici del composto (7) sono i seguenti:
Composto 7: solido amorfo di colore giallo pallido; 1H-NMR e 13C-NMR (Cap 3, Tab. 3.3); ESI-MS
m/z 593 [M-H]-, 447 [M-H-146]-, 285 [M-H-146-162]-, 595 [M+H]+.
4.4.5 Analisi della frazione R
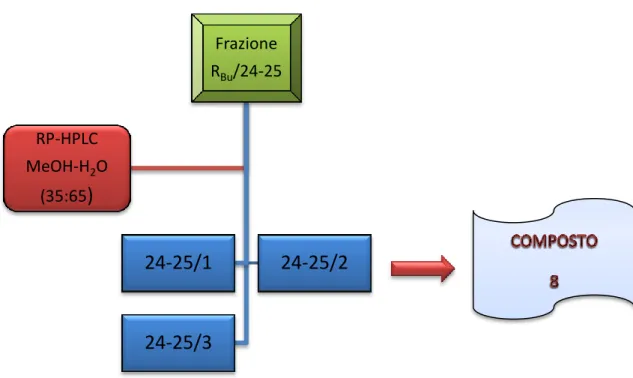
Bu/24-25
Le frazioni RBu/24 e RBu/25 sottoposte a TLC su lastra di gel di silice 60 F254, e come fase mobile
una miscela BAW (n-BuOH-CH3COOH-H2O, 60:15:25), hanno mostrato una certa analogia, e
pertanto sono state riunite prima di essere sottoposte ad ulteriore cromatografia. La frazione RBu/24-25 (120 mg) così ottenuta, è stata disciolta in 1.2 ml di una soluzione MeOH-H2O (35:65) e
centrifugata. Il sopranatante è stato poi sottoposto ad HPLC su una colonna µ-Bondapack RP18 (30
cm x 7.8 mm) condizionando ed eluendo la colonna con una miscela di MeOH-H2O (35:65)
operando nelle seguenti condizioni:
Attenuazione: 7x
Eluente: MeOH-H2O (35:65) Velocità di flusso: 2 ml/min
Iniettata: 100 µl
Numero di iniettate: 5
Dalla cromatografia si sono ottenute 20 frazioni, a cui si è aggiunta la frazione contenente il lavaggio della colonna con MeOH. Dopo completa evaporazione del solvente, le frazioni sono state disciolte nella minima quantità di MeOH e sottoposte a TLC 60 F254 e, come miscela eluente una
miscela BAW (n-BuOH-CH3COOH-H2O, 60:15:25) e come reattivo spray di rivelazione il solfato di
cerio.
Sulla base delle caratteristiche cromatografiche, le frazioni sono state raggruppate in tre riunioni principali (Fig. 4.9) e, quelle non significative sono state eliminate.
Ha suscitato ulteriore interesse solo il campione 24-25/2 (6.6 mg ,tR=35 min), il quale
cromatografato su TLC si presentava come singola macchia di colore bruno rossastro. Le analisi spettroscopiche hanno portato all’identificazione del composto come acido rosmarinico (8).
Composto 8: solido amorfo di colore giallo pallido; 1H-NMR e 13C-NMR (Cap 3, Tab. 3.8); ESI-MS
m/z 359 [M-H]-, 197 [M-H-162]-.
Fig. 4.9 HPLC della frazione RBu/24-2 Frazione RBu/24-25
24-25/1
24-25/2
24-25/3
RP-HPLC MeOH-H2O (35:65)
4.5 Studio dell’estratto cloroformico (R
CHCl3)
Il residuo cloroformico (RCHCl3) ottenuto per completa evaporazione del solvente, presentava un
peso complessivo di 13.474 g. Una parte di questo residuo (circa 10 g) è stata disciolta in circa 45 ml di CHCl3 e successivamente sottoposta a centrifugazione.
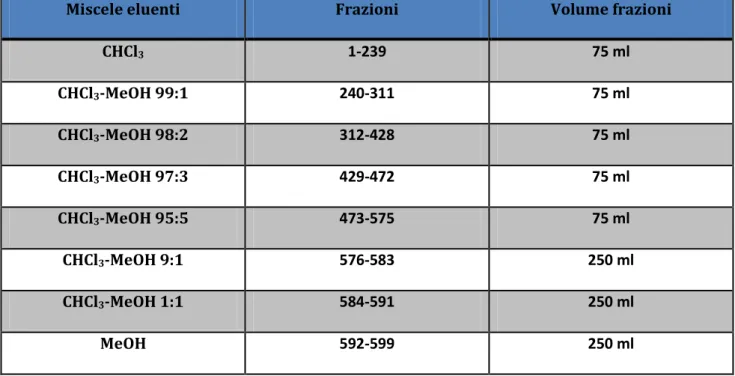
Il sopranatante ottenuto è stato sottoposto a cromatografia flash, realizzata in una colonna di gel di silice (25 × 9 cm) con flusso approssimativamente di circa 75 ml/min. Sono state raccolte, in beute, 599 frazioni utilizzando, come eluenti, miscele di solventi a polarità crescente, come illustrato in (Tab. 4.3.)
Miscele eluenti Frazioni Volume frazioni
CHCl3 1-239 75 ml CHCl3-MeOH 99:1 240-311 75 ml CHCl3-MeOH 98:2 312-428 75 ml CHCl3-MeOH 97:3 429-472 75 ml CHCl3-MeOH 95:5 473-575 75 ml CHCl3-MeOH 9:1 576-583 250 ml CHCl3-MeOH 1:1 584-591 250 ml MeOH 592-599 250 ml
Tab. 4.3 Cromatografia flash di RC , miscele eluenti, frazioni raccolte e loro volumi.
Le frazioni ottenute sono state successivamente riunite in 40 riunioni principali tenendo conto delle caratteristiche cromatografiche evidenziate da cromatografia su strato sottile (TLC) su lastra di gel di silice 60 F 254 . Le fasi mobili utilizzate a tale scopo sono state solo CHCl3, diverse miscele
CHCl3-MeOH (99:1, 97:3, 95:5, 9:1, 85:15) e una miscela CHCl3-MeOH –H2O (CMW) in proporzione
80:18:2.
Le frazioni sono state rivelate con il reattivo spray solfato di cerio. Al termine si è ottenuto lo schema di riunione presentato in (Tab. 4.4).
Riunione Fraz. riunite Resa in mg Riunione Fraz. riunite Resa in mg 1 1-3 257.6 21 263-267 205 2 4-6 829 22 268-285 303.4 3 7-15 352.2 23 286-296 349.4 4 16-21 56.8 24 297-346 52 5 22-25 72.9 25 347-352 278.7 6 26-31 100.2 26 353-373 500 7 32-56 23.9 27 374-442 185.8 8 57-72 26.4 28 443-468 121 9 73-90 32.8 29 469-493 155.9 10 91-94 319 30 494-508 292.2 11 95-97 113.6 31 509-541 79.8 12 98-101 228.3 32 542-562 127.4 13 102-107 58.6 33 563-575 249 14 108-115 557.4 34 576-578 213.2 15 116-156 348 35 579-583 27.2 16 157-180 953.4 36 584-586 230.2 17 181-190 319 37 587-588 477.3 18 191-213 274.5 38 589-591 980.4 19 214-222 596.3 39 592-596 455.4 20 223-262 196.2 40 597-599 110.4
4.5.1 Analisi della frazione R
C/16-18
Le frazioni RC/16 (958.4 mg), RC/17 (319 mg) e RC/18 (274.5mg), viste le loro affinità
cromatografiche rivelate mediante TLC, sono state riunite, dopo aver disciolto separatamente ciascuna in una soluzione metanolo-acqua (7:3). Il sopranatante ottenuto è stato poi portato a secco, ottenendo un campione di 21.5 mg. Questo è stato disciolto in 200 µl di una soluzione MeOH-H2O (7:3) e successivamente sottoposto a cromatografia ad alta pressione (HPLC) su
colonna μ-Bondapak RP18 (30 cm × 7.8 mm). La colonna è stata condizionata ed eluita con una
miscela di MeOH-H2O (7:3) utilizzando le seguenti condizioni: Attenuazione: 7x
Eluente: MeOH-H2O (7:3) Velocità di flusso: 2,0 ml/min Iniettata: 100 µl
Numero di iniettate: 2
Dalla cromatografia sono state ottenute 32 frazioni più la frazione ottenuta dal lavaggio della colonna con metanolo. Tali frazioni, dopo completa evaporazione del solvente, sono state disciolte nella minima quantità di metanolo e sottoposte a TLC su lastra di gel di silice 60 F254 usando come
fase mobile una miscela CHCl3-MeOH (99:1) e come reattivo spray di rivelazione il solfato di cerio.
Sulla base delle caratteristiche cromatografiche sono state riunite le frazioni in 8 riunioni principali (Fig. 4.10) eliminando quelle non significative.
La frazione 16-18/5 (1.5 mg, tR= 19 min) su TLC si presentava come singola macchia. Le analisi
spettroscopiche hanno permesso la sua identificazione come composto terpenoidico, il sesquiterpene 2β-angeloilossi-5β-idrossi-7αH,10β-metil-eudesm-3-en-1-one (9).
I dati chimico-fisici del composto (9) sono i seguenti:
Composto 9: solido amorfo; 1H-NMR e 13C-NMR (Cap 3, Tab. 3.9); ESI-MS m/z 357 [M+Na]+, 274 [M+Na-83]+, 257 [M+Na-100]+.
Fig. 4.10 HPLC della frazione RC/16-18
4.5.2 Analisi della frazione R
C/26
La frazione RC/26 (500 mg) è stata disciolta in una soluzione MeOH-H2O (3:2). Il sopranatante è
stato poi portato a secco ottenendo così un campione di 113 mg. Questo è stato disciolto in 1.3 ml di una soluzione metanolo-acqua (3:2) e poi successivamente è stato sottoposto a cromatografia ad alta pressione (HPLC) su colonna μ-Bondapak RP18 (30 cm × 7.8 mm). La colonna è stata
condizionata ed eluita con una miscela di metanolo-acqua (60:40) utilizzando le seguenti condizioni:
Attenuazione: 7x
Eluente: MeOH-H2O (3:2) Velocità di flusso: 2 ml/min
Iniettata: 100 µl
Numero di iniettate: 10
Dalla cromatografia si sono ottenute 24 frazioni a cui si è aggiunta la frazione derivante dal lavaggio della colonna con metanolo. Le frazioni, dopo completa evaporazione del solvente, sono state disciolte nella minima quantità di metanolo e sottoposte a TLC su lastra di gel di silice 60 F254
Frazione RC/16-18 16-18/1 16-18/2 16-18/3 16-18/4 16-18/5
16-18/6
16-18/7 16-18/8
RP-HPLC MeOH-H2O (7:3)usando come fase mobile una miscela CHCl3-MeOH (95:5) e come reattivo spray di rivelazione il
solfato di cerio.
In considerazione delle caratteristiche cromatografiche si sono ottenute 7 riunioni principali (Fig.
4.11) e quelle non rilevanti sono state eliminate.
Fig.4.11 HPLC della frazione RC/26
La frazione 26/3 (5.5 mg, tR=11 min) su TLC si presentava come una singola macchia. Dalle analisi
spettroscopiche è stata possibile la loro identificazione come 14,15-diidro-15-idrossi-3-epicarioptina (10), un derivato diterpenico.
La frazione 26/6 (5.4 mg, tR=22 min) si presentava anch’essa come singola macchia su TLC. Le anali
spettroscopiche hanno confermato la purezza del composto ed hanno permesso la sua caratterizzazione come composto a struttura diterpenica mai precedentemente isolato, 2α-acetossi-3β-(2’,3’-diacetossi-2’-metil)-butanoilossi-14-idro-15-idrossiclerodina (11).
I dati chimico-fisici dei composti (10) e (11) sono i seguenti:
Composto 10: solido amorfo incolore; 1H-NMR e 13C-NMR (Cap 3, Tab. 3.10); ESI-MS m/z 509 [M-H]-, 467 [M-H-42]-, 425 [M-H-42-42]-, 383 [M-H-42-42-42]-: 533 [M+Na]+. Frazione RC/26
26/1
26/2
26/326/4
26/5
26/6
26/7
RP-HPLC MeOH-H2O (3:2)
Composto 11: solido amorfo incolore; [α]25=-9.4 (c=0.5, MeOH) 1H-NMR e 13C-NMR (Cap 3, Tab. 3.11); HR-ESIMS [M+H]+ 7273204; ESI-MS m/z 749 [M+Na]+, 689 [M+Na-60]+, 531 [M+Na-218]+, 489 [M+Na-218-42]+, 471 [M+Na-218-60]+, 411 [M+Na-218-60-60]+.
4.5.3 Analisi della frazione R
C/30
La frazione RC/30 (292 mg) è stata disciolta in una soluzione MeOH-H2O (7:3). Il sopranatante è
stato poi portato a secco e pesato (35 mg). Il campione così ottenuto è stato poi disciolto in 400 µl di una soluzione MeOH-H2O (2:3) e sottoposto a cromatografia ad alta pressione (HPLC) su
colonna μ-Bondapak RP18 (30 cm × 7.8 mm). La colonna è stata condizionata ed eluita con una
miscela di MeOH-H2O (2:3) utilizzando le seguenti condizioni: Attenuazione: 7x
Eluente: MeOH-H2O (2:3) Velocità di flusso: 2 ml/min
Iniettata: 100 µl
Numero di iniettate: 4
Dalla cromatografia HPLC son state raccolte 24 frazioni più il lavaggio della colonna con metanolo. Le frazioni, dopo completa evaporazione del solvente, son state disciolte nella minima quantità di metanolo e sottoposte a TLC su lastra di gel di silice 60 F254 usando come fase mobile una miscela
CHCl3-MeOH (95:5) e come reattivo spray di rivelazione il solfato di cerio.
In base alle caratteristiche cromatografiche si sono ottenute 7 riunioni principali (Fig. 4.12), dopo aver eliminato le frazioni non significative.
La frazione 30/7 (1.8 mg, tR=27 min) cromatografata su TLC si presentava come singola macchia. Le
analisi spettroscopiche hanno permesso di identificare e caratterizzare la molecola come nuovo composto neo-clerodanico, 13,15-diidrossi-14-idro-clerodina (12).
I dati chimico-fisici del composto (12) sono i seguenti:
Composto 12: solido amorfo incolore; [α]25= + 5.7 (c=0.15); 1H-NMR e 13C-NMR (Cap 3, Tab. 3.12);
HRESIMS [M+H]+ ; ESI-MS m/z 491 [M+Na]+, 431 [M+Na-60]+, 371 [M+Na-60-60]+; 467 [M-H]-, 425 [M-H-42]-, 383 [M-H-42-42]-.
Fig.4.12 HPLC della frazione Rc/30
4.5.4 Analisi della fazione R
C/33
La frazione RC/33 (249 mg) è stata disciolta in una soluzione MeOH-H2O (3:2). Il sopranatante è
stato poi portato a secco. Il campione ottenuto (35 mg) è stato poi disciolto in 400 µl di una soluzione MeOH-H2O (45:55) e sottoposto a cromatografia ad alta pressione (HPLC) su colonna
μ-Bondapak RP18 (30 cm × 7.8 mm). La colonna è stata condizionata ed eluita con una miscela di
MeOH-H2O (45:55) utilizzando le seguenti condizioni: Attenuazione: 7x
Eluente: MeOH-H2O (45:55) Velocità di flusso: 2 ml/min
Iniettata: 100 µl
Numero di iniettate: 4
Dalla cromatografia si sono ottenute 30 frazioni più la frazione ottenuta dal lavaggio della colonna con metanolo. Le frazioni, dopo completa evaporazione del solvente, sono state disciolte nella
Frazione
R
C/30
30/1
30/2
30/3
30/4
30/5
30/6
30/7
RP-HPLC
MeOH-H
2O
(40:60)
minima quantità di metanolo e sottoposte TLC su lastra di gel di silice 60 F254 usando come fase
mobile una miscela CHCl3-MeOH (95:5) e come reattivo spray il solfato di cerio.
Sulla base delle caratteristiche cromatografiche le sono state raggruppate le frazioni in 9 riunioni principali (Fig. 4.13) e le frazioni non significative sono state eliminate.
La frazione 33/7 (1.4 mg, tR=20 min) su TLC si presentava come singola macchia costituita quindi
da una molecola pura. Grazie alle analisi spettroscopiche tale composto è stato caratterizzato come 2α,15-diidrossi-3β-(2’-idrossi-2’-metil-3’-acetossi)-butanoilossi-6α,18-diacetossi-4α,17-epossi-clerodan-11,16-lattone (13).
Fig.4.13 HPLC della fazione RC/33
I dati chimico-fisici del composto (13) sono i seguenti:
Composto 13: solido amorfo incolore; [α]25=-5.7 (C=0.11, MeOH); HR-ESIMS [M+H]+ 643.2899; 1
H-NMR e 13C-NMR (Cap 3, Tab. 3.13); ESI-MS m/z 665 [M+Na]+, 605 [M+Na-60]+, 486 [M+Na-176]+. Frazione Rc/33 33/1 33/2 33/3 33/4 33/5 33/6 33/7 33/8 33/9 RP-HPLC MeOH-H2O (45:55)
4.5.5 Analisi della frazione R
C/35
La frazione RC/35 (270 mg) è stata disciolta in una soluzione MeOH-H2O (7:3). Il sopranatante è
stato portato poi portato a secco. Il campione ottenuto (64.4 mg) è stato poi disciolto in 700 µl di una soluzione MeOH-H2O (2:3) e sottoposto a cromatografia ad alta pressione (HPLC) su colonna
μ-Bondapak RP18 (30 cm × 7.8 mm). La colonna è stata condizionata ed eluita con una miscela di
metanolo-acqua (2:3) utilizzando le seguenti condizioni:
Attenuazione: 7x
Eluente: MeOH-H2O (2:3) Velocità di flusso: 2 ml/min
Iniettata: 100 µl
Numero di iniettate: 6
Dalla cromatografia si sono ottenute 25 frazioni più la frazione ottenuta dal lavaggio della colonna con metanolo. Le frazioni, dopo completa evaporazione del solvente, sono state disciolte nella minima quantità di metanolo e sottoposte TLC su lastra di gel di silice 60 F254 usando come fase
mobile una miscela CHCl3-MeOH (9:1) e come reattivo spray di rivelazione il solfato di cerio.
Sulla base delle caratteristiche cromatografiche evidenziate, come mostrato in Fig. 4.14, sono state ottenute 7 riunioni.
La frazione 35/2 (10.3 mg,tR=12 min) cromatografata su TLC si presentava come macchia pulita.
Dalle analisi spettroscopiche è stato possibile identificare e caratterizzare la molecola come 3,14,15-triidrossi-6α,18-diacetossi-4α,17-epossi-clerodan-11,16-lattone (14).
I dati chimico-fisici del composto (14) sono i seguenti:
Composto 14: solido amorfo incolore; [α]25= + 2.5 (C=0.13, MeOH); HR-ESIMS [M+H]+ 485.2423,
[M+Na]+ 507.2246; 1H-NMR e 13C-NMR (Cap 3, Tab. 3.14); ESI-MS m/z 507 [M+Na]+, 447 [M+Na-60]+, 387 [M+Na-60-60]+.
Fig.4.14 HPLC della frazione RC/35 Frazione RC/35 35/1 35/2 35/3 35/4 35/5 35/6 35/7