15
2. RISULTATI E DISCUSSIONE
2.1. Reazioni di attivazione di molecole organiche contenenti atomi
di ossigeno
Tutte le reazioni sono state condotte in soluzione di CH2Cl2 e i prodotti inorganici isolati sono stati caratterizzati mediante tecniche spettroscopiche (NMR in soluzione, IR allo stato solido) e analitiche (conducibilità elettrica in soluzione). In più, è stato possibile determinare, in un buon numero di casi, la struttura allo stato solido di tali composti mediante diffrazione di raggi X. L’identificazione dei prodotti organici derivanti dalla attivazione dei substrati e non impegnati nella coordinazione ai centri metallici, quando possibile, è stata effettuata mediante analisi NMR e GC/MS.
2.1.1. Attivazione di composti carbonilici
Il risultato di maggior rilievo è dato dalla reazione di MoCl5, 1a, con dimetilformammide (Me2NCHO, DMF) in rapporto molare 1:2, che genera il composto ionico [MoOCl4(O=CHNMe2)]− [ClCHNMe2]+, 2, in rese elevate. La formazione di 2 è chiaramente il risultato dello scambio di un atomo di ossigeno con un legante cloruro tra una molecola di DMF e MoCl5, conseguenza della ossofilicità del centro metallico.29 L’anione risultante, [MoOCl4]−, è in grado successivamente di coordinare una seconda molecola di DMF per completare la sfera di coordinazione del molibdeno; si ottiene così [MoOCl4(O=CHNMe2)]−.30 La carica negativa di tale anione è bilanciata dal catione imminio [HClC=NMe2]+ (Schema 8).
16 Schema 8: Reazione di MoCl5 con DMF.
MoCl5 + H N O Me Me [MoOCl4]− + C+ N Cl Me Me H Mo Cl Cl Cl O Cl H N O − 2 H N O Me Me Me Me N H Me Me Cl +
La struttura allo stato solido di 2 è stata determinata tramite diffrazione di raggi X su cristallo singolo ed è rappresentata in Figura 2. Inoltre, le distanze e gli angoli di legame sono riportati in Tabella 1.
17 Tabella 1: Distanze (Å) e angoli di legame (°) nel complesso 2.
Distanze di legame Mo(1)−O(1) 1.662(3) Mo(1)−O(2) 2.234(3) Mo(1)−Cl(3) 2.3565(10) Mo(1)−Cl(4) 2.3658(10) Mo(1)−Cl(2) 2.3955(10) Mo(1)−Cl(1) 2.4018(10) O(2)−C(1) 1.246(5) C(1)−N(1) 1.317(5) N(1)−C(2) 1.455(5) N(1)−C(3) 1.467(5) Cl(5)−C(4) 1.673(5) C(4)−N(2) 1.259(6) N(2)−C(6) 1.472(6) N(2)−C(5) 1.536(6) Angoli di legame
O(1)
−
Mo(1)−
O(2) 177.43(12) O(1)−
Mo(1)−
Cl(3) 98.13(11) O(2)−
Mo(1)−
Cl(3) 83.95(8) O(1)−
Mo(1)−
Cl(4) 97.56(10) O(2)−
Mo(1)−
Cl(4) 83.93(8) Cl(3)−
Mo(1)−
Cl(4) 90.05(4) O(1)−
Mo(1)−
Cl(2) 95.53(10) O(2)−
Mo(1)−
Cl(2) 82.93(8) Cl(3)−
Mo(1)−
Cl(2) 89.45(4) Cl(4)−
Mo(1)−
Cl(2) 166.84(4) O(1)−
Mo(1)−
Cl(1) 94.43(11) O(2)−
Mo(1)−
Cl(1) 83.50(8) Cl(3)−
Mo(1)−
Cl(1) 167.44(4) Cl(4)−
Mo(1)−
Cl(1) 88.12(4) Cl(2)−
Mo(1)−
Cl(1) 89.52(4) C(1)−
O(2)−
Mo(1) 129.3(3) O(2)−
C(1)−
N(1) 123.5(4) C(1)−
N(1)−
C(2) 122.2(3) C(1)−
N(1)−
C(3) 120.9(3) C(2)−
N(1)−
C(3) 116.6(3) N(2)−
C(4)−
Cl(5) 122.8(4) C(4)−
N(2)−
C(6) 123.5(4) C(4)−
N(2)−
C(5) 122.3(4) C(6)−
N(2)−
C(5) 114.2(4)Come si evince dalla struttura allo stato solido, l’anione consiste di un atomo di molibdeno esacoordinato, con un legante DMF in posizione trans rispetto alla unità ossido. La coordinazione intorno al metallo è approssimativamente ottaedrica: il metallo giace fuori dal piano individuato dagli atomi di Cl (gli angoli O(1)−Mo−Cl e O(2)−Mo−Cl misurano in media 96° e 84° rispettivamente) e le distanze di legame Mo−O(1) e Mo−O(2) sono rispettivamente di 1.662(3) Å e 2.234(3) Å.30,31 Il catione imminio è planare e la distanza C(4)−N(2) risulta pari a 1.259(6) Å, il che rende ragione del carattere di doppio legame C=N.32
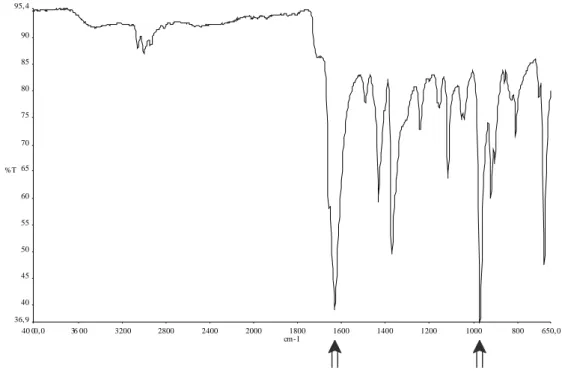
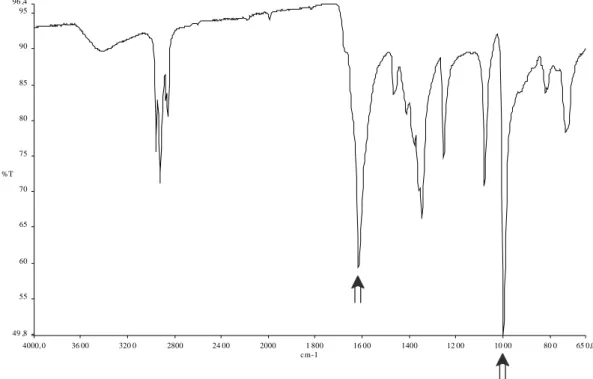
Lo spettro IR di 2 allo stato solido (Figura 3) presenta due bande intense e particolarmente significative: una a 1658 cm−1, relativa allo stiramento del doppio
18 legame C=O della DMF coordinata (νC=O nella DMF libera è pari a 1687 cm−1),33 e l’altra a 971 cm−1, attribuita allo stiramento del legame Mo=O.34
Figura 3: Spettro IR di 2 allo stato solido.
40 00,0 36 00 3200 2800 2400 2000 1800 1600 1400 1200 1000 800 650,0 36,9 40 45 50 55 60 65 70 75 80 85 90 95,4 cm-1 %T
Misure di conducibilità in soluzione hanno confermato la natura ionica del composto. Infatti, la conduttività molare (ΛM) risulta pari a 3.17S·cm2·mol−1, in CH2Cl2, e rientra nell’intervallo di valori tipici dei derivati ionici di alogenuri metallici dei primi gruppi di transizione.35
La sintesi del catione imminio [HClC=NMe2]+, a partire da dimetilformammide e POCl3, è ben nota e utilizzata nella reazione di Vilsmeier.36
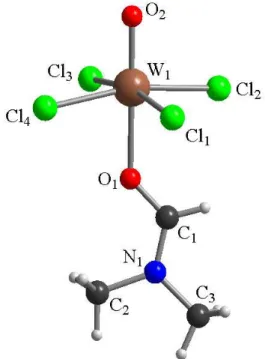
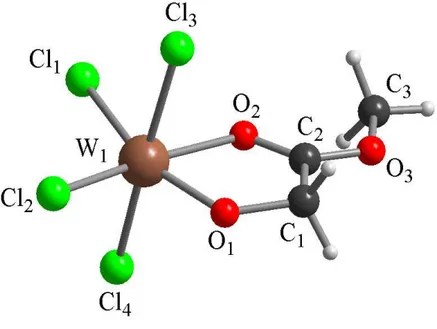
La reazione di WCl6, 1b, con DMF fornisce il composto ossicloruro neutro WOCl4(O=CHNMe2), 3, identificato mediante diffrazione di raggi X su cristallo singolo (Figura 4, Tabella 2) e caratterizzato mediante spettroscopia NMR. La struttura allo stato solido mostra un atomo di tungsteno esacoordinato, con un legante DMF in posizione trans rispetto alla unità ossido. Il metallo giace fuori dal piano individuato dagli atomi di Cl, infatti gli angoli O(1)−W−Cl e O(2)−W−Cl misurano in media 84° e 96° rispettivamente, e le distanze di legame W−O(1) e W−O(2) sono rispettivamente di 2.157(3) Å e 1.691(3) Å. Tali valori sono in accordo con quelli riportati in letteratura per legami W−O e W=O.37a
19 Figura 4: Struttura allo stato solido di 3 determinata tramite diffrazione di raggi X.
Tabella 2: Distanze (Å) e angoli di legame (°) nel complesso 3.
Distanze di legame C(1)−O(1) 1.263(5) C(1)−N(1) 1.297(6) C(2)−N(1) 1.471(5) C(3)−N(1) 1.455(5) Cl(1)−W(1) 2.3256(10) Cl(2)−W(1) 2.3136(11) Cl(3)−W(1) 2.3079(10) Cl(4)−W(1) 2.3141(10) O(1)−W(1) 2.157(3) O(2)−W(1) 1.691(3) Angoli di legame O(1)−C(1)−N(1) 122.6(4) C(1)−N(1)−C(3) 121.2(4) C(1)−N(1)−C(2) 121.6(4) C(3)−N(1)−C(2) 117.1(4) C(1)−O(1)−W(1) 134.6(3) O(2)−W(1)−O(1) 178.93(15) O(2)−W(1)−Cl(3) 97.06(11) O(1)−W(1)−Cl(3) 83.61(9) O(2)−W(1)−Cl(2) 95.80(12) O(1)
−
W(1)−
Cl(2) 85.02(8) Cl(3)−
W(1)−
Cl(2) 89.78(4) O(2)−
W(1)−
Cl(4) 96.64(12) O(1)−
W(1)−
Cl(4) 82.53(8) Cl(3)−
W(1)−
Cl(4) 89.30(4) Cl(2)−
W(1)−
Cl(4) 167.54(4) O(2)−
W(1)−
Cl(1) 95.48(11) O(1)−
W(1)−
Cl(1) 83.84(8) Cl(3)−
W(1)−
Cl(1) 167.45(4) Cl(2)−
W(1)−
Cl(1) 89.36(4) Cl(4)−
W(1)−
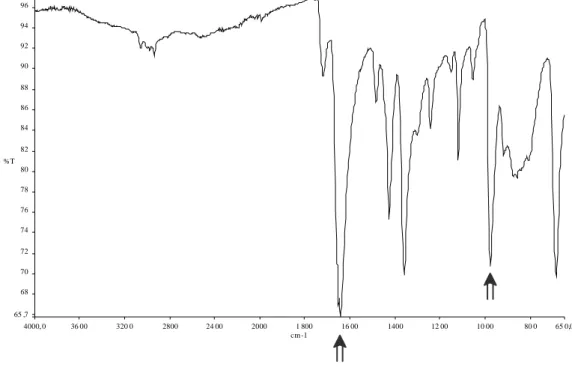
Cl(1) 88.84(4)20 Lo spettro IR di 3 allo stato solido (Figura 5) appare simile a quello del composto 2 (Figura 3): presenta una banda intensa a 1652 cm−1, relativa allo stiramento del doppio legame C=O della DMF coordinata (νC=O = 1687 cm−1 nella DMF libera),33 e una seconda banda a 978 cm−1, attribuita allo stiramento del legame W=O.38
Figura 5: Spettro IR di 3 allo stato solido.
4000, 0 36 00 320 0 2800 24 00 2000 1 800 16 00 1400 12 00 10 00 80 0 65 0,0 65 ,7 68 70 72 74 76 78 80 82 84 86 88 90 92 94 96 97 ,0 cm -1 %T
Composti WOCl4(L) analoghi a 3 sono riportati in letteratura.37 Per analogia con la reazione di sintesi di 2, si è ipotizzato che la presenza del legante ossido in 3 sia il risultato della attivazione di un equivalente di DMF. Secondo questa ipotesi, la reazione procederebbe con la produzione di Cl2CHNMe2, che però non è stato possibile individuare con certezza nella miscela finale di reazione, mediante tecniche GC/MS e NMR. A sostegno della ipotesi, occorre tuttavia notare che la formazione di 3, così come quella di 2, procede in rese elevate solo in presenza di almeno due equivalenti di ammide per metallo.
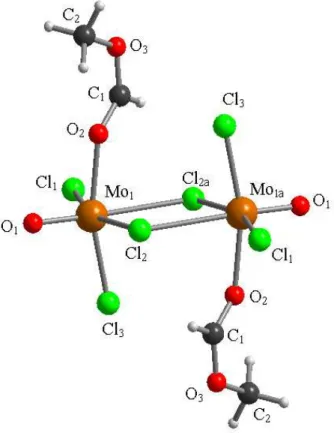
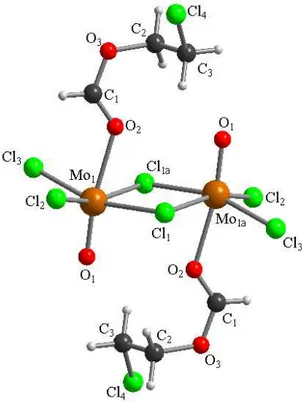
La reazione di MoCl5, 1a, con l’estere HCOOMe fornisce l’addotto dinucleare [MoOCl3(HCO2Me)]2, 4, la cui struttura molecolare è stata ottenuta tramite diffrazione di raggi X su cristallo singolo (Figura 6, Tabella 3).
21 Figura 6: Struttura allo stato solido di 4 determinata tramite diffrazione di raggi X.
Tabella 3: Distanze (Å) e angoli di legame (°) nel complesso 4.
Distanze di legame Mo(1)−O(1) 1.6513(17) Mo(1)−O(2) 2.1102(17) Mo(1)−Cl(3) 2.3082(6) Mo(1)−Cl(1) 2.3192(7) Mo(1)−Cl(2) 2.4110(6) Mo(1)−Cl(2a) 2.7799(7) O(2)−C(1) 1.238(3) O(3)−C(1) 1.286(3) O(3)−C(2) 1.464(3) Angoli di legame
O(1)−Mo(1)−O(2) 95.63(8) O(1)−Mo(1)−Cl(3) 99.98(6) O(2)−Mo(1)−Cl(3) 164.06(5) O(1)−Mo(1)−Cl(1) 102.33(7) O(2)−Mo(1)−Cl(1) 86.78(5) Cl(3)−Mo(1)−Cl(1) 92.97(2) O(1)−Mo(1)−Cl(2) 97.07(6) O(2)−Mo(1)−Cl(2) 85.26(5) Cl(3)−Mo(1)−Cl(2) 89.64(2) Cl(1)−Mo(1)−Cl(2) 159.65(2) O(1)−Mo(1)−Cl(2a) 174.27(6) O(2)−Mo(1)−Cl(2a) 80.75(5) Cl(3)−Mo(1)−Cl(2a) 83.43(2) Cl(1)−Mo(1)−Cl(2a) 81.98(2) Cl(2)−Mo(1)−Cl(2a) 78.27(2) Mo(1)−Cl(2)−Mo(1a) 101.73(2) C(1)−O(2)−Mo(1) 133.83(16) C(1)−O(3)−C(2) 118.6(2) O(2)−C(1)−O(3) 123.7(2)
22 La struttura mostra due leganti cloruro a ponte tra i centri metallici e i due leganti ossido giacenti in prima approssimazione sul piano individuato dai due Mo e dai due
µ-Cl, orientati in modo tale da massimizzarne la distanza. Infine, i leganti metilformiato sono orientati perpendicolarmente al piano di cui sopra, e in versi opposti. I legami Mo−O(1) e Mo−O(2) misurano rispettivamente 1.6513(17) Å e 2.1102(17) Å in accordo con con quanto già osservato nel composto 2. Si nota che gli atomi di molibdeno interagiscono più fortemente con il cloro a ponte in cis all’unità ossido [Mo(1)−Cl(2) = 2.4110(6) Å] piuttosto che con quello in trans [Mo(1)−Cl(2a) = 2.7799(7) Å]. Sulla base dei dati di letteratura raccolti, non sono ancora state riportate strutture, determinate mediante diffrazione di raggi X, di derivati di Mo(V) aventi formula generale [MoOX3(L)]2 (X = F, Cl, Br, I). Piuttosto, sono note strutture di composti mononucleari MoOX3(L)2, come per esempio MoOCl3(OPPh3)2,39 MoOCl3(PMe3)2 40 e MoOCl3(THF)2.41 È interessante il fatto che quest’ultimo composto deriva dalla addizione di tre equivalenti di substrato organico al pentacloruro di molibdeno (v. Paragrafo 2.1.2). Infatti, i prodotti delle reazioni di MoCl5 con molecole contenenti ossigeno in rapporto molare 1:2, quale è 4, non sono stati finora descritti, al di là di pochissime eccezioni. La più significativa riguarda la reazione di MoCl5 con etanolo: in questo caso, il composto risultante non ha struttura dimerica, ma è il monomero MoOCl3(EtOH).42
Lo spettro IR di 4 allo stato solido presenta due segnali molto intensi: uno a 1602 cm−1 riconducibile allo stiramento del doppio legame C=O del metilformiato coordinato (spostato di 127 cm−1 verso numeri d'onda inferiori rispetto al metilformiato non coordinato) e l’altro a 994 cm−1 relativo allo stiramento del legame Mo=O.33
La presenza del legante ossido nel composto 4 sembra essere la conseguenza, come per i complessi 2 e 3, del trasferimento di un atomo di ossigeno dal substrato organico al centro metallico (Schema 9), coerentemente con risultati precedentemente riportati.43 Ulteriore evidenza della avvenuta attivazione dell’estere si ha conducendo la reazione in tubo NMR, in CDCl3: una analisi combinata NMR e GC/MS della miscela di reazione, trattata con H2O, mostra la presenza di MeCl, il cui gruppo metile deriva con ogni probabilità dalla decomposizione del metilformiato. Gli altri prodotti di questa decomposizione non sono stati
23 caratterizzati, probabilmente a causa del basso punto di ebollizione (è stato osservato lo sviluppo di gas nel corso della reazione).
Schema 9: Reazione di MoCl5 con HCOOMe.
Mo2Cl10 + 4 H O O Me 4 Mo Cl Mo Cl Cl Cl O Cl O O O H O O H Cl Me Me −MeCl
Allo scopo di vedere se le reazioni di attivazione dei leganti carbonilici da parte di 1a,b fossero estendibili ad aldeidi e chetoni,44 sono state prese in considerazione le seguenti molecole: acetone, o-tolualdeide e benzofenone. Le reazioni di WCl6, 1b, con acetone e o-tolualdeide, in rapporto molare 1:2, danno gli ossocloruri WOCl4(L) [L = Me2CO, 5a; L = C6H4(CHO)(2-Me), 5b] 37 (Schema 10) caratterizzati mediante spettroscopia NMR (in soluzione). Gli spettri NMR dei prodotti 5a,b mostrano le risonanze relative alla molecola organica coordinata al centro metallico a frequenze più basse rispetto a quanto osservato per la stessa molecola non coordinata [per esempio nel caso di 5a 1H-NMR(CDCl3): δ = 2.68 (CH3) ppm; 13C-NMR(CDCl3): δ = 223.1 (C=O), 32.6 (CH3) ppm. Per l’acetone non coordinato 1H: δ = 2.16 (CH3) ppm; 13C: δ = 206.6 (C=O), 30.8 (CH3) ppm].33 Esperimenti NMR hanno mostrato la formazione, in rapporto molare ca. 1:1 rispetto agli addotti 5a,b, dei composti organoalogenati R(R′)CCl2 (R = R′ = Me; R = H, R′ = C6H4Me) (Schema 10). La presenza di tali composti è il risultato della attivazione del substrato organico, che consiste nello scambio di un atomo di ossigeno con due leganti cloruro tra il composto carbonilico e il complesso WCl6.
24 Schema 10: Reazione di WCl6 con Me2CO.
WCl6 + WOCl4 + W Cl O Cl Cl Cl O R' R R R' Cl Cl O R' R R = R' = Me, 5a R = H, R' =C6H4Me, 5b O R' R
È probabile che la formazione di 5a,b avvenga secondo la sequenza indicata nello Schema 10. Infatti, la reazione di WCl6 con acetone è stata condotta in due tempi, introducendo inizialmente un equivalente di acetone e, successivamente, un secondo equivalente. Nel giro di pochi secondi dall’aggiunta del primo equivalente, si è osservata la abbondante precipitazione di un solido giallo, corrispondente a WOCl4 (caratterizzato mediante spettroscopia IR; la banda relativa allo stiramento W=O in WOCl4 cade a 808 cm−1).45 Tale solido si scioglie prontamente per aggiunta del secondo equivalente, generando una soluzione arancione. Questi fatti suggeriscono che il primo stadio della reazione consiste nella astrazione dell’atomo di ossigeno dal substrato organico da parte del tungsteno, a dare WOCl4, che precipita a causa della scarsa solubilità. Il secondo stadio della reazione consiste invece nella coordinazione di una molecola di acetone a WOCl4, per dare il complesso ottaedrico 5a ben solubile.
Le reazioni di MoCl5, 1a, con acetone 44b e benzofenone, in rapporto molare 1:2, procedono analogamente a quanto sopra descritto per WCl6, 1b: i composti [MoOCl3(L)]2 (L = OCMe2, 6a; L = OCPh2, 6b) sono stati isolati e caratterizzati mediante spettroscopia IR e NMR. Lo spettro IR di 6a (allo stato solido) (Figura 7) presenta una banda intensa a 1616 cm−1, dovuta allo stiramento del legame C=O dell’acetone coordinato (l’acetone non coordinato mostra la banda a 1715 cm−1),33 e una banda molto intensa a 1000 cm−1, attribuita allo stiramento del legame Mo=O.34
25 Analogamente, lo spettro IR del complesso 6b mostra un segnale intenso a 1522 cm−1, dovuto allo stiramento del legame C=O del benzofenone coordinato (il benzofenone non coordinato presenta il segnale a 1665 cm−1) 33 e una banda molto intensa a 990 cm−1, attribuita a Mo=O.34
Figura 7: Spettro IR di 6a allo stato solido.
4000, 0 36 00 320 0 2800 24 00 2000 1 800 16 00 1400 12 00 10 00 80 0 65 0,0 49 ,8 55 60 65 70 75 80 85 90 95 96 ,4 cm-1 %T
Nell’ambito dello studio della reattività di 1a,b con composti carbonilici, si è considerata anche la reazione di WCl6, 1b, con un composto contenente due funzionalità all’ossigeno, quale il metilmetossiacetato, MeOCH2COOMe. La reazione procede attraverso la attivazione del substrato organico ed è accompagnata
da riduzione del centro metallico. Il prodotto isolato è il complesso WCl4(κ2-OCH2CO2Me), 7, la cui struttura molecolare è stata determinata mediante
26 Figura 8: Struttura allo stato solido di 7 determinata tramite diffrazione di raggi X.
Tabella 4: Distanze (Å) e angoli di legame (°) nel complesso 7.
Distanze di legame C(1)−−−−O(1) 1.422(8) C(1)−−−−C(2) 1.499(9) C(2)−−−−O(2) 1.236(7) C(2)−−−−O(3) 1.289(8) C(3)−−−−O(3) 1.464(8) Cl(1)−−−−W(1) 2.2881(14) Cl(2)−−−−W(1) 2.173(2) Cl(3)−−−−W(1) 2.3574(15) Cl(4)−−−−W(1) 2.3306(15) O(1)−−−−W(1) 1.849(4) O(2)−−−−W(1) 2.211(4) . Angoli di legame O(1)−−−−C(1)−−−−C(2) 105.6(5) O(2)−−−−C(2)−−−−O(3) 125.4(6) O(2)−−−−C(2)−−−−C(1) 118.3(6) O(3)−−−−C(2)−−−−C(1) 116.3(5) C(1)−−−−O(1)−−−−W(1) 125.5(4) C(2)−−−−O(2)−−−−W(1) 113.5(4) C(2)−−−−O(3)−−−−C(3) 117.4(5) O(1)−−−−W(1)−−−−Cl(2) 99.20(15) O(1)−−−−W(1)−−−−O(2) 75.09(17) Cl(2)−−−−W(1)−−−−O(2) 174.27(11) O(1)−−−−W(1)−−−−Cl(1) 157.86(15) Cl(2)−−−−W(1)−−−−Cl(1) 102.75(7) O(2)−−−−W(1)−−−−Cl(1) 82.97(11) O(1)−−−−W(1)−−−−Cl(4) 93.04(14) Cl(2)−−−−W(1)−−−−Cl(4) 92.25(7) O(2)−−−−W(1)−−−−Cl(4) 87.74(11) Cl(1)−−−−W(1)−−−−Cl(4) 89.02(5) O(1)−−−−W(1)−−−−Cl(3) 87.72(14) Cl(2)−−−−W(1)−−−−Cl(3) 92.72(7) O(2)−−−−W(1)−−−−Cl(3) 87.47(11) Cl(1)−−−−W(1)−−−−Cl(3) 88.35(5) Cl(4)−−−−W(1)−−−−Cl(3) 174.78(6)
27 La struttura mostra una coordinazione approssimativamente ottaedrica dell’atomo di tungsteno, con un legante bidentato [MeOC(O)CH2O]− sul piano equatoriale. La distanza di legame W(1)−−−−O(1) [1.849(4) Å] è minore rispetto a quella W(1)−−−−O(2) [2.211(4) Å], dato il differente grado di σ-donazione dei due atomi di ossigeno, uno ibridato sp2 e l'altro sp3. Inoltre, i legami W−−−−Cl(eq.) sono sensibilmente più corti rispetto ai W−−−−Cl(ass.), come conseguenza della presenza di atomi di ossigeno in posizione trans.
L’evoluzione della reazione in tubo NMR (solvente CDCl3) è stata studiata mediante spettroscopia NMR. Questo studio ha mostrato che la reazione procede probabilmente attraverso l’iniziale formazione del complesso di W(V) WCl5[O(Me)CH2CO2Me], 8 (Schema 11).46 Infatti, lo spettro 1H-NMR della miscela, dopo circa 10 giorni a temperatura ambiente, contiene risonanze piuttosto allargate, a 4.31 (s, 2 H, CH2), 4.14 (s, 3 H, CO2Me) e 3.62 (s, 3 H, OMe) ppm, attribuibili a una unità metilmetossiacetato coordinata e indicative di una specie paramagnetica. È plausibile che la riduzione del centro metallico avvenga contestualmente alla formazione di Cl2 (v. Paragrafo 2.3). Successivamente, il composto 8 sarebbe sottoposto ad attivazione di un legame C−O, per dare il prodotto 7 e MeCl (Schema 11).47 Lo spettro 1H-NMR della miscela presenta risonanze allargate attribuite a 7 [1H: δ = 6.21 (s, 2 H, CH2), 4.14 ppm (s, 3 H, CO2Me)], e la risonanza relativa a MeCl. La conversione 8 → 7 risulta selettiva e completa dopo ca. 2 ore, qualora la miscela di reazione contenente 8 venga scaldata a 100 °C in CDCl3.
Schema 11: Reazione di WCl6 con MeOCH2COOMe.
WCl6 + Me O O Me O + 1/2 Cl2 WCl5(MeOCH2CO2Me) 8 WCl5(MeOCH2CO2Me) 8 W Cl Cl Cl Cl O O O Me + MeCl 7
28 La reazione di MoCl5, 1a, con MeOCH2COOMe sembra procedere analogamente alla sintesi di 7, tuttavia non è stato possibile, in questo caso, isolare e caratterizzare alcun prodotto di natura inorganica. Gli spettri NMR della miscela di reazione idrolizzata presentano comunque i segnali relativi a MeOCH2COOMe e a MeCl, indicando la avvenuta attivazione del legame C−O etereo del metilmetossiacetato.
2.1.2. Eteri
La reazione di MoCl5, 1a, con due equivalenti di THF fornisce selettivamente il composto [MoOCl3(THF)]2, 9, la cui struttura molecolare è stata determinata mediante diffrazione di raggi X (Figura 9, Tabella 5).
29 Tabella 5: Distanze (Å) e angoli di legame (°) nel complesso 9.
Distanze di legame C(1)−O(1) 1.484(3) C(1)−C(2) 1.510(3) C(2)−C(3) 1.533(3) C(3)−C(4) 1.515(3) C(4)−O(1) 1.487(3) Cl(2)−Mo(1) 2.4243(6) Cl(2a)−Mo(1) 2.7766(6) Cl(3)−Mo(1) 2.3203(6) Cl(4)−Mo(1) 2.3097(6) Mo(1)−O(2) 1.6575(16) Mo(1)−O(1) 2.1153(16) Angoli di legame O(1)
−
C(1)−
C(2) 104.34(18) C(1)−
C(2)−
C(3) 102.93(19) C(4)−
C(3)−
C(2) 102.44(19) O(1)−
C(4)−
C(3) 104.16(18) C(1)−
O(1)−
C(4) 109.58(17) C(1)−
O(1)−
Mo(1) 128.28(13) C(4)−
O(1)−
Mo(1) 121.62(13) Mo(1)−
Cl(2)−
Mo(1a) 102.45(2) O(2)−
Mo(1)−
O(1) 94.87(7) O(2)−
Mo(1)−
Cl(4) 102.23(6) O(1)−
Mo(1)−
Cl(4) 88.13(5) O(2)−
Mo(1)−
Cl(3) 99.56(6) O(1)−
Mo(1)−
Cl(3) 165.23(5) Cl(4)−
Mo(1)−
Cl(3) 91.84(2) O(2)−
Mo(1)−
Cl(2) 97.97(6) O(1)−
Mo(1)−
Cl(2) 85.57(5) Cl(4)−
Mo(1)−
Cl(2) 159.28(2) Cl(3)−
Mo(1)−
Cl(2) 89.32(2) O(2)−
Mo(1)−
Cl(2a) 173.47(6) O(1)−
Mo(1)−
Cl(2a) 80.14(4) Cl(4)−
Mo(1)−
Cl(2a) 81.93(2) . Cl(3)−
Mo(1)−
Cl(2a) 85.24(2) Cl(2)−
Mo(1)−
Cl(2a) 77.55(2) La struttura del complesso dinucleare 9 rispecchia quella discussa per il composto 4. In entrambi i casi, i due leganti ossido giacciono approssimativamente sul piano definito dai due centri metallici e dai due cloruri a ponte, inoltre i due leganti organici sono orientati perpendicolarmente a tale piano. Le distanze di legame Mo=O [1.6575(16) Å], Mo−Ο [2.1153(16)Å] e Mo−Cl sono analoghe a quelle riscontrate nel complesso 4.La miscela della reazione di MoCl5 con THF, svolta in CDCl3, contiene 1,4-diclorobutano (1H-NMR), il che dimostra che le unità ossido presenti in 9 derivano dalla frammentazione del THF (Schema 12). Lo spettro IR (allo stato solido) di 9 presenta una banda molto intensa a 992 cm−1 attribuita allo stiramento del legame Mo=O.34
30 Schema 12: Reazione di MoCl5 con THF.
2 MoCl5 + 4 + 2 Cl Cl O Mo Cl Mo Cl Cl Cl 9 O O Cl O Cl O
È stato riportato in precedenza che la reazione di MoCl5 con un largo eccesso di THF porta alla formazione del complesso MoOCl3(THF)2.41 Tale composto deriva, evidentemente, dalla attivazione di una molecola di tetraidrofurano e dalla coordinazione di due molecole di substrato organico al centro metallico. Inoltre, dal momento che MoCl5, specie fortemente acida, è attivo nella polimerizzazione del THF, il complesso 9 potrebbe essere considerato come la prima specie intermedia nel corso della reazione di polimerizzazione.23
Le reazioni di MoCl5, 1a, e WCl6, 1b, con composti contenenti due unità eteree, quali gli 1,2-dialcossialcani, procedono con la attivazione non selettiva del substrato organico. Per esempio, la reazione di 1a con 1,2-dimetossietano (DME) fornisce (dopo idrolisi) MeCl e ClCH2CH2Cl, indicando che sia i legami C−O interni (CH2–O) sia quelli esterni (CH3–O) sono soggetti a rottura. Gli spettri NMR relativi alla reazione di 1b con DME, in CDCl3, mostrano la probabile formazione del cloro-alcossido WCl5(OCH2CH2OMe), 10 [1H: δ = 5.72 (WOCH2), 4.27 (CH2), 4.03 (CH3) ppm ; 13C: δ = 79.0 (WOCH2), 75.6 (CH2), 63.5 (Me)].48 Dopo idrolisi della miscela di reazione, sono stati identificati MeOCH2CH2Cl, ClCH2CH2Cl e MeCl. Sulla base di questi dati, l’andamento della reazione di 1b con DME può essere riassunto come in Schema 13.
Schema 13: Reazione di MoCl5 con DME.
WCl6 + Me O OMe Cl W Cl O Cl Cl Cl O Me 10 Cl Cl Cl O Me + H2O −MeCl −MeCl
31 E' interessante osservare che, contrariamente a quanto riportato in questo lavoro di Tesi, i pentaalogenuri del Gruppo 5, MX5 (M = Nb, Ta; X = F, Cl, Br), danno semplice coordinazione con substrati all’ossigeno monofunzionali a temperatura ambiente. Inoltre, nell'unico caso finora riportato di attivazione, ossia le reazioni con chetoni a temperatura ambiente,18 si osserva attivazione del legame C−H (Schema 14) e non del legame carbonilico.
Schema 14: Reazione di TaCl5 con acetone.
TaCl5 + 2 Me Me O Ta Cl Cl Cl O Cl O −HCl Me Me Me
32
2.2. Reattività di MoCl
5e WCl
6con 1,1-dialcossialcani
Gli 1,1-dialcossialcani, più comunemente chiamati chetali CRR(OR)2 o acetali CHR(OR)2, sono impiegati principalmente nel corso di sintesi organiche a più stadi come gruppi protettivi per le funzioni ossidriliche o carboniliche.49 Le funzioni protette sono quindi facilmente ripristinate in presenza di specie acide quali TiCl4 (Schema 15), SiMe3I e BF3·OEt2.49,50
Schema 15: Reazione di ripristino della funzione carbonilica da un acetale in presenza di TiCl4.
Me O O Me
Ph
O Ph
H + MeCl + TiCl3OMe 0.5 TiCl4
Et2O, 10 min
Gli 1,1-dialcossialcani sono inoltre usati come reagenti in svariate reazioni organiche e biochimiche. Tra le reazioni che coinvolgono 1,1-dialcossialcani, numerose sono quelle promosse da alogenuri di metalli di inizio transizione in alto stato di ossidazione, per esempio TiCl4,51 ZrCl4,52 MoCl5,53 WCl6.54
Nel mio lavoro di Tesi, è stata studiata la reattività di MoCl5, 1a,e WCl6, 1b, nei confronti di quantità limitate di una serie di 1,1-dialcossialcani, e più precisamente: O(CH2)2O(CH2) (1,3-diossolano), CH2(OMe)2 (1,1-dimetossimetano), CH2(OEt)2
(1,1-dietossimetano), MeCH(OEt)2 (1,1-dietossietano), CMe2(OMe)2 (2,2-dimetossipropano). Tale studio è stato esteso alla reattività con il 1,1,1-trimetossimetano CH(OMe)3, data la similarità strutturale con i suddetti
reagenti.
Le reazioni sono state condotte in condizioni rigorosamente anidre in cloroformio deuterato (nel caso delle prove spettroscopiche NMR), per un tempo variabile da uno a dodici giorni. Sono state sempre utilizzate quantità equimolari di 1a,b e di 1,1-dialcossialcano, inoltre a ciascuna miscela di reazione è stato aggiunto un equivalente di CH2Cl2 come standard interno.
La caratterizzazione dei prodotti inorganici è stata possibile solo in un numero limitato di casi, principalmente a causa della scarsa selettività delle reazioni. Tuttavia, è stato possibile caratterizzare, mediante analisi NMR e GC/MS, i composti
33 organici derivanti dalle frammentazioni dei substrati organici, promosse dal complesso metallico. La chiara identificazione delle specie organiche ha richiesto il trattamento con acqua (idrolisi) delle miscele di reazione: anche se tale trattamento causa la probabile formazione di specie metalliche contenenti ossigeno, non meglio identificate, cosa molto importante, favorisce il rilascio delle molecole organiche eventualmente impegnate nella coordinazione ai centri metallici.55
L’identificazione dei prodotti organici ha permesso di formulare ipotesi sui meccanismi di frammentazione operativi nei diversi casi e di dedurre la natura di alcuni dei prodotti inorganici ottenuti prima della idrolisi.
Le reazioni caratterizzate da maggiore selettività sono state condotte anche in CH2Cl2 per tentare di isolare e caratterizzare il prodotto inorganico. Allo scopo di limitare il più possibile la manipolazione delle soluzioni, data la elevata sensibilità all’umidità dei composti in esame, le miscele finali di reazione sono state direttamente stratificate con eptano e quindi raffreddate a ca. -30 °C onde indurre la cristallizzazione dei composti. Seguendo questa strada, è stato possibile isolare e caratterizzare alcuni composti derivanti dalla coordinazione della specie ossigenata iniziale o di un suo prodotto di frammentazione con il centro metallico.
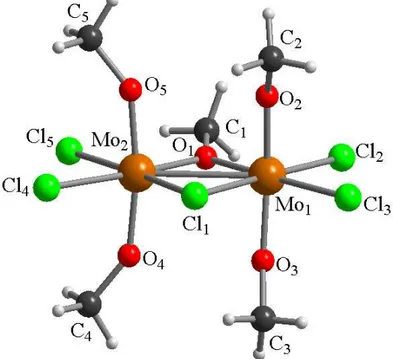
Tra le reazioni che hanno portato ai risultati più completi, vi sono quelle di 1a,b con 1,3-diossolano. Il principale prodotto della reazione che coinvolge MoCl5 è il complesso dinucleare [MoOCl3(HCO2CH2CH2Cl)]2, 11, che è stato caratterizzato mediante tecniche spettroscopiche e mediante diffrazione di raggi X su cristallo singolo (Figura 10, Tabella 6). La struttura di 11 differisce da quella dei complessi dinucleari di molibdeno precedentemente incontrati (composti 4 e 9). Infatti, i leganti ossido in 11 si trovano in posizione trans rispetto alle unità cloroetilformiato: di conseguenza, i due legami Mo−Cl(1) sono di uguale lunghezza mentre la distanza Mo−O [2.2924(14) Å] è più lunga rispetto alle corrispondenti nei complessi 4 e 9 [rispettivamente 2.1102(17) Å e 2.1153(16) Å].
Lo spettro IR di 11 presenta una banda a 1645 cm−1,dovuta allo stiramento del legame C=O del gruppo estereo coordinato (l’estere non coordinato mostra la banda di stiramento del gruppo C=O a 1687 cm−1),33 e una banda a 1000 cm-1,attribuita allo stiramento del legame Mo=O.34
34 Figura 10: Struttura allo stato solido di 11 determinata ai raggi X.
Tabella 6: Distanze (Å) e angoli di legame (°) nel complesso 11.
Distanze di legame Mo(1)−O(1) 1.6532(14) Mo(1)−O(2) 2.2924(14) Mo(1)−Cl(2) 2.3029(6) Mo(1)−Cl(3) 2.3170(6) Mo(1)−Cl(1) 2.4749(6) Mo(1)−Cl(1a) 2.4790(6) Cl(4)−C(3) 1.799(2) O(2)−C(1) 1.217(3) C(1)−O(3) 1.311(3) O(3)−C(2) 1.455(3) C(2)−C(3) 1.496(3) Angoli di legame
O(1)−Mo(1)−O(2) 169.59(6) O(1)−Mo(1)−Cl(2) 102.28(5) O(2)−Mo(1)−Cl(2) 86.19(4) O(1)−Mo(1)−Cl(3) 100.54(6) O(2)−Mo(1)−Cl(3) 84.91(4) Cl(2)−Mo(1)−Cl(3) 92.75(2) O(1)−Mo(1)−Cl(1) 96.50(6) O(2)−Mo(1)−Cl(1) 77.58(4) Cl(2)−Mo(1)−Cl(1) 87.92(2) Cl(3)−Mo(1)−Cl(1) 162.395(19) O(1)−Mo(1)−Cl(1a) 94.24(5) O(2)−Mo(1)−Cl(1a) 76.74(4) Cl(2)−Mo(1)−Cl(1a) 162.266(19) Cl(3)−Mo(1)−Cl(1a) 90.479(19) Cl(1)−Mo(1)−Cl(1a) 83.826(18) Mo(1)−Cl(1)−Mo(1a) 96.174(18) C(1)−O(2)−Mo(1) 129.49(14) O(2)−C(1)−O(3) 123.9(2) C(1)−O(3)−C(2) 117.11(16) O(3)−C(2)−C(3) 110.68(17) C(2)−C(3)−Cl(4) 110.87(15)
35 La formazione del legante estereo, presente nel complesso 11, è il risultato dell’apertura dell’anello del diossolano, causata dalla attivazione di un legame C−O, e successiva attivazione di un legame C−H. La formazione di esteri non ciclici a partire da diossolani è una reazione nota in letteratura ed è promossa da acidi di Lewis quali il TiCl4.56
I prodotti della reazione di MoCl5 con diossolano, identificati dopo idrolisi, sono: bis-(clorometil)etere, (clorometil)(cloroetil)etere, (cloroetil)formiato e metilcloruro. La formazione di questi composti, così come quella del legante ossido nel complesso 11, potrebbe essere spiegata come riportato nello Schema 16. Alla iniziale coordinazione del diossolano al centro metallico attraverso un atomo di ossigeno, (Schema 16-A) segue la rottura di uno oppure due legami C−O adiacenti, causata dalla elevata ossofilicità di MoCl5. A partire dalla rottura di un singolo legame C−O, e a seguito del trasferimento di un cloruro dal metallo al substrato organico e della attivazione di un legame C−H, si ottiene il (cloroetil)formiato (Schema 16-B). Qualora entrambi i legami C−O vengano rotti, si verifica astrazione dell’atomo di ossigeno da parte del centro metallico e il trasferimento di due cloruri da quest’ultimo al substrato organico, producendo così (clorometil)(cloroetil)etere e MoOCl3 (Schema 16-C). La formazione di bis-(clorometil)etere, invece, implica necessariamente la rottura di un legame C−C, con conseguente formazione di un frammento [CH2] (Schema 16-D). La presenza di metilcloruro nella miscela finale potrebbe essere una conseguenza della combinazione di tale frammento [CH2] con un atomo di cloro e uno di idrogeno, (quest’ultimo proveniente dal processo di formazione di (cloroetil)formiato).
È plausibile che tutte le reazioni di attivazione rappresentate nello Schema 16 vengano promosse da MoCl5, e non, eventualmente, da MoOCl3 che si produce nella reazione. Quest’ultima specie, infatti, a causa della presenza di un atomo di ossigeno, possiede caratteristiche ossofiliche ridotte rispetto a quelle mostrate dal pentacloruro, MoCl5. In accordo con la serie di reazioni (Schema 16), la formazione del complesso 11 è una conseguenza della coordinazione di cloroetilformiato all’ossicloruro di molibdeno, MoOCl3 (Schema 16-E).
36 Schema 16: Reazione di MoCl5 con 1,3-diossolano.
O O H H O O H Cl Cl5Mo + [H] + MoCl5 O O Cl3Mo=O + Cl O Cl A) B) C) D) 2 Cl3Mo=O + O O H Cl 2 Mo Cl Cl Mo Cl Cl O Cl O Cl O O O H Cl O H Cl 11 Cl5Mo O O Cl3Mo=O + Cl O Cl + [CH2] Cl5Mo O O H H Cl5Mo MoCl5 + O O E)
Per quanto riguarda la reazione di WCl6 con 1,3-diossolano, gli spettri NMR della miscela di reazione hanno mostrato la presenza dell’alcolato WCl5[O(CH2)2OCH2Cl], 12.48 Tale composto mostra tre risonanze per i gruppi OCH2 a 5.84, 5.74, 4.48 ppm (1H) e a 80.6, 78.1, 70.5 ppm (13C) che sono state assegnate ai gruppi metilenici di W−OCH2−, −CH2O− e −CH2Cl, rispettivamente. Inoltre, dopo idrolisi della miscela di reazione, sono stati identificati i composti bis-(clorometil)etere, bis-(cloroetil)etere e (clorometil)(cloroetil)etere.
37 La formazione del complesso 12 è il risultato dell’interazione di WCl6 con 1,3-diossolano, che consiste nella rottura di un legame C−O e nel contemporaneo trasferimento di un cloruro dal tungsteno a un atomo di carbonio (Schema 17).
Schema 17: Formazione del complesso 12.
W Cl Cl O Cl Cl Cl O Cl W Cl Cl Cl Cl Cl Cl O O 12
La formazione di O(CH2Cl)(CH2CH2Cl) e O(CH2Cl)2, a partire da WCl6 e diossolano, può essere spiegata analogamente a quanto descritto per MoCl5 (Schema 18-B,C).Invece, la formazione di O(CH2CH2Cl)2 potrebbe derivare dalla attivazione di legami C−O e C−C, e successiva formazione di un nuovo legame C−C (Schema 18-D).
Schema 18: Reazione di WCl6 con 1,3-diossolano.
O O Cl4W=O + Cl O Cl O O Cl O Cl + [CH 2] B) C) D) O O Cl O Cl + [CH2] A) O O H H Cl6W WCl6 + O O Cl6W Cl6W Cl6W Cl4W=O + Cl4W=O +
38 La driving force delle reazioni di attivazione dell’1,3-diossolano da parte di 1a,b sembra essere la tendenza del metallo ad astrarre un atomo di ossigeno dal substrato organico. Allo scopo di avvalorare questa ipotesi, è stata studiata la reazione di 1,3-diossolano con WOCl4, un derivato di W(VI) che, al contrario di WCl6, contiene un legante ossido. Lo spettro 1H-NMR della miscela mostra che il diossolano non subisce alcun tipo di attivazione, ma si coordina semplicemente al centro metallico formando il complesso WOCl4(C3H6O2), 13 (v. Schema 19). Il composto 13 risulta termicamente stabile (v. Parte Sperimentale) in soluzione di CDCl3: 1,3-diossolano libero viene recuperato in alte rese dopo idrolisi.
Schema 19: Reazione di WOCl4 con 1,3-diossolano.
WOCl4 + O O W Cl Cl Cl Cl O O O 13 5.77 ppm 4.50 ppm 5.86 ppm O O H2O 4.90 ppm 3.88 ppm
La stabilità dell’addotto di coordinazione 13 indica che, analogamente a quanto osservato per il molibdeno, la presenza di un atomo di ossigeno sul metallo, rende WOCl4 meno ossofilico e quindi meno efficace nella attivazione di legami C−O, rispetto a quanto osservato con MoCl5 e WCl6.
È interessante osservare che NbCl5 non é in grado di frammentare il diossolano a temperatura ambiente 35b : questo dato suggerisce che 1a,b presentano una maggiore ossofilicità rispetto a NbCl5, e quindi una maggiore tendenza ad attivare substrati contenenti ossigeno.
Le reazioni di CHMe(OEt)2 con WCl6 e MoCl5 sono caratterizzate da un basso grado di selettività: in entrambi i casi, gli spettri NMR delle miscele di reazione, presentano molti segnali, tra i quali solo quelli relativi a EtCl sono stati attribuiti (Schema 20). Ripetendo le reazioni e riscaldando le miscele a ca. 100°C, gli spettri non subiscono modificazioni.
39 Schema 20: Prodotti organici ottenuti dalla reazione di CHMe(OEt)2 con WCl6 e MoCl5, in
tubo NMR, e successiva idrolisi della miscela.
Me O O Me Me 1. CDCl3 2. H2O MCln + altri prodotti di frammentazione + EtCl M = Mo,W
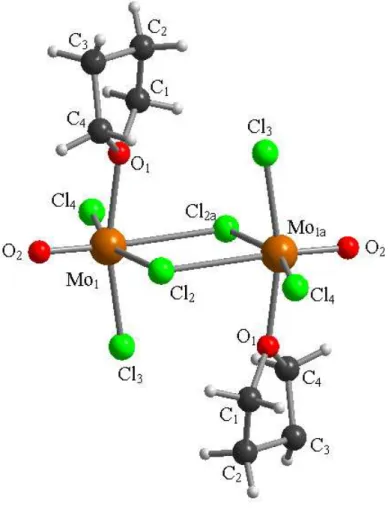
Il tentativo di cristallizzazione della miscela ottenuta da MoCl5 e CHMe(OEt)2 ha permesso di ottenere una miscela solida di due prodotti: il primo, formatosi in bassa resa, è il cloro-alcossido Mo2Cl5(OMe)5, 14, che è stato caratterizzato mediante tecniche spettroscopiche e mediante diffrazione di raggi X su cristallo singolo (Figura 11, Tabella 7, Tabella 8). La struttura mostra la presenza di 4 leganti metossido disposti in modo da minimizzare la repulsione e un quinto MeO disposto a ponte. La distanza Mo(1)−Mo(2) [2.8509(3) Å] risulta confrontabile con quelle riportate in letteratura per composti simili 57 : per esempio, la distanza Mo–Mo in Mo2Cl4(OiPr) è pari a 2.731(1) Å.57a Tale distanza, molto più corta di quelle osservate in 4, 9 e 11 [4.033 Å, 4.061 Å, 3.687 Å rispettivamente] suggerisce la presenza di un legame fra i due atomi di molibdeno in 14.
40 Tabella 7: Distanze di legame (Å) nel complesso 14.
C(1)−O(1) 1.439(3) C(2)−O(2) 1.414(3) C(3)−O(3) 1.426(3) C(4)−O(4) 1.413(3) C(5)−O(5) 1.421(3) Cl(1)−Mo(2) 2.4196(6) Cl(1)−Mo(1) 2.4876(6) Cl(2)−Mo(1) 2.3297(6) Cl(3)−Mo(1) 2.3902(6) Cl(4)−Mo(2) 2.3905(7) Cl(5)−Mo(2) 2.3881(6) Mo(1)−O(3) 1.8157(16) Mo(1)−O(2) 1.8157(16) Mo(1)−O(1) 2.0154(16) Mo(1)−Mo(2) 2.8509(3) Mo(2)−O(5) 1.8115(16) Mo(2)−O(4) 1.8153(16) Mo(2)−O(1) 2.0285(16) Tabella 8: Angoli di legame (°) nel complesso 14.
Mo(2)−Cl(1)−Mo(1) 71.020(17) O(3)−Mo(1)−O(2) 165.11(8) O(3)−Mo(1)−O(1) 93.98(7) O(2)−Mo(1)−O(1) 94.91(7) O(3)−Mo(1)−Cl(2) 96.76(6) O(2)−Mo(1)−Cl(2) 95.74(6) O(1)−Mo(1)−Cl(2) 86.08(5) O(3)−Mo(1)−Cl(3) 85.56(5) O(2)−Mo(1)−Cl(3) 86.82(5) O(1)−Mo(1)−Cl(3) 173.99(5) Cl(2)−Mo(1)−Cl(3) 88.02(2) O(3)−Mo(1)−Cl(1) 83.50(6) O(2)−Mo(1)−Cl(1) 83.37(6) O(1)−Mo(1)−Cl(1) 98.73(5) Cl(2)−Mo(1)−Cl(1) 175.16(2) Cl(3)−Mo(1)−Cl(1) 87.18(2) O(3)−Mo(1)−Mo(2) 87.96(5) O(2)−Mo(1)−Mo(2) 89.82(5) O(1)−Mo(1)−Mo(2) 45.36(5) Cl(2)−Mo(1)−Mo(2) 131.434(18) Cl(3)−Mo(1)−Mo(2) 140.521(18) Cl(1)−Mo(1)−Mo(2) 53.378(15) O(5)−Mo(2)−O(4) 170.37(7) O(5)−Mo(2)−O(1) 92.39(7) O(4)−Mo(2)−O(1) 93.17(7)
O(5)−Mo(2)−Cl(5) 86.13(6) O(4)−Mo(2)−Cl(5) 86.42(5) O(1)−Mo(2)−Cl(5) 85.97(5) O(5)−Mo(2)−Cl(4) 86.90(6) O(4)−Mo(2)−Cl(4) 86.58(6) O(1)−Mo(2)−Cl(4) 172.66(5) Cl(5)−Mo(2)−Cl(4) 86.69(2) O(5)−Mo(2)−Cl(1) 92.99(6) O(4)−Mo(2)−Cl(1) 93.71(6) O(1)−Mo(2)−Cl(1) 100.58(5) Cl(5)−Mo(2)−Cl(1) 173.42(2) Cl(4)−Mo(2)−Cl(1) 86.75(2) O(5)−Mo(2)−Mo(1) 94.79(5) O(4)−Mo(2)−Mo(1) 94.71(5) O(1)−Mo(2)−Mo(1) 44.99(4) Cl(5)−Mo(2)−Mo(1) 130.958(17) Cl(4)−Mo(2)−Mo(1) 142.354(19) Cl(1)−Mo(2)−Mo(1) 55.602(15) C(1)−O(1)−Mo(1) 136.55(15) C(1)−O(1)−Mo(2) 132.32(15) Mo(1)−O(1)−Mo(2) 89.66(6) C(2)−O(2)−Mo(1) 145.09(16) C(3)−O(3)−Mo(1) 142.87(16) C(4)−O(4)−Mo(2) 146.20(16) C(5)−O(5)−Mo(2) 144.63(18)
41 Il secondo prodotto è stato identificato, mediante tecniche spettroscopiche e analitiche, come l’addotto del metilformiato con MOCl3, [MoOCl3(HCO2Me)]2, 4 (Schema 21-D). Lo spettro IR della miscela solida, costituita prevalentemente da 4, presenta un segnale molto intenso a 1643 cm−1, dovuto allo stiramento del legame C=O dell’estere coordinato (l’estere non coordinato mostra la banda a 1729 cm−1)33 e una banda a 987 cm−1, attribuita al legame Mo=O.34 Coerentemente, la soluzione risultante dalla idrolisi della miscela di 14 e 4, sciolti in CDCl3, contiene metilformiato e metanolo, caratterizzati mediante analisi NMR e GC/MS. La formazione dei complessi 14, contenente unità metossido (OMe), e 4, contenente un legante ossido e un legante metilformiato (HCO2Me), suggerisce che la frammentazione di 2,2-dimetossipropano mediata da MoCl5 procede non solo attraverso la attivazione di legami C−O (Schema 21-B,C), ma coinvolge anche la rottura di legami C−C e la formazione di nuovi legami C−O (Schema 21-C).
Schema 21: Reazione di MoCl5 con CHMe(OEt)2.
B) D) 2 Cl 3Mo=O + 2 Me O O Me Me MoCl5 Cl3Mo=O + altri prodotti di frammentazione + O O H O O H C) + MoCl5 Me O O Me Me A) Me O O Me Me MoCl5 MoCl5 + Me O O Me Me 4 Mo Cl Mo Cl Cl Cl O Cl O O O H O O H Cl Me EtCl EtCl Me Me Me
42 Le reazioni di WCl6 con CH2(OR)2 (R = Me, Et) procedono selettivamente attraverso la rottura di 2 legami C−O, a dare ROCH2Cl e RCl (R = Me, Et), identificati dopo idrolisi della miscela di reazione (Schema 22-A,B). Inoltre, i complessi WOCl4[O(R)CH2Cl] (R = Me, 15a; R = Et, 15b) sono stati identificati nella miscela di reazione prima dell’idrolisi. Gli spettri NMR di 15a,b mostrano le risonanze relative all’etere ROCH2Cl coordinato al centro metallico [per esempio, nel caso di 15a 1H-NMR(CDCl3): δ = 5.71 (s, 2 H, CH2), 3.82 (s, 3 H, CH3) ppm; 13
C-NMR(CDCl3): δ = 84.8 (CH2), 57.7 (CH3) ppm]. La coordinazione dell’etere al tungsteno è dimostrata dallo spostamento verso frequenze basse delle risonanze tipiche dell’etere non coordinato [nel caso di MeOCH2Cl 1H: δ = 5.46, 3.51 ppm].33 In più, gli spettri IR di 15a,b presentano un segnale intenso riconducibile allo stiramento del legame W=O, a 970 (15a) e 980 (15b) cm−1.38
Schema 22: Reazioni di WCl6 con CH2(OMe)2 (A) e CH2(OEt)2 (B).
W O O Cl Cl Cl Cl + MeCl Me O O Me A) B) Me O O Me W O Cl O Cl Cl Cl Cl Me O Cl 15a Cl 15b Me O Cl + EtCl Me Me H2O H2O WCl6 −MeCl WCl6 −EtCl
La reattività di CH2(OR)2 (R = Me, Et) con WCl6 può essere confrontata con quella mostrata con NbCl5.35b Il 1,1-dimetossimetano subisce una frammentazione analoga nei due casi, con conseguente formazione di MeOCH2Cl. Tuttavia, mentre NbCl5 causa la attivazione di un singolo legame C−O (Schema 23), WCl6 determina la rottura di due legami C−O, così da trasferire l’ossigeno sul metallo. Inoltre,
43 1,1-dietossimetano agisce da semplice legante nei confronti di NbCl5 a temperatura ambiente, confermando così la maggiore tendenza ad attivare legami carbonio-ossigeno da parte di WCl6 rispetto a NbCl5.
Schema 23: Attivazione di 1,1-dimetossimetano da parte di NbCl5.
Cl O Me O O Me + [NbCl3(OMe)2]2 + O Cl Nb Cl Cl Cl Cl Cl Me Me NbCl5
Le reazioni di MoCl5 con CH2(OR)2 (R = Me, Et) sono caratterizzate da un grado di frammentazione del substrato organico maggiore rispetto a quanto descritto a proposito di WCl6. Tale frammentazione sembra includere la attivazione di legami C−C e/o C−H, al contrario di quanto riportato per le reazioni selettive di WCl6 con CH2(OR)2 (R = Me, Et), (v. Schema 22). In particolare, dalla reazione di MoCl5 con CH2(OMe)2, dopo idrolisi, si ottiene principalmente MeCl, e in quantità minore MeOCH2Cl e O(CH2Cl)2 [MeCl : MeOCH2Cl : O(CH2Cl)2 = 10 : 1 : tracce]. Analogamente, dalla reazione di MoCl5 con CH2(OEt)2, dopo idrolisi, si ottiene una
miscela in cui sono stati identificati solo etilcloruro e metilcloruro [EtCl : MeCl = 10 : 1].
Schema 24: Prodotti organici ottenuti dalla reazione di MoCl5 con CH2(OMe)2 (A) e
CH2(OEt)2 (B) in tubo NMR, e successiva idrolisi della miscela.
MeCl + + Me O O Me A) B) Me O O Me Me O Cl + MoCl5 Cl O Cl EtCl + MeCl +
+ MoCl5 altri prodotti di
frammentazione 1. CDCl3
2. H2O
1. CDCl3 2. H2O
I composti 2,2-dimetossipropano e 1,1,1-trimetossimetano vengono attivati allo stesso modo sia da MoCl5, 1a, che da WCl6, 1b, e forniscono gli stessi prodotti in
44 entrambi i casi. A partire da 2,2-dimetossipropano si ottengono, dopo idrolisi, metilcloruro e 4-metil-3-pentenone. Tenendo conto che la conversione CMe2(OMe)2 → Me2C=O è una reazione ben nota nell’ambito delle trasformazioni chetale → chetone promosse da specie acide,49c la formazione di acetone a partire da 2,2-dimetossipropano è presumibilmente il primo stadio della reazione mediata da 1a,b. Successivamente, l’acetone é convertito in 4-metil-3-pentenone in presenza di 1a,b per condensazione (Schema 25), analogamente a quanto è stato visto per le reazioni di CMe2(OMe)2 con MX5 (M = Nb, Ta).35b
Schema 25: Reazione di formazione di 4-metil-3-pentenone da 2,2-dimetossipropano, promossa da MoCl5 e WCl6. Me O O Me Me Me Me Me O Me Me Me O MCln MCln −MeCl
Lo spettro IR del solido ottenuto dalla reazione di 2,2-dimetossipropano con MoCl5, 1a, presenta segnali a 1584 cm−1 (νC=O), 1519 cm−1 (νC=C) e 978 cm−1 (νMo=O).34 Segnali analoghi si ritrovano nello spettro IR del solido ottenuto dalla reazione con WCl6, 1b : 1595 (νC=O), 1506 cm−1 (νC=C) e 981 cm−1 (νW=O).38 Gli spettri dei composti sono simili a quello del 4-metil-3-pentenone: la differenza principale risiede nello spostamento a numeri d’onda minori della banda di stiramento C=O, che nella specie libera cade a 1690 cm−1.33 Ciò suggerisce che detta specie è coordinata al metallo mediante il legame C=O della funzione esterea a dare gli addotti [MoOCl3(MeC(O)CH=CMe2)]2, 16a, e WOCl4(MeC(O)CH=CMe2), 16b. La presenza di 16a e 16b nella miscela di reazione iniziale suggerisce inoltre che il 4-metil-3-pentenone si forma già prima del processo di idrolisi.
La reazione di 1a,b con 1,1,1-trimetossimetano produce, dopo idrolisi, soltanto MeCl e HCO2Me (Schema 26-A,B), secondo un processo di degradazione selettivo già noto nel caso delle reazioni con i pentaalogenuri del gruppo 5.35b
45 Schema 26: Reazione di 1,1,1-trimetossimetano con MoCl5 con (A) e WCl6 (B).
WCl6 + + MeCl H O Me O + MeCl O O Me O Me Me H O Me O W Cl Cl Cl Cl O MoCl5 + H2O A) B) 17 O O Me O Me Me H O Me O −MeCl 1. CDCl3 2. H2O
È stato possibile isolare e identificare il prodotto inorganico derivante dalla reazione con WCl6. Questo corrisponde al complesso WOCl4(HCO2Me), 17, caratterizzato mediante spettroscopia IR e NMR. Lo spettro IR del solido presenta un segnale a 1652 cm−1,relativo allo stiramento C=O (spostato di 77 cm−1 verso numeri d'onda inferiori rispetto al metilformiato non coordinato),33 e un picco intenso a 1056 cm−1, relativo allo stiramento del legame W=O.38 Gli spettri NMR di 17 evidenziano la presenza di un gruppo metilformiato coordinato al centro metallico [1H-NMR(CDCl3): δ = 8.67 (CH), 4.19 (CH3) ppm; 13C-NMR(CDCl3): δ = 170.8 (CH), 55.8 (CH3) ppm; il metilformiato non coordinato mostra il seguente spettro 1
46
2.3.
Reazioni
di
coordinazione
di
substrati
all’ossigeno
accompagnate da riduzione del centro metallico
Tutte le reazioni riportate in precedenza avvengono con attivazione dei substrati all’ossigeno e senza alcuna variazione dello stato di ossidazione del metallo (ad eccezione della reazione di WCl6 con metilmetossiacetato).
Saranno ora esaminate una serie di reazioni di MoCl5, 1a, e WCl6, 1b, con molecole contenenti atomi donatori all'ossigeno in cui si ha riduzione del centro metallico: ciò comporta la formazione di specie paramagnetiche. Queste sono state isolate e caratterizzate mediante diffrazione di raggi X, spettroscopia IR e misure di conducibilità in soluzione. Inoltre, è stata effettuata l’analisi combinata NMR e GC/MS delle miscele di reazione trattate con acqua e in tutti i casi esaminati è stata rivelata la presenza del reagente organico di partenza. Questo dato indica che le reazioni non procedono con attivazione del substrato all’ossigeno. Se ne deduce quindi che, nel corso delle reazioni, un legante Cl− sia soggetto a ossidazione generando cloro elementare. In letteratura sono riportate reazioni di preparazione di addotti di Mo(IV), W(IV) e W(V) con eteri, che consistono nella riduzione di 1a,b in presenza di olefine, le quali agiscono da accettore di cloro.58
Dalla reazione di WCl6 con (NMe2)2CO (tetrametilurea, TMU) si ottiene [WCl6]− [(NMe2)2COH]+, 18, la cui struttura è rappresentata in Figura 12, mentre le distanze e gli angoli di legame sono riportate in Tabella 9.
Il composto 18 è costituito da un anione ottaedrico WCl6− e da un catione derivante dalla protonazione della tetrametilurea.59 Il principale effetto della protonazione è l’allungamento dell’interazione C=O e una diminuzione delle distanze di legame C−N, rispetto a TMU.59b Infatti, il legame C(3)−O(1) misura 1.289(8) Å [in TMU, d(C=O) = 1.22 Å]32 e i legami C(3)−N(1) e C(3)−N(2) rispettivamente 1.336(8) Å e 1.344(8) Å [in TMU, d(C-N) = 1.38 Å].32 Lo spettro IR (allo stato solido) di 18 non mostra alcun picco nella regione 1000÷800 cm−1, confermando l’assenza di unità W=O, quale conseguenza della mancata frammentazione di TMU.
47 Figura 12: Struttura allo stato solido di 18 determinata ai raggi X.
Tabella 9: Distanze (Å) e angoli di legame (°) nel complesso 18.
Distanze di legame C(1)−N(1) 1.467(8) C(2)−N(1) 1.500(9) C(3)−O(1) 1.289(8) C(3)−N(1) 1.336(8) C(3)−N(2) 1.344(8) C(4)−N(2) 1.474(8) C(5)−N(2) 1.465(8) W(1)−Cl(2) 2.3152(16) W(1)−Cl(1) 2.3268(16) W(1)−Cl(3) 2.3330(16) Angoli di legame O(1)−C(3)−N(1) 118.2(6) O(1)−C(3)−N(2) 120.9(6) N(1)−C(3)−N(2) 120.9(6) C(3)−N(1)−C(1) 119.0(6) C(3)−N(1)−C(2) 127.7(6) C(1)−N(1)−C(2) 111.7(5) C(3)−N(2)−C(5) 120.0(5) C(3)−N(2)−C(4) 128.0(6) C(5)−N(2)−C(4) 110.1(5) Cl(2)−W(1)−Cl(2) 180.00(2) Cl(2)−W(1)−Cl(1) 89.41(6) Cl(2)−W(1)−Cl(1) 90.59(6) Cl(1)−W(1)−Cl(1) 180.00(2) Cl(2)−W(1)−Cl(3) 89.92(6) Cl(2)−W(1)−Cl(3) 90.08(6) Cl(1)−W(1)−Cl(3) 89.40(6) Cl(1)−W(1)−Cl(3) 90.60(6) Cl(3)−W(1)−Cl(3) 180.00(8)
48 La formazione del composto 18 potrebbe avvenire secondo questa sequenza: inizialmente si ha la formazione del complesso neutro WCl5(TMU),58a risultato della coordinazione di TMU al tungsteno e della riduzione del W(VI) a W(V) accompagnata da sviluppo di Cl2. In seguito, a causa di tracce di acqua nell’ambiente di cristallizzazione, la parziale idrolisi delle specie metalliche produrrebbe HCl. Per reazione di WCl5(TMU) con HCl si potrebbe formare il composto 18 (Schema 27).
La reattività di uree con MoCl5 è già nota,60 e non prevede l’attivazione del substrato organico.
Schema 27: Reazione di WCl6 con TMU.
WCl6 + O N Me Me N Me Me W Cl Cl O Cl Cl Cl N Me Me N Me Me W Cl Cl Cl Cl Cl Cl − O+ N Me Me N Me Me H 18 HCl (H2O) −Cl2
Una analoga reazione di riduzione da W(VI) a W(V) è quella che genera il composto WCl4(κ2-OCH2CO2Me), 7 (v. Paragrafo 2.1.1). Tuttavia, in questo caso, il probabile derivato WCl5[O(Me)CH2CO2Me], 8, ottenuto inizialmente, non è stabile ed è soggetto a una lenta trasformazione che comporta la attivazione del legante organico (v. Schema 11, Figura 8).47
Reazioni di riduzione di MoCl5, 1a, causate dalla coordinazione di leganti all’ossigeno sono state precedentemente riportate, anche se la struttura dei prodotti risultanti non è stata determinata univocamente mediante diffrazione di raggi X.41 Si è quindi deciso di provare queste reazioni note, con l’obiettivo di cristallizzare i prodotti e determinarne senza ambiguità la struttura allo stato solido. La reazione di 1a con tetraidropirano (C4H8O2, THP) fornisce il complesso ottaedrico MoCl4(THP)2, 19, coerentemente con quanto descritto in letteratura.41 Rese ottimali sono state ottenute impiegando due equivalenti di THP per metallo. La struttura molecolare è rappresentata in Figura 13, mentre le distanze e gli angoli di legame sono riportati in Tabella 10.
49 La struttura di 19 evidenzia la presenza di due leganti THP, in conformazione a sedia, e occupanti posizioni relative cis rispetto al centro metallico esacoordinato. Gli anelli tetraidropiranici non sono distorti e presentano angoli e legami confrontabili con il THP libero.32 I legami Mo−Cl in trans rispetto alle unità tetraidropirano misurano 2.2534(12) Å e risultano leggermente più corti dei legami Mo−Cl in cis [2.3555(8) Å]. Le distanze di legame Mo−O e Mo−Cl, così come gli angoli di legame riguardanti il metallo, sono confrontabili con quelle riportate in letteratura per composti strutturalmente simili, come ad esempio MoCl4(DME).58c
50 Tabella 10: Distanze (Å) e angoli di legame (°) nel complesso 19.
Distanze di legame C(1)−O(1) 1.469(4) C(1)−C(2) 1.522(5) C(2)−C(3) 1.528(5) C(3)−C(4) 1.523(5) C(4)−C(5) 1.513(5) C(5)−O(1) 1.474(4) Mo(1)−O(1) 2.155(2) Mo(1)−Cl(2) 2.2534(12) Mo(1)−Cl(1) 2.3555(8) Angoli di legame O(1)−C(1)−C(2) 110.5(3) C(1)−C(2)−C(3) 110.9(3) C(4)−C(3)−C(2) 111.0(3) C(5)−C(4)−C(3) 111.1(3) O(1)−C(5)−C(4) 109.6(3) C(1)−O(1)−C(5) 110.7(3) C(1)−O(1)−Mo(1) 126.0(2) C(5)−O(1)−Mo(1) 123.3(2) O(1)−Mo(1)−Cl(2a) 173.26(8) O(1a)−Mo(1)−Cl(2) 173.26(8) Cl(1a)−Mo(1)−Cl(1) 171.23(4) O(1a)−Mo(1)−O(1) 83.33(14) O(1a)−Mo(1)−Cl(2a) 90.25(7) O(1)−Mo(1)−Cl(2) 90.25(7) Cl(2a)−Mo(1)−Cl(2) 96.24(6) O(1)−Mo(1)−Cl(1a) 86.41(6) O(1a)−Mo(1)−Cl(1a) 87.04(6) Cl(2)−Mo(1)−Cl(1a) 94.60(4) Cl(2)−Mo(1)−Cl(1) 91.25(3) O(1)−Mo(1)−Cl(1) 87.04(6) O(1a)−Mo(1)−Cl(1) 86.41(6) Cl(2a)−Mo(1)−Cl(1a) 91.25(3) Cl(2a)−Mo(1)−Cl(1) 94.60(4) Lo spettro 1H-NMR di 19 (in CDCl3) presenta risonanze allargate, come atteso per una specie paramagnetica, a 3.68 e 1.70 ppm, attribuite al THP coordinato al centro metallico. Dalla idrolisi della miscela di reazione, invece, si ottiene una soluzione contenente principalmente THP e, in minore quantità, 1,5-dicloropentano [THP : 1,5-dicloropentano = 10: 1]. La presenza di quest’ultimo è probabilmente dovuta alla decomposizione di THP durante l’idrolisi non essendo presente nella miscela prima dell’aggiunta di H2O.
51 Schema 28: Reazione di MoCl5 con THP.
MoCl5 + 2 O + 1/2 Cl2 Mo Cl Cl O O Cl Cl 19
La reazione di MoCl5, 1a, con trans-(EtO2C)CH=CH(CO2Et) (dietilfumarato) mostra un andamento analogo a quella appena illustrata. Infatti, il prodotto che si ottiene è il composto polimerico [MoCl4{κ2-trans-(EtO2C)CH=CH(CO2Et)}]∞, 20
(Figura 14, Tabella 11). Anche in questo caso, si verifica la riduzione del Mo(V) a Mo(IV) e ogni atomo di molibdeno si trova infine legato a due molecole di legante organico, che occupano siti di coordinazione adiacenti. In più, ciascuna molecola di dietilfumarato agisce da legante bidentato a ponte tra due centri metallici, determinando così la struttura polimerica. I legami Mo−−−−Cl(eq.), in trans rispetto alle molecole di dietilfumarato, misurano 2.2587(12) Å e sono leggermente più corti dei legami Mo−−−−Cl(ass.) [Mo(1)−Cl(2) = 2.3283(15) Å; Mo(1)−Cl(3) = 2.3200(15) Å]. La possibilità che un diestere possa agire da legante bidentato a ponte determinando la formazione di una struttura polimerica è già stata descritta. Un esempio riguarda il derivato di TiCl4, [(µ-Cl)2{µ-p-C6H4(CO2Me)2Cl6Ti}]∞.61
Lo spettro IR (allo stato solido) di 20 mostra un segnale molto intenso a 1628 cm−1, relativo allo stiramento del doppio legame C=O, che cade a frequenze più basse rispetto a quanto osservato nel dietilfumarato libero (1726 cm−1), come conseguenza della coordinazione. È stata studiata la stabilità termica del composto 20 con un esperimento NMR: una soluzione di tale composto in CDCl3, è stata riscaldata a 100 °C per 1 ora. Al termine del riscaldamento, si è osservata la formazione di una piccola quantità di EtCl [dietilfumarato coordinato : EtCl = 10: 2]. La modesta quantità di EtCl prodotto suggerisce che il complesso 20 può decomporre lentamente per attivazione del legame C−O del fumarato coordinato.62
52 Figura 14: Struttura allo stato solido di 20 determinata ai raggi X.
Tabella 11: Distanze (Å) e angoli di legame (°) nel complesso 20.
Distanze di legame C(1)−O(1) 1.229(5) C(1)−O(2) 1.305(5) C(1)−C(2) 1.475(5) C(2)−C(2) 1.306(8) C(3)−O(2) 1.470(5) C(3)−C(4) 1.505(6) Cl(2)−Mo(1) 2.3283(15) Cl(3)−Mo(1) 2.3200(15) Cl(4)−Mo(1) 2.2587(12) Mo(1)−O(1) 2.154(3) Angoli di legame O(1)−C(1)−O(2) 122.1(3) O(1)−C(1)−C(2) 123.3(4) O(2)−C(1)−C(2) 114.6(3) C(2)−C(2)−C(1) 123.0(5) O(2)−C(3)−C(4) 110.1(3) C(1)−O(1)−Mo(1) 140.8(3) C(1)−O(2)−C(3) 117.0(3) O(1)−Mo(1)−Cl(4) 172.83(8) O(1)−Mo(1)−O(1) 80.84(14) O(1)−Mo(1)−Cl(4) 92.15(8) Cl(4)−Mo(1)−Cl(4) 94.81(7) O(1)−Mo(1)−Cl(3) 85.27(8) Cl(4)−Mo(1)−Cl(3) 95.71(4) O(1)−Mo(1)−Cl(2) 81.92(8) Cl(4)−Mo(1)−Cl(2) 95.68(4) Cl(3)−Mo(1)−Cl(2) 163.14(6)
53 Le reazioni di MoCl5, 1a, e WCl6, 1b, con analoghi diesteri 62 (dimetilmalonato e dimetilmaleato) hanno fornito composti di coordinazione di cui non è stato possibile identificare la struttura. Tuttavia, scaldando a 100 °C per 1÷2 ore soluzioni di questi addotti, in CDCl3, è stata osservata attivazione del legante coordinato e i frammenti ottenuti sono stati identificati, quando possibile, via NMR e GC/MS della miscela trattata con acqua. In particolare sono stati ottenuti: trans-dimetilmaleato, MeCl e 2,5-furandione dalla reazione di 1a con cis-dimetilmaleato; trans-dimetilmaleato, MeCl, 2,5-furandione e ClOCCH=CHCOCl dalla reazione di 1b con cis-dimetilmaleato (Schema 29).
Schema 29: Reazione di WCl6 con cis-dimetilmaleato.
O O Me O O Me O O O O Cl O Cl + + MeCl 1. ∆ (100°C) 2. H2O WCl6 +
Un discorso a parte meritano le reazioni di WCl6 con gli eteri ciclici (THF, THP, 1,4-diossano) e con l’etere etilico. In ciascuno di questi casi, non è stato possibile ottenere la struttura allo stato solido del prodotto inorganico mediante diffrazione di raggi X. Non è quindi possibile definire con certezza la natura dei prodotti, in particolare non è chiaro se la formazione di questi proceda con riduzione del centro metallico (da W(VI) a W(V), vedi sopra) oppure no.
Allo scopo di capire se le reazioni potessero procedere con riduzione del metallo e contestuale sviluppo di Cl2, si è pensato di svolgere le reazioni di 1b con gli eteri sopra elencati in presenza di un eccesso di cicloesene. Il cicloesene, infatti, è un
composto in grado di addizionare Cl2 a temperatura ambiente per formare 1,2-diclorocicloesano.58b,63 Esiste tuttavia la possibilità che, in presenza di
cicloesene, le reazioni seguano percorsi alternativi. Per verificare questa possibilità è stata condotta la reazione di MoCl5 con THF, di cui è noto con certezza il prodotto (v. Figura 6), in presenza di cicloesene. In questo caso, la miscela finale di reazione idrolizzata contiene cicloesano, 1-clorocicloesano, 1,2-diclorocicloesano, THF (NMR, GC/MS), e non 1,4-diclorobutano. Questi dati indicano la probabile formazione selettiva del composto MoCl4(THF)2,64 piuttosto che del complesso
54 [MoOCl3(THF)]2, 9. In altre parole, la presenza del cicloesene non è “innocente” ma è in grado di promuovere la riduzione del centro metallico, favorendo così un cammino completamente differente rispetto a quello osservato in assenza di cicloesene (Schema 30).
Schema 30: Reazione di MoCl5 con THF in assenza di cicloesene (A) e in presenza di
cicloesene (B). 2 MoCl5 + 4 THF + 2 Cl Cl 9 A) MoCl5 + 2 THF MoCl4(THF)2 + 1/2 Cl2 [MoOCl3(THF)]2 B) CDCl3 CDCl3
Queste osservazioni indicano che lo svolgere le reazioni di WCl6, 1b, con eteri in presenza di cicloesene, non può dare alcuna informazione riguardo l’andamento di tali reazioni in assenza di cicloesene.
Le reazioni di WCl6 con THP, THF e 1,4-diossano forniscono prodotti contenenti una molecola di etere coordinata al centro metallico, probabilmente riconducibili alla formula WCl5(L) 58a (L = THP, 21a; L = THF, 21b; L = 1,4-diossano, 21c). Gli spettri NMR mostrano risonanze allargate, in accordo con la probabile natura paramagnetica dei composti, a valori di spostamento chimico maggiori rispetto a quelli noti per i rispettivi eteri non coordinati. Per esempio, lo spettro 1H-NMR (CDCl3) di 21a mostra risonanze a 4.03 e 1.73 ppm, mentre per il THP 1H: δ = 3.65, 1.59 ppm.33 Per quanto riguarda il composto 21c, esperimenti NMR condotti a bassa temperatura hanno evidenziato la coordinazione monodentata del legante diossano (lo spettro 1H-NMR, registrato a temperatura ambiente, mostra un segnale piuttosto largo, indicativo di un processo di scambio). A –60 °C, si distinguono le risonanze relative ai protoni assiali ed equatoriali più vicini all’ossigeno coordinato, oltre a un segnale a 3.99 ppm, relativo ai protoni più lontani dall’ossigeno coordinato (Figura 15).
55 Figura 15: Coordinazione monodentata del legante diossano nel complesso 21c dedotta
mediante esperimenti NMR a bassa temperatura.
O O H H H H WCl5 4.89 ppm 4.25 ppm 3.99 ppm
I complessi 21a-21c risultano invariati dopo riscaldamento in soluzione di CDCl3 (v. Parte Sperimentale).
Nel caso della reazione di WCl6, 1b, con THF, l’aggiunta di ulteriori quantità di reagente organico, rispetto alla quantità equivalente, comporta la formazione di 1,4-diclorobutano. Questo fatto è coerente con quanto riportato in letteratura riguardo la reattività di WCl6 con quantità di THF molto maggiori del valore stechiometrico.58a,23 Inoltre, nello spettro IR della miscela solida ottenuta si identifica principalmente WOCl4. Sulla base di questo, è ipotizzabile che siano operativi due percorsi di reazione: i) coordinazione del THF al centro metallico, accompagnata dalla probabile riduzione di quest’ultimo; ii) attivazione del THF, analogamente a quanto descritto a proposito di MoCl5 (v. Paragrafo 2.1.2, Schema 12), (Schema 31).
Schema 31: Ipotesi di reattività di WCl6 con THF.
3.73 ppm 1.84 ppm 2.16 ppm 4.57 ppm O=WOCl4 WCl6 21b O W Cl Cl Cl O Cl Cl −Cl2 Cl Cl −
La reazione di 1b con Et2O 46,58a,58b fornisce un composto identificato come WCl6(OEt2), 22. Questa specie, che conterrebbe un tungsteno eptacoordinato,65 mostra risonanze NMR (in CDCl3) piuttosto risolte, in accordo con la natura
56 diamagnetica. Lo spettro IR (allo stato solido) mostra un segnale molto intenso a 855 cm−1, attribuito allo stiramento C−O−C (per Et2O libero, νC−O−C = 1126 cm−1). La natura neutra di 22 è stata confermata da misure di conducibilità in soluzione (v. Parte Sperimentale).
Figura 16: Spettro 1H-NMR (CDCl3) della miscela di reazione di WCl6 con Et2O.
0.6 0 .6 0.8 0.8 1.0 1.0 1.2 1.2 1.4 1.4 1.6 1.6 1.8 1.8 2.0 2.0 2.2 2.2 2 .4 2 .4 2.6 2.6 2.8 2.8 3.0 3.0 3.2 3.2 3.4 3.4 3.6 3.6 3.8 3.8 4.0 4.0 4.2 4.2 4.4 4.4 4.6 4.6 CH3 CH2 O CH2 C H3 WCl6 CH3 CH2 O CH2 C H3 WCl6 EtCl EtCl
L’identità di 22 è stata avvalorata, inoltre, da una prova di reattività (Schema 32). È stato aggiunto un eccesso di acetone a una soluzione di 22 in CDCl3, quindi si è osservata (1H-NMR) la formazione del complesso WOCl4(Me2CO), 5, e di una quantità equimolare di 2,2-dicloropropano (v. Paragrafo 2.1.1). Queste evidenze indicano che il composto 22 deve contenere un atomo di tungsteno nello stato di ossidazione +6, piuttosto che +5, dal momento che il prodotto finale 5 sicuramente include un W(VI), e non è ipotizzabile una ossidazione W(V) → W(VI) per aggiunta di acetone a 22.
57 Schema 32: Reazione di 22 con un eccesso di acetone.
WCl6(OEt)2 W + Cl O Cl Cl Cl Me Me Cl Cl O Me Me 5a Me Me O -Et2O