1
2
Capitolo 1: Le zinco-proteasi
1.1. Introduzione
Il tessuto connettivo ha come ruolo principale nell’organismo quello di sostenere gli altri tessuti mediante una complessa organizzazione di cellule, fibrille e matrice extracellulare. Esso partecipa dinamicamente al mantenimento delle funzionalità dei tessuti (es: sangue e linfa) e purtroppo la degradazione del tessuto connettivo è spesso alla base di numerose patologie di diverso genere.
Il rimodellamento e il turnover del tessuto connettivo vengono regolati da alcune endoproteasi che operano individuando e idrolizzando determinati legami peptidici. Queste proteasi vengono classificate come Aspartato Proteasi, Cisteina Proteasi, Serina Proteasi, Treonina Proteasi e Metalloproteasi. Quest’ultime, che seguono per importanza la Serina e la Cisteina Proteasi, sono 184, e si suddividono a loro volta in quattro classi: Astacine, Reprolisine, Serralisine e Metalloproteasi della matrice
(MMPs) di cui le Metallo Proteasi della Matrice (MMPs), e le Reprolisine con la sottofamiglia delle ADAMs (A Disintegrin And Metalloproteinase Domain), costituiscono le due più importanti famiglie di zinco-proteasi 1. La loro attività omeostatica non consiste solo nell’ attivazione/inattivazione di proteine, ma anche nella liberazione di ligandi presenti sulla superficie cellulare che regolano la comunicazione tra le cellule. E’ evidente che l’alterazione dell’espressione delle zinco-proteasi comporta una serie di gravi malattie a carattere tumorale, infiammatorio, autoimmune, che possono coinvolgere anche tessuti diversi. Tra queste vi sono il cancro, l’infarto del miocardio, l’ictus, l’ipossia, l’aterosclerosi, l’artrite reumatoide, l’osteoartrite, la periodontite, il morbo di Alzheimer e altre patologie neurodegenerative (Tab. 1.1). Per
3
questo la ricerca farmaceutica da circa 20 anni si è dedicata alla sintesi di inibitori delle Zinco-Proteasi.
4
1.2. Le Metallo Proteasi della Matrice.
1.2.1. Classificazione e funzioni.
Le Metallo proteasi della matrice extracellulare, dette anche matrixine, attualmente identificate sono almeno 24. Il genoma umano possiede 23 geni codificanti per tali proteine. Tra queste si possono distinguere 17 MMPs propriamente dette, che vengono secrete nella matrice extracellulare e 7 Membrane-Type Metallo Protease (MT-MMPs), che sono ancorate alla membrana plasmatica della cellula mediante un dominio transmembranale e uno citoplasmatico all’estremità C terminale. Nonostante le numerose omologie tra i membri di questa famiglia, un primo elemento discriminante, che ne permette anche una classificazione, è la scelta del substrato da idrolizzare (Tab.1.1).
Sono state identificate 4 tipi di Collagenasi (MMP-1, -8, -13, -18) di cui solo tre presenti nel genere umano. Le tre Collagenasi individuate nell’uomo hanno tutte come substrato il collagene I, II e III che nel complesso costituisce il 90 % del collagene totale. Ciascuna di esse tuttavia idrolizza preferibilmente un tipo di Collagene, difatti la Collagenasi–1 (MMP-1) detta anche “Collagenasi interstiziale” ha più affinità per il collagene di tipo III, la Collagenasi -2 (MMP-8) detta anche “Collagenasi neutrofila” ha più affinità per il collagene di tipo I, mentre la Collagenasi-3 (MMP-13) ha come substrato preferito il Collagene di tipo II. Il Collagene di tipo IV, che è il costituente delle lamine basali, viene degradato dalle Gelatinasi, dette Gelatinasi A (MMP-2) e Gelatinasi B (MMP-9), le quali sono inoltre in grado di idrolizzare il Collagene di tipo I, V, VII, X e XII e altre proteine come la fibronectina, la laminina e l’elastina. Il meccanismo di rottura della tripla elica del collagene prevede innanzitutto il legame del collagene all’enzima, cui segue una tripla attività elicasica che mette a nudo i legami
5
che verranno infine idrolizzati. La capacità di sciogliere la tripla elica del collagene è propria sia delle Collagenasi che delle Gelatinasi.
Le Stromelisine, Stromelisine-1 (MMP-3) o Proteoglicanasi, Stromelisine-2 (MMP-10), Stromelisine-3 (MMP-11) non hanno attività elicasica e degradano componenti della matrice extracellulare come proteoglicani e proteine quali la laminina e la fibronectina. Mentre le Stromelisine -1 e -2 sembrano funzionalmente correlate, rimane ancora oggi oscuro il ruolo e il substrato preferito dalla Stromelisina-3, la quale tuttavia desta interesse perchè espressa nel tumore al seno, e perchè inattiva gli inibitori della Serina proteasi (serpin). Questa funzione serpinasica, tipica anche di altre MMPs fa supporre che vi sia un intreccio tra le cascate enzimatiche delle Serina- e delle Metallo proteasi 3. Differiscono dalla sequenza amminoacidica delle MMPs precedentemente elencate, poichè prive del dominio emopexinico, le Matrilisine (MMP-7 e MMP-26). MMP-7 detta anche PUMP-1, degrada fibronectina, laminina, alcuni tipi di collagene non disposti ad elica e molti elementi dell’ECM. La MMP-26, detta anche Endometasi, è
espressa dalle cellule dell’endometrio ed opera su una vasta gamma di substrati tra cui l’elastina, la fibrina e il fibrinogeno; questa a differenza delle altre MMPs è in gran parte accumulata intracellularmente.
Le 7 Membran-Type Metallo Protease oltre ad idrolizzare componenti della ECM come i proteoglicani, la gelatina, la fibronectina, intervengono in prima linea nell’ attivazione stessa delle Metallo proteasi della matrice. Esse vengono denominate MT-MMPs e numerate da 1 a 6, mentre la MMP-23 viene definita CA-MMP (Cystein Array MMP) poichè possiede una cisteina libera all’interno del sito catalitico.
Non fanno parte degli insiemi precedenti alcune Metallo proteasi che quindi vengono elencate a parte. Esse sono la Metalloelastasi (MMP-12), che è espressa
6
prevalentemente nei macrofagi, perchè è fondamentale nella migrazione di questi, e degrada l’elastina; la MMP-19 detta anche RASI (Rheumatoid Arthritis Synovial Infiammation) il cui nome si riferisce al suo ritrovamento nel plasma di pazienti affetti da artrite reumatoide, l’Enamelisina (MMP-20) che digerisce l’amelogenina ed è stata individuata nello smalto dei denti e la MMP-21 che è stata scoperta di recente nell’uomo e di cui non se ne conoscono ancora i substrati.
1.2.2. Struttura delle MMPs.
Le MMPs sono zinco proteasi, perchè dotate di un atomo di zinco all’interno del sito catalitico; inoltre esse, come molte altre proteine della ECM, sono costituite da più domini (Fig.1.1). Essendo numerose le analogie tra i componenti di questa famiglia di enzimi, ci si può avvalere di una descrizione generica per tutte. Questa profonda similarità probabilmente è il risultato della duplicazione da un unico gene ancestrale e poi della successiva differenziazione della proteina per sostituzione di più amminoacidi.
7
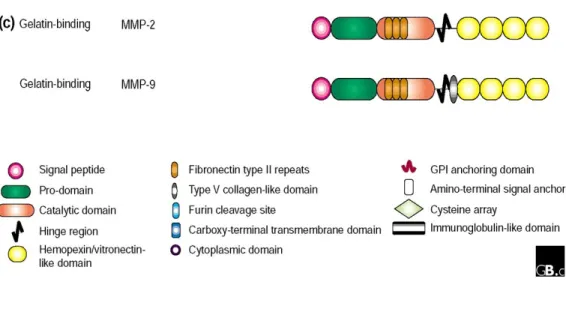
Fig.1.1: Domini delle MMPs 4
A partire dall'estremità amino-terminale troviamo il peptide segnale, il dominio propeptidico, il dominio catalitico ed infine il dominio emopexinico, presente in tutte le MMPs ad eccezione delle Matrilisine. Le MMPs, come molte altre proteasi, vengono secrete come zimogeni inattivi.
Il pro-peptide, che è costituito da 80 aa, rende latente l’enzima perchè lo zinco catalitico è coordinato dal tiolo di una cisteina presente nel propeptide. L’idrolisi del propeptide determina quindi l’attivazione del sito catalitico; tale meccanismo prende il nome di
8
“switch cisteinico”. L’attivazione del proenzima può essere mediata da altre proteasi o può avvenire sulla superficie plasmatica ad opera delle Membran Types; quest’ ultime e la stromelisina-3 invece vengono riconosciute tramite una sequenza amminoacidica detta “sito d’attivazione della furina” (Arg-Xaa-Lys-Arg) e idrolizzate all’interno delle vescicole dell’Apparato del Golgi da una “furin-like” convertasi. Il propeptide è un dominio altamente conservato tra tutte le metalloproteasi perchè tutti i componenti della famiglia mantengono la sequenza -PRCGXPD-.
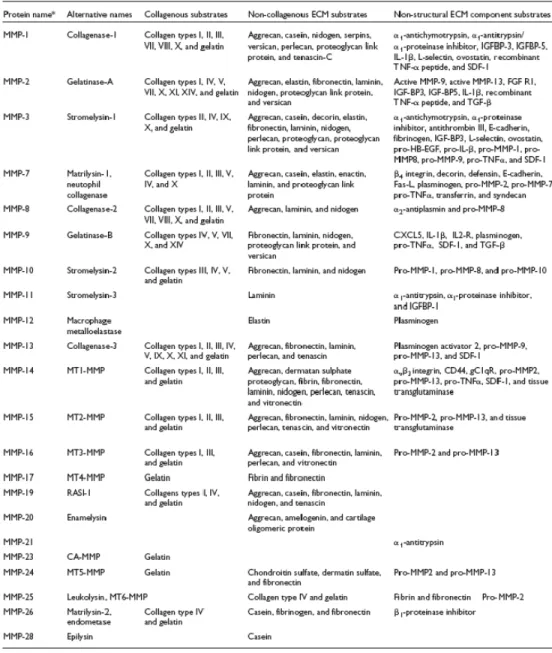
Il sito catalitico delle MMPs ha, nella struttura terziaria, forma sferica caratterizzata da 5 foglietti β curvi che contengono due strands paralleli uno strand antiparallelo di 4-7 residui ciascuno,e 3 α-eliche di 11-17 residui che si dispongono nella cavità del foglietto β (Fig.1.2).5
Fig. 1.2: Struttura terziaria del sito catalitico.
Anche il sito attivo dell’enzima presenta una sequenza (-HEXGHXXGXXH -)altamente conservata. Essa si trova su di un lato dell’α-elica e contiene tre residui di istidina che
9
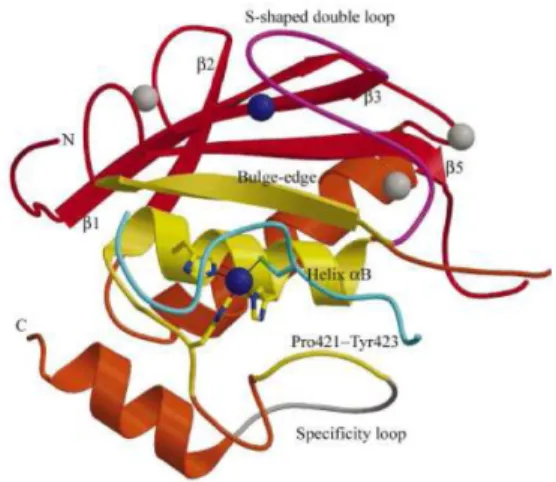
insieme ad una molecola d’acqua coordinano lo zinco catalitico; in più è presente un glutammato, necessario per l’attività proteasica. La mutagenesi di almeno una delle tre His sopprime l’attività catalitica dell’enzima. Il dominio catalitico è dotato anche di uno zinco(II) strutturale, anch’esso coordinato a tre His, e due o tre ioni calcio(II). Un’attenta analisi dei motivi contenenti lo zinco e il calcio strutturale illustra che mentre esistono almeno 4 motivi diversi per lo zinco strutturale, la sequenza contenente il calcio è invece altamente conservata. Tuttavia anche lo zinco catalitico partecipa al mantenimento della struttura dell’enzima. Il sito catalitico delle MMPs al fine di essere substrato specifico è strategicamente dotato di alcuni sottositi dove il peptide a seconda delle caratteristiche chimico fisiche si inserisce, pronto per essere scisso. Questi sottodomini indicati come S1, S2, S3, S1’, S2’, S3’ e P1, P2, P3, P1’, P2’, P3’ sono rispettivamente le porzioni del peptide che interagiscono con i sottositi. S1 e S3 formano una regione poco profonda che da un lato confina con il IV β-strand. S3 accoglie bene una prolina, ma generalmente le differenze tra i membri delle MMPs in S1 e S3 sono sottili.
Fig 1.3: Rappresentazione del dominio catalitico delle MMPs. Le 6 tasche del sito di legame-MMP sono
10
Ben più selettiva è la porzione S1’: l’analisi cristallografica ha infatti dimostrato che questa tasca costituisce un elemento discriminante tra gli enzimi, perchè è selettivo il legame che instaura con P1’. S1’ viene infatti chiamata specific loop perchè si legano rigorosamente solo i peptidi o gli inibitori che ne rispettano le caratteristiche chimiche; inoltre essa è flessibile, e si adatta bene al substrato che vi si introduce. Generalmente è una tasca profonda, quasi una sorta di tunnel che attraversa la proteina (2, MMP-9, MMP-8, MMP-13), fanno eccezione la MMP-1, MMP-7, e la MMP-11 dove la tasca è occlusa rispettivamente da un’ arginina, da una tirosina e da una glutammina.
La regione S2’ è esposta ai solventi e lega preferibilmente porzioni P2’ idrofobiche, mentre S3’ è ancora poco nota nelle MMPs (Fig1.4).
11
In tutte le MMPs, fanno eccezione solo le matrilisine, il sito catalitico è collegato ad un dominio che, per la sua notevole omologia con l’emopexina, viene definito dominio emopexinico. Esso ha la forma di un tozzo cilindro ed è costituito da quattro moduli di emopexina ognuna delle quali forma una lamina del foglietto β; i quattro moduli disponendosi a cuneo formano un poro che contiene ioni Ca(II). Tale dominio è importante perchè suggerisce quale substrato scindere e perchè si lega ai TIMPs (Tissue Inhibitors Metallo Protease), inibitori fisiologici con attività regolatoria sulle MMPs. Un linker flessibile ricco di proline detto peptide-hinge unisce il dominio emopexinico con il sito attivo, meno che nella MMP-21 dove sono direttamente congiunti. Anche la MMP-23 è priva del linker e il dominio non è proprio emopexinico ma un suo analogo. La prima e l’ultima cisteina sono altamente conservate e formano un legame disolfuro tra il modulo I e IV che stabilizza l’intero dominio; il ponte S-S è presente in tutte le MMPs, eccetto che nelle Gelatinasi dove tre moduli di fibronectina formano sei ponti disolfuro tra di loro. Questo dominio di 174 aa nei pressi di S3’che lega la gelatina è esclusivo delle Gelatinasi e prende il nome di Collagen Binding Domain (CBD). Nella MMP-2, oltre a legare la gelatina, permette anche il legame dell’elastina e del collagene II, IV, V, X, difatti una delezione di CBD comporta una completa perdita dell’attività elastinolitica e gelatinolitica. Infine le Membran-Type Metalloproteasi sono dotate di un segmento, stalk, che le ancora ad un’ α-elica transmembranale e ad un dominio citoplasmatico. Tale frammento ha natura peptidica in tutte le MT-MMPs meno che nella -4 e nella -6 dove è costituito da glicosilfosfatidilinositolo (GPI) (Fig. 1.5).
12
Fig.1.5: Organizzazione dei domini nelle MMPs
1.2.3. Meccanismo d’azione.
Diversi studi strutturali hanno permesso di individuare il meccanismo d’azione delle Metalloproteasi della matrice. Il procedimento è simile a quello della termolisina batterica. Il potere catalitico delle Metallo proteasi dipende da 4 fattori: dal legame del substrato al sito proteolitico, dalla specificità di legame del substrato mediante i sottositi, dall’azione chelante delle tre istidine e dal potere catalitico del glutammato, ed
13
infine dal legame del substrato ad altri siti esterni al sito attivo che incrementano la specificità e la selettività dell’interazione tra il peptide e l’enzima.
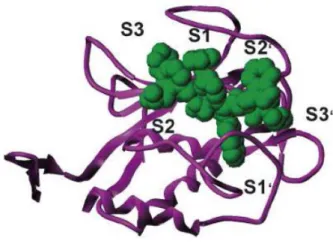
Fondamentale è il ruolo della molecola d’acqua presente nel dominio catalitico: essa interagisce mediante legami ad idrogeno con il glutammato e chela lo zinco catalitico. La catalisi è avviata dall’attacco nucleofilo al carbonile del peptide da parte della molecola d’acqua, la quale poi cede un protone al glutammato che a sua volta lo dona all’azoto ammidico. Il passaggio del secondo protone dall’acqua al glutammato e quindi all’azoto, determina la rottura del legame e la scomparsa della molecola d’acqua. Lo zinco, che da uno stato tri-coordinato passa ad uno stato penta-coordinato, compensa la carica negativa che si crea sul carbonile, mentre un residuo di alanina stabilizza la carica positiva presente sull’azoto. (Fig. 1.6)
Fig. 1.6: Meccanismo d’azione della catalisi enzimatica delle MMPs
1.2.4. Regolazione delle MMPs: i TIMPs (Tissue Inhibitors of Metallo
Proteases).
Come detto in precedenza un’alterata regolazione dell’attività proteolitica delle MMPs può favorire l’insorgere di una vasta gamma di patologie gravi, come l’osteoartrite, l’artrite reumatoide, l’insufficienza cardiaca, l’aterosclerosi, ed in particolare la
14
diffusione tumorale e l’angiogenesi. Inoltre in condizioni fisiologiche esse controllano processi come l’ovulazione, la dilatazione della cervice uterina, l’involuzione post partum, la cicatrizzazione delle ferite e la migrazione delle cellule infiammatorie, per cui è necessario che la loro attività sia finemente regolata sia a livello trascrizionale che post-trascrizionale.
I meccanismi che assolvono a tale compito sono:
I. Induzione o inibizione della trascrizione, processo che può essere mediato da citochine, ormoni, fattori di crescita e promotori del tumore;
II. Secrezione ed endocitosi del propeptide; III. Attivazione dello zimogeno;
IV Inibizione da parte di inibitori fisiologici tra i quali l’α2-macroglobulina e i TIMPs (inibitori tissutali delle MMPs).
La regolazione mediata da inibitori endogeni costituisce forse l’aspetto più cruciale della modulazione post-trascrizionale.
L’α2-macroglobulina è una glicoproteina plasmatica di 725 kDa formata da 4 subunità identiche di 180 kDa ciascuna. Disattiva le proteasi che si trovano nei fluidi biologici intrappolandole al suo interno e il complesso α2-macroglobulina-proteasi viene poi riassorbito per endocitosi mediata da recettore. Ben più enigmatico è invece il ruolo giocato dai TIMPs perchè essi prendono parte sia all’attivazione che all’inibizione delle MMPs. I TIMPs sono glicoproteine con peso molecolare di 21-34 kDa denominate TIMP-1, -2, -3, -4. Essi differiscono tra loro sia per la solubilità, che per la diffusione che per l’interazione con le MMPs. TIMP-2 è costitutiva ed è ampiamente espressa nell’organismo, TIMP -1, -3, -4 sono inducibili e si trovano in diversi tipi di cellule, ed in particolare TIMP- 4 è tessuto specifica, difatti si concentra nelle cellule cerebrali,
15
nelle cellule cardiache adulte, nell’ovario e nel muscolo scheletrico. Inoltre mentre TIMP -1, -2, -4 sono solubili TIMP-3 è strettamente legata all’ECM. TIMP-1 è un debole inibitore di MT1-MMP, MT3-MMP, MT5-MMP e MMP-19, TIMP-2 e -4 sono inibitori delle gelatinasi, mentre TIMP-3 ha dimostrato di essere un ottimo inibitore per le ADAMs, specie per il TACE 8.
Le TIMPs sono divise in due domini principali, il C-terminale e l’N-terminale, dove 12 cisteine instaurano sei legami disolfuro. L’estremità N-terminale di tutte le TIMPs conserva altamente una sequenza VIRAK (Val-Ile-Arg-Ala-Lys).
Fig.1.7: Struttura primaria delle TIMPs. Le cisteine sono unite da 6 ponti disolfuro. Le frecce indicano l’unione tra il dominio C e N-terminale. In giallo la sequenza VIRAK.
16
MMP e mediante il gruppo amminico terminale e il carbonile della Cys 1, allontana la molecola d’acqua e chela in maniera bidentata lo zinco catalitico.
L’estremità C-terminale invece lega preferibilmente le pro-MMPs.
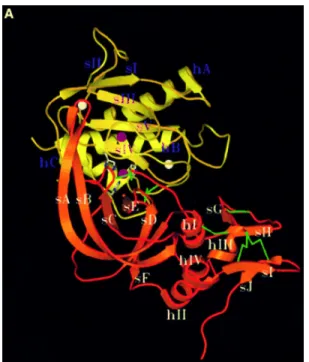
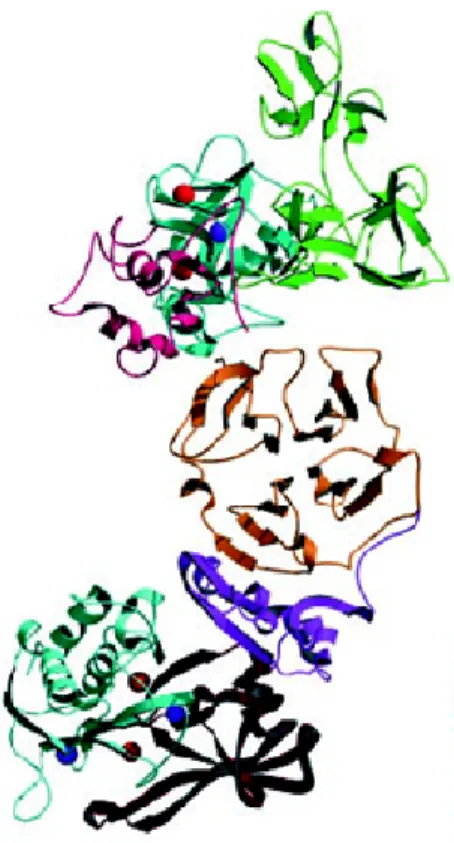
La cristalizzazione del complesso trimolecolare tra pro-MMP2, TIMP-2, MT-MMP-1 (Fig. 1.8) testimonia come questi inibitori endogeni siano necessari per l’attivazione delle pro-Metalloproteasi. E’ bene specificare che non tutti gli inibitori sono in grado di formare un complesso trimolecolare, e che non tutti i meccanismi di inibizione e attivazione delle TIMPs sono noti.
Fig.1.8: Formazione del complesso trimolecolare tra pro-MMP-2, TIMP-2 e MT1-MMP 9
17
della MT1-MMP e l’estremità C-terminale si lega al dominio emopexinico della proMMP-2. Il sito di legame della TIMPs a questo dominio si trova tra il III e il IV modulo di emopexina e tale interazione, che è stabilizzata dalla formazione di un ponte salino tra i residui cationici di alcune lisine presenti nel sito emopexinico e i residui acidi dell’estremità C-terminale, è più forte tra proMMP-2 e TIMP-2 che non con TIMP-4 o -3 perchè la TIMP-2 ha una carica netta negativa maggiore; inoltre TIMP-3 e TIMP-4 non formano il complesso trimolecolare.
Perchè la proMMP-2 sia attivata è necessaria una seconda molecola di MT1-MMP perchè l’altra agisce da recettore per il complesso TIMP-2/proMMP-2; si forma quindi un complesso quaternario. Tale processo è sensibile alla concentrazione di TIMPs libere che possono altresì inibire la seconda MT-MMP impedendo così l’attivazione.
Oltre a partecipare alla formazione del complesso trimolecolare TIMP-2 agisce come modulatore positivo su MT1-MMP. Difatti questa proteina dal peso di 57 kDa, in assenza della TIMP-2 è rapidamente convertita mediante un processo autocatalitico in
un peptide inattivo di 44 kDa 10.
Sebbene non siano state ancora risolte strutture cristallografiche del complesso di inibizione tra TIMPs e MMPs attive, sono state fatte alcune considerazioni sulle eventualità di interazione. Nel complesso d’attivazione la funzione inibitoria N-terminale delle TIMPs è impegnata nel chelare il sito attivo della MT1-MMP, quindi l’estremità C-terminale si lega alla pro-MMP presso il dominio emopexinico in un sito che viene definito docking site tra il III e il IV modulo di emopexina. L’interazione con il docking site impedisce alla stessa molecola di TIMPs di interagire con il sito catalitico della MMP attiva. Più proficua è invece l’interazione con un altro sito detto stabilization site che si trova tra il I e il II modulo di emopexina, ma topograficamente dalla parte
18
opposta dell’enzima rispetto al docking site . Sulla base della formazione del complesso d’attivazione di cui se ne conosce la struttura ai raggi X, è probabile che per inibire la MMP sia necessaria una seconda molecola di TIMP. Questa si va a legare allo stabilization site, mentre la prima TIMP si lega al docking site della MMP attiva mediante l’estremità C-terminale, e con l’estremità N-terminale la ancora alla membrana plasmatica mediante una MT-MMP. Il complesso che si forma viene definito “catena allungata” (Fig. 1.8).
Docking site e stabilization site analoghi sono presenti su tutte le MMPs e mediano il legame con le TIMPs 11.
1.3. La MMP-2
1.3.1. Struttura e funzioni.
Le Gelatinasi sono Metalloproteasi di matrice, caratterizzate dalla presenza di tre moduli di fibronectina di tipo II al'interno del dominio catalitico. I tre moduli di fibronectina formano sei ponti disolfuro tra di loro; questo dominio di 174 aa nei pressi di S3’, che lega la gelatina, è esclusivo delle Gelatinasi e prende il nome di Collagen
19
Fig. 1.9: Domini delle Gelatinasi
Il dominio catalitico della MMP-2 non risulta alterato dalla presenza dei tre filamenti di fibronectina; come per le altre MMPs, infatti, nella struttura terziaria presenta forma sferica caratterizzata da 5 foglietti β curvi che contengono due strands paralleli uno strand antiparallelo di 4-7 residui ciascuno, e 3 α-eliche di 11-17 residui che si dispongono nella cavità del foglietto β.
I filamenti di fibronectina si inseriscono tra il quinto foglietto β e la seconda α-elica, nel dominio catalitico 12.
20
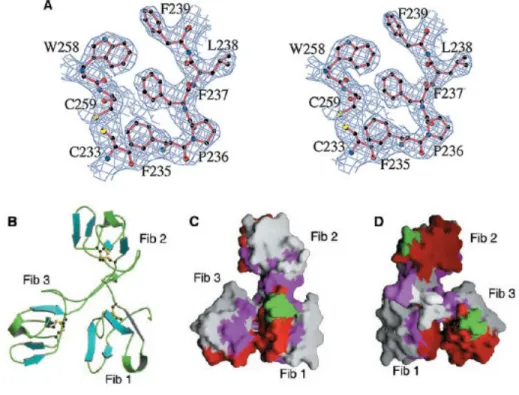
Fig. 1.10: Domini della fibronectina 12
a) Densità elettronica intorno ai ponti disolfuro cis-Pro236 (P236) e Cys233 (C233)-Cys259 (C259). Gli atomi di zolfo sono indicati in giallo.
b) Struttura secondaria in cui sono mostrati i ponti disolfuro
c) e d) Superficie molecolare relativa ai domini della fibronectina; in verde sono indicati i residui polari, in rosso i residui idrofobi, che si legano alla gelatina.
21
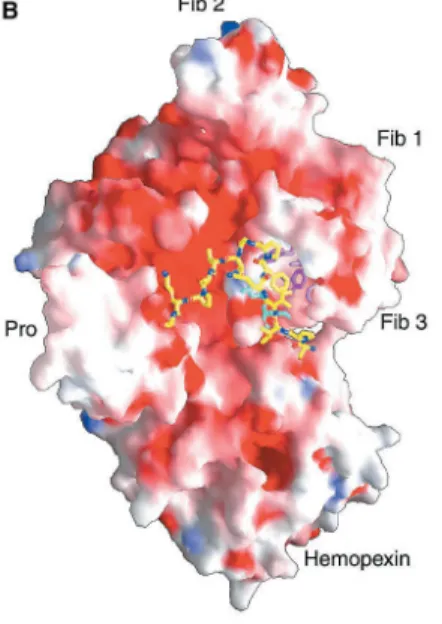
Fig. 1.11: Interazione tra il propeptide e i domini di fibronectina. 12
a) Residui del propeptide in contatto con la tasca idrofoba a livello del terzo dominio di fibronectina; i residui idrofobi del dominio della fibronectina sono indicati in magenta, i residui del propetide in giallo. Arg 368 (R368) forma un legame ad idrogeno con Asp 40; Gly 367 (G367) forma un legame ad idrogeno con
Ile 35 (I35).
b) Superficie molecolare di proMMP-2; in rosso sono indicati i residui con carica negativa, in blu i residui con carica positiva.
Le gelatinasi, sono molecole caratterizzate da un’elevata efficienza proteolitica nei confronti del Collagene di tipo IV, costituente principale delle lamine basali, le quali sono inoltre in grado di idrolizzare il Collagene di tipo I, V, VII, X e XII e altre proteine come la fibronectina, la laminina e l’elastina.
Attualmente sono conosciute due gelatinasi, la MMP-2 (gelatinasi-A) e la MMP-9 (gelatinasi-B), implicate in una varietà di processi patologici quali la proliferazione tumorale e la formazione di metastasi. L’MMP-9, 92 kDa, è principalmente espressa nelle cellule maligne, ma anche nelle cellule infiammatorie. La MMP-2, 72 kDa, è espressa principalmente nei fibroblasti durante lo sviluppo e la rigenerazione dei tessuti ed è anche altamente espressa nelle cellule stromali che circondano le metastasi. Le due Gelatinasi possono essere distinte anche per la differente efficienza nel degradare la
22 Gelatina, maggiore per la MMP-2.
L’attivazione della pro-MMP-2 è considerato essere un evento critico nell’invasione tumorale. Contrariamente alla maggior parte delle MMPs solubili, la forma latente di quest’enzima non viene attivata da una proteasi a serina bensì dalla MT1-MMP (MMP-14), identificato come il maggiore attivatore fisiologico delle pro-MMP-2 . L’attivazione avviene sulla superficie cellulare, durante un processo regolato da un inibitore endogeno delle metalloproteasi : TIMP-2 13.
Un complesso bimolecolare (Fig.1.13) costituito da TIMP-2 e MT1-MMP lega la proforma dell’enzima MMP-2 in modo tale da generare una struttura trimolecolare, che porterà all’attivazione della pro-MMP-2.
23
Questo complesso bimolecolare funziona come una sorta di recettore per la pro-MMP-2 che interagisce con la TIMP-2 attraverso un legame di tipo non-covalente.
TIMP-2, quindi, oltre ad inibire la MMP-2, legandosi al sito catalitico dell’enzima con la porzione N-terminale, risulta avere un ruolo importante anche nell’attivazione stessa dell’enzima, grazie ad una forte interazione fra il dominio emopexinico dello zimogeno (Glu446-Cys660) e la sua porzione C-terminale (Glu153-Pro221) 15.
Fig. 1.14: Complesso trimolecolare formato da Pro-MMP-2, TIMP-2 e sito catalitico della MT1-MMP. 14
L’interazione fra MT1-MMP e TIMP-2 avviene, invece, attraverso il sito catalitico della MT1-MMP e quello inibitorio N-terminale della TIMP-2; dopodiché l’inibitore lega la
24
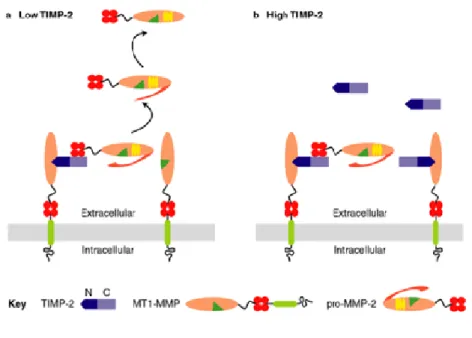
forma latente della MMP-2. A questo punto, poichè la capacità della MMP-14 di agire proteoliticamente sul propeptide della MMP-2 è inibita dalla TIMP-2, è necessaria un’altra MT1-MMP, libera dall’interazione con TIMP-2, adiacente al complesso 16. Il rapporto stechiometrico finale è quindi 1:2:1 (TIMP-2 : MT1-MMP : pro-MMP-2/MMP-2). La seconda MT1-MMP idrolizza il legame peptidico Asn37-Leu38 della pro-MMP-2 (72 KDa) generando una forma intermedia (64 kDa) che è successivamente resa completamente attiva (62 kDa) da un meccanismo di autocatalisi intermolecolare che permette la scissione del legame fra gli amminoacidi Asn80 e Tyr81; alternativamente questa seconda idrolisi si può avere in seguito all’azione della plasmino. Un’efficiente attivazione della pro-MMP-2 è possibile soltanto se la concentrazione dell’inibitore endogeno è bassa, con TIMP-2 sufficiente per generare il complesso trimolecolare, ma non abbastanza da saturare tutte le MT-MMPs richieste per la proteolisi del propeptide. Un elevato livello di TIMP-2 comporterebbe il legame anche con la seconda MT1-MMP e la conseguente inibizione dell’attività proteolitica
25
Fig. 1.15: Meccanismo di attivazione della pro-MMP-2:effetto della concentrazione del TIMP-2
sull’attivazione della pro-MMP-2
a) a basse concentrazioni TIMP-2 induce l’attivazione promuovendo il legame della pro-MMP-2 e della MT1-MMP
b) ad alte concentrazioni impedisce l’attivazione inibendo l’attività proteolitica della MT1-MMP
Studi cellulari dimostrano che il TIMP-2, oltre ad avere un ruolo nella formazione del complesso trimolecolare, ha degli effetti anche sullo sviluppo della MT1-MMP, infatti il legame del TIMP-2 alla MT1-MMP attiva (57 kDa) ne inibisce la degradazione autocatalitica, portando ad un accumulo della MT1-MMP attiva sulla superficie cellulare. In assenza di TIMP-2, invece l’MT1-MMP si trasforma rapidamente in una forma inattiva di 44 kDa.
Quest’inibitore endogeno può esercitare, quindi, un controllo positivo sull’attività della MT1-MMP aumentando la sua disponibilità sulla superficie cellulare e di conseguenza può promuovere l’attività proteolitica della MT1-MMP e quindi l’attivazione della pro-MMP-2.
26
Da tutto ciò è possibile dedurre come uno squilibrio fra la concentrazione delle MMPs e quella della TIMP-2 , con conseguente aumento dell’attività proteolitica, sia coinvolto nell’invasione tumorale, nella formazione di metastasi e nell' angiogenesi. 17
1.4. La MMP-12
1.4.1. Struttura e funzioni.
La MMP-12 o Metalloelastasi, è una proteasi zinco-dipendente secreta come proenzima di 54 kDa, costituita da tre domini:
• la porzione propetidica amino-terminale (9 kDa) • il sito catalitico (22 kDa)
• il dominio emopexinico (23 kDa).
Il propeptide mantiene l'enzima in forma latente; in questo modo l'enzima si attiva solo dopo l’idrolisi di questo frammento mediante il meccanismo di switch cisteinico. Il dominio catalitico della MMP-12, come nel caso delle altre MMPs, ha forma globulare e comprende, oltre allo ione zinco catalitico e lo ione zinco strutturale, 3 ioni calcio con differente affinità per l’enzima che contribuiscono a stabilizzare la conformazione attiva del sito catalitico irrigidendo i loop di connessione. In particolar modo, la tasca S1’ del domino catalitico della MMP-12 è un lungo canale idrofobo aperto al solvente. La specificità della MMP-12 sembra essere determinata principalmente dalla prima metà del loop S, che da origine ai sottositi S1 e S3, la cui conformazione è leggermente diversa dalle altre MMP, forse dovuta alla presenza in MMP-12 della Ala173 in una posizione in cui nelle altre MMP è di solito presente un residuo di Pro molto conservato.
27
Il dominio emopexinico è costituito da quattro moduli di emopexina ognuna delle quali forma una lamina del foglietto β; i quattro moduli disponendosi a cuneo formano un poro che contiene ioni Ca(II). Tale dominio è importante perchè suggerisce quale substrato scindere e perchè si lega alle TIMPs (Tissue Inhibitors Metallo Protease), inibitori fisiologici con attività regolatoria sulle MMPs.
Profilo di specificità: Ala-Met-Phe-Leu-Glu-Ala
S3 S2 S1 S1’ S2’ S3’
Fig. 1.16: Rappresentazione della superficie del dominio catalitico della proteina
MMP12. I sottositi del sito catalitico sono colorati secondo lo schema riportato in figura. L’atomo di zinco è colorato in fucsia.
L’atomo di zinco catalitico si trova nel centro della fenditura del sito attivo ed è coordinato da tre N-imidazolici dei residui His218, His222 e His228.
28
In figura è rappresentato il dominio catalitico della MMP-12 con i residui che formano il sito attivo colorati a seconda del sottosito a cui appartengono, e di lato è riportata
anche una sequenza peptidica, derivata da α1-PI, Ala-Met-Phe-Leu-Glu-Ala
rappresentativa delle specificità dei vari sottositi.
S3 (Ala) è una tasca ben definita, formata da Phe185, His183 e His172, che mostra una preferenza per amminoacidi con piccole catene laterali idrofobiche;
S2 (Met) è un sito non delimitato e l’aminoacido P2 può estendersi per tutta la
superficie idrofobica della base. Il residuo P2 interagisce con i residui His222, His228;
S1 (Phe) è una fenditura idrofobica adatta per amminoacidi aromatici o idrofobici. Essa
è formata dalla faccia piatta dell'anello di His172 (S-loop) e Ile180;
S1' (Leu) viene anche detto specific loop, in quanto è il maggiore responsabile della
specificità delle MMPs. Per quello che riguarda la MMP-12 accetta amminoacidi con catene laterali alifatiche voluminose. Questo sottosito è in effetti un tunnel leggermente basico che attraversa la proteina. In questo sottosito è presente la catena laterale della Thr215 che sostituisce una Val altamente conservata nelle altre MMPs. Studi di modelling hanno mostrato che la catena laterale di un residuo di Arg può raggiungere la Thr e formare un legame ad idrogeno. Questo dato spiegherebbe la capacità di MMP12 di processare sequenze con un residuo di Arg dal lato amino-terminale del legame idrolizzabile. Il sottosito è delimitato dall'anello imidazolico dell'His218, Pro238, Thr239, Thr215 e Tyr240.
S2' (Glu) è parzialmente esposto al solvente;
S3' (Ala) è poco profondo, idrofobico, adatto per un residuo di Ala.
29
ruolo fondamentale nei processi di migrazione dei monociti e dei macrofagi attraverso le membrane basali digerendo appunto l’elastina e numerose altre proteine della membrana basale come il collagene di tipo IV, la fibronectina, la laminina, l’entactina e i proteoglicani. La MMP-12 tuttavia è in grado di idrolizzare anche proteine non di matrice come l’inibitore della serin α-1 proteinasi del plasma, il plasminogeno, per formare l’angiostatina. In particolar modo, la MMP-12 è coinvolta nella degradazione dell’elastina a livello della parete degli alveoli polmonari, infatti, è stato osservato, che una sua iperespressione è collegata a numerose patologie come l’enfisema polmonare e la malattia polmonare cronica ostruttiva (chronic obstructive pulmonary disease COPD) 18.