Sviluppo del sistema nervoso centrale
Lo sviluppo embrionale dei Vertebrati successivo alla segmentazione segue uno schema comune a tutte le classi; durante la gastrulazione si identificano tre foglietti embrionali, ectoderma, mesoderma e endoderma che, in seguito a complessi movimenti cellulari assumono la collocazione spaziale definitiva: l’endoderma e il mesoderma vengono internalizzati, l’ectoderma forma il rivestimento esterno dell’embrione. Nelle fasi seguenti i tre foglietti interagiranno tra loro nella formazione di tutte le strutture, organi e tessuti.
In particolare, la neurulazione è quell’insieme di movimenti cellulari e di eventi induttivi che conducono alla formazione del tubo neurale, da cui deriverà in seguito il sistema nervoso centrale (SNC) costituito dall’encefalo e dal midollo spinale (Gilbert, 2000).
La neurulazione
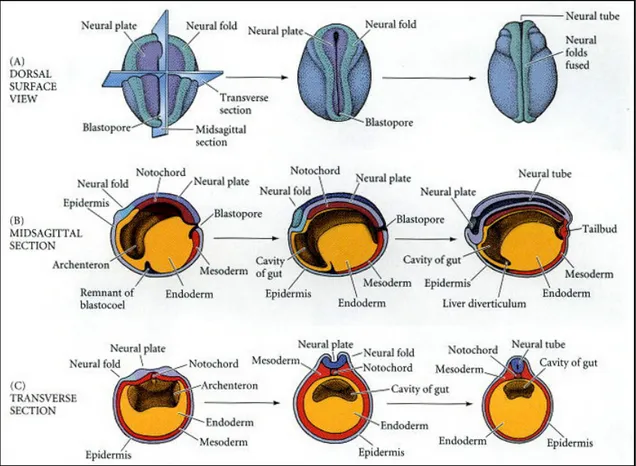
Attraverso l’interazione induttiva con il sottostante cordomesoderma, l’ectoderma della regione dorsale dell’embrione acquisisce un destino neurale, diventando neuroectoderma: le cellule acquisiscono una morfologia colonnare più che appiattita, con la formazione di una regione ispessita e rilevata rispetto al resto dell’ectoderma, identificata con il nome di “piastra neurale”, i cui margini si sollevano originando le pliche neurali. La forma definitiva, più ampia anteriormente, stretta e allungata posteriormente, viene raggiunta attraverso una serie di specifici movimenti morfogenetici quale l’estensione convergente (Keller et al., 1992). Le pliche neurali successivamente convergono lungo la linea mediana dell’embrione delimitando dapprima una doccia neurale e poi congiungendosi e fondendosi per formare un tubo neurale cavo (Balinsky, 1975) (Fig. 1).
Figura 1 : la neurulazione di un anfibio da tre punti di vista diversi; in ognuno sono mostrate neurule precoci (sinistra), intermedie (centro) e tardive (destra). (A) vista dall’alto della superficie dorsale dell’embrione. (B) Sezione sagittale attraverso il piano mediano dell’embrione. (C) Sezione trasversale attraverso il centro dell’embrione (Gilbert, 2000).
Questo modello, detto di “neurulazione primaria” si riferisce in particolare agli Anfibi, ma è valido anche per le altre classi di Vertebrati, con una eccezione nei Pesci, in cui il tubo neurale si forma pieno e viene cavitato successivamente: questo processo viene definito “neurulazione secondaria” e si verifica, di fatto, anche in Anfibi, Uccelli e Mammiferi, interessando però unicamente le regioni più posteriori del tubo neurale (Catala et al., 1996; Nievelstein et al., 1993).
Compartimentazione del tubo neurale
Il tubo neurale una volta formatosi subisce un profondo riarrangiamento nella sua architettura. In primo luogo l’espressione regionalmente specifica di diversi geni (“patterning genes”) individua i domini anatomo-funzionali lungo gli assi antero-posteriore e dorso-ventrale (Lupo et al., 2002; Rubenstein et al., 1998; Shimamura et al., 1995; Wilson e Rubenstein, 2000). Il processo di differenziamento poi avviene contemporaneamente a tre livelli differenti: a livello anatomico si verifica la formazione delle vescicole encefaliche; a livello tissutale si differenziano le popolazioni cellulari che formeranno le diverse regioni funzionali e a livello cellulare si formano i sei strati della corteccia e i tre del midollo; l’interazione tra proliferazione cellulare e apoptosi controlla infine la corretta proporzione delle popolazioni cellulari.
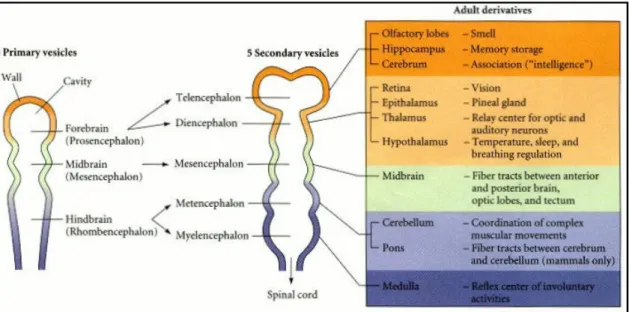
A livello prettamente anatomico si osserva che alla chiusura del tubo neurale la pressione esercitata dal liquido al suo interno provoca l’allargamento del lume: successivi restringimenti portano prima alla formazione della vescicola archencefalica e deuterencefalica, e successivamente alle tre vescicole encefaliche primarie, prosencefalo, mesencefalo e romboencefalo (le ultime due derivanti dal deuterencefalo) (Fig. 2). Il prosencefalo da’ origine a due espansioni laterali che formeranno le vescicole ottiche e si suddivide ulteriormente in telencefalo, più anteriore, da cui si sviluppano gli emisferi cerebrali, e in diencefalo, più posteriore, da cui derivano il talamo, l’ipotalamo e l’epitalamo. Il mesencefalo resta indiviso e vi si possono distinguere una regione ventrale, il corpo, da cui originano i nuclei e la reticolare, ed una regione dorsale, il tetto, che forma i lobi ottici a cui arriva l’informazione visiva. Il romboencefalo si suddivide in metencefalo e mielencefalo (Fig. 2): il primo dorsalmente da’ origine al cervelletto, e ventralmente rimane pressoché indistinto dal mielencefalo più rostrale, con cui costituisce il midollo allungato.
A livello cellulare il tubo neurale è costituito da un neuroepitelio pseudostratificato in cui i neuroblasti subiscono numerosi cicli di divisione simmetrica: quando il numero di cellule raggiunge un determinato limite iniziano cicli di divisione asimmetrica in cui la cellula figlia smette di moltiplicarsi e comincia a migrare (Cremisi et al., 2003).
In questo modo il tubo neurale acquisisce una struttura a tre strati concentrici: uno strato ventricolare, interno, con caratteristiche di epitelio in proliferazione; uno strato mantellare, intermedio, in cui migrano le cellule uscite dal ciclo e una zona marginale, esterna, costituita da fibre, che formerà la sostanza bianca. A livello cerebrale e cerebellare questa struttura a tre strati si modifica e i neuroblasti della zona intermedia migrano al di sopra di quella marginale verso una collocazione dipendente dal momento di uscita dal ciclo cellulare; giunti in sede, differenziano acquisendo le loro caratteristiche definitive e stabilendo le giuste connessioni con altri neuroni o tipi cellulari (McConnell e Kaznowski, 1991).
Figura 2: compartimentazione del tubo neurale: le tre vescicole primarie si suddividono in cinque nel corso dello sviluppo. A destra: lista delle strutture derivate da ciascuna vescicola in Uomo (Gilbert, 2000).
Sviluppo dell’occhio nei Vertebrati
L’occhio dei Vertebrati è una struttura estremamente complessa che, derivando da differenti porzioni dell’embrione, come il neuroectoderma prosencefalico, l’ectoderma superficiale della testa e le cellule delle creste neurali, richiede durante la morfogenesi uno sviluppo coordinato nel tempo e nello spazio di tutte le sue componenti.
Il processo di sviluppo dell’occhio è divisibile in tre fasi: inizialmente l’induzione da parte del mesoderma specifica le regioni da cui deriveranno i primordi di retina e cristallino; successivamente le strutture più precoci (la coppa ottica e il cristallino) vanno incontro a interazioni induttive reciproche e a processi di differenziamento che porteranno alla definizione delle strutture definitive dell’occhio; la funzionalità finale dell’occhio viene raggiunta poi al formarsi delle corrette connessioni neurali tra la retina e il tetto ottico.
Possiamo far risalire l’inizio dello sviluppo dell’occhio alla fine della gastrulazione, allo stadio di piastra neurale precoce, momento in cui l’endomesoderma interagisce con l’ectoderma dorsale inducendo in questo un destino neurale. Un’ampia regione della piastra neurale anteriore viene specificata a formare strutture neurali anteriori (Sasai et al., 1994) e successivamente regionalizzata a dare, tra l’altro, il “campo dell’occhio”: a questo punto è possibile identificare, nel neuroectoderma anteriore, i territori presuntivi da cui origineranno le strutture neurali dell’ occhio (Eagleson e Harris, 1990).
Eventi morfogenetici
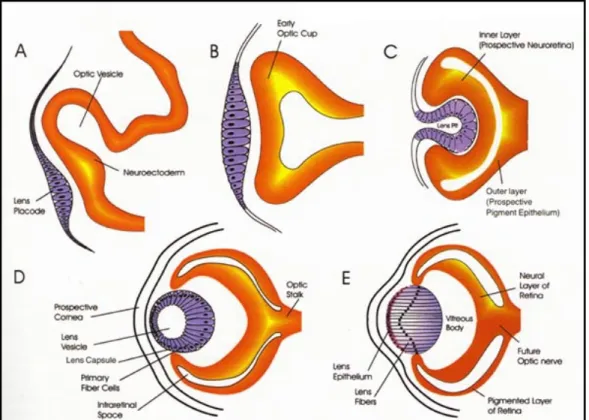
La prima evidenza morfologica dello sviluppo dell’occhio si ritrova alla fine della neurulazione, quando il tubo neurale all’altezza del diencefalo presuntivo produce due estroflessioni simmetriche che daranno origine alle vescicole ottiche. Ciascuna di esse si estende lateralmente in direzione prossimo-distale,
allontanandosi dal diencefalo, cui resta connessa tramite il peduncolo ottico; in prossimità della superficie ciascuna vescicola invia segnali induttivi che agiscono sull’ectoderma sovrastante promuovendo la formazione del placode del cristallino (Fig. 3). Di fatto il cristallino si forma in una regione di ectoderma già resa competente a formare questa struttura: durante le fasi precoci della neurulazione segnali planari dalla retina presuntiva e segnali verticali dall’endomesoderma sottostante hanno agito su un’ampia regione di ectoderma anteriore conferendole la potenzialità a formare il cristallino (Saha et al., 1989). In questo modo le vescicole ottiche sono quindi necessarie non tanto per l’induzione iniziale del cristallino, quanto per la sua corretta localizzazione nella regione di ectoderma competente.
Figura 3: morfogenesi dell’occhio. (A-B) La vescicola ottica si allontana dal diencefalo, induce il placode del cristallino e viene da esso indotta a sua volta a formare una struttura a coppa (C). (D-E) I due strati della coppa ottica differenziano in epitelio pigmentato e retina mentre il cristallino termina il differenziamento.
Il placode del cristallino a questo punto si invagina progressivamente fino a staccarsi dall’ectoderma, dando origine alla vescicola del cristallino che, interagendo a sua volta con la vescicola ottica, ne induce l’invaginazione a
partire dalla porzione ventrale (Cvekl e Piatigorsky, 1996). In questo modo la vescicola ottica (definita ora coppa ottica) assume un aspetto bistratificato: lo strato più esterno, il prossimale, differenzierà in epitelio pigmentato producendo melanina, lo strato più interno, il distale, originerà la retina neurale (Fig. 3).
Con il progredire dell’invaginazione della coppa ottica il peduncolo ottico si assottiglia progressivamente fino a ridursi a un canale che guiderà gli assoni pionieri delle cellule gangliari verso il tetto ottico.
La retina e il nervo ottico
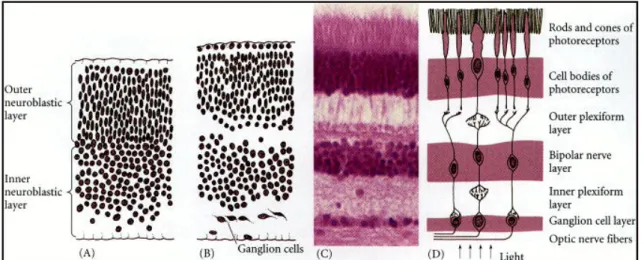
La retina neurale matura è una struttura stratificata (Fig. 4) della quale è possibile apprezzare al microscopio in sezione trasversale l’alternanza tra strati nucleari, costituiti dai corpi cellulari dei neuroni, e strati plessiformi, costituiti dai processi cellulari tramite cui le cellule stabiliscono interconnessioni sinaptiche tra loro. A partire dall’epitelio pigmentato si riconosce uno strato nucleare esterno costituito dai corpi dei fotorecettori, uno strato nucleare interno in cui sono presenti le cellule bipolari (che garantiscono la comunicazione tra i fotorecettori e le cellule gangliari), i neuroni amacrini e i neuroni orizzontali, questi ultimi deputati al trasporto dell’informazione in senso orizzontale e alla sua integrazione; l’ultimo strato è costituito dalle cellule gangliari i cui assoni costituiscono il nervo ottico.
Infine lo strato plessiforme esterno separa gli strati nucleare interno e esterno; lo strato nucleare interno e quello delle cellule gangliari sono separati dallo strato plessiforme interno.
Questa architettura laminare viene raggiunta attraverso un complesso insieme di eventi comprendenti la proliferazione, la migrazione e la morte differenziale delle cellule. Il differenziamento dei vari tipi cellulari segue un ordine che è rimasto conservato in tutti i Vertebrati: prima le cellule gangliari, seguite dai coni, dalle amacrine, dai bastoncelli, dalle bipolari, dalle orizzontali e in ultimo dalle cellule di Müller (Young, 1985). Un singolo neuroblasto può dare origine a tre tipi di neuroni o a due tipi di neuroni e una
Figura 4: sviluppo della retina. (A-B) Separazione iniziale dei neuroblasti. (C) Stratificazione della retina adulta. (D) Rappresentazione funzionale delle principali connessioni sinaptiche all’interno della retina: la luce attraversa la retina fino a essere colta dai fotorecettori; gli assoni dei fotorecettori sinaptano con i neuroni bipolari, che trasmettono a loro volta alle cellule gangliari. Gli assoni delle cellule gangliari si uniscono a formare il nervo ottico.
cellula gliale (Turner e Cepko, 1987): il differenziamento in un tipo neuronale piuttosto che in un altro dipende quindi dallo strato in cui le cellule si trovano e non dal loro precursore, e dall’influenza esercitata dalle cellule circostanti e dai fattori da esse secreti (Cepko et al., 1996; Harris, 1997).
Il nervo ottico nei Mammiferi prende origine nel momento in cui gli assoni delle cellule gangliari entrano nella regione peduncolare associata al pavimento del diencefalo, interagendo strettamente con le cellule del peduncolo ottico, che a loro volta differenziano in cellule gliali con funzione di sostegno: esse originano in loco dalla proliferazione e differenziamento delle cellule del peduncolo. Una volta raggiunto il recesso ottico alla base del diencefalo una parte delle fibre decussa e si fa controlaterale, le restanti restano omolaterali.
Cristallino e cornea
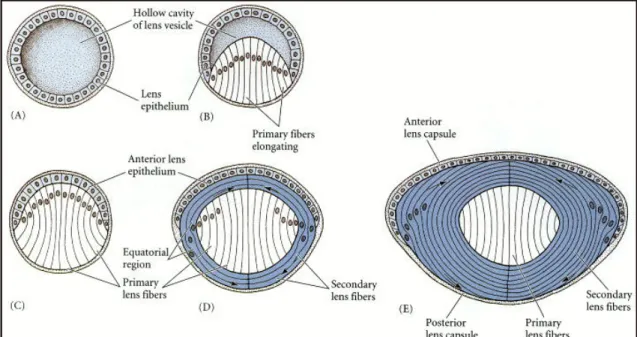
Il primordio del cristallino è costituito da un epitelio monostratificato: le cellule della parte posteriore, quella rivolta verso la coppa ottica, si allungano fino ad acquisire morfologia colonnare e, dietro segnalazione della retina neurale, diventano fibre primarie che crescono, fino a colmare la cavità all’interno del cristallino. Tali cellule producono cristalline che riempiono progressivamente ogni cellula causando la perdita del nucleo e degli organuli (Fig. 5).
Figura 5: differenziamento del cristallino. (A) Vescicola del cristallino. (B) Produzione delle fibre primarie del cristallino. (C) Cristallino ripieno di cellule sintetizzanti cristalline. (D) Nuove cellule del cristallino derivano dall’epitelio anteriore. (E) Crescita del cristallino, differenziamento continuo di nuove cellule e perdita dei loro nuclei. (Gilbert, 2000)
Le cellule della parte anteriore del cristallino mantengono la morfologia epiteliale e restano in attiva proliferazione producendo cellule che migrano verso la regione equatoriale; queste si allungano e differenziano in fibre secondarie che si dispongono ad anelli concentrici a quelle primarie. L’apposizione di nuove fibre secondarie intorno al “core” di fibre primarie continua per tutto l’arco di vita dell’animale
La formazione della cornea è l’ultimo degli eventi induttivi che avvengono durante lo sviluppo dell’occhio: esso è dovuto all’interazione della vescicola del cristallino con l’ectoderma sovrastante, che diviene colonnare e comincia a secernere fibrille di collagene formando uno stroma primario. Cellule derivanti dalla cresta neurale migrano dai bordi della coppa ottica lungo la superficie interna dello stroma, al di sopra della vescicola del cristallino, formando un monostrato cellulare detto endotelio, che secerne acido ialuronico nello stroma primario. Per l’azione dell’acido ialuronico, lo stroma primario si espande e diventa substrato per una nuova migrazione di cellule mesenchimali, derivanti dalle creste neurali, che a loro volta secernono ulteriore collageno e ialuronidasi formando lo stroma secondario (Bard, 1990; Hay, 1979). La ialuronidasi permette il restringimento della cornea, che diventa successivamente trasparente.
Eventi induttivi nella piastra neurale
Sebbene la prima indicazione morfologica della formazione dell’occhio sia l’evaginazione bilaterale del prosencefalo, gli eventi implicati nella specificazione sono indubbiamente precedenti e comprendono una complessa serie di interazioni induttive che cominciano già con l’induzione neurale; per mezzo di questa l’ectoderma dorsale viene rispecificato e da’ origine alla piastra neurale, che viene poi progressivamente regionalizzata.
Il modello più noto per spiegare il “patterning” della piastra neurale anteriore è quello di attivazione/trasformazione, proposto da Nieuwkoop e collaboratori, per cui l’induzione e il “patterning” del neuroectoderma avvengono in due fasi. Durante la prima (“attivazione”) l’ectoderma dorsale viene inizialmente indotto a neuroectoderma prosencefalico presuntivo dall’adiacente e sottostante mesendoderma. In seguito, nella seconda fase (“trasformazione”), parte di questo tessuto riceve segnali “caudalizzanti” dal mesoderma dorsale posteriore (Nieuwkoop, 1952; Nieuwkoop, 1954).
Un ulteriore perfezionamento del modello è derivato dagli eleganti studi, sempre di Nieuwkoop, in rana (Nieuwkoop, 1963). Neuroectoderma presuntivo espiantato da embrioni di rana allo stadio di blastula produce epidermide non-neurale se coltivato da solo, ma se le cellule di questi espianti (“animal caps”) vengono dissociate e poi riaggregate, differenziano in tessuto neurale anteriore: il punto importante di questi esperimenti è che questi espianti, cosiddetti “attivati”, divengono neurali in assenza del mesoderma e dell’endoderma (possibili induttori) e danno origine a cervello anteriore, placodi olfattivi e strutture dell’occhio.
L’apparente contraddizione con il modello di attivazione/trasformazione si risolve ipotizzando che l’attivazione avvenga attraverso un’inibizione di segnali che contrastano il destino neurale. In Xenopus, conferme sono arrivate dal punto di vista molecolare, con l’identificazione di molecole secrete che fungono da attivatori, come noggin, chordin, follistatin, Xnr3, cerberus (Harland, 2000; Weinstein e Hemmati-Brivanlou, 1999). Queste molecole sono espresse nel mesendoderma dorsale durante gli stadi di gastrula e neurula e funzionano come antagonisti extra-cellulari delle vie di segnalazione dei BMP (“bone morphogenetic proteins”), che indirizzano l’ectoderma verso il destino epidermico. Espianti provenienti da embrioni microiniettati con questi inibitori, privi del potenziale induttivo fornito dal mesoderma o dall’endoderma, si comportano esattamente come riportato da Nieuwkoop per gli espianti “attivati”.
Caratteristiche di “trasformazione” invece sono state identificate in molecole secrete come l’acido retinoico, gli Wnt, i BMP e gli Fgf, tutte capaci di attivare l’espressione di geni neurali posteriori nel neuroectoderma (Gamse e Sive, 2001; Munoz-Sanjuan e Brivanlou, 2001; Sasai e De Robertis, 1997). Queste molecole influenzerebbero il “patterning” antero-posteriore iniziale agendo secondo schemi complessi (Wilson e Houart, 2004): in Xenopus un gradiente globale di attività degli Wnt e dei loro antagonisti regola ad esempio la definizione di valori posizionali antero-posteriori (Kiecker e Niehrs, 2001) mentre in “zebrafish” i livelli di attività dei BMP sono capaci di regolare i movimenti di estensione convergente (Myers et al., 2002).
Se queste vie di segnalazione possono spiegare una prima suddivisione del sistema nervoso centrale in regioni ampie come prosencefalo, mesencefalo, romboencefalo e midollo spinale, non possono tuttavia definire completamente la complessa sub-regionalizzazione di strutture come il prosencefalo: segnali più tardivi rispetto a quelli già visti agiscono localmente modulando e rifinendo il “patterning” regionale in modo tale che i domini di espressione dei geni successivamente indotti suddividano la piastra neurale in territori discreti (Wilson e Houart, 2004).
Se a livello di mesencefalo/romboencefalo si riconosce l’istmo come organizzatore locale, ultimamente sono stati fatti anche progressi nella delucidazione degli eventi che portano alla suddivisione regionale della piastra neurale anteriore, identificando le cellule del bordo anteriore della piastra neurale come sorgenti di segnali secreti – come fgf-8 e gli sFRP, inibitori degli Wnt - che promuovono l’espressione di geni telencefalici (Echevarria et al., 2003; Houart et al., 1998; Shimamura e Rubenstein, 1997; Tian et al., 2002).
Anche in questa fase l’attività degli Wnt sembra avere un ruolo importante: dopo l’iniziale regionalizzazione antero-posteriore dell’intera piastra neurale da parte di un gradiente di Wnts (Kiecker e Niehrs, 2001), l’espressione localizzata di agonisti e antagonisti delle vie di segnalazione degli Wnt stessi potrebbe stabilirne e rifinirne localmente i gradienti di attività e di conseguenza perfezionare il “patterning” regionale (Houart et al., 2002).
Negli ultimi tempi sta quindi diventando più chiaro che eventi più complessi che la sola inibizione dei BMP sono alla base dello sviluppo delle strutture più rostrali del sistema nervoso centrale, eventi in cui sono coinvolti e integrati ulteriori segnali nell’induzione e nel corretto “patterning” della piastra neurale anteriore e, in conseguenza, del campo morfogenetico dell’occhio (Houart et al., 2002; Lupo et al., 2002; Mukhopadhyay et al., 2001; Pera et al., 2001; Stern, 2001; Wilson e Rubenstein, 2000).
Il campo morfogenetico dell’occhio
Durante lo sviluppo iniziale del sistema nervoso centrale viene indotta e specificata nella piastra neurale anteriore un’ampia regione a forma di mezzaluna equipotenzialmente capace di formare le strutture dell’occhio: il “campo morfogenetico dell’occhio” (“eye-field”). Successivamente sotto l’azione del sottostante mesoderma precordale (Li et al., 1997; Pera e Kessel, 1997) il campo dell’occhio si suddividerà in due regioni bilaterali simmetriche che daranno origine ai singoli occhi.
In effetti già alla fine del 1800, sulla scorta dell’osservazione di fenomeni di ciclopia in neonati, era sorta l’ipotesi che potesse esistere nell’embrione un singolo campo morfogenetico dell’occhio che si risolvesse in due porzioni simmetriche durante lo sviluppo. Le prove per questa ipotesi furono raccolte attraverso una serie di esperimenti di manipolazione di embrioni di anfibi: questi dimostrarono che porzioni di neuroectoderma anteriore trapiantate hanno il potenziale per svilupparsi in occhi (Adelmann, 1936); inoltre, la rimozione del mesoderma precordale di urodeli, sottostante la piastra neurale anteriore, generava embrioni ciclopici (Mangold, 1931). Esperimenti simili sono stati condotti anche in Xenopus e pollo (Li et al., 1997; Pera e Kessel, 1997) e hanno confermato il ruolo inibitore della placca precordale, necessaria e sufficiente a sopprimere il destino neurale del neuroectoderma sovrastante. E’ interessante sottolineare che in Xenopus non vi è migrazione laterale delle cellule situate medialmente nel campo dell’occhio e che il loro destino retinico viene semplicemente ‘spento’ dai segnali sottostanti (Li et al., 1997). Diversamente avviene in “zebrafish”, in cui i precursori retinici, derivanti da un singolo dominio del prosencefalo antero-mediale, migrano lateralmente, spiazzati fisicamente da precursori del diencefalo ventrale: questi infatti si muovono anteriormente inserendosi nella regione mediale, suddividendo così l’”eye-field” in due domini simmetrici (Moody, 1999; Varga et al., 1999). Sono diverse le mutazioni in “zebrafish” che hanno come fenotipo la ciclopia - cyclops, one-eyed-pinhead , schmalspur e squint (Hatta et al., 1994; Pogoda et al., 2000; Schier et al., 1997; Sirotkin et al., 2000) – e sono tutte collegate a differenti livelli all’alterazione della via di segnalazione dei Nodal dal mesoderma assiale.
A livello molecolare in Xenopus e topo il suddetto cambiamento nel programma di sviluppo nella regione mediale dell’”eye-field” si accompagna alla repressione di diversi geni regolatori, come Pax6 (Hirsch e Harris, 1997), Rx (Casarosa et al., 1997; Mathers et al., 1997), Optx2 (Zuber et al., 1999) e ET (Li et al., 1997) nella parte mediana del loro dominio di espressione nella piastra neurale anteriore. Nella stessa regione vengono nel contempo attivati geni regolatori dello sviluppo del prosencefalo come sonic hedgehog (shh), la cui perdita di funzione in topo genera appunto la ciclopia (Chiang et al., 1996). E’ interessante notare come alcuni degli effetti delle vie di segnalazione di Nodal nel tessuto neurale siano mediati proprio da molecole secrete di classe Hedgehog (Rohr et al., 2001; Wilson e Rubenstein, 2000), secrete, come Nodal, dal mesoderma assiale.
Induzione e specificazione dell’”eye-field”
Anche se ancora ben lontani dall’essere completamente chiariti, gli eventi induttivi responsabili della determinazione di questo territorio si possono riprodurre con esperimenti di coniugazione di espianti di embrioni di Xenopus: combinando tessuto dell’organizzatore di rana con espianti ectodermici (“animal caps”) si assiste all’induzione di Xrx1, un marcatore specifico dell’”eye-field” (Casarosa et al., 1997; Lupo et al., 2002; Mathers et al., 1997). Anche la microiniezione di mRNA di noggin e chordin in “animal caps” induce l’espressione di marcatori dell’occhio (Andreazzoli et al., 1999; Lupo et al., 2002). Tutto ciò suggerisce che l’inibizione di BMP potrebbe essere sufficiente per la specificazione iniziale dell’”eye-field”. Inoltre è stato osservato che a stadio 11.5 (“midgastrula”) in Xenopus l’ectoderma dorsale ha già ricevuto segnali per la specificazione dell’”eye-field”, dato che, se espiantato e messo in coltura fino a stadi più tardivi, esprime l’opsina, un marcatore dell’occhio, e può formare retina pigmentata (Saha et al., 1992).
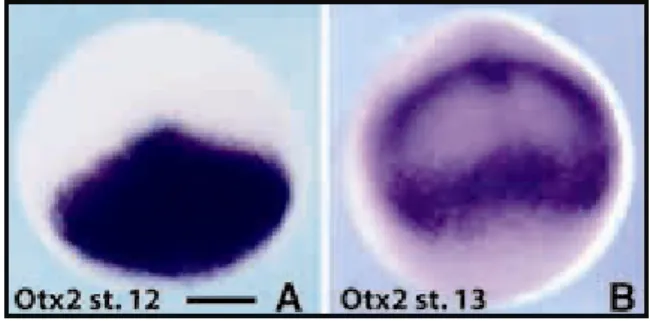
C’è da notare anche che l’”eye-field” è compreso in un territorio della piastra neurale anteriore che inizialmente esprime interamente il marcatore del
prosencefalo/mesencefalo Xotx2 (Foto 1A). E’ ipotizzabile che Xotx2 impartisca precocemente qualche tipo di competenza a questo territorio, che rende possibile l’espressione iniziale e il mantenimento di fattori di trascrizione specifici (vedi sotto), permettendo così la specificazione dell’”eye-field” (Bernier et al., 2001; Kenyon et al., 2001; Zuber et al., 2003) Inoltre, la capacità di tutta la piastra neurale presuntiva - non solo della sua parte più anteriore - di formare occhi (Saha et al., 1992) appare riflettere una competenza residua in questo territorio, seguente a una prima ondata di espressione di Xotx2 durante la fase di attivazione dell’induzione neurale (Blitz e Cho, 1995).
Fattori di trascrizione ”eye-field” specifici
Evidenze molecolari provano che il territorio dell’occhio viene specificato all’interno della piastra neurale anteriore dall’espressione di fattori di trascrizione “eye-field” specifici (EFTF) che includono ET, Rx1, Pax6, Six3, Lhx2, tll e Optx2 (Chow e Lang, 2001; Zuber et al., 2003) e che sono inizialmente espressi in un dominio continuo, rafforzando così anche l’idea di un “eye-field” inizialmente singolo che successivamente viene bisecato in due primordi dell’occhio separati e simmetrici rispetto l’asse antero-posteriore dell’embrione (Lupo et al., 2000) (Schema 1).
Schema 1: territori di espressione di ET, Rx1, Pax6, Six3, Lhx2, nella piastra neurale anteriore allo stadio di neurula precoce.
Diversi di questi fattori di trascrizione sono stati identificati come omologhi di geni necessari alla formazione dell’occhio in Drosophila, in cui la specificazione dell’occhio dipende dalle interazioni di sette geni: twin of eyeless (toy), eyeless (ey), eyes absent (eya), sine oculis (so), dachsund (dac), eye gone (eyg) e optix. Il loro “pattern” di espressione si sovrappone ed è regolato dalle vie di segnale di Notch e EGF-R: più che agire in cascata formano una rete genica di regolazione a “feedback” e di interazioni reciproche proteina-proteina (Kumar e Moses, 2001).
Tornando a Xenopus,i suddetti EFTF includono un omologo di ey, Pax6, e due omologhi di optix,che sono Six3 e Optx2.
Studi funzionali in diversi sistemi modello hanno dimostrato non solo che ET, Rx1, Pax6, Six3, Lhx2, tll e Optx2 sono necessari al corretto sviluppo dell’occhio, ma anche che in determinati contesti sono sufficienti: la sovraespressione di Pax6, Rx, Six3 e Optx2 espande o induce tessuti ectopici dell’occhio in Vertebrati diversi (Andreazzoli et al., 1999; Bernier et al., 2000; Chow et al., 1999; Chuang e Raymond, 2001; Loosli et al., 1999; Mathers et al., 1997; Oliver et al., 1996; Zuber et al., 1999). Oltre a indurre strutture ectopiche dell’occhio, la sovraespressione di ciascuno dei geni Pax6, Rx, Optx2 e Six3 riesce ad attivare l’espressione degli altri, mentre l’inattivazione di ognuno è capace di ridurre l’espressione degli altri, senza comunque prevenirne l’attivazione (Andreazzoli et al., 1999; Bernier et al., 2001; Carl et al., 2002; Chow et al., 1999; Chuang e Raymond, 2001; Goudreau et al., 2002; Lagutin et al., 2001; Lagutin et al., 2003; Loosli et al., 1999; Zhang et al., 2000; Zuber et al., 1999).
Non sorprende quindi che questi fattori di trascrizione, al pari dei loro omologhi in Drosophila, non si ritrovino in una cascata di attivazione lineare, ma siano incasellati in una rete genica di cui recentemente si sta rivelando la natura (Zuber et al., 2003). I risultati sperimentali ottenuti in Xenopus sostengono l’idea di un modello di specificazione tissutale progressiva in cui l’induzione neurale e quindi il “patterning” regionale guidato da Xotx2 preparano la piastra neurale anteriore alla formazione dell’”eye-field”; a questo punto gli EFTF formano una rete di interazioni reciproche a “feedback” che specifica l’”eye-field” e lo determina nel suo destino (Zuber et al., 2003).
Oltre ad essere implicati nella specificazione precoce dell’”eye-field” ognuno di questi EFTF gioca un ruolo specifico nelle fasi successive dello sviluppo dell’occhio, e non solo. Infatti tutti vengono anche espressi in altri territori neurali: Pax6 ad esempio viene espresso anche nel prosencefalo, nei placodi olfattivi, nel romboencefalo e nel midollo spinale (Chow et al., 1999); similmente, Xrx1 possiede domini di espressione nel telencefalo e nel diencefalo (Casarosa et al., 1997).
Sarà opportuno quindi fissare brevemente le caratteristiche di espressione e funzionali di alcuni di questi geni, per delucidarne meglio la molteplicità dei ruoli durante lo sviluppo, al fine di interpretare correttamente i risultati della presente tesi.
Otx2
A livello molecolare uno dei primi eventi durante il processo di specificazione regionale del neuroectoderma anteriore è l’espressione del gene Otx2 (Foto 1A), che precede quella di altri fattori di trascrizione espressi precocemente nell’occhio (come i già citati Rx, Pax6, Six3). Otx2 è dotato di un omeodominio di classe bicoid ed è un membro della famiglia dei fattori di trascrizione correlati a orthodenticle (otd) (Simeone et al., 1993), un gene di Drosophila fondamentale per il corretto sviluppo di strutture della testa del moscerino come l’antenna, l’occhio e il cervello anteriore (Finkelstein e Boncinelli, 1994; Finkelstein et al., 1990; Simeone et al., 1993).
In topo, Otx2 si esprime nell’ectoderma embrionale per poi restringersi gradualmente all’estremità anteriore dell’embrione man mano che procede la gastrulazione (Simeone et al., 1993).
In Xenopus Xotx2 viene dapprima espresso nel mesendoderma precordale presuntivo della regione dell’organizzatore, per poi restringersi alla piastra neurale anteriore e nei distretti prosencefalici e mesencefalici (Blitz e Cho, 1995; Kablar et al., 1996; Pannese et al., 1995) (Foto 1A).
L’importanza per lo sviluppo del cervello anteriore e degli occhi è stata dimostrata in esperimenti di perdita di funzione in Xenopus e topo, nei quali si
riscontrano problemi di gastrulazione e la perdita delle strutture anteriori come il prosencefalo, il mesencefalo e gli occhi, probabilmente per problemi durante l’induzione neurale (Gammill e Sive, 2001; Isaacs et al., 1999; Matsuo et al., 1995; Pannese et al., 1995). Poichè questi difetti si stabiliscono durante fasi di sviluppo assai più precoci della formazione degli occhi, questi esperimenti non consentono di determinare il ruolo preciso di Otx2 nell’occhio in via di sviluppo. Mutanti eterozigoti Otx2+/- in topo manifestano difetti nel cristallino, nell’epitelio pigmentato, nella retina neurale e nel peduncolo ottico (Martinez-Morales et al., 2001), mentre la sovraespressione in Xenopus riesce a indurre tessuto nervoso e ghiandole del cemento ectopiche, ma non strutture oculari.
Foto 1: (A) Il territorio di espressione di Xotx2 è esteso a un’ampia porzione della piastra neurale anteriore in embrioni a stadio 12 (gastrula tardiva). (B) Allo stadio 13 (neurula precoce) l’espressione di Xotx2 viene repressa in corrispondenza della retina presuntiva.
In ogni caso studi in cui la sovraespressione di Pax6, Six3, Optx2 o Rx produce tessuti oculari ectopici suggeriscono che Otx2 sia necessario alla formazione dell’occhio: questi si formano infatti solo nella regione della testa definita dall’espressione di Otx2, anteriormente al romboencefalo (Andreazzoli et al., 1999; Bernier et al., 2000; Chow et al., 1999; Chuang e Raymond, 2002; Loosli et al., 1999; Mathers et al., 1997; Mathers e Jamrich, 2000).
Sebbene in Xenopus Xotx2 sia necessario alla specificazione della piastra neurale anteriore, la specificazione del campo morfogenetico dell’occhio ne richiede la repressione locale. Infatti, alla fine della gastrulazione Xotx2 viene espresso in tutta la piastra neurale anteriore, ma poche ore dopo viene represso esattamente nei territori della retina presuntiva (Foto 1B): è interessante notare che Xrx1 gioca un ruolo importante in questo evento, essendo capace di reprimere l’espressione di Xotx2 (Andreazzoli et al., 1999).
Pax6
Pax6 è un gene “homeobox” di tipo “paired-like” che ha mantenuto una notevole conservazione nel corso dell’ evoluzione (Callaerts et al., 1997; Cvekl e Piatigorsky, 1996): nei Vertebrati viene espresso a partire dalla fine della gastrulazione nella piastra neurale anteriore (Grindley et al., 1995; Hirsch e Harris, 1997; Li et al., 1997; Li et al., 1994; Puschel et al., 1992; Walther e Gruss, 1991). Per quanto riguarda l’occhio, nel corso della neurulazione l’espressione di Pax6 si risolve nella zona distale delle vescicole ottiche e nell’ectoderma del cristallino presuntivo. Nel corso del differenziamento del cristallino l’espressione di Pax6 si restringe alle cellule epiteliali in proliferazione. Similmente, l’iniziale espressione di Pax6 nella coppa ottica (Grindley et al., 1995), si restringe progressivamente solo alle cellule gangliari e amacrine della retina differenziata (Belecky-Adams et al., 1997). Oltre al ruolo nella formazione dell’occhio, Pax6 è essenziale anche per il normale sviluppo dell’epitelio nasale (Hogan et al., 1986), del cervello (Grindley et al., 1997; Schmahl et al., 1993), del pancreas (St-Onge et al., 1997) e della ghiandola lacrimale (Makarenkova et al., 2000).
Le mutazioni per perdita di funzione di Pax6 sono semi-dominanti e allo stato eterozigote portano al fenotipo Small eye (Sey) in topo (prima mappato sul cromosoma 2 e solo successivamente correlato a Pax6) (Hogan et al., 1986) e in ratto (Matsuo et al., 1993); tale fenotipo è caratterizzato da catarattogenesi, ipoplasia dell’iride e microftalmia. Mutazioni simili nell’uomo causano una sindrome detta aniridia (Glaser et al., 1992; Hanson et al., 1993; Ton et al., 1991).
Il dosaggio genico di Pax6 risulta importante per il normale sviluppo degli occhi, come dimostrato da studi in cui copie in soprannumero del locus Pax6 sono state introdotte in topi transgenici (Schedl et al., 1996): mentre una singola copia del locus può recuperare il fenotipo Sey eterozigote, copie multiple producono anch’esse difetti nello sviluppo degli occhi. Quindi un eccesso di Pax6 va a detrimento di un corretto sviluppo dell’occhio e il suo dosaggio genico deve essere finemente regolato.
Ratti e topi omozigoti per la mutazione sono anoftalmici e muoiono alla nascita (Grindley et al., 1997; Hogan et al., 1986; Matsuo et al., 1993). Anche
se inizialmente le vescicole ottiche sono presenti, non subiscono la costrizione prossimale e il risultato è un peduncolo ottico pervio e una coppa ottica rudimentale e indifferenziata; inoltre anche se esse entrano in contatto con l’ectoderma di superficie, il normale ispessirsi del placode del cristallino non avviene.
La capacità di Pax6 di indurre occhi ectopici, anche se in proporzione limitata, conferma l’ipotesi della sua importanza negli stadi precoci dello sviluppo dell’occhio. In Xenopus la sovraespressione di Pax6 produce occhi ectopici pienamente differenziati e l’espressione ectopica di geni dello sviluppo precoce dell’occhio come Otx2, Rx e Six3, oltre che di se’ stesso (Chow et al., 1999). L’osservazione che gli occhi ectopici si formano soltanto quando l’mRNA di Pax6 viene microiniettato in blastomeri dorsali (che origineranno tessuti neurali ed ectodermici) indica che, come visto in precedenza, per l’induzione di occhi ectopici sono necessari anche altri fattori.
Dal momento che i mutanti per perdita di funzione non portano a completamento lo sviluppo degli occhi, l’uso di mutanti condizionali si è rivelato importante per delucidare il ruolo di Pax6 a stadi più tardivi dello sviluppo dell’occhio. Pax6 risulta avere un ruolo essenziale nel mantenimento dei precursori retinici allo stato multipotente: in caso di assenza di espressione nella retina neurale gli unici tipi cellulari che differenziano sono una sottopopolazione di cellule amacrine (Marquardt et al., 2001). Comunque Pax6 non sembra essere necessario per il mantenimento dell’identità retinica, dato che in questi esperimenti l’espressione di Rx, Six3 e Six6 non viene perduta.
Six3 e Optx2
Six3 e Optx2 (denominato anche Six6 o Six9) sono membri correlati appartenenti alla famiglia SIX-omeodominio (di cui sine oculis di Drosophila è il membro fondatore) e condividono oltre il 90% di identità aminoacidica nell’omeodominio con optix, altro gene di Drosophila della famiglia SIX. Mutazioni eterozigoti di SIX3 nell’uomo sono state ritrovate in casi di oloprosencefalia di tipo II (Wallis et al., 1999), in cui la presenza di
malformazioni cranio-facciali come ciclopia e microftalmia rende probabile un ruolo di SIX3 nella piastra neurale anteriore e nella formazione dell’occhio.
Six3 e Optx2 hanno un dominio di espressione correlabile a un ruolo nello sviluppo precoce dell’occhio: sono espressi nella piastra neurale anteriore in domini che si sovrappongono, ma solo Six3 successivamente restringe il suo dominio di espressione al territorio che comprende l’”eye-field” e il diencefalo ventrale (Schema 1). A stadi più tardivi Six3 e Optx2 sono espressi nella vescicola ottica e successivamente nel peduncolo ottico e nella retina neurale (Bovolenta et al., 1998; Granadino et al., 1999; Jean et al., 1999; Loosli et al., 1998; Oliver et al., 1995; Zuber et al., 1999). Nel placode del cristallino Six3 risulta attivato, mentre l’espressione di Optx2 pare essere assente o fortemente ridotta (Jean et al., 1999; Zuber et al., 1999).
Gli esperimenti di guadagno e perdita di funzione in differenti sistemi modello confermano l’importanza di questi geni nello sviluppo dell’occhio. Nel pesce medaka la sovraespressione di Six3 risulta nella conversione di regioni del mesencefalo e cervelletto presuntivi in strutture a forma di coppa ottica contenenti epitelio pigmentato e nella concomitante comparsa di espressione ectopica di Rx, Pax6 e Six3 endogeno (Loosli et al., 1999). Inoltre la sovraespressione di Six3 in “zebrafish” produce un ingrandimento del prosencefalo rostrale e del dominio di espressione di Pax2, un marcatore dei peduncoli ottici: ciò è in accordo con la normale espressione di Six3 nei peduncoli ottici, e ne suggerisce così un possibile ruolo nella regionalizzazione prossimo-distale dell’occhio attraverso il controllo del destino cellulare nel peduncolo (Kobayashi et al., 1998).
Infine la sovraespressione di Optx2 nel campo morfogenetico dell’occhio in Xenopus causa un’espansione dei territori retinici e un notevole incremento delle dimensioni dell’occhio, suggerendo così un ruolo nella regolazione della proliferazione dei retinoblasti (Bernier et al., 2000; Zuber et al., 1999).
Proliferazione e differenziamento
Se da un lato gli eventi induttivi di specificazione e “patterning” forniscono una cornice spaziale finemente controllata, il corretto sviluppo delle strutture neurali (e non solo) dipende anche da un preciso equilibrio temporale tra durata della proliferazione, uscita dal ciclo cellulare e conseguente differenziamento in senso neurogenico.
Proliferazione e differenziamento devono essere strettamente coordinati: per il corretto sviluppo di ogni parte del corpo ci deve essere sufficiente proliferazione che fornisca abbastanza cellule per la struttura finale; sono poi necessari meccanismi che assicurino che la proliferazione termini e che il differenziamento di precisi tipi cellulari inizi al momento giusto; infine ci vogliono sistemi che assicurino la corretta proporzione di ogni parte del corpo, in relazione a se’ stessa e al resto dell’organismo.
Vale la pena notare che la piastra neurale anteriore è caratterizzata da una prolungata proliferazione e ritardato differenziamento, specie se confrontata alle regioni più posteriori (Papalopulu e Kintner, 1996). Ciò conduce alla formazione di un ampio encefalo anteriore, mentre le strutture posteriori del sistema nervoso centrale (midollo spinale) assumono dimensioni più ristrette. Le basi molecolari del fatto che il sistema nervoso centrale generi più neuroni anteriormente che posteriormente, sono ancora in buona parte sconosciute.
Nei vertebrati non-mammiferi come “zebrafish” e Xenopus il differenziamento neuronale inizia quando la piastra neurale è ancora aperta: questi organismi hanno uno stadio embrionale di larva natante e quindi hanno necessità di formare rapidamente un sistema nervoso primitivo ma funzionante, così un sottoinsieme di cellule neuroectodermiche esce dal ciclo cellulare e inizia a differenziare al termine della gastrulazione originando i neuroni primari (Hartenstein, 1989; Wilson e Easter, 1992). Successivamente una seconda ondata di neurogenesi genera i neuroni secondari dell’adulto e rimpiazza i primari (Forehand e Farel, 1982).
In Xenopus la prima ondata di neurogenesi consiste in tre strisce parallele di cellule che esprimono n-tubulin come marcatore di differenziamento neuronale terminale: queste tre strisce sono disposte su entrambi i lati della
piastra neurale posteriore, e contengono – separatamente e in direzione medio-laterale - neuroni motori, interneuroni e neuroni sensoriali primari (Chitnis et al., 1995).
Questo processo è controllato dall’espressione di geni di specificazione regionale precoce come la famiglia dei geni “homeobox” Xiro (de la Calle-Mustienes et al., 2002), che definiscono le zone dove la formazione di neuroni primari è consentita o no. Inoltre i geni Xiro regolano la più precisa espressione dei geni proneurali, un gruppo di fattori di trascrizione di tipo bHLH, come Xngnr-1 (Ma et al., 1996), che rendono cellule neurali di domini più ristretti competenti a diventare neuroni differenziati. Entro un gruppo proneurale viene quindi selezionata una singola cellula a diventare un precursore neuronale, mentre alle cellule vicine ciò viene impedito attraverso un processo di inibizione laterale mediato dal gene neurogenico Notch e dal suo ligando Delta (Chitnis et al., 1995). I geni proneurali promuovono l’espressione di Delta nella cellula selezionata (Ma et al., 1996), e quindi Delta interagisce con il recettore Notch sulla superficie delle cellule vicine. In seguito a tale interazione il recettore Notch viene tagliato a formare un dominio intracellulare che entra nel nucleo e attiva la trascrizione di geni bersaglio quali quelli appartenenti alla famiglia degli HES, repressori trascrizionali che sopprimono il destino neuronale (Bray, 1998; Wettstein et al., 1997).
Alla fine della gastrulazione in Xenopus, i bordi della piastra neurale anteriore in proliferazione sono chiaramente delimitati dall’espressione di geni coinvolti nella neurogenesi come Xdelta-1 e Xngnr-1 e di geni che mediano l’arresto del ciclo cellulare come p27Xic1 e Xgadd45-γ (de la Calle-Mustienes et al., 2002; Hardcastle e Papalopulu, 2000). All’interno della piastra neurale anteriore invece i fattori coinvolti nel ritardare il differenziamento sono Xsix3, Xoptx2, Xanf-1 e Xbf-1; Xsix3 e Xoptx2 promuovono entrambi l’attività proliferativa portando all’ingrandimento della retina (Bernier et al., 2000; Zuber et al., 1999); la sovraespressione di Xanf-1 fa allargare la piastra neurale e reprime il differenziamento neuronale (Ermakova et al., 1999). Xbf-1 infine ha n ruolo nel limitare la neurogenesi al bordo della piastra neurale anteriore sopprimendo o promuovendo la neurogenesi in modo concentrazione-dipendente (Bourguignon et al., 1998).
Comunque il campo relativo ai meccanismi che correlano l’uscita dal ciclo cellulare ai fattori che controllano il destino differenziativo cellulare è di grande rilievo e complessità e per ora non del tutto decifrato (Harris, 1997). E’ stato recentemente dimostrato che la ciclina p27Xic1 viene espressa ad alti livelli in cellule destinate a diventare neuroni, è necessaria alla neurogenesi e funziona a monte di neuroD - un fattore di trascrizione che attiva i geni delle proteine strutturali specifiche dei neuroni (Lee et al., 1995) - e in parallelo a Xngnr-1 (Vernon et al., 2003).
Il ruolo di Rx/Xrx1
Gli omologhi di Rx sono stati identificati nell’uomo, nei roditori (topo e ratto, denominato Mrx), nel pollo (due omologhi, cRax e cRaxL) , nei Pesci (tre omologhi in “zebrafish”, Rx1, Rx2, Rx3 e due in medaka, Rx2 e Rx3) e nel moscerino (drx), oltre che in Xenopus (due omologhi, Xrx1 e Xrx2) (Casarosa et al., 1997; Eggert et al., 1998; Loosli et al., 2001; Mathers et al., 1997; Ohuchi et al., 1999; Tucker et al., 2001).
Sono geni homeobox di classe paired-like (il residuo in posizione 50 dell’omeodominio è una glutammina e non una serina come nei geni di classe paired), e sono dotati di un octapeptide HSIEAILG e di un motivo OAR di trans-attivazione, entrambi anche presenti in altri fattori di trascrizione di classe paired-like (Furukawa et al., 1997; Simeone et al., 1994) (Fig. 6).
OCT Hd OAR
Figura 6: schema dei domini funzionali di un omologo di Rx. OCT: octapeptide. Hd: omeodominio. OAR: dominio di trans-attivazione.
In Drosophila drx non si esprime ne’ nei primordi ne’ nei dischi imaginali dell’occhio (Eggert et al., 1998; Mathers et al., 1997) e non è necessario al suo sviluppo, ma a quello del cervello: è dimostrato infatti che mutanti nulli per drx
hanno un sistema visivo normalmente conformato, mentre il corpo ellissoide, una struttura cerebrale, subisce alterazioni (Davis et al., 2003).
Nel pollo la sequenza aminoacidica di cRax è maggiormente correlata a quella di Xrx1, laddove quella di cRaxL è più correlata alle sequenze di Rx1 e Rx2 di “zebrafish” e manca dell’octapeptide; i due geni hanno domini di espressione che si sovrappongono nell’ectoderma neurale anteriore, corrispondenti al prosencefalo e alla retina presuntvi (Ohuchi et al., 1999).
In “zebrafish” i tre omologhi Rx1, Rx2, Rx3 sono tutti attivati nella piastra neurale anteriore durante la neurulazione e tutti trascritti nelle vescicole ottiche presuntive, ma sono diversamente modulati durante lo sviluppo tardivo. Rx1 ed Rx2 hanno un uguale “pattern” di espressione nella retina, mentre Rx3 viene espresso nel prosencefalo ventrale, suggerendo che durante l’evoluzione sia avvenuta la duplicazione e la divergenza delle funzioni di questi geni; il loro “pattern” di espressione combinato comprende gli stessi domini di espressione degli omologhi in Xenopus e topo (Mathers et al., 1997) (vedi sotto).
In medaka vi è un mutante eyeless (el), conseguenza di un’inserzione intronica nel locus Rx3; il fenotipo mutante dimostra che questo gene è richiesto per la corretta determinazione, evaginazione e proliferazione delle vescicole ottiche (Loosli et al., 2001). Rx3 condivide un’omologia di sequenza maggiore con Xrx2 che con Xrx1 (Zuber et al., 2003). La mutazione di Rx3 non influenza ne’ l’espressione di Rx2, ne’ i movimenti morfogenetici, almeno fino all’evaginazione delle vescicole ottiche, ne’ la divisione del campo presuntivo della retina nei due primordi dell’occhio, disaccoppiando di fatto la morfogenesi dal “patterning” (Winkler et al., 2000). Rx2 si esprime esclusivamente nel tessuto retinico presuntivo e differenziato, durante e dopo la gastrulazione (Loosli et al., 2001; Mathers et al., 1997). Questi dati suggeriscono che Rx2 o un ulteriore omologo di Rx non ancora identificato agisca come l’omologo funzionale di Xrx1 di Xenopus (Zuber et al., 2003).
In topo Rx1 è espresso nella piastra neurale anteriore in una regione che darà origine all’occhio, alla ghiandola pineale e a regioni diencefaliche; nell’occhio la sua espressione si ritrova in strutture di origine neurale (l’epitelio pigmentato e la retina) ed al giorno post-natale 6.5 si restringe ai fotorecettori
ed allo strato nucleare interno; a giorno post-natale 13.5 non è più rilevabile (Mathers et al., 1997).
Il suo ruolo precoce nella formazione degli occhi è chiaramente deducibile dai topi “knock-out”. Topi omozigoti per una mutazione nulla sono anoftalmici (Mathers et al., 1997), non formando nessuna struttura dell’occhio, nemmeno le più precoci come le vescicole e le coppe ottiche. Ciò distingue i mutanti Rx1 dai mutanti omozigoti Sey/Sey in cui le vescicole ottiche si formano, anche se in modo anormale. I mutanti Rx1-/- mostrano a livello di prosencefalo un fenotipo graduale: nei casi meno estremi il prosencefalo è presente, ma non le vescicole ottiche, e la regione dove si sarebbero dovute formare manca anche dell’ espressione di Pax6, Otx2 e Six3 (Zhang et al., 2000); gli animali più colpiti invece mostrano gravi delezioni anteriori, con assenza completa del prosencefalo e di regioni mesencefaliche (Mathers et al., 1997).
E’ interessante ricordare che anche nei mutanti condizionali el di medaka non avviene evaginazione delle vescicole ottiche (Winkler et al., 2000).
Gli omologhi di Rx in Xenopus sono stati denominati Xrx1 e Xrx2 (Xenopus retinal homeobox 1 e 2): i loro “pattern” di espressione sembrano identici (Mathers et al., 1997). Xrx1 comincia ad essere espresso a bassi livelli già a stadio 11, si rafforza a stadio di sviluppo 12.5-13 e continua a livelli abbastanza stabili fino a stadio 45, dopo il quale declina (Casarosa et al., 1997). Alla fine della gastrulazione l’espressione è ristretta alla regione più anteriore della piastra neurale, destinata a dare origine alle vescicole ottiche alla retina neurale, al pavimento del diencefalo, al chiasma ottico e all’epifisi (Eagleson et al., 1995) (Fig. 7).
La sua espressione accompagna tutto lo sviluppo degli occhi man mano che le vescicole ottiche si allontanano dal diencefalo: il messaggero non è comunque uniformemente distribuito, ma presenta una espressione più marcata nella regione ventro-nasale della vescicola ottica. Inoltre viene espresso unicamente nelle regioni ottiche di origine neurale (retina neurale ed epitelio pigmentato), e non in quelle di derivazione ectodermica (cristallino e cornea). I livelli di espressione cominciano a diminuire a stadio embrionale di sviluppo 42 e raggiungono livelli molto bassi a stadio 45, in cui tutti i tipi cellulari della retina hanno finito di differenziarsi.
Figura 7: espressione di Xrx1. Sinistra: espressione nell’ “eye-field” in neurula precoce (stadio 13, visione dorsale). Destra: espressione di Xrx1 nella larva natante (stadio 28, visione dorsale); l’espressione è localizzata alle vescicole ottiche, all’epifisi (testa di freccia verde) e all’ipofisi (testa di freccia rossa). La marcatura diffusa tra gli occhi corrisponde al pavimento del diencefalo.
Durante lo sviluppo neurale, altre strutture prosencefaliche esprimono Xrx1: l’ipofisi, il tetto del diencefalo in corrispondenza dei territori della ghiandola pineale presuntiva, e il pavimento del diencefalo dal recesso prechiasmatico all’ipotalamo posteriore (Casarosa et al., 1997).
L’analisi funzionale mostra che Xrx1 è importante sia nella specificazione che nel controllo della proliferazione e della neurogenesi nella piastra neurale anteriore (Andreazzoli et al., 1999; Andreazzoli et al., 2003).
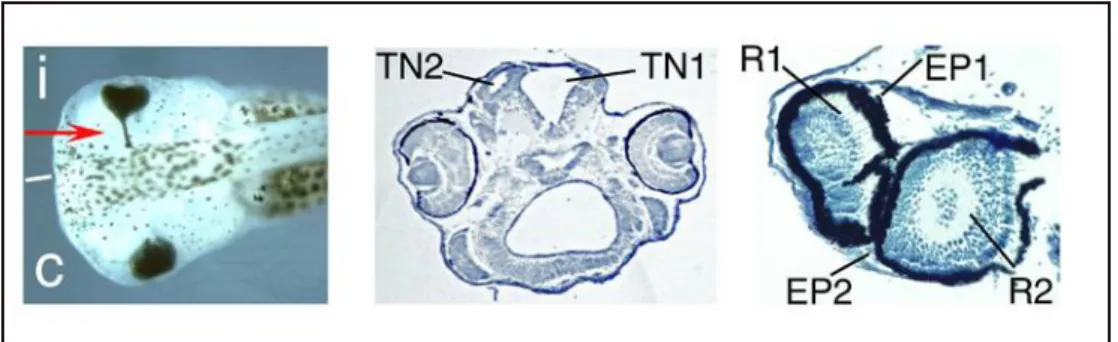
La sovraespressione di Xrx1 infatti produce, nell’embrione allo stadio di larva natante, retina pigmentata ectopica che invade anche il peduncolo ottico, iperproliferazione della retina neurale e sviluppo di tubi neurali secondari ectopici (Andreazzoli et al., 1999; Mathers et al., 1997) (Fig. 8). Allo stadio di neurula precoce inoltre la sovraespressione di Xrx1 è capace di reprimere Xotx2, ma non Pax6 e Six3, nei quali provoca l’attivazione ectopica a stadi di sviluppo neurale più tardivi; tutto ciò suggerisce un ruolo nella specificazione della piastra neurale anteriore e nelle sue proprietà proliferative.
La perdita di funzione, ottenuta mediante microiniezione di un costrutto Xrx1-EnR (in cui la regione codificante di Xrx1, privata del dominio OAR, è fusa “in frame” con il dominio di repressione trascrizionale del gene engrailed di Drosophila) produce con diversa efficienza, in larve natanti, delezioni
Figura 8: sovraespressione di Xrx1. Sinistra: la freccia indica epitelio pigmentato ectopico. Centro, sezione trasversale. TN1: tubo neurale. TN2: tubo neurale secondario ectopico. Destra: sezione trasversale di occhio. R1, EP1, R2, EP2:retina ed epitelio pigmentato di una duplice struttura oculare.
anteriori di entità variabile: queste vanno dalla riduzione delle dimensioni degli occhi alla loro completa assenza accompagnata da gravi delezioni a livello di telencefalo e di diencefalo ventrale (Andreazzoli et al., 1999) (Fig. 9). A stadi più precoci, nella piastra neurale anteriore è possibile osservare una marcata riduzione dell’espressione di marcatori quali Pax6, Xotx2, XBF-1, e Six3: ciò suggerisce che la mancata formazione delle strutture anteriori dipenda dalla compromissione di eventi precoci, quando le regioni anteriori vengono specificate per la prima volta (Andreazzoli et al., 1999). La mancanza di funzione di Xrx1 quindi impedisce la formazione di strutture derivanti dal neuroectoderma in cui esso normalmente si esprime.
Figura 9: inattivazione di funzione di Xrx1 mediante microiniezione di Xrx1-EnR. C: embrione non iniettato di controllo. Inj: embrioni microiniettati. Le delezioni anteriori hanno un’entità variabile da semplice riduzione delle dimensioni delle vescicole ottiche all’ablazione completa delle strutture telencefaliche e diencefaliche.
E’ stato almeno in parte delucidato il meccanismo di azione di Xrx1. L’attività di Xrx1 si esprime contrastando i segnali differenziativi e promuovendo la proliferazione con una modalità regione-specifica. Il suo dominio di espressione, coincidente con la zona proliferativa della piastra neurale anteriore, viene definito in base all’interazione di segnali positivi e negativi. La regione di espressione di Xrx1 è infatti circondata da cellule che esprimono il gene proneurale Xngnr-1, il gene neurogenico XDelta-1 e l’inibitore del ciclo cellulare p27Xic1, di fatto cellule che sono uscite dal ciclo cellulare e stanno differenziando in neuroni (Andreazzoli et al., 2003). Xrx1 viene attivato da segnali come chordin e hedgehog, che inducono un destino anteriore e proliferativo, e represso dall’attività di Xngnr-1 (neurogenin), e dell’acido retinoico (Andreazzoli et al., 2003). Se sovraespresso Xrx1 riesce a contrastare i ruoli differenziativi di neurogenin, dell’acido retinoico e di XDelta-1. Infine l’ azione di Xrx1 non si esplica attraverso l’inibizione laterale, ma mediante l’induzione di repressori trascrizionali antineurogenici come Xhairy2 e Zic2 (Andreazzoli et al., 2003). Concludendo, Xrx1 è necessario allo sviluppo dell’occhio e del cervello anteriore e, visto il suo coinvolgimento nel controllo della proliferazione nella piastra neurale anteriore, ha anche un ruolo di regolatore anteriore della specificazione regionale e della neurogenesi.
Scopo della tesi
Come riportato nella sezione precedente, negli esperimenti di perdita di funzione di Xrx1 è stata utilizzata una proteina di fusione dotata del dominio di repressione EnR. Il costrutto -EnR esplica la sua funzione competendo con la proteina endogena per i siti di legame sui promotori dei geni bersaglio, promuovendone così l’inattivazione funzionale. Anche se molto più efficace dell’RNA antisenso (Andreazzoli et al., 1999), l’azione del costrutto -EnR non si esplica direttamente sul gene endogeno, che resta libero di essere trascritto e tradotto. Inoltre bisogna anche tenere conto di fenomeni di aspecificità del
costrutto, dovuta al legame con promotori solo debolmente riconosciuti dal dominio di legame al DNA.
Scopo di questa tesi è pertanto quello di attuare un diverso approccio all’inattivazione funzionale di Xrx1, mediante l’utilizzo di oligonucleotidi antisenso di nuova generazione, gli oligonucleotidi “morpholino”, che causano selettivamente il blocco della traduzione del gene contro cui sono stati progettati.
Poiché questi sono prodotti su misura per la singola applicazione dalla casa produttrice (Gene Tools LLC.), è stato necessario innanzitutto verificarne la specificità, ossia dimostrare che l’inattivazione traduzionale attraverso cui si esplica l’attività di questi oligonucleotidi è limitata al solo gene Xrx1.
Una volta dimostrato ciò, si è passati ad analizzarne l’efficacia mediante l’osservazione degli effetti su embrioni allo stadio di larva natante e sull’espressione dello stesso Xrx1 e di altri marcatori genici della piastra neurale anteriore; in particolare sono stati analizzati marcatori di destino neurale, geni che controllano la specificazione regionale della piastra neurale anteriore e geni del ciclo cellulare.
Questo lavoro di tesi costituisce la base per un progetto più ampio, volto a ricercare e caratterizzare i bersagli trascrizionali a valle del gene Xrx1. Questo progetto prevede sia uno “screening” di trascrizione differenziale di mRNA effettuato utilizzando i “microchip” a DNA Affymetrix, che la tecnica denominata SSH (“Subtractive Suppression Hybridization”): questa consente di generare una genoteca sottrattiva di cDNA corrispondenti a mRNA trascritti a livelli diversi in due tessuti differenti: nel caso specifico, una piastra neurale anteriore esprimente Xrx1, e quindi tutti i suoi bersagli, e una in cui l’attività di Xrx1 come fattore di trascrizione sia stata abolita dall’oligonucleotide antisenso “morpholino” contro Xrx1.
Oligonucleotidi antisenso “morpholino”
Gli oligonucleotidi antisenso “morpholino" sono stati originariamente sviluppati per applicazioni in medicina, constatata l’inefficienza di altri approcci (Summerton e Weller, 1997), e continuano a essere impiegati in tale direzione. A partire dal 2000 (Heasman et al., 2000) hanno inoltre incontrato un crescente favore nell’ambito della biologia dello sviluppo: il loro uso infatti si sta rivelando estremamente utile negli studi di perdita di funzione in numerosi sistemi modello, tra cui possiamo citare “zebrafish” (Nasevicius e Ekker, 2001), Xenopus laevis (Heasman et al., 2000), Xenopus tropicalis (Nutt et al., 2001).
Gli oligonucleotidi “morpholino” sono stati sviluppati per superare i problemi posti dagli oligonucleotidi antisenso a DNA di prima generazione: questi, legandosi all’mRNA bersaglio ne provocavano la degradazione tramite l’attività dell’RNasi H. Tuttavia la loro inibizione veniva compensata da nuova trascrizione; inoltre essi inducevano tossicità aspecifica dovuta alla degradazione anche di messaggeri parzialmente riconosciuti. In biologia dello sviluppo un simile approccio è efficace solo negli studi di perdita di funzione di geni materni, in cui si può microiniettare l’oligonuleotide in un oocita, coltivarlo e poi fecondarlo quando ormai sia l’oligonucleotide sia il suo bersaglio sono stati degradati.
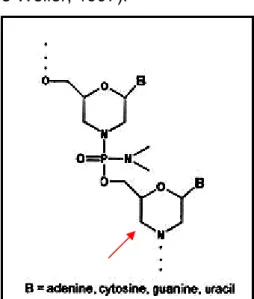
Un oligonucleotide “morpholino” invece è costituito da subunità nucleotidiche in cui l’anello ribosidico è stato sostituito con un anello “morpholino” (morpholino = C4H9NO), legate con un legame fosforodiamidato
anziché fosfodiestere (Fig. 10).
Questi oligonucleotidi esprimono la loro attività bloccando la traduzione degli mRNA contro cui sono stati progettati e hanno manifestato diverse proprietà interessanti: innanzitutto hanno un’elevata solubilità in soluzione acquosa (importante per l’accessibilità al bersaglio); sono biologicamente stabili in quanto resistono all’attività di numerose nucleasi compresa la RNasi H; mostrano un’elevata efficacia anche a concentrazioni nanomolari e un’alta specificità di sequenza, legandosi con forza all’mRNA bersaglio (oligonucleotidi con una sequenza contenente quattro appaiamenti errati non funzionano); non
possiedono altre attività oltre a quella antisenso (Summerton, 1999; Summerton e Weller, 1997).
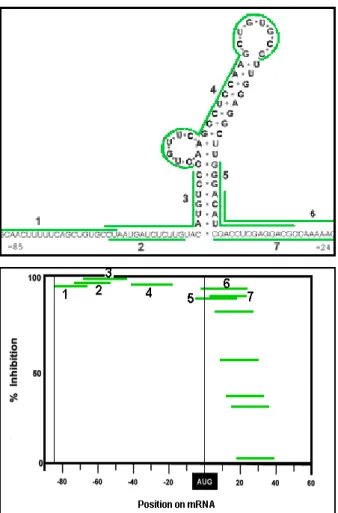
Esperimenti condotti con mRNA di luciferasi fuso “in frame” alla sequenza “leader” del virus dell’epatite B (HBV) hanno dimostrato che un oligonucleotide “morpholino” riesce ad attaccare efficacemente la probabile struttura secondaria dell’mRNA e che la sua efficienza dipende largamente dalla sua posizione rispetto al codone ATG di inizio traduzione (Fig. 11): se l’oligonucleotide è progettato per legarsi a cavallo di questo o
lla regione 5’UTR, l’efficienza di inibizione della traduzione raggiunge anche il 100%. Nel momento in cui ci si allontana dal codone di inizio si ha un drastico calo di questa efficienza che diviene nulla già a distanza di 18 nucleotidi (Summerton, 1999). E’ ipotizzabile che la presenza dell’oligonucleotide legato al 5’UTR o al codone di inizio impedisca il corretto assemblaggio del macchinario traduzionale della cellula; nel caso l’oligonucleotide sia legato più a valle, il ribosoma già formato riuscirebbe invece a spiazzarlo dal suo sito di legame (Heasman, 2002). Gli oligonucleotidi “morpholino” sono in grado di diffondere nell’intero l’embrione nel caso vengano microiniettati (Nasevicius e Ekker, 2001; Nutt et al., 2001), e la loro attività è dose-dipendente e persiste fino a stadi di sviluppo avanzati. Tuttavia la penetranza dei fenotipi indotti dipende dal singolo oligonucleotide utilizzato e la microiniezione di quantità superiori a un certo limite (non predicibile) induce fenomeni di tossicità aspecifica, che si manifestano con un ritardo nello sviluppo embrionale, microcefalia e alterazioni assiali soprattutto posteriori (Heasman, 2002; Nutt et al., 2001).
a
Figura 10: struttura di un oligonucleotide “morpholino”. La freccia indica l’anello “morpholino”, legato al successivo con un legame fosforodiamidato.
Figura 11: dipendenza dell’attività di un oligonucleotide “morpholino” dalla posizione rispetto al codone AUG. Alto: costrutto di mRNA comprendente 85 basi della sequenza leader dell’mRNA di HBV (epaite B virus) fuse ”in frame” con la regione codificante dalla luciferasi. 1-7: siti di legame di 7 dfferenti oligonucleotidi morpholino. Basso: percentuale di inibizione della traduzione del costrutto ottenuta da 1mM di ogni oligonucleotide 1-7. Il livello dell’inibizione è funzione della posizione rispetto al codone di inizio AUG.
La conclusione è che questi oligonucleotidi antisenso di nuova generazione forniscono un utile strumento negli studi di perdita di funzione genica, ma il loro uso deve essere sottoposto a un’attenta analisi dei fenotipi e bilanciato da una serie accurata di controlli e confronti con altri esperimenti di perdita e guadagno di funzione genica.
Xenopus laevis come sistema modello
Diversi motivi generali hanno indotto a scegliere Xenopus laevis, un anfibio anuro di origine sudafricana, come modello di studio in laboratorio; innanzitutto il suo sviluppo è un buon paradigma di come prenda forma il corpo di un vertebrato: dato che le modalità di sviluppo di tutti i Vertebrati sono simili, i meccanismi di base dell’embriogenesi in Xenopus laevis possono essere estesi anche alle altre classi, con le dovute eccezioni.
Inoltre in qualsiasi periodo dell’anno la femmina può essere artificialmente indotta a deporre uova mediante stimolazione ormonale: di solito vengono rilasciate tra le 1000 e le 1500 uova, che possono essere fecondate esternamente con facilità.
La grandezza delle uova - circa 1 mm di diametro - permette di manipolarle semplicemente con l’uso di uno stereoscopio e consente un’ampia gamma di esperimenti: ad esempio attraverso la microiniezione di DNA plasmidico o mRNA sintetizzato in vitro è possibile studiare l’effetto della sovraespressione di un gene; allo stesso modo è possibile microiniettare mRNA in oociti maturi per sfruttarli letteralmente come fabbriche di proteine.
Lo studio della perdita di funzione mediante “knock-out” genico, possibile in altri sistemi modello (ad esempio il topo) ormai a livello di routine, in Xenopus laevis è impossibile: a parte il fatto che è un organismo tetraploide (e quindi dotato di 4 copie geniche da sopprimere), la difficoltà sorge dal fatto che la ricombinazione omologa non avviene con la stessa efficienza che in topo; inoltre, dato che la maturità sessuale viene raggiunta dopo tre anni di vita, risulta anche scarsamente praticabile stabilire linee transgeniche.
Ad ogni modo, in Xenopus sono disponibili metodi per l’inattivazione funzionale (“knock-down”), come la microiniezione di mRNA o di oligonucleotidi antisenso, oppure di costrutti dotati di potenti repressori trascrizionali (ad esempio il dominio di repressione del gene engrailed di Drosophila).
Altra caratteristica utile è la rapidità con cui si sviluppano gli embrioni: una volta fecondato, l’uovo di Xenopus laevis si divide in due blastomeri in circa 90 minuti e le divisioni successive avvengono in maniera sincrona ogni 20 minuti, fino allo stadio di blastula (Fig. 12): di solito perché un embrione arrivi allo
stadio di larva natante e quindi abbia completato l’organogenesi sono sufficienti 2 giorni.
Figura 12: ciclo vitale di Xenopus laevis. Dopo la fecondazione inizia la segmentazione, seguita dalla gatrulazione. Dopo la neurulazione inizia l’organogenesi che è praticamente completa allo stadio di larva natante. L’embrione è pronto per la metamorfosi.