Capitolo 1
Introduzione generale
1.1 Miscele polimeriche
Uno dei principali obiettivi della ricerca scientifica è lo sviluppo di processi economici e di tecnologie a basso impatto ambientale, al fine di produrre materiali innovativi, di alta qualità e in grado di fornire prestazioni ottimali nei settori d’impiego. Negli ultimi decenni, gli sforzi indirizzati alla sintesi di nuovi polimeri sono stati contenuti, mentre hanno trovato un impiego sempre maggiore i materiali polimerici, risultato delle modifiche apportate ad alcuni dei prodotti esistenti. La messa a punto di opportune tecniche di modificazione dei polimeri, quali la funzionalizzazione, il miscelamento o l’additivazione, ha aperto nuove importanti possibilità applicative per alcuni materiali, affermati da tempo sul mercato. Le miscele polimeriche, in particolare, si ottengono dal mescolamento di due o più omopolimeri o copolimeri, mediante coprecipitazione da un solvente comune o coestrusione allo stato fuso. Le miscele polimeriche, combinando le proprietà di più polimeri in uno solo e potendo ovviare alle mancanze dell’uno attraverso i meriti dell’altro, permettono di programmare le caratteristiche finali del materiale. Uno dei principali vantaggi delle miscele polimeriche, che rende ragione del loro recente successo, è la possibilità che esse offrono di impiegare polimeri riciclati, per recuperarli all’uso originale o per promuoverli ad applicazioni di maggiore valore. Negli ultimi decenni, l’utilizzo delle materie plastiche nel settore degli imballaggi è giunto ad un livello tale da rendere urgente la soluzione dello smaltimento dei rifiuti in plastica. L’uso di polimeri riciclati, oltre ad essere un mezzo economico di approvvigionamento di materia prima per le miscele polimeriche, riduce la quantità dei residui plastici e, per tale motivo, rientra nella classe delle strategie adottate dall’industria per la salvaguardia dell’ambiente. L’interesse principale nei confronti delle miscele polimeriche consiste nella facilità della loro produzione e nella possibilità di ottenere materiali polimerici con caratteristiche anche molto diverse da quelle dei componenti, senza ricorrere a procedimenti di sintesi più costosi. Variando i componenti della miscela e/o la sua composizione è possibile produrre un’infinità di nuovi materiali con un rapporto prestazione/prezzo ottimizzato caso per caso. Il continuo aumento di interesse nei confronti delle miscele polimeriche è supportato dal progressivo miglioramento sia della conoscenza dei principi che stanno alla base delle interazioni tra polimeri diversi, sia delle tecnologie di miscelamento e di lavorazione delle miscele.
1.2 Materiali polimerici eco-compatibili
1.2.1 Il problema dell’impatto ambientale dei materiali polimerici
Negli ultimi anni, la protezione dell’ambiente è divenuta un obiettivo comune, e ciò ha dato impulso allo sviluppo di materiali polimerici a basso impatto ambientale. Nei paesi ad economia avanzata circa un quarto dei rifiuti solidi è costituito da materiali polimerici. Tre diverse strategie sono percorribili per ridurre il volume dei rifiuti in plastica: l’incenerimento, il riciclo e la biodegradazione.
La combustione della maggiore parte dei polimeri non causa grossi problemi di inquinamento da fumi, e presenta il vantaggio di fornire notevoli quantitativi di energia. In alcuni casi, però, quantità non trascurabili di metalli pesanti possono depositarsi nelle ceneri, dando luogo a emissioni tossiche. Un altro problema dell’incenerimento è legato alla presenza, tra i polimeri di rifiuto, di materiali clorurati (ad esempio PVC), che, per combustione, possono dare luogo alla formazione di diossine cancerogene, cosa che può essere evitata solo se la combustione viene condotta ad elevatissime temperature. Per quanto riguarda il riciclo, nel 1991 si riciclavano negli USA circa 0.5 milioni di tonnellate di polimeri (principalmente HDPE e PET), mentre in Europa la quantità ammontava a 1.5 milioni di tonnellate (principalmente poliolefine). I sistemi principali adottati per il riciclo sono: la rilavorazione e la depolimerizzazione. La rilavorazione comprende il riciclo primario, cioè lo sminuzzamento o la macinazione dei materiali, ed il riciclo secondario, cioè la trasformazione in un prodotto secondario. Un esempio di riciclo è rappresentato dal PET utilizzato per i contenitori di bevande, che può essere recuperato per ottenere pannelli isolanti. Il PET di riciclo è lavato, sminuzzato in particelle di circa 5 mm, seccato per evitare l’idrolisi, addizionato con un agente nucleante ed un additivo per aumentare la viscosità del fuso e lavorato in estrusore per lastre espanse, nel quale viene iniettato Freon 12, immediatamente prima dell’ugello. L’altra alternativa per il riciclo è costituita dal cosiddetto riciclo terziario, che consiste in un trattamento chimico o termico delle plastiche di riciclo, per ottenere monomeri che possono essere reimpiegati per produrre resine vergini. Questa strategia è adatta per i polimeri di condensazione, come poliesteri, poliammidi, poliuretani, etc. Attualmente, solo il 4% di tutti i materiali polimerici viene riciclato, mentre le percentuali relative al vetro, alla carta, all’acciaio, e all’alluminio sono, rispettivamente, del 20, 30, 15 e 40 %. Questa situazione è dovuta principalmente ai maggiori costi delle operazioni di raccolta, di cernita e di rilavorazione delle materie plastiche. La produzione di materiali polimerici a limitato impatto ambientale a fine vita, cioè biodegradabili, rappresenta un’altra interessante alternativa alla soluzione dello smaltimento dei rifiuti in plastica. Ad essa è dedicato il paragrafo 1.2.2, dal momento che la sua comprensione è fondamentale per il lavoro di ricerca svolto.
1.2.2 Materiali polimerici biodegradabili
L’ecocompatibilità è una caratteristica propria di un materiale dalla formulazione economica, che, a fine utilizzo, è soggetto ad un processo di degradazione nell’ambiente (biodegradazione) a prodotti non tossici. Le definizioni di biodegradabilità per i polimeri sono quelle proposte dall’ASTM, e sono riportate di seguito [ASTM, 1993]:
- degradable plastic: si tratta di una plastica progettata in modo tale da modificare significativamente la sua struttura chimica in condizioni ambientali specifiche, con il risultato della perdita di alcune proprietà, che possono variare come rilevato dai test di misurazione appropriati al tipo di plastica e all’applicazione, nel periodo di tempo che determina la sua classificazione.
- biodegradabile plastic: si tratta di una plastica degradabile, nella quale la degradazione risulta dall’azione di microrganismi naturali, come batteri, funghi ed alghe.
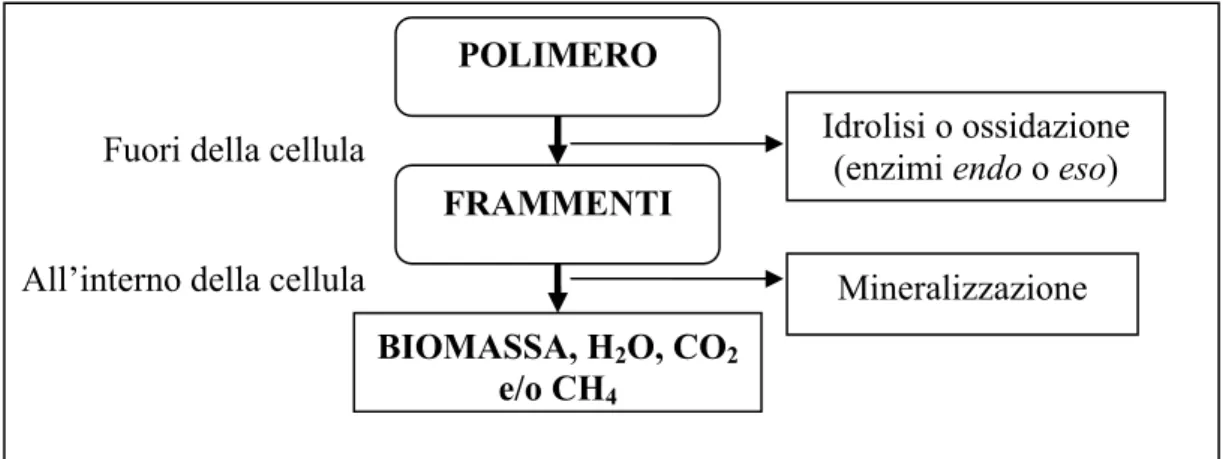
Dalla prima definizione emerge che la variazione di struttura chimica deve provocare un peggioramento delle proprietà (quantificabile con un metodo standardizzato), che a sua volta deve avvenire entro limiti di tempo prefissati. Tuttavia, la formulazione rimane vaga nel definire quali specifiche proprietà devono cambiare in modo significativo, come conseguenza della variazione della struttura chimica. La seconda definizione, invece, stabilisce in modo chiaro che si ha biodegradazione quando l’effetto degradativo è provocato dall’intervento attivo di microrganismi presenti nell’ambiente. Quando i microrganismi provocano la biodegradazione di macromolecole per utilizzarne i frammenti come fonte di carbonio, i prodotti ultimi della biodegradazione sono essenzialmente biomassa, acqua, anidride carbonica e, nel caso di microrganismi anaerobici, metano. E’ noto che, a livello biologico, le macromolecole naturali sono degradate mediante reazioni di idrolisi ed ossidazione catalizzate da enzimi. Uno dei requisiti fondamentali perché un polimero possa subire processi di biodegradazione è che in catena principale siano presenti legami chimici idrolizzabili o ossidabili. Il processo di biodegradazione può essere schematizzato come mostrato in Figura 1-1.
Figura 1-1. Schema del processo di biodegradazione
La prima fase della biodegradazione avviene esternamente alla cellula, per via dell’alto peso molecolare e dell’insolubilità caratteristica della maggiore parte dei polimeri in mezzi acquosi. Gli enzimi che catalizzano il primo stadio (idrolisi o ossidazione) sono enzimi extracellulari, che possono operare mediante un meccanismo endo (attacco a legami “interni” della catena principale) o eso (attacco ad un terminale della catena e distacco sequenziale delle unità terminali). La seconda fase del processo di biodegradazione (mineralizzazione) prevede il trasporto all’interno della cellula dei frammenti di macromolecola ottenuti nella prima fase, che vengono metabolizzati dal microrganismo. Oltre alla presenza di legami labili nella catena principale del polimero, ci sono altri requisiti perché la catalisi enzimatica possa avvenire: il polimero, infatti, deve potere assumere una conformazione tale da garantire l’incastro secondo una geometria ben definita del tratto di catena contenente il legame labile entro il sito attivo dell’enzima. Ciò richiede una certa libertà conformazionale della macromolecola ed è per questo motivo che, a parità degli altri parametri, i poliesteri alifatici, ad esempio, biodegradano con facilità, mentre quelli aromatici (molto più rigidi) non mostrano velocità di biodegradazione apprezzabile. Altri parametri importanti sono il grado e il tipo di ramificazioni, la cui presenza può richiedere l’intervento di enzimi aggiuntivi specifici rispetto alla struttura chimica della catena laterale o al legame di innesto di questa ultima sulla catena principale. Anche il grado di idrofobia della macromolecola è un fattore significativo, che può condizionare l’azione enzimatica con notevoli ripercussioni sulla velocità del processo di biodegradazione. Infine, occorre considerare la stereochimica delle unità monometriche, dal momento che molti enzimi sono stereoselettivi, il peso molecolare medio e la distribuzione di peso molecolare del polimero. Oltre alla struttura chimica, un altro parametro che gioca un ruolo fondamentale nel processo di biodegradazione è la morfologia del materiale polimerico puro, vale a dire il grado di cristallinità, la dimensione e la distribuzione dei domini cristallini. Per le miscele polimeriche, inoltre, il numero, la concentrazione e il grado di distribuzione delle fasi influenza molto l’efficacia dell’attacco enzimatico. Per esempio, nel caso di biodegradazione tramite idrolisi enzimatica, la presenza di domini cristallini ostacola il processo di biodegradazione. Il fenomeno è imputato ai requisiti geometrici dell’interazione enzima-substrato, che implicano un adattamento tramite riarrangiamenti conformazionali del segmento di catena polimerica, contenente il legame da idrolizzare, alla geometria del sito attivo dell’enzima. Tali riarrangiamenti avvengono con maggiore difficoltà in segmenti di macromolecola appartenenti alla fase cristallina e ciò comporta un rallentamento della velocità di idrolisi enzimatica al crescere del grado di cristallinità. E’ fondamentale ricordare che, poiché gli enzimi sono macromolecole (di peso molecolare pari a 5-7×105), le reazioni di biodegradazione catalizzate da enzimi su substrati polimerici solidi sono processi che interessano solo la superficie del substrato: la biomolecola infatti è impossibilitata ad accedere all’interno del substrato polimerico. La velocità di biodegradazione di un campione di massa unitaria dipende dalla sua superficie e cresce al crescere dell’area del campione.
POLIMERO
FRAMMENTI
BIOMASSA, H
2O, CO
2e/o CH
4Fuori della cellula
All’interno della cellula
Mineralizzazione
Idrolisi o ossidazione
(enzimi endo o eso)
1.2.2.1 Principali sistemi biodegradabili
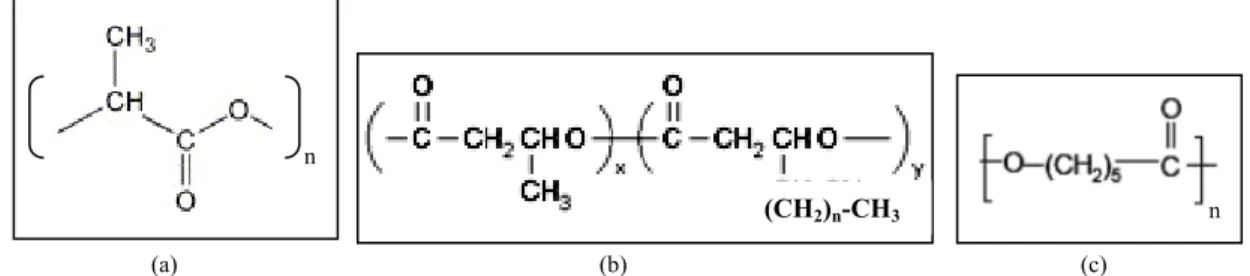
Il termine biopolimero indica un materiale polimerico derivato da risorse rinnovabili, che può essere processato in modo da ottenere prodotti dalle desiderate proprietà strutturali e funzionali per l’applicazione finale. Albertsson e Karlsson hanno osservato che la natura può essere un ottimo modello per la progettazione di materiali biodegradabili [Albertsson et al., 1996]. I biopolimeri presenti in natura (polimeri naturali) sono suscettibili all’azione degradativa di vari fattori ambientali e di loro combinazioni. Esempi di biopolimeri naturali includono i polisaccaridi, come la cellulosa, l’amido, il destrano, il gellano e il chitosano, le proteine, come la gelatina e la seta, oli e grassi, lignina, poliisoprenoidi, etc. I polimeri naturali sono sintetizzati in natura da organismi viventi o da piante, attraverso sofisticati percorsi biologici, e possono infine subire un processo di biodegradazione. Alcuni polimeri naturali, come gomma e lignina, hanno una bassa velocità di biodegradazione e vengono mineralizzati molto gradualmente. Un'altra categoria di biopolimeri è rappresentata dai polimeri artificiali, di cui sono un esempio gli esteri e gli eteri della cellulosa, ottenuti dalla modificazione chimica di polimeri naturali, e l’acido polilattico (PLA) (Figura 1-2 a), prodotto dall’acido lattico derivato dall’amido. Alcuni polimeri sintetici appartengono alla classe dei materiali biodegradabili. I poli(β-idrossialcanoati), la cui struttura chimica generale è riportata in Figura 1-2 b, sono un gruppo commercialmente importante di polimeri biodegradabili. Essi sono sintetizzati da particolari batteri, che li usano come riserva energetica. Si tratta di polimeri altamente biodegradabili, adoperati sia come biomateriali, sia come materiali per imballaggi ecocompatibili. Altri poliesteri biodegradabili sono l’acido poliglicolico (PGA), il poli(butilensuccinato) (PBS), il poli(idrossibutilenesuccinato-co-adipato) e i copolimeri acido poli(lattico-co-glicolico) (PLGA). Ci sono poi polimeri sintetici che possono subire biodegradazione, con l’aiuto di additivi che favoriscono la degradazione chimica, come il policaprolattone (PCL) (Figura 1-2 c) e il polivinilalcol (PVA).
Figura 1-2. Formule chimiche di alcuni polimeri biodegradabili: a) PLA; b) poli-idrossialcanoati; c) PCL.
L’ottenimento di prodotti polimerici sintetici con specifiche proprietà in relazione all’applicazione finale e capaci di biodegradare a fine vita, si avvale di varie strategie possibili. Una soluzione costosa consiste nell’inserimento di segmenti biodegradabili o fotoossidabili all’interno della catena principale dei polimeri sintetici. La seconda strategia consiste nell’uso di polimeri sintetici biodegradabili. Un’altra soluzione consiste nello sviluppo di nuove strutture idrolizzabili (ad es. poliesteri, polianidridi, policarbonati). La soluzione più semplice ed economica consiste invece nella miscelazione dei polimeri sintetici con componenti biodegradabili. Un possibile sistema per migliorare la ecocompatibilità dei polimeri sintetici, in particolare, è quello di miscelarli o di aggraffarli con prodotti di origine naturale biodegradabili. L’amido, ad esempio, può essere miscelato con il polietilene (PE) per la produzione di film per sacchetti, in modo che, nelle discariche, dopo la fase di biodegradazione dell’amido, il film di PE risulti sminuzzato in minuscoli frammenti. Tuttavia, i film, addizionati di una piccola percentuale di amido (5% circa) hanno minori proprietà meccaniche, che possono essere compensate solo aumentando lo spessore dei film. Tipiche miscele tra polimeri sintetici e naturali a basso impatto ambientale sono quelle che utilizzano i prodotti naturali di scarto dell’industria agro-alimentare, i materiali biodegradabili di scarto di vari processi industriali, e i sottoprodotti biodegradabili dell’industria. Esempi di utilizzo di polimeri naturali di scarto per ottenere prodotti economici, ad alto valore aggiunto ed ecocompatibili sono la paglia di grano, la segatura, o il
(CH2)n-CH3
(b) (c)
n n
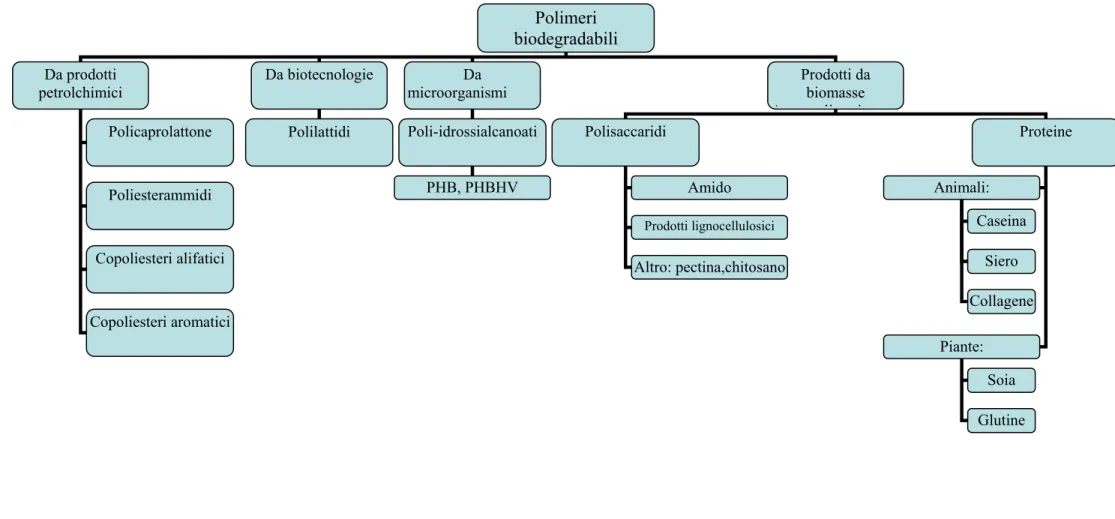
“bagasso”, cioè il residuo solido cellulosico derivato dall’estrazione del sugo dalla canna da zucchero. Il chitosano rappresenta invece un tipico esempio di polimero naturale a basso costo, adatto per formulazioni di miscele polimeriche, ottenuto dal trattamento chimico di un prodotto di scarto dell’industria dei crostacei, la chitina. La gelatina può essere ottenuta come sottoprodotto dell’industria farmaceutica, agricola e delle concerie: essa è quindi un materiale naturale biodegradabile ed economico, che può essere utilizzato per formulazioni a basso costo di materiali degradabili nell’ambiente. Le tecnologie che utilizzano sottoprodotti o prodotti di scarto dell’industria sono particolarmente vantaggiose nelle zone dove questi materiali sono prodotti (applicazioni in situ). L’organigramma riportato in Figura 1-3 riassume i principali tipi di materiali biodegradabili. L’organigramma suddivide i prodotti biodegradabili in quattro famiglie, che, fatta eccezione per il gruppo di origine fossile, sono ottenute da fonti rinnovabili (biomassa). La prima famiglia comprende poliesteri totalmente sintetizzati da prodotti petrolchimici (policaprolattone, cfr Capitolo 4, Capitolo 5, Capitolo 6; poliesterammidi; copoliesteri alifatici o aromatici). La seconda e terza famiglia a partire da sinistra è costituita da poliesteri ottenuti, rispettivamente, tramite sintesi, a partire da monomeri ottenuti da biomassa (polilattidi), oppure tramite fermentazione della biomassa o per estrazione da piante geneticamente modificate (poliidrossialcanoati; cfr Capitolo 6). L’ultima famiglia comprende gli agro-polimeri (ad es i polisaccaridi, cfrCapitolo 3, Capitolo 4, Capitolo 5) che sono ottenuti dalla biomassa per frazionamento.
Occorre, infine ricordare che nonostante la biodegradazione sia una interessante soluzione ai problemi associati alla presenza di grossi volumi di rifiuti di materie plastiche, tuttavia esistono dubbi circa la possibilità che una reale biodegradazione avvenga all’interno delle moderne discariche: esse sono progettate in modo da impedire la dispersione nell’ambiente di materiali pericolosi e sono rese, quindi, impermeabili all’umidità e all’aria. Queste condizioni anaerobiche sono ritenute poco favorevoli, in vista dei processi di biodegradazione dei polimeri. Un altro problema è legato alla conflittualità tra la strategia di riciclo e quella di biodegradazione dei polimeri, dal momento che i polimeri biodegradabili non sono adatti al mescolamento con altri materiali, come è invece richiesto nelle operazioni di riciclo. Attualmente, i principali svantaggi nell’utilizzo di formulazioni ecocompatibili sono dovute ad una insoddisfacente politica di smaltimento dei rifiuti, alla mancanza di infrastrutture, all’assenza di una regolamentazione internazionale, alla mancanza di incentivi e ai prezzi ancora relativamente elevati dei prodotti ottenuti, legati agli alti costi della ricerca e alla produzione e ai consumi di scala limitati.
Polimeri
biodegradabili
Da prodotti petrolchimici Da microorganismi Prodotti da biomasse A li i Polisaccaridi Proteine Da biotecnologie Animali: Piante: Caseina Siero Soia Glutine Poli-idrossialcanoati PHB, PHBHV Policaprolattone Poliesterammidi Copoliesteri alifatici Copoliesteri aromatici Amido Prodotti lignocellulosici Altro: pectina,chitosano Polilattidi Collagene1.3 Materiali polimerici biocompatibili
La biocompatibilità è la proprietà di un materiale che riesce ad integrarsi perfettamente all’interno di un sistema biologico, senza scatenare una reazione immunitaria da parte dell’organismo o rilasciare sostanze tossiche a contatto con i fluidi corporei e, in particolare, nella fase di degradazione, qualora sia presente. Il termine si riferisce esclusivamente a quei materiali per i quali è prevista un’applicazione biomedica, di cui sono un esempio i dispositivi per il rilascio di farmaci e le apposite strutture per la crescita cellulare e la rigenerazione dei tessuti (Tissue Engineering). Per chiarire quali sono le caratteristiche principali che sono richieste ai materiali e ai dispositivi adoperati nel campo biomedico, occorre soffermarsi sui principi dell’Ingegneria Tissutale.
1.3.1. Ingegneria Tissutale
Fino ad una decina di anni fa, si riteneva che i tessuti umani potessero essere rimpiazzati solo con trapianti diretti di donatori, o con parti completamente artificiali in materiale metallico, plastico e dotate di circuiti elettronici. Per far fronte alla scarsità di organi umani da trapiantare, la medicina era anche orientata all’utilizzo di organi animali. L’idea di utilizzare organi ibridi, combinazione di cellule viventi e di polimeri artificiali o naturali, che facessero loro da supporto, non era ancora emersa in modo concreto, nonostante la ricerca si fosse mossa in tale direzione, già dagli inizi degli anni Settanta. Poi, all’inizio degli anni Novanta, grazie al lavoro molto creativo di una serie di ricercatori, provenienti dal mondo della Medicina e della Ingegneria, si cominciò a prendere coscienza del fatto che la costruzione di «bioibridi» era realmente possibile. Nacque così l’ingegneria dei tessuti (TE), o
Tissue Engineering, che divenne rapidamente un importantissimo filone di ricerca, oggetto di rilevanti
investimenti. La Figura 1-4 evidenzia il recente interesse rivolto dalla ricerca al settore dell’ingegneria dei tessuti, in termini di pubblicazioni scientifiche dedicate a tale settore. Normalmente, si considerano come appartenenti all’ingegneria dei tessuti tutti quei processi che: combinano cellule viventi e biomateriali; utilizzano cellule viventi per terapia o diagnostica; generano tessuti o organi in vitro per poi impiantarli in vivo; forniscono materiali e tecnologie per rendere possibili questi processi (tra questi sono inclusi la clonazione terapeutica, la medicina rigenerativa e l’organogenesi basata sulle cellule staminali).
Sono definiti «biomateriali» i materiali che vengono utilizzati per dare un sostegno fisico alle cellule e per guidarle nella loro crescita tridimensionale; essi debbono fornire alle cellule tutti i segnali necessari per la differenziazione e, allo stesso tempo, debbono lentamente degradarsi in composti fisiologici, man mano che il nuovo tessuto si forma e si integra nei tessuti del paziente. Vi sono tre modi diversi di rifornirsi di cellule: dal paziente (cellule autologhe), da un donatore diverso dal paziente (cellule allogeniche), da specie diverse (cellule xenogeniche). Un tipo specifico di cellule, quelle staminali (definite anche progenitrici, perché in grado di generare molti tipi di cellule, in quanto non ancora differenziate), possono derivare dal paziente o da un altro donatore (cellule staminali adulte) o da embrioni.
Figura 1-4. Numero di pubblicazioni sull’ingegneria dei tessuti dal 1991 al 2002 negli USA, UE, Giappone e Svizzera [Ovi et al., 2004].
La caratteristica che ha reso l’ingegneria dei tessuti diversa da molti altri settori high tech, è stata che il suo sviluppo iniziale non ha tratto beneficio tanto dalla ricerca accademica, quanto soprattutto da quella industriale, finanziata dal venture capital. Una idea di questo fenomeno è derivata da pochi dati significativi: all’inizio del 2001 la ricerca e lo sviluppo nella tissue engineering erano arrivate a impegnare 3.300 ricercatori in più in 70 nuove società, 16 delle quali in Europa e in Australia, con una spesa complessiva di 600 milioni di dollari nel 2000 e una crescita annua del 16% a partire dall’inizio degli anni Novanta. Il 60 % delle nuove società si occupava, prevalentemente, dello sviluppo di applicazioni strutturali (pelle, cartilagine, ossa, protesi cardiache, etc.); il secondo segmento per importanza era quello della terapia cellulare, diretto su due linee distinte: l’utilizzo di cellule staminali per clonazione terapeutica e organogenesi in vitro, e i processi cellulari extracorporei. Nel 2002, come in tutto il mondo high tech, è scoppiata la crisi; la borsa è crollata, la raccolta di capitale di rischio è diventata praticamente impossibile e le spese di ricerca hanno dovuto subire pesanti tagli o rinvii. I fallimenti, alla fine del 2002, di Advanced Tissue Sciences e di Organogenesis, società leader nello sviluppo di pelle, prodotta con le tecniche dell’ingegneria dei tessuti, è stato il segnale più visibile del momento di crisi. In questa fase, si è reso evidente che il tempo necessario per arrivare a nuovi prodotti era stato precedentemente sottostimato, così come i costi relativi al loro sviluppo. Ciò aveva rapidamente creato una spaccatura tra le attese espresse dai business plans e la concreta realizzazione dei progetti su cui i venture capitalists avevano puntato. Molti si resero conto che erano necessari un maggior sforzo di ricerca di base e un contributo accademico più profondo. Questo mancanza fu sopperita in modo straordinariamente rapido, con l’entrata in campo delle più grandi università, attraverso varie linee di ricerca. Il maggior bisogno di nuova conoscenza ha interessato soprattutto la biologia cellulare. Il settore del tissue engineering, infatti, aveva sviluppato in poco tempo una base solida di conoscenze nei biomateriali, ma non abbastanza nelle bioscienze delle cellule.
Il cambiamento del tipo di approccio alla ricerca ha trovato una spinta particolare da due fatti nuovi; il primo è stato la mappatura del genoma umano, che, sicuramente, ha permesso una conoscenza molto più completa delle cellule e del loro comportamento. Il secondo è stato la comprensione più profonda del fenotipo delle cellule, ovvero del modo in cui avviene la loro differenziazione verso quelle di un organo specifico. In passato, si era pensato che una cellula che avesse cominciato a differenziarsi non potesse più modificare il proprio percorso. Recentemente, si è capito come effettuare il trasferimento del nucleo, ed è diventata possibile la riprogrammazione del DNA cosa che permette alla cellula di esprimere più cammini diversi di potenziale differenziazione.
Gli sviluppi nella biologia cellulare rappresentano un’importante fonte di ricerca di base per l’ingegneria dei tessuti e, analogamente, la ricerca nell’ingegneria dei tessuti è un valido ausilio per la biologia cellulare. Da questo incremento della ricerca di base ci si aspetta lo sviluppo di conoscenze assai più solide rispetto al passato e di applicazioni utilizzabili commercialmente. La speranza è che questo approccio aumenti il numero e l’entità degli investimenti in tecnologie biomedicali. I primi segni di ottimismo sono percepibili, tuttavia occorrerebbe puntare su tipi di sviluppo che portassero la ricerca accademica, non commerciale, più vicino ai prodotti utilizzabili nella pratica medica, al fine di dare all’investitore privato un orizzonte di pianificazione più limitato e meno incerto di quelli del passato. Sul fronte della ricerca, quello della ingegneria dei tessuti è un campo dove non esiste un distanza significativa tra Europa e Stati Uniti. Il grafico nella Figura 1-4 che riporta il numero delle pubblicazioni scientifiche originate in UE, USA, Giappone e Svizzera lo mostra chiaramente. Tra gli istituti universitari e di ricerca con il maggior numero di autori, la leadership spetta agli USA, con la Harvard, MIT, Michigan University e la Pittsburg University ai primi posti. In Europa 12 istituzioni di tre stati membri sono presenti tra le prime 50 istituzioni nel settore della ricerca nell’ingegneria dei tessuti: Regno Unito (University College London), Germania (Humboldt University, Università di Monaco, Heidelberg, Friburgo, Amburgo, Rosenburg, Hannover Medical School, TH Aachen), Olanda (Università di Nijimnegen, Erasmus University).
Un secondo confronto interessante è mostrato nella Figura 1-5, nella quale viene riportata l’analisi del numero di collaborazioni tra pubblico e privato, e quindi, sostanzialmente, tra università e aziende. Per gli Stati Uniti, la percentuale di lavori fatti in cooperazione supera, a partire dal 2000, il 30% mentre, in Europa, non arriva al 15% e in Giappone è attorno al 5%. Le ragioni alle spalle di questo dato non sono chiare e forse vanno ricercate nella mancanza, in Europa e Giappone, di una organizzazione forte della comunità dell’ingegneria dei tessuti. Comunque, i lavori in cooperazione stanno crescendo in modo rilevante sia in Europa sia negli Stati Uniti e questo dovrebbe significare che la
multidisciplinarità, che è necessaria al progredire nell’ingegneria dei tessuti, richiede una crescente collaborazione nella ricerca tra istituzioni diverse.
Figura 1-5. Percentuale di lavori in cooperazione tra pubblico e privato dal 1991 al 2002 [Ovi et al., 2004].
La frontiera più avanzata della integrazione tra ricerca accademica e sviluppo industriale spetta a due grandi scienziati, entrambi attivi a Boston: Robert Langer (MIT) e Joseph Vacanti (Massachussetts General Hospital). Infine, merita un cenno uno degli aspetti che potranno essere più critici per lo sviluppo dell’ingegneria dei tessuti: la regolamentazione del settore, che presenta non solo aspetti rilevanti dal punto di vista della protezione del consumatore, ma anche dal punto di vista dell’etica e del rapporto con diverse posizioni religiose nel mondo. In Europa, al momento, non vi sono regole specifiche per i prodotti derivati dall’ingegneria dei tessuti, ma il dibattito, soprattutto sull’uso delle cellule staminali embrionali, è molto acceso. Nel 2002 la Commissione Europea ha pubblicato una proposta di direttiva, per definire standard di qualità e di sicurezza per la donazione, l’acquisto, la sperimentazione, la produzione e la distribuzione di cellule umane e di tessuti da utilizzare nell’uomo. Anche l’uso delle cellule staminali embrionali, qualora venga autorizzato, dovrà essere regolamentato. Negli Stati Uniti, la Food and Drug Administration ha iniziato già nel 1997 un Tissue Action Plan, per inquadrare in un contesto omnicomprensivo la regolamentazione esistente. Nel 2001 ha pubblicato
Human Cells, Tissues and Cellular Based Products; Establishment, Registration and Listing, che
richiede a tutti i produttori di essere registrati e di depositare una lista dei propri prodotti. Vengono fissate regole per lo screening di fattori di rischio legati a malattie contagiose, sulle cellule e sui loro donatori; vengono poi definiti standard per i metodi utilizzati, le attrezzature e i controlli di qualità. Nel suo complesso, la regolamentazione americana non solo è più organica di quella europea, ancora in via di definizione, ma ha anche il vantaggio, essendo una sola in tutto il paese, di offrire un mercato omogeneo assai più ampio. La commercializzazione di prodotti derivati dalle tecnologie della TE è iniziata solo recentemente. Le applicazioni iniziali si sono focalizzate sulla pelle per la cura delle ustioni o delle ulcerazioni da diabete, sulla rigenerazione di midollo osseo e di cartilagini in vitro, sull’innesto per applicazioni durali in neurologia. Si è oggi aperto, tuttavia, un grande spazio di applicazione della TE al trattamento di malattie cardiovascolari, urologiche, neurologiche, ortopediche e muscolari. In un futuro non troppo lontano, inoltre, si può prevedere un utilizzo importante della TE nella rigenerazione di organi (reni, fegato, pancreas, intestino), fornendo metodi di cura completamente nuovi ed efficaci a patologie molto gravi e diffuse. Una delle sfide più complesse di queste terapie è evitare i problemi del rigetto e su questo fronte un vantaggio molto importante della TE è la possibilità di fare a meno di farmaci immunodepressivi, grazie all’ utilizzo, come cellule di partenza, di quelle del paziente stesso. Vengono riportate di seguito nella Tabella 1-1 le prospettive di mercato a dieci anni dei prodotti ottenuti da TE, nelle sei categorie principali: cardiovascolare, ortopedico, neurologico, urologico, rigenerazione di organi e pelle. I dati sono ricavati dalle proiezioni di Meditech Insight 2004, e mostrano che la TE, oltre ad essere uno dei filoni di ricerca tra i più interessanti dal punto di vista della scienza e della tecnologia, è anche alla base di uno straordinario sviluppo industriale, non inferiore a quello della microelettronica o del software.
Tabella 1-1. Mercato potenziale annuo globale nel 2014 dei prodotti da TE [Ovi et al., 2005] Settore Potenzialità (milioni di dollari) Cardiovascolare 31,200 Ortopedia 64,200 Neurologia 23,400 Urologia 620 Rigenerazione di organi 32,800 Pelle 32,900 Totale 185,120
1.3.1.1 Principi per la rigenerazione dei tessuti
Come evidenziato nel paragrafo precedente la TE è una disciplina che, attraverso i principi della chimica, della biochimica, della medicina, dell'ingegneria, della fisica e della matematica, si propone di costruire in vitro tessuti biologici destinati alla sostituzione di parti del corpo umano danneggiate o affette da patologie [Bhatia et al., 1999]. In questo e nei prossimi paragrafi, vengono specificati più in dettaglio gli approcci applicativi dell’ingegneria dei tessuti. Il termine “Tissue
Engineering” è stato ufficialmente coniato al National Science Foundation Workshop a Lake Tahoe
nel 1988 ed è stato definito come “un campo multidisciplinare che applica i principi dell'ingegneria e delle scienze della vita per la realizzazione di sostituti biologici che ripristinino, mantengano o migliorino le funzioni di tessuti o organi” [Langer et al., 1993]. Come accennato nel paragrafo precedente, fino a non molti anni fa, gli unici tipi di intervento attuabili in caso di malfunzionamento o lesione irreversibile di organi del corpo umano erano l'approccio farmacologico, la chirurgia ricostruttiva e il trapianto. La possibilità di costruire organi bioartificiali completi coltivando cellule vive su polimeri naturali o artificiali era un’ipotesi remota; pertanto l’impiego, con le dovute cautele, di organi provenienti da animali appariva come l’unica alternativa alla carenza di organi umani per il trapianto. La TE si occupa quindi della progettazione e della creazione di organi e protesi, non più dal punto di vista della ricerca di materiali inerti nell’organismo, bensì dal punto di vista dell’interazione tra materiale sintetico e sito biologico, in modo da poter realizzare la rigenerazione del tessuto o dell’organo originario, ottenendo così una vera e propria sorta di replicante biologico naturale, dove il supporto artificiale, quando presente, si degradi nel tempo. In questi ultimi anni, i tessuti ingegnerizzati si sono ampiamente sviluppati, grazie ai grandi passi in avanti che hanno caratterizzato lo studio dei biomateriali [Stark et al., 1998]; in particolare, i settori che maggiormente hanno contribuito allo sviluppo della TE sono quello finalizzato alla realizzazione degli scaffolds (matrici polimeriche biocompatibili di supporto) e quello preposto all’individuazione della semina cellulare caratteristica di ogni polimero. Infatti, come succede all’interno del tessuto originario, nella struttura polimerica su cui sono coltivate, le cellule rispondono e si adattano agli stimoli fisici e biologici. La componente cellulare è responsabile del conseguimento delle funzioni del tessuto che deve essere riprodotto. Il processo d’assemblaggio di una struttura ingegnerizzata inizia con l’identificazione del tipo di cellule più adatte per l’ottenimento del tessuto desiderato e con la procedura d’isolamento di queste cellule dal loro tessuto nativo. Il passo successivo consiste nell’espansione della popolazione cellulare: il grado di espansione cellulare e la sua velocità sono fortemente dipendenti dal tipo di cellule, per esempio, i fibroblasti, usati per riprodurre pelle e cartilagine, si moltiplicano presto, in contrapposizione alle cellule neuronali usate per la rigenerazione dei nervi. In questo processo, è importante assicurarsi che la popolazione cellulare in espansione mantenga il proprio fenotipo. Tra le cellule sotto investigazione come potenziali risorse dell’ingegneria tessutale, particolare attenzione è stata riservata a quelle staminali. Tecnologie innovative nel campo della biologia cellulare consentono di prelevare cellule staminali embrionali, cellule progenitrici o cellule già specializzate e di utilizzarle nella riparazione di lesioni e nella rigenerazione di tessuti mediante coltura su scaffolds. La creazione
di tessuti ad uso medico è già una realtà. Alcuni tessuti ingegnerizzati, quali l’epidermide e la cartilagine vengono già impiegati in clinica, altri, fra i quali l’osso, i tendini, i legamenti, le pareti vascolari e gli epiteli, sono ancora in una fase di sviluppo, spesso vicina all’applicazione clinica. La cute artificiale è uno degli ultimi sostituti della cute, ideati dalla bioingegneria per il trattamento delle lesioni cutanee con perdita di tessuto e, soprattutto, delle ustioni profonde. La cute artificiale può essere prodotta seguendo due diverse strategie: in vivo o in vitro. Quella prodotta in vivo prevede la realizzazione di un sistema polimerico biodegradabile, tipicamente costituito da fibre di collagene, da impiantare nella zona lesionata. Tale sistema serve da impalcatura per la rigenerazione del derma, mediante infiltrazione al suo interno di fibroblasti (cellule appunto responsabili della formazione del derma) e capillari, a partire dalle aree sane sottostanti e limitrofe alla zona lesionata. Una volta realizzato tale supporto dermico, si procede con un autoinnesto epidermico o di cheratinociti coltivati (cellule che formano lo strato epidermico) [Parenteau et al., 1999]. La cute artificiale prodotta in vitro utilizza come supporto dermico, per il successivo innesto epidermico, un sistema prodotto in laboratorio e non dal paziente stesso. In campo ortopedico, è stata dimostrata la possibilità di trapiantare condrociti umani e cellule staminali precursori degli osteoblasti, rispettivamente per la ricostruzione di cartilagine deteriorata a seguito di traumi o patologie (quali osteocondrite dissecante o condromalacia patellare) e per favorire la formazione di nuovo tessuto osseo, nel trattamento di anomalie dello scheletro, traumi e tumori ossei. La possibilità di riparare la cartilagine articolare rappresenta un importante traguardo, se pensiamo alla notevole frequenza di traumi o lesioni a cui è sottoposto questo tessuto in seguito ad incidenti stradali o sportivi. Il problema risulta ancora più complesso, considerando la grande percentuale d’incidenza di patologie infiammatorie, reumatiche e degenerative, cui la cartilagine va incontro con l’avanzare dell’età e che si verificano spesso come conseguenze post-traumatiche degli eventi sopra citati. A quanto precedentemente menzionato si aggiunga come il tessuto cartilagineo sia dotato di una limitata capacità di rigenerazione delle lesioni ad esso associate; inoltre il naturale processo di riparazione porta alla formazione di un tessuto fibrocartilagineo con peggiori caratteristiche di resistenza e deformabilità al carico. L’approccio clinico nell’uomo ha interessato soprattutto la riparazione di lesioni a livello del ginocchio, anche se altre sedi, quali ad esempio l’articolazione tibio-tarsica ed il menisco, sono oggetto di studio. Ricercatori hanno verificato la possibilità di far crescere nuova cartilagine conformata come un orecchio, un naso e altre forme naturali, altri stanno verificando se sia possibile prelevare dal paziente cellule cartilaginee, coltivarle in laboratorio e utilizzarle per consolidare l’uretra e alleviare l’incontinenza urinaria negli adulti e il riflusso vescicale nei bambini. E’ in sperimentazione l’uso di un tessuto, prelevato dalle gambe e dai glutei, per far crescere un nuovo tessuto mammario, allo scopo di sostituire quello rimosso a seguito di una mastectomia o della rimozione chirurgica di un tumore del seno. Tale sistema, anche se non costituito dai numerosi diversi tipi di cellule che formano la vera mammella, potrebbe essere una alternativa alle attuali protesi o impianti mammari. Altro esempio di applicazione clinica di trapianto di cellule è quello rivolto al trattamento del diabete mellito insulina-dipendente [Colton et al., 1995]. Le isole di Langerhans, un cluster di cellule specializzate del pancreas, producono diversi ormoni fra i quali l’insulina, responsabile della regolazione dei livelli di glucosio nel sangue: l’insufficiente produzione di insulina porta al diabete. Le soluzioni cliniche prevedono pertanto iniezioni giornaliere di insulina o in alternativa il trapianto selettivo di tali cellule specializzate. Il trapianto viene realizzato inserendo le cellule all’interno di una “membrana di immunoisolamento”. Tale membrana consente lo scambio di nutrienti e metaboliti e la diffusione di agenti secreti dalle cellule stesse, ma al contempo previene la permeazione di molecole di grandi dimensioni quali anticorpi e altre proteine prodotte dalle cellule del sistema immunitario. Grazie a questa immunoprotezione possono essere utilizzate per il trapianto anche cellule animali e ciò fa crescere enormemente la disponibilità di tessuti donatori. I risultati conseguiti nel campo della TE fanno pensare alla possibilità di ingegnerizzare organi grandi e complessi come il fegato, i reni, la mammella, la vescica e l’intestino: la speranza in questo settore è quella di poter disporre di neo-organi da trapiantare.
1.3.1.2 Principi di biologia molecolare
Lo sviluppo di un tessuto è regolato da una complessa gamma di eventi durante i quali le cellule interagiscono tra loro, con i fattori di crescita e con la matrice extracellulare.
Sulle cellule di un tessuto in fase di sviluppo intervengono un’ampia varietà di regolatori durante la loro ontogenia: questi eventi sono mediati da interazioni recettore-legante, e sono necessari per stimolare la proliferazione e/o la motilità cellulare. La regolazione dello sviluppo cellulare che porta alla formazione di un tessuto è un processo complesso al quale cooperano molti elementi, con l’obiettivo di ottenere un’organogenesi coordinata: cellule stromali e parenchimali, fattori di crescita e matrice extracellulare.
Le interazioni cellulari sono di tre tipi: cellula-cellula, cellula-fattori di crescita e cellula-matrice extracellulare. La molteplicità di interazioni tessuto-cellula richiede la presenza di recettori sia per mediare l’adesione cellulare, sia per trasmettere segnali intracellulari da altre cellule, fattori di crescita e/o matrice extracellulare. In particolare, esistono due tipologie di recettori. La maggioranza dei recettori sono proteine e sono costituiti da un dominio extracellulare legando-legante, una regione con una membrana idrofobica e una zona citoplasmatica per la trasduzione dei segnali. La sequenza degli amminoacidi definisce le varie famiglie di recettori (ad esempio immuno-globuline e integrine). Tuttavia, alcuni recettori non sono legati alla superficie cellulare tramite proteine, ma tramite fosfatidilinositoli. Di seguito sono esaminati in maggiore dettaglio i vari componenti del microambiente cellulare.
1.3.1.2.1 Microambiente tessutale
I tessuti sono costituiti da cellule e da un fluido extra-cellulare che contiene varie macromolecole, definite matrice extra-cellulare (ECM). La ECM si compone di glicosamminoglicani (GAGs) e proteine fibrose, che, in contatto con le cellule, danno loro un’organizzazione tridimensionale. Le cellule che definiscono un certo tipo di tessuto sono le cellule parenchimali. In breve, la ECM permette alle cellule di formare una adeguata struttura 3D e garantisce la comunicazione intercellulare, controlla i processi cellulari (proliferazione, migrazione cellulare, adesione, differenziazione). Le macromolecole della ECM sono secrete localmente da cellule specializzate dette fibroblasti. In Tabella 1-2 sono indicati i componenti principali della matrice extracellulare e la loro funzione.
Tabella 1-2. Componenti della matrice extracellulari
Componenti Funzione principale
GAGs Forma la struttura gel della matrice ECM
Collagene Conferisce resistenza meccanica e organizzazione alla ECM Elastina Conferisce resilienza o elasticità alla ECM
Fibronectina Garantisce l’adesione dei fibroblasti e delle altre cellule Laminina Garantisce l’adesione delle cellule alla lamina basale
I GAGs sono polimeri lineari, che consistono di numerose unità ripetitive disaccaridi. Il peso molecolare può essere di parecchie migliaia o anche milioni di dalton. I GAGs posseggono molte cariche negative a causa della presenza di gruppi carbossilici e solfato. Sono molto estesi e formano strutture di tipo random-coil. Sono molto idrofili, pertanto formano, in combinazione con il fluido interstiziale, la struttura gel che contiene le altre molecole della ECM. Esistono quattro tipi di GAGs, a seconda del tipo di zuccheri di cui sono composti: acido ialuronico, solfato di condroitina, solfato di dermatano, solfato di eparina ed eparina, e solfato di cheratina. Ad eccezione del solo acido ialuronico, essi formano anche dei proteoglicani attraverso legami covalenti con le proteine. I collageni sono proteine fibrose costituite da tre catene polipeptidiche che formano la struttura a tripla elica del collagene. La resistenza a trazione dei tessuti si deve al collagene. Sono stati identificati dieci tipi di collageni, tuttavia i più importanti sono i collageni fibrillari (tipo I, tipo II, tipo III) e il collagene di tipo IV. Il collagene di tipo I rappresenta ben il 90% del collagene che si trova nel corpo umano e si trova nella pelle, nei tendini, nei legamenti, in vari organi interni e nelle ossa. Il collagene di tipo II si trova soprattutto nella cartilagine, quello di tipo III nei vasi sanguigni e nella pelle. Il collagene IV si organizza in fogli all’interno della lamina basale della membrana basamento. I fibroblasti hanno la capacità di organizzare le fibrille di collagene che essi secernono, formando fogli o strutture a corda, quindi essi riescono ad influenzare l’organizzazione spaziale della matrice che producono. L’elastina è
una glicoproteina idrofoba, che attraverso reticolazione con molecole di elastina, forma un network di fogli o filamenti, con la proprietà di essere molto elastici. L’elasticità è dovuta all’organizzazione random-coil della singola molecola di elastina. La natura elastica riveste un ruolo importante nei vasi sanguigni, pelle, utero, e polmoni. Le fibrille anelastiche del collagene sono intrecciate con quelle di elastina, in modo da controllare e limitare il loro grado di allungamento. La fibronectina è la principale glicoproteina adesiva della ECM. Essa si lega con le altre molecole della ECM e con i recettori cellulari, quindi ha un ruolo fondamentale nell’adesione cellulare. La fibronectina è un dimero che consiste in due sottounità legate ad una estremità tramite disolfuro. Lungo la molecola ci sono dei domini funzionali che possono legare una serie di molecole (ad es collagene o eparina) o specifici recettori cellulari superficiali. Il dominio per l’adesione cellulare ha una specifica sequenza tripeptidica, costituita da arginina (R), glicina (G) e acido aspartico (D), detta sequenza RGD. La sequenza RGD è contenuta anche in altre proteine di adesione della ECM. La lamina basale è una struttura continua della ECM che separa cellule specifiche, come le cellule epiteliali, muscolari, endoteliali dallo strato sottostante di tessuto connettivo. Essa è composta da collagene di tipo IV, proteoglicani e la glicoproteina laminina. La laminina è una proteina molto grossa (850,000 dalton), costituita da tre lunghe catene polipeptidiche, che contiene domini funzionali per l’adesione di collagene di tipo IV, solfato di eparina e recettori cellulari. La lamina basale è costituita da due strati: la lamina rara, che si trova sotto la membrana basale delle cellule posizionate sopra, e la lamina densa, che è sotto la lamina rara. Al di sotto dei due strati della lamina basale, c’è la lamina reticularis che contiene collagene e connette la lamina basale al tessuto connettivo sottostante. Questi tre strati costituiscono la cosiddetta membrana basamento.
1.3.1.2.2 Interazioni cellulari
Le interazioni cellulari, come già accennato, sono di tre tipi: cellula-cellula, cellula-ECM, cellula-fattori di crescita. Le interazioni sono mediate da recettori della superficie cellulare, che sono parte della membrana cellulare. Il legame tra recettore e componenti della ECM (collagene, fibronectina, laminina) fa sì che le cellule si leghino alla matrice circostante. Il legame cellula-cellula mediato dai recettori cellulari permette loro di organizzarsi in strutture come tessuti e organi. Il legame cellula-fattori di crescita permette il controllo di una varietà di funzioni cellulari, mediante regolazione dell’espressione genetica. Ci sono quattro tipi di recettori di adesione: le caderine, le selectine e le molecole di adesione cellulare (CAMs), che sono coinvolte in interazioni cellula-cellula, le integrine, che sono coinvolte nelle interazioni cellula-cellula e cellula-ECM. Molte cellule secernono proteine solubili dette citochine che funzionano da messaggeri chimici tra le cellule. Esse sono richieste per il normale sviluppo cellulare (crescita, proliferazione) e sono coinvolte in vari processi, quali i processi infiammatori, la guarigione da ferite e varie risposte del sistema immunitario. Esse stimolano la proliferazione di tipi specifici di cellule e, quindi, sono anche dette fattori di crescita. I fattori di crescita si legano a specifici recettori sulla superficie delle cellule e inducono e dirigono l’azione di specifici geni in tali cellule.
1.3.1.2.3 Architettura dei tessuti
[Dunn et al., 2003]Per progettare organi e tessuti umani occorre tenere conto dei meccanismi alla base della loro formazione e conoscere, in particolare, i principi che regolano adesione, crescita, proliferazione, differenziazione e migrazione cellulare. L’architettura caratteristica dei tessuti è il risultato di molti processi cellulari. Oltre alla secrezione della matrice extracellulare, si possono distinguere processi legati al ciclo cellulare – crescita, divisione, differenziazione, morte – e processi legati alla motilità cellulare – movimento della cellula, risposte di motilità, movimenti associati, rimodellazione della matrice extracellulare. Tutti questi processi sono controllati dalle interazioni cellula, cellula-matrice, e da interazioni cellulari con la fase fluida del tessuto. Tutti e tre i tipi di interazione possono controllare la velocità e la direzione del movimento cellulare. Non solo il movimento cellulare è controllato dalla fase fluida, dalla matrice, e dalle altre cellule del tessuto, ma esso, a sua volta, può profondamente influenzare la fase fluida, rimodellare la matrice, determinare la posizione delle altre cellule mediante risposte cellula-cellula o movimenti associati.
1.3.1.2.3.1 Risposte di motilità diretta in vivo
Interazioni cellulari con la fase fluida
Le risposte cellulari alla fase fluida contenuta negli spazi del tessuto sono mediate largamente da specifiche molecole diffusibili nella fase fluida. La più importante delle risposte dirette è la chemiotassi, cioè la migrazione unidirezionale delle cellule in un gradiente di concentrazione di sostanze chemoattrattive o chemorepellenti. Oltre a controllare la migrazione di cellule singole, i gradienti di sostanze chemoattrattive possono controllare la direzione dell’estensione di gruppi organizzati di cellule, come i capillari sanguigni, o processi cellulari, come la crescita degli assoni nervosi. Questo tipo di meccanismo è chiamato più precisamente chemitrofismo, poiché ha come effetto l’estensione di un processo invece della traslocazione di una cellula singola. Oltre alla chemiotassi, esistono risposte cellulari dovute alle sollecitazioni meccaniche conseguenti alle condizioni di flusso della fase fluida con cui sono a contatto: per esempio, nei vasi sanguigni, il flusso di sangue esercita un’azione meccanica sulle cellule endoteliali delle pareti interne al vaso.
Interazioni cellulari con la fase solida acellulare
La fase solida acellulare nei tessuti è la matrice extracellulare, che, solitamente, ha natura fibrillare, anche se può prendere la forma di una lamina, come nella membrana del basamento. La presenza di fibrille nella matrice extracellulare da origine alla migrazione per contatto delle cellule (contact guidance). A loro volta le cellule, esercitando una tensione sulla matrice, possono allineare la matrice, e questo allineamento può guidare le cellule. Alcune proprietà della matrice extracellulare, inoltre, possono dirigere il movimento delle cellule. La chemioaffinità ne è un esempio: essa è responsabile della migrazione delle cellule secondo percorsi preferenziali, dovuti alla presenza di specifiche molecole adsorbite sul substrato di adesione.
Interazioni cellulari con altre cellule
Cellule vicine ad altre cellule rappresentano le une per le altre una fase solida. Quando alcune cellule sono usate da altre come substrato per il loro movimento, si hanno le risposte dirette di guida per contatto o chemioaffinità, che persistono anche se le cellule substrato sono state fissate dalla luce e quindi sono morte. Tuttavia, il comportamento di due cellule viventi che collidono è diverso da quello di una cellula vivente che collide una cellula morta. Esiste, infatti, il fenomeno di inibizione per contatto che si verifica quando un normale tessuto cellulare, collidendo con un altro, modifica la direzione della migrazione cellulare. Questo fenomeno impedisce che le cellule usino altre cellule some substrato ed è responsabile dell’orientazione cellulare radiale che si riscontra nella crescita cellulare da espianti.
1.3.1.2.3.2 Risposte di motilità diretta in vitro
Lo studio della motilità in vitro consente di scoprire molti aspetti dei meccanismi che controllano e dirigono la motilità cellulare in vivo. Generalmente, in coltura si cerca di riprodurre le condizioni che esistono in vivo e di isolare i vari fattori che determinano le risposte di motilità cellulare, per distinguere i singoli effetti. Per portare avanti simili studi, occorre creare un adeguato ambiente artificiale. Un ambiente uniforme è isotropo e non può causare una risposta guidata di movimento cellulare. Una qualsiasi risposta di movimento non guidata, come la variazione della velocità cellulare causata da una variazione di una proprietà scalare, è detta cinesi. Campi anisotropi uniformi possono agire come campi vettoriali e orientare la movimentazione cellulare lungo una direzione: il fenomeno è detto tassia. Nel caso in cui il movimento cellulare predominante sia nella direzione perpendicolare a quella del vettore del campo, si parla di diatassia. Nel caso di un campo uniforme di un qualche tensore simmetrico del secondo ordine, come la deformazione o la superficie di curvatura, gli assi ortogonali orientano il movimento cellulare. In tale caso, infatti, la risposta è bidirezionale. Per altri casi più complessi, le risposte cellulari non hanno un nome preciso e si parla semplicemente di funzione guida per le cellule.
1.3.1.2.3.3 Ambienti con specifiche proprietà della fase fluida
Gradiente lineare di concentrazione
Il metodo più comune per riprodurre la chemiotassia in vitro consiste nell’utilizzare una camera di Boyden, nella quale il gradiente di qualche specifica sostanza chimica viene ottenuto grazie ai fenomeni diffusivi attraverso una membrana. L’entità del movimento cellulare è definito dal numero di cellule che migrano attraverso i pori del filtro e si posizionano alle due facciate esterne della membrana. Tuttavia, la camera di Boyden presenta due inconvenienti: non è noto il gradiente di concentrazione all’interno del percorso, spesso tortuoso, dei pori, e la risposta cellulare non può essere osservata direttamente. La camera detta di Zigmond consente di osservare direttamente il comportamento cellulare, ma il gradiente impostato rimane stabile solo per poco tempo (al massimo due ore). Attualmente la camera di Dunn consente di ottenere un gradiente stabile e un’osservazione diretta del comportamento cellulare. La camera di Dunn è in vetro e possiede due pozzetti concentrici separati da un ponte anulare. Un vetrino contenente le cellule viene sistemato rovesciato sui pozzetti. La distanza tra il vetrino e il ponte anulare è di circa 20 µm. Inizialmente i due scomparti sono riempiti con un mezzo di controllo, poi quello esterno viene svuotato e riempito con un mezzo contenente la sostanza di interesse. Si sviluppa così un gradiente della sostanza la cui concentrazione è massima alla parete esterna del ponte e minima all’interno. Il gradiente genera un flusso della sostanza dall’esterno all’interno il cui tempo di dimezzamento è sufficiente per lo studio del corrispondente movimento cellulare. Un gradiente lineare di concentrazione può essere visto come un campo di concentrazione scalare non uniforme o come un campo vettoriale uniforme del gradiente di concentrazione. La risposta chemiotattica delle cellule può essere allora complicata dalla risposta chemiocinetica. Inoltre le cellule possono modificare il gradiente ad esempio rilasciando segnali chemiotattici.
Gradiente di sforzi di taglio
Le condizioni di flusso della fase fluida dell’ambiente che ospita le cellule può influire in due modi sulla loro motilità: per prima cosa può influenzare le proprietà di trasporto di massa e, quindi, la distribuzione delle molecole, inoltre, può causare uno sforzo di taglio sulle cellule.
1.3.1.2.3.4 Ambienti con specifiche proprietà della fase solida
Forme e architetture specifiche
Le cellule possono essere guidate dalla topografia superficiale o dalla disponibilità del substrato. Le cellule aderiscono ai substrati tramite filamenti di actina. Essi permettono alla cellula di rilevare la presenza di curvature del substrato. I filamenti di actina si formano continuamente, e parallelamente alla generazione di nuovi punti di adesione tra cellula e substrato. Essi esercitano una forza di trazione sulla matrice e, nei confronti di superfici convesse (come la superficie esterna di fibre), si posizionano tangenti al punto di adesione. La forza di trazione, inoltre, si riduce in corrispondenza delle direzioni di alta curvatura convessa. Nel caso di un substrato concavo, come la cavità interna di un cilindro, il corpo cellulare tende ad assumere una forma bipolare con i filamenti di actina a 180° gli uni dagli altri diretti verso le pareti, e ad assumere un’orientazione perpendicolare all’asse del cilindro.
Nel caso di superfici con brusco cambio di inclinazione (forma a tetto), la cellula è inibita ad attraversare il bordo che delimita le zone a diversa inclinazione, quando l’angolo di inclinazione è maggiore di quello che i filamenti di actina formano generalmente su un substrato piano. Nel caso di substrati con avvallamenti o rilievi in direzione longitudinale e parallela, non è chiaro se i filamenti di actina si inseriscano negli avvallamenti o li evitino. Nel caso in cui i filamenti di actina si inseriscano negli avvallamenti, la cellula è obbligata a orientarsi e muoversi longitudinalmente per evitare che tali filamenti si rompano. Nel caso in cui i filamenti di actina evitino gli avvallamenti, i meccanismi legati alla disponibilità del substrato spiegano la necessità di un orientamento longitudinale, parallelo alle strisce del substrato.
Zone del substrato con specifiche proprietà di adesione
In coltura, l’equivalente alla risposta di chemioaffinità è dato dall’azione guida fornita alle cellule da zone del substrato con buone proprietà di adesione (create ad hoc sul substrato stesso) rispetto ad altre meno idonee all’attaccamento cellulare. Addirittura, se i tracciati specifici per l’adesione cellulare sono sufficientemente stretti, il movimento delle cellule è limitato alla direzione del tracciato. La guida lungo le zone di alta adesione è pronunciata anche nel caso in cui le cellule possano comunque aderire alle zone di bassa adesione: le cellule, infatti, tendono a passare molto più frequentemente dalle aree di bassa adesione a quelle di alta adesione, essendo le forze di trazione verso il substrato esercitate più efficacemente dalla parte di cellula a contatto con le zone specifiche per l’attaccamento cellulare. Considerando una serie di strisce parallele dotate di buone proprietà di adesione e alternate con zone a bassa adesione, è stato osservato che, se la spaziatura è molto inferiore alla dimensione cellulare, non si notano effetti rilevanti sull’orientazione cellulare.
Specifiche proprietà meccaniche
La guida cellulare dovuta a caratteristiche meccaniche anisotrope non è stata provata ma è una possibilità. Risulta peraltro complesso eseguire delle prove a riguardo, in quanto è difficile fabbricare substrati adeguati, cioè completamente piatti, chimicamente uniformi in superficie, e con proprietà viscoelastiche anisotrope.
1.3.1.2.3.5 Ambienti con specifici arrangiamenti delle cellule vicine
Se le cellule sono seminate a densità non uniforme, si osserva una loro migrazione alle zone meno densamente occupate. Per quanto riguarda le colture eseguite a densità uniforme, le risposte per contatto mutuo tra le cellule possono influire sulla mutua orientazione di cellule vicine confluenti. Si possono quindi ottenere regioni con cellule orientate, a partire da colture uniformi. Per studiare l’effetto del contatto tra popolazioni cellulari diverse (eterologhe), si possono seminare due popolazioni ad una distanza di pochi mm su un certo substrato. Inizialmente, il fenomeno di inibizione per contatto delle cellule omologhe, porta le cellule a orientarsi in direzione radiale, fino alla collisione delle due popolazioni cellulari. A questo punto, in caso di linee cellulari non invasive, il movimento cellulare si riduce molto dopo la collisione e avviene un limitato miscelamento delle due popolazioni nella zona di confine. In caso di linee cellulari invasive, l’inibizione per contatto di cellule eterologhe non si verifica, portando a fenomeni di infiltrazione cellulare di una linea cellulare nell’altra.
1.3.1.3. Strutture polimeriche per l’ingegneria dei tessuti o scaffold
Uno scaffold è una matrice polimerica tridimensionale che svolge la funzione di impalcatura di supporto per la crescita delle cellule in una conformazione quanto più simile ad un tessuto. Il biomateriale è conformato in modo tale da permettere l’omogenea colonizzazione delle cellule ed è caratterizzato da una degradazione controllata.
Le caratteristiche peculiari che un biomateriale deve possedere affinché possa essere processato come
scaffold si possono riassumere nella lista seguente:
deve essere biodegradabile e biocompatibile, possedere proprietà fisiche e meccaniche confrontabili con quelle del tessuto da sostituire e una malleabilità strutturale per ottenere strutture conformate;
deve produrre cataboliti atossici e promuovere l’adesione e la mobilizzazione cellulari;
deve essere riconoscibile e rimodellabile dalle cellule tessutali e dagli enzimi della extra cellular matrix (ECM);
deve essere angiogenico e suturabile ed essere caratterizzato da bassa trombogenicità e immunogenicità.
Gli scaffolds non sono dunque supporti meccanici passivi ma partecipano attivamente nella ricostruzione dei tessuti; essi provvedono alla stabilità meccanica della struttura necessaria per l’organizzazione tridimensionale delle cellule che si devono sviluppare fino alla formazione del tessuto. Mentre il tessuto si forma, il materiale polimerico viene assorbito dalle cellule ospiti con una velocità di degradazione uguale a quella di biosintesi cellulare. I requisiti che gli scaffolds devono possedere sono [Dietmar et al., 2000; Lu et al., 1996; Limpanuphap et al., 2002; Hutmaker at al., 2001]:
¾ porosità elevata e tridimensionale con una rete di interconnessione di pori tale da permettere la crescita cellulare, il trasporto dei nutrienti e l’eliminazione dei cataboliti;
¾ velocità di degradazione e di riassorbimento controllabile e proporzionale alla crescita del tessuto;
¾ superficie chimicamente adatta all’adesione, alla proliferazione e alla differenziazione delle cellule;
¾ proprietà meccaniche il più possibile simili a quelle dei tessuti che si trovano nel sito d’impianto;
¾ riproducibilità in forme e dimensione differenti; ¾ diametro dei pori compreso tra 200 e 400 µm
Lo scaffold polimerico tridimensionale, in generale, deve essere altamente poroso, deve avere un’elevata area superficiale, e una distribuzione controllata dei pori. Tali proprietà non devono compromettere l’integrità strutturale e la resistenza meccanica della struttura. Un’alta porosità è indispensabile per la crescita del tessuto all’interno del supporto, per la formazione di un network vascolare, e per il trasporto dei nutrienti e dei prodotti del metabolismo cellulare. La distribuzione dei pori deve essere opportuna per evitare la presenza di regioni non vascolarizzate e per ottimizzare la dimensione dell’impianto. Un’elevata area superficiale rispetto al volume della struttura garantisce una molteplicità di punti di adesione per le cellule, inoltre favorisce l’interazione delle pareti con molecole della ECM o con fattori di crescita nei trattamenti mirati ad accrescere le interazioni tra le cellule e il substrato ed a promuovere la proliferazione e differenziazione.
1.3.1.3.1 Tecniche utilizzate per la realizzazione degli scaffolds
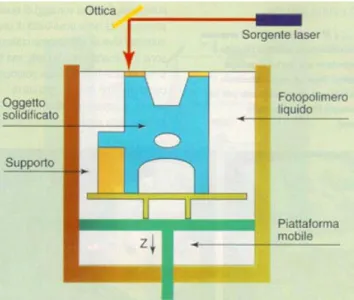
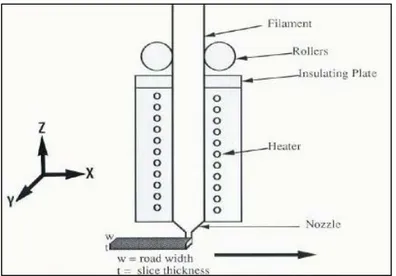
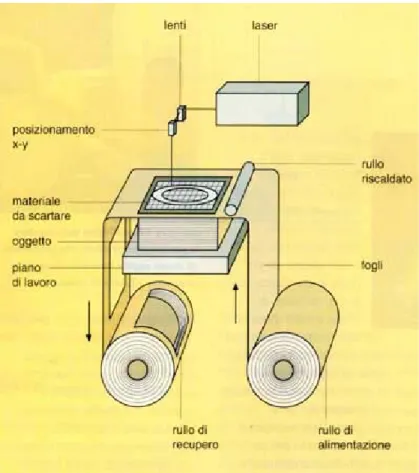
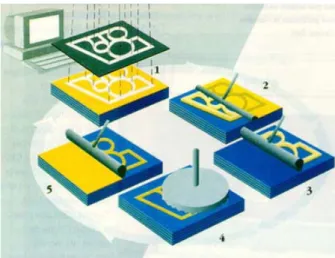
Le tecnologie che possono essere utilizzate per la fabbricazione di scaffolds polimerici per applicazioni nel campo dell’Ingegneria Tessutale sono molteplici e possono essere suddivise in due grandi categorie. La prima categoria è rappresentata dalle tecniche convenzionali che includono tecnologie tessili, di casting, di stampaggio per fusione e di stratificazione di membrane; esse presentano la grave limitazione di non consentire la realizzazione di strutture che abbiano un network di pori sufficientemente interconnesso e che siano riproducibili con facilità per quanto concerne morfologia e caratteristiche. La seconda categoria comprende le tecniche non convenzionali di prototipazione rapida (o solid freeform fabrication), che essendo interfacciate da un PC, consentono di ottenere strutture con pori interconnessi e facilmente riproducibili.
1.3.1.3.1.1 Principali tecniche convenzionali
Tecnologia tessile
Un gran numero di tecnologie tessili possono essere potenzialmente impiegate per realizzare scaffolds altamente porosi. Le fibre forniscono un’ampia area superficiale in rapporto al volume occupato e per questo motivo esse risultano molto adatte per produrre sistemi di supporto per trapianti cellulari. Strutture tridimensionali della forma desiderata vengono ottenute da tessuti di fibre o fibre legate assieme; per incrementare le proprietà meccaniche di questi tipi di scaffolds, sono state sperimentate tecniche di legatura delle fibre in modo da ottenere reti (network) di diverse forme [Hutmacher et al., 2001]. Lo schema generale per legare fibre non tessute prevede quattro stadi. La fase iniziale consiste nell’immergere una struttura di fibre non legate di polimero A in una soluzione di polimero B. In alternativa una soluzione di polimero B viene versata in uno stampo contenente una
struttura di fibre non legate di polimero A. Il solvente impiegato deve essere un non-solvente per il polimero A, inoltre i polimeri A e B devono essere immiscibili allo stato fuso. Nella fase successiva, a seguito dell’evaporazione del solvente, si ha la formazione di un composito costituito da fibre del polimero A intrappolate all’interno della matrice di polimero B. La fase ancora successiva prevede il riscaldamento a temperatura ancora maggiore di quella di fusione del polimero A per un opportuno lasso di tempo, in modo da saldare le fibre laddove si sovrappongono. L’ultima fase prevede la dissoluzione selettiva della matrice del polimero B e l’ottenimento di un supporto di fibre legate tra loro.
Tecniche di filatura
Le molteplici metodologie utilizzate per la produzione di fibre possono essenzialmente essere ricondotte a tre principali categorie:
Filatura da fuso (melt spinning) Filatura a secco (dry spinning) Filatura ad umido (wet spinning)
Gli impianti per la filatura da fuso sono costituiti dalle seguenti sezioni: Fusione
Filtrazione e dosaggio Filatura
Raffreddamento Raccolta delle fibre
Il polimero, in forma di pellets, viene riscaldato ad una temperatura di 20/40°C superiore rispetto alla sua temperatura di fusione, in modo da poterlo filare allo stato fuso. Il fuso attraversa una sezione di filtrazione mediante la quale vengono rimosse le impurezze, rappresentate dai chips non completamente fusi. Successivamente il polimero viene forzato attraverso una testa di estrusione (spinneret); il filamento uscente da questa viene condotto ad una sezione di raffreddamento dove il materiale solidifica, completando il processo di formatura della fibra. Una volta che le fibre si sono formate e hanno acquistato una propria stabilità dimensionale, vengono raccolte in bobine attraverso un sistema di rulli. Un tipico impianto di filatura da soluzione a secco è composto dalle seguenti sezioni:
Preparazione della soluzione Filtrazione e dosaggio Filatura
Eliminazione del solvente Raccolta delle fibre
Il polimero viene inizialmente dissolto in un opportuno solvente, che deve essere sufficientemente volatile in modo da poterlo allontanare facilmente nella fase di consolidamento della fibra; la soluzione viene quindi filtrata e pompata attraverso uno spinneret. Il filamento prodotto viene condotto in una sezione riscaldata, nella quale avviene la formazione della fibra solida per evaporazione del solvente. Generalmente in tale sezione vengono immessi, in controcorrente al filamento, gas caldi: per ragioni economiche il gas più utilizzato è l’aria, ma, se necessario, sono utilizzati anche argon, anidride carbonica o vapore surriscaldato. La filatura da soluzione ad umido è la metodologia più complessa ma anche la più usata a livello industriale. Verrà descritta più in dettaglio nel Capitolo 6, essendo una delle tecniche adoperate in questo lavoro. Brevemente, il polimero viene dissolto in un solvente in modo da formare una soluzione che viene estrusa attraverso una filiera completamente immersa in una vasca contenente un bagno di coagulazione dove il materiale precipita o è rigenerato chimicamente.
Solidi cellulari
I metodi convenzionali utilizzati per la produzione di solidi cellulari risultano inutilizzabili per produrre matrici porose, in quanto sono richieste aggiunte di agenti emulsionanti, stabilizzanti, lubrificanti ed agenti schiumogeni, che possono risultare tossici o difficilmente riassorbibili da parte dell’organismo ospite. Per tali ragioni gli studi compiuti nel settore si sono rivolti al perfezionamento di tecniche alternative. Queste le tecnologie più comuni per la fabbricazione di scaffolds: sottrazione
![Figura 1-4. Numero di pubblicazioni sull’ingegneria dei tessuti dal 1991 al 2002 negli USA, UE, Giappone e Svizzera [Ovi et al., 2004]](https://thumb-eu.123doks.com/thumbv2/123dokorg/7242508.79694/7.892.223.713.880.1103/figura-numero-pubblicazioni-ingegneria-tessuti-usa-giappone-svizzera.webp)
![Figura 1-5. Percentuale di lavori in cooperazione tra pubblico e privato dal 1991 al 2002 [Ovi et al., 2004]](https://thumb-eu.123doks.com/thumbv2/123dokorg/7242508.79694/9.892.224.710.184.403/figura-percentuale-lavori-cooperazione-pubblico-privato-ovi-et.webp)
![Tabella 1-1. Mercato potenziale annuo globale nel 2014 dei prodotti da TE [Ovi et al., 2005] Settore Potenzialità (milioni di dollari) Cardiovascolare 31,200 Ortopedia 64,200 Neurologia 23,400 Urologia 620 Rigenerazione di organi 32,800 Pelle 32,9](https://thumb-eu.123doks.com/thumbv2/123dokorg/7242508.79694/10.892.130.707.110.393/mercato-potenziale-potenzialità-cardiovascolare-ortopedia-neurologia-urologia-rigenerazione.webp)