Scuola di Specializzazione in Biochimica Clinica
“INFIAMMAZIONE E AUTO
DI RISTENOSI
IN PAZIENTI CON CORO
CANDIDATO RELATORE
Dr.sa Chiara Colotti
FACOLTÀ DI FARMACIA
Scuola di Specializzazione in Biochimica Clinica
Tesi di Specializzazione
INFIAMMAZIONE E AUTOIMMUNITÀ NEL PROCESS
DI RISTENOSI DOPO ANGIOPLASTICA CORONARICA
IN PAZIENTI CON CORONAROPATIA
ELATORE
Dr.sa Chiara Colotti
Dr.sa Daniela Gian
Prof. Antonio Lucacchini
Anno Accademico 2010-2011
Scuola di Specializzazione in Biochimica Clinica
IMMUNITÀ NEL PROCESSO
ORONARICA
NAROPATIA”
Dr.sa Daniela Giannessi
Prof. Antonio Lucacchini
2
Sommario
Ringraziamenti 4 Abstract 5 Riassunto 7 1 Introduzione 9 1.1 Aterosclerosi 9 1.2 Tecniche di rivascolarizzazione 121.2.1 Angioplastica Coronarica Transluminale Percutanea (PTCA) 12
1.2.2 PTCA con impianto di stent 14
1.2.3 PTCA con impianto di stent medicati 15
1.2.4 By pass aorto-coronarico (CABG) artero-venoso e artero-arterioso 15
1.3 Ristenosi dopo PTCA e stenosi dei graft venosi 16
1.4 Ristenosi intra-stent: meccanismi molecolari dell'iperplasia neointimale 17
1.4.1 Impianto dello stent 19
1.4.2 Adesione, attivazione piastrinica e formazione del trombo 21
1.4.3 Infiammazione locale e sistemica 24
1.4.4 Infezioni e autoimmunità nell’aterosclerosi e nella ristenosi 26
1.4.5 Proliferazione e migrazione delle VSMC 28
1.4.6 Apoptosi delle VSMC 29
1.4.7 Rimodellamento della ECM 35
1.4.8 Retrazione del coagulo e sintesi di nuova matrice 36
1.5 Iperplasia neointimale: Effettori Biochimici 36
1.5.1 Infiammazione locale e sistemica 36
3
1.5.3 Rimodellamento della ECM 73
1.6 Ristenosi intra-stent: trattamenti farmacologici 86
1.6.1 Rapamicina, o Sirolimus 87 1.6.2 Paclitaxel (Taxolo) 88 1.6.3 Inibitori di MMP: Batimastat 88 1.6.4 Tacrolimus 89 1.6.5 Beta Estradiolo 89 1.6.6 Actinomicina D 90
1.7 Stent medicati: impiego nella pratica clinica 90
2 Scopo del lavoro di tesi 95
3 Materiali e Metodi 98
3.1 Pazienti 98
3.2 Campioni biologici 100
3.3 Determinazione dei biomarcatori 101
3.4 Rilevazione angiografica della ristenosi intra-stent a 6 mesi 102
3.5 Analisi statistica 103
4 Risultati 105
4.1 Dati clinici e angiografici 105
4.2 Biomarcatori 106
5 Discussione 114
6 Glossario 118
4
Ringraziamenti
Desidero innanzitutto ringraziare la Dott.sa Daniela Giannessi per i preziosi insegnamenti forniti durante gli anni di frequenza presso l’Istituto di Fisiologia Clinica del CNR di Pisa per il conseguimento dei titoli di laurea, di perfezionamento e ora di specializzazione, per le numerose ore dedicate alla mia tesi, la disponibilità e l’affetto da sempre dimostrati. Inoltre, ringrazio la Dott.sa Silvia Del Ry per le preziose indicazioni, il sostegno morale e la benevolenza che ha avuto nei miei confronti in tutti gli anni di lavoro trascorsi assieme. Intendo poi ringraziare la particolare disponibilità della Dott.sa Annamaria Mazzone, del Prof. Aldo Clerico e dei loro collaboratori, e l’Istituto di Fisiologia Clinica del CNR di Pisa e l’ospedale G.Pasquinucci di Massa per avermi fornito testi e dati indispensabili per la realizzazione di questa tesi e per la disponibilità mostratami durante il periodo di tirocinio. Inoltre, vorrei esprimere la mia sincera gratitudine alle mie colleghe di laboratorio, in particolare Rosa Letizia, Maristella, Manuela e Valeria per i numerosi consigli e il sostegno morale dimostratomi durante la ricerca.
Infine, ho desiderio di ringraziare con affetto mio marito, le mie figlie Luna e Aurora, i miei genitori e i miei suoceri per il sostegno morale e materiale a me offerto nel corso degli anni, indispensabile per il conseguimento dei traguardi raggiunti.
5
Abstract
Background and Purpose. Growing evidence supports the role played by inflammation and autoimmunity in atherosclerosis as well as in restenosis after revascularization techniques. Identifying sensitive biomarkers is useful in predicting accelerated atherosclerosis and restenosis. Aim of this study was to investigate prospectively the relationship between plasma levels of inflammatory and autoimmune biomarkers and instent restenosis/rapid coronary plaque progression in patients with coronary artery disease (CAD) undergoing percutaneous coronary intervention (PCI).
Methods. We studied 39 patients with CAD: 22 affected by unstable angina/non-ST elevation myocardial infarction (ACS, acute coronary syndrome) and 17 by chronic coronary syndrome (CCS). Serum anti-Heat Shock Protein (HSP)65 and anti-HSP60 auto-antibodies, plasma osteopontin (OPN), Interleukin (IL)-6 and C-reactive protein (PCR) were measured at baseline and at 1, 15, 30, 90, and 180 days during the follow-up. Clinical and biohumoral data were correlated with baseline and 6-month PCI follow-up angiography.
Results. At baseline higher levels of OPN, IL-6, and PCR were found in CAD patients compared to healthy controls, and this increase is enhanced in ACS patients. Similarly, anti-HSP60 antibodies are higher in ACS with respect to CCS subjects, although both anti-HSP antibodies do not differ from controls considering the CAD patients as a whole. PCI increased inflammatory markers acutely while no alteration of serum anti-HSP60 and anti-HSP65 antibodies was observed. No correlation was observed between anti-HSP antibody levels and restenosis/rapid atherosclerosis progression or inflammatory biomarker profile; only baseline OPN levels proved to be associated with instent restenosis (p = 0.03).
6
Conclusion. The study prospectively suggests that inflammation and tissue remodeling are key factors in accelerated atherosclerosis. On the contrary, autoimmunity appears do not have a pivotal role in this process as well as in inflammatory status exacerbation in patients with CAD undergoing PCI.
7
Riassunto
Introduzione e scopo. Infiammazione, rimodellamento e proliferazione cellulare sono i principali processi patogenetici associati con l’insorgenza e progressione dell’aterosclerosi e della ristenosi coronarica dopo rivascolarizzazione percutanea (PCI); in questo contesto, il processo di autoimmunità nei confronti delle Heat Shock Proteins (HSP) sembra possa avere un ruolo importante, sebbene non ancora ben definito. Scopo principale di questo lavoro di tesi è stato quello di indagare prospetticamente la relazione esistente tra la presenza nella circolazione periferica di anticorpi autologhi anti-HSP e la rapida progressione aterosclerotica/ristenotica in pazienti coronaropatici (CAD) sottoposti a PTCA con impianto di stent. Un ulteriore obiettivo di questo lavoro di tesi è stato quello di valutare l’esistenza di una associazione fra i livelli ematici degli anticorpi autologhi anti-HSP65 e anti-HSP60 e quelli di osteopontina (OPN), interleuchina (IL) -6 e proteina C-reattiva (PCR), indici rispettivamente di rimodellamento vascolare, proliferazione cellulare e infiammazione.
Metodi. Sono stati arruolati nello studio 39 pazienti con CAD: 22 affetti da angina instabile/infarto miocardico senza elevazione del tratto ST (ACS, sindrome coronarica acuta) e 17 da sindrome coronarica stabile (CCS). I livelli di tutti i biomarcatori sono stati misurati in condizioni basali e durante il follow-up a 1, 15, 30, 90, e 180 giorni dall’intervento di PTCA con impianto di stent. I dati bioumorali di questi pazienti sono stati correlati con quelli rilevati angiograficamente in condizioni basali e dopo 6 mesi dall’intervento.
Risultati. In condizioni basali i livelli ematici di OPN, IL-6 e PCR sono risultati significativamente più elevati nei pazienti con CAD rispetto ai controlli sani, e tale aumento si è rivelato più spiccato nei pazienti affetti da ACS. Allo stesso modo, i livelli
8
serici degli anticorpi anti-HSP60 sono risultati più elevati nei soggetti con ACS rispetto a quelli con CCS mentre i livelli ematici di entrambi gli anticorpi nella totalità dei pazienti con CAD non differiscono significativamente da quelli dei controlli. La PTCA con impianto di stent non ha prodotto effetti importanti sui livelli circolanti degli anticorpi anti-HSP60 e anti-HSP65, a fronte di un aumento degli indici infiammatori e dell’OPN. Non si è osservata alcuna associazione fra i titoli anticorpali e la progressione dei processi di ristenosi e aterosclerosi. Solo i livelli di OPN basali sono risultati associati con la comparsa di ristenosi intra-stent a sei mesi dalla rivascolarizzazione (p=0.03).
Conclusione. Questo studio prospettico suggerisce che l'infiammazione, il rimodellamento vascolare e la proliferazione cellulare sono processi importanti per la rapida progressione della malattia aterosclerotica. Al contrario, l’autoimmunità sembra non rivestire un ruolo rilevante in questo processo patogenetico.
9
1
Introduzione
1.1
Aterosclerosi
Al giorno d’oggi, le malattie cerebro- e cardio-vascolari su base aterosclerotica (infarto miocardico ed Ictus cerebrale) rappresentano la prima causa di mortalità e morbilità nella popolazione mondiale. In particolare, la prevalenza di aterosclerosi coronarica è estremamente elevata nei soggetti di sesso maschile e negli asiatici.
L’ aterosclerosi è una forma peculiare di arteriosclerosi, processo patologico causato da indurimento con perdita di elasticità della parete vasale, che consiste nella formazione di placche dette ateromi o placche aterosclerotiche all’interno della parete delle arterie di piccolo, grosso e medio calibro. In dettaglio, l’eziologia dell’aterosclerosi coronarica è molto complessa e variabile da individuo a individuo ed è principalmente caratterizzata dall’accumulo di lipidi, che vanno a costituire l’ateroma o placca aterosclerotica nella parete delle arterie coronarie. Gli ateromi solitamente hanno una lenta evoluzione: dapprima sono costituiti prevalentemente da lipidi di cui il colesterolo è il maggior rappresentante mentre, con il passare del tempo, diventano sempre più estesi, sviluppano una propria struttura di sostegno composta da molecole fibrose e cellule connettivali, calcificano e spesso degenerano andando incontro a necrosi (Kadar et Glasz, 2001). Inoltre, in alcuni casi, l’ateroma può andare incontro a rottura e indurre la formazione di un trombo piastrinico, che può ulteriormente andare restringere o ostruire l’arteria colpita da tale fenomeno patologico causando quindi l’ischemia o l’infarto del tessuto a valle dell’ostruzione. A sua volta, il trombo può frantumarsi e distaccarsi dalla parete vasale, divenendo un embolo, che in circolo può andare ad ostruire un’altra arteria di calibro inferiore causando la necrosi dei tessuti o degli organi da quest’ultima irrorati.
10
L'estensione della malattia può variare molto, da poche placche isolate fino ad arrivare sino alle forme molto gravi in cui tutto l'endotelio è sostituito da queste placche e quindi la parete arteriosa perde del tutto la sua naturale elasticità.
Le sedi maggiormente colpite dall’aterosclerosi sono rappresentate dall’aorta e dai suoi rami principali, dai vasi del circolo cerebrale e degli arti inferiori, ma soprattutto dalle coronarie dove, la presenza di ateromi, provoca ischemia cardiaca come conseguenza di un ridotto flusso sanguigno all’interno dei vasi ateromatosi.
Attualmente, l’aterosclerosi è considerata una malattia sostanzialmente infiammatoria cronica ed evolutiva della parete arteriosa, costellata da più o meno frequenti riacutizzazioni, cui corrispondono episodi clinici, talvolta anche molto gravi come ad esempio l'infarto miocardico acuto (IMA) e l'ictus.
Lo sviluppo di aterosclerosi dipende da molteplici fattori causali che agiscono nel processo patogenetico, da soli o in concerto tra loro, sia negli stadi iniziali sia nella progressione di malattia. Tra i fattori di rischio tradizionali vengono annoverati: l’età avanzata, il sesso maschile, il fumo di sigaretta, l’abuso di alcool, la sedentarietà, l’ipertensione, la dislipidemia, il diabete, l’obesità e la familiarità per malattie cardiovascolari.
Tuttavia, negli ultimi anni, si sono accumulate osservazioni che confermano l’origine autoimmune e infettiva di alcune forme di aterosclerosi (Nilsson et Hansson, 2008). In particolare, nel primo caso, è stato riportato che i pazienti affetti da malattie autoimmuni, come il Lupus sistemico eritromatoso e la sindrome antifosfolipidica che spesso lo accompagna, presentano un’aumentata mortalità e morbilità a causa di un prematuro o accelerato sviluppo di aterosclerosi. Questo è spiegabile in parte con la presenza, in tali pazienti, di elevati livelli serici di autoanticorpi diretti contro i fosfolipidi di membrana che possono, in presenza di stress ossidativo, cross-reagire con
11
le lipoproteine a bassa densità ossidate (ox-LDL) contribuendo così alla progressione del fenomeno aterosclerotico (Hansson et Libby, 2006; Binder et al., 2002). Diversamente, la teoria infettiva dell’aterosclerosi si basa sull’assunto che alcune infezioni croniche da chlamydia pneumoniae, helicobacter pylori, porphiromonas gingivalis e citomegalovirus possano attivare anomale risposte immunitarie che contribuiscono alla insorgenza o alla progressione della malattia aterosclerotica. In particolare, molti lavori hanno indagato il ruolo della proteina da stress termico batterica HSP65, quale determinante antigenico capace di stimolare la produzione di anticorpi anti-HSP65 a loro volta in grado di cross-reagire con le HSP60 umane presenti a livello sistemico e locale, seguendo un meccanismo noto con il nome di mimetismo molecolare (Yokota et Fujii, 2010). Secondo quest’ultimo, l’isoforma batterica HSP65, presenta notevole somiglianza antigenica con la variante umana HSP60 ed è quindi in grado di determinare la comparsa di una risposta autoimmune locale poiché gli anticorpi rivolti contro la sopraccitata isoforma batterica sono in grado di riconoscere e legare la variante umana che spesso risulta esposta sulla membrana delle cellule endoteliali vasali sottoposte a stress di varia natura. Questa interazione antigene-anticorpo a livello endoteliale determina quindi un effetto citotossico che può essere il fattore scatenante di alcune forme di aterosclerosi di origine infettiva o autoimmune. Ad esempio, la risposta autoimmune nei confronti della HSP65 batterica, indipendentemente dall’età e dai livelli serici di colesterolo, si è rivelata capace di determinare la comparsa di placche ateromatose in conigli normo-colesterolemici sottoposti a precedente immunizzazione con HSP65 di origine micobatterica. Inoltre, è stata riscontrata la presenza di HSP65 a livello delle placche ateromatose di conigli e ratti precedentemente immunizzati con micobacterium tubercolosis; questo a conferma della possibilità che anticorpi anti-HSP65 e linfociti T possano interagire con la parete vasale di animali immunizzati nei confronti dell’HSP65 batterica. Nell’uomo, le osservazioni condotte sull’animale sono
12
state confermate e inoltre si è riscontrato che la HSP65 a livello dell’ateroma è in grado di stimolare la produzione di metalloproteasi e TNFα così come pure di attivare le VSMC e i macrofagi presenti a livello della tonaca media. Pertanto, ad oggi, anche nell’uomo, è stato riconosciuto l’importante ruolo patogenetico e prognostico degli anticorpi anti-HSP65 nell’aterosclerosi (Nilsson et Hansson, 2008).
L'aterosclerosi è una malattia che si sviluppa in maniera asintomatica e, quando compaiono i primi sintomi, spesso la situazione delle arterie è già molto compromessa ed è elevato il rischio di complicanze spesso mortali quali, ad esempio, ictus cerebrale e infarto miocardico (Kàdàr et Glasz, 2001).
In particolare, per prevenire il rischio di complicanze dovute alla progressione del fenomeno aterosclerotico coronarico, gli interventi meno invasivi più frequentemente praticati sono l’angioplastica coronarica transluminale percutanea (PTCA) semplice o con impianto di stent. Diversamente, quando non è possibile intervenire per via percutanea, si opta solitamente per l'intervento chirurgico di by-pass coronarico (CABG) artero-arterioso o artero-venoso. Tutti gli interventi sopraccitati hanno lo scopo di ripristinare un adeguato flusso ematico nella regione cardiaca a rischio di complicanze per mancata ossigenazione (Michaels et Chatterjee, 2002).
1.2
Tecniche di rivascolarizzazione
1.2.1 Angioplastica Coronarica Transluminale Percutanea (PTCA)
La PTCA transluminale è una metodica ampiamente diffusa per rivascolarizzare il miocardio in pazienti che presentano una cardiopatia ischemica sintomatica con stenosi prossimali delle coronarie. L'indicazione clinica più comune alla PTCA è l'angina pectoris, stabile o instabile, associata ad evidenza di ischemia alla valutazione ergometrica. I candidati ideali alla PTCA sono rappresentati da pazienti con sintomi di
13
ischemia che presentano stenosi prossimali a carico di uno o due vasi, e solo casi selezionati con malattia trivasale. La procedura, che ha l'obiettivo di migliorare il flusso ematico coronarico frammentando l' ateroma, consiste nel far avanzare nell' arteria che deve essere dilatata un catetere con un piccolo palloncino terminale. Quest'ultimo viene posizionato, con controllo radiografico, a cavallo della stenosi. Gonfiando il palloncino viene esercitata una pressione costante che frammenta e comprime l'ateroma (Figura 1.1).
Figura 1.1 PTCA e posizionamento di stent coronarico. (A) Un palloncino assottigliato viene guidato mediante catetere nella coronaria ostruita; una volta giunto in corrispondenza del restringimento vasale il dispositivo viene gonfiato per ripristinare un adeguato flusso sanguigno al tessuto miocardio a valle della coronaria rivascolarizzata. (B) uno stent che internamente reca un palloncino assottigliato viene posizionato in corrispondenza del sito di ostruzione coronarica. (C) Quando il palloncino viene gonfiato lo stent si dilata e fa espandere le pareti del vaso. (D) Il palloncino viene sgonfiato e rimosso dal vaso. Lo stent invece rimane posizionato nel vaso in modo permanente per impedirne il ritorno elastico e il rimodellamento negativo. In poche settimane lo stent viene ricoperto da nuovo tessuto (Modificata da Michaels et Chatterjee, 2002).
14
Il limite principale della PTCA è rappresentato dalla comparsa di una nuova stenosi sul vaso coronarico rivascolarizzato; quest’ultima si presenta entro i primi 6 mesi dall'intervento, riguarda il 3-5% dei pazienti rivascolarizzati e si ritiene dovuta principalmente alla combinazione di due fattori: il ritorno elastico vasale e l’iperplasia neointimale (Lubbe et al., 2001).
1.2.2 PTCA con impianto di stent
La difficoltà d'impiego dell'PTCA in alcuni tipi di lesione (calcifiche, eccentriche, ostiali, contenenti un trombo o lesioni in corrispondenza di biforcazioni vasali) e l'alta incidenza di ristenosi, hanno favorito lo sviluppo di nuova metodica che utilizza nella procedura di PTCA coronarica il posizionamento di stent, strutture metalliche endovascolari permanenti che mantengono la pervietà del lume vasale (Figura 1.1). Con l'adozione degli stent intracoronarici, divenuti di uso comune dall'inizio degli anni '90, è stato eliminato in gran parte il problema del ritorno elastico vasale e del rimodellamento vasale negativo. Tuttavia, l'iperplasia neointimale anche dopo l'impianto di stent è rimasta una delle principali cause di ristenosi che si verifica nel 15-20% dei casi trattati per lesioni coronariche semplici pre-intervento, arrivando anche al 60% dei casi trattati per lesioni complesse pre-intervento (Versaci et al., 1997). Inoltre, il rischio di ristenosi intra-stent è più elevato per i pazienti affetti da diabete, con vasi piccoli, con lunghe lesioni coronariche e con stent multipli embricati ("overlapping"stent).
Il principale meccanismo patologico responsabile della ristenosi intrastent è l’iperplasia intimale in quanto, la forza radiale della struttura metallica dell' endoprotesi è in grado di prevenire pressochè totalmente il fenomeno del ritorno elastico vasale (Mintz et al., 1996). I fattori predisponenti alla comparsa di iperplasia intimale sono principalmente quelli di natura infiammatoria e immunologica. Inoltre, da non sottovalutare, è anche la componente genetica individuale che svolge un ruolo determinante nella modulazione
15
della risposta infiammatoria e immunologica attivata a seguito dell’impianto di stent (Shirotani er al, 1993; Forrester et al., 1991).
1.2.3 PTCA con impianto di stent medicati
Recentemente sono stati introdotti sul mercato stent eluenti farmaci finalizzati a ridurre l'incidenza di ristenosi intra-stent. Il rivestimento dello stent con un farmaco (mediante supporto polimerico) permette la liberazione di una dose efficace di farmaco nella sede prescelta nell' arco di un periodo di settimane, con una tossicità sistemica trascurabile. La sicurezza e l'efficacia di questo approccio dipendono fortemente dalla delicata combinazione di farmaco, polimero e cinetica di rilascio. Diversi farmaci antiproliferativi ed immunosoppressivi si sono dimostrati in grado di ridurre l'iperplasia neointimale. Il sirolimus (Rapamune), un inibitore della crescita cellulare e dell' espressione delle citochine infiammatorie, è usato per la prevenzione del rigetto nel trapianto renale; anche il paclitaxel (Taxol), approvato per il trattamento del carcinoma ovarico, inibisce la replicazione cellulare, ma in una differente fase del ciclo cellulare. Liberati in loco, entrambi questi farmaci riducono la migrazione delle cellule muscolari lisce ed endoteliali e conseguentemente l'iperplasia neointimale ed i processi cicatriziali normalmente conseguenti all'impianto dello stent e responsabili della ristenosi intra-stent (Anderson, 2003). Il limite principale delle procedure di rivascolarizzazione che prevedono l'impianto di stent medicati è rappresentato dalla trombogenicità tardiva dello stent che può essere dovuta sia alla molecola farmacologica in esso inserita che può inibire il processo di riendotelizzazione del vaso che alla composizione del polimero deputato al rilascio del farmaco (Smith et al., 2006).
1.2.4 By pass aorto-coronarico (CABG) artero-venoso e artero-arterioso
Il CABG viene solitamente impiegato nei casi di gravi coronaropatie che non possono essere trattate alternativamente con i metodi percutanei. Tale intervento chirurgico
16
consiste nell'innesto di un segmento di vaso sanguigno ectopico che collega l'aorta con il tratto a valle dell' ostruzione al fine di ripristinare il flusso sanguigno. Per l'innesto è possibile utilizzare segmenti sia di arterie che di vene. Inizialmente i gli interventi di CABG venivano eseguiti esclusivamente con l'innesto di un segmento di vena safena mentre, attualmente si ritiene preferibile utilizzare allo stesso scopo l'arteria toracica interna detta anche mammaria che, nel tempo, permette di ottenere risultati clinici nettamente migliori (Mitra et al., 2006).
Durante la procedura chirurgica di CABG, il frammento di vaso ectopico subisce un danno immediato (trauma, ischemia, sforzo chirurgico sulla parete) che può causare, in una piccola percentuale di casi, l'occlusione iniziale per trombosi dell'innesto. Più tardivamente (nell’arco di settimane-mesi), eventuali complicanze sono imputabili al processo di arterializzazione del vaso ectopico causato dallo stress conseguente all'esposizione dello stesso alle elevate pressioni arteriose. In dettaglio, questo processo può determinare la comparsa di una stenosi nel graft venoso con conseguente rischio di ischemia e infarto per la regione cardiaca da quest’ultimo irrorata. Analogamente alla ristenosi dopo PTCA con o senza impianto di stent, la stenosi del CABG, comporta il rimodellamento costrittivo del vaso e la comparsa di iperplasia neointimale (Mitra et al., 2006). Diversamente, a distanza di anni dalla procedura di CABG artero-venoso, il principale processo patologico responsabile di complicanze è l'aterosclerosi venosa/arteriosa che può condurre a stenosi e talvolta occlusione del condotto (Barboriak et al., 1974; Grondin, 1986).
1.3
Ristenosi dopo PTCA e stenosi dei graft venosi
Attualmente, il limite principale delle tecniche di rivascolarizzazione percutanee è rappresentato dalla ristenosi, vale a dire dalla comparsa, entro i primi 6-12 mesi dopo l'intervento, di una nuova stenosi di tipo cicatriziale nel vaso coronarico sottoposto a
17
PTCA sia con che senza impianto di stent (Toutouzas et al., 2004). Diversamente il limite degli interventi di CABG è rappresentato dalla stenosi del vaso ectopico impiegato per l'innesto aorto-coronarico. In generale la frequenza di ristenosi dopo PTCA rappresenta il 30-40% dei casi, mentre a seguito dell'impianto di stent tale percentuale risulta ridotta e pari a circa il 20%.
Nonostante il risultato della ristenosi sia unico e comporti la perdita della pervietà del vaso rivascolarizzato, le cause che la determinano possono essere molto diverse a seconda del tipo di intervento di rivascolarizzazione effettuato sul vaso ovvero a seconda che si tratti di PTCA semplice o con impianto di stent. Più precisamente, la ristenosi dopo PTCA è il risultato di tre processi fondamentali quali: la risposta proliferativa neointimale delle VSMC della tonaca media, il ritorno elastico negativo del vaso a seguito dell'iniziale dilatazione meccanica conseguente all'espansione del palloncino e il rimodellamento vasale costrittivo dovuto a modificazioni della lamina elastica esterna del vaso (Meads et al., 2000). Diversamente a seguito dell'impianto di stent, il ritorno elastico del vaso risulta inibito dalla presenza delle maglie metalliche della protesi mentre risulta fortemente stimolato il processo di iperplasia neointimale che in tempi più o meno brevi può determinare la comparsa di ristenosi intra-stent (Wainwright et al., 2001).
1.4
Ristenosi intra-stent: meccanismi molecolari dell'iperplasia neointimale
In condizioni fisiologiche la parete vasale risulta composta da cellule endoteliali (EC), VSMC e ECM la cui composizione è variabile in funzione del diverso strato di appartenenza all'interno della parete vasale. Quest'ultima infatti risulta formata da tre diversi strati concentrici che, dal versante esposto verso il lume vasale a quello esposto in direzione tissutale, sono rappresentati dalle tonache intima, media e avventizia. In particolare, la tonaca intima è caratterizzata dalla presenza di un sottile strato di EC che
18
si affaccia sul versante luminale ed uno strato connetti vale sub-endoteliale che confina con la membrana elastica interna del vaso che separa la tonaca intima dalla sotto stante media. Diversamente, la composizione della tonaca media prevede svariati strati di VSMC immersi in una ECM composta da fibre elastiche, collagene e proteoglicani. Infine, la membrana elastica esterna è la struttura che separa la tonaca media dalla soprastante avventizia composta da fibroblasti, fibrille di collagene evasa vasorum, i vasi sanguigni che approvvigionano di nutrienti e ossigeno gli strati più esterni della parete vasale (Mitra et al., 2006).
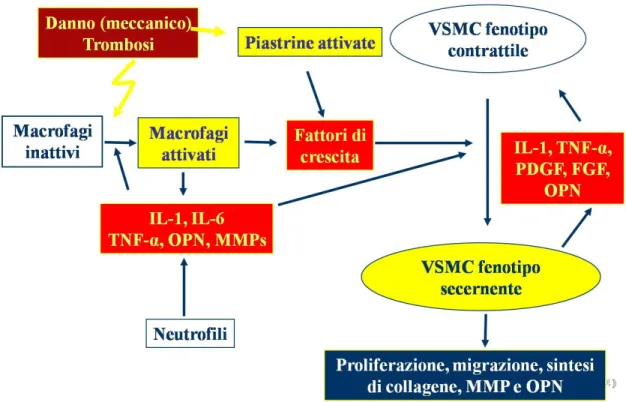
A seguito di danneggiamento della parete vasale, come ad esempio a seguito della procedura di PTCA con impianto di stent, la risposta riparatoria fisiologica attivata provoca, nei mesi succesivi all'intervento, il rimodellamento della stessa con la conseguente comparsa di un nuovo strato cellulare, la cosiddetta neointima caratterizzata dalla netta prevalenza di elementi cellulari di origine muscolare liscia. Quest'ultima solitamente risulta composta da nuova ECM, macrofagi, leucociti e VSMC con fenotipo simil-fibroblastico provenienti dalla tonaca media (Welt et Campbell, 2002). In dettaglio, le VSMC hanno origine nella tonaca media del vaso, ma hanno caratteristiche fenotipiche sempre più modificate e indifferenziate se si volge l'attenzione in direzione dell'intima del vaso. In questa sede, infatti, le cellule di origine mesenchimale della neointima risultano prive del fenotipo contrattile, tipico delle VSMC della tonaca media, e mostrano tratti fenotipici simil-fibroblastici tipici delle cellule con proprietà secementi. Questi elementi di tipo mesenchimale indifferenziato sono responsabili della sintesi e secrezione di ECM che si accumula nella neointima contribuendo allo spiccato incremento dello spessore parietale e alla riduzione del calibro residuo (Figura 1.2). Fra i principali stimoli responsabili del transdifferenziamento, proliferazione e conseguente migrazione delle VSMC vi sono le
citochine e fattori di crescita rilasciati dalle EC danneggiate, dalle piastrine e dai i macrofagi attivati (PDGF, ET
(TGF-α, NO), gli episodi di ischemia e riperfusione e, da ultimo, le condizioni emodinamiche a cui la parete vasale risulta soggetta (minore o maggiore stress di parete) (Mitra et al., 2006).
Figura 1.2 Principali processi responsabili dell'attivazione della risposta iperplasica a seguito di danno a carico della parete vascolare: danno endoteliale, aggregazione piastrinica, risposta infiammatoria e transdifferenziamento delle VSMC (modificata da Erlinge D., 199
Nei successivi paragrafi saranno esaminati i principali processi implicati nella comparsa di ristenosi intra-stent ovvero, impianto dello stent, adesione, attivazione piastrinica e formazione del trombo, infiammazione locale e sistemica, infezioni e
proliferazione e migrazione delle VSMC, apoptosi delle VSMC, rimodellamento della ECM e retrazione del coagulo con sintesi di nuova matrice.
1.4.1 Impianto dello stent
Il danno a carico della parete vasale che si verif
rivascolarizzazione comporta un grado variabile di denudazione endoteliale con conseguente esposizione dello strato sub
infiammazione locale (Mitra et al., 2006). La risposta co
della parete vasale consiste inizialmente nella formazione di un nuovo strato di proteine 19
citochine e fattori di crescita rilasciati dalle EC danneggiate, dalle piastrine e dai i macrofagi attivati (PDGF, ET-1, FGF), la ridotta produzione di inibitori della crescita , NO), gli episodi di ischemia e riperfusione e, da ultimo, le condizioni emodinamiche a cui la parete vasale risulta soggetta (minore o maggiore stress di parete) (Mitra et al., 2006).
pali processi responsabili dell'attivazione della risposta iperplasica a seguito di danno a carico della parete vascolare: danno endoteliale, aggregazione piastrinica, risposta infiammatoria e transdifferenziamento delle VSMC (modificata da Erlinge D., 199
Nei successivi paragrafi saranno esaminati i principali processi implicati nella comparsa di stent ovvero, impianto dello stent, adesione, attivazione piastrinica e formazione del trombo, infiammazione locale e sistemica, infezioni e
proliferazione e migrazione delle VSMC, apoptosi delle VSMC, rimodellamento della ECM e retrazione del coagulo con sintesi di nuova matrice.
Impianto dello stent
Il danno a carico della parete vasale che si verifica a seguito delle procedure di rivascolarizzazione comporta un grado variabile di denudazione endoteliale con conseguente esposizione dello strato sub-endoteliale trombogenico del vaso, trombosi e infiammazione locale (Mitra et al., 2006). La risposta conseguente al danneggiamento della parete vasale consiste inizialmente nella formazione di un nuovo strato di proteine citochine e fattori di crescita rilasciati dalle EC danneggiate, dalle piastrine e dai i dotta produzione di inibitori della crescita , NO), gli episodi di ischemia e riperfusione e, da ultimo, le condizioni emodinamiche a cui la parete vasale risulta soggetta (minore o maggiore stress di
pali processi responsabili dell'attivazione della risposta iperplasica a seguito di danno a carico della parete vascolare: danno endoteliale, aggregazione piastrinica, risposta infiammatoria e transdifferenziamento delle VSMC (modificata da Erlinge D., 1998).
Nei successivi paragrafi saranno esaminati i principali processi implicati nella comparsa di stent ovvero, impianto dello stent, adesione, attivazione piastrinica e formazione del trombo, infiammazione locale e sistemica, infezioni e autoimmunità, proliferazione e migrazione delle VSMC, apoptosi delle VSMC, rimodellamento della
ica a seguito delle procedure di rivascolarizzazione comporta un grado variabile di denudazione endoteliale con endoteliale trombogenico del vaso, trombosi e nseguente al danneggiamento della parete vasale consiste inizialmente nella formazione di un nuovo strato di proteine
20
e piastrine seguito dal rapido richiamo di leucociti e monociti dal lume vasale verso l'intima del vaso. Questo processo è seguito dal trans-differenziamento, proliferazione e migrazione delle VSMC delle tuniche media e/o avventizia e dalla deposizione di nuova ECM a livello della tunica intima dove si assiste, a seguito di diverse settimane, alla comparsa della cosiddetta neointima (Figura 1.3). Pertanto, a seguito delle procedure di rivascolarizzazione, l'iniziale grado di danneggiamento della parete vasale è un importante indice dell'entità finale della risposta riparatoria attivata (Mitra et al., 2006). Ad esempio, una lesione limitata a carico dell'endotelio vasale dell'arteria rivascolarizzata può limitare la proliferazione cellulare, la risposta riparatoria del vaso lesionato e ridurre così il grado di iperplasia neointimale e la comparsa di ristenosi. Ad esempio, il trapianto di EC perivascolari è stato osservato essere in grado di ridurre l'ispessimento neointimale in modelli bovini e suini di danno carotideo. Questo a supporto dell'ipotesi che esista una regolazione paracrina della risposta riparatoria vasale attivata esercitata dalle molecole rilasciate in loco dalle EC danneggiate (Mitra et al., 2006).
Figura 1.3 Processi fisiopatologici responsabili della comparsa di ristenosi intra da Welt et Rogers, 2002).
1.4.2 Adesione, attivazione piastrinica e formazione del tr
In condizioni fisiologiche la lesione di un vaso causa vasocostrizione, seguita da un accumulo di piastrine nella sede del trauma e dalla formazione di un reticolo di fibrina attorno alla massa piastrinica, sicché il lume del vaso gradualmente si rest
effetto del tappo emostatico (Mitra et al., 2006). La formazione del tappo piastrinico è uno degli eventi più precoci conseguenti al danneggiamento della parete vasale anche a seguito dei principali interventi di rivascolarizzazione e la sua enti
essere positivamente correlata al grado di danno intimale (Wilentz et al., 1987). Tale evento è un processo che si attua in più fasi: adesione, aggregazione ed attivazione piastrinica. La denudazione dell'endotelio vasale determina ini
della matrice sub-endoteliale al flusso sanguigno. Il collagene subendoteliale, a sua volta, fa da richiamo per le piastrine che così vi aderiscono e si aggregano fra loro a
21
Processi fisiopatologici responsabili della comparsa di ristenosi intra
Adesione, attivazione piastrinica e formazione del trombo
In condizioni fisiologiche la lesione di un vaso causa vasocostrizione, seguita da un accumulo di piastrine nella sede del trauma e dalla formazione di un reticolo di fibrina attorno alla massa piastrinica, sicché il lume del vaso gradualmente si rest
effetto del tappo emostatico (Mitra et al., 2006). La formazione del tappo piastrinico è uno degli eventi più precoci conseguenti al danneggiamento della parete vasale anche a seguito dei principali interventi di rivascolarizzazione e la sua entità è stata osservata essere positivamente correlata al grado di danno intimale (Wilentz et al., 1987). Tale evento è un processo che si attua in più fasi: adesione, aggregazione ed attivazione piastrinica. La denudazione dell'endotelio vasale determina inizialmente l'esposizione endoteliale al flusso sanguigno. Il collagene subendoteliale, a sua volta, fa da richiamo per le piastrine che così vi aderiscono e si aggregano fra loro a
Processi fisiopatologici responsabili della comparsa di ristenosi intra-stent (modificata
In condizioni fisiologiche la lesione di un vaso causa vasocostrizione, seguita da un accumulo di piastrine nella sede del trauma e dalla formazione di un reticolo di fibrina attorno alla massa piastrinica, sicché il lume del vaso gradualmente si restringe per effetto del tappo emostatico (Mitra et al., 2006). La formazione del tappo piastrinico è uno degli eventi più precoci conseguenti al danneggiamento della parete vasale anche a tà è stata osservata essere positivamente correlata al grado di danno intimale (Wilentz et al., 1987). Tale evento è un processo che si attua in più fasi: adesione, aggregazione ed attivazione zialmente l'esposizione endoteliale al flusso sanguigno. Il collagene subendoteliale, a sua volta, fa da richiamo per le piastrine che così vi aderiscono e si aggregano fra loro a
22
formare il cosiddetto tappo piastrinico. L'adesione piastrinica è un evento che coinvolge il recettore piastrinico GpIb, il fattore plasmatico di von Willebrand e la fibronectina, mentre la loro aggregazione è un evento mediato dal fattore tissutale, la fibronectina, il fattore di von Willebrand ed il recettore piastrinico GpIIb- IIIa. A seguito della aggregazione le piastrine divengono attivate e rilasciano granuli contenenti serotonina, adenosina difosfato (ADP) ed attivano la via di sintesi dell'acido arachidonico per produrre il trombossano A2, una molecola con potente attività sia di chemochina che di citochina nei confronti delle VSMC. L’estrusione dei granuli piastrinici può avvenire a seguito della contrazione dei filamenti miosinici (causata dalla mobilizzazione del calcio a sua volta derivata dalla fosforilazione del fosfatidilinositolo) di cui sono dotate le piastrine, oppure all'azione di una particolare proteina, la P47 che può essere fosforilata e quindi attivata dalla protein chinasi C preventivamente attivata in conseguenza della stimolazione della via di trasduzione del segnale mediata dal diacilglicerolo (DAG). Una volta attivate, le piastrine rilasciano numerose molecole che svolgono un importante ruolo di promozione nei confronti dei processi di migrazione e proliferazione delle VSMC (Lee et al., 2004). Queste sostanze includono alcuni fattori di crescita, quali il fattore di crescita di derivazione piastrinica (PDGF), il fattore di crescita tumorale (TGF)-β, le citochine IL-1, IL-6 et IL-8 e la trombina. L'attivazione piastrinica quindi, grazie anche al rilascio della trombina è in grado di determinare la formazione del trombo e l'espressione del fattore tissutale attraverso il ligando CD40L, una proteina transmembrana che si ritrova solitamente contenuta nei granuli a delle piastrine (Henn et al., 1998). Il CD40L è a sua volta responsabile dell'induzione dell'espressione di alcune molecole di adesione, che rendono possibile l'adesione dei leucociti alla superficie endoteliale. Alcuni eventi che si verificano sulla superficie delle piastrine possono avvenire sia prima che dopo l'attivazione piastrinica. Ad esempio la molecola P-selectina, una molecola di adesione contenuta nei granuli alfa, può legarsi al
23
ligando l per la P-selectina (PSGL-l) che si ritrova sulla superficie dei leucociti e determiname l'attivazione con conseguente induzione di una risposta infiammatoria locale (Mitra et al., 2006).
1.4.2.1 Formazione del trombo
Dopo la rottura degli strati più interni della placca aterosc1erotica, il danno vascolare che ne deriva è responsabile dell'esposizione del fattore tissutale (TF) alla circolazione sanguigna, evento causale della attivazione della cascata coagulativa estrinseca che determina, a seguito dell' attivazione della protrombina, la trasformazione del fibrinogeno in fibrina. Il TF è una glicoproteina della parete vasale che assieme ai monociti è in grado di promuove la cascata coagulativa legandosi al fattore VII della coagulazione. Recentemente, Huynh et al. (Huynh et al., 2001) hanno ossevato che un aumento dell' espressione intimale di TF precede lo sviluppo di iperplasia neointimale a livello di CABG venosi; infatti l'inibizione dell'attività del TF riduce la risposta trombogenica e l'iperplasia neointimale stessa. La trombina attivata a sua volta è in grado di stimolare la proliferazione delle VSMC sia per via diretta che indiretta inducendo le piastrine a liberare il fattore di crescita derivante dalle piastrine (PDGF), un potente mitogeno per le VSMC (Hasenstab et al., 2000; Huynh et al., 2001). La risultante dell'attivazione della trombina è rappresentata dalla polimerizzazione della fibrina con conseguente formazione del coagulo di sangue (Giesen et al., 1999). A sua volta, la presenza di fibrina e trombina sul luogo della lesione può richiamare le piastrine dal circolo e dare inizio alla formazione del trombo ovvero di una massa solida costituita da un reticolo di fibrina contenente piastrine e/o globuli rossi e bianchi e/o i loro prodotti di disfacimento (McNamara et al., 1996).
Pertanto, il processo di formazione del trombo può essere riassunto in tre fasi: • inizio ad opera delle cellule presentanti TF;
24
• amplificazione sulla superficie piastrinica attivata che risulta così in grado di rilasciare trombina;
• propagazione ad opera di notevoli quantità di trombina e trombossano A2 sulla superficie piastrinica responsabili rispettivamente della polimerizzazione della fibrina e dell 'ulteriore richiamo ed aggregazione di piastrine nella sede di danno vascolare (Mitra et al., 2006).
La formazione di un trombo in un vaso, a sua volta, può determinare la chiusura totale o parziale di un vaso sanguigno, oppure, disgregandosi, l'embolia, eventi, talvolta, responsabili dell'insuccesso precoce delle procedure di rivascolarizzazione. Le cause di questo effetto indesiderato possono essere dovute sostanzialmente a:
• una eccessiva esposizione di materiale proaggregante (fibrina e trombina) che altera la componente ematica e causa un aumento dell' aggregabilità piastrinica e altresì delle dimensioni del coagulo;
• una conseguente riduzione del flusso ematico nel vaso ormai parzialmente ostruito dalla placca che provoca aggregazione di globuli rossi e bianchi al suo interno e conseguentemente un ulteriore protrusione della placca all'interno del lume vasale. 1.4.3 Infiammazione locale e sistemica
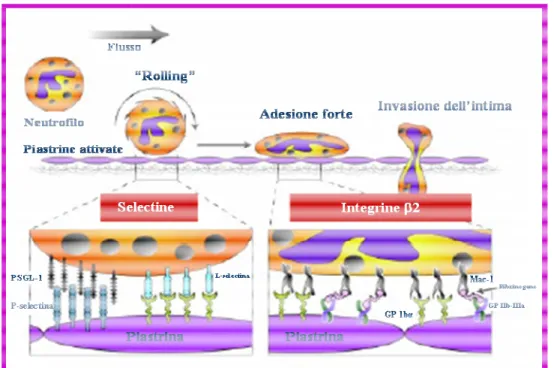
L'insorgenza dell'infiammazione cronica è il risultato del reclutamento di leucociti nella sede del danneggiamento vasale e costituisce uno dei punti chiave del processo di ristenosi. Inizialmente i leucociti aderiscono e poi rotolano con un processo di rolling sulle piastrine adese alla superfice vasale danneggiata. Questi eventi sono mediati dall'interazione fra la molecola di membrana piastrinica P-selectina e il ligando leucocitario PSGL-1 (Diacono et al., 1996) (Figura 1A). A seguito dell'attivazione i leucociti rotolano in modo scoordinato sulle piastrine adese all'endotelio e,
25
successivamente oltrepassano la barriera piastrinica per diapedesi migrando all'interno della parete vasale. Questi eventi sono mediati dall'interazione dell'integrina leucocitaria Mac1 (Diacovo et al., 1996) con i recettori piastrinici ICAM 2 (Diacovo et al., 1994) e GPIba. L'accumulo dei leucociti polimorfonucleati avviene nelle prime 6-24 h dopo il danno, a differenza dei linfociti T e dei monociti che appaiono dopo 2-14 giorni e 3-8 giorni, rispettivamente. Il reclutamento dei leucociti non è casuale; altresì, quest'ultimo è rivolto in direzione del gradiente di chemochine generato nella ECM ad opera delle VSMC, EC e delle cellule infiammatorie già presenti nel vaso al momento di danneggiamento dello stesso. Ad esempio, l'IL-8 stimola il reclutamento dei neutrofili, mentre altre citochine, quali IL-1, IL-6, e TNF (tumor necrosis factor)-α in associazione con le specie reattive dell'ossigeno, enzimi proteolitici e fattori di crescita, sembrano svolgere un ruolo importante di modulazione della risposta infiammatoria (Wainwright et al., 2001).
Inoltre, è stato osservato che la risposta infiammatoria attivata a seguito del danneggiamento della parete vasale è proporzionale al grado di danneggiamento della stessa. Questo giustifica il fatto che, dal momento che lo stenting è la procedura di rivascolarizzazione che più si associa ad un marcato danneggiamento della parete vasale, quest'ultima è anche quella che risulta associata ad una più spiccata risposta infiammatoria con un elevato tasso di reclutamento di cellule infiammatorie di cui in particolare neutrofili e monociti/macrofagi (Horvath et al., 2002; Inoue et al., 2000). Inoltre, anche la tunica avventizia svolge un ruolo importante nell'insorgenza di iperplasia neointimale, infatti qualora danneggiata quest'ultima può dare infiammazione poiché in grado di richiamare leucociti e neutrofili dal circolo attraverso la molecola E-selectina e contribuire all'induzione del fenomeno iperplasico (Gotoh et al., 2004).
Figura 1.4 Processi di reclutamento, rolling e invasione della plasmatici (modificata da Diacovo et al., 1996).
1.4.4 Infezioni e autoimmunità nell’aterosclerosi e nella ristenosi Oltre allo stress meccanico a carico d
a livello locale o sistemico e la preesist
determinare la comparsa o contribuire alla risposta infiammatoria cronica e autoimmune che risulta attiva nella maggior
maggioranza dei soggetti che si sottopongono ad interventi di rivascolarizzazione. Pertanto, in quest’ottica, anche le componenti infettiva e autoimmune sembrano essere
importanti fattori predisp
attivata a seguito di impianto di stent. Ad esempio, in un modello sperimentale di ristenosi dopo PTCA nell’arteria carotidea di ratto, è stato osservato che, indipendentemente dai livelli di col
micobatterica (con richiamo a 3 settimane prima dell’intervento) è in grado di determinare un’aumentata risposta iperplasica e un’aumentato rapporto intima/media rispetto alla condizione di controllo non imm
26
Processi di reclutamento, rolling e invasione della parete vasale da parte dei plasmatici (modificata da Diacovo et al., 1996).
Infezioni e autoimmunità nell’aterosclerosi e nella ristenosi
Oltre allo stress meccanico a carico della parete vasale, anche la presenza di agenti infettivi a livello locale o sistemico e la preesistenza di malattie autoimmuni, possono determinare la comparsa o contribuire alla risposta infiammatoria cronica e autoimmune che risulta attiva nella maggior parte dei pazienti affetti da aterosclerosi e quindi nella maggioranza dei soggetti che si sottopongono ad interventi di rivascolarizzazione. Pertanto, in quest’ottica, anche le componenti infettiva e autoimmune sembrano essere
importanti fattori predisponenti e regolatori nei confronti della risposta iperplasica attivata a seguito di impianto di stent. Ad esempio, in un modello sperimentale di PTCA nell’arteria carotidea di ratto, è stato osservato che, indipendentemente dai livelli di colesterolo, la precedente immunizzazione con
micobatterica (con richiamo a 3 settimane prima dell’intervento) è in grado di determinare un’aumentata risposta iperplasica e un’aumentato rapporto intima/media rispetto alla condizione di controllo non immunizzata (Stansby et al., 2002)
parete vasale da parte dei leucociti
ella parete vasale, anche la presenza di agenti infettivi enza di malattie autoimmuni, possono determinare la comparsa o contribuire alla risposta infiammatoria cronica e autoimmune parte dei pazienti affetti da aterosclerosi e quindi nella maggioranza dei soggetti che si sottopongono ad interventi di rivascolarizzazione. Pertanto, in quest’ottica, anche le componenti infettiva e autoimmune sembrano essere
onenti e regolatori nei confronti della risposta iperplasica attivata a seguito di impianto di stent. Ad esempio, in un modello sperimentale di PTCA nell’arteria carotidea di ratto, è stato osservato che, esterolo, la precedente immunizzazione con HSP65 micobatterica (con richiamo a 3 settimane prima dell’intervento) è in grado di determinare un’aumentata risposta iperplasica e un’aumentato rapporto intima/media (Stansby et al., 2002). Inoltre, in
27
tali animali non è stata riscontrata alcuna variazione nella percentuale di cellule infiammatorie presenti nella parete vascolare trattata nelle due diverse condizioni sperimentali a conferma che il danno meccanico inferto durante la procedura di PTCA nei due diversi gruppi di animali è stato di entità paragonabile. Pertanto l’aumentata risposta iperplasica osservata nei ratti immunizzati con HSP65 dipende unicamente dalla risposta autoimmune attivata a seguito di tale trattamento. Un ulteriore conferma di queste osservazioni deriva da uno studio condotto su un modello sperimentale di danno arterioso nel topo dove, l’iniezione ripetuta di gammaglobuline umane effettuata per 5 giorni a partire dal giorno precedente all’intervento, si è rivelata in grado di ridurre significativamente la risposta iperplasica ed il rapporto intima/media rispetto ai topi di controllo (Suzuki et al., 2004). Questo probabilmente a causa di un’aumentata secrezione dell’interleuchina IL-10 da parte dei linfociti Thelper (CD4+) attivati. Recentemente, anche nell’uomo è stato condotto uno studio in vivo per indagare il ruolo svolto dal livello serico degli anticorpi anti-HSP65 nella comparsa di ristenosi dopo PTCA a 6 mesi dall’intervento. Da tale studio è emerso che, indipendentemente dal sesso, dall’età e dai livelli di anticorpi anticardiolipina, un significativo calo nel livello serico anticorpale anti-HSP65 immediatamente a seguito della PTCA e al momento della dimissione dall’ospedale, è associato ad una prognosi migliore ovvero alla mancata comparsa di ristenosi dopo PTCA (Mukherjee et al., 1996). Pertanto, la presenza di anticorpi anti-HSP65 sembra essere un marker di prognosi nel caso della ristenosi dopo PTCA senza impianto di stent sia nell’uomo che nell’animale a conferma del ruolo regolatorio svolto dai processi infettivi ed autoimmuni nella comparsa di ristenosi dopo PTCA.
28 1.4.5 Proliferazione e migrazione delle VSMC
In risposta all’impianto di stent, le VSMC vanno incontro ad una modulazione fenotipica passando da uno stato contrattile quiescente ad uno stato proliferativo mobile, che stimola la loro proliferazione e migrazione a livello della tonaca intima dove vanno a costituire la neointima (Libby et al., 1997; Schwartz, 1997a; Schwartz, 1997b). I principali fattori ritenuti responsabili di questo processo di rimodellamento della componente cellulare del vaso sono i fattori di crescita, le citochine e le chemochine presenti nella ECM e rilasciate dalle stesse VSMC, EC danneggiate, piastrine, leucociti e macrofagi attivati nella sede di danneggiamento vasale (Mitra et al., 2006) (Figura 1.5). La proliferazione rappresenta la fase critica della formazione della neointima: a partire dal 7° fino al 30° giorno a seguito del danno endoteliale vasale, il transdifferenziamento e conseguente proliferazione e migrazione delle VSMC determina una vera e propria invasione dell'intima che per questo va incontro ad una profonda alterazione strutturale (Allaire et Cloves, 1997). I meccanismi biochimici coinvolti nel transdifferenziamento delle VSMC e nel loro ingresso nel ciclo cellulare non sono ancora del tutto noti, ma alcune delle molecole implicate nella stimolazione della proliferazione delle VSMC sono state individuate. Fra queste ultime, ad esempio, vi sono il PDGF, il fattore di crescita insulino-simile (IGF)-I, la trombina, il fattore di crescita fibroblastico (FGF), il fattore di crescita endoteliale vascolare (VEGF), il TGFβ, il TNF-α,l'osteopontina (OPN) e le interleuchine (IL)-1 e -6 (Wainwright et al., 2001); queste ultime solitamente vengono secrete in gran quantità a seguito del danneggiamento della parete vasale ad opera di cellule coinvolte nella fonnazione della neointima, quali leucociti, macrofagi, linfociti T e piastrine attivate (Mitra et al., 2006).
29
Figura 1.5 Il modello a cascata di citochine e fattori di crescita. L' espressione di cito chine e fattori di crescita è un meccanismo a feedback positivo autocrino e paracrino in grado di auto sostenersi e di far protrarre nel tempo la risposta infiammatoria conseguente alla iniziale lesione del vaso dopo PTCA e posizionamento di stent, responsabile della comparsa, in tempi successivi, di iperplasia neointimale e ristenosi intra-stent (modificata da Libby et al., 1992).
1.4.6 Apoptosi delle VSMC
La proliferazione e la migrazione delle VSMC della tunica media costituiscono un punto chiave per la crescita della neointima, sebbene da soli non possano rendere conto del fenomeno della ristenosi in toto. Infatti, altri processi fondamentali per la formazione della neointima sono l'apoptosi delle VSMC che, assieme alla proliferazione delle stesse, è responsabile del rimodellamento della componente cellulare del vaso, l'infiammazione locale e il rimodellamento della ECM del vaso. A seguito delle principali procedure di rivascolarizzazione, infatti, l'insulto iniziale provocato sulla parete vasale solitamente è responsabile della morte cellulare per necrosi e/o apoptosi
30
delle VSMC della tunica media. Entrambi questi processi costituiscono, nella fase acuta di insulto, uno stimolo sia per il rimodellamento della componente cellulare del vaso che, relativamente alla necrosi, per l'infiammazione locale (Mayr et Xu, 2001). Inoltre, studi in vivo su modelli animali hanno messo in evidenza che il processo apoptotico è presente e svolge un ruolo chiave anche nelle fasi successive che da ultimo sfociano nell'iperplasia neointimale (Alcocer et al., 2001). Questa condizione può essere favorita da diversi fattori quali una persistenza dei corpi apoptotici a causa di una clearence ridotta da parte dei macrofagi tissutali, una più tardiva entrata delle VSMC nel ciclo apoptotico a causa di un iniziale danno subletale, una successiva esposizione a fattori pro-apoptotici e inadeguati livelli di citochine che possono provocare l’arresto del ciclo mitotico e quindi l’apoptosi delle VSMC in attiva proliferazione (Angelini et al., 2002). L'apoptosi è un fenomeno tipico delle cellule degli organismi pluricellulari, anche se si avvale di prodotti genici in parte presenti negli organismi unicellulari cui, come spesso accade, l'evoluzione ha attribuito nuove funzioni. Le cellule degli organismi pluricellulari non esprimono tutti i geni in loro possesso, ma attivano di volta in volta "pacchetti di geni specifici", cui corrispondono specifici "programmi cellulari": la morte per apoptosi è per l'appunto uno di questi programmi, alla pari del differenziamento e della divisione cellulare, e comporta, come gli altri programmi, una complessa rete di segnalazione inter-cellulare e un processo decisionale interno alla cellula stessa, nel quale vengono soppesate le varie opzioni presentate dai segnali che giungono alla cellula (Erickson, 1997). La morte per apoptosi pelmette alla cellula di morire senza provocare l'insorgenza di una risposta infiammatoria come altresì si verifica ad esempio a seguito del processo di necrosi cellulare. Le cellule che vanno incontro ad apoptosi sono solitamente facilmente riconoscibili grazie alla presenza di alcuni segni caratteristici all'esame microscopico quali, ad esempio, i cambiamenti nella
31
composizione della membrana plasmatica, la perdita di volume, la perdita della membrana mitocondriale, il condensarnento della cromatina e la frammentazione del DNA. La cellula muore rompendosi in piccoli frammenti circondati da membrana (corpi apoptotici), che vengono poi rapidamente fagocitati dai macrofagi tessutali impedendo così l'insorgenza di alcun processo infiammatorio (Erickson, 1997).
Una delle funzioni dell'apoptosi all'interno di un organismo pluricellulare è quello di contribuire, insieme alla mitosi, al mantenimento dell'omeostasi numerica. È evidente che i due processi si devono equilibrare tra loro in ogni tessuto e in ogni momento della vita dell'organismo (nell'accrescimento come nella vita adulta, nel normale turn over come in presenza di patologie) e che un loro squilibrio può avere conseguenze anche potenzialmente molto gravi (aplasia o iperplasia), quali ad esempio l'insorgenza di cancro, di sindrome da Immunodeficienza Acquisita (AIDS) e di ristenosi, situazioni caratterizzate o da un'iperattivazione o da una soppressione della morte cellulare programmata (Reed, 2000). Un ruolo molto importante in tale regolazione è giocato dai fattori di crescita, che non hanno solo la funzione di indurre le cellule bersaglio alla proliferazione, ma svolgono il ruolo di veri e propri fattori di sopravvivenza: molti tipi cellulari sembra abbiano insito un "programma di morte", che solo la continua presenza di fattori di sopravvivenza impedisce di attuare.
L'apoptosi, pur diversificandosi da organismo ad organismo e spesso da cellula a cellula nel medesimo organismo, può essere suddivisa in quattro fasi principali e ricorrenti: l'induzione, l'esecuzione, il riconoscimento e la fagocitosi. Esistono molteplici vie di induzione dell'apoptosi che differiscono fra loro sia in base allo stimolo iniziale che agli effettori biochimici implicati nelle diverse vie di trasduzione del segnale attivate. In particolare, la fase di induzione del processo apoptotico vede coinvolti numerosi fattori quali per esempio il trattamento con TNF o farmaci citotossici, radiazioni ionizzanti e
32
UV, shock da calore, ipossia e infezioni virali (Israels, 1999). Altri stimoli importanti sono la rimozione dei fattori di crescita presenti nel siero (Petmann et Henderson, 1998) e la riduzione di disponibilità di molecole di ATP. In particolare, se il calo di ATP è massiccio ed improvviso, la cellula muore per necrosi mentre se è più moderato, muore per apoptosi (Leist et al., 1997). L'ATP è inoltre necessario per l'attivazione della procaspasi-9 e quindi per la condensazione e la frammentazione nucleare nelle fasi finali del processo (Granville et al. 1998). La fase di esecuzione sembra essere comune a tutte o quasi le vie d'innesco ed è costituita da una serie di reazioni enzimatiche a cascata in un certo modo paragonabili a quelle del complemento o della coagulazione del sangue che, una volta innescate, procedono automaticamente portando inevitabilmente la cellula alla morte; è in questa fase che entrano in gioco le caspasi esecutrici. Le restanti fasi del processo apoptotico ovvero, il riconoscimento e la fagocitosi, avvengono nei tessuti,dove i corpi apoptotici vengono riconosciuti e rapidamente fagocitati dalle cellule circostanti e/o dai macrofagi e degradati all'interno dei lisosomi. Sono stati finora identificati tre diversi sistemi mediante i quali i fagociti riconoscono i corpi apoptotici.
A seconda del tipo cellulare e del fagocita interessato possono essere utilizzati il recettore delle asialoglicoproteine, quello della vitronectina (VnR)/CD36, o quello della fosfatidilserina (PS) (Savill et Fadok, 2000). Si pensa che la scelta del meccanismo di riconoscimento usato dai fagociti sia influenzato, oltre che dal tipo cellulare coinvolto, anche da stimoli provenienti dal microambiente. quale che sia la modalità con cui le cellule ed i corpi apoptotici vengono riconosciuti e fagocitati, il risultato finale è sempre quello di un'eliminazione pulita, senza sconvolgimento dell'architettura strutturale del tessuto e senza innesco di un processo infiammatorio.
33
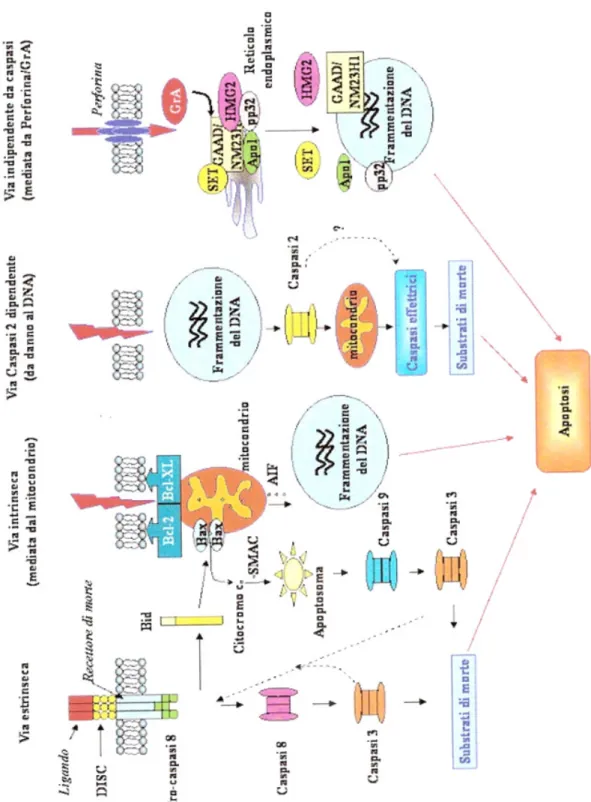
Come sopra anticipato l'apoptosi può essere indotta da molteplici stimoli, sia intra- che extra-cellulari, i quali attivano diverse vie di induzione del processo in questione (figura 1.6). In particolare, la via di induzione estrinseca richiede la presenza di recettori nella membrana citoplasmatica e coinvolge la caspasi-8; la via intrinseca è incentrata sul ruolo svolto dai mitocondri e coinvolge la caspasi-9 (Hengartner, 2000). Un'altra via è caratterizzata dal danneggiamento del DNA che può indurre l'attivazione della caspasi2. Recentemente, sono state individuate anche altre vie di induzione che coinvolgono il reticolo endoplasmatico: una di queste è indipendente dall'azione delle caspasi mentre un'altra porta all'attivazione della caspasi-12.
Figura 1.6 Vie di trasduzione del segnale per l’induzione del processo apoptotico da Orrenius et al., 2003).
34
Vie di trasduzione del segnale per l’induzione del processo apoptotico
35 1.4.7 Rimodellamento della ECM
Analogamente all'infiammazione e al rimodellamento della componente cellulare del vaso, anche il rimodellamento della ECM sembra svolgere un ruolo essenziale per la progressione del fenomeno iperplasico in quanto consente la migrazione delle VSMC dalla tunica media verso l'intima del vaso. La ECM di un vaso sano solitamente è composta da un insieme di proteine fibrose, glicoproteine di vario genere, glicosamminoglicani e proteoglicani. Queste molecole sono organizzate in una rete altamente ordinata e strettamente associata alle cellule vascolari che ne sono le dirette produttrici. Inoltre, la ECM oltre a fornire una struttura di supporto e sostegno alla parete vasale svolge anche un ruolo regolatore nei confronti dei processi di migrazione, proliferazione e sopravvivenza delle VSMC che sono particolarmente importanti qualora il vaso venga danneggiato e debba andare incontro ad un processo di riparazione. La composizione della ECM nelle lesioni intimali che caratterizzano il processo di ristenosi e aterosclerosi è molto diversa da quella del vaso originario ed è caratterizzata dalla presenza di numerosi monociti, linfociti provenienti dal circolo e VSMC simil-fibroblastiche migrate in tale sede a partire dalla tonaca media del vaso. La diversa composizione della parete vasale che si osserva a seguito dei processi patologici sopraccitati è, per lo più, una conseguenza del fenomeno di rimodellamento della ECM che può essere indotto inizialmente da svariati tipi di insulto. Fra i principali effettori coinvolti in questo processo di rimodellamento vi sono numerosi enzimi proteolitici quali ad esempio le metalloproteasi di matrice (MMP) e le catepsine. L'espressione, il rilascio e l'attivazione di tali proteasi nella ECM sono eventi finemente regolati ed una perdita di tale regolazione può favorire lo sviluppo di patologie correlate con un anomalo rimodellamento della ECM quali, ad esempio, i fenomeni iperplasici (Sierevogel et al., 2003). In vitro, l'impiego di inibitori delle MMP ha permesso di
36
evidenziare l'importanza del ruolo svolto dalle MMP nei processi di migrazione e proliferazione delle VSMC dalla tonaca media verso l'intima del vaso.
1.4.8 Retrazione del coagulo e sintesi di nuova matrice
Dopo un lungo periodo a seguito dell'insulto arrecato dalle procedure di impianto dello stent, il coagulo inizialmente presente nella sede vasale danneggiata può essere riassorbito e, a sua volta, il vaso può andare incontro ad un processo di riendotelializzazione , anche se talvolta solo parziale. La riendotelializzazione del sito danneggiato può, a sua volta, causare una cessazione della proliferazione delle VSMC, probabilmente a causa della ripristinata attività antiproliferativa dello NO e dell'eparina. Come conseguenza, questa situazione, associata all'aumentato rilascio di PDGF e TGF-β, può determinare a livello intimale un'aumentata secrezione di collagene, elastina e proteoglicani da parte delle VSMC migrate, provocando un ulteriore aumento del volume neointimale totale (Mitra et al., 2006). Questo fenomeno spiega la composizione di alcune placche ristenotiche che mostrano, talvolta, uno scarso numero di VSMC a raffronto di una elevata componente fibrotica.
1.5
Iperplasia neointimale: Effettori Biochimici
1.5.1 Infiammazione locale e sistemica
1.5.1.1 Infiammazione locale
1.5.1.1.1 Citochine e fattori di crescita
La ristenosi coinvolge meccanismi multipli che includono, nella fase iniziale, la risposta trombotica e infiammatoria, seguita da proliferazione di VSMC vascolari e la produzione di ECM. Il processo infiammatorio può essere considerato come quel meccanismo che dà l'avvio al processo di ristenosi: si assiste infatti all'infiltrazione di monociti e macrofagi nello strato muscolare liscio vascolare. La produzione da parte di
37
questi ultimi di vari fattori chemotattici, fattori di crescita e citochine è associata con la formazione della neointima. Fattori di crescita come quello dei fibroblasti (FGF)-β, quello piastrinico (PDGF), quello insulino-simile (IGF)-l e quello trasformante (TGF)-β sono coinvolti nello sviluppo dell'iperplasia neointimale e sono tutti in grado di indurre la sintesi ed il rilascio di OPN da parte dei macrofagi, neutrofili e delle VSMC attivate. In particolare, il PDGF gioca un ruolo significativo nella regolazione dell'OPN, probabilmente attraverso il recettore PDGF-β; analogamente, l'interleuchina (IL)-lβ, importante composto infiammatorio e attivatore mitogeno, esercita un importante effetto sulla up regulation di OPN da parte di VSMC neutrofili e macrofagi tissutali. A differenza dei fattori di crescita, con il termine citochine si intende una classe eterogenea
di proteine secretorie che hanno la funzione di condizionare il comportamento di altre cellule-specifiche verso cui sono indirizzate. Tali molecole costituiscono anche il linguaggio molecolare per la comunicazione tra le diverse cellule del sistema immunitario e tra queste e quelle appartenenti ad altri sistemi. Le citochine prodotte dai macrofagi sono chiamate anche monochine, quelle prodotte dai linfociti, linfochine, mentre quelle dotate di proprietà chemotattica sono denominate chemochine; la nomenclatura attuale, visto che la loro azione è per lo più diretta nei confronti dei leucociti, le ha definite complessivamente interleuchine. Fra le interleuchine sono comprese anche le citochine non prodotte dai leucociti e che non agiscono su tale tipo cellulare.
Questa classe di mediatori presentano collettivamente le seguenti caratteristiche generali: • sono molecole prodotte essenzialmente durante la fase di attivazione e durante la fase
38
• la loro secrezione è in genere un fenomeno di breve durata ed autolimitato. In generale, infatti, le citochine sono sempre prodotte ex-novo dalla trascrizione dei loro geni, e non vengono mai accumulate nella cellula come molecole preformate;
• spesso vengono prodotte da tipi cellulari diversi ed agiscono su tipi cellulari diversi (pleiotropismo). Inizialmente si pensava che alcune di esse potessero agire soltanto sui leucociti, da cui il nome interleuchine (cioè molecole prodotte da leucociti per leucociti), ma è stato osservato che ciò non è vero;
• possono avere effetti diversi sulla stessa cellula bersaglio, ovvero una citochina può contrastare l'effetto di un’altra diretta verso la stessa cellula;
• la loro attività è spesso ridondante, ovvero citochine diverse possono avere la stessa azione biologica;
• influenzano spesso la sintesi di altre citochine e/o la loro attività;
• possono operare in modo SINERGICO e COOPERATIVO potenziando si a vicenda. Come accade per tutti gli ormoni peptidici, anche le citochine per svolgere il loro ruolo,
hanno bisogno di legarsi a recettori specifici presenti sulle rispettive cellule bersaglio. In particolare, se queste ultime sono rappresentate dalle stesse cellule produttrici allora si parlerà di citochine ad azione autocrina. Diversamente se le cellule bersaglio sono localizzate rispettivamente nelle immediate vicinanze o lontane dal sito di rilascio allora si parlerà di citochine ad azione paracrina ed endocrina.
L'espressione di molti recettori per le citochine è regolata da segnali specifici e la loro affinità per la propria citochina è estremamente alta, ovvero il legame recettore/citochina può avere una costante di dissociazione dell'ordine di 10-10 – 10-12 M. La maggior parte delle risposte cellulari alle citochine non è immediata, ma richiede neo