C
C
a
a
p
p
i
i
t
t
o
o
l
l
o
o
I
I
I
I
I
I
F
F
u
u
n
n
c
c
t
t
i
i
o
o
n
n
a
a
l
l
M
M
a
a
g
g
n
n
e
e
t
t
i
i
c
c
R
R
e
e
s
s
o
o
n
n
a
a
n
n
c
c
e
e
I
I
m
m
a
a
g
g
i
i
n
n
g
g
(
(
f
f
M
M
R
R
I
I
)
)
I cambiamenti dell’attività neurale del cervello sono associati ai cambiamenti delle richieste energetiche: quanto maggiore è l’attività funzionale di un distretto cerebrale, tanto maggiore sarà il suo metabolismo e conseguentemente, le sue richieste energetiche aumenteranno.
Una delle tecniche, non invasive, più sofisticate che sfruttano le variazioni emodinamiche prodotte dall’attività neuronale per identificare le aree attivate del cervello è la risonanza magnetica funzionale (fMRI).
Questo metodo di indagine si basa sul cambiamento del segnale MRI, in seguito alla risposta emodinamica e metabolica in una regione in cui si ha un’attivazione neuronale indotta da stimoli interni o esterni. La risonanza magnetica (MRI) ha lo scopo di ottenere immagini dettagliate dell’anatomia cerebrale sfruttando le proprietà nucleari di certi atomi in presenza di campi magnetici. Attraverso tecniche di rilevamento (fMRI) dei dati è possibile acquisire immagini che possono seguire lo svolgimento di alcuni fenomeni metabolici.
Utilizzando questa metodologia è possibile:
visualizzare le variazioni dell’ossigenazione delle regioni corticali;
ricostruire la mappa di attivazione del cervello per funzioni sensoriali, mentali e motorie, con un’alta risoluzione spaziale.
III.1 Cenni sul segnale di risonanza magnetica
Il segnale MRI nel normale uso clinico, deriva quasi interamente dai protoni dell’acqua contenuti nei tessuti. L’intensità dell’immagine dipende, in primo luogo, dalla densità dei protoni ma può essere profondamente influenzata dall’ambiente locale delle molecole d’acqua. Ciascun protone possiede una carica ed ha la caratteristica di ruotare attorno al proprio asse, cioè possiede uno spin. Questa rotazione produce un dipolo magnetico con orientamento parallelo all’asse del nucleo ed è caratterizzato da un momento magnetico. In assenza di campo magnetico esterno, i dipoli sono disposti casualmente nello spazio. Quando il tessuto viene posizionato all’interno di un campo magnetico statico (B0), i protoni, nel giro di pochi secondi, si ordineranno secondo la sua direzione, assumendo verso parallelo (up) o antiparallelo (down); tale orientamento dipende dall’energia dei nuclei stessi in quanto i versi up e down rappresentano due situazioni di livello energetico diverse. In particolare il livello up richiede minor energia da parte dei protoni rispetto a quello down; quindi il verso antiparallelo è meno probabile poiché necessita di maggior energia da parte dei protoni. L’insieme dei nuclei formerà una magnetizzazione netta M0 , avente come direzione e verso quello del campo magnetico statico e come risultante la somma vettoriale tra i nuclei. Aumentando l’intensità di B0 cresce,
proporzionalmente, anche quella del vettore M0 con conseguente aumento della quantità del segnale utile per le immagini RM. Inoltre tali nuclei, che già possiedono un movimento di rotazione, acquistano un altro moto rotazionale lungo la superficie di un cono ideale attorno al proprio asse. Tale movimento, detto di “precessione”, è costante per ogni specie nucleare; questa costante viene detta giromagnetica (
γ
) e dipende direttamente dall’intensità del campo magnetico nel quale sono immersi i protoni di idrogeno (H) del tessuto biologico da esaminare.La condizione indispensabile affinché si verifichi il fenomeno della risonanza è che deve essere inviata un’onda a RF specifica, cioè a frequenza uguale a quella di precessione dei protoni di H secondo la legge di Larmor
ω=γ B
0 , doveω
è la frequenza di precessione eγ
è la costantegiromagnetica. In questo modo si produce un’eccitazione sul sistema protonico; l’energia erogata dall’onda sarà tanto maggiore quanto più lunga è la durata dell’impulso RF. I nuclei risentono della transizione energetica, e quindi perdono la loro situazione di equilibrio.
Quest’onda ha due funzioni:
fornire l’energia necessaria ai protoni per allinearsi in modo perpendicolare al campo originale.
riallineare le fasi di oscillazione di precessione dei singoli protoni. Al cessare dell’impulso a RF, il sistema protonico si trova in una situazione di non equilibrio, dovuta alla quantità di energia assorbita e ad un conseguente aumento dell’energia potenziale che genera instabilità e tendenza al ripristino delle condizioni iniziali. All’eccitazione protonica segue quindi una fase durante la quale gli spin tenderanno a liberarsi dell’energia in sovrappiù fino a tornare nella condizione iniziale che è assai più stabile e più probabile.
La magnetizzazione ritorna al suo equilibrio secondo un processo di decadimento esponenziale. La magnetizzazione precessa nel piano perpendicolare al campo magnetico statico, decadendo esponenzialmente con una costante di tempo detta di “rilassamento trasversale” T2 (figura 1); questo meccanismo si basa sulla dispersione di fase “incoerente” dovuta all’interazione spin-spin.
Figura 1
Inoltre se le particelle paramagnetiche producono una variazione del campo magnetico nell’oggetto, si verifica un’ulteriore dispersione di fase (sfasamento angolare) che produce un ancor più rapido decadimento del segnale. Questo rilassamento addizionale è detto T2'. Questi due effetti producono il decadimento temporale T2* , dove:
' 2 2 2
1
1
1
T
T
T
∗=
+
Infine, la magnetizzazione ritorna al suo stato di equilibrio allineandosi al campo magnetico statico con una costante di tempo detta di “rilassamento” T1 (figura 2):
Figura 2
III.2 Il segnale fMRI
L’aumento dell’attività elettrica neuronale ha come conseguenza una maggiore richiesta da parte dei neuroni di energia con conseguente maggior necessità di ossigeno. Questo fenomeno causa una variazione del segnale MRI attorno ai vasi che irrorano la corteccia. Durante un aumento dell’attività cerebrale, quindi, si ha un aumento localizzato del flusso sanguigno, con conseguente aumento locale della quantità di ossigeno. La molecola trasportatrice dell’ossigeno è l’emoglobina (Hb). Nello stato inattivo, le cellule nervose prelevano una certa quantità di ossigeno dall’emoglobina ossigenata (ossiemoglobina, HbO2), che quindi diviene emoglobina deossigenata (deossiemoglobina, Hbr). Nello stato attivo la
richiesta, da parte dei neuroni, di ossigeno aumenta e quindi il flusso sanguigno porterà una quantità di emoglobina ossigenata maggiore rispetto allo stato inattivo. Nelle aree attivate, quindi, ci sarà un netto aumento della concentrazione di ossiemoglobina.
Sebbene l’aumento regionale del flusso sanguigno sia un indicatore dell’aumento dell’attività elettrica cerebrale, non è ancora chiaro il meccanismo legato al controllo della richiesta di un maggiore flusso sanguigno. Le ipotesi più probabili sono:
il rilascio di fattori chimici come l’ossido nitrico, l’adenosina, gli ioni idrogeno o potassio;
una stimolazione nervosa diretta della muscolatura vascolare.
Figura 3
Stato basale:
Flusso normale; Livello basale [Hbr];
Volume del sangue (CBV) basale; Segnale MRI normale;
Stato attivato
Aumento del flusso; Diminuzione di [Hbr]; Aumento di CBV;
Aumento del segnale MRI.
L’emoglobina ossigenata e la non ossigenata hanno proprietà magnetiche diverse, in particolare l’ossiemoglobina è diamagnetica e la deossiemoglobina è paramagnetica. La presenza della Hbr paramagnetica causa la distorsione del campo magnetico statico B0; gli spins in un campo magnetico non uniforme precessano a frequenze diverse causando una dispersione di fase e il decadimento del segnale MRI. Questo effetto responsabile delle variazioni dei segnali MRI, è detto BOLD [Ogawa, 1998] (blood oxygenation level dependent).
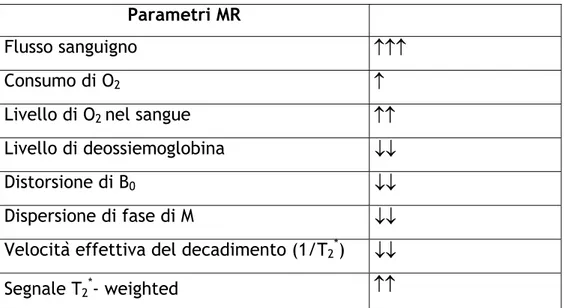
La variazione dell’ossigenazione nel sangue causa una variazione del parametro T2* (costante di tempo che tiene conto del decadimento della magnetizzazione dovuta sia al campo magnetico non omogeneo che all’interazione spin-spin) che a sua volta porta ad una variazione dell’intensità dell’immagine T2*-weighted (figura 4).
La tabella 1 mostra come variano i parametri dovuti all’attivazione corticale:
Parametri MR
Flusso sanguigno ↑↑↑
Consumo di O2 ↑
Livello di O2 nel sangue ↑↑
Livello di deossiemoglobina ↓↓
Distorsione di B0 ↓↓
Dispersione di fase di M ↓↓
Velocità effettiva del decadimento (1/T2*) ↓↓
Segnale T2*- weighted ↑↑
Tabella 1: Variazione dei parametri MR dovuti all’attivazione corticale
La fMRI non produce immagini dirette di quello che avviene nel cervello. Questo succede non solo perché queste immagini raffigurano un effetto indiretto (risposta emodinamica) dell’attività neuronale (che è molto più rapida), ma anche perché, più che delle istantanee, sono in realtà delle mappe di distribuzione statistica di questo effetto su tutto il cervello.
In un esperimento di fMRI con un campo di 1.5 T, l’effetto BOLD (figura 5) determina, difatti, una variazione del segnale dell’ordine del 5-8% , ancora troppo debole perché si possa essere sicuri di riconoscerlo nell’evento singolo (il segnale BOLD non fornisce una misurazione assoluta dell’attività neurale, ma relativa).
Figura 5
Durante una sessione d’esame, perciò, vengono acquisite immagini funzionali in assenza di stimoli, che serviranno come immagini di confronto; inoltre, durante il periodo di acquisizione, vengono presentati degli stimoli che possono essere: sensoriali, motori o task cognitivi. Lo stesso task viene ripetuto periodicamente in modo da fare una media statistica di tutti i valori delle immagini relativi all’attivazione. L’immagine finale si ottiene facendo una sottrazione mediata tra l’immagine acquisita durante l’assenza di stimoli e l’immagine acquisita durante la presentazione dello stimolo. In questo modo si ottiene un’immagine statistica parametrica, che va poi sovrapposta all’immagine anatomica (figura 6).
Figura 6
3.2.1. Il rumore
La differenza di suscettibilità magnetica tra il sangue totalmente ossigenato e deossigenato è molto piccola (circa 0.002 10-6 unità cgs), di conseguenza, nella tecnica BOLD, i cambiamenti di intensità sono generalmente piccoli. Le prove sperimentali hanno dimostrato che la variazione nel tasso di rilassamento T2*, associato alla diminuzione del segnale, aumenta all’aumentare del campo magnetico statico dello scanner.
Da ciò si deduce che sarebbe conveniente aumentare il campo magnetico statico per una migliore visualizzazione, e per migliorare il rapporto segnale rumore (SNR) che è direttamente proporzionale all’intensità di campo statico.
Il rumore nelle immagini fMRI è dovuto a diversi fattori quali: il rumore termico dovuto al soggetto;
le bobine di ricezione;
i pre-amplificatori e gli altri componenti elettronici; il rumore di quantizzazione nel convertitore A/D; il ciclo cardiaco e respiratorio;
i movimenti della testa;
eventi neuronali spontanei e incontrollati. Le soluzioni hardware per ridurre il rumore sono:
i. usare speciali bobine di ricezione, ad esempio realizzate per ricevere da parti specifiche del cervello;
ii. usare alti campi magnetici, che aumentano la magnetizzazione e di conseguenza aumentano la non uniformità del campo dovuta all’effetto paramagnetico della deossiemoglobina.
L’equazione del SNR per un’immagine MR è:
D A
T
MV
SNR
=
/il parametro
M
è la magnetizzazione, che è funzione dei parametritessutali (T1, T2 o T2*, densità degli spin), dei parametri di acquisizione (TR, TE, flip angle) e del campo magnetico B0 ;
il parametro
V
è il volume elementare (voxel);TA/D è il tempo totale trascorso campionando il k-space per una data immagine.
Si possono avere diverse soluzioni per migliorare il rapporto segnale rumore; un possibile modo, ad esempio, può essere quello di ridurre la risoluzione spaziale aumentando la dimensione dei singoli voxel (si aumenta
V) ma ciò porta a modesti miglioramenti dei dati fMRI; l’altro modo è aumentare il campo magnetico B0 e aumentare il tempo TA/D .
Per minimizzare gli effetti indesiderati del ciclo cardiaco, respiratorio e dei movimenti della testa si usa una tecnica di acquisizione rapida come l’echo-planar imaging (EPI) [Bandettini, 1992]; l’immagine rapida permette di “congelare” i movimenti fisiologici: in questo modo il loro contributo sull’immagine diventa inconsistente.
III.3 Registrazione dei dati fMRI
I dati fMRI sono una serie temporale di immagini (2D o 3D), queste sono combinate con la conoscenza degli stimoli presentati al soggetto durante un run di imaging. E’ necessario utilizzare almeno 2 stimoli diversi in modo da evocare differenti risposte neuronali. Esistono varie tecniche per ottenere una mappa di attivazione funzionale da questi dati; prima di applicarle, però, è necessario pre-processare i dati per minimizzare l’effetto delle sorgenti di rumore e l’effetto dei movimenti del soggetto. Il cambiamento del segnale, perfino per piccoli movimenti (al di sotto di 1 mm) può essere maggiore del 5-8% della risposta BOLD a 1,5 T. Se il movimento del soggetto avviene nello stesso istante dello stimolo, la variazione del segnale causa un aumento di “false attivazioni” rilevate. La registrazione delle immagini, cioè il loro allineamento, può essere fatta in 2D (slice per slice) o in 3D (volumetrica). In 2D i movimenti rigidi sono
movimenti rigidi sono descritti da sei parametri: traslazione e rotazione rispetto a tutti gli assi. In generale si preferisce usare una registrazione 3D, dato che il movimento del soggetto avviene in ogni direzione.
La tecnica più comunemente utilizzata per ridurre i movimenti della testa è quella di registrare le immagini (2D o 3D), confrontarle, poi, con un’ immagine di base e quindi stimare lo spostamento (rotazione e traslazione) rispetto all’immagine di base. Successivamente ogni immagine viene poi ricampionata in modo da ottenere una nuova matrice che è allineata con l’immagine di base. Questo metodo non elimina completamente l’effetto del movimento della testa, è infatti impossibile stimare i parametri del movimento in modo accurato.
Un altro effetto, dovuto al movimento, è la lenta deriva nella serie temporale, dell’intensità del segnale sul tempo di scanning; anche questo è risolvibile parzialmente nella fase di pre-processing.
Un’altra sorgente di rumore è la distorsione in fase nelle immagini echo-planar (EPI); questa dipende dalla non uniformità del campo magnetico causato dalle diverse proprietà magnetiche locali del tessuto. Il modo migliore per risolvere questo problema è quello di acquisire una “mappa del campo magnetico” usando una sequenza MRI particolare.
Altre sorgenti rumorose sono i cicli cardiaci e respiratori. Il ciclo cardiaco varia la velocità del flusso sanguigno nelle varie slices, questo causa una variazione del livello di magnetizzazione longitudinale disponibile per la conversione in magnetizzazione trasversale. Le sorgenti di rumore di natura fisiologica possono essere filtrate; l’approccio più semplice, per fare ciò, è quello di misurare (o stimare) le frequenze del ciclo respiratorio e/o cardiaco e poi eliminare, dalla serie temporale, tutti i dati relativi a queste frequenze. Lo svantaggio di questo metodo è il fenomeno di aliasing che rende impossibile distinguere, in dati campionati, frequenze che differiscono di multipli di (∆t)-1, dove
∆t
è l’intervallo di campionamento. Un modo per evitare il problema è quello di misurare le frequenze esistemare poi il TR (tempo di ripetizione), della sequenza di acquisizione utilizzata, in modo da evitare l’aliasing vicino alle frequenze dello stimolo. Un modo più complesso per filtrare il rumore fisiologico, prevede di misurare il ciclo cardiaco e respiratorio per tutta la durata dell’esperimento, e alla fine sottrarre le componenti dei dati che sono correlate con la misura dei cicli fisiologici.
III.4 Tecniche di generazione delle immagini
funzionali
La classe di metodi maggiormente usata per la rilevazione dei voxels attivi, in una serie temporale, è basata sulla creazione di un modello per il segnale MRI che ci si aspetta di avere da una regione neuronale attiva. I dati vengono poi elaborati e quei voxels che sono statisticamente significativi sono dichiarati attivi. I principali metodi utilizzati sono:
il metodo di correlazione;
il metodo di regressione lineare; il metodo di regressione non lineare.
3.4.1 Metodo di correlazione
Il metodo di correlazione [Cox, 1997] è un metodo parametrico che si applica a un esperimento in cui lo stimolo si alterna tra due condizioni diverse. Si basa sulla predizione di una serie temporale di riferimento (“ideale”) che ha la forma della risposta fMRI che ci si aspetta. Una volta
scelta la risposta si calcola la correlazione di ogni voxel della serie temporale con quella di riferimento [Bandettini, 1992]. I voxel con un alto coefficiente di correlazione sono supposti attivi.
Il coefficiente di correlazione stimato tra le due serie temporali ha un valore compreso tra –1 e 1, ed è pari a:
( )
[
]
[
( )
]
( )
(
)
[
]
[
(
( )
)
]
2 1 2 2 1 2∑
∑
∑
−
−
−
−
=
t t ty
t
y
z
t
z
y
t
y
z
t
z
ρ
dove:z(t)
è la serie temporale in uscita per ogni voxel:z
( )
t
=
β
1y
( )
t
+
β
0+
rumore
bianco
dove
β
0 è un parametro noto e si misura con il metodo dei minimiquadrati; la soluzione per
β
1 è la misura migliore dell’ampiezza diy(t)
inz(t)
:( )
[
]
[
( )
]
( )
[
]
[
[
(
(
( )
( )
)
)
]
]
ρ
β
⋅
−
−
=
−
−
−
=
∑
∑
∑
∑
2 1 2 2 1 2 2 1 t t t ty
t
y
z
t
z
y
t
y
y
t
y
z
t
z
y(t)
è la serie di riferimento;z
è il valor medio diz(t)
;Il parametro
β
1 non dipende dal livello di rumore inz(t)
, quindi può essereusato come misura dell’effetto BOLD. Un inconveniente è che
β
1 dipendedalla scala scelta per
y(t)
, ma dipende anche dalla scala diz(t)
. Nell’analisi di un solo run di imaging questo fattore di scala non è importante: diventa, invece, significativo se si confrontano risultati provenienti da più sessioni di scanning. Anche se viene usato lo stessoy(t)
, il fattore di scala perz(t)
, probabilmente, non sarà esattamente lo stesso ad ogni istante. Questo fattore è settato dall’operatore quando sceglie il livello di amplificazione della bobina di ricezione RF. Alcuni scanner clinici settano questo valore automaticamente durante l’operazione di pre-scan, in questo caso il cambiamento del fattore di scala non è noto all’operatore.Un’alternativa migliore è quella di calcolare la variazione percentuale del segnale rispetto a quello di partenza. Questa operazione è facilmente realizzabile se si sceglie come riferimento
y(t)
compreso tra 0 e 1; in questo modo la variazione percentuale è: 100% β1/β0 . Se la densità e la distribuzione di sangue nei vasi sono circa uguali a quelle lungo la materia grigia, allora la variazione percentuale in ogni voxel sarà approssimativamente proporzionale al cambiamento della concentrazione di ossiemoglobina nei voxel.3.4.2 Scelta della funzione di riferimento
Il metodo di correlazione non specifica come scegliere
y(t)
. La tecnica più usata oggi è basata sulla teoria dei sistemi lineari tempo-invarianti. E’ un modello in cui viene presentato un input (lo stimolo), e si avrà un output (il segnale BOLD) che non tiene conto delle condizioni iniziali dei voxel e del loro passato (modello tempo-invariante). Quando vengono presentati più(linearità). In termini matematici si suppone che in seguito ad uno stimolo in
t
=0 si abbia una rispostah(t)
, cioè una risposta impulsiva che deve essere zero pert<
0, (altrimenti si ha una risposta prima che lo stimolo venga presentato). Quindi se lo stimolo viene presentato agli istantit=a
et=b
la risposta del modello sarà:(
t
a
) (
h
t
b
h
−
+
−
)
Se, invece, lo stimolo viene presentato continuamente in un intervallo a < t < b la risposta sarà pari a:
(
)
∫
b−
adm
m
t
h
La tecnica per generare
y(t)
richiede due input:la risposta impulsiva
h(t)
;una funzione
f(t)
che è uguale a 0, all’istante t in cui lo stimolo non è presentato, e uguale a 1 quando lo stimolo viene presentato.La risposta
y(t)
può, quindi, essere scritta in una forma integrale (III.1) o come somma (III.2) nel caso discreto:( )
=
T∫
(
−
) ( )
=
∫
T(
−
) ( )
tdm
m
f
m
t
h
dm
m
f
m
t
h
t
y
0 (III.1)∑
∑
= − = −=
=
T m m n m n m m m n nh
f
h
f
y
0 0 (III.2)In questo modo scegliere
y(t)
è equivalente a scegliere la funzioneh(t)
. Il problema, quindi, si semplifica perché la scelta dih(t)
non tiene conto del TR o della temporizzazione dello stimolo; inoltre,h(t)
è una funzione universale che riproduce le caratteristiche della risposta emodinamica di uno stimolo breve, ed è pari a:( )
t
=
0
h
pert
<0
( )
c t re
t
t
h
=
− pert
>0
con:r
=8.6c
=0.5 secLa rete neuronale nel cervello può essere paragonata ad un sistema non lineare e di conseguenza anche la risposta emodinamica sarà non lineare. Tuttavia, è stato dimostrato che il modello del sistema lineare è molto utile per la rappresentazione delle serie temporali dei dati fMRI.
3.4.3 Metodo di regressione lineare
Lo scopo di questo metodo [Cox, 1997] è quello di spiegare le variazioni temporali in termini di combinazione lineare. Si assume:
∑
= −=
p m m m n nf
h
y
0diversa da 0 solo nell’intervallo
n
≥
p
, conp
fissato. La sequenza di uscita è :∑
= −+
=
p m n m n m nh
f
Z
0ε
conn
≥
p
dove
ε
n è un termine di rumore bianco gaussiano. Le misure dei dati fMRIsono approssimate da una costante
β
0, da un termine lineareβ
1n e da unulteriore termine di rumore
ε
n, in aggiunta al segnaley(t)
:n p n p n n n n n
y
n
n
h
f
h
f
h
f
Z
=
+
β
0+
β
1+
ε
=
β
0+
β
1+
0+
1 −1...
+
−+
ε
per n= p, p+1,…N-1.Usando la notazione matriciale: , Z Z Z Z 1 N 1 p p = − + , − + = − − − + 1 1 1 1 0 1 1 1 1 1 1 p N N p p f f N f f p f f p X = p h h0 1 0 β β β , . = − + 1 N 1 p p ε ε ε ε
Quindi l’equazione può essere scritta:
ε
β
+
= X
Z
Risolvere il problema con il metodo di regressione lineare significa trovare una stima :
β
ˆ
=
b
del vettore
β
dei parametri incogniti.Questa stima è una buona approssimazione dei dati. In questo modo si ottiene una stima di
Z
:Xb
Z
ˆ
=
Il criterio per stimare
b
è quello di minimizzare la somma degli scarti quadratici tra i valor stimati e i dati:( )
∑
−(
) (
) (
)
=−
−
=
−
=
=
1 0 2ˆ
ˆ
ˆ
N i t i iZ
Z
Z
Z
Z
Z
b
Q
SSE
E’ facile dimostrare che:
(
X
X
)
X
Z
b
=
t −1 tquindi
b
contiene i parametri stimati della risposta impulsiva.3.4.4 Regressione lineare multipla
In un esperimento con tre differenti stimoli (riposo, A e B) l’analisi è data da risposte separate per le due condizioni attive:
( )
t
y
( )
t
y
( )
t
t
rumore
z
=
β
A A+
β
B B+
β
0+
β
1⋅
+
dove il riferimento
y
A,B(t)
può essere calcolato con il metodo dicorrelazione descritto. Per questo modello devono essere calcolati quattro parametri per ogni voxel: le due ampiezze
β
A eβ
B, la condizione inizialeβ
0e la deriva iniziale
β
1. Si ipotizza che il termine di rumore residuo siabianco e Gaussiano (ipotesi giustificata dal fatto che è richiesto in fase di pre-processamento un’operazione di smoothing). I voxels dove
β
A– β
B >0stimolo A è più intenso di quello B. Lo scopo di questo metodo è quello di permettere di adattare il modello della risposta ad ogni voxel. Il numero dei parametri da calcolare aumenta, così come aumenta il numero di dati necessari per mantenere lo stesso livello di rilevabilità e di importanza statistica del segnale.
Questa tecnica è usata per l’analisi di dati fMRI “event related”, caratterizzati cioè da una sequenza di risposte separate ottenute dai vari stimoli. Gli stimoli sono separati nel tempo, quindi possono essere analizzati separatamente. Le risposte sono divise in categorie (1,2,…C); per ogni categoria j:
1
=
j
f
se si presenta uno stimolo di categoria j al tempo t; 0=
j
f altrimenti.
Quindi il modello del segnale per ogni voxel è:
( )
∑
(
) ( )
=−
=
T t m j jt
h
t
m
f
m
y
risposta, normalizzata, allo stimoloj
;( )
∑
( )
= + ⋅ + + = C j j jy t t rumore t z 1 1 0β
β
β
risposta totale per ogni voxel.Ogni categoria j ha una sua ampiezza
β
j per ogni voxel.Gli intervalli di separazione tra gli stimoli devono essere tali da contenere la salita e la discesa di
h(t)
. Questa osservazione ci permette di usare intervalli random tra i vari stimoli, in modo che si abbia una densità media di stimoli più alta e quindi un miglioramento dell’analisi temporale.Il modello
y
j(t)
analizzato può essere complicato utilizzando più funzionih
j(t)
. E’ anche possibile usare una funzioneh(t)
con dipendenza non linearedai parametri. Queste classi di tecniche sono dette di “deconvoluzione” e possono essere lineari e non lineari.
3.4.5 Metodo di regressione non lineare
Il metodo di regressione non lineare [Cox, 1997] è un’ulteriore generalizzazione della regressione lineare; la differenza è che, con questa tecnica, non si misura solo l’ampiezza della risposta di ogni voxel. La forma della risposta può variare, entro certi range fissati dal modello delle equazioni. Il metodo si basa sulla non linearità dei parametri (non additività); un esempio è quello di definire:
( )
ct r
e
t
t
h
=
− modello della risposta impulsiva( )
∑
(
) ( )
=−
=
T t mm
f
m
t
h
t
y
somma delle risposte( ) ( )
t
y
t
t
rumore
z
=
+
β
0+
β
1⋅
+
modello della serie temporale.I parametri (non lineari) r e c determinano la forma dell’impulso. Con questo tipo di modello la forma della risposta per ogni voxel non è specificata ed è completamente libera.
Una ragione per cui la tecnica di regressione non lineare non è molto usata nell’analisi fMRI è che la routine di misurazione non lineare è molto più lenta di quella lineare. E’, inoltre, molto più difficile essere sicuri di aver trovato la “migliore” misura, infatti è più probabile trovare un falso minimo.
L’algoritmo della regressione lineare è più stabile, più veloce e garantisce di trovare la migliore stima dei parametri globali. La regressione non lineare, invece, è utile quando non è necessario misurare la forma della risposta (può essere parzialmente definita).
Questo tipo di analisi è usata per singoli eventi, cioè quando c’è uno stimolo per run. In questo caso:
( )
t
=
0
y
pert
<s
( )
t
e
c( )t se
d(t sy
=
− −−
− − ) pert
>s
con
c e d
velocità di ingresso e di uscita del mezzo di contrasto; queste equazioni devono essere risolte per ogni voxel. Il tempo di inizios
è fissato dal tempo di iniezione.Un altro modello del segnale può essere:
( )
t
=
0
y
pert
<s
ot
>f
( ) (
) (
p)
qt
f
s
t
t
r
=
−
−
pers
<t
<f
dove y(t) è una funzione che per
t
=s
inizia a salire e pert
=f
ritorna a 0.La forma esatta dipende dai parametri p e q (che sono presi positivi). Questo
modello è applicato, soprattutto, alle variazioni degli stati d’animo del soggetto in seguito a stimoli visivi.
III.5 Analisi delle immagini ricostruite
Una volta ottenuta l’immagine è necessario elaborarla; i metodi per ottenere ciò sono:
T-test;
Analisi della varianza.
3.5.1 T-Test
Il punto di partenza del t-test di Student [Clare, 1994] è quello di definire una condizione iniziale in cui tutti i voxel sono disattivi, e confrontare le immagini acquisite con la condizione iniziale, punto per punto, durante e dopo il task (figura 7):
Per ogni istante temporale si calcola il valor medio e la deviazione standard della distribuzione dei valori dei voxel; quindi si costruisce un set di mappe parametriche t-statistiche [Appendice] confrontando i valori medi dell’immagine di base e delle immagini acquisite.
Questa tecnica ha due svantaggi:
per raggiungere un rapporto segnale rumore sufficiente è necessario avere molti più cicli rispetto ad un paradigma di base, aumentando cosi la durata dell’esperimento;
applicando questa tecnica è necessario fare molte assunzioni restrittive che possono essere errate.
3.5.2 Analisi della varianza
Per risolvere il problema delle assunzioni imposte sull’attivazione si utilizza l’analisi della varianza [Clare, 1994]. Questo metodo è basato semplicemente su operazioni di media sul segnale. Si consideri, ad esempio, la risposta misurata in figura 8:
La serie temporale contiene due componenti: una è dovuta al vero segnale; l’altra è una fluttuazione dovuta a eventi fisiologici incorrelati e al rumore nelle immagini. Mediando trentadue cicli, l’ampiezza della componente di rumore si riduce; questa riduzione può essere quantificata calcolando la varianza sia dei dati mediati che di quelli non mediati.
Successivamente, per determinare le regioni di attivazione, si calcola il rapporto tra le varianze per ogni pixel. Per i voxels nelle regioni in cui si ha una variazione dell’intensità puramente casuale, questo rapporto è circa
1/n, dove n è il numero di cicli mediati. Invece, i pixels nelle regioni di
attivazione avranno un rapporto più alto e quindi più significativo.
Se
Z
ij si riferisce all’istantei
-esimo dopo lo stimoloj
-esimo, di unesperimento con n cicli:
tempo t Z11, Z12, .... Z1j, ... , Z1n Z1 tempo 2t Z21, Z22, .... Z2j, ... , Z2n Z2 ... tempo it Zi1, Zi2, ... Zij, ... , Zin Zi ... ... ... ... ... ... ... tempo kt Zk1, Zk2, .... Zkj, ... , Zkn Zk
con n = numero di cicli e k= punti per ciclo.
La varianza di ogni punto può essere calcolata come:
(
)
∑
=−
−
=
n j i ij in
Z
Z
s
1 2 21
(
)
(
)
∑
∑∑
= = =−
−
=
=
k i k i n j i ij i Wn
k
Z
Z
k
s
1 1 1 2 2 21
ˆ
σ
con k(n-1) gradi di libertà.
La varianza del punto medio è data da:
(
)
∑
=−
−
=
k i i Zk
Z
Z
s
1 2 21
ed essendo:n
Z 2 2σ
σ
=
si può stimare:(
)
∑
=−
−
⋅
=
⋅
=
k i i Z Bk
Z
Z
n
s
n
1 2 2 21
ˆ
σ
che ha k-1 gradi di libertà. Quindi il rapporto sarà pari a:
2 2
ˆ
ˆ
W BF
σ
σ
=
Queste equazioni sono usate per formare una mappa parametrica F-statistica. Queste equazioni sono più facilmente implementabili con le seguenti formule: