Fig. 1 Minnie G.
1. INTRODUZIONE
1.1 La sindrome di Cushing: cenni storici
Nel 1912, il neurochirurgo Harvey Williams Cushing descrisse per la prima volta il caso di una donna di 23 anni di New York, Minnie G. (Figura 1), la quale presentava ipercortisolismo accompagnato da segni clinici e sintomi alquanto caratteristici:
“…una fastidiosa obesità, ipertricosi e amenorrea con sviluppo di caratteristiche sessuali secondarie accompagnate da un basso grado di idrocefalo e da un aumento della tensione cerebrale”(1).
Questo caso stimolò la fervida mente di H. W. Cushing e accese in lui un interesse che culminò 20 anni dopo in uno studio fondamentale che dimostrava il legame tra adenoma
basofilo ipofisario e ipercorticosurrenalismo (2). Nel 1933 veniva dimostrata da Collip et al. (3)
l’esistenza dell’ormone adrenocorticotropo, precedentemente ipotizzata da Bauer sotto il nome di
“ormone madre”. Soltanto tre anni dopo Jores (4) stabilì il legame tra l’eccesso di produzione di ormone adrenocorticotropo e quella che nel 1950 Bauer definirà “malattia di Cushing”. Quest’ultimo pubblicò infatti nel 1950 l’articolo “The so called Cushing’s sindrome, its
history, terminology, and differential diagnosis” in cui sostenne che
l’associazione tra la ben conosciuta sindrome clinica e l’adenoma basofilo ipofisario meritava l’eponimo di “malattia di Cushing”. Con il termine “sindrome di Cushing” invece, si intendeva allora l’insieme di manifestazioni cliniche conseguenti all’eccessiva produzione di cortisolo dalla corteccia surrenalica.
Nel 1962 Liddle individuò un’ulteriore causa di sindrome di Cushing, ovvero la sindrome da ACTH ectopico, dovuta alla produzione di ACTH da parte di tumori non meglio identificati in sedi diverse dall’ipofisi. Tuttavia gli aspetti patogenetici della sindrome da ACTH ectopico furono meglio chiariti nel 1966 quando Hunder della Mayo Clinic riuscì ad identificare il collegamento tra microcitoma polmonare e alcuni tumori pancreatici con la produzione di una o più sostanze ACTH simili in grado di indurre iperplasia surrenalica corticale.
1.2 La classificazione eziopatogenetica della sindrome di Cushing
In base all’eziologia è possibile classificare la sindrome di Cushing in:
• IATROGENA (causa più frequente) • SPONTANEA - ACTH DIPENDENTE (80%) o Adenoma ipofisario (60%) o ACTH/CRH ectopico (20%) - ACTH INDIPENDENTE (20%) o Adenoma surrenalico (10%) o Carcinoma surrenalico (8%) o Iperplasia micronodulare (1%) o Iperplasia macronodulare (1%) • PSEUDO-CUSHING • PSICOSI DEPRESSIVA (1%) • ALCOLISMO (<1%)
La forma iatrogena di sindrome di Cushing è sicuramente la più frequente, si osserva nei pazienti sottoposti a terapia corticosteroidea cronica e dipende dalla dose totale di steroidi assunti e dalla durata della terapia. Le caratteristiche cliniche sono molto simili a quelle dei soggetti con adenoma surrenalico, e pertanto risulterà dirimente ai fini di una diagnosi differenziale una corretta anamnesi e le indagini di laboratorio.
Tra le forme spontanee la malattia di Cushing, attribuita come abbiamo visto ad un’ipersecrezione ipofisaria di ACTH correlabile nella maggioranza dei casi alla presenza di un adenoma secernente, provoca una iperplasia surrenalica bilaterale (Figura 2); tale reperto anatomopatologico si osserva anche, seppur con minore frequenza, nelle sindromi da ACTH ectopico (5).
La sindrome di Cushing dovuta ad adenoma surrenalico è la più frequente all’interno delle forme ACTH-indipendenti. Gli adenomi di questo tipo sono più spesso unici, monolaterali, di dimensioni medie intorno ai 4 cm, giallo brunastri e capsulati. La diagnosi differenziale con i carcinomi surrenalici è ovviamente d’obbligo e si basa sul fatto che generalmente i carcinomi surrenalici risultano essere di maggiori dimensioni, più spesso infiltranti e con maggiori aree necrotico- emorragiche al loro interno.
L’iperplasia bilaterale micronodulare ACTH indipendente è una causa molto rara di sindrome di Cushing, e si verifica sia in forma sporadica, sia all’interno del complesso di Carney, una forma familiare. Il complesso o sindrome di Carney è una malattia autosomica dominante caratterizzata da due principali tipi di reperti clinici: lentiggini pigmentate e nevi blu sulla faccia, sul collo e sul tronco, includendo anche le labbra, la congiuntiva e le sclere, e tumori multipli, sia endocrini (tumori testicolari a cellule di Sertoli e occasionalmente surrenalici, ipofisari e tiroidei) che non endocrini (cutanei, mammari, mixomi atriali e schwannomi) (6).
L’iperplasia surrenalica macronodulare invece, consiste nella presenza di macronoduli multipli bilaterali che causano un marcato ingrandimento delle ghiandole surrenali (7). Una sottocategoria di pazienti affetti da ISM mostrano l’espressione ectopica di recettori con aumentata responsività al GIP (ipercortisolismo cibo dipendente) (8-9), ai recettori della vasopressina (10-11), e ai recettori β adrenergici (12): tali rilievi suggeriscono che la massiva iperplasia adrenocorticale
in questi pazienti potrebbe essere secondaria ad anomalie dei recettori per vari ormoni e fattori di crescita.
Infine è opportuno menzionare alcune condizioni come l’alcolismo cronico e la depressione, che rientrano nella sindrome pseudo-Cushing: tali pazienti mostrano infatti un modesto aumento del cortisolo urinario, alterato ritmo circadiano e mancata soppressione al test di soppressione notturna con basse dosi di desametasone. Tuttavia l’astinenza dall’alcool per almeno 5 giorni nel primo caso, e il miglioramento del tono dell’umore nel secondo, normalizzano gli esami di laboratorio.
1.3 Epidemiologia e presentazione clinica della malattia di Cushing
La malattia di Cushing è una patologia relativamente rara: ha un’incidenza di circa 10-15 casi per milione ogni anno, più comunemente interessa la fascia d’età compresa tra i 20 e i 40 anni e ha una frequenza maggiore nella donna, con un rapporto F/M di 8:1.
Per ciò che concerne la presentazione clinica, la malattia di Cushing si manifesta con una serie di segni e sintomi la maggior parte dei quali dipende dallo stato di ipercortisolismo (Tabella 1), e pertanto risulta praticamente indistinguibile all’esame obbiettivo da tutte le altre cause di sindrome di Cushing (13).
! " # $ " # % &
L’aumento del cortisolo determina il deposito di tessuto adiposo in sedi caratteristiche (Figura 4), in particolar modo nella regione superiore del volto (con aspetto tipico della facies “a luna piena”), nella regione interscapolare (con comparsa del cosiddetto “gibbo a dorso di bufalo”), nella zona sopraclavicolare (cuscinetti di grasso) e nel distretto mesenterico (classica obesità del tronco). Nonostante la causa di tale particolare distribuzione di tessuto adiposo non sia ancora ben conosciuta, si è comunque visto che risulta essere correlata all’insulino-resistenza e/o a livelli elevati di insulina.
Per quanto riguarda gli effetti sul metabolismo proteico, la risposta catabolica esercitata dagli aumentati livelli di cortisolo a livello del muscolo scheletrico è responsabile della miopatia prossimale e della facile stancabilità che molto spesso lamentano i pazienti.
Allo stesso modo sia la difficile cicatrizzazione che la friabilità dei tessuti connettivi (aspetto quest’ultimo denotato dalla comparsa di strie rubre ed ecchimosi) sono da ricondurre rispettivamente alla diminuzione di attività da parte dei fibroblasti e alla riduzione della collagenosintesi (Figura 5).
Inoltre, l’iperproduzione di cortisolo induce un aumento della glicogenosintesi e della gluconeogenesi epatica e riduce la captazione di glucosio da parte dei tessuti: questi effetti metabolici sono responsabili della comparsa di un diabete mellito conclamato in meno del 20% dei pazienti.
A livello osseo invece, la risposta catabolica si traduce in una diminuzione dell’attività osteosintetica da parte degli osteoblasti da un lato, e in un aumento del riassorbimento osseo da parte degli osteoclasti dall’altro: ciò rende ragione del fatto che tali pazienti presentano spesso i segni e i sintomi di osteoporosi, potendo presentare fratture in diversi distretti, compreso il collasso dei corpi vertebrali.
Un altro aspetto di rilievo clinico, di fondamentale importanza ai fini della terapia, è la aumentata suscettibilità alle infezioni, condizione questa che presenta più meccanismi patogenetici. Infatti l’ipercortisolismo determina una riduzione numerica di linfociti T/B, di eosinofili e di monociti ma allo stesso tempo provoca anche una riduzione della loro attività funzionale, ravvisabile essenzialmente nella insoddisfacente attività fagocitaria e nella scarsa produzione di citochine.
Sul sistema cardiovascolare poi, ben conosciuta è l’azione ipertensiva del cortisolo, mediata sia da un incremento della gittata che da un effetto permissivo sulla risposta delle cellule muscolari lisce alla noradrenalina e alla adrenalina.
Inoltre si riscontrano frequentemente segni e sintomi legati all’iperproduzione surrenalica di androgeni: nella donna determinano acne, irsutismo, alopecia androgenica e amenorrea, nell’uomo invece provocano calo della libido, infertilità (blocco della spermatogenesi), deficit erettile, acne e perdita di capelli.
Per concludere, non devono essere trascurate le interferenze che l’eccesso di cortisolo induce sulla regolazione dei neuroni e della glia: perdita di memoria, insonnia, psicosi (depressione, mania) sono infatti cambiamenti che si interpongono di frequente in un quadro clinico, come abbiamo visto, già di per sé molto complesso.
1.4 Indagini di laboratorio nella malattia di Cushing: diagnosi differenziale
Ogniqualvolta venga sollevato il sospetto clinico di sindrome di Cushing, il primo passo da compiere è la sua conferma mediante indagini di laboratorio, le quali in ordine comprendono:
1. La determinazione del ritmo circadiano di secrezione di cortisolo e ACTH: si eseguono dei prelievi alle ore 8:00, alle ore 16:00 e alle ore 24:00 (è importante che il prelievo delle ore 24:00 venga eseguito mentre il paziente dorme o entro 5-10 minuti dal risveglio) (14): la mancanza di ritmo circadiano del cortisolo è suggestiva di sindrome di Cushing (la cortisolemia nel soggetto sano alle ore 24 dovrebbe essere < 36 ng/ml). La misurazione dei livelli basali di ACTH plasmatico trova invece impiego nella diagnosi differenziale delle varie forme di sindrome di Cushing: infatti nei tumori surrenalici i livelli di ACTH sono bassi o indosabili (< 10 pg/ml), mentre nella sindrome da ACTH ectopico possono arrivare a raggiungere valori superiori a 500 pg/ml. Nella malattia di Cushing e nelle rare sindromi di Cushing dovute a disfunzione
ipotalamo-ipofisaria, i livelli di ACTH oscillano invece tra 30 e 150 pg/ml.
2. Il dosaggio del “cortisolo libero urinario”: elevate concentrazioni di CLU depongono a favore di una sindrome di Cushing (i valori normali di CLU oscillano tra 36 e 120 µg/24h). Naturalmente, è necessario escludere eventuali alterazioni della funzione renale. A tale scopo, è opportuno misurare i livelli di creatininuria per verificare la correttezza della raccolta delle urine. Se il filtrato glomerulare risultasse inferiore a 30 ml/min., l’escrezione di CLU sarebbe conseguentemente diminuita potendo quindi non mostrare un’eccessiva produzione di cortisolo. Nei bambini l’escrezione di CLU dovrebbe essere corretta per l’area della superficie
corporea/1.72 m2.
Contrariamente alla misurazione dei livelli di cortisolo plasmatico, che fornisce una stima del cortisolo totale, legato e non, il CLU non è gravato da fattori che influenzano la globulina legante il cortisolo (es. estrogeni, tamoxifene etc.) (15). Considerando tuttavia la possibilità della presenza di ipercortisolismo intermittente, qualora il sospetto di sindrome di
Cushing sia elevato, nonostante il primo valore di CLU sia risultato normale, dovrebbero essere eseguite fino a tre raccolte di CLU/24h. Se l’escrezione di cortisolo risultasse normale in tutte e tre le raccolte urinarie, potremmo considerare altamente improbabile una sindrome di Cushing. I valori di CLU possono essere estremamente variabili nella sindrome di Cushing, anche se, secondo alcuni autori, valori di CLU quattro volte superiori al normale possono essere considerati indicativi di questa condizione (15). Come abbiamo visto precedentemente, lievi aumenti di CLU si possono ritrovare anche in condizioni come l’ansia cronica, la depressione, l’alcolismo (stati di pseudo-Cushing), e nelle donne in gravidanza (16). Tuttavia il CLU può risultare nei limiti pur in presenza di sindromi di Cushing subcliniche o precliniche, nelle quali l’ipercortisolismo è ancora lieve. Per tale ragione, secondo alcuni non può essere considerato come un test di screening universale per la diagnosi di sindrome di Cushing (15).
3. L’esecuzione del test di Liddle con basse dosi di desametasone (0,5 mg x 4/die x 2 giorni): il cortisolo plasmatico viene misurato alle ore 9:00, nel secondo giorno dalla prima
somministrazione di desametasone. La mancata soppressione del cortisolo plasmatico < 18 ng/ml (< 50 nmol/l) è diagnostica di una sindrome di Cushing (17): tale test mostra una sensibilità e una specificità > 95% (16). Tuttavia anche questa indagine è gravata da falsi positivi, essenzialmente dovuti alla depressione endogena, allo pseudo-Cushing alcolico (che si associa generalmente a livelli elevati di transaminasi e di alcolemia) e a malattie gravi con infezioni intercorrenti. Falsi negativi si hanno invece quando ci troviamo di fronte al cosiddetto “Cushing ciclico”.
4. L’esecuzione del test di Liddle con alte dosi di desametasone (8 mg per 2 giorni oppure 8 mg in una sola somministrazione alle ore 23): dopo aver confermato la presenza di una sindrome di Cushing, il test di Liddle ad alte dosi servirà per discriminare tra eccesso secretivo di ACTH ipofisario, in cui si ha una parziale soppressione dei livelli di ACTH (ciò si verifica nell’80-90% degli adenomi corticotropi), dalle forme di origine ectopica, caratterizzate da mancata soppressione. Tale test è dotato di una sensibilitàcompresa tra 60 e 80% e di un’elevata specificità, qualora venga utilizzato un cut-off di soppressione
del cortisolo plasmatico > 50% (18). La specificità può essere incrementata utilizzando un cut-off di soppressione del cortisolo > 80%.
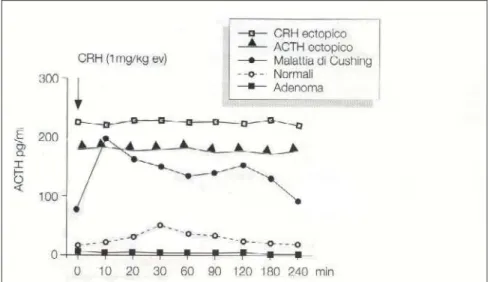
Risultano inoltre particolarmente utili le prove di stimolazione: la prova con CRH infatti, (1 µg/Kg ev., con prelievi da -30 a +120 minuti ogni 30 minuti) è efficace nel differenziare la malattia di Cushing (ACTH > 50% rispetto al basale, Cortisolo > 20% rispetto al basale) dalle sindromi di Cushing da ACTH ectopico (Figura 6). Tuttavia è opportuno dire che il 10-15% dei Cushing ipofisari non rispondono allo stimolo con CRH, e che i pazienti con depressione e obesità presentano una risposta ridotta allo stimolo.
Fig. 6 – Differenti risposte dell’ACTH alla prova con CRH nella sindrome di Cushing a diversa eziologia
1.5 L’imaging nella malattia di Cushing
La diagnostica per immagini nella malattia di Cushing si avvale essenzialmente dell’utilizzo della tomografia computerizzata e della risonanza magnetica nucleare con intensificazione del contrasto mediante gadolinio. La TC è indicata per determinare l’invasione del tumore nelle strutture ossee della regione sellare, ma difficilmente localizza microadenomi ipofisari (< 10 mm).
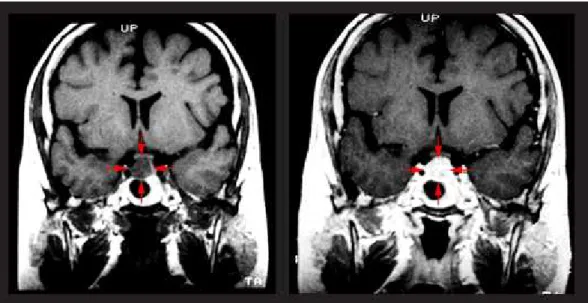
La RMN (Figura 7) può risultare più utile rispetto alla TC, sebbene sia in grado di evidenziare microadenomi ipofisari solo nella metà dei pazienti affetti da malattia di Cushing (13). Una delle principali ragioni di tale mancata diagnosi consiste nel fatto che i tumori ipofisari e il normale tessuto ipofisario circostante spesso mostrano simili patterns di enhancement contrastografico.
Fig. 7 - Donna di 37 anni con malattia di Cushing causata da un macroadenoma di 9 x 11 x 14 mm. Immagine a sinistra: sezione coronale senza mezzo di contrasto della sella turcica. Il macroadenoma appare come un’area di diminuita intensità di segnale che invade il chiasma ottico e il seno sferoidale in basso (frecce). Immagine a destra: RMN con gadolinio: il macroadenoma appare come un’area di aumentato segnale con qualche area di disomogeneità.
La valutazione di una casistica di pazienti trattati con chirurgia trans-sfenoidale ha mostrato come la risonanza magnetica con gadolinio risulti avere una sensibilità del 72% (13 su 18 identificati) a fronte di una sensibilità del 23% della tomografia computerizzata (5 su 22 identificati) (19).
In uno studio pilota effettuato su una casistica di pazienti adulti affetti da malattia di Cushing, è stato dimostrato che la risonanza magnetica eseguita mediante sequenze “spoiled gradient echo”
(SPGR) (Figura 10) risultava superiore alla convenzionale sequenza T-1 pesata spinecho (SE) nell’identificazione dei tumori ipofisari (20). Da ciò si può pertanto concludere che la SPGR-RMN, dal momento che può essere effettuata con sezioni fino a 1 mm di spessore, consente di ottenere una migliore risoluzione spaziale durante l’elaborazione delle immagini.
Figura 10 - Microadenoma. RMN dinamica 3D SPGR con slices di 3 mm di spessore. Risoluzione temporale di 20 secondi. Contrasto iniettato dopo la prima immagine. Da notare il precoce enhancement della ghiandola normale (immagine in alto a sin.). L’adenoma e il restante tessuto ipofisario diventano per lo più indistinguibili nelle immagini successive.
Tuttavia, per meglio chiarire il significato di tali indagini strumentali, è importante mettere in risalto il fatto che in circa il 10-20% dei soggetti senza patologia ipofisaria nota, si può riscontrare la presenza di un microadenoma: da questo si può comprendere come un esame di imaging positivo non consenta di fare diagnosi di malattia di Cushing.
1.6 Anatomia della regione sellare
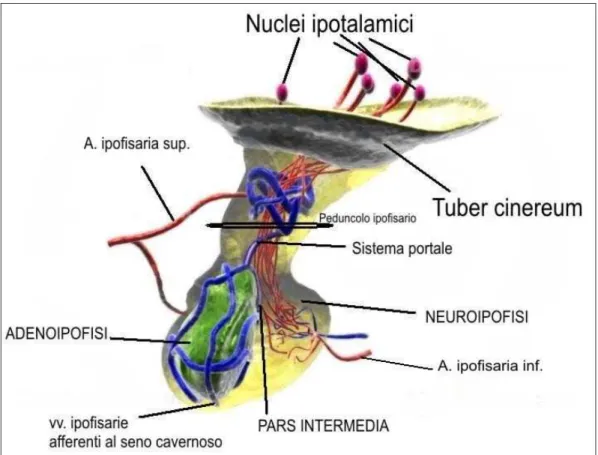
L’ipofisi è una piccola ghiandola rosso-grigiastra di circa 1 cm di diametro situata all’interno della sella turcica dell’osso sfenoide ed è connessa alla porzione inferiore dell’encefalo attraverso il peduncolo ipofisario. Dietro al peduncolo si trovano il tuber cinereum e i corpi
mammillari: al davanti del peduncolo si trova il chiasma ottico che
appoggia sul diaframma della sella (Figura 11).
L’ipofisi è costituita da un lobo anteriore (adenoipofisi) e da un lobo posteriore (neuroipofisi), che differiscono tra loro nella struttura e nello sviluppo. Il lobo anteriore è di dimensioni maggiori ed ha una morfologia reniforme, con la concavità rivolta ad abbracciare posteriormente la neuroipofisi. E’ formato da una parte anteriore e da
una pars intermedia, separate l’una dall’altra da una stretta fessura, ciò che resta della tasca di Ratkhe. La parte anteriore è riccamente vascolarizzata ed è costituita da cellule epiteliali di varie dimensioni e forma, arrangiate in trabecole cordoniformi e separate da sottili vasi sanguigni: cellule somatotrope (60%) secernenti GH, cellule lattotrope (10-15%) secernenti PRL, cellule corticotrope (10-15%) secernenti ACTH, cellule gonadotrope (10-15%) secernenti FSH e LH e cellule tireotrope (<10%) secernenti TSH. Sebbene il lobo posteriore abbia un’origine nervosa, questo non contiene né neuroni né fibre nervose. E’ costituito essenzialmente da cellule di nevroglia modificate dette
pituiciti ed è invaso da colonne che crescono al suo interno e che
originano della pars intermedia, in cui vi sono grandi quantità di una sostanza colloide istologicamente simile a quella tiroidea (21). Le fibre nervose amieliniche che originano dai nuclei sopraottico e
paraventicolare a livello ipotalamico, discendono attraverso il
peduncolo ipofisario e forniscono delle ramificazioni terminali che si mettono in rapporto con la parete dei vasi, dove rilasciano ADH e ossitocina.
Figura 11 – Ricostruzione 3D dell’ipofisi
L’ipofisi è irrorata da due gruppi principali di arterie ipofisarie, le superiori e le inferiori. Le arterie ipofisarie superiori nascono dal
circolo del Willis e penetrano nel peduncolo ipofisario come arterie
anteriori e posteriori: qui danno origine a dei particolari grappoli capillari i quali si aprono in venule che si portano nel lobo anteriore, sboccando nei sinusoidi della parte distale dell’adenoipofisi. In tal modo si realizza la circolazione portale ipofisaria, che permette ai
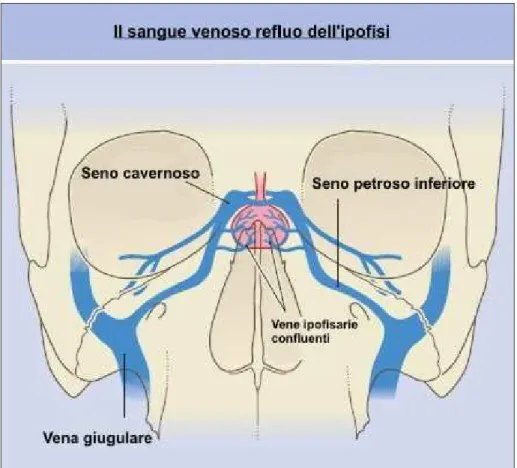
venoso refluo (Figura 12) viene quindi drenato attraverso le vene ipofisarie prima nel seno cavernoso per arrivare, passando attraverso il seno petroso inferiore, nella vena giugulare interna.
Figura 12 – Il sangue venoso refluo dell’ipofisi
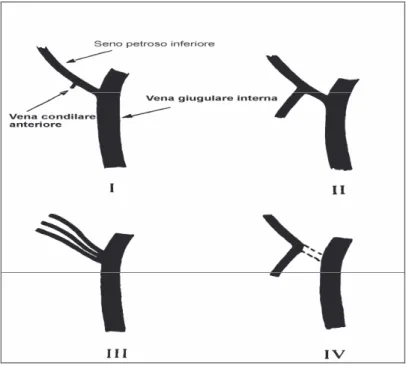
Shiu et al. hanno descritto la presenza di quattro tipi distinti di drenaggio del seno petroso inferiore nella vena giugulare interna
del seno cavernoso con mezzo di contrasto (22). Nel tipo I, il più comune pattern di drenaggio della loro casistica (45%), il seno petroso inferiore drena direttamente nel bulbo della vena giugulare interna. Nel tipo II (24% dei pz.) il seno petroso si anastomizza sia direttamente che attraverso una via comunicante con la vena condilare anteriore, che si estende dal seno marginale (attorno al forame magno) al plesso venoso vertebrale. Nel tipo III (24% dei pz.) il seno petroso inferiore esiste come un plesso di vene piuttosto che come singolo vaso. Nel tipo IV il seno petroso inferiore non raggiunge la giugulare interna svuotandosi direttamente nella vena condilare (22).
Figura 13 – Schema delle quattro variazioni della giunzione tra seno petroso inferiore e vena giugulare interna, descritto da Shiu et al.
1.7 Il cateterismo dei seni petrosi inferiori (IPSS): descrizione della metodica e interpretazione critica dei dati in letteratura
Come abbiamo visto, la diagnosi differenziale della sindrome di Cushing, in particolare la distinzione dell’ipersecrezione di ACTH ipofisaria dalla produzione ectopica, risulta spesso difficile. La RMN costituisce in una buona parte di casi un valido supporto diagnostico; talvolta però, i risultati che si ottengono con tali indagini strumentali possono essere fuorvianti a causa della non trascurabile percentuale di falsi positivi e falsi negativi.
E’ in questo contesto che si colloca l’utilità del cateterismo bilaterale dei seni petrosi inferiori (IPSS – “inferior petrosal sinus
sampling”). Questa tecnica è infatti volta alla dimostrazione di un
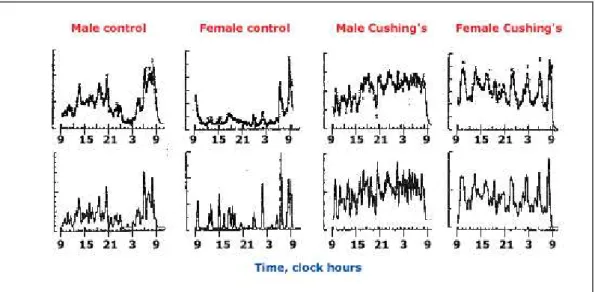
gradiente centro-periferia nella concentrazione di ACTH: tuttavia, considerando che la secrezione di ACTH nella malattia di Cushing è pulsatile (Figura 14), la possibilità di dimostrare senza stimoli esterni la presenza di un gradiente sarebbe ridotta. Per questo motivo tale problema viene superato attraverso la somministrazione di CRH ovino (1 µg/kg di peso corporeo), che determina l’induzione di un picco di ACTH.
Figura 14 – Le analisi di campioni prelevati a intervalli di 10 minuti in soggetti normali (4 grafici di sx) e in pazienti con malattia di Cushing (4 grafici di dx), rivelano che nella malattia di Cushing sono aumentate l’ampiezza e la durata, ma non la frequenza dei picchi di ACTH. Dati tratti da van den Berg, G, Frölich, M,
Veldhuis, JD, Roelfsema, F, J Clin Endocrinol Metab 1995; 80:3750.
La metodica si avvale dell’utilizzo di cateteri di calibro 6-7
French, i quali vengono inseriti attraverso la vene giugulari o
femorali, fino a raggiungere entrambi i seni petrosi inferiori. Prima di ogni prelievo, le punte dei cateteri vengono visualizzate in fluoroscopia: è molto importante che ogni catetere sia nella corretta posizione e non nel bulbo o nella vena giugulare, poiché in tal caso il risultato verrebbe falsato dalla notevole diluizione prodotta dal sangue refluo dalle altre aree del cranio. Il sangue viene quindi prelevato da
una vena periferica attraverso un terzo catetere o da una porta nella vena iliaca.
I prelievi di sangue vengono fatti simultaneamente da entrambi i seni petrosi inferiori (Figura 15) e dalle vene periferiche, al fine di determinare, mediante radioimmunoassay, i livelli di ACTH. Durante ogni prelievo il sangue viene aspirato lentamente in un intervallo di circa 60 secondi, per evitare un flusso retrogrado dalle vene giugulari interne. Si devono ottenere almeno cinque batterie composte da tre prelievi ciascuna: due batterie vengono ottenute immediatamente prima della somministrazione endovenosa di CRH e le restanti tre sono prelevate rispettivamente tra il 3° e il 5° , tra l’8° e il 10° e tra il
Figura 15 - Visione antero-posteriore che mostra le punte dei cateteri (frecce) posizionate nel seno cavernoso attraverso il seno petroso inferiore. A sinistra, radiografia senza sottrazione; a destra, radiografia con sottrazione.
Prima di passare in rassegna gli aspetti della letteratura riguardo al cateterismo dei seni petrosi inferiori, è doveroso premettere che tale procedura trova impiego sia per la misurazione del gradiente centro/periferia dell’ACTH, sia per la determinazione del gradiente intersinusale di ACTH. Nel primo caso, come vedremo successivamente, l’utilità diagnostica sta nella possibilità di compiere una diagnosi differenziale all’interno degli ipercortisolismi ACTH-dipendenti; nel secondo invece, risiede nell’opportunità di localizzare (lateralizzare) un tumore ACTH-secernente non visualizzabile alla RMN.
1.7.1 L’interpretazione del gradiente centro/periferia
Le prime esperienze sul cateterismo dei seni petrosi inferiori risalgono alla fine degli anni Settanta, periodo in cui, i primi studi condotti in materia, si sono focalizzati sul tentativo di identificare l’utilità diagnostica del gradiente centro/periferia di secrezione dell’ACTH.
Corrigan et al. nel 1977 (23) sono stati tra i primi, durante l’esecuzione dell’IPSS, ad utilizzare il gradiente C/P di ACTH nella diagnostica differenziale tra malattia di Cushing e secrezione ectopica di ACTH: tale studio ha permesso di identificare correttamente la malattia di Cushing in una casistica di pazienti che mostravano un gradiente C/P di ACTH 2.
Inizialmente la metodica prevedeva la cateterizzazione selettiva di un singolo seno petroso inferiore: seguendo tale procedura, Findling
et al. nel 1981, in 5 pazienti su 5 affetti da malattia di Cushing,
riscontrarono un gradiente C/P di ACTH > 2 e in 3 pazienti su 3 affetti da secrezione ectopica di ACTH il rapporto C/P di ACTH risultava < 1,5 (24).
Tuttavia dal momento che, dopo studi anatomici, si arrivò a comprendere come l’ipofisi potesse essere dotata o meno di un
drenaggio venoso predominante da un lato, Doppman et al. (nel 1984) hanno ritenuto necessario effettuare il cateterismo dei seni petrosi inferiori bilateralmente, allo scopo di ridurre l’incidenza dei falsi negativi (25). La necessità di estendere bilateralmente lo studio dei dati ottenuti dai prelievi è stata confermata successivamente anche da Oldfield et al. (26).
Nel 1989 McCance et al. (27), sulla base dei precedenti studi (24, 25, 26), adottarono come indicativo di malattia di Cushing un gradiente C/P di ACTH 1,5.
In contrapposizione rispetto al precedente studio di McCance, nel 1991 lo stesso Oldfield (28) riportava dei dati secondo i quali un rapporto di ACTH C/P 2 riusciva ad identificare i pazienti con malattia di Cushing con una sensibilità del 95% e una specificità del 100% e che un rapporto C/P 3 dopo somministrazione di CRH aveva una specificità e sensibilità del 100%.
L’efficacia diagnostica del cateterismo dei seni petrosi inferiori veniva ulteriormente suffragata da uno studio del 1999 condotto su 85 pazienti da Invitti et al. (29), che riscontrava un gradiente C/P basale 2 in 69 pazienti con malattia di Cushing e in un paziente con secrezione ectopica e 3 dopo stimolo con CRH in 65 pazienti su 76.
Di recente Swearingen et al., rispetto ai dati forniti da Oldfield, hanno riportato livelli inferiori di sensibilità diagnostica dell’IPSS, ovvero di 85% con un gradiente basale C/P 2 e di 90% con un gradiente C/P 3 dopo somministrazione di CRH. Secondo tale studio, se l’IPSS è indicativo di ipersecrezione ipofisaria di ACTH, il suo valore predittivo raggiunge il 99% dopo stimolo con CRH (30).
Nei pazienti con sindrome da secrezione ectopica di ACTH (oEAS – “occult ectopic ACTH syndrome”) i livelli di ormone adrenocorticotropo, sia nei seni petrosi inferiori che nella periferia, non aumentano dopo la somministrazione di CRH (Figura 16). Una casistica di pazienti affetti da oEAS, secondo Kaltsas et al. mostrava un rapporto C/P < 2 sia prima che dopo stimolo con CRH: pertanto la specificità di un rapporto C/P > 2, nel distinguere pazienti con malattia di Cushing da quelli con oEAS, era del 100% (31).
Figura 16 - Rapporti ACTH centro-periferia in pazienti valutabili chirurgicamente, prima (sx) e dopo (dx) oCRH. , Pazienti con malattia di Cushing; , pazienti con sindrome da ACTH ectopico. Gli asterischi indicano due casi in cui il gradiente C/P suggeriva fortemente un adenoma ipofisario: sono mostrati i cut-offs che distinguono un adenoma da una sindrome ectopica prima (C/P ratio = 2) e dopo stimolo con CRH (C/P ratio = 3).
Un quadro riassuntivo delle sensibilità, specificità e dei falsi negativi secondo la letteratura è riportato nella Tabella 2. Tutti questi studi dimostrano un significativo beneficio nell’esecuzione dell’IPSS dopo stimolo con CRH.
Tabella 2 – Sensibilità, specificità, falsi negativi e positivi nella letteratura (modificata da Swearingen et al. – Diagnostic errors after Inferior Petrosal Sinus Sampling 2004 JCEM)
1.7.2 Il gradiente intersinusale nella lateralizzazione
Lo studio di Oldfield et al. (26) ha posto l’attenzione sul fatto che, il riscontro di un gradiente unilaterale di ACTH, poteva essere utile non soltanto a identificare la presenza di un microadenoma ACTH-secernente, ma anche a mostrarne la lateralizzazione. Infatti, un gradiente intersinusale di ACTH > 1,4 risultava utile nella dimostrazione di una lateralizzazione della lesione ipofisaria.
Molti altri studi hanno successivamente confermato la validità di tale cut off (31-35), tuttavia è stato posto in evidenza che l’analisi del gradiente intersinusale di ACTH non mostra una validità nella localizzazione della lesione quando il tumore ipofisario è localizzato sulla linea mediana (36). Alcuni hanno tuttavia sostenuto che un gradiente intersinusale < 1,4 poteva essere considerato come indicativo di un tumore della linea mediana oppure di un adenoma bilaterale (37).
Non c’è stato però un consenso unanime sul vantaggio dello stimolo con CRH nella diagnosi della lateralizzazione.I risultati della lateralizzazione erano migliorati da 74% a 83% dopo somministrazione di CRH secondo Kaltsas et al. (31), da 60% a 73% per Doppman et al. (38), e da 60% a 94% per Oliverio etal. (39). Nella
estensiva review di Newell-Price et al. (16), tuttavia, lo stimolo con CRH ovino non migliorava in maniera significativa l’accuratezza della localizzazione.
Per quanto riguarda i falsi negativi nell’IPSS, questi sono principalmente dovuti a incorretto posizionamento dei cateteri o alla rara evenienza di seni petrosi inferiori ipoplasici (40), e inoltre tumori secernenti CRH ectopico ne costituiscono un’altra causa. La Tabella 3 illustra le principali cause di mancata localizzazione e lateralizzazione di un adenoma ipofisario durante l’esecuzione di un cateterismo dei seni petrosi inferiori.
! " # ! $ % & & $ # ' () ' ()
Tabella 3 – Le cause più comuni di mancata localizzazione e lateralizzazione di un adenoma durante l’IPSS
Negli adulti affetti da malattia di Cushing e nei volontari sani, è stato visto che il seno petroso inferiore dominante è quello di destra (41). La maggioranza dei pazienti presentava lateralizzazione destra della secrezione di ACTH, e questo concordava con una successiva localizzazione chirurgica del tumore nel 77% dei casi rispetto al 56% quando la lateralizzazione era a sinistra. Dopo CRH la differenza scompariva (42).
La strategia chirurgica (Figura 17) dopo la valutazione dei dati dell’IPSS è stata la seguente: quando il tumore non era visibile alla RMN pre-operatoria ma l’IPSS aveva dimostrato un gradiente intersinusale > 1,4, la prima incisione veniva fatta nell’adenoipofisi paramediana dal lato del gradiente di ACTH (28). Se non era reperibile tessuto adenomatoso, venivano effettuate incisioni paramediane controlaterali e mediane ed esplorate.
Figura 17 – Approccio chirurgico trans-sfenoidale. 1= incisioni paramediane 2= incisione mediana CL= Clivus PG= ghiandola pituitaria PS= piano sfenoidale
Quando sia la RMN che l’IPSS fallivano ad indicare la localizzazione dell’adenoma, l’intera ghiandola veniva esplorata attraverso due incisioni paramediane verticali e un’incisione mediana. Se il tumore non veniva trovato esplorando la ghiandola, veniva praticata quindi una parziale ipofisectomia dal lato con gradiente maggiore di ACTH o dal lato con maggior sospetto alla visione intraoperatoria (43).
1.7.3. I principali studi sull’utilizzo di parametri biochimici alternativi nell’IPSS
Nel corso degli anni sono emersi degli studi sull’utilità del dosaggio della prolattina durante l’esecuzione dell’IPSS, al fine di migliorare la diagnosi nei pazienti con malattia di Cushing.
Già Vignati et al. nel 1989, avevano mostrato l’associazione tra rapporti di ACTH e prolattina durante prelievo di sangue refluo dai seni petrosi inferiori, probabilmente correlato alla stimolazione paracrina mediata dalla beta endorfina (36).
In seguito McNally et al. nel 1993 , condussero uno studio su otto pazienti con sindrome di Cushing, al fine di determinare se la stimolazione combinata con hCRF e TRH potesse avere utilità durante l’esecuzione del cateterismo dei seni petrosi inferiori nella sindrome di Cushing. I picchi di ACTH furono corretti per i gradienti intersinusale di TSH e PRL. Il gradiente C/P dell’ACTH corretto per la concentrazione di TSH e PRL riuscì a predire correttamente la malattia di Cushing in tutti gli otto casi e dimostrò corretta lateralizzazione del microadenoma ipofisario in 4 pazienti su 5 (44).
Nel 2004 Findling et al. arrivarono a concludere che la misurazione della PRL (come un indice di fedeltà del sangue venoso
effluente durante l’IPSS) e la determinazione di un rapporto centro-periferia di ACTH normalizzato per i livelli di PRL, era utile nell’identificazione dei pazienti con malattia di Cushing che non mostravano un rapporto C/P di ACTH maggiore di 3 dopo somministrazione di CRH (45).
Oltre alla PRL, sono state studiate nel tempo anche le concentrazioni di AVP nel sangue refluo dai seni petrosi inferiori.
A. Colao et al. (46) mostrarono come i pazienti con malattia di Cushing avessero concentrazioni di AVP nel seno petroso inferiore più elevate rispetto ai pazienti sani; inoltre i pazienti con uno scarso
outcome chirurgico mostravano livelli di AVP più alti rispetto a quelli
in cui l’intervento chirurgico era perfettamente riuscito. Sulla base di tali dati quindi veniva posta l’ipotesi che l’AVP potesse essere coinvolta nella persistenza dell’ipersecrezione di ACTH in una sottocategoria di pazienti poco responsivi alla chirurgia. I livelli di AVP nel seno petroso inferiore stimolati dal CRH erano più alti nella malattia di Cushing rispetto ai controlli e ciò era da ricondursi ai più bassi livelli di CRH causati dallo stato di ipercortisolismo, piuttosto che alla malattia di Cushing stessa (47).
Un altro studio ha indicato la possibile riduzione dell’incidenza dei falsi negativi (48) data dalla combinazione di CRH e
desmopressina (DDAVP), analogo sintetico dell’AVP, nei casi non responsivi al CRH, in quanto andava ad incrementare il rilascio di ACTH dagli adenomi corticotropi.
Inoltre la desmopressina, ha trovato impiego anche al posto del CRH per stimolare la secrezione di ACTH. Utilizzando 10 µg di desmopressina ev. e gli stessi criteri presi in considerazione nel test al CRH, 14 pazienti su 17 con evidenza di malattia di Cushing mostravano esito diagnostico positivo (49). Un adenoma ipofisario, veniva correttamente lateralizzato in 9 pazienti su 14 (64%) (50).
Infine nel 2005 Manetti et. al. (51), in uno studio portato a termine su una casistica di 9 pazienti con adenoma ipofisario ACTH secernente, hanno valutato la possibile utilità del dosaggio del “PTH related peptide” (PTHrP), sia a livello dei seni petrosi inferiori che in periferia, dopo somministrazione di CRH. Tale studio partiva dal presupposto che al PTHrP era stato riconosciuto un ruolo significativo nell’ipercalcemia maligna e in molti tessuti, inclusi i tumori ipofisari (52,53).
I risultati dello studio mostravano in tutti e 9 i pazienti un gradiente C/P di ACTH > 2 basalmente e > 3 dopo CRH; al contrario i livelli sierici di PTHrP prima e dopo somministrazione di CRH, risultavano trascurabili (o comunque inferiori alla sensibilità limite del
test) e non veniva osservato un gradiente C/P. Pertanto, alla luce di questo risultato, concordando con Raff. et al. (54), Manetti et al. concludevano che la determinazione del PTHrP a livello del seno petroso inferiore e in periferia, era una procedura di scarsa utilità clinica.
2. SCOPO DELLA TESI
Lo scopo della presente tesi è stato quello di valutare i risultati dell’IPSS prima e dopo stimolo con CRH in una casistica di pazienti affetti da sindrome di Cushing ACTH dipendente, con due finalità:
• valutare la sensibilità e la specificità del gradiente C/P di ACTH nella diagnosi differenziale tra pazienti con malattia di Cushing e pazienti con secrezione ectopica di ACTH
• misurare la sensibilità e la specificità del gradiente intersinusale di ACTH, facendo un confronto diretto con l’efficacia predittiva della RMN, con lo scopo di individuare la lateralizzazione di un adenoma ai fini dell’intervento chirurgico
3. MATERIALI E METODI
3.1 Pazienti
Sono stati inclusi nello studio 37 pazienti con sindrome di Cushing ACTH dipendente, afferiti presso il Dipartimento di Endocrinologia di Pisa nel periodo 2000-2006.
Del totale dei pazienti, 31 erano femmine di età media 45±13 anni (range 18-74) e 6 erano maschi di età media 59±12 anni (range 44-72) (Tabella 4). Il rapporto tra donne e uomini era di 5:1.
Il gruppo di studio era composto da 35 pazienti con malattia di Cushing (CD) e 2 pazienti con secrezione ectopica di ACTH (EAS). Il cateterismo dei seni petrosi inferiori è stato eseguito con successo in tutti e 37 i pazienti, prima e dopo stimolo con CRH.
Tutti i pazienti sono stati sottoposti ad una terapia eparinica preventiva nei 5 giorni successivi all’esecuzione dell’IPSS.
Sesso Età Età media (range)
31 femmine 18-74 45±13 aa 6 maschi 44-72 59±12 aa
Tabella 4 - Caratteristiche dei pazienti arruolati nello studio
3.2 Metodi
3.2.1 Parametri utilizzati per la diagnosi di sindrome di Cushing ACTH-dipendente
Nei 35 pazienti affetti da CD, in primis sono stati eseguiti dosaggi ormonali per valutare il ritmo circadiano del cortisolo, il cortisolo libero urinario e l’ACTH sierico basale.
Successivamente abbiamo eseguito il test al CRH dopo somministrazione di CRH (1
µ
g/Kg ev, con prelievi da -30 a +120 minuti ogni 30 minuti), valutando il picco di cortisolo e ACTH sierici.Infine abbiamo eseguito il test di soppressione con desametasone a basse dosi (0,5 mg x 4/die x 2 giorni) e ad alte dosi (8
I criteri diagnostici che abbiamo utilizzato sono stati trattati estensivamente nel paragrafo 1.4 dell’introduzione.
3.2.2 Metodo di dosaggio dell’ACTH
Abbiamo eseguito il dosaggio sierico dell’ACTH basalmente e dopo stimolazione con 100 µg ev. di CRH, utilizzando un kit comunemente reperibile in commercio (Nichols Institute Diagn. San
Juan Capistrano, CA, USA).
Questo metodo utilizza un anticorpo monoclonale legato ad un estere di acridinio che si lega in maniera selettiva alla regione C-terminale dell’ACTH eun anticorpo policlonale legato alla biotina che si lega alla regione N-terminale. Il campione ematico viene incubato per 21 min. a 37 °C con entrambi gli anticorpi simultaneamente, portando alla formazione di un “complesso sandwich” solubile in presenza di molecole di ACTH. Vengono successivamente aggiunte delle particelle rivestite di streptavidina, e la reazione viene incubata per 10 min., durante i quali il complesso sandwich si lega alle particelle attraverso un’interazione biotina-streptavidina. Quindi, una volta che le particelle si sono fissate, gli anticorpi legati vengono
separati mediante aspirazione e successivo lavaggio con un apposito reagente. Infine, vengono aggiunte al preparato due soluzioni “trigger” per innescare la reazione di chemioluminescenza, e l’emissione di luce viene quantificata da un apposito luminometro (63).
Il nostro laboratorio, utilizzando questo metodo, ha considerato come valori di riferimento per l’ACTH un range di 9-52 pg/ml.
3.2.3 Esami strumentali
Prima dell’esecuzione dell’IPSS, tutti e 37 i pazienti hanno eseguito una RMN della sella turcica con un apparecchio da 1,5 T
(General Electric, Signa Infinity Twinspeed-Milwaukee, WI, USA).
Il protocollo di esecuzione della RMN prevedeva l’acquisizione di sequenze Spin Echo T1 pesate (TR 500 msec, TE 15 msec, campo di veduta 16 cm, matrice 256x256, spessore slice 3 mm) sui piani sagittali e coronali, prima e dopo somministrazione di mezzo di contrasto (gadolinio).
La refertazione delle sequenze ottenute è stata eseguita da un singolo operatore.
3.2.4 Metodo di esecuzione del cateterismo dei seni petrosi inferiori
Per l’accesso venoso è stato utilizzato un Seldinger introdotto bilateralmente attraverso la vena femorale, dopodichè è stato posizionato un introduttore valvolato di calibro 5 French: quindi sono state introdotte le due guide dotate di cateteri vertebrali idrofili di 5
French, e si è raggiunta la giugulare interna fino ad arrivare ai seni
petrosi inferiori, monitorando le punte dei cateteri in fluoroscopia. A questo punto è stato iniettato il mezzo di contrasto e sono state fatte delle acquisizioni radiologiche, visualizzando l’opacizzazione di entrambi i seni petrosi inferiori. Dopo l’iniezione del mezzo di contrasto, sono stati effettuati dei lavaggi cateterali con soluzione fisiologica, per evitare la trombizzazione del vaso, complicanza altrimenti non trascurabile considerato il basso flusso venoso e il ridotto calibro del catetere.
Sono stati infine prelevati bilateralmente campioni ematici di sangue refluo dai seni petrosi inferiori al tempo 0, al 3°, all’8° e al 13° minuto; contemporaneamente venivano effettuati dei prelievi ematici da una vena periferica.
La procedura non ha presentato complicanze di rilievo, fatta eccezione per una transitoria sensazione di fastidio o di dolore
auricolare avvertita da alcuni pazienti durante la cateterizzazione selettiva dell’IPS.
3.2.5 L’intervento chirurgico: interpretazione dei dati dell’IPSS
Tutti i pazienti sono stati inviati dal neurochirurgo con i dati dell’IPSS riguardanti sia il gradiente C/P che il gradiente intersinusale di ACTH, in modo tale che si discriminasse con certezza tra CD e EAS: a tale scopo è stato considerato indicativo di CD il riscontro di un gradiente C/P di ACTH >2 dopo stimolo con CRH, e ai fini della localizzazione/lateralizzazione di un adenoma è stato utilizzato come suggestivo un gradiente intersinusale di ACTH >1,3 a 5 min. dallo stimolo con 1 µg/Kg ev. di CRH. Viceversa è stata considerata predittiva di EAS l’assenza di gradiente C/P di ACTH.
Il neurochirurgo esplorava l’ipofisi per via trans-sfenoidale, descrivendone l’aspetto macroscopico, dopodichè, in mancanza del riscontro visivo diretto di un adenoma, interveniva incidendo la porzione di ipofisi indicata dai dati dell’IPSS riguardanti la lateralizzazione.
Tutti e 35 i pazienti affetti da CD sono stati inviati dal neurochirurgo: del totale, è stato eseguito l’intervento in 33 pazienti mentre 2 pazienti erano ancora in attesa di intervento al momento della raccolta dei dati di questo studio.
4. RISULTATI
4.1 La diagnosi differenziale degli ipercortisolismi ACTH- dipendenti
Nei 35 soggetti affetti da CD, il valore medio di ACTH dosato sui prelievi ematici ottenuti dai seni petrosi inferiori al tempo 0, era di 328±359 pg/ml a dx e di 447±767 pg/ml a sx.
Dopo stimolo con CRH il valore di ACTH centrale raggiungeva un picco medio di 2865±4174 pg/ml a dx e di 3035±4871 pg/ml a sx al 3° minuto, di 2151±2104 pg/ml a dx e di 2211±2772 pg/ml a sx all’8° minuto e di 1427±1225 pg/ml a dx e di 1610±1998 pg/ml a sx al 13° minuto.
Nella figura 18 e nella figura 19 sono illustrati i livelli basali e i livelli massimi assoluti di ACTH dosati rispettivamente nel sangue del seno petroso di dx e di sx dopo stimolazione con 1 µg/Kg ev. di CRH, indipendentemente dal tempo impiegato a raggiungere il picco sierico.
1
10
100
1000
10000
100000
Basale
Dopo CRH (picco)
ACTH IPS dx
A
C
TH
(p
g/
m
l)
Figura 18 – Livelli di ACTH dell’IPS destro, prima e dopo stimolo con 1 µµµµg/Kg ev. di CRH
1
10
100
1000
10000
100000
Basale
Dopo CRH (picco)
ACTH IPS sx
A
C
TH
(p
g/
m
l)
Figura 19 – Livelli di ACTH dell’IPS sinistro, prima e dopo stimolo con 1 µµµµg/Kg ev. di CRH
Per quanto riguarda invece il valore medio di ACTH dosato sui prelievi ematici ottenuti da una vena periferica, al tempo 0 era di 53±42 pg/ml.
Dopo stimolo con CRH il valore di ACTH periferico raggiungeva un picco medio di 65±51 pg/ml al 3° minuto, di 114±106 pg/ml all’8° minuto e di 133±122 pg/ml al 13° minuto.
Nella figura 20 sono illustrati i livelli basali e i livelli massimi assoluti di ACTH dosati in una vena periferica dopo stimolazione con 1 µg/Kg ev. di CRH, indipendentemente dal tempo impiegato a raggiungere il picco sierico.
1
100
Basale
Dopo CRH (picco)
A
C
TH
(p
g/
m
l)
Figura 20 – Livelli di ACTH dosati in una vena periferica, prima e dopo stimolo con 1 µµµµg/Kg ev. di CRH
Su un totale di 35 cateterismi effettuati nei pazienti affetti da CD, il massimo gradiente è stato ottenuto a 3 min. in 23 pazienti (65%), a 8 min. in 8 pazienti (23%) e a 13 min. in 4 pazienti (12%) (Figura 21).
E’ doveroso tuttavia considerare il fatto che i tempi in cui devono essere eseguiti i prelievi non sono da intendere in maniera assoluta, ma piuttosto come un range di tempo: la metodica di prelievo di sangue venoso refluo dai seni petrosi inferiori prevede infatti che l’aspirazione di sangue avvenga molto lentamente (in un intervallo di circa 60 secondi) per evitare un flusso retrogrado dalle vene giugulari interne che altrimenti falserebbe il risultato.
0% 10% 20% 30% 40% 50% 60% 70% 80% 90% 100%
3° minuto 8° minuto 13° minuto
Pz
Figura 21 – Percentuale di pazienti affetti da CD che hanno raggiunto il massimo gradiente C/P, rispettivamente al 3°, all’8° e al 13° minuto.
Il gradiente C/P di ACTH variava da 13,7±24,3 pg/ml a un gradiente massimo di 123,4±172,8 pg/ml, dopo stimolo con 1 µg/Kg ev. di CRH.
In 34 pazienti su 35 affetti da CD, è stato ottenuto un gradiente C/P di ACTH >2, a 5 minuti dallo stimolo con CRH (Figura 22).
Invece, i 2 pazienti con EAS hanno mostrato un gradiente C/P massimo di 1,5±0,6, e questo non variava dopo stimolo con CRH, rimanendo inferiore a 2 prima e dopo stimolo sia dal lato dominante che non.
Pertanto, nel distinguere pazienti con malattia di Cushing da quelli con secrezione ectopica di ACTH, un gradiente C/P di ACTH >2 dopo stimolo con CRH aveva una sensibilità del 97% ed una specificità del 100%.
4.2 La lateralizzazione di un adenoma ipofisario nei pazienti con CD
Il gradiente di ACTH tra i due seni petrosi (dx/sx) era presente in tutti e 35 i pazienti con CD, viceversa era assente nei 2 pazienti con EAS.
Il gradiente intersinusale basale nei pazienti con CD era di 3,9±4,4 pg/ml e arrivava a 12,2±17,5 pg/ml dopo somministrazione di CRH.
Un gradiente intersinusale di ACTH plasmatico >1,3 dopo 5 minuti dalla somministrazione del CRH, è stato ottenuto in 34 pazienti su 35 con CD e i reperti macroscopici fornitici dal neurochirurgo correlavano con i risultati dell’IPSS in 27 pazienti su 34, mostrando, nella localizzazione del lato del microadenoma ipofisario, una sensibilità dell’80%.
4.3 La RMN pre-operatoria: identificazione e localizzazione di un adenoma
Abbiamo eseguito una RMN pre-operatoria in tutti e 37 i pazienti affetti da sindrome di Cushing ACTH-dipendente, ottenendo i seguenti risultati (Figura 23):
- 13 pazienti negativi per adenoma (35 %) - 2 pazienti con sospetto adenoma (5%) - 16 pazienti con microadenoma (43%) - 1 paziente con macroadenoma (3%) - 5 pazienti con sella vuota (14%)
35%
14%
3%
43%
5%
Nella nostra esperienza la RMN ha quindi mostrato, ai fini dell’identificazione pre-operatoria di un adenoma ipofisario, una sensibilità del 55%, notevolmente inferiore se comparata alla sensibilità dell’IPSS (80%).
In un paziente, pur essendo presente un gradiente C/P suggestivo di CD, non c'era lateralizzazione, la RMN risultava negativa per la presenza di un adenoma e all’esplorazione macroscopica dell’ipofisi il neurochirurgo confermava la presenza di un microadenoma in sede mediana.
4.4 Sommario dei risultati
I risultati che abbiamo ottenuto ci consentono di affermare che
(Figura 24):
1. L’IPSS, nel distinguere pazienti con malattia di Cushing da quelli con secrezione ectopica di ACTH, possiede una sensibilità del 97% ed una specificità del 100%
2. L’IPSS è utile nell’identificazione e localizzazione della sede di un adenoma nell’80% dei casi
3. La RMN individua una lesione ipofisaria responsabile di ipersecrezione di ACTH nel 55% dei casi
97%
55%
80%
55%
0
10
20
30
40
50
60
70
80
90
100
! " ! " ! " ! "IPSS
RMN
Figura 24 – Sensibilità dell’IPSS rispetto alla RMN nella diagnosi differenziale degli ipercortisolismi ACTH-dipendenti e nella identificazione/localizzazione di un adenoma ipofisario
5. DISCUSSIONE
La sindrome di Cushing ACTH-dipendente deriva da un incremento nella produzione di ACTH dall’ipofisi o da una origine ectopica. Una delle maggiori sfide della neuroendocrinologia clinica è quella di riuscire a compiere una diagnosi differenziale tra CD ed EAS, utilizzando tecniche biochimiche e radiologiche. E’ stato visto come il prelievo di sangue venoso refluo dai seni petrosi inferiori, con o senza stimolo con 1 µg/Kg ev. di CRH, sia la procedura più accurata per diagnosticare una malattia di Cushing (57).
Nonostante l’IPSS sia una procedura invasiva e la sua percentuale di successo dipenda dalle capacità e dall’esperienza dell’operatore, rappresenta comunque la via più efficace per dimostrare una ipersecrezione ipofisaria di ACTH e pertanto per identificare i pazienti che trarranno benefici dalla chirurgia ipofisaria.
Nella letteratura ci sono stati soltanto due studi relativi all’IPSS che hanno utilizzato una casistica maggiore di 100 pazienti (28, 31). Svariati autori hanno proposto criteri differenti nella diagnosi della malattia di Cushing, basati sul gradiente C/P dell’ACTH: rapporti maggiori di 1,5-2,5 sono stati considerati indicativi di lesione
ipofisaria (27,55,57). Negli studi più recenti l’accuratezza diagnostica dell’IPSS oscilla tra il 90 e il 100%.
Nella nostra casistica di 37 pazienti, un gradiente C/P di ACTH >2, a 5 minuti dallo stimolo con CRH, ha mostrato il 97% di sensibilità e il 100% di specificità nella diagnosi della malattia di Cushing.
Tuttavia, l’utilità dell’esecuzione dell’IPSS allo scopo di distinguere i rari casi di EAS dai pazienti con CD è stata messa in discussione, in particolar modo perché il cateterismo dei seni petrosi inferiori è una procedura invasiva non esente da complicanze.
Alcuni hanno sostenuto il fatto che questa procedura dovrebbe essere riservata ai pazienti con classici segni clinici e biochimici di CD ma con RMN negativa o equivoca, e per i pazienti con test di stimolo e di soppressione equivoci (64).
La maggioranza dei pazienti con CD sono affetti da microadenomi ipofisari (55), e la RMN in più studi ha mostrato, nella capacità di identificare tali lesioni, una sensibilità diagnostica variabile tra il 70 e l’80%: pertanto, risulta chiaro come utilizzando soltanto la RMN, alcuni microadenomi ipofisari non potrebbero essere diagnosticati.
Nella nostra casistica, la RMN ha mostrato una sensibilità del 54% nella diagnosi di un adenoma ipofisario, rivelando la minore accuratezza diagnostica della metodica rispetto a quella dell’IPSS, anche alla luce del fatto che la RMN è una metodica operatore e macchina dipendente, e pertanto difficilmente inquadrabile in un unico standard procedurale.
Inoltre, è opportuno aggiungere che circa il 10-20% delle persone “endocrinologicamente normali” mostrano all’imaging ipofisario delle lesioni ipofisarie di nessuna rilevanza clinica, e questo contribuisce ulteriormente a complicare il significato e la capacità diagnostica della RMN.
E’ quindi di fondamentale importanza stabilire una corretta diagnosi soprattutto ai fini dell’intervento chirurgico, che mostra una percentuale di successo del 50%, e normalizza i livelli di cortisolo in un ulteriore 40% dei pazienti con CD.
La principale ragione dell’utilizzo dell’IPSS per dimostrare un ipercortisolismo ipofisario, sta nel fatto che è ragionevole aspettarsi di trovare livelli più alti di ACTH in prossimità dell’ipofisi rispetto ad una vena periferica, dove si è già verificata una diluizione (65). Tuttavia, poiché la secrezione di ACTH può essere intermittente, esiste un rischio di eseguire un prelievo tra le due fasi secretorie e
pertanto di ottenere un gradiente C/P falsamente negativo. Per tale ragione è stata proposta con successo la stimolazione con CRH durante la procedura. Tuttavia anche con stimolo con CRH, i risultati dell’IPSS possono essere fuorvianti in alcune situazioni non comuni. L’ipercortisolismo periodico è stato infatti documentato anche in questi pazienti, ed è stato suggerito da alcuni il fatto che questi pazienti potevano non essere stati ipercortisolemici al momento del prelievo, mostrando come il cateterismo dei seni petrosi inferiori sia un test di utilità solo in presenza di ipercortisolismo.
I nostri risultati supportano l’utilizzo del CRH prima dell’esecuzione dell’IPSS: un gradiente C/P >2 a 5 min. dall’iniezione di 1 µg/Kg e.v. di CRH, è stato ottenuto in 34 pazienti su 35 e la sensibilità diagnostica aumentava dal 72,5% al 97%.
La letteratura, e la nostra esperienza lo conferma, ci rivela che la maggioranza degli adenomi ACTH secernenti sono confinati ad un lato dell’ipofisi. Diversi studi hanno dimostrato il drenaggio di un’emipofisi nel seno petroso inferiore ipsilaterale e pertanto l’IPSS è stato utilizzato per la localizzazione pre-operatoria dei microadenomi nei pazienti con CD.
Tuttavia sono fondamentali ai fini dell’interpretazione dei risultati della lateralizzazione il corretto posizionamento delle punte
dei cateteri e la morfologia dei drenaggi venosi dell’ipofisi (Mamelak
et al. 1996, Lefournier et al. 2003). Una maggiore accuratezza
diagnostica è stata osservata in quei pazienti che mostravano un drenaggio venoso simmetrico.
I più recenti studi hanno rivelato un’eccellente correlazione tra il gradiente intersinusale e la localizzazione pre-operatoria del tumore, portando alcuni autori a raccomandare l’emipofisectomia diretta alla metà dell’ipofisi in cui la secrezione di ACTH era >1,4 a 5 min. dall’iniezione ev. di CRH, quando un adenoma non veniva reperito all’esplorazione chirurgica.
Riguardo ai dati della lateralizzazione in letteratura, possiamo sicuramente dire l’utilizzo dell’IPSS è una metodica affidabile ai fini della localizzazione pre-operatoria della sede di un adenoma: secondo Newell Price et al. (16), in un’analisi combinata di risultati pubblicati prima del 1998, l’accuratezza diagnostica del cateterismo simultaneo bilaterale dei seni petrosi inferiori per la lateralizzazione degli adenomi corticotropi era del 78%.
Booth e Bonelli (37,60) hanno riportato un’accuratezza del 70% nella localizzazione della lesione ipofisaria.
Per Kaltsas et al. (31) il valore predittivo positivo del gradiente intersinusale era del 74% prima della somministrazione di oCRH e di 83% successivamente.
Un’eccezione è costituita tuttavia dai dati che emergono dallo studio multicentrico italiano condotto da Colao et al. (62), in cui l’IPSS risultava essere sorprendentemente meno affidabile nell’identificare la sede dell’adenoma (reperito durante la chirurgia) rispetto alla RMN (65% vs 75%).
Nei nostri pazienti abbiamo utilizzato un cut off di 1,3 ai fini della dimostrazione di una lateralizzazione di un adenoma: se tuttavia, si trovava un inversione della lateralizzazione del gradiente dai valori pre- ai valori post-CRH, il test non veniva considerato indicativo di lateralizzazione.
La nostra esperienza nell’utilizzo del gradiente intersinusale di ACTH, se confrontata con i reperti macroscopici fornitici dal neurochirurgo, ha mostrato una sensibilità dell’80% nella localizzazione del lato del microadenoma ipofisario, rimanendo in linea con la maggioranza degli studi presenti in letteratura.
6. CONCLUSIONI
I dati del presente studio dimostrano che:
• Il cateterismo dei seni petrosi inferiori è una metodica dotata di alta sensibilità e specificità per la diagnosi differenziale tra malattia di Cushing e secrezione ectopica di ACTH
• Elevate percentuali di successo del cateterismo dei seni petrosi inferiori e minime complicanze sono ottenute solo dopo che un’adeguata esperienza nell’esecuzione della tecnica è stata ottenuta
• Il gradiente intersinusale di ACTH > 1,3 a 5 min. dallo stimolo con CRH ha un valore predittivo maggiore rispetto a quello della RMN nella localizzazione di un adenoma ACTH-secernente
In conclusione possiamo sicuramente dire che il cateterismo dei seni petrosi inferiori acquisisce un ruolo di fondamentale importanza nella diagnosi differenziale degli ipercortisolismi ACTH-dipendenti, e che,
in previsione dell’intervento chirurgico, è una procedura utile ai fini della localizzazione di un adenoma ACTH-secernente non visibile alla RMN.