Capitolo 6.
Principali tipi di infezione occorrenti in pazienti
sottoposti a trapianto d’organo solido.
Mentre l’incidenza delle complicanze infettive dei pazienti trapiantati risulta elevata per tutti i tipi di trapianto, il tipo di infezione, la gravità e la mortalità variano ampiamente a seconda del tipo di graft impiantato (tabella 14).[151]
I siti primari di infezione nei pazienti trapiantati sono le vie urinarie, le vie respiratorie, la cavità intra-addominale e la cute.
Tabella 14: Incidenza di complicanze infettive differenti in pazienti sottoposti a differenti tipologie di trapianto di organo solido.[30]
Tipo di graft Inf. batteriche CMV HSV VZV Candida spp. Funghi miceliali PCP Fegato 33 – 68% 22 – 29% 3 – 14% 5 – 10% 1 – 26% 2 – 4% 4 – 11% Rene 47% 8 – 32% 53% 4 – 12% 2% 1 – 2% 5 – 10% Cuore 21 – 30% 9 – 35% 1 – 42% 1 – 12% 1 – 5% 3 – 6% 1 – 8% Polmone/ Cuore-pomone 35 – 66% 53 – 75% 10 – 18% 8 – 15% 10 – 16% 3 – 19% 15% Pancreas/ Rene-pancreas 35% 50% 6% 9% 32% 3% --
Le infezioni virali in pazienti trapiantati possono assumere molteplici forme che vanno da infezioni asintomatiche, diagnosticate solo sulla base di indagini sierologiche e soprattutto di amplificazione genomica (Polymerase Chain Reaction, PCR), ad infezioni fulminanti o malattie invasive gravate da elevati tassi di mortalità. Le infezioni virali possono essere causate da virus latenti, da agenti virali trasmessi da donatore a ricevente al momento del trapianto o da microrganismi presenti nell’ambiente al quale il paziente immunodepresso è quotidianamente esposto.
La maggior parte delle infezioni batteriche insorge generalmente nei primi mesi dopo il trapianto, interessando il 33-68% dei pazienti sottoposti a trapianto di fegato, il 54% dei
pazienti sottoposti a trapianto di polmone, il 47% dei pazienti sottoposti a trapianto di rene, il 35% dei pazienti sottoposti a trapianto di pancreas ed il 21-30% dei pazienti sottoposti a trapianto di cuore.[88,30,145,146]
Le infezioni fungine insorgono nel 5-20% dei pazienti sottoposti a trapianto d’organo solido, con incidenza variabile a seconda del tipo di trapianto, generalmente minore in soggetti trapiantati di rene e maggiore in soggetti trapiantati di fegato, pancreas ed intestino (tabella 15). Le forme più comuni di infezione fungina opportunistica sono sostenute da Candida spp., Aspergillus spp., Cryptococcus neoformans e micosi endemiche provocate da Histoplasma capsulatum, Coccidioides immitis e Blastomyces dermatitidis; inoltre possono occorrere infezioni da Mucor spp., Tinea spp., Torulopsis spp. e Fusarium spp..[62,144,179-181]
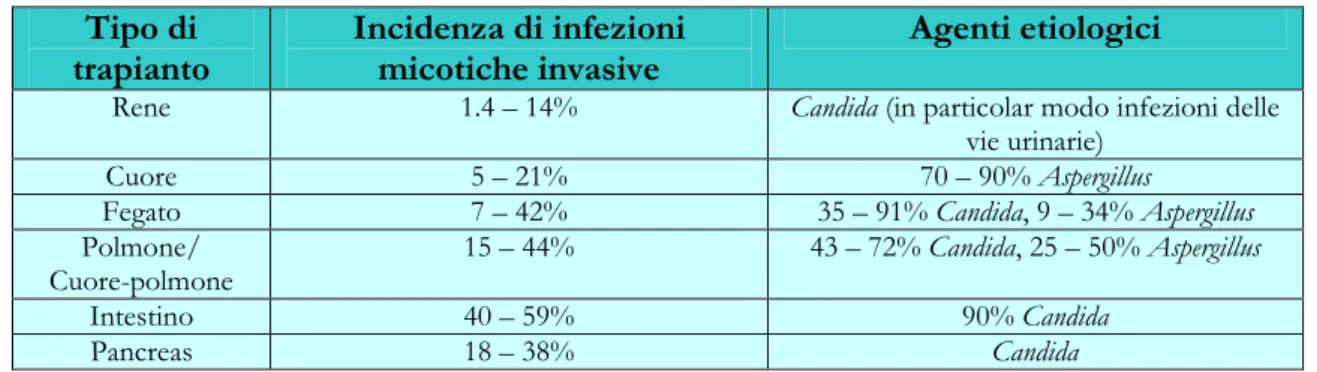
Tabella 15: Incidenza di infezioni fungine e principali agenti patogeni in pazienti trapiantati.
Tipo di trapianto
Incidenza di infezioni micotiche invasive
Agenti etiologici
Rene 1.4 – 14% Candida (in particolar modo infezioni delle vie urinarie)
Cuore 5 – 21% 70 – 90% Aspergillus
Fegato 7 – 42% 35 – 91% Candida, 9 – 34% Aspergillus Polmone/
Cuore-polmone
15 – 44% 43 – 72% Candida, 25 – 50% Aspergillus
Intestino 40 – 59% 90% Candida
Pancreas 18 – 38% Candida
Non esistono dati certi sull’occorrenza di infezioni parassitarie in pazienti sottoposti a trapianto d’organo solido, tranne che per Toxoplasma gondii i cui valori di mortalità e morbidità, soprattutto in soggetti trapiantati di cuore, sono elevati in caso di infezione primaria trasmessa da donatore sieropositivo a ricevente sieronegativo (D+/R-), evento che avviene in circa il 50% dei pazienti sottoposti a trapianto d’organo solido.[88]
6.1 Infezioni da CMV.
Citomegalovirus è il patogeno virale che più comunemente infetta pazienti sottoposti a trapianto d’organo solido, con effetti significativi sulla sopravvivenza del graft e dell’individuo.
Alcuni autori riportano un’incidenza estremamente elevata (fino al 90%) di infezione da CMV post-trapianto diagnosticata sulla base di sieroconversione od evidenza di antigeni virali e/o replicazione genomica su siero in presenza o meno di manifestazioni cliniche di malattia.
Secondo Dunn et al. l’incidenza dell’infezione da CMV in pazienti trapiantati raggiunge approssimativamente valori di 50-75% e quella di patologia clinicamente manifesta valori di 10-35%, con i tassi più elevati rinvenuti in pazienti sottoposti a trapianto di fegato, cuore e polmone.[62]
L’infezione da CMV può essere primaria, derivante da trasmissione da donatore affetto da infezione latente a ricevente sieronegativo (D+/R-): tale tipo di infezione è in grado di determinare i tassi più elevati di mortalità e perdita del graft; oppure può derivare da evenienze relativamente più “benigne” quali: super-infezione, quando il graft da donatore sieropositivo viene impiantato su ricevente a sua volta sieropositivo (D+/R+), e riattivazione del virus nel ricevente sieropositivo indipendentemente dallo status del donatore (D?/R+).[91]
Anche in seguito alla sieroconversione ed alla remissione clinica della patologia spesso non è possibile parlare di guarigione completa: l’incidenza di riesacerbazioni è elevata (circa 25%) ed i pazienti continuano ad essere portatori “sani” del virus.
In generale si distinguono:
• infezione latente quando il virus è presente nelle cellule dell’ospite in assenza di evidente replicazione virale;
• infezione attiva: evidenza di replicazione virale in circolo e/o nei tessuti del paziente: isolamento del virus da sangue, urine, saliva o prelievi bioptici anche attraverso metodiche di coltura rapida (“shell vial”) od ibridizzazione in situ; oppure rilievo di viremia (CMV-DNA) quantitativamente significativa; od ancora riscontro di significativo incremento dell’antigenemia pp65 valutata in numero di cellule infette su 200.000 leucociti
• malattia conclamata quando si realizzino manifestazioni cliniche in presenza di infezione attiva.[62,202,205]
L’infezione da CMV può presentarsi quindi in numerosi modi:
• Infezione asintomatica diagnosticata per isolata dimostrazione di replica virale su differenti campioni biologici;
• Infezione sintomatica in cui CMV è il solo agente etiologico, con manifestazioni differenti a seconda dell’organo interessato o manifestazioni sistemiche in caso di malattia disseminata;
• Infezione sintomatica occorrente in concomitanza di altri eventi infettivi.
Gli effetti dell’infezione da CMV possono essere distinti in “diretti” ed “indiretti” (figura 11).
Gli effetti “diretti”, la cui incidenza cresce proporzionalmente con l’incremento della carica virale, consistono nella malattia conclamata da CMV che si presenta alternativamente come sindrome mononucleosica da CMV, caratterizzata da segni e sintomi simil-mononucleosici quali febbre, mialgie, malessere generale, neutropenia, trombocitopenia e linfocitosi, o come malattia d’organo: polmonite, emorragie del tratto gastrointestinale superiore od inferiore in seguito al prodursi di ulcere CMV correlate, pancreatite, epatite, corioretinite generalmente occorrente in periodo tardivo post-trapianto, od in casi più gravi insufficienza multi-organo (Multiple Organ Failure, MOF).[29,49,62,91,203,215]
Gli effetti “indiretti” dell’infezione da CMV al contrario si estrinsecano più comunemente nei periodi di lenta replicazione virale e rappresentano il risultato della risposta immunitaria dell’ospite al virus immunomodulante.
Tra gli effetti “indiretti” ricordiamo:
• Aumento del livello di immunosoppressione con riduzione del rapporto CD4+/CD8+, capace di aprire la strada a nuove infezioni opportunistiche e prima tra tutte l’infezione da P. jirovecii, ma anche di aumentare fino a 7-10 volte il rischio di sviluppo di PTLD;
• Up-regolation di MHC di classe II nel graft e dell’espressione di molecole di adesione sulle cellule endoteliali e dei loro recettori sui leucociti con aumentata produzione di citochine, tutte modificazioni capaci di incrementare da 2 a 4 volte il rischio di rigetto acuto o cronico con manifestazioni cliniche differenti: disappearing bile duct syndrome nei trapiantati di fegato, bronchiolitis obliterans nei trapiantati di polmone, aterosclerosi coronarica “accelerata” nei trapiantati di cuore e glomerulopatia nei trapiantati di rene.[29,91,204-211-214]
La diagnosi dell’infezione da CMV si basa ormai comunemente sull’identificazione di antigeni virali, in particolar modo la proteina strutturale pp65, e sulla ricerca quali e quantitativa del genoma virale (CMV-DNA) attraverso esami di amplificazione molecolare (PCR), utilizzati anche per il follow-up dei pazienti infetti.[205] Possibile anche l’isolamento colturale con metodiche rapide (tecnica “shell-vial”), metodiche di ibridizzazione in situ ed esami istopatologici effettuati su tessuti infetti e capaci di svelare le tipiche inclusioni cellulari ad “occhio di civetta”.[216]
Figura 11: Infezione da CMV.[22]
6.2 Infezioni da EBV.
L’infezione da virus di Epstein-Barr (EBV) interessa il 25-82% dei pazienti sottoposti a trapianto d’organo solido ed è in grado di provocare infezione asintomatica, polmonite interstiziale che si presenta con febbre, tosse, dispnea ed astenia, oppure interessamento epatico con elevazione delle transaminasi e quadro clinico spesso sfumato.[62,218]
La diagnosi si basa sul significativo incremento del titolo anticorpale diretto verso antigeni nucleari e del capside ma soprattutto sull’incremento quantitativo di EBV-DNA sul sangue e/o in differenti campioni tissutali e su indagini immuno-istologiche degli stessi.
Il rischio principale dell’infezione da EBV è rappresentato dalla capacità del virus di provocare PTLD (Post-Transplant Lymphoproliferative Disorders), gruppo eterogeneo di malattie linfoproliferative che occorrono nel 3-10% dei pazienti adulti sottoposti a trapianto d’organo solido, in particolar modo durante il primo anno post-trapianto, con una mortalità globale del 40-60%.[22,219-221]
EBV, penetrato nei linfociti B-naive, facilita l’espressione di tutta una serie di proteine, note nel complesso come “programma di crescita”, che sono in grado di indurre una proliferazione cellulare policlonale. In numerosi casi il microambiente della cellula B può essere in grado di selezionare specifici cloni cellulari assicurando loro un vantaggio di crescita e provocando un’espansione oligo o monoclonale.
Nel paziente immunocompetente tali linee cellulari vengono eliminate tramite l’intervento di linfociti T citotossici EBV-specifici in grado di riconoscere gli antigeni espressi oppure attraverso la differenziazione di tali cellule monoclonali in linfociti della memoria.
In presenza di una risposta immunitaria non soddisfacente, invece, il tasso di proliferazione degli elementi monoclonali supera la clearance e conduce ad iperplasia delle plasmacellule con successivo sviluppo di PTLD.[217,227,228]
Il maggior fattore di rischio per il prodursi di PTLD è rappresentato dall’infezione primaria da EBV in seguito a trapianti da donatore sieropositivo a ricevente sieronegativo (D+/R-), evenienza occorrente con maggior frequenza in pazienti pediatrici data l’elevata prevalenza (>90%) di sieropositività negli adulti; in questo caso la probabilità di sviluppare malattia linfoproliferativa aumenta da 10 a 76 volte poiché, in assenza di anticorpi specifici, un numero maggiore di cellule B infette viene reclutato nel processo patogenetico. Altri fattori di rischio sono rappresentati da: rigetto, somministrazione di anticorpi antilinfociti e co-infezione con CMV od HCV.
Inoltre il rischio varia in funzione dell’organo trapiantato con incidenza minore in pazienti trapiantati di rene (1%) e progressivamente maggiore in trapiantati di fegato (2.2%), cuore (3.4%), polmone (1.8-7.9%), cuore-polmone (9.4%), intestino (7-11%) e trapiantati multiorgano (13-33%).[22,217,229]
Lo spettro di manifestazioni con cui tali disordini possono manifestarsi spazia da una sindrome infettiva benigna policlonale a cellule B con sintomatologia simil-mononucleosica al linfoma maligno monoclonale (tabella 16); quest’ultimo può insorgere come forma intra-nodale od extra-intra-nodale, e frequentemente si presenta come lesione occupante spazio in prossimità del graft od infiltrante lo stesso, evenienza che pone problemi di diagnosi differenziale non indifferenti anche con le stesse reazioni di rigetto.[22,222-224]
La diagnosi è guidata generalmente dalla ricerca e quantificazione del genoma virale (EBV-DNA) in circolo e/o in differenti campioni bioptici associata ad esami istopatologici.[22,217,225,226,230-232]
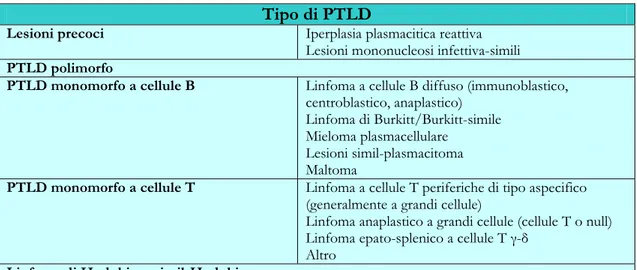
Tabella 16: Categorie di PTLD.
Tipo di PTLD
Lesioni precoci Iperplasia plasmacitica reattiva Lesioni mononucleosi infettiva-simili
PTLD polimorfo
PTLD monomorfo a cellule B Linfoma a cellule B diffuso (immunoblastico, centroblastico, anaplastico)
Linfoma di Burkitt/Burkitt-simile Mieloma plasmacellulare
Lesioni simil-plasmacitoma Maltoma
PTLD monomorfo a cellule T Linfoma a cellule T periferiche di tipo aspecifico (generalmente a grandi cellule)
Linfoma anaplastico a grandi cellule (cellule T o null) Linfoma epato-splenico a cellule T γ-δ
Altro
Linfoma di Hodgkin o simil-Hodgkin
6.3 Infezioni da HSV.
HSV-1 (Herpes simplex virus-1) e, meno frequentemente, HSV-2 sono virus erpetici capaci di provocare in pazienti trapiantati gravi mucositi ulcerate a carico dell’oro-faringe, infezioni cutanee disseminate, patologie gastroenteriche, epatiti fulminanti, polmoniti ed encefaliti. La maggior parte dei casi è sostenuta dalla riattivazione di un’infezione latente.[62,233,234] Il gruppo a maggior rischio è rappresentato dai pazienti trapiantati di cuore e/o polmone che presentano tassi di incidenza di polmonite da HSV che vanno dallo 0.8% al 10%. Non esistono dati precisi circa il ruolo dell’infezione da HSV post-trapianto per quanto concerne sopravvivenza di graft e paziente.[235,259]
La diagnosi di infezione da HSV si pone attraverso: esame clinico, individuazione dell’effetto citopatico provocato da HSV sulle cellule epiteliali attraverso esame citologico di Tzanck, esami sierologici, colturali e rilevazione qualitativa diretta del virus da tessuti infetti tramite amplificazione del genoma virale (PCR).
6.4 Infezioni da VZV.
Il virus della varicella-zoster (VZV) si manifesta clinicamente nel 5-26% dei pazienti sottoposti a trapianto d’organo solido. Soggetti non immuni che vanno incontro ad infezione primaria sono particolarmente a rischio di malattia disseminata, polmonite ed encefalite da VZV.
La diagnosi di infezione da VZV si pone attraverso: esame clinico, individuazione dell’effetto citopatico provocato da VZV sulle cellule epiteliali attraverso esame citologico di Tzanck, esami sierologici, colturali e rilevazione qualitativa diretta del virus da tessuti infetti tramite amplificazione del genoma virale (PCR).[62,236,237]
6.5 Infezioni da virus epatotropi maggiori.
HBV ed HCV sono gli agenti causali più comuni di epatite acuta o cronica nel post-trapianto anche se sono descritte in letteratura infezioni da HAV, HDV ed HEV.
Nonostante la possibilità di infezione primaria nel post-trapianto, più comunemente tali virus tendono a re-infettare il paziente portatore di epatite cronica e sottoposto a trapianto ortotopico di fegato in rapporto alla presenza di reservoir extraepatici. L’andamento dell’infezione da HBV ed HCV procede a partire da una viremia non associata a danno epatico ad epatite acuta, cronica ed infine cirrosi, con aumentato rischio di sviluppare carcinoma epatocellulare.[62,245]
La recidiva di infezione da HCV è un fenomeno universale in pazienti che sono viremici nel periodo pre-trapianto, a rischio nel 50-70% dei casi di sviluppare epatite nel post-intervento.
I principali fattori che influenzano la storia naturale della recidiva di HCV post-trapianto aumentandone la gravità sono rappresentati da: carica virale pre-intervento >1x106 Eq/mL,
genotipo virale 1, episodi di rigetto ed infezione concomitante da CMV.
Generalmente a causa della mancanza di una profilassi efficace la recidiva post-trapianto si manifesta con un incremento della carica virale da 10 a 20 volte superiore rispetto ai valori pre-intervento.[247]
L’andamento dell’infezione HCV correlata è generalmente accelerato: durante i primi 5 anni dopo l’intervento i pazienti affetti hanno una probabilità del 90% di sviluppare epatite cronica, del 30% di evolvere a cirrosi e del 20% di necessitare di re-trapianto.
Un ulteriore 2-5% di soggetti infetti da HCV e sottoposti a trapianto di fegato va incontro ad insufficienza epatica precoce sostenuta da epatite colestatica in assenza di cirrosi, mentre lo scompenso epatico nel primo anno dal trapianto avviene con una probabilità del 42%.[238-244]
La recidiva dell’infezione da HCV può essere controllata dalla somministrazione di IFN o PEG-IFN associato o meno a ribavirina.
Nel paziente affetto da HBV e trapiantato di fegato, HBsAg può persistere oppure scomparire dal sangue nelle prime settimane post-intervento per ricomparire successivamente, spesso preceduto dalla comparsa di HBcAg identificabile all’esame immuno-istopatologico di biopsie epatiche effettuate a scopo di follow-up.
I fattori che comunemente predispongono alla recidiva di infezione da HBV sono: positività sierica di HBeAg in epoca pre-trapianto (83% di probabilità di recidiva), epatite cronica senza evidenza di replicazione attiva (58%), co-infezione con HDV (32%) ed infine epatite fulminante (16%).[246]
L’infezione da HBV è prevenibile attraverso la vaccinazione pre-trapianto, consigliata per tutti i pazienti in lista d’attesa; inoltre l’andamento delle recidive, al contrario di quanto avviene per HCV, è ormai controllabile attraverso l’utilizzo di immunoglobuline specifiche anti-HBs (HBIG) e di farmaci antivirali efficaci per la profilassi quali lamivudina, adefovir, tenofovir ed entecavir.[62]
6.6 Infezioni da BKV e JCV.
BKV e JCV sono poliomavirus ubiquitari la cui prevalenza sierologica è pari al 90% nella popolazione adulta; in seguito all’infezione primaria tali virus persistono in forma latente a livello di sangue, reni ed encefalo, tessuti che rappresentano reservoir per la riattivazione e veicoli per la trasmissione.[248]
L’incidenza di viremia da BKV/JCV è maggiore in pazienti sottoposti a trapianto di pancreas e/o di rene (26%) e molto minore in pazienti trapiantati di cuore (7%) e di fegato (4%); l’infezione concomitante da CMV rappresenta uno dei principali fattori di rischio per l’occorrenza della viremia stessa e sembra associarsi ad un’aumentata replicazione virale.[248-252]
Le sindromi correlate ad infezione da BKV in pazienti sottoposti a trapianto d’organo solido sono rappresentate da nefrite tubulo-interstiziale, stenosi ureterale e disfunzione del graft in pazienti trapiantati di rene.
JCV è invece l’agente etiologico responsabile della leucoencefalopatia multifocale progressiva (PML).
La diagnosi si pone attraverso l’individuazione del DNA virale in campioni di sangue, di urine o tessuti, test utilizzato anche per il follow-up di tali infezioni.[22,249]
6.7 Infezioni delle vie urinarie (IVU).
I pazienti sottoposti a trapianto di organo solido differente da rene e pancreas con drenaggio vescicale in genere non subiscono frequenti manipolazioni delle vie urinarie, eccezion fatta per la cateterizzazione vescicale effettuata durante l’intervento, per cui l’incidenza globale di infezioni delle vie urinarie si assesta tra l’8% ed il 30%, percentuali non superiori ai tassi rinvenuti in pazienti non immunosoppressi sottoposti ad interventi di chirurgia maggiore differenti.
In pazienti sottoposti a trapianto di pancreas con drenaggio vescicale la prolungata cateterizzazione è associata ad elevato rischio di IVU, che, in quanto a sintomatologia, entrano in diagnosi differenziale con cistiti ed uretriti ricorrenti che occorrono frequentemente in tali soggetti a causa dell’irritazione mucosale provocata dalle secrezioni pancreatiche esocrine; inoltre un reperto di batteriuria significativa è presente nell’83% dei casi in riceventi di trapianto di rene.[62,150]
La maggior parte delle IVU occorre nei primi mesi dopo il trapianto ed è correlata all’intervento in sé ed agli alti dosaggi di farmaci immunosoppressori somministrati in questo periodo.
I microrganismi più frequentemente coinvolti sono gli stessi agenti responsabili di IVU in pazienti non trapiantati: batteri Gram-negativi (E. Coli, Klebsiella spp., Enterobacter spp., Pseudomonas aeruginosa), batteri Gram-positivi (Enterococcus spp.) e miceti (Candida spp.); tra i fattori di rischio sono da includere: un lungo periodo trascorso in emodialisi in epoca pre-trapianto, presenza di catetere vescicale, ridotta funzione renale e prolungata profilassi antibiotica post-operatoria (>48 ore).
Il paziente trapiantato di rene, in particolare nei primi 3-6 mesi in presenza di reflusso vescico-ureterale, stenosi uretrale, stenosi del GPU e vescica neurologica, è inoltre a rischio di sviluppare pielonefrite, talora in grado di causare insufficienza renale acuta in genere reversibile con adeguata terapia.[62,147-149]
A meno dell’insorgenza di episodi di pielonefrite acuta e conseguente sepsi, comunque, l’insorgenza di infezioni delle vie urinarie in pazienti sottoposti a trapianto d’organo solido,
in linea generale, non sembra causare significative variazioni della sopravvivenza del graft o dell’individuo.[151-153]
Così come avviene in numerosi altri casi di complicanze infettive in soggetti sottoposti a trapianto d’organo, nella maggior parte dei pazienti con IVU generalmente non compare la classica sintomatologia caratterizzata da disuria, pollachiuria e stranguria, mentre più frequenti sono febbre, ematuria e leucocitosi. Necessari per la diagnosi sono l’esame standard delle urine e l’urinocoltura, in grado di determinare la natura dell’agente patogeno e di testarne la sensibilità a differenti tipi di antibiotico.
6.8 Infezioni della ferita chirurgica.
Le infezioni della ferita chirurgica sono complicanze generalmente gravi, associate con elevati tassi di morbidità, perdita del graft e mortalità. Le infezioni dei tessuti contigui al graft presentano notevoli difficoltà di management richiedendo spesso ripetuti interventi chirurgici ed un periodo di convalescenza prolungato per permettere la guarigione delle ferite per seconda intenzione.
Esistono tre differenti tipi di infezioni della ferita:
• Infezioni superficiali, localizzate al di sopra della fascia;
• Infezioni profonde, occorrenti al di sotto del piano fasciale, all’interno della cavità in cui è stato impiantato il graft.
• Infezioni miste, in presenza di focolai infettivi superficiali e profondi tra loro comunicanti.[62,147]
I tassi di incidenza di tali infezioni, così come gli agenti etiologici e la terapia necessaria differiscono a seconda dell’organo trapiantato, tuttavia l’incidenza globale varia dall’1-2% in pazienti trapiantati di rene al 25-30% in pazienti trapiantati di pancreas od intestino tenue. Valori intermedi si ritrovano in pazienti trapiantati di cuore o polmone (0-8%) e di fegato (6-8% infezioni superficiali e 15-19% profonde).[62,150,154]
L’infezione diviene clinicamente manifesta in genere nelle prime 2-4 settimane dopo il trapianto ed il germe più frequentemente isolato è Staphylococcus aureus, seguito da enterobatteri Gram-negativi, Staphylococcus epidermidis e Candida spp.[151,155]
Molteplici fattori possono predisporre i pazienti a sviluppare un’infezione della ferita chirurgica: oltre a fattori di rischio comuni per tutte le infezioni complicanti il trapianto sono da ricordare: re-esplorazione chirurgica della ferita, formazione di ematoma nei tessuti
contigui al graft, infezioni coinvolgenti il graft e distacco dei drenaggi dai siti di impianto.[62,149,150,156]
I pazienti trapiantati di pancreas sono particolarmente vulnerabili poiché le secrezioni esocrine dell’organo impiantato contribuiscono a creare un eccellente terreno di coltura entro il quale i batteri possono facilmente proliferare.[62,154]
La diagnosi di infezione della ferita chirurgica in pazienti trapiantati può non essere semplice a causa della mancanza di segni e sintomi di allarme quali febbre, dolore o formazione di pus: ricerche colturali su liquidi provenienti da drenaggi e scansioni ecografiche o TAC dei tessuti molli circostanti la ferita possono indirizzare la diagnosi; in caso di infezione superficiale della ferita vanno sempre ricercate eventuali infezioni profonde concomitanti.
Un ritardo nella diagnosi di infezione superficiale può provocare estesa necrosi dei tessuti molli circostanti, conseguenza grave che necessita di aggressivo intervento di toilette chirurgica che deve coinvolgere anche i piani muscolare e fasciale.
Le infezioni profonde sono a loro volta evenienze gravi, frequentemente associate con la formazione di pseudoaneurismi micotici a carico delle anastomosi vascolari del graft che possono andare incontro a pericolose rotture, spesso causa di perdita del graft e di intervento chirurgico urgente.[62,147]
6.9 Infezioni intra-addominali.
L’occorrenza di infezioni intra-addominali è riportata con una frequenza del 2-4% in pazienti sottoposti a trapianto d’organo solido generalmente come complicanza chirurgica in caso graft impiantati entro la cavità addominale o come complicanza di ulcera peptica perforata o di diverticolite del colon perforata.
I pazienti trapiantati di fegato sono in particolar modo a rischio di sviluppare ascessi epatici successivi a stenosi biliare, inspissatio biliare, trombosi o stenosi dell’arteria epatica; colangite secondaria a stenosi biliare od a studi radiologici delle vie biliari (colangiografia con tubo di Kher o colangio-pancreatografia retrograda endoscopica, ERCP); ascessi addominali peri-epatici, splenici, peri-colici o pelvici spesso polimicrobici in pazienti ripetutamente operati; ed infine peritonite.[62,151,157-160]
I batteri più frequentemente implicati sono Enterococcus spp. ed enterobatteri Gram-negativi, anche se non sono rare le infezioni da Staphylococcus spp. e da Candida spp..
Le perforazioni viscerali sia del tratto gastrointestinale superiore che inferiore possono anche essere sostenute da esofagiti o coliti da CMV.
L’immunosoppressione iatrogena inibisce la risposta peritoneale all’infezione diminuendo la capacità di contenzione del processo e contribuendo a rendere sfumato il quadro clinico. La valutazione diagnostica di ogni episodio di discomfort addominale deve essere perciò aggressiva per prevenire l’insorgenza di episodi di peritonite batterica secondaria, gravata da una mortalità del 50-77% in pazienti immunocompromessi, e deve basarsi su radiografie dell’addome con mezzo di contrasto idro-solubile e scansioni ecografiche o TAC.
Il management del paziente affetto da complicanze infettive intra-addominali è complesso e multidisciplinare, coinvolgendo ripetute esplorazioni e drenaggi chirurgici associati a terapia antibiotica prolungata.[62,158,161]
6.10 Polmoniti batteriche.
L’incidenza globale delle polmoniti batteriche in pazienti sottoposti a trapianto d’organo si assesta intorno al 4%, con incidenze relative ai differenti tipi di graft variabili dall’1-2% dei riceventi di rene al 22% dei riceventi di polmone; tutti gli altri tipi di trapianto mostrano un’incidenza di polmoniti batteriche compresa tra il 5% ed il 17%.
La mortalità globale delle infezioni polmonari occorrenti in pazienti trapiantati è significativamente più elevata rispetto alla popolazione generale, con tassi di mortalità del 20-60% nei primi mesi post-trapianto.[62,162,163]
Gli agenti infettivi più comunemente isolati nei primi 3 mesi dopo l’intervento sono batteri Gram-negativi (Klebsiella spp., Enterobacter spp., Pseudomonas aeruginosa), Staphylococcus aureus e Legionella spp.; le infezioni sono frequentemente polimicrobiche ed intercorrenti con colonizzazioni da parte di virus (CMV) e miceti (Candida spp.) che contribuiscono a rendere diagnosi e terapia più difficoltose.
Dopo il terzo mese dal trapianto lo spettro dei patogeni più frequentemente in grado di provocare polmonite si allarga a comprendere Streptococcus pneumoniae, Haemophilus influenzae, Chlamydia pneumoniae, Listeria spp., Nocardia spp. e Mycobacterium tuberculosis.[62,164,165] Molteplici fattori concorrono ad aumentare il rischio di polmonite in pazienti sottoposti a trapianto d’organo solido: ventilazione meccanica, episodi di edema polmonare e procedure chirurgiche associate con il prodursi di aree di atelettasia polmonare. In particolar modo i pazienti trapiantati di polmone sono il gruppo a maggior rischio a causa della ridotta funzione muco-ciliare, della soppressione del riflesso della tosse e delle dosi particolarmente elevate di farmaci immunosoppressori utilizzate; tra i trapiantati di
polmone i pazienti affetti da fibrosi cistica sono inoltre a rischio di colonizzazione ed infezione da parte di batteri farmaco-resistenti (Pseudomonas spp.), e pertanto debbono essere sorvegliati con particolare attenzione.[62,92-95,166,167]
Febbre, malessere generale e tosse produttiva sono i sintomi più comuni delle infezioni polmonari, ma possono essere poco evidenti in pazienti immunocompromessi. L’aspetto fondamentale nel management della polmonite in pazienti trapiantati è l’identificazione rapida del patogeno responsabile e l’inizio tempestivo della terapia antibiotica specifica.
I pazienti con sintomatologia insorta da breve tempo (inferiore a 3 giorni) con addensamento focale alla radiografia o TAC del torace ed in cui si evidenzi la presenza di neutrofili ed una popolazione batterica predominante alla colorazione Gram dell’espettorato debbono iniziare rapidamente una terapia antibiotica con copertura verso i batteri “comuni” identificati; al contrario la presenza di infiltrati diffusi o lesioni nodulari, di tosse non produttiva o la lunga durata della sintomatologia (>7 giorni) depongono più comunemente per patogeni opportunisti “insoliti” e in questi casi dovrebbe essere considerata l’opportunità di indagini diagnostiche invasive per chiarire l’etiologia: lavaggio bronco-alveolare (BAL), biopsia polmonare e metodiche colturali o sierologiche specifiche (antigene urinario per Legionella spp.) sono frequentemente in grado di permettere la diagnosi e di guidare la terapia.[62,151,162,168,169,257]
6.11 Setticemia.
La maggior parte degli episodi di setticemia si realizza nel periodo precoce post-trapianto con incidenza variabile dal 10% al 41%.[62,147,170]
IVU, infezioni del catetere venoso centrale (CVC) o di differenti devices, polmoniti ed infezioni della cute e dei tessuti molli sono le sorgenti più frequenti da cui i batteri riescono a guadagnare il torrente circolatorio. Gli agenti più frequentemente implicati sono i patogeni Gram-negativi, in particolare Escherichia Coli, Klebsiella spp., Enterobacter spp. e Serratia spp..[62,154,171,260]
I fattori favorenti principali sono rappresentati da: marcata leucopenia, graft proveniente da donatore cadavere ed alte dosi di terapia antirigetto; un ulteriore fattore di rischio è la splenectomia che favorisce episodi setticemici: l’assenza della milza aumenta sensibilmente l’incidenza di sepsi batteriche causate in particolar modo da microrganismi capsulati quali Streptococcus pneumoniae od Haemophilus influenzae verso cui è possibile la vaccinazione
pre-La mortalità causata da episodi di sepsi batterica e shock settico in pazienti sottoposti a trapianto d’organo solido raggiunge percentuali >50%, perciò nel sospetto di setticemia, in attesa dell’esito delle emocolture, è indicato il tempestivo inizio di una terapia antibiotica empirica.[62]
6.12 Infezioni micobatteriche.
Le infezioni da micobatteri possono avere uno spettro di manifestazioni particolarmente ampio nei pazienti sottoposti a trapianto d’organo solido; l’incidenza globale si assesta intorno all’1-2% per raggiungere l’1-6% nei paesi in via di sviluppo ed il 15% in aree endemiche, con un tasso di mortalità globale del 30%.
Nel 60-75% dei casi le infezioni micobatteriche sono sostenute da Mycobacterium tuberculosis. La modalità di presentazione di gran lunga più comune è l’infezione polmonare isolata che occorre nel 40% dei casi seguita da infezione pleuro-polmonare invasiva, epatite granulomatosa, infezione gastrointestinale, interessamento di osso ed articolazioni, ascessi cerebrali e disseminazione miliare.
Sebbene non sia semplice definire l’esatto corso della malattia da infezione micobatterica nel post-trapianto sembra che l’evento infettivo sia nella maggioranza dei casi sostenuto dalla riattivazione di focolai latenti, mentre si ritiene che infezione primaria e trasmissione donatore-ricevente siano eventi decisamente meno comuni.[62,172-174,178]
L’infezione da Mycobacterium tuberculosis deve essere presa in considerazione in ogni paziente trapiantato che presenti infiltrati apicali o lesioni cavitate alla radiografia o alla TAC del torace.
La diagnosi di infezione micobatterica in pazienti sottoposti a trapianto d’organo solido è generalmente complicata dall’anergia sostenuta dalla terapia immunosoppressiva che riduce notevolmente l’utilità dello skin-test; l’esecuzione di BAL o di biopsie transbronchiali con ricerca del microrganismo attraverso metodiche di amplificazione genomica e colturale può permettere una corretta diagnosi etiologica.[62,175-177]
6.13 Infezioni del sistema nervoso centrale.
Le infezioni del sistema nervoso centrale in pazienti trapiantati si possono suddividere in quattro differenti categorie.[29]
• La meningite acuta è generalmente sostenuta da Listeria monocytogenes, in grado di causare inoltre encefalite, polmonite e setticemia in pazienti immunocompromessi. La mortalità riportata per infezioni da Listeria spp. in pazienti trapiantati di rene è di circa il 26%. In letteratura non esistono dati inerenti l’incidenza di meningite da germi capsulati in pazienti trapiantati e splenectomizzati.
• Cryptococcus neoformans è il principale agente patogeno in grado di sostenere quadri di
meningite subacuta o cronica in pazienti sottoposti a trapianto d’organo solido, in particolar modo secondari ad infezione polmonare. Anche altri agenti patogeni quali Mycobacterium tuberculosis, Listeria monocytogenes, Nocardia asteroides, miceti responsabili di micosi sistemiche ed EBV possano provocare sindromi cliniche dalle manifestazioni simili.
• Infezioni cerebrali focali, in genere manifestatesi con convulsioni o deficit neurologici focali, possono essere sostenute da malattie linfoproliferative EBV correlate (PTLD), infezioni da Toxoplasma gondii in particolar modo in pazienti trapiantati di cuore, ed infezioni metastatiche da Aspergillus spp.
• Infine quadri di demenza progressiva sono generalmente associati a leucoencefalopatia multifocale progressiva causata da poliomavirus JC.[29,253]
Gli effetti anti-infiammatori della terapia immunosoppressiva tendono generalmente a mascherare i segni e sintomi di irritazione meningea e le alterazioni dello stato di coscienza; pertanto i sintomi che più comunemente depongono per infezione del SNC del paziente immunocompromesso sono rappresentati da febbre e cefalea di natura indeterminata che debbono essere valutati attentamente attraverso accurato esame neurologico, scansioni TAC e/o RM ed esame del liquor.[29,253]
6.14 Infezioni da
Candida
spp.
Candida spp. è il fungo più frequentemente isolato in soggetti trapiantati e sostiene il 35-91% delle infezioni fungine in tali pazienti.
Incidenza e presentazione clinica risultano ampiamente variabili tra un tipo di graft e l’altro: sono da attribuire a Candida spp. il 62-83% delle infezioni fungine in pazienti trapiantati di fegato ed il 95% in trapiantati di rene, inoltre Candida spp. colonizza fino all’86% dei trapiantati di polmone ed ha un’incidenza del 7-15% in trapiantati di pancreas.
I principali fattori predisponenti per l’infezione da Candida spp. in pazienti trapiantati includono: fattori chirurgici, uso prolungato di devices, nutrizione parenterale, terapia immunosoppressiva ad alte dosi, neutropenia prolungata, diabete mellito, terapia antibiotica ad ampio spettro ed infezione da parte di virus immunomodulanti quali CMV e, soprattutto, HHV-6.[137,180,183,184]
Un trend particolarmente preoccupante insorto negli ultimi anni, non solo in pazienti sottoposti a trapianto d’organo, è l’aumento di incidenza di ceppi di Candida non-albicans azolo-resistenti.[52,137]
6.15 Infezioni da
Aspergillus
spp.
Aspergillus spp. interviene nell’1-4% delle infezioni dei pazienti sottoposti a trapianto d’organo solido ed è il secondo agente etiologico più comune per quanto riguarda le infezioni micotiche, sostenendo il 9-52% delle stesse (tabella 17).
Nella metà dei casi l’infezione si presenta nella sua forma disseminata, con un tasso di mortalità che raggiunge il 92%.[62,144,181,182,185,186]
L’infezione da Aspergillus spp., in particolar modo nei primi 3 mesi dopo l’intervento, si osserva con maggior frequenza in pazienti riceventi trapianto di fegato e, soprattutto, di polmone rappresentando il 50% delle infezioni fungine che si manifestano in tali soggetti; l’infezione interessa nel 75% dei casi le anastomosi bronchiali e tracheo-bronchiali, nel 18% dei casi il parenchima polmonare e nel 7% dei casi l’intero organismo sotto forma di infezione disseminata.[137,144,166,187-190]
Tabella 17: Epidemiologia infezione da Aspergillus.[137]
Tipo di trapianto Incidenza di aspergillosi invasiva Incidenza media di colonizzazione da Aspergillus Tempo di insorgenza (giorni) Frazione di infezioni causate da aspergillosi disseminata Tasso di mortalità Fegato 1 – 8% 0.5% 50 – 60 87% -- Polmone 3 – 14% 23% 120 15 – 20% 68% Cuore 1 – 15% ND 45 20 – 35% 78% Rene 0.9 – 4% 1.7% 82 9 – 36% 77% Pancreas 1.1 – 2.9% ND ND ND 100% Intestino 0 – 3.6% ND ND ND 100% ND: non determinabile.
Il tipo di manifestazione più comune dell’infezione da Aspergillus spp. (90% dei casi) è generalmente la polmonite con infiltrati diffusi o, più comunemente, sotto forma di noduli singoli o multipli, in presenza o meno di cavitazione.
La diagnosi differenziale si pone in particolare con polmoniti di origine batterica e generalmente per chiarire il dubbio è necessaria l’esecuzione di TAC torace, biopsie transbronchiali e rilevazione di antigeni fungini (galattomannano) che spesso si ritrovano su siero già prima della comparsa di segni clinici e radiologici dell’infezione.
La forma disseminata di infezione da Aspergillus spp. coinvolge frequentemente il SNC (10-50% dei casi) con ascessi insorgenti a livello degli emisferi cerebrali o, più raramente, di cervelletto e tronco encefalico; inoltre possono essere interessati: vie respiratorie superiori, oro-faringe, seni paranasali, cute e midollo osseo.[62,137,191-194]
6.16 Altre infezioni fungine.
Il 37% di tutte le infezioni da funghi miceliali in pazienti sottoposti a trapianto d’organo solido sono sostenute da agenti differenti da Aspergillus spp. e sono gravate da tassi di mortalità del 18-56%.
I microrganismi più frequentemente implicati sono zigomiceti, dermatiacei o funghi ialini (Fusarium spp.), che occorrono con particolare frequenza in pazienti che vanno incontro a re-trapianto.
Le infezioni da zigomiceti si manifestano nel 57% dei casi come forme encefaliche ma possono occorrere anche infezioni polmonari, cutanee e disseminate.[137,195-197]
L’infezione da Cryptococcus neoformans insorge in pazienti sottoposti a trapianto in media dopo 1.6 anni dall’intervento con incidenza del 2.8-5.2% e mortalità intorno al 42%.
Nel 55% dei casi il SNC è l’unico sito di infezione colpito da Cryptococcus neoformans, anche se talora si tratta di colonizzazione successiva a focolai polmonari; con percentuali di incidenza minori possono essere interessati anche cute, tessuti molli, osso ed articolazioni. La manifestazione più frequente della criptococcosi del SNC è la meningite subacuta o cronica, mentre la formazione di masse occupanti spazio (criptococcomi) è di gran lunga meno comune.[137,198-200]
Le micosi endemiche sono sostenute in pazienti trapiantati da Coccidioides immitis con incidenza del 7-9% nel sud-ovest degli Stati Uniti e nel nord del Messico, e da Histoplasma
capsulatum e Blastomyces dermatitidis con incidenza dello 0.5-2% nelle valli del Mississippi e del fiume Ohio negli Stati Uniti e possibile riattivazione in aree non endemiche.
La coccidioidomicosi si manifesta tipicamente dopo alcuni mesi dal trapianto come sindrome subacuta con anoressia, perdita di peso, astenia, malessere generale e febbre, anche se sono stati descritti casi di sepsi e polmonite in seguito ad infezioni in fase precoce post-trapianto con mortalità rispettivamente del 72% e del 25%.
La manifestazione più frequente di istoplasmosi e blastomicosi in pazienti sottoposti a trapianto d’organo solido è rappresentata da infezione disseminata (>75% dei casi) con epato-splenomegalia, lesioni mucocutanee eritema nodoso-simili, infezione polmonare ed adenopatia intra-toracica.[62,137]
Il rischio di sviluppare infezione da Pneumocystis jirovecii si assesta intorno al 10-12% in pazienti non sottoposti a profilassi con cotrimossazolo, strategia preventiva che ha diminuito sensibilmente l’incidenza dell’infezione in soggetti sottoposti a trapianto d’organo solido.
L’infezione risulta dalla riattivazione del microrganismo latente o da colonizzazione de novo a partire dall’ambiente esterno e si manifesta con polmonite interstiziale bilaterale evidenziabile alla TAC con il tipico aspetto a “ground-glass”, ed i cui segni e sintomi principali sono tosse, tachipnea, febbricola, ipossiemia con ipocapnia marcate.[62,201]
![Tabella 14: Incidenza di complicanze infettive differenti in pazienti sottoposti a differenti tipologie di trapianto di organo solido.[30]](https://thumb-eu.123doks.com/thumbv2/123dokorg/7333874.91147/1.892.152.798.620.823/incidenza-complicanze-infettive-differenti-sottoposti-differenti-tipologie-trapianto.webp)
![Figura 11: Infezione da CMV.[22]](https://thumb-eu.123doks.com/thumbv2/123dokorg/7333874.91147/5.892.153.788.343.818/figura-infezione-da-cmv.webp)
![Tabella 17: Epidemiologia infezione da Aspergillus.[137]](https://thumb-eu.123doks.com/thumbv2/123dokorg/7333874.91147/17.892.146.826.856.1067/tabella-epidemiologia-infezione-da-aspergillus.webp)