2. CARBA ANALOGHI DEI VINIL EPOSSIDI E VINIL AZIRIDINE
DERIVATI DAI GLICALI: UNA NUOVA VIA DI ACCESSO AI
CARBAZUCCHERI
2.1 Vinil epossidi e vinil aziridine derivati dal
D-galattale e
D-allale: stato
dell’arte
2.1.1 Sistemi eterociclici vinilici derivati dai glicali
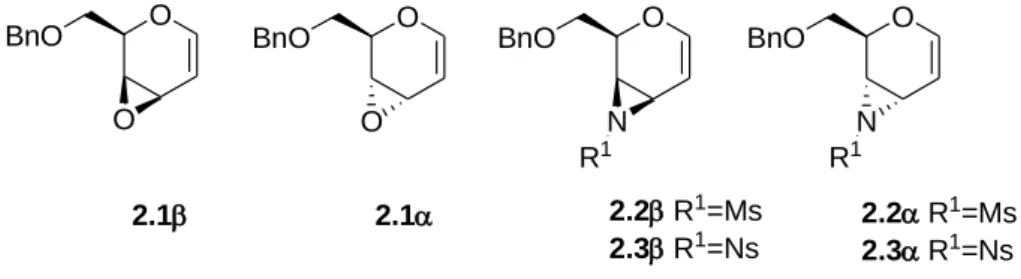
Recentemente, nel laboratorio in cui ho condotto la mia tesi, erano stati sintetizzati e studiati nuovi sistemi eterociclici vinilici derivati dai glicali: l’epossido 2.1β96 derivato dal D-galattale e l’epossido 2.1α97 derivato dal D-allale e le corrispondenti vinil aziridine N-mesilate 2.2β98 e 2.2α99 e N-nosilate 2.3β e 2.3α.100
O O BnO O O BnO O N BnO O N BnO 2.1 2.1 2.2R1=Ms 2.3R1=Ns 2.2R1=Ms 2.3R1=Ns R1 R1
Figura 2.1. Vinil epossidi e vinil aziridine derivate dai glicali
I sistemi riportati in Figura 2.1 possiedono un intrinseco interesse sintetico, dovuto al fatto che sono al tempo stesso glicali e vinil ossirani o vinil aziridine, come illustrato nello Schema 2.1.
Come vinil ossirani e vinil aziridine, questi sistemi sono caratterizzati da una doppia reattività quando sono sottoposti a reazione di addizione nucleofila: il nucleofilo può attaccare i) il C(1) vinilico terminale del “sistema coniugato” attraverso una tipica addizione 1,4 (addizione coniugata o reazione SN2’, via a) per fornire α- e/o β-glicosidi 2,3 insaturi o pseudo glicali, indicati come α- e β-prodotti di addizione 1,4, e ii) il carbonio ossiranico o aziridinico vinilico C(3) per dare glicali sostituiti attraverso un processo diretto di apertura, generalmente 1,2-anti (processo SN2, via b) per dare glicali sostituiti, indicati come prodotti di addizione 1,2-anti. Da sottolineare che il C(1) del sistema vinilico ossiranico o aziridinico corrisponde anche al classico sito reattivo di
ogni sistema glicale, cui gli epossidi 2.1α e 2.1β e le aziridine 2.2α e 2.2β e 2.3α e 2.3β, di fatto appartengono (Schema 2.1).
O O
O
X
HX HX
BnO BnO BnO
Nu Nu Nu via b via a Nu X= O, NMs, NNs addizione 1,2-anti o SN2 addizione 1,4 addizione coniugata o SN2' X= O, NMs, NNs
prodotto di addizione 1,2-anti prodotto di addizione
glicali sostituiti glicosidi 2,3 insaturi
2.1 X=O X=NMs X=NNs 1 3 4 2 Nu Nu a b
Schema 2.1. Regioselettività dell’addizione nucleofila nei vinil ossirani 2.1β e nelle aziridine 2.2β e 2.3β, derivati dai glicali
Gli epossidi 2.1β, 2.1α e le N-mesil 2.2α, 2.2β e N-nosil aziridine 2.3α, 2.3β non sono sufficientemente stabili da essere isolati, ma possono essere convenientemente preparati “in situ” mediante ciclizzazione, in condizioni alcaline per t-BuOK, degli immediati precursori stabili, ossia i corrispondenti trans-idrossi mesilati (HMs) (o trans- N,O-dimesilati o trans-N-nosil-O-mesilati come mostrato nello Schema 2.2, dove come esempio viene riportata solo la sintesi “in situ” dell’epossido 2.1β a partire dal corrispondente idrossi mesilato 2.4β) e quindi messo immediatamente a reagire con l’opportuno nucleofilo (O-, C-, N- e S-nucleofili).
O OH BnO MsO O O R1O t-BuOK solvente (PhH, Et2O, MeCN, THF) 2.4 2.1
Schema 2.2. Sintesi “in situ” dell’epossido 2.1β
Le reazioni di addizione dei nucleofili sono state condotte facendo uso di due diversi protocolli:
-protocollo A: la base (t-BuOK, 1 equiv) è aggiunta ad una soluzione del precursore diretto stabile dell’epossido o dell’aziridina, nel nucleofilo (ad es. l’alcool) utilizzato come solvente. Queste condizioni di reazione sono quindi caratterizzate dalla presenza di un largo eccesso di nucleofilo.
-protocollo B: la base (t-BuOK, 1 equiv) è aggiunta ad una soluzione del corrispondente precursore stabile dell’epossido o dell’aziridina in un solvente anidro non nucleofilo (benzene, toluene, THF, MeCN, Et2O), contenente il nucleofilo (3-4 equiv). Queste condizioni di reazione sono caratterizzate quindi dalla presenza solo di un piccolo eccesso di nucleofilo.
Come indicato da studi teorici condotti facendo uso di sistemi di calcolo B3LYP e MP2, l’epossido 2.1β e le aziridine 2.2β e 2.3β esistono come unico conformero β’, mentre l’epossido 2.1α esiste come miscela di equilibrio 1:1 fra i due possibili conformeri α’ e α’’, mentre le aziridine 2.2α e 2.3α esistono come equilibrio 35:65 fra α’ e α’’ (Schema 2.3). O X OBn O X BnO O OBn X O BnO X 2.1'''''''''''''''''' X = O, N-Ms, N-Ns
Schema 2.3. Conformeri di vinil epossidi 2.1β e 2.1α e vinil aziridine 2.2β, 2.2α, 2.3β e 2.3α
2.1.2 Reattività degli epossidi 2.1β e 2.1α con O-nucleofili
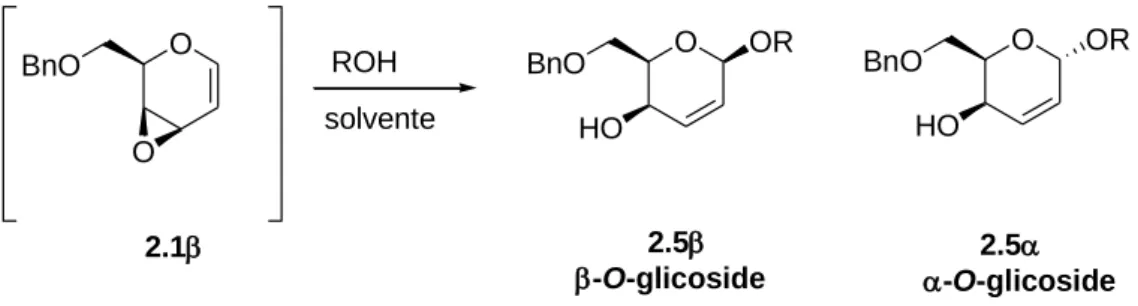
I risultati più interessanti erano stati ottenuti nello studio che riguardava le reazioni di addizione di O-nucleofili agli epossidi vinilici 2.1β e 2.1α: in presenza di alcooli quali O-nucleofili i sistemi analizzati si erano comportati da eccellenti glicosil donatori, promuovendo un efficace processo di glicosilazione.
Le reazioni di addizione di alcooli (MeOH, EtOH, i-PrOH, t-BuOH) all’epossido 2.1β (secondo il protocollo A) avevano fornito i corrispondenti O-glicosidi (prodotti di addizione 1,4) con una completa regioselettività 1,4, ma con una stereoselettività che
dipendeva dal tipo di alcool usato96 (Schema 2.4). Infatti nella reazione condotta col MeOH si otteneva una miscela circa 1:1 di α- e β-glicosidi 2,3 insaturi, mentre l’uso dell’EtOH e dell’i-PrOH più ingombrati portava ad un aumento di β-selettività con un rapporto α/β rispettivamente 25:75 e 5:95. O O BnO 2.1 ROH solvente O BnO BnO O HO OR HO OR -O-glicoside -O-glicoside 2.5 2.5
Schema 2.4. Reazioni di addizione di alcooli all’epossido 2.1β.
Conducendo invece la reazione di addizione secondo il protocollo B, si otteneva un processo completamente 1,4-regio- e β-stereoselettivo con formazione esclusiva dei corrispondenti β-O-glicosidi.
La completa 1,4 regio- e β–stereoselettività ottenute nelle reazioni di addizione di O-nucleofili (alcooli) all’epossido 2.1β è stata razionalizzata mediante l’intervento di una coordinazione tra l’ossigeno ossiranico e l’ossidrile alcolico del nucleofilo attraverso un legame a idrogeno, come mostrato in Figura 2.2. In questo modo il nucleofilo viene ad essere efficientemente trasportato sulla faccia β del sistema vinil ossiranico e appropriatamente disposto per un suo attacco coniugato β-diretto sul C(1), favorito dal punto di vista entropico, come trovato sperimentalmente.
O O OBn H O R 1 2.6 O HO OR BnO O-glicosidi-2,3-insaturi
R= Me, Et, i-Pr, t-Bu O O BnO 2.1 ROH (3 equiv) solvente prodotto di coordinazione
Figura 2.2. Razionalizzazione della 1,4 regio- e β-stereoselettività nelle reazioni di addizione di alcooli all’epossido 2.1β
Analogamente a quanto osservato per l’epossido 2.1β, i risultati ottenuti nelle reazioni di addizione nucleofila dell’epossido 2.1α con gli alcooli (O-nucleofili), avevano indicato come le reazioni fossero completamente 1,4-regioselettive, con una stereoselettvità α/β dipendende dal tipo di protocollo (A o B) utilizzato: in presenza di quantità controllate di nucleofilo (3-4 equiv) si ottenevano stereoselettivamente α-O-glicosidi (Schema 2.5 e 2.6). O O BnO 2.1 ROH solvente O BnO BnO O HO OR HO OR -O-glicoside -O-glicoside 2.8 2.8
Schema 2.5. Reazioni di addizione di alcooli all’epossido 2.1α.
Analogamente a quanto ammesso per l’epossido 2.1β, in questo caso la completa 1,4-regio- ed α-stereoselettività osservata nella reazione dell’epossido 2.1α con gli alcooli era stata razionalizzata mediante una possibile coordinazione tra l’ossigeno ossiranico e il nucleofilo attraverso un legame a idrogeno, come mostrato nella struttura 2.10 (Schema 2.6). In questo modo il nucleofilo viene ad essere efficacemente trasportato sulla faccia α del sistema vinil ossiranico e quindi viene a trovarsi appropriatamente disposto per un suo attacco α-diretto sul carbonio C(1) a dare il corrispondente prodotto di addizione α-1,4 (α-glicoside), come sperimentalmente trovato. In questo processo di addizione l’epossido 2.1α dovrebbe ragionevolmente reagire attraverso il suo conformero 2.1α’, nel quale la coordinazione consente un più favorevole attacco nucleofilo pseudoassiale da parte del nucleofilo stesso sul C(1) del sistema vinilico (Schema 2.6).
O BnO O O OBn O H O R a O BnO O O BnO HO OR ROH(3 equiv) prodotto di coordinazione glicosidi-2,3-insaturi 2.1 2.10 2.1' 2.1'' 2.9 solvente
R= Me, Et, i-Pr, t-Bu
Schema 2.6. Razionalizzazione della 1,4 regio- e α-stereoselettività nella glicosilazione di alcooli da parte dell’epossido 2.1α
2.1.3 Reattività delle N-(nosil)-vinil- aziridine derivate dal D-allale e D-galattale con O-nucleofili
Gli alchil O-glicosidi nei quali uno o più gruppi ossidrilici legati allo scheletro carbonioso sono sostituiti da gruppi amminici liberi o variamente sostituiti, vengono chiamati amminozuccheri.
Gli amminozuccheri rappresentano un’importante categoria di carboidrati modificati presenti in oligosaccaridi e glicoconiugati di importanza biologica,101 pertanto lo sviluppo di metodologie sintetiche efficienti per ottenere questi carboidrati rappresenta un obiettivo importante. A questo proposito, l’interesse del gruppo presso il quale ho svolto la mia tesi, si era diretto verso la possibilità di introdurre, in modo stereoselettivo una funzionalità azotata sul carbonio C(4)del sistema glicale.
Al momento solo pochi metodi sono riportati in letteratura per la sintesi di questi utili composti. I più convenienti di questi coinvolgono un riarrangiamento da vinil cianato a isocianato, di es-3-enopiranosidi e una sostituzione vinilica, palladio-catalizzata, da parte di ammine secondarie su opportuni es-2-enopiranosidi.102
L’osservazione che nella α- e β-O-glicosilazione stereospecifica di alcooli e fenoli mediante gli epossidi 2.1α e 2.1β, il gruppo ossidrilico in C(4)presente nel prodotto di addizione deriva dall’epossido, aveva spinto il nostro gruppo di ricerca a cercare di realizzare un analogo trasferimento di azoto alla posizione C(4), mediante l’impiego di un’aziridina attivata quale utile intermedio che avrebbe consentito, qualora si fosse comportata in modo analogo ai sistemi vinil ossiranici precedentemente visti, di realizzare l’introduzione regio- e stereoselettiva di una funzionalità amminica protetta
sulla posizione C(4) di un sistema piranosidico, con contemporanea formazione del legame glicosidico. O O O O N Nu RHN Nu RHN R' R R' R' N R 4 1 4 R' Nu Nu 1
Schema 2.7. Trasferimento di un gruppo NHR al C(4) di un sistema pseudo glicale
Allo scopo di sintetizzare aziridine con un gruppo N-attivante che potesse essere facilmente rimosso, una volta che fosse avvenuto il processo di glicosilazione, erano state sintetizzate le nosil aziridine diastereoisomere 2.3α e 2.3β, portanti il gruppo N-(o-nitrobenzensulfonil) come gruppo protettivo/attivante.100 Infatti, una volta avvenuto il processo di glicosilazione, il gruppo N-nosile può essere rimosso facilmente, mediante il protocollo PhSH/K2CO3, sulla basedi un efficace meccanismo SNAr,103 a dare il gruppo amminico libero.
La sintesi delle N-nosil aziridine procede a partire dai 3-ammino alcool trans 2.10 e 2.11, ottenuti dagli epossidi 2.1β e 2.1α rispettivamente, come illustrato nello Schema 2.8. O O O MsO O BnO BnO BnO NH2 HO NHNs K2CO3 MeCN O N BnO Ns O O BnO BnO O NH2 HO O MsO BnO NHNs O N BnO Ns K2CO3 MeCN
Schema 2.8. Sintesi delle N-nosil aziridine 2.3α e 2.3β
Per valutare l’efficacia delle aziridine 2.3α e 2.3β come glicosil-donatori, la possibile influenza del gruppo N-nosile sulla regio- e stereoselettività del processo di apertura e
l’applicabilità della procedura di deprotezione sui prodotti N-(nosilammino)-sostituiti che derivano dal processo di glicosilazione, è stato esaminato il comportamento regio- e stereochimico delle aziridine 2.3α e 2.3β nelle reazioni con O-nucleofili, quali alcooli, monosaccaridi parzialmente protetti e fenoli. I risultati ottenuti hanno indicato complessivamente, in maniera analoga a quanto già osservato con i corrispondenti epossidi vinilici, che le aziridine 2.3α e 2.3β, sia in condizioni di protocollo A che in condizioni di protocollo B, forniscono ancora un risultato completamente 1,4-regio e prevalentemente (protocollo A) o esclusivamente (protocollo B) stereoselettivo verso l’anomero avente la stessa configurazione dell’aziridina di partenza (α-anomero per 2.3α e β-anomero per 2.3β).
La completa 1,4 regioselettività e la stereoselettività correlata alla configurazione dell’anello aziridinico, osservate in tutte le reazioni delle N-nosil aziridine 2.3α e 2.3β con O-nucleofili, poteva essere razionalizzata, ancora una volta, mediante l’intervento di una coordinazione in forma di legame a idrogeno, fra l’O-nucleofilo e l’azoto aziridinico di 2.3α e 2.3β che, analogamente a quanto ammesso precedentemente con gli epossidi, è in grado di dirigere l’attacco nucleofilo sul C(1) del sistema vinil aziridinico (Schema 2.9). O N OBn '' Ns O R H b 1 O BnO O OBn N H O R a NsHN OR Ns O BnO NsHN OR via b via a 2.13 2.13
prodotto di coordinazione prodotto di coordinazione
-O-4-amminoglicoside -O-4-amminoglicoside
protetto protetto
R = Me, Et, i-Pr, Bn, t-Bu, allil, metil, diacetone D-glucopiranosil
Schema 2.9. Razionalizzazione dell’addizione regio- e stereoselettiva di alcooli alle N-nosil aziridine 2.3α e 2.3β
Come riportato nello Schema 2.9 l’aziridina 2.3α reagisce ragionevolmente attraverso il suo conformero più stabile 2.3α’, mentre l’aziridina 2.3β reagisce attraverso l’unico conformero esistente 2.3β’, come dimostrato da calcoli teorici.
Il protocollo di deprotezione (PhSH/K2CO3), applicato ai metil glicosidi 2.13α e 2.13β presi come appropriato esempio (Schema 2.10), si era dimostrato estremamente efficace e aveva condotto ai corrispondenti metil 4-ammino-4-desossi-α-O-glicosidi o β-O-glicosidi 2.14α e 2.14β in modo estremamente semplice e in buone rese.
O BnO NsHN OCH3 BnO O H2N OCH3 2.13 2.14 O BnO H2N OCH3 O BnO NsHN OCH3 2.13 PhSH K2CO3/MeCN PhSH K2CO3/MeCN
Schema 2.10. Reazione di deprotezione dei metil 4-N-(nosilammino)-O-glicosidi 2.13α e 213β
In conclusione, questo nuovo processo di O-glicosilazione degli alcooli che utilizza le N-nosil aziridine 2.3α e 2.3β, seguito dal processo di deprotezione, costituisce un semplice e valido strumento per la sintesi C(4)-regioselettiva e stereospecifica di O-glicosidi 2,3-insaturi-4-ammino-4-desossi, ovvero di pseudoglicali, portanti un gruppo amminico libero sulla posizione C(4).
2.2 Carba analoghi dei vinil epossidi derivati dal
D,L-allale e
D,L-galattale
In tempi più recenti, l’interesse del gruppo di ricerca presso cui ho svolto la presente tesi, si è rivolto verso i carbazuccheri. In questo ambito era stata presa in considerazione la possibilità di applicare ai carba analoghi dei glicosil donatori 2.1α e 2.1β il nuovo processo di glicosilazione completamente stereoselettivo e substrato-dipendente, messo a punto nel nostro laboratorio e illustrato nei paragrafi precedenti, utilizzato anche in un’interessante versione reiterativa.
Negli epossidi vinilici diastereoisomerici 2.15α e 2.15β, carba analoghi degli epossidi 2.1α e 2.1β, l’ossigeno endociclico degli epossidi derivati dai glicali, è sostituito con un gruppo metilenico (Fig. 2.3).
O O BnO O BnO O O BnO O BnO
Teoricamente, qualora i carba epossidi 2.15α e 2.15β si fossero comportati da buoni glicosil donatori (come 2.1α e 2.1β), utilizzando il nostro processo di glicosilazione anche nella versione reiterativa, sarebbe stato possibile sintetizzare, con un approccio completamente nuovo, carba oligosaccaridi, analoghi dei veri oligosaccaridi, con possibili, interessanti applicazioni quali mimetici dei carboidrati (Schema 2.11). O BnO O BnO carbadisaccaride 2.15carbadisaccaride HO HO OR O BnO HO HO OR O BnO
Schema 2.11. Carbadisaccaridi possibili dagli epossidi 2.15α e 2.15β
Erano stati quindi sintetizzati i due epossidi 2.15α e 2.15β diastereoisomeri, precedentemente non noti, e ne era stato studiato, in via preliminare, il comportamento regio- e stereoselettivo in reazioni di addizione nucleofila con O-nucleofili che sembravano i più interessanti nell’aspettativa di poter riscontrare elevati gradi di 1,4- regio e α- o β-stereoselettività.
Nella prima fase di questo studio gli epossidi 2.15α e 2.15β erano stati sintetizzati in forma racema. Così, utilizzando una procedura sintetica riportata in letteratura104-106 piuttosto lunga ma che garantiva la completa stereoselettività di tutti i passaggi, era stato sintetizzato il triolo 2.16, mediante un’iniziale reazione di Diels-Alder fra il furano e il metil acrilato (Schema 2.12).
O O OMe + HO OH HO BnO O 2.15 BnO O 2.15 2.16
Schema 2.12. Intermedi della via di sintesi degli epossidi 2.15 α e 2.15 β
Seguendo poi procedure già utilizzate per le sintesi degli epossidi vinilici derivati dai glicali, il triolo 2.16 era stato trasformato prima nell’epossido 2.15β, a sua volta poi trasformato nell’epossido 2.15α.
Gli epossidi 2.15α e 2.15β, diversamente dai corrispondenti epossidi di tipo glicale 2.1α e 2.1β, si sono dimostrati sufficientemente stabili da poter essere isolati e conservati anche per tempi lunghi, per prudenza comunque a basse temperature (15°C).
2.2.1 Reazioni di addizione nucleofila di alcooli agli epossidi 2.15α e 2.15β
O-Nucleofili
Lo studio del comportamento regio- e stereoselettivo dei due epossidi diastereoisomeri 2.15α e 2.15β ha inizialmente riguardato il loro comportamento con il MeOH preso come semplice esempio di O-nucleofili. Sono state esaminate diverse condizioni di reazione (ambiente alcalino, ambiente acido, diverso rapporto substrato/nucleofilo) e i risultati ottenuti sono abbastanza interessanti. Il comportamento chimico dei due epossidi 2.15α e 2.15β in termini di regio- e stereoselettività dell’addizione nucleofila è abbastanza diverso fra loro ed è soprattutto diverso il loro comportamento se confrontato con quello dei corrispondenti sistemi vinil ossiranici di tipo glicale.
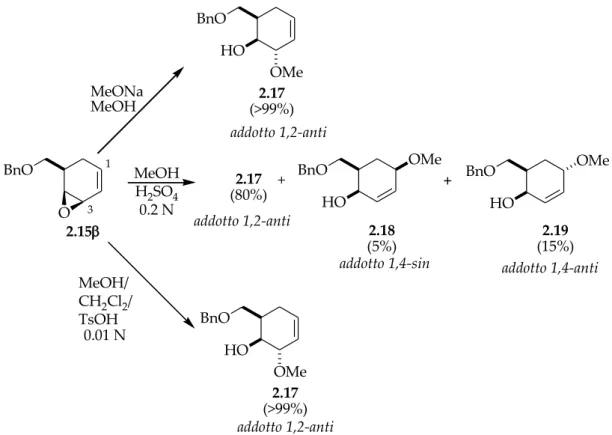
Nel caso dell’epossido 2.15 β (Schema 2.13), la completa 1,2-regioselettività a dare il trans metossi alcool 2.17 è ottenuta solo in ambiente alcalino o in ambiente acido, ma in questo caso solo quando il nucleofilo, disperso in un solvente non nucleofilo (CH2Cl2), sia presente in piccola quantità rispetto all’epossido (soluzione 0.01N). Una completa o, quantomeno, prevalente regioselettività 1,4 non è mai osservata, in quanto anche in condizioni acide più spinte (MeOH/H2SO4 0.2N) la reazione conduce ad una miscela 80:20 dei corrispondenti addotti 1,2, il metossialcool 2.17, e 1,4α (il metil-O-glicoside 2.19) e 1,4 β (il metil-O-metil-O-glicoside 2.18).
HO BnO BnO O 2.15 HO BnO HO OMe BnO + BnO HO OMe OMe OMe MeONa MeOH MeOH H2SO4 0.2 N MeOH/ CH2Cl2/ TsOH 2.17 (>99%) 2.17 (80%) 2.18 (5%) 2.19 (15%) 2.17 (>99%) + addotto 1,2-anti addotto 1,2-anti addotto 1,2-anti
addotto 1,4-sin addotto 1,4-anti 1
3
0.01 N
Schema 2.13. Reazioni di metanolisi dell’epossido 2.15β in ambiente acido e alcalino
Mentre l’addizione 1,2-anti di nucleofili a sistemi vinil ossiranici costituisce un comportamento tipico di questi sistemi, qualcosa di più va detto a proposito dell’addizione 1,4. Le richieste stereoelettroniche di una reazione di addizione-1,4 consistono nella necessità che l’orbitale p, che si sviluppa per rottura del legame ossiranico C-O vinilico, sia in grado di sovrapporsi con l’adiacente orbitale p dell’esistente doppio legame, in modo tale che, già nelle reazioni di addizione, possa formarsi il legame del nuovo doppio legame. Questa richiesta stereoelettronica è parimenti soddisfatta sia che l’attacco nucleofilo avvenga dalla stessa parte (sin) o dalla parte opposta (anti) rispetto al legame C-O vinilico (Fig. 2.4).107
Così, in genere, la reazione di addizione-1,4 non è altamente stereoselettiva: l’attacco del nucleofilo può avvenire sia sin che anti, dipendentemente dalla natura del nucleofilo, dagli effetti sterici (che favoriscono in genere l’attacco dalla parte opposta rispetto all’anello ossiranico), e dalla possibilità di avere una sostituzione inter- o intramolecolare.
Il comportamento dell’epossido diastereoisomero 2.15α con gli stessi O-nucleofili presenta caratteristiche simili a quelle osservate con l’epossido 2.15β, con alcune significative differenze (Schema 2.14).
OMe OMe HO HO HO HO OMe OMe BnO
BnO BnO BnO BnO
O + + MeONa MeOH MeOH H2SO4 0.2 N MeOH CH2Cl2 TsOH 0.01 N 2.15 2.20 (>99%) 2.20 (32%) 2.21 (44%) (24%)2.22 68% addotto 1,2-anti
addotto 1,2-anti addotto 1,4-sin addotto 1,4-anti
1 3
OMe
HO HO HO
OMe OMe
BnO BnO BnO
+ + 2.20 (43%) 2.21 (47%) (10%)2.22 57%
addotto 1,2-anti addotto 1,4-sin addotto 1,4-anti
Schema 2.14. Metanolisi dell’epossido 2.15α in ambiente acido e alcalino
Innanzitutto la metanolisi condotta in ambiente alcalino (MeONa/MeOH) è anche in questo caso completamente C(3)-regioselettiva ed anti-stereoselettiva con esclusiva formazione del trans metossi alcool 2.20. Anche in questo caso la reazione di metanolisi in ambiente acido (MeOH/H2SO4 0.2 N) è risultata non regioselettiva e poco stereoselettiva conducendo ad una miscela di reazione costituita dal corrispondente addotto 1,2-anti [il trans metossi alcool 2.20 (32%)] accompagnato da una miscela del corrispondente addotto 1,4-sin (il cis metossi alcool 2.21) (44%) e addotto 1,4-anti (il trans metossi alcool 2.22) (24%). Il comportamento dell’epossido 2.15α è quindi simile
a quello osservato con l’epossido 2.15β, con l’importante differenza che la regioselettività verso l’addizione 1,4 era decisamente prevalente (68%). L’uso di condizioni di reazione caratterizzate dalla presenza di quantità controllate di nucleofilo (CH2Cl2/MeOH/TsOH, 0.01 N) migliorano il risultato non tanto per quanto riguarda la regioselettività-1,4, che anzi diminuisce (57%), bensì in termini di sin-stereoselettività nei confronti dell’addotto 1,4-sin (47%). Questa osservata sin-stereoselettività è particolarmente interessante, perchè rende la reazione di addizione potenzialmente utile ai fini della costruzione di carba oligosaccaridi.
L’inversa regioselettività osservata nelle reazioni degli epossidi 2.15α e 2.15β con MeOH, può essere attribuita ai diversi effetti conformazionali e stereoelettronici coinvolti nelle loro reazioni di apertura in ambiente acido.
Innanzitutto bisogna tener conto della situazione conformazionale presente nei due epossidi: 2.15α e 2.15β. Sulla base di un esteso studio conformazionale teorico condotto nel nostro laboratorio, basato su metodi di calcolo B3LYP, era stato calcolato che, per quanto riguarda l’epossido 2.15β, fra i due conformeri 2.15β’ e 2.15β’’, esiste un ΔG + 4.40 Kcal (conformero 2.15β’ 99%), mentre, per quanto riguarda l’epossido 2.15α, fra i due conformeri 2.15α’ e 2.15α’’ esiste un ΔG + 2.91 Kcal (ad indicare un rapporto 2.15α’:2.15α” = 96:4) (Schema 2.15). E’ interessante notare che i due conformeri 2.15β’ e 2.15α’ hanno la stessa conformazione d’anello, con l’ossigeno ossiranico dalla stessa parte del gruppo metilenico allilico.
L’analisi conformazionale degli epossidi 2.15α e 2.15β inizialmente determinata attraverso lo studio teorico, sopra riportato, è stata successivamente confermata da un appropriato studio conformazionale attraverso l’esame dei loro spettri 1
H NMR. BnO O 2.15 O BnO 2.15 = = OBn O BnO O 2.15' (>99%) 2.15 '' (<1%) 2.15' (96%) 2.15'' (4%) BnO O OBn O G +4.40 Kcal G +2.91 Kcal
Su questa situazione conformazionale dei due epossidi si inserisce la loro particolare reattività in reazioni di addizione nucleofila (Schema 2.16). Tenuto conto del fatto che l’apertura trans-diassiale di un anello ossiranico è da considerarsi il processo di apertura energeticamente favorito, si può vedere come questo si realizzi in modo estremamente efficace nell’epossido 2.15β. Infatti, in questo epossido, reagente praticamente attraverso il suo unico conformero 2.15β’, l’attacco diretto del nucleofilo sul C(3), a dare prodotti di addizione 1,2, corrisponde perfettamente alle caratteristiche di trans-diassialità richieste e non sembra risentire di alcun disturbo sterico (via a). Ne segue che l’addizione 1,2 anti, per quanto non costituisca l’unico processo di apertura attivo in questo epossido, sia largamente favorito e prevalga sulla competitiva addizione 1,4. Quest’ultima, poi, avviene in modo non selettivo, potendo procedere per attacco sul C(1), sia attraverso la faccia α che β del sistema insaturo (vie b e c) (Schema 2.16).
OBn O 2.15' NuH H+ OBn O+ H NuH NuH NuH a c b -H+ via a HO Nu BnO apertura trans-diassiale via b via c HO Nu BnO HO BnO Nu addotto 1,4-sin addotto 1,4-anti addotto 1,2-anti 1 3 -H+ -H+
Schema 2.16. Meccanismi di formazione dell’addotto-1,2 anti, -1,4 anti e -1,4 sin nelle reazioni di addizione nucleofila dell’epossido 2.15β
Nell’epossido 2.15α, la situazione è decisamente diversa. L’attacco nucleofilo sul carbonio ossiranico vinilico C(3), attraverso il conformero largamente prevalente 2.15α’, corrisponde ai requisiti di trans-diassialità richiesti, ma è allo stesso tempo
soggetto ad una interazione sterica 1,3-sin diassiale con il legame C(5) - C(6) (via a) (Schema 2.17). Ne segue che il processo di apertura a dare il corrispondente prodotto di addizione 1,2-anti risulterà alquanto rallentato, tanto da far sì che il regioisomero attacco sul C(1) (addizione 1,4) diventi competitivo fino a diventare l’attacco percentualmente prevalente (vie b e c). Per gli stessi motivi legati alla interazione 1,3-sin diassiale, si ricava che, all’interno dell’addizione 1,4, l’attacco 1,4-1,3-sin (via b) prevalga sul corrispondente attacco 1,4-anti (via c), per quanto il primo corrisponda ad un attacco di tipo pseudoequatoriale (Schema 2.17).
NuH H+ NuH NuH c b -H+ via a HO Nu BnO apertura trans-diassiale via c via b HO Nu BnO HO BnO Nu addotto 1,4-anti addotto 1,4-sin attacco pseudoassiale attacco pseudoequatoriale OBn O BnO O BnO O a -H+ addotto 1,2-anti 1 3 H + 2.15' -H+
Schema 2.17. Meccanismi di formazione dell’addotto 1,2-anti, 1,4-anti e -1,4-sin nelle reazioni di addizione nucleofila dell’epossido 2.15α
2.3 Carba analoghi delle aziridine N-nosilate derivate dal
D,
L-allale e
D,
L-galattale
Nel proseguimento degli studi rivolti alla individuazione di sistemi mimici di carboidrati capaci di reagire in reazioni di addizione nucleofila, l’indagine condotta nel nostro laboratorio era stata rivolta alle N-nosil aziridine attivate 2.23α e 2.23β, carba analoghe delle aziridine 2.3α e 2.3β derivate da glicali, precedentemente sintetizzate e studiate in modo originale nel nostro laboratorio. L’interesse verso le aziridine 2.23α e 2.23β era inizialmente dovuto alla possibilità che questi sistemi potessero condurre ad elevati gradi di 1,4-regioselettività in reazioni di addizione di O-nucleofili. Questo avrebbe permesso di utilizzare le aziridine stesse come agenti “glicosilanti” per la costruzione di sistemi carba-glicosidici e, fra questi, di disaccaridi misti (una unità carba ed una saccaridica) uniti tra loro attraverso il carbonio C1 del sistema carba a mimare il carbonio anomerico. Contemporaneamente una funzionalità ammino o ammino-protetta sarebbe stata inserita in modo completamente regio- e stereoselettivo sul C(4) della porzione carba-glicosilante a dare in definitiva mono- od oligosaccaridi riconducibili agli amminocarbazuccheri.
Una volta sintetizzate, dai corrispondenti epossidi 2.15α e 2.15β di opposta configurazione (Schema 2.18), è stato esaminato il comportamento regio- e stereoselettivo delle aziridine 2.23α e 2.23β in reazioni di addizione nucleofila.
BnO BnO N N Ns Ns BnO O BnO O 2.15 2.15 2.23 2.23 O BnO N Ns carba analogo di 2.3 O BnO N Ns 2.3 carba analogo di
Considerato che, nella nostra aspettativa di utilizzare questi sistemi per la costruzione di O-glicosidi e di O-linked oligosaccarici mimici, a noi interessava in modo particolare il loro comportamento verso gli O-nucleofili, era stato preso il MeOH quale O-nucleofilo modello, da noi ritenuto adeguato allo scopo. Al tempo stesso, al fine di avere informazioni sul comportamento chimico delle nuove aziridine che avessero valore il più generale possibile e quindi ragionevolmente trasferibili a qualsiasi altro O-nucleofilo, semplice o complesso, è stata presa come reazione modello quella che prevede l’impiego del MeOH in solo piccolo eccesso rispetto all’aziridina utilizzata (6 equiv) in un solvente non nucleofilo quale CH2Cl2 sotto la necessaria catalisi acida (0.02 N TsOH). Ovvero sono state trascurate, perché ritenute non di generale applicazione, le reazioni di metanolisi condotte in MeOH, quale solvente-nucleofilo della reazione. Infatti queste condizioni, per quanto interessanti per sé stesse, non sarebbero state di alcun aiuto nel capire il comportamento di queste aziridine, quando ci fossimo trovati nelle condizioni di dover utilizzare O-nucleofili non volatili, quali alcooli complessi, anche naturali, e/o monosaccaridi parzialmente protetti.
Inoltre l’uso delle condizioni sopra descritte, già utilizzate con successo nel caso di epossidi 2.15α e 2.15β, avrebbero permesso di effettuare un confronto tra il comportamento chimico dei precedenti sistemi ossiranici con le nuove aziridine.
Nelle condizioni di metanolisi descritte (MeOH/CH2Cl2 0.02 N TsOH), l’aziridina 2.23α mostra un comportamento completamente 1,2-regio- ed anti stereoselettivo, conducendo al solo prodotto di addizione 1,2-anti, il corrispondente trans-idrossietere 2.24 (Schema 2.19). Prodotto di addizione 1,2-anti Prodotti di addizione 1,4 N OMe NsHN NsHN OMe
BnO BnO BnO
Ns + MeOH 2.23 H+ 2.24 2.25, 2.26 MeOH/CH2Cl2/TsOH 10ˉ2N >99% <1%
Nelle stesse condizioni, la diastoisomerica aziridina 2.23β mostra un comportamento non regioselettivo ed il corrispondente prodotto di addizione 1,2-anti, il trans-idrossietere 2.27, prodotto minoritario della reazione (40%), è accompagnato da una consistente quantità (60%) di una miscela di corrispondenti prodotti di addizione 1,4, l’N-nosiletere cis 2.28 e trans 2.29, la cui esatta percentuale non è stata determinata (Schema 2.20). Prodotto di addizione 1,2-anti Prodotti di addizione 1,4 N OMe NsHN NsHN OMe
BnO BnO BnO
Ns + MeOH 2.23 H+ 2.27 2.28, 2.29 MeOH/CH2Cl2/TsOH 40% 60% (cis+trans)
Schema 2.20. Metanolisi dell’aziridina 2.23β
Quindi sostanzialmente le due aziridine 2.23α e 2.23β presentano un comportamento regiochimico decisamente diverso: nell’aziridina 2.23α completamente spostato verso l’addizione 1,2, mentre nell’aziridina 2.23β spostato in modo sufficientemente deciso, anche se non completo, verso l’addizione 1,4.
Al di là delle considerazioni che potrebbero essere fatte in merito al diverso utilizzo di queste due aziridine a seguito del loro diverso comportamento regiochimico, un aspetto che vale la pena segnalare è che il comportamento delle due aziridine 2.23α e 2.23β è opposto rispetto a quanto osservato nelle medesime condizioni con i corrispondenti epossidi 2.15α e 2.15β. Infatti come qui di seguito riassunto, in questo caso è l’epossido 2.15β a mostrare un comportamento completamente 1,2-regioselettivo ed anti stereoselettivo, mentre l’epossido 2.15α conduce a livelli accettabili di 1,4-regioselettività (Schema 2.21).
Prodotti di addizione 1,2 Prodotti di addizione 1,4
O
Nu
HO HO
Nu
BnO BnO BnO
+ NuH
2.15
MeOH/CH2Cl2/TsOH 10ˉ2N 43% anti 57% (47% sin, 10%
anti)
O
Nu
HO HO
Nu
BnO BnO BnO
+ NuH
2.15
MeOH/CH2Cl2/TsOH 10ˉ2N >99% anti <1%
Schema 2.21.Riepilogo aperture degli epossidi 2.15α e 2.15β.
Al di là di questa osservazione numerica, i dati in nostro possesso non possono permettere al momento di razionalizzare un così opposto comportamento tra sistemi eterociclici diversi di pari configurazione nelle medesime condizioni di reazione.
2.4 Funzionalizzazione del doppio legame nei prodotti di addizione 1,2
ottenuti dalle aziridine 2.23α e 2.23β
Una volta studiato l’aspetto regioselettivo, l’indagine sulle aziridine 2.23α e 2.23β era proseguito andandone ad esaminare ulteriori aspetti sintetici. Così facendo uso di alcuni prodotti di addizione 1,2, che erano di facile impiego in quanto avevano il vantaggio sintetico di essere sempre ottenuti facilmente e come unico stereoisomero trans, era stata esaminata la stereoselettività di alcune reazioni di funzionalizzazione del residuo doppio legame.
Due reazioni erano state prese in considerazione: la diidrossilazione catalitica e l’epossidazione con peracidi. L’intenzione era quella di verificare la possibilità di giungere a composti portanti una funzionalità ossigenata sulle restanti posizioni di un sistema carba 4-amminoprotetto-sostituito, mimico di un corrispondente sistema monosaccaridico.
La diidrossilazione catalica condotta sui metossi derivati 2.24 e 2.27 con OsO4 cat in presenza di NMO è risultata completamente stereoselettiva in quanto conduce in entrambi i casi ad un corrispondente unico prodotto diasteroisomero, il diolo cis 2.30 da 2.24, ed il diolo cis 2.31 da 2.27 (Schema 2.22).
BnO BnO 2.24 2.27 OMe NsHN OMe NsHN OsO4 NMO cat OsO4 NMO cat BnO 2.30 OMe NsHN OH OH BnO 2.31 OMe NsHN OH OH
Schema 2.22. Reazione di diidrossilazione dei metossi derivati 2.24 e 2.27
Sulla base di questi risultati è stato possibile ipotizzare come la completa selettività faciale mostrata dal sistema ossidante OsO4/NMO sia da ricondurre, con ogni probabilità, ad un effetto di disturbo sterico esercitato dal sostituente allilico –OMe. Infatti in entrambi i casi, la selettività osservata è proprio per quella faccia del doppio legame opposta alla direzione assunta dal sostituente –OMe.
Successivamente la funzionalizzazione del doppio legame 1,2 è stata condotta per reazione elettrofila con l’acido m-cloroperbenzoico applicato su sistemi modello quali l’acetato 2.32 e l’acetato 2.33 (Schema 2.23).
OAc OAc O O O O NsHN NsHN OAc NsHN NsHN NsHN
OAc OAc OAc
BnO BnO BnO BnO BnO BnO NsHN m-CPBA CH2Cl2 m-CPBA CH2Cl2 2.32 2.33 2.34 72% 2.34 28% 2.35 42% 2.35 58% + +
Schema 2.23. Epossidazione degli acetil derivati 2.34 e 2.38 con m-CPBA.
In queste condizioni , l’acetato 2.32 aveva condotto ad una miscela dei due epossidi 2.34α e 2.34β in rapporto 72:28, mentre nell’acetato 2.33, veniva osservata una mancanza di stereoselettività in quanto i due epossidi 2.35α e 2.35β erano ottenuti in rapporto (58:42 1HNMR).
La parziale stereoselettività verso l’epossido α-diretto 2.34α osservato nell’ossidazione dell’olefina 2.32 era stata giustificata sulla base del consueto disturbo di tipo sterico esercitato dal sostituente allilico, quando questo, come l’attuale –OAc, non sia in grado di dare legame a idrogeno di tipo dativo, con l’agente ossidante. Così la β-direzione del gruppo –OAc sul C3 determina il preferenziale avvicinamento del peracido dalla faccia opposta α.
Al contrario la pressoché completa mancanza di stereoselettività riscontrata nell’ossidazione dell’olefina 2.33 poteva essere dovuta a vari fattori sia conformazionali che sterici, e sulla base di questi tentativamente giustificata, ma la discussione relativa, puramente speculativa, non viene qui riportata.