1
1 LE CELLULE STAMINALI
Nel processo di omeostasi del nostro organismo, le cellule staminali (SCs), rivestono un ruolo unico e assolutamente essenziale. Esse sono il germe di una moltitudine di specie cellulari, e viste le loro particolari potenzialità, vengono considerate cellule davvero speciali. Sono infatti cellule “senza carta d’identità” , ossia altamente indifferenziate, progenitrici di tutte le cellule che popolano i nostri organi. Possiedono infatti la capacità di rigenerare gli organi stessi, dando così origine a tutti i tipi di cellule specializzate presenti nel nostro corpo, seguendo specifici pathways molecolari, ma possiedono anche un’elevata capacità di auto-rinnovamento, cioè di dividersi e ricreare altre cellule staminali identiche alla madre. Questa eccezionale capacità di auto-rinnovamento che dura per tutto l’arco della vita, sembra venire meno solo quando, invecchiando, le staminali non riescono più a far fronte ai troppi danni provocati dagli inevitabili attacchi del tempo e dell’ambiente.
1.2 Le cellule staminali embrionali
Durante l’embriogenesi, un uovo appena fecondato da uno spermatozoo genera lo zigote, il quale comincia a dividersi dando origine ad un organismo pluricellulare, attraverso eventi di
commitment, proliferazione e differenziazione che portano alla formazione di organi e tessuti
diversi. Nei primissimi stadi dello sviluppo, sia lo zigote che i blastomeri, che si formano in seguito alle prime divisioni mitotiche (pre-blastocisti), sono le vere e uniche cellule staminali “totipotenti” (ESCs) perché capaci di dare origine a tutti i tessuti embrionali ed extraembrionali. La totipotenza può essere dimostrata dall’isolamento di un singolo blastomero da un embrione pre-impianto e il conseguente monitoraggio della sua capacità di portare a termine la nascita di un individuo completo, in seguito ad un trasferimento in un ricevente adatto. Questo approccio è stato utilizzato sui ratti nei primi esperimenti e successivamente anche su altri mammiferi (Nicholas et al., 1942; Johnson et al., 1995;
Willadsen et al., 1981; Tarkowsky et al., 1959).
La prima perdita della proprietà di totipotenza delle staminali embrionali (ESCs) avviene con il passaggio dell’embrione allo stadio di blastocisti caratterizzata dalla presenza di due tipi cellulari, le cellule del trofoblasto e le cellule della massa interna (Inner Cell Mass, ICM). Le cellule del trofoblasto daranno origine alle cellule che formeranno gli annessi placentari. Le cellule della massa interna presenti all’interno della blastocisti allo stadio embrionale pre-impianto, che segue alla compattazione della morula (corrispondente a 3.5 giorni post-coitum nell’embrione murino), sono le cellule staminali embrionali pluripotenti (Figura 1.1).
2
Figura 1.1 Potenzialità delle cellule staminali
Le cellule provenienti della IMC della blastocisti, sono capaciti di proliferare in maniera indefinita e di mantenere la loro pluripotenza, ma allo stesso modo posso dare origine a tutti i tessuti embrionali, differenziando nei tipi cellulari dei lineages ectodermico, mesodermico ed endodermico. Inoltre possono essere isolate, stabilizzate e coltivate ex vivo in opportune condizioni e sono in grado di generare un numero elevatissimo di cellule figlie le quali mantengono la capacità di autorinnovarsi e di differenziare in tutti i tessuti dell’organismo (
Melino et al., 2006; Mitalipov S.,2009). Le ESCs murine sono state stabilizzate in colture in vitro per la prima volta nel 1981 (Evans e Kaufman, 1981; Martin, 1981) e nel 1998 sono
3
Figura 1.2 ESCs in vitro
Per mantenere le ESCs in coltura nel loro stato indifferenziato, esse devono essere esposte al segnale della citochina LIF (Leukemia Inhibitory Factor) appartenente alla famiglia dell’ IL-6 (Dani at al.,1998). Questo segnale estrinseco agisce tramite il legame eterodimerico costituito dal recettore di LIF (LIF-R) e la glicoproteina 130 (gp130). L’interazione del ligando con il recettore attiva una via di trasduzione del segnale interna, mediata dalla chinasi JACK e dai fattori di trascrizione STAT, essenziali per il mantenimento della pluripotenzialità in vitro. In assenza di LIF, spontaneamente le ESCs coltivate in vitro si aggregano a formare i corpi embrioidi costituiti da cellule appartenenti a diversi lineages cellulari ( Dani et al., 1997). Non vi è dubbio che le cellule staminali embrionali siano le più flessibili tra tutte le cellule staminali, ma il loro utilizzo a scopo terapeutico è oggetto di accesi dibattiti, sia sulla base di considerazioni etiche che per la loro possibile tumorigeneicità. Infatti, se s’impiantano le ESCs in siti ectopici in topi immunocompromessi, queste differenziano in masse multicellulari contenenti tipi cellulari di diversi tessuti definiti teratocarcinomi (Fuchs et al.,
2000) .
Pertanto, molti sforzi sono diretti a trovare fonti alternative di cellule staminali capaci di rigenerare organi e tessuti. Tuttavia le ESs rappresentano un modello validissimo per comprendere i meccanismi dello sviluppo embrionale, della differenziazione tissutale e della patogenesi di numerose malattie.
Negli ultimi anni gli sforzi della ricerca sono diretti a trovare nuove fonti di cellule staminali capaci di rigenerare organi e tessuti. Uno dei più grandi sviluppi della ricerca degli ultimi anni
4
è stata la scoperta di poter indurre la pluripotenza in cellule somatiche adulte, grazie all’introduzione e l’espressione ectopica di specifici geni. Questo è possibile in seguito a una trasfezione con vettori retrovirali impaccati con quattro geni “embrionali” che codificano i fattori di trascrizione Oct4, Sox2, c-Myc e Klf4 (Takahashi K. et al, 2006). Questi sono in grado di revertire lo stato epigenetico di una cellula somatica adulta in uno simile a quello delle ESCs. Queste cellule sono conosciute attualmente con il nome di iPS (induced Pluripotent Stem cells) e hanno caratteristiche simili alle ESCs in termini di espressione di
markers, attività trascrizionale e capacità di differenziare in diversi tipi cellulari (Mitalipov S.,2009).
1.3 Le cellule staminali adulte
Le cellule staminali adulte (ASCs) sono presenti in tutti gli organi dei mammiferi, possiedono un’elevata capacità di self-renewal e possono al contempo dare origine a molteplici tipi di cellule mature con funzioni specializzate. Hanno una potenzialità “differenziativa” più ridotta rispetto alle embrionali tanto da parlare di multipotenza, cioè danno origine a cellule di diverso tipo ma appartenenti al tessuto in cui si trovano (Fuchs et al.,2000). In passato si riteneva che soltanto i tessuti soggetti a continuo ricambio (sangue ed epiteli) possedessero cellule staminali. In realtà, come dimostrano gli studi degli ultimi anni, le cellule staminali sembrano essere presenti in tutti i tessuti anche in quelli considerati post-mitotici come ad esempio il sistema nervoso centrale (Gage et al.,1995) e il cuore (Beltrami et al.,2003). Le ASCs sono capaci di dividersi in maniera asimmetrica dando origine sia a cellule staminali che provvedono al self-renewal del pool delle staminali che a progenitori, cellule con potenzialità più limitata che andranno in contro a differenziamento terminale garantendo una corretta omeostasi tissutale.
Occasionalmente le ASCs possono andare incontro anche ad una divisione simmetrica originando due cellule figlie staminali, che aumentano il pool di staminali.
Questa organizzazione gerarchica sembra essere mantenuta anche nei tumori. Infatti negli ultimi anni, sono emerse numerose evidenze che anche il tessuto neoplastico possa ospitare cellule staminali (Bonet D. and Dick J.E.,1997; Al-Hajj et al.,2003;Galli R. et al.,2004;
Ricci-Vitiani et al.,2006) che avrebbero un ruolo determinante nel mantenimento del processo
neoplastico. Evidenze sperimentali avvalorano la tesi per cui la propagazione del tumore sia alimentato da un piccolo numero di cellule con un grande potenziale auto-replicativo. Queste cellule, note come Cancer Stem Cells (CSCs ) sono insensibili alle terapie convenzionali che hanno come bersaglio le cellule altamente proliferanti. (e la) La ripresa della malattia, a
5
distanza di tempo dal trattamento terapeutico, potrebbe essere spiegata proprio dall’esistenza di questo tipo di cellule che essendo staminale è presente allo stato di quiescenza (Weissman
et al. 2000; Natasha Y. et al. 2010).
Le cellule staminali adulte rappresentano un potenziale strumento terapeutico utilizzabile in un ampio spettro di patologie, quali ad esempio il morbo di Parkinson, l’Alzheimer, l’ infarto, ustioni, malattie cardiache, diabete, osteoartrite e artriti reumatoidi. Pertanto la comprensione dei meccanismi molecolari che regolano le cellule staminali è assolutamente necessaria per poter disegnare strategie terapeutiche mirate, in grado di sfruttare al meglio il loro enorme potenziale. Un problema che limita l’utilizzo delle ASCs sta nella difficoltà nell’isolarle dai tessuti adulti, a causa dell’assenza di marcatori unici per un determinato tipo di ASCs; infatti è la combinazione di diversi antigeni di superficie a definire un certo fenotipo staminale. Ad esempio, le cellule staminali ematopoietiche (HSC-Hematopoietic stem cells), le prime ad essere studiate e caratterizzate (Till and Mc Cullongh,1961), mostrano un fenotipo CD34-CD45-kit+-Scan1+-Lin-. Ogni tipo di cellula staminale esprime quindi una combinazione specifica di antigeni di membrana che la distinguono dalle altre. La presenza del marker CD45 unicamente sulle cellule ematopoietiche, infatti, permette di discriminare le HSCs da un’altra popolazione di staminali adulte presenti nel midollo osseo, le cellule staminali mesenchimali (MSC-Mesenchymal stem cells).
Le HSCs costituiscono un modello per le cellule staminali adulte in quanto sono le più conosciute e studiate, anche dal punto di vista del loro potenziale differenziativo: esse sono dotate di elevata capacità autorigenerativa, proliferativa e differenziativa, capacità che vengono progressivamente perse nelle divisioni cellulari successive che, dalle cellule staminali, generano progenitori pluripotenti. Essi, a loro volta, possono intraprendere cammini differenziativi e indirizzati verso una specifica filiera cellulare.
1.4 Plasticità delle cellule staminali adulte
Mentre le cellule staminali embrionali sono definite totipotenti, cioè hanno conservato la capacità di differenziare in tutti i tessuti dell’animale, si ritiene che le cellule staminali dei tessuti adulti (ASCs) possiedano capacità differenziative limitate al tessuto in cui risiedono (Fuchs et al., 2000). Tuttavia, questa teoria negli ultimi anni è stata messa in discussione da studi che indicano che alcuni tipi di cellule staminali adulte appartenenti ad un certo tessuto possono, se sottoposte ad opportune condizioni, generare progenie tipica di altri tessuti (
Henry E. Young et al.,2004; Amy J. Wagers et al., 2004). Questo fenomeno che descrive la
6
plasticità delle ASCs sono emerse dallo studio sul sistema ematopoietico. Attraverso saggi in
vivo, è stato infatti osservato che cellule di midollo trapiantate in topi mutati difettivi o
mieloablati, sembrano essere in grado di dare origine a progenie “atipica” e rigenerare, anche se ad una frequenza piuttosto bassa, altri tessuti quali fegato (Theise et al.,2000; Austin e
Lagasse,2003), pancreas (Ianus et al.,2003), reni (Gupta et al.,2002), pelle (Krause et al.,2001), tratto gastrointestinale (Okamoto et al., 2002) (Figura1.3).
Figura1.3 Rappresentazione figurale della plasticità delle ASCs.
Questo fenomeno, se confermato, avrebbe un enorme potenziale applicativo. In molte malattie genetiche o acquisite in età adulta, le cellule staminali residenti nel tessuto colpito potrebbero essere state distrutte dal processo patologico o avere esaurito il loro potenziale proliferativo e non essere quindi più disponibili per contribuire al riparo e alla rigenerazione tissutale. In questi casi sarebbe utile isolare le cellule staminali da un altro tessuto e utilizzarle per riparare il danno leso, dopo averle indotte a differenziare in vitro nel tipo cellulare necessario.Il fenomeno della plasticità è tuttora dibattuto e in attesa di definitive verifiche, tuttavia diverse ipotesi sono state avanzate per spiegare i meccanismi di base (Amy J. Wagers
et al., 2004).
Quattro sono i modelli proposti: il modello gerarchico, la transdifferenziazione, la transdeterminazione e la dedifferenziazione.
7
Il modello gerarchico (Figura 1.4 D) prevede l’esistenza, all’interno dei diversi tessuti, di cellule staminali altamente pluripotenti non ancora indirizzate verso un determinato destino differenziativo, e capaci, quindi, come le cellule staminali embrionali, di dare origine a progenie di diversi tessuti.
Secondo il modello della transdifferenziazione (figura 1.4 A) una cellula già differenziata acquisisce un altro fenotipo, spesso senza andare incontro alla divisione cellulare: un esempio sono le cellule pancreatiche che, in opportune condizioni di coltura, transdifferenziano in vitro in cellule epatiche. Tuttavia, questo modello risulta opinabile poiché non è stato finora possibile stabilire che cosa succeda realmente in vivo.
La transdeterminazione (Figura 1.4 C) descrive invece la condizione in cui una cellula staminale o un precursore primitivo già indirizzato verso uno specifico cammino differenziativo, genera una progenie appartenente ad un altro lineage cellulare.
Nella dedifferenziazione (Figura 1.4 B), una cellula lineage-specifica riacquisisce dapprima le proprietà di cellula staminale o di precursore primitivo e, in seguito, intraprende un altro cammino differenziativo.
Il tema della plasticità delle cellule staminali continua ad essere argomento di acceso dibattito. Negli ultimi anni, studi sempre più rigorosi hanno messo in evidenza che alcuni apparenti eventi di plasticità sono in realtà riconducibili ad altri fenomeni, quali la contaminazione o la fusione cellulare (Figura1.4 E). Sia la plasticità che la fusione hanno osservazioni sperimentali a conferma e a smentita (Andrew E.Wurmser et al.,2002; La Barge e Blau,2002;
Ianus et al.,2003; Weimann et al.,2003; Caplice et al.,2003). E’ chiaro che per poter parlare
con certezza di plasticità è necessario il massimo rigore nelle procedure sperimentali adottata. Per prima cosa bisogna caratterizzare al meglio le cellule che si stanno studiando; è capitato infatti che esperimenti siano stati invalidati perché sono state utilizzate popolazioni cellulari di partenza troppo eterogenee o contenenti alterazioni cromosomiche. Inoltre è molto importante caratterizzare le cellule generate dalle staminali di interesse dal punto di vista funzionale.
8
Figura1.4 Potenziali meccanismi che spiegherebbero il fenomeno della
plasticità delle ASCs.
1.5 La nicchia delle cellule staminali
Le nicchie sono microambienti localizzati nei tessuti adulti, che mantengono e regolano le cellule staminali (Morrison et al.,2008).
La capacità delle cellule staminali adulte di scegliere se auto-repicarsi o differenziarsi è critica per il mantenimento dell’omeostasi dei tessuti adulti ed è regolata mediante un delicato equilibrio delle divisioni simmetriche e asimmetriche (Tong Y. et al.,2006).Tali meccanismi, se alterati nella vita adulta, contribuiscono sia ai processi di invecchiamento che alla tumorigenesi (Morrison et al., 2008). Studi condotti su diversi modelli animali hanno dimostrato che le modalità di divisione sono controllate e influenzate sia da fattori extracellulari della nicchia sia da fattori intrinseci della cellula stessa. Attraverso una divisione asimmetrica una cellula staminale dà origine a due cellule figlie, una che rimane nella nicchia come cellula staminale e una che lascia la nicchia e va incontro a un destino differenziativo. L’asimmetria può essere determinata da una diversa localizzazione di molecole regolative all’interno delle due cellule figlie, in associazione con componenti citoscheletrici, si parla in questo caso di asimmetria divisionale; può anche essere determinata da un’esposizione delle cellule a segnali extracellulari differenti, i fattori di nicchia, che creano quindi un’asimmetria ambientale (Figura 1.5).
9
Figura1.5 Asimmetria divisionale(a) e asimmetria ambientale (b).
Questo microambiente interagisce con le CSs attraverso fattori di secrezione, ormoni, interazioni cellula-cellula e cellula-matrice e molecole segnale di varia natura (Scadden,2006). Al contrario, attraverso una divisione simmetrica, la cellula staminale si divide generando due cellule identiche, entrambe staminali, che rimangono nella nicchia andando a incrementare il pool delle staminali.
Da un punto di vista funzionale non è ancora chiaro se esiste una singola nicchia in grado di supportare le diverse potenzialità delle cellule staminali (self-renewal e/o inibizione del differenziamento) o se diverse nicchie coesistono (Wilson et Trumpp,2006). Si può ipotizzare l’esistenza di una nicchia di storage contenente cellule staminali quiescenti, ancorate al centro della nicchia. Queste cellule svolgono una funzione di riserva e sono attivate nella proliferazione solo in seguito a danni tissutali; ed una nicchia di self-renewal la cui funzione principale è quella di garantire che una delle due figlie preservi le caratteristiche di staminalità mentre l’altra produca progenitori differenziativi, tali cellule potrebbero trovarsi al confine che separa la nicchia dall’ambiente “non-nicchia”, cioè una zona in cui risentono di segnali che inducono alla divisione o al differenziamento per il normale mantenimento dell’omeostasi dei tessuti (Figura 1.6).
10
Figura 1.6 Nicchia di storage (a) e nicchia di self-renewal (b).
Nonostante esistano diversi tipi di nicchia a seconda della localizzazione nei nostri tessuti , sembrano condividere strutture simili e meccanismi di regolazione comuni. Spesso le SCs sono in contatto tra di loro medianti giunzioni aderenti con cellule patners (cellule differenziate post-mitoticamente). Di fondamentale importanza risulta anche l’interazione con la matrice extracellulare, attraverso giunzioni strette o interazione con molecole segnale della matrice per l’attivazione di vie di trasduzione interne del segnale. Anche fattori metabolici e nervosi giocano un ruolo importante nella definizione della dimensione anatomica e funzionale della nicchia (Scadden, 2006) (Figura 1.7).
11
La nicchia meglio caratterizzata nei mammiferi è quella delle cellule staminali ematopoietiche (HSCs). Il concetto di nicchia fu per la prima volta proposto da Schofield nel 1978 per descrivere quel microambiente fisiologico limitato dove risiedono le SCs in equilibrio tra il
self-renewal ed il differenzimento (Yin and. Li., 2006).
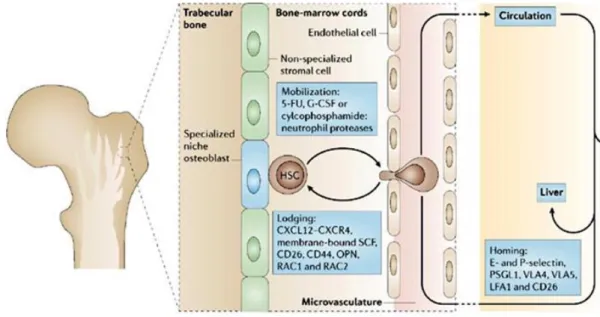
Negli adulti, gli osteoblasti, che derivano da cellule staminali mesenchimale (MSCs), responsabili dell’osteogenesi, e le HSCs, responsabili dell’ematopoiesi, sono strettamente associati nel midollo osseo, suggerendo una reciproca interazione tra i due (lineage). Negli ultimi anni è stato scoperto che gli osteoblasti sono una componente chiave della nicchia delle HSCs e ne controllano il numero (Calvin et al., 2003; Zhang et al., 2003). Le HSCs non interagiscono solo con gli osteoblasti ma anche con altre cellule stromali, comprese le cellule endoteliali. Si può quindi parlare di due distinte nicchie che supportano le HSCs, identificate nel midollo osseo: una nicchia per il mantenimento e per il self-renewal (dell’endostio) e una importante per la proliferazione, differenziazione e la mobilizzazione delle HSCs (vascolare) (Yin and Lin., 2006) (Figura 1.8).
Figura 1.8 Modello della nicchia delle HSCs nel midollo osseo.
Nell’ambito delle HSCs si possono distinguere due popolazioni funzionalmente distinte: le LT-HSCs (Long Term HSCs) e le ST-HSCs (Short Term HSCs). Le LT-HSCs regolano
12
l’ematopoiesi a lungo termine e sono mantenute in uno stato di quiescenza, grazie alla nicchia dell’endostio. Le ST-HSCs, invece, hanno un’abilità di ricostituzione limitata a poche settimane, sono molto attive dal punto di vista del ciclo cellulare e risiedono nella nicchia vascolare. In risposta a danno tissutale, le HSCs quiescenti possono ri-attivarsi, uscire dalla nicchia dell’endostio e migrare verso la nicchia vascolare, responsabile, al contrario, della loro proliferazione, differenziazione e migrazione. La nicchia di self-renewal produce invece precursori multipotenti (MultiPotent Progenitors-MMPs), tramite meccanismi di asimmetria divisionale o ambientale, che daranno origine a tutti i tipi cellulari dei diversi lineages ematopoietici. A dimostrazione del ruolo degli osteoblasti, che si trovano sulla superficie dell’endostio, nel supporto e mantenimento delle HSCs nella nicchia, sono stati condotti studi su topi transgenici, che esprimono costitutivamente il gene virale della timidina chinasi (TK) sotto il promotore del gene del Collagene α1 in osteoblasti. Inducendo l’ablazione degli osteoblasti con il ganciclovir i topi mostrano una diminuzione nel numero di progenitori linfoidi, mieloidi ed eritroidi nel midollo osseo, seguito da un decremento del numero di HSCs. Con l’assorbimento del ganciclovir gli osteoblasti riappaiono nell’osso, come l’ematopoiesi nel midollo osseo (Visnjic et al., 2004). Altri esperimenti hanno dimostrato che l’aumento del numero di osteoblasti nella nicchia comporta un aumento del numero di HSCs (Calvi et al., 2003; Zhang et al., 2003; Yin et al., 2006). Queste osservazioni supportano l’ipotesi secondo la quale gli osteoblasti hanno un ruolo fondamentale nel mantenimento delle HSCs e nella regolazione dell’ematopoiesi, controllandone direttamente il numero. La nicchia vascolare è costituita da cellule endoteliali sinusoidali che creano un microambiente ricco di nutrienti, con un’alta concentrazione di ossigeno e fattori di crescita e in cui le cellule del sangue mature possono essere rilasciate per andare nella circolazione periferica (Yin et al.,
2006). In risposta a specifici segnali, inoltre, le HSCs possono uscire e rientrare nella nicchia
dell’endostio grazie a processi conosciuti come mobilizzazione e “homing”. La mobilizzazione può avvenire in seguito a trattamento con fattori come la ciclofosfamide o il G-CSF (Granulocyte Colony-Stimulating Factor) a causa di danno al midollo osseo, ma anche normalmente durante l’omeostasi (midollare), in cui un piccolo numero di HSCs sono costantemente rilasciate nella circolazione. Esse costituendo una risorsa velocemente accessibile per la riparazione di eventuali danni al midollo osseo. Un fattore cruciale coinvolto nella migrazione e mobilizzazione delle HSCs durante l’omeostasi e in seguito a danno è SDF1 (Stromal-Derived Factor 1), espresso da diversi tipi cellulari, inclusi osteoblasti e cellule endoteliali dei vasi. Esso è in grado di indurre motilità, chemiotassi e adesione delle cellule che esprimono il suo recettore CXCR4 (CXC-chemokine Receptor 4).
13
L’interazione SDF1/CXCR4 inoltre è cruciale per la colonizzazione del midollo osseo da parte delle HSCs durante le fasi finali dello sviluppo fetale e per l’induzione della mobilizzazione in circolo durante la vita adulta (Figura 1.9).
Figura 1.9 Mobilizzazione e homing delle HSCs.
Diversi tipi di segnalazioni e molecole di adesione sono coinvolti nelle interazioni della nicchia delle HSCs. Le molecole meglio studiate implicate nella segnalazione della nicchia includono SCF/Kit, Jagged/Notch, Angiopoietina-1/Tie2 (Ang-1/Tie2), Wnt/β-catenina, osteopontina.
La via di Notch, che si ritiene avere un ruolo nel mantenimento della staminalità in una grande varietà di tessuti. Nel midollo osseo è stato osservato l’ espressione di diversi recettori e ligandi di Notch. In particolare si è visto che in concomitanza con una sovraespressione del ligando Jagged-1, secreto dagli osteoblasti, determina un incremento del numero delle HSCs (Calvin, 2003), suggerendo un possibile ruolo della via di Notch durante il sefl-renewal delle HSCs; un altro meccanismo con cui gli osteoblasti possono regolare il numero delle HSCs è tramite la secrezione dell’osteopontina (Opn), una proteina di matrice altamente fosforilata e glicosilata che sembra avere un effetto negativo sulla proliferazione delle HSCs e favorire, invece, la loro quiescenza (Nilsson et al.,2005). Un’altra interazione molto studiata è quella tra il fattore di crescita SCF( Stem Cell Factor), sia nella forma secreta che in quella legata alla membrana, e il suo recettore tirosin-chinasico Kit, che ha un ruolo importante per il mantenimento della staminalità e del self-renewal di molti sistemi compreso quello delle HSCs. Infatti la perdita di funzione di SCF in topo sl/sl o la perdita di funzioni di Kit in topo W/W porta a un’ematopoiesi difettiva, indicando il ruolo essenziale di queste molecole nella
14
nicchia (Yin et al., 2006). Gli osteoblasti esprimono SCF legato alla membrana e sono in grado di attivare il pathway SCF/Kit attivando il recettore Kit sulla membrana delle HSCs, andando a modificare le proprietà adesive della nicchia endosteale attraverso una modulazione dello stato funzionale di specifiche integrine (VLA4, VLA5). Questa segnalazione quindi è implicata nel controllo dell’attivazione delle HSCs e del loro rilascio dalla nicchia (Lyman e Jacobsen,1998). Questa segnalazione quindi è implicata nel controllo dell’attivazione delle HSCs e del loro rilascio dalla nicchia. L’ N-caderina e la β-catenina sono molecola di adesione espresse sia dagli osteoblasti della nicchia che da alcune HSCs (LT-HSCS) e sono considerate importanti componenti del sistema di ancoraggio nella nicchia dell’endostio (Zhang et al.,2003). La via di Wnt/β-catenina è implicata nel mantenimento della quiescenza delle HSCs ed è necessaria per preservare il self-renewal. Wnt funziona favorendo l’accumulo di β-catenina citoplasmatica con la conseguente traslocazione nel nucleo e attivazione di fattori di trascrizione della famiglia TCF/LEF, implicati nella regolazione della proliferazione cellulare (Nemeth M.J et al.,2007). Questo è stato dimostrato da studi funzionali condotti su topi ingegnerizzati in modo da far sovraesprimere dagli osteoblasti Dickkopft (Dkk1), un membro della famiglia degli inibitori di Wnt. Il gene Dkk1 è stato posto sotto il controllo del promotore del gene Collagene 1α (Col1α), normalmente espresso dagli osteoblasti. È stato osservato un difetto nel mantenimento del potenziale di ricostituzione delle HSCs, in seguito a trapianti seriali, di topi letalmente irradiati. Le HSCs hanno mostrato una riduzione del numero di cellule allo stadio G0 del ciclo cellulare, chiaro segno che quindi la via di Wnt è necessaria per il mantenimento delle cellule in quiescenza (Fleming et al., 2008; Nemeth J.M. et al.,2007).
Anche l’Angiopoietina 1 (Ang-1), un ligando solubile, secreto dagli osteoblasti, interagendo con il recettore tirosin-chinasico Tie2, specificatamente espresso dalle HSCs, porta ad un aumento dell’espressione della molecole d’adesione N-caderina da parte delle HSCs, favorendone l’adesione agli osteoblasti; induce anche l’attivazione dell’inibitore del ciclo cellulare p21, mantenendo così le HSCs in uno stato di quiescenza (Arai F. et al.,2004;
Nemeth M.J. et al.,2007). Recentemente, è stata, inoltre, avanzata l’ipotesi dell’esistenza di
una nicchia unica nel midollo osseo composta dalla coppia HSC-MSC. Infatti le cellule staminali mesenchimali (MSCs), selezionate positivamente per la nestina, sono spazialmente associata alle HSCs ed esprimono geni necessari per il mantenimento delle stesse. Questo set di geni viene down regolato in seguito a mobilizzazione forzata delle HSCs. Inoltre, in vivo, la deplezione delle MSCs nestina+ causa una repentina diminuzione del numero delle HSCs e
15
una riduzione dell’homing di HSCs trapiantate in animali letalmente irradiati (Mendez-Ferrer
et al., 2010).
2 LE CELLULE STAMINALI MESENCHIMALI
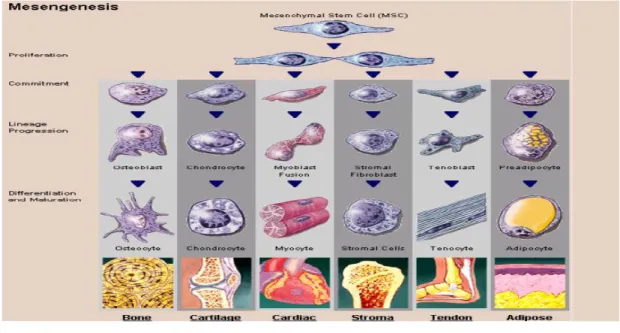
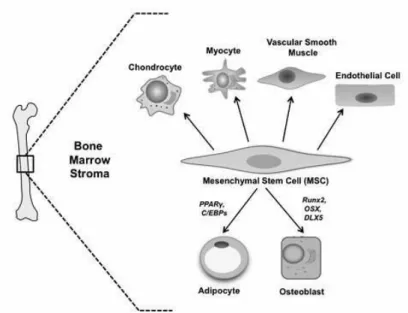
Le cellule staminali mesenchimali o cellule stromali multi potenti (MSCs) sono cellule staminali somatiche non ematopoietiche presenti nel midollo osseo degli organismi adulti. Sono cellule clonogeniche multipotenti, che hanno la capacità di differenziare e contribuire alla rigenerazione di tessuti mesenchimali, come osso, cartilagine, muscolo, legamento, tendine e grasso (Figura 2.1).
Figura 2.1 MSCs
Le MSCs sono rare nel midollo osseo, rappresentano infatti solo una frazione minima delle cellule midollari (0,001-0,01%), nonostante ciò hanno un ruolo fondamentale in questa sede e rappresentano uno dei componenti principali della nicchia endosteale delle HSCs. Le prime evidenze sperimentali a supporto dell’esistenza delle MSCs emergono dai lavori pionieristici di Friedenstein e colleghi, che per primi dimostrarono che cellule del midollo osseo erano in grado di intraprendere un percorso differenziativo in senso osteogenico quando trapiantate in
vivo (Friedenstien et al., 1970). Sono stati sviluppati metodi per il loro isolamento e per il
mantenimento in vitro allo stato indifferenziato e condotte a differenziare in diversi lineages. È stato dimostrato, infatti, che queste cellule potevano essere isolate ed espanse in vitro grazie alla loro capacità di crescere in adesione alla plastica, caratteristica utile per purificarle dalla
16
componente ematopoietica, che, al contrario, cresce in sospensione. Le cellule aderenti inizialmente appaiono molto eterogenee, ma la maggior parte di queste mostrano un fenotipo affusolato e un’alta capacità proliferativa; in seguito a diversi passaggi in coltura, le cellule aderenti di forma fibroblastoide diventano più omogenee (Chamberlain et al.,2007).
Il primo saggio utilizzato per identificarle è stato il saggio delle CFU-F (Colony Forming
Unit-Fibroblast), grazie al quale queste cellule, piastrate a bassa densità in coltura in un
terreno minimo privo di fattori di crescita, sono in grado di creare delle colonie; queste ultime, eterogenee da un punto di vista di potenziale differenziativo, permettono anche di fare una stima del numero delle MSCs presenti nel midollo. Attraverso questo tipo di analisi è emerso che la capacità di formare le CFU-F in coltura subisce un forte calo con l’avanzare dell’età (Caplan et al.,2007).
2.1 Localizzazione delle MSCs
Nel midollo osseo, le cellule staminali mesenchimali sono un’importante componente della nicchia delle cellule staminali ematopoietiche (HSCs). Come precedentemente
detto sono state identificate due tipologie di nicchia per le HSCs, una nicchia endosteale e una vascolare (Yin and Lin.,2006; Sacchetti et al.,2007). Le MSCs e le cellule che da esse derivano, gli osteoblasti e i fibroblasti, sono coinvolti nella nicchia endosteale. Oltre che per la produzione di cellule mature e specializzate che interagiscono con le HSCs, le MSCs sono direttamente coinvolte nella regolazione del processo ematopoietico attraverso la produzione di citochine e molecole di adesione che favoriscono la mobilizzazione delle HSCs (da Silva
Meirelles et al., 2008; Phinney e Prockop 2007). Diverse molecole prodotte dalle cellule della
nicchia possono regolare il numero delle HSCs andando ad influenzare i processi che regolano l’equilibrio tra self-renewal e differenziazione (Wilson et al., 2007, Da Silva
Meirelles et al., 2008).
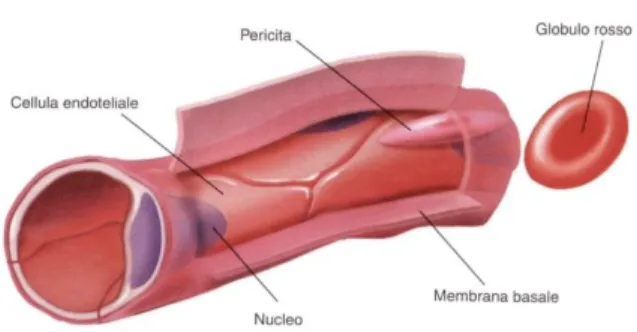
Le MSCs, oltre che dal midollo osseo, possono essere isolate da altri tessuti. Sono state trovate associate ai vasi sanguigni di grande e piccolo calibro. Questo strato endoteliale a contatto con le MSCs è stato ritrovato in tutti i tessuti del corpo, inclusi tessuti non-mesenchimali, quali fegato e reni. Le MSCs associate ai vasi sono conosciute con il nome di periciti o cellule periendoteliali e potrebbero essere una sorgente in vivo di “MSCs terapeutiche” locali (Caplan A.I., 2007; da Silva Meirelles et al., 2008). Si tratta di cellule sparse che si trovano al di sotto della membrana basale, strettamente associate con le cellule endoteliali mediante gap-junctions. Verosimilmente, quando queste interazioni vengono interrotte e il pericita viene liberato, questo potrebbe essere considerato una cellula staminale
17
mesenchimale. Queste cellule perivascolari/periciti in coltura mostrano un fenotipo molto simile a quello delle MSCs e, oltre ai marcatori perivascolari, esprimono anche quelli tipici delle MSCs. Sono anche in grado di differenziare in vitro in osteoblasti, condrociti e adipociti, come fanno tipicamente le MSCs. Sono state isolate anche da altri tessuti, quali muscolo scheletrico, tessuto adiposo, fluido amniotico, denti, cordone ombelicale. Studi in corso sono volti alla caratterizzazione molecolare di MSCs provenienti da vari siti anatomici del corpo. Dalle prime analisi sembra che MSCs, isolate da diversi tessuti, mostrino delle differenze a livello molecolare che potrebbero essere legate anche ad una maggiore o minore potenzialità
in vivo (Figura 2.2.).
Figur a 2.2 Rappresentazione di un vaso sanguigno capillare.
2.2 Identificazione delle MSCs
Ad oggi non esistono singoli markers di superficie che le identificano in maniera univoca, ma vengono selezionate attraverso una combinazione di antigeni di superficie positivi, come Stro-1, CD44, CD105, CD166 e SSEA-4 e negativi, come CD45, CD34, CD14 e Sca-Stro-1, markers tipici delle HSCs. Recenti evidenze sperimentali hanno posto l’attenzione su un altro antigene di superficie che sembra essere espresso ad alti livelli in sottopopolazioni di MSCs. Attraverso trapianti sottocutanei in topi immunocompromessi, di cellule del midollo osseo umano di diversa natura e origine, è stato provato che solo alcune di queste erano in grado di generare osso e midollo osseo eterotopico, ricreando anche un microambiente ematopoietico. Queste cellule potevano essere distinte dalle altre per un’elevata espressione di CD146. Colture primarie di MSCs umane, piastrate a bassa densità, sono state allestite per eseguire il saggio delle CFU-F. Tutte le colonie formate mostravano l’espressione dell’antigene di superficie CD146. In colture non clonali solo il 30% delle cellule esprimeva questo antigene, ma, l’analisi al FACS ha rivelato che le cellule CD146 mostravano invece un’elevata espressione di marcatori propri di osteoblasti maturi (CD146 CD105+ oCD146-ALP+cells). Sono stati eseguiti anche trapianti aggiuntivi di singoli cloni isolati da una colonia. Dopo 8 settimane dall’allestimento dei trapianti sono state prelevate di nuovo tutte le cellule umane e
18
piastrate a bassa densità per analizzare le CFU-F. L’analisi al FACS di queste CFU-F secondarie ha mostrato un’omogenea elevata espressione di CD146, indicando che questo è un marcatore di cellule con un’elevata capacità di self-renewal (Sacchetti et al., 2007). Inoltre è stato dimostrato che cellule multipotenti CD146+, isolate da midollo osseo umano, mostrano tutte le caratteristiche tipiche delle MSCs: una proliferazione di 12 settimane, capacità di differenziare in osteoblasti, condrociti, adipociti e cellule stromali di supporto per l’ematopoiesi. In più queste cellule secernono una complessa combinazione di fattori di crescita che sono in grado di controllare la funzione delle HSCs (Sorrentino et al., 2008). Le MSCs, oltre all’identificazione basata sulla loro morfologia o sulle loro caratteristiche fenotipiche, si distinguono funzionalmente in base alla loro capacità di generare in vitro, in seguito a specifiche induzioni, cellule del tessuto osseo, adiposo e cartilagineo. Il classico metodo per differenziare le MSCs in osteoblasti implica il trattamento con un cocktail di sostanze inducenti, quali l’Acido Ascorbico, il β-Glicerofosfato e il Dexametasone, aggiunto alla coltura di MSCs confluenti, in opportune concentrazioni. Le MSCs in queste condizioni formano aggregati cellulari o noduli secernenti matrice extracellulare e incrementano l’espressione della Fosfatasi Alcalina (ALP). Questi noduli risultano positivi a colorazioni istochimiche Alizarin Red, che mette in evidenza la formazione di matrice di fosfati di calcio tipica degli osteoblasti maturi. Per promuovere una differenziazione adipogenica, le colture di MSCs sono incubate con Dexametasone, Insulina, Isobutilmetilxantina e Indometacina. Una volta differenziate, le cellule mostrano, al loro interno, accumuli di vacuoli lipidici e incrementano l’espressione di geni marcatori come PPARγ (Peroxisome
Proliferation-Activated Receptor 2), C/EBPα, lipoproteina lipasi e aP2 (Fatty Acid Binding Protein).
L’accumulo dei lipidi è mostrato istologicamente attraverso la colorazione con Oil Red. Ulteriori studi hanno dimostrato che le MSCs, opportunamente trattate in vitro, possono anche essere indotte a differenziare in condrociti. A tale scopo le MSCs devono essere centrifugate per formare un pellet che viene messo in coltura, come micromassa, in presenza di TGF-β. Il pellet cellulare sviluppa multistrati e l’analisi istologica evidenzia la positività alla Toluidina
Blu, ad indicare un’abbondanza di glicosamminoglicani nella matrice extracellulare. Le
cellule, così trattate, producono anche il collagene di tipo II (Chamberlain et al., 2007) (Figura 2.3).
19
Figura 2.3 Differenziazioni in vitro delle MSCs.
Alcuni studi hanno permesso di identificare, nell’ambito delle MSCs, cellule dotate di maggiore versatilità. Evidenze sperimentali suggeriscono che le MSCs sono molto eterogenee, ciò è dovuto alla presenza di cellule multipotenti mesenchimali stromali, capaci di differenziare in vari lineages cellulari mesodermici, insieme a cellule pluripotenti con caratteristiche simili a quelle di cellule embrionali. Questi ultimi tipi cellulari possono differenziare in cellule del lineage mesodermico, endodermico e anche neuroectodermico. Recenti studi descrivono una nuova popolazione di progenitori mesodermici (Mesodermal
Progenitor Cells, MPCs), nel midollo osseo adulto umano, capaci di differenziare in vitro in
cellule mesenchimali in opportune condizioni di coltura. Queste cellule sono in grado di differenziare anche in cellule endoteliali. I progenitori mesodermici hanno un fenotipo preciso e marcatori di superficie embrionali, non presenti nelle cellule mesenchimali, e una volta spinti verso un destino differenziativo, perdono questi marcatori e acquisiscono quelli mesenchimali. Le cellule mesenchimali, invece, non possono essere indotte a revertire in MPCs, che possono essere, quindi, considerati precursori delle MSCs (Petrini et al., 2008). Inoltre cellule con proprietà simili sono state recentemente identificate nel sangue del cordone
20
ombelicale, note come Unrestricted Somatic Stem Cells (USSCs), e nel midollo, note invece come Marrow-Isolated Adult Multilineage Inducile cells (MIAMIs) (Nauta e Willem E.
Fibbe, 2009) e Multi-potent Adult Progenitor Cells (MAPCs). Le cellule staminali MIAMI a
MAPC hanno un potenziale proliferativo e differenziativo più alto rispetto alle classiche MSCs. È stato suggerito che queste possano rappresentare una sottopopolazione di cellule staminali più primitive che potrebbero essere i precursori comuni delle MSCs e delle HSCs (Reyes et al., 2001;Nardi and da Silva Meirelles, 2003).(Figura 2.4)
Figura 2.4 MAPCs
2.3 Immunoregolazione e attività trofica
Le MSCs sono in grado di esercitare effetti immunoregolatori, inibendo fortemente il riconoscimento e l’espansione dei linfociti-T attraverso la produzione di TNF-α e INF-γ e incrementando i livelli di IL-10. Quest’attività immunoregolatoria supporta il concetto che MSCs allogeniche possono essere usate come agenti terapeutici. L’intrinseca attività secretoria di un ampio spettro di molecole bioattive crea anche un microambiente rigenerativo in caso di lesioni o danni tissutali. Questa straordinaria capacità delle MSCs è stata testata anche nel contesto di terapie contro il cancro, aggiungendo MSCs umane, espanse in coltura, ai trapianti di midollo osseo, assumendo che queste cellule avrebbero attuato un processo di
21
homing e rigenerato il midollo osseo di pazienti trattati con chemioterapia e radioterapia. Il
meccanismo che governa questi processi è lo stesso: la secrezione di fattori paracrini bioattivi che inibiscono la cicatrizzazione, inibiscono l’apoptosi (nei pressi o nel sito della lesione), stimolano l’angiogenesi e anche la mitosi di cellule staminali o progenitori propri dei tessuti. Questa complessa attività è nota con il nome di “attività trofica” (Caplan et al.,2007). Le MSCs hanno suscitato grande interesse per la loro facile reperibilità e capacità di espansione e differenziazione in vitro. Inoltre, grazie alle loro proprietà biologiche, le MSCs rappresentano un potenziale valido strumento terapeutico per un ampio spettro di malattie, attraverso interventi di terapia genica, medicina rigenerativa e ingegneria tissutale. Tuttavia, il loro impiego ottimale richiede un’approfondita conoscenza dei meccanismi che ne regolano l’espansione e la differenziazione, ma a tutt’oggi molti aspetti della loro biologia sono ancora sconosciuti.
3 APPARATO SCHELETRICO
3.1 Struttura dell’osso e sue componenti
L’osso è un tessuto connettivo costituito da una componente cellulare e da una matrice extracellulare e sebbene sia uno dei costituenti più duri dell’organismo, esso possiede notevoli capacità dinamiche ed è in grado di rinnovarsi continuamente in relazione alle forze che si scatenano su di esso. Per esempio, la pressione esercitata sull’osso porta al suo riassorbimento, mentre la trazione stimola la produzione di nuovo tessuto. L’osso rappresenta un’impalcatura di primaria importanza con funzioni di sostegno e di protezione, infatti permette i movimenti del corpo, immagazzina minerali e grassi ed è il luogo di produzione delle cellule del sangue. Le singole ossa sono classificate in base alla loro forma in lunghe (la maggior parte delle ossa degli arti superiori e inferiori), brevi (es. le ossa carpali del polso e della caviglia), piatte (es. le ossa del cranio, le coste, lo sterno, le scapole) e irregolari (es. le vertebre e le ossa facciali). Da un punto di vista macroscopico l’osso può essere classificato in base al rapporto tra quantità di matrice ossea e l’ammontare dello spazio presente all’interno dell’osso stesso: l’osso spugnoso ha meno matrice ossea e più spazi rispetto all’osso compatto che ha, invece, più matrice ossea e meno spazio (Seeley et al., 2005). Le ossa presentano una cavità centrale, la cavità midollare, dentro la quale si trova il midollo osseo costituito da due componenti: il midollo rosso che è il tessuto ematopoietico e il midollo giallo in larga parte costituito da tessuto adiposo. La cavità midollare è delimitata dall’endostio, un connettivo
22
specializzato composto da un singolo strato di cellule osteoprogenitrici, osteoblasti e osteoclasti. La superficie esterna dell’osso è rivestita dal periostio, costituito da uno strato più esterno di connettivo fibroso che contiene vasi sanguigni e nervi ed uno strato più interno fatto di cellule osteoprogenitrici, osteoblasti e osteoclasti (Gartner, 1998). La componente cellulare della matrice ossea è immersa in una sostanza extracellulare calcificata, la matrice extracellulare .
La matrice extracellulare è costituita da una componente fibrosa organica che consiste in fibre di collagene, proteoglicani e alcune glicoproteine quali l’osteonectina, osteopontina, sialoproteine e da una componente di sostanza amorfa inorganica costituita da cristalli di fosfati di calcio chiamata idrossiapatite. Ambedue queste componenti sono essenziali al mantenimento dell’integrità dell’osso: il materiale organico conferisce deformabilità alla matrice, mentre i componenti minerali danno resistenza.
Le cellule ossee sono classificate come osteoblasti, osteociti ed osteoclasti ed hannofunzioni ed origini diverse:
• gli osteoblasti derivano da cellule staminali mesenchimali indifferenziati (MSCs) e sono responsabili della sintesi della componente organica e inorganica della matrice. Le sostanze sintetizzate sono accumulate in vescicole cellulari e rilasciate per esocitosi, per questo tali cellule sono caratterizzate citologicamente da un esteso reticolo endoplasmico e numerosi ribosomi;
• l’osteocita rappresenta l’ultima fase del processo differenziativo dell’osteoblasto quando, una volta maturo, si trova incluso nella matrice ossea. Gli spazi occupati dai corpi cellulari dell’osteocita sono chiamati lacune, collegate tra loro mediante processi cellulari che permettono agli osteociti di rimanere in contatto diretto. Apparentemente inattivi è possibile che collaborino al mantenimento della matrice ossea;
• gli osteoclasti sono grosse cellule macrofagiche multinucleate responsabili
del riassorbimento dell’osso e del rilascio di enzimi di degradazione di proteine di matrice; derivano da precursori indifferenziati presenti nel midollo osseo capaci di generare anche monociti.
Durante lo sviluppo fetale, la formazione di osso avviene con due modalità chiamate ossificazione intramembranosa e ossificazione endocondrale. In entrambi i casi il tessuto osseo che si forma inizialmente è di tipo primario, ricco di osteociti e fibre intrecciate, ma ancora povero di minerali. Successivamente viene sostituito dall’osso secondario che viene continuamente rimodellato. Dopo il rimodellamento non è più possibile distinguere l’osso formatosi con le due diverse modalità.
23
L’ossificazione intramembranosa è il processo di ossificazione mediante il quale si sviluppano la maggior parte delle ossa piatte; comincia all’incirca verso l’ottava settimana di sviluppo ed è completato approssimativamente verso i due anni di età. In alcune zone specifiche detti centri primari di ossificazione il mesenchima altamente vascolarizzato si condensa per formare una membrana di tessuto connettivo con delicate fibre di collagene orientate casualmente (Seeley, 2005). Alcune delle cellule mesenchimali presenti nella membrana differenziano in osteoblasti che cominciano a produrre matrice ossea. In seguito inizia la deposizione di calcio e gli osteoblasti che rimangono intrappolati nella matrice diventano osteociti. La continua attività mitotica delle cellule mesenchimali rifornisce il tessuto di cellule progenitrici che differenzieranno in osteoblasti. Man mano che l’osso matura, il tessuto connettivo vascolare si trasforma in midollo osseo. Il periostio e l’endostio si originano da tessuto mesenchimale non calcificato (Gartner, 1998).
La maggior parte delle ossa lunghe e corte del corpo hanno origine mediante il
processo di ossificazione endocondrale che comincia quando cellule mesenchimali si aggregano nella sede di formazione di tessuto osseo e differenziano in condroblasti.
Questi producono un modello di cartilagine ialina sostituita poi da tessuto osseo che origina per differenziamento in senso osteoblastico di progenitori osteocondrali presenti nel modello. In secondo luogo, i condrociti presenti nel modello cartilagineo, si ipertrofizzano, e la matrice tra le cellule ipertrofiche si mineralizza con carbonato di calcio causando la morte dei condrociti stessi (Gartner, 1998). Gli osteoclasti, trasportati dai vasi sanguigni, rimuovono osso dal centro del modello per formare la cavità midollare, e cellule all’interno della cavità midollare si specializzano per formare midollo (Seeley, 2005). La sostituzione della cartilagine con l’osso continua fino a che tutta la cartilagine, ad eccezione di alcune sedi come le superfici articolari, non sia stata sostituita. Questi eventi caratterizzano il centro primario di ossificazione nel corso del processo di ossificazione endocondrale.
3.2 L’osteogenesi
L’osteogenesi è il processo ontogenetico che porta alla sintesi dell’osso attraverso una sequenza di eventi complessi e coordinati che permettono il differenziamento in senso osteoblastico di cellule staminali mesenchimali indifferenziate. I segnali che intervengono nella differenziazione osteogenica sono numerosi e sono responsabili dell’attivazione di
pathways intracellulari ancora non ben definiti. Complessivamente questi meccanismi
agiscono nella regolazione trascrizionale e post-trascrizionale per la determinazione del fenotipo osseo (Kirkham e Cartmell,2007).
24
Prima dell’inizio del processo osteogenico, le cellule mesenchimali sono morfologicamente omogenee e appaiono di forma appiattita di tipo fibroblastoide. Hanno, inoltre, un’ampia superficie di contatto con le cellule adiacenti con cui comunicano tramite gap junction. A seguito della ricezione di segnali informativi, le cellule staminali mesenchimali multipotenti vanno incontro a divisioni asimmetriche che generano osteoprogenitori i quali, a loro volta, danno origine a pre-osteoblasti, osteoblasti maturi e infine osteociti presenti all’interno della matrice ossea (Song e Tuan, 2004). Durante queste trasformazioni le cellule mesenchimali si aggregano e cominciano ad esprimere varie molecole di adesione, come la N-caderina, la fibronectina e le NCAM (Neural Cell Adhesion Molecules). La loro espressione poi diminuisce mano mano che le cellule cominciano ad esprimere marcatori di differenziamento osteoblastico (Wezeman, 1998). I progenitori committed, preosteoblasti, risiedono in prossimità della superficie dell’osso ed esprimono l’enzima fosfatasi alcalina (Alp) considerato un importante marcatore della differenziazione osteogenica (Deng et al.,2008). Quando i pre-osteoblasti cominciano a differenziare vanno incontro ad una serie di cambiamenti che portano all’acquisizione di un tipico fenotipo di osteoblasto maturo: il nucleo si espande, l’apparato del Golgi e il reticolo endoplasmatico aumentano di dimensioni. Durante questa trasformazione, le cellule aumentano di densità e perdono il loro aspetto fibroblastoide, assumendo una forma più rotondeggiante. Gli osteoblasti maturi cominciano a secernere la componente organica e inorganica della matrice, alcuni vi rimangono intrappolati e differenziano in osteociti che rappresentano lo stadio terminale del differenziamento degli osteoblasti.
3.2 Principali fattori che controllano la differenziazione osteogenica Le fasi proliferative sono caratterizzate da un aumento nell’espressione di geni
associati al ciclo cellulare, mentre la fase di maturazione è accompagnata dall’attivazione e successiva inattivazione di diversi fattori di trascrizione come
CBFA1/Runx2, Msx2, Dlx5, Dlx3, Osterix e la β-Catenina e dall’espressione di
marcatori funzionali precoci, quali la Fosfatasi Alcalina, e tardivi, come l’Osteocalcina, l’Osteopontina e la Sialoproteina ossea (Deng et al. 2008). Nelle fasi precoci del differenziamento sono attive importanti vie di segnalazione come quella mediata dalle BMPs che agiscono attivando vie di trasduzione interne del segnale che mediano l’attivazione e la regolazione di fattori di trascrizione dell’osteogenesi precoce.
Le BMPs (Bone Morphogenetic Proteins) appartengono alla superfamiglia delle proteine TGF-β (Transforming growth factor β), in particolare alla sottofamiglia TGF β1 proteine
25
regolatrici multifunzionali di proliferazione e differenziazione. Le BMPs svolgono un’importante ruolo nello sviluppo dello scheletro e nella formazione delle ossa andando ad attivare l’espressione del gene master della differenziazione osteogenica, Runx2 ed altri geni coinvolti nelle fasi iniziali dell’osteogenesi quali Msx2 e Dlx5 (Figura 2.5).
Figura 2.5 Trasduzione interna del segnale mediata dalla BMP2.
Le BMPs vengono sintetizzate come pre-peptidi i quali sono processati prima della secrezione per poi agire come omodimeri o eterodimeri interagendo con un complesso dimerico di due recettori di membrana serina-treonina chinasi, chiamati di tipo I e II (BMPRI-II). Il recettore attivato trasduce il segnale all’interno mediante la fosforilazione dei fattori trascrizionali SMADs i quali traslocano nel nucleo andando a regolare l’espressione di geni target sia interagendo direttamente con il loro promotore sia in associazione con specifici co-attivatori (Deng et al.,2008; Luu et al., 2006). In quest’ultimo caso sono gli stessi co-attivatori a determinare l’azione regolatoria delle SMADs sia in senso inibitorio che di attivazione (Itoh
26
Figura 2.6 Schema riportante gli interattori della SMADs
Al fine di comprendere la reale capacità osteoinduttiva di ciascun membro della famiglia delle BMPs, sono stati condotti diversi studi che hanno indicato le BMP2, 4,6,7 e 9 quelle con una maggiore capacità osteoinduttiva. Uno studio in vitro su linee cellulari con diverse potenzialità osteogeniche, ha dimostrato che esiste una sorta di modello gerarchico nell’impiego delle BMPs nell’osteogenesi, in cui le BMP2, 6 e 9 giocano un ruolo importante nell’induzione dei progenitori pluripotenti mesenchimali, mentre le BMP2, 4, 7e 9 sono capaci di sostenere la maturazione degli osteoblasti (Cheng H. et al.,2003)
A valle del segnale delle BMPs ritroviamo le omeoproteine Msx e Dlx, fattori
trascrizionali appartenenti a due vicine ma distinte famiglie di geni omeobox che, pur non essendo specifici per il differenziamento delle ossa, sono coinvolti nelle prime fasi del processo differenziativo degli osteoblasti. I geni Dlx dei vertebrati comprendono una famiglia di geni contenenti omeobox omologhi dei geni distal-less (Dll) di Drosophila. Svolgono funzioni essenziali durante la morfogenesi degli organi di senso e durante la migrazione delle cellule della cresta neurale (Merlo et al.,2000). In aggiunta Dlx5e Dlx6 sono espressi anche nel differenziamento degli osteoblasti. Le modalità con cui tali fattori intervengono non sono del tutto chiare, ma sembrano intervenire nello stesso pathway della omeoproteina Msx2 (mesh-less2). In letteratura è noto che Msx2 è espresso prevalentemente negli osteoprogenitori e la sua espressione cala durante il differenziamento. La sua funzione sembra essere quella di favorire la proliferazione delle cellule indifferenziate e inibire il differenziamento probabilmente andando ad inibire l’espressione di Runx2 e/o di altri geni di differenziamento
27
(Marie, 2008). Le proteine Dlx5, Dlx6 e Dlx3 si esprimono in tutte le fasi della differenziazione osteoblastica e la loro espressione aumenta negli osteoblasti maturi per poi mantenersi a livelli abbastanza alti quando questi differenziano terminalmente in osteociti. E’ noto che Dlx5 e Dlx6 hanno pattern d’espressione molto simili e presumibilmente assolvono simili funzioni. (Li et al.,2008). In particolare, Dlx5 e 6 sono antagonisti di Msx2 e agiscono andando ad occupare il promotore di quegli stessi geni la cui espressione è inibita da Msx2 come Runx2 (Newberry et al, 1998). Esperimenti di immunoprecipitazione hanno evidenziato la presenza di Msx2 sul promotore dell’osteocalcina negli osteoprogenitori in proliferazione, mentre Dlx5, Dlx3 e Runx2 sono reclutati sul promotore del gene in stadi post-proliferativi (Hassan et al.,2004). Per questo la loro funzione sembra essere rivolta a favorire il processo differenziativo degli osteoblasti. Meno chiara sembra la funzione Dlx3 che invece sembra poter agire sia favorendo che ostacolando la differenzizione a seconda dei partners con cui agisce.
Runx2 (CBFA1/PEBP2αA/AML-3/Osf2) è stato identificato come il principale
fattore di trascrizione, appartenente alla famiglia dei fattori trascrizionali Runt che controlla il
commitment e la differenziazione osteoblastica a partire dalle cellule mesenchimali sia durante
lo sviluppo scheletrico embrionale che nell’osteogenesi adulta. In particolare la sua funzione sembra essere essenziale a livello di cellule staminali mesenchimali indifferenziati per determinare il commitment di progenitori osteogenici. Successivamente mentre il livello di espressione di tale fattore trascrizionale tende a rimanere alto o ad aumentare nella differenziazione osteogenica, cala nella differenziazione in condrociti (Karsenty, 2008). Presumibilmente la funzione svolta da Runx2 non si limita al solo commitment di progenitori indifferenziati, ma la sua azione, combinata a quella di altre proteine, può intervenire a livelli multipli della differenziazione osteoblastica.
Nei mammiferi gli altri membri di tale famiglia sono Runx1, essenziale durante
l’ematopoiesi, e Runx3 coinvolto nella neurogenesi. Nonostante questa specificità tra i membri di questa famiglia ci possono essere delle ridondanze funzionali soprattutto per quanto riguarda il comune ruolo svolto nella regolazione della mitosi e nella regolazione trascrizionale di geni ribosomali (Zaidi et al.,2007). Il ruolo essenziale di Runx2 nella differenziazione osteoblastica è stato evidenziato per la prima volta in topi knock-out per tale gene caratterizzati da uno scheletro cartilagineo, privo di osteoblasti (Komori et al.,2006). D’altra parte, esperimenti di guadagno di funzione hanno rivelato che l’espressione indotta di
Runx2 porta alla formazione di osso ectopico. Non solo, aploinsufficienze di tale gene e
28
caratterizzate da una genesi anormale dello scheletro e arresto dello sviluppo osteoblastico (Mundlos et al., 1997). Il controllo della differenziazione osteoblastica da parte di Runx2 avviene secondo diverse modalità, non esclusive, ma che concorrono alla definizione delle giuste condizioni per il differenziamento. Evidenze sperimentali indicano che Runx2 regola negativamente il ciclo cellulare interagendo con alcune proteine coinvolte nella regolazione dello stesso, come retino blastoma, per poi agire come attivatore trascrizionale nella regolazione dell’espressione di inibitori del ciclo cellulare e di geni che favoriscono la differenziazione (Thomas et al.,2007). Runx2 può anche influenzare l’espressione genica attraverso un modellamento dell’architettura nucleare, agendo su proteine del di rimodellamento della cromatina (Marie, 2008). Inoltre attiva direttamente un certo numero di marcatori osteblastici come il Collagene di tipo 1, l’Osteopontina e l’Osteocalcina, attraverso un’azione diretta su sequenze consensus presenti sul loro promotore “Osteoblastic specific
element” (OSE: PuACCPuCA) (Marie, 2008).
Anche altre proteine con domini di legame al DNA partecipano all’osteogenesi. Osterix (Osx), è un fattore di trascrizione con un dominio di legame al DNA zinc-finger, è importante nell’acquisizione di un fenotipo osteoblastico maturo infatti esso è coinvolto nelle fasi più tardive dell’osteogenesi. L’espressione di Osx è successiva rispetto a quella di Runx2, che risulta normale in topi Osx-/- , mentre Osx è assente in mutanti Runx2-/-. Questo è stato confermato anche attraverso la caratterizzazione di un elemento di binding di Runx2 sul promotore del gene Osx (Nishio et al.,2006). Questo suggerisce che la funzione di Runx2 è fondamentale nelle fasi iniziali del differenziamento, agendo soprattutto a livello di progenitori osteo-condrali, mentre Osterix agisce prevalentemente in stadi più tardivi della differenziazione osteoblastica per distinguere il lineage cartilagineo da quello osteoblastico (Ryoo et al.,2006). Infatti, tale proteina contribuisce all’attivazione di marcatori osteogenici tardivi quali ad esempio l’Osteopontina e l’Osteocalcina. Inoltre in topi Osx-/- mostrano completa assenza di osteoblasti dimostrando che Osterix è il secondo fattore di trascrizione importante per la differenziazione osteoblastica (Komori, 2006).
La via di Wnt/β-Catenina guida un’importante via di trasduzione interna del segnale per il controllo dell’osteogenesi. L’interazione di una glicoproteina secreta Wnt con il recettore di membrana Frizzled e il co-recettore LRP5/6 hacome conseguenza l’inibizione della chinasi (GSK-3) responsabile della fosforilazione della β-Catenina. La β-Catenina non fosforilata non viene degradata e si accumula nel citoplasma per poi muovere al nucleo dove attiva la trascrizione di geni coinvolti nella differenziazione osteoblastica. Uno dei target della via di trasduzione del segnale mediata dalla β-Catenina è proprio Runx2 di cui promuove
29
l’espressione analogamente a quanto fanno le proteine BMPs (Gaur et al., 2005). L’inattivazione della β-Catenina nei progenitori mesenchimali blocca completamente la differenziazione osteoblastica e spinge le cellule a differenziare in condrociti (Hill et al.,
2005). In cellule mesenchimali β-Catenina -/- si ritrova l’espressione di Runx2 ma non di Osx;
la β-Catenina sembra trovarsi a valle di Runx2 nel pathway osteogenico ed essere richiesta per la differenziazione allo stadio di preosteoblasti (Hill et al., 2005). Esiste inoltre un
cross-talk molecolare tra la via di Wnt e quella di Notch, una famiglia di recettori transmembrana
che controllano il destino differenziativo in vari processi di sviluppo (Deregowsky et al.,
2006). I meccanismi con cui Notch regola il destino differenziativo degli osteoblasti sono
ancora poco noti e le opinioni al riguardo contrastanti. Il segnale di Notch sembra agire in contrasto con quello della β-Catenina portando quindi ad una inibizione del differenziamento in senso osteoblastico (Deregoswky et al., 2006).
Ad influenzare l’osteogenesi intervengono anche gli ormoni e alcuni dei fattori di crescita di fibroblasti (FGFs). I fattori ormonali di maggiore importanza sono l’ormone paratiroideo (PTH), gli estrogeni, i glucocorticoidi e la vitamina D che controllano la formazione dell’osso regolando l’espressione di fattori trascrizionali negli osteoblasti (Marie, 2008). In particolare, l’ormone paratiroideo è un ormone proteico che è stato dimostrato svolgere un ruolo importante durante l’ossificazione endocondrale nel corso della quale la proteina è secreta dalle cellule pericondri ali intorno alla cartilagine e dai primi condrociti in proliferazione (Deng et al., 2008). La sua funzione sembra essere rivolta ad una promozione dell’osteogenesi sia contribuendo all’attivazione di Runx2, sia inibendo la sua degrazione proteasomica (Marie, 2008). Per quanto concerne gli FGFs è stato dimostrato che il fattore FGF2,
pur non essendo un fattore trascrizionale specifico dell’osso, può provocare una prematura mineralizzazione, una minore lunghezza delle ossa lunga quando è sovraespresso e un significativo decremento nella massa ossea se i suoi livelli sono bassi (Kirkham et al.,2007). Quello che emerge è uno schema piuttosto complesso in cui molteplici fattori
trascrizionali convergono su medesime proteine per orchestrare l’espressione di una serie di segnali necessari al differenziamento di progenitori indifferenziati in
osteoblasti e poi in osteociti. Il problema principale sta nella comprensione delle modalità con cui tali segnali interagiscono, dei loro partners, del momento della
differenziazione in cui intervengono, del loro stesso effetto. Infatti, nella maggior parte dei casi si riesce a comprendere che un certo fattore è implicato nell’osteogenesi, ma non sono
30
note le modalità con cui agisce. Basti pensare che lo stesso Runx2, gene master nel differenziamento agisce con meccanismi e tempi che non sono ancora stati ben definiti. Presumibilmente tale fattore trascrizionale svolge la sua funzione in due momenti nel primo dei quali è coinvolto nel committment dei progenitori osteogenici. Successivamente contribuisce al loro differenziamento osteoblastico insieme ad altre proteine, ad esempio Osx e la β-Catenina (Marie, 2008).(Figura 2.7)
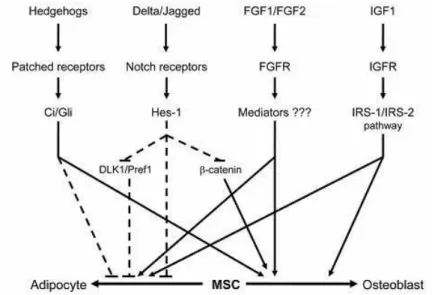
Figura 2.7 Ruolo di alcuni dei fattori trascrizionali coinvolti nella determinazione del lineage osteoblastico,
condrocitico e adipogenico.