4.1. Preparazione della soluzione di processo
La composizione della soluzione di processo utilizzata nel presente lavoro è riportata in Tabella 4.1. Come si osserva il contenuto di cromo è cosi elevato da giustificare lo sviluppo di un processo per un suo recupero.
Tab. 4.1. Composizione tipica della soluzione di processo in mg/l.
Cromo III 2857 Cromo esavalente < 0,5 Alluminio 62 Ferro 33 Solfati 19260 Cloruri 14870 Calcio 690 Magnesio 1018 Manganese 2,8 COD 7530 Olii e grassi 825
Come indicato nel Paragrafo 3.1, la soluzione tal quale è stata trattata con dicalite al fine di ridurre la quantità di olii e grassi. I risultati del pretrattamento effettuato utilizzando tempi di contatto e rapporti soluzione/dicalite diversi sono riportati in Tabella 4.2.
Tab. 4.2. Risultati prove con farina fossile
dicalite/soluzione (g/l) 28 28 19 36
Tempo di agitazione (h) 17 4 17 17
Olii e grassi (mg/l) iniziali 522 648 1011 1181
Olii e grassi (mg/l) finali 16 16 27 37
Dai risultati appare evidente che l’efficienza di abbattimento risulta pressoché indipendente dal tempo di contatto e dal dosaggio nel range dei valori investigati. Pertanto abbiamo scelto come dosaggio circa 19 g/l e tempo 4 ore al fine di ridurre sia il consumo di farina fossile e, quindi il residuo da smaltire a valle della filtrazione, sia i tempi di agitazione della sospensione.
4.2. Adsorbimento di Cr(III) su TP207
A seguito del condizionamento della resina, a partire da 50 g di resina secca sono stati ottenuti 68 m l di resina condizionata, di questi sono stati utilizzati 50 mL, corrispondenti a 36,76 g di resina secca di partenza) o 30 mL (22,06 g resina secca).
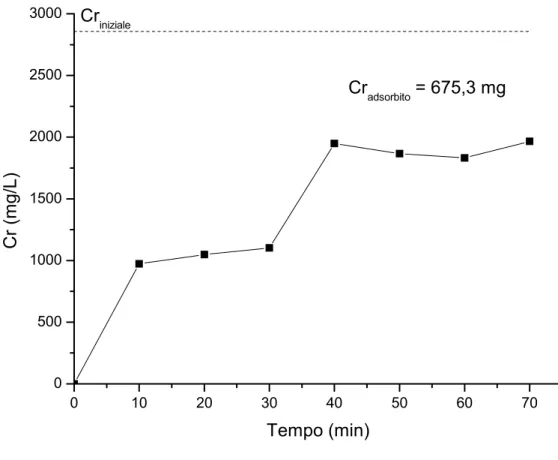
Nelle Figg. 4.1 e 4.2 si riportano, rispettivamente, la curva di adsorbimento e di eluizione ottenute nelle condizioni operative relative alla prova A/R 1 (v. Tab. 3.3 Par. 3.5). 0 10 20 30 40 50 60 70 0 500 1000 1500 2000 2500 3000 Cradsorbito = 675,3 mg Criniziale Cr (m g/ L) Tempo (min)
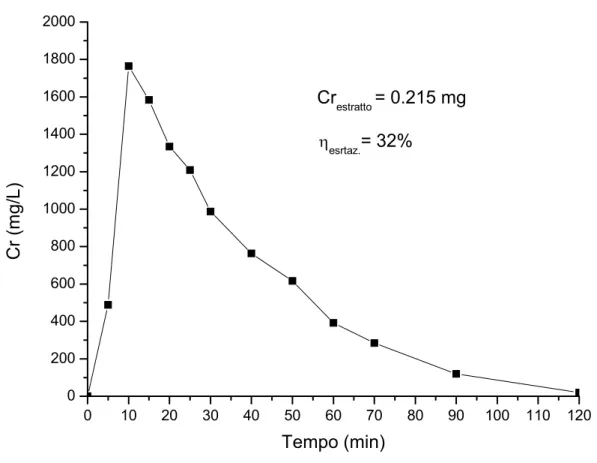
0 10 20 30 40 50 60 70 80 90 100 110 120 0 200 400 600 800 1000 1200 1400 1600 1800 2000 ηesrtaz.= 32% Crestratto = 0.215 mg Cr (m g/ L) Tempo (min)
Fig. 4.2. Curva di eluizione relativa alla prova A/R 1
A causa del basso valore di efficienza abbiamo utilizzato un diverso protocollo per la fase di estrazione/rigenerazione che prevede l’utilizzo di H2O2/NaOH per
l’estrazione di Cr3+ sottoforma di Cr6+ e successivamente l’utilizzo di H2SO4 al 10%
per l’estrazione di Al e Fe.
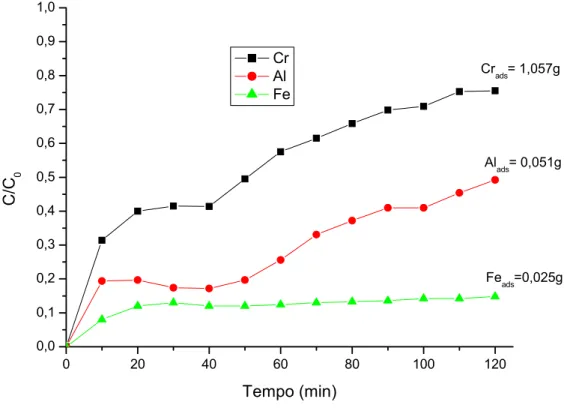
Nelle Figg. 4.3 – 4.4 si riportano le curve di adsorbimento di Cr, Al e Fe nelle condizioni relative alle prove A/R 2 e A/R 3 rispettivamente.
La soluzione alimentata in colonna presentava le seguenti concentrazioni: per la prova A/R 2 (Cr = 2848 mg/L, Al = 66 mg/L, Fe = 33 mg/L); per la prova A/R 3, invece, (Cr = 2965 mg/L, Al = 88,4 mg/L, Fe = 27 mg/L).
0 20 40 60 80 100 120 0,0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9 1,0 Feads=0,025g Alads= 0,051g Crads= 1,057g C/C 0 Tempo (min) Cr Al Fe
Fig. 4.3. Curve di adsorbimento per Cr, Al, Fe relative alla prova A/R 2
0 50 100 150 200 0,0 0,2 0,4 0,6 0,8 Feads= 0,018g Alads= 0,054g Crads= 1,170g C/ C 0 Tempo (min) Cr Al Fe
In entrambe le prove il sistema si è intasato probabilmente a causa della precipitazione degli idrossidi, causato dall’elevata concentrazione di NaOH, e nella difficoltà di smaltimento dell’O2,sviluppato dalla decomposizione dell’ H2O2. Non è
stato quindi possibile calcolare l’efficienza di estrazione.
Al fine di facilitare l’allontanamento dell’O2, proveniente dalla decomposizione dell’
H2O2, durante la prima fase di estrazione, si è deciso di utilizzare un minore volume
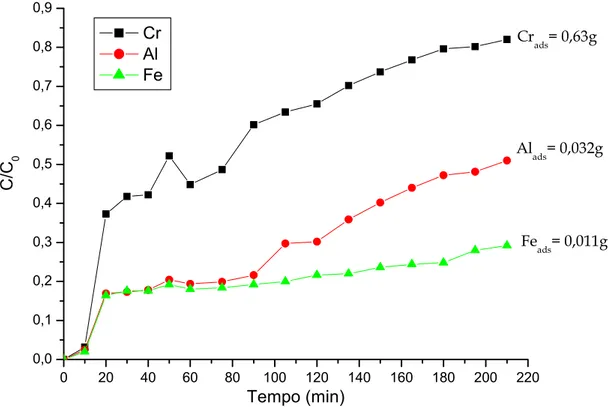
di letto (30mL). In Fig. 4.5. si riportano le curve di adsorbimento di Cr, Al e Fe nelle condizioni relative alle prove A/R 4; le concentrazioni della soluzione di alimentazione sono Cr = 2869 mg/L, Al = 87 mg/L, Fe = 25 mg/L. 0 20 40 60 80 100 120 140 160 180 200 220 0,0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9 Feads= 0,011g Alads= 0,032g Crads= 0,63g C/ C 0 Tempo (min) Cr Al Fe
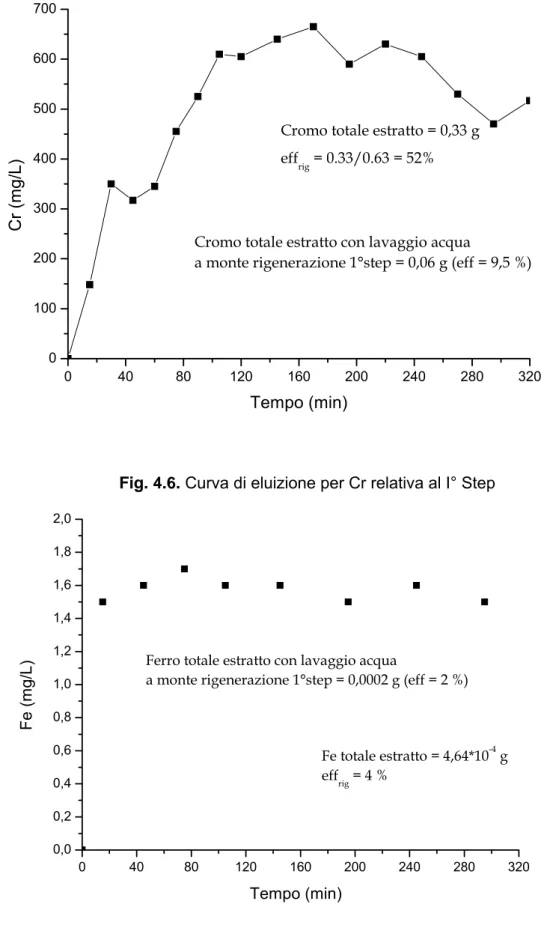
Nelle seguenti Figg. si riportano le curve di eluizione, per Cr, Al, Fe, relative alla fase di estrazione/rigenerazione (I° step con H2O2-NaOH-NaCl ; II° step con H2SO4)
0 40 80 120 160 200 240 280 320 0 100 200 300 400 500 600 700
Cromo totale estratto con lavaggio acqua
a monte rigenerazione 1°step = 0,06 g (eff = 9,5 %) effrig = 0.33/0.63 = 52%
Cromo totale estratto = 0,33 g
Cr (m
g/
L)
Tempo (min)
Fig. 4.6. Curva di eluizione per Cr relativa al I° Step
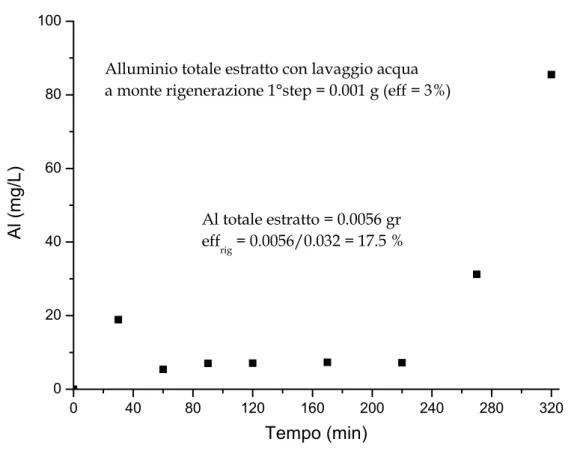
0 40 80 120 160 200 240 280 320 0,0 0,2 0,4 0,6 0,8 1,0 1,2 1,4 1,6 1,8 2,0
Ferro totale estratto con lavaggio acqua
a monte rigenerazione 1°step = 0,0002 g (eff = 2 %)
Fe totale estratto = 4,64*10-4 g effrig = 4 % Fe (m g/L ) Tempo (min)
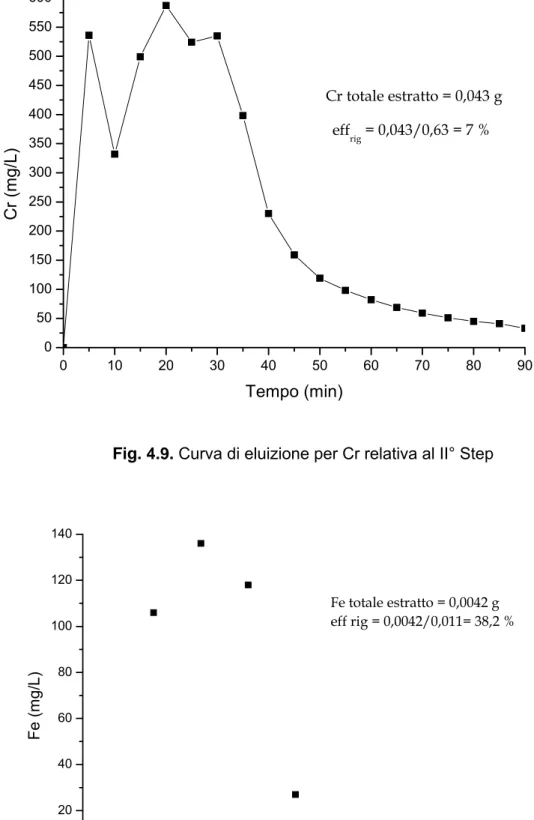
0 40 80 120 160 200 240 280 320 0 20 40 60 80 100
Alluminio totale estratto con lavaggio acqua a monte rigenerazione 1°step = 0.001 g (eff = 3%)
Al totale estratto = 0.0056 gr effrig = 0.0056/0.032 = 17.5 % Al (m g/L ) Tempo (min)
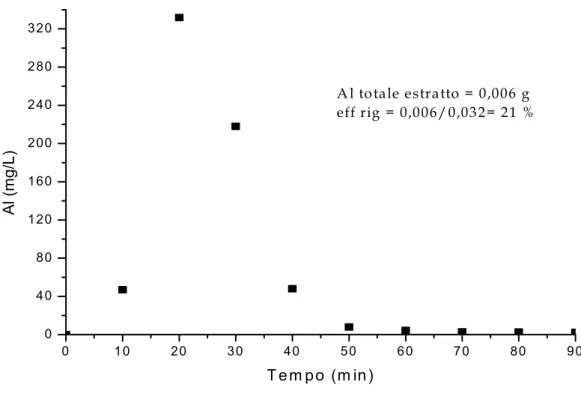
600 0 10 20 30 40 50 60 70 80 90 0 50 100 150 200 250 300 350 400 450 500 550 effrig = 0,043/0,63 = 7 % Cr totale estratto = 0,043 g Cr (m g/L) Tempo (min)
Fig. 4.9. Curva di eluizione per Cr relativa al II° Step
0 10 20 30 40 50 60 70 80 90 0 20 40 60 80 100 120 140 Fe totale estratto = 0,0042 g eff rig = 0,0042/0,011= 38,2 % F e ( m g /L ) Tempo (min)
20 60 200 240 80 20 0 10 20 30 40 50 60 70 80 90 0 40 80 1 1 2 3 A l totale estratto = 0,006 g eff rig = 0,006/0,032= 21 % Al (m g/L ) T em po (m in)
Fig. 4.11. Curva di eluizione per Al relativa al II° Step
Dai conti effettuati risulta che l’efficienza totale vale: ηEstr = 68.5% ( Cr )
ηEstr = 44.5% ( Fe)
ηEstr = 41.5% ( Al )
L’efficienza di estrazione rimane sempre bassa come nelle prove precedenti. Inoltre nella fase di estrazione ci sono comunque stati problemi nello smaltire l’O2
formatosi. Per cercare di risolvere il problema, nella prova successiva, è stato utilizzato un letto fluidizzato nella fase di estrazione I° step.
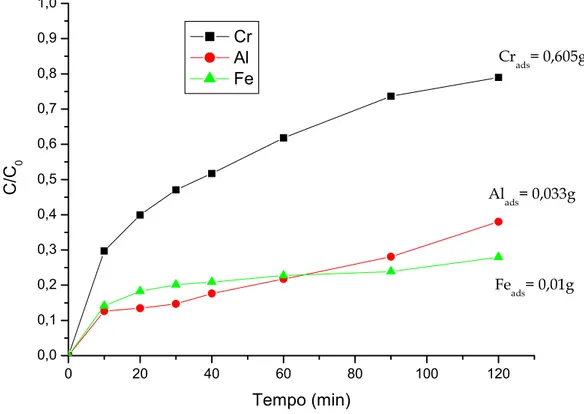
In Fig. 4.12 si riportano le curve di adsorbimento relative a Cr, Al, Fe per la prova A/R 5 0 20 40 60 80 100 120 0,0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9 1,0 Feads= 0,01g Alads= 0,033g Crads= 0,605g C/C 0 Tempo (min) Cr Al Fe
Fig. 4.12. Curve di adsorbimento per Cr, Al, Fe relativa alla prova A/R 5
Durante il primo lavaggio con H2O si ottiene una efficienza di estrazione del 2%.
Nella fase di estrazione,I° step, a letto fluidizzato in 170 minuti abbiamo raccolto 808 ml di soluzione in uscita, pertanto la soluzione di alimentazione è stata prelevata a 9,5 BV/h.
La soluzione così ottenuta presentava una concentrazione di Cr(VI) pari a 324 mg/L, quindi il cromo estratto è risultato pari a 0,532 g portando così ad una efficienza di estrazione del 87,8%.
0 3 0 4 0 5 0 6 0 7 0 8 0 9 0
In Fig. 4.13 si riporta la curva di eluizione per il Cr relativa al II° step.
0 15 30 45 60 75 90 0 100 20 0 0 0 0 0 0 0
Cromo estratto nel lavaggio = 0,014 g (eff = 2%) Cromo estratto 2° rigenerazione
a letto fisso = 0,072 g (eff = 11%) Cromo estratto 1° rigenerazione
letto fluidizzato = 0,532 g (eff = 87.5 %)
Cr ( m g/ L) Tempo (min)
Fig. 4.13. Curva di eluizione per Cr relativa al II° Step
In questa fase l’efficienza di estrazione risulta pari a 8,8%.
Riguardo al Fe l’efficienza di estrazione sono risultate pari a 0,68%, 14% ed infine 85% durante il lavaggio con acqua, estrazione con NaOH/H2O2/NaCl ed estrazione
con H2SO4 rispettivamente.
Per quanto riguarda l’Al si è ottenuto: 0.7%, 28,2%, 71% rispettivamente. Le efficienze totali risultano pari a:
ηEstr = 98,6% ( Cr )
ηEstr = 99,68% ( Fe)
4.3. Adsorbimento di Cr (VI) su S990
4.3.1 Preparazione della soluzione di dicromatoA partire da 10 L di soluzione di Cr(III), dopo trattamento con dicalite e filtrazione, si ottengono 9.5 L di filtrato a cui si sono addizionati 1.06 L di NaOH (10%) per portare il pH a circa 12. Dopodiché si sono aggiunti 340 mL di H2O2 (30%) per ossidare il
Cr3+ a Cr6+,secondo la seguente reazione:
2Cr3+ 3H2O2 + 10OH- 2CrO42- + 8H2O (4.1)
Il tutto è stato mantenuto in agitazione per 4 ore e lasciato a riposo tutta la notte per completare la reazione di ossidazione e allontanare l’H2O2 residua. Il solido che si è
depositano sul fondo (color verde-marrone) è stato allontanato per filtrazione e il filtrato, circa 10.5 L, di color giallo paglierino contiene cromo sotto forma di cromato CrO42-.
Da lavori di letteratura, viene consigliato di adsorbire il cromo come dicromato Cr2O72- al fine di aumentare la capacità adsorbente della resina dato che per ogni
possibile centro di adsorbimento due atomi di Cr possono essere fissati alla resina invece di uno solo. A tale scopo la soluzione di cromato, priva di H2O2 residua, è
stata acidificata a pH = 3 - 3.5 con H2SO4 al 5 % per passare da cromato a
dicromato (il colore passa da giallo ad arancione scuro):
2CrO42- + 2H+ Cr2O72- + H2O (4.2)
Al fine di valutare la possibilità di recuperare il cromo contenuto nel residuo solido dopo la fase di ossidazione, è stata condotta un’ulteriore fase di ossidazione su tale residuo. Il solido di color verde-marrone (la colorazione indica chiaramente la presenza di Cr(III) come idrossido) ottenuto a partire da 1.5 L di soluzione di Cr(III) pretrattata è stato trattato nuovamente con 50 mL di Na(OH) al 10% per portare il pH a 12 e 50 mL di H2O2 per cercare di ossidare ulteriormente il Cr(III). A valle di
quest’ulteriore stadio di ossidazione rimane ancora del solido di color giallo rossastro che in alcuni lavori di letteratura viene identificato come perossocromato
quantificato e analizzato.
In Fig.4..14 si riporta il flowsheet complessivo per chiarire meglio i flussi, le composizioni e come si è ripartito il Cr totale.
9.5 L Cr 3+ = 2900 mg/L (27.55 g) Al3+ = 90 mg/L (0.85 g) Fe3+ = 23 mg/L (0.22 g) Cr3+ Æ Cr 6+ pH = 12 NaOH (10%) H2O2 (30%) FILTRAZIONE cromato Æ dicromato pH = 3.5 10.5 L Cr6+ = 1396 mg/L (14.66) Al3+ = 1.2 mg/L (0.01 g) Fe3+ = 0.9 mg/L (0.01 g) Residuo solido 10.9 L 1396 mg/L 0.7 L Cr6+ 1075 mg/L (0.75 g) Al3+ ≈ 0 Fe3+ ≈ 0 NaOH (10 %) H2O2 (30%) Cr = 12.14 g Al = 0.84 g Fe = 0.21 g H2SO4 5 % adsorbimento su resina
Fig.4.14 Schema della procedura seguita per l’ottenimento della soluzione di
dicromato utilizzata nelle prove di adsorbimento.
Appare evidente che la procedura inizialmente adottata per l’ossidazione non ha permesso di ossidare tutto il Cr(III). Per tale ragione sono state condotte prove successive di ossidazione più spinta al fine di valutare l’eccesso di H2O2 necessario
4.3.2 Adsorbimento su S990
La soluzione di dicromato ottenuta seguendo la procedura descritta sopra è stata utilizzata per le preliminari prove di adsorbimento/rigenerazione, al fine di testare la capacità della resina scelta e la rigenerabilità della stessa.
30 mL (Bed Volume, BV) di resina condizionata sono stati caricati nel letto per iniziare le prove di adsorbimento/rigenerazione. La soluzione di dicromato è stata alimentata in continuo secondo lo schema riportato nel Paragrafo 3.6. La soluzione in uscita dalla colonna è stata campionata a intervalli di tempo di 60 min. La durata di 4.5 h è stata scelta, non avendo in partenza le analisi, sulla base del passaggio visivo del colore della soluzione in uscita dal letto da incolore a giallo paglierino. In Fig. 4.15 si riporta la concentrazione del Cr in uscita dal letto, durante i 4 cicli di adsorbimento, in funzione del tempo e dei BV di soluzione trattata. In Tabella 4.2 si riportano i risultati ottenuti in termini di Cromo adsorbito dopo 180 min (pari a 29 BV) e 270 min (pari a 44 BV) e Cromo estratto nei vari step di rigenerazione. Si riportano, inoltre, le quantità di soluzione inviata alla colonna durante le fasi di adsorbimento (relative a 270 min), le quantità di soluzione totale e relativa concentrazione di Cr che esce dalla colonna durante le fasi di adsorbimento ed, infine, la quantità di soluzione totale che viene raccolta durante le fasi di rigenerazione, ottenuta sommando i vari contributi delle singole fasi di rigenerazione.
0 30 60 90 120 150 180 210 240 270 0,00 0,05 0,10 0,15 0,20 0,25 0,30 0,8 0,9 BV = 30 mL Flusso = 9.7 BV/h BV 30 40 20 10 C/C0 Tempo (min.) 1° ciclo 2° 3° 4°
Fig 4.15. Andamento della concentrazione normalizzata del Cromo nel tempo all’uscita
della colonna di adsorbimento nei 4 cicli di adsorbimento/rigenerazione.
Tabella 4.3 Riassunto dei risultati dei cicli di adsorbimento /rigenerazione.
Ciclo 1 Ciclo 2 Ciclo 3 Ciclo 4
Soluzione trattata (L)* Cr0 (mg/L) 1.3 1354 1.3 1340 1.3 1337 1.3 1350 Crads in 180 min (g) 1.16 1.14 1.13 1.12 Crads in 270 min (g) 1.72 1.69 1.68 1.67
Soluzione uscita colonna (L)**
Cr (mg/L) 1.3 30 1.3 38 1.3 44 1.3 65 Cr estratto (mg) a. b. c. d. e. Cr estratto totale (g) Efficienza estrazione (%) 2.6 1333.4 0.4 0.6 0.5 1.34 78 2.8 1419.0 1.0 0.8 0.7 1.42 85 3.6 1223.0 0.2 0.8 1.0 1.23 74 Soluzione finale (L)*** Cr (mg/L) 3428 0.39 3651 0.39 3148 0.39
* soluzione trattata in ogni ciclo ≈ 9.7·0.030·270/60 (~ 44 BV); ** soluzione totale in uscita dalla colonna durante la
4.3.3 Prove di ossidazione a stadi
A fronte dei risultati ottenuti nelle preliminari prove di ossidazione, si osservato che l’ossidazione nelle condizioni adottate non è stata sufficiente a convertire totalmente il Cr(III) a Cr(VI). Infatti, da semplici bilanci di materia, una rilevante quantità di Cromo (presubilmente Cr(III)) rimane del residuo solido dopo anche il secondo stadio di ossidazione (vedi Fig.4.14). Trattandosi, infatti, di una reazione reversibile è necessario usare un forte eccesso di H2O2 a pH 12 per spostare la reazione verso
destra. A tale scopo la reazione di ossidazione è stata realizzata in due stadi: il primo stadio è stato condotto nelle stesse condizioni adottate inizialmente, mentre il secondo stadio è stato condotto con un forte eccesso di H2O2. In Fig. 4.16 si riporta
lo schema del processo con le quantità utilizzate dei reagenti e le quantità delle varie correnti con le relative concentrazioni. Come si osserva, il residuo solido ottenuto dopo la filtrazione a valle del secondo stadio di ossidazione è stato essiccato al fine di quantificarlo. Tale precipitato assume una colorazione giallo rossastra e dovrebbe essere costituito essenzialmente da perossocromato come riportato in alcuni articoli [1.8]. Una parte di questo è stato analizzato al SEM-EDS per avere un’analisi qualitativa in termini anche degli altri elementi (v. Fig.4.17), mentre una parte è stata sciolta con H2SO4 (5%) a pH 3-3.5. La soluzione risultante
è stata analizzata. Come si osserva dai valori riportati in Fig. 4.16 i bilanci sul Cromo non si chiudono perfettamente in quanto durante le operazioni di filtrazione e trasferimento/recupero dei pannelli si sono verificate inevitabili perdite di materiale che, data la quantità ridotta di soluzione trattata (1L), vanno a pesare in maniera non trascurabile sul bilancio totale.
Dalle analisi della soluzione, risultante dallo scioglimento del pannello, risulta che il Cromo è presente per l’85% come Cr6+ e il rimanente 15 % come Cr3+. Basandoci
su tale rapporto e distribuendo la perdita nelle due filtrazioni si ottiene una conversione di ossidazione del Cr6+ a Cr3+ di circa 97-98%. In futuro si possono prevedere altre prove di ossidazione più spinta per arrivare a convertire quasi totalmente il Cr3+ a Cr6+.
Nel processo reale, una volta valutate le condizioni ossidative più idonee, la soluzione di cromato a valle dell’ossidazione potrebbe essere portata direttamente a pH 3-3.5, dopo energica agitazione per rimuovere l’H2O2 residua, in modo da
favorire contemporaneamente lo scioglimento dell’eventuale solido formatosi (perossocromato) e il passaggio da cromato a dicromato. In tal modo le due
unico stadio. In Fig. 4.18 si riporta lo schema dell’ipotetico processo per ottenere la soluzione di dicromato da inviare all’adsorbimento.
adsorbimento su resina 1° STADIO Cr3+ Æ Cr 6+ pH = 12 mix 3 h; a riposo 24 h 150 mL NaOH (10%) 30 mL H2O2 (30%) FILTRAZIONE Soluzione totale di cromato 50 mL NaOH (10%) 100 mL H2O2 (30%) 1,9657 g 2 ° STADIO Cr3+ Æ Cr 6+ pH = 12 mix 3 h FILTRAZIONE ~ 0.3 L Cr6+ = 600 mg/L ( 0.18 g) Al3+ = 0 mg/L ( 0 g) Fe3+ = 0.6 mg/L ( ~ 0 g) residuo solido arancione-marrone ESSICCAMENTO 105 °C per 12 h
residuo solido secco (giallo ocra) 2,668 g per analisi 100 mL H2O 22 mL H2SO4 (5 %) pH = 3 - 3.5 122 mL (0.2 L) Cr6+ = 976 mg/L ( 0.19 g) e Cr3+ = 179 mg/L (0.04 g) Crtot = 0.23 g
Al3+ = 450 mg/L (calcolata per differenza)
Fe3+ = 110 mg/L (calcolata per differenza)
cromato Æ dicromato pH = 3.5 H2SO4 96 %
Fig.4.16. Flowsheet del processo adottato nelle prove residuo solido umido
( ~ 100 mL + 100 mL H2O) 1.5 L 1.180 L ~ 1 L Cr6+ = 1885 mg/L ( 1.9 g) Al3+ = 8.9 mg/L ( 0.009 g) Fe3+ = 2.6 mg/L ( 0.002 g) Fe3+ = 22 mg/L
C 2.40 4.65 O 38.32 55.68 Na 8.29 8.38 Mg 5.09 4.87 Al 1.04 0.90 Si 1.40 1.16 P 0.40 0.30 S 3.17 2.30 Cl 14.98 9.82 Ca 6.11 3.55 Cr 18.80 8.40 Tot. 100.00
Fig.4.17 Microanalisi SEM-EDS del pannello (giallo ocra) ottenuto a valle del secondo
Soluzione di partenza Cr3+, Al3+ ,Fe3+ Cr3+ Æ Cr 6+ pH = 12 NaOH (10%) H2O2 (30%) in grande eccesso cromato Æ dicromato pH = 3 - 3.5 Cr6+ (tracce di Cr3+), Al3+ ,Fe3+ H2SO4 5 % adsorbimento su resina
Fig.4.18 Schema previsto per l’ottenimento della soluzione di dicromato da inviare
all’adsorbimento.
4.3.4 Preliminare valutazione dei consumi di reagenti e della resina
Il percorso logico utilizzato per quantificare i reagenti e il consumo di resina per ciclo di adsorbimento è stato il seguente.
Sulla base dei dati relativi alle prove di adsorbimento si è visto che a fronte di 1.3 L di soluzione di dicromato a concentrazione media di Cr6+ di 1350 mg/L inviata in colonna, riempita con 30 mL (BV) di resina, per ciclo di adsorbimento/rigenerazione sono stati utilizzati per l’estrazione/rigenerazione complessivamente 90 mL di acqua, 180 mL di NaOH 10% e 90 mL di H2SO4 5%. Inoltre a fronte di 4 cicli di
adsorbimento/rigenerazione si è avuta una perdita di capacità adsorbente di circa il 3 % (= (1.72-1.67)/1.72·100), pertanto è come avere una perdita di resina distribuita nei 4 cicli pari a 0.225 mL (= 0.03·30/4). Considerando di processare per ciclo di adsorbimento 1000 L di soluzione di dicromato con concentrazione iniziale analoga, si andrebbe ad utilizzare 23 L ( = 1000/(9.7·4.5)) di resina e, ipotizzando un analoga perdita di capacità dopo 4 cicli, per ogni ciclo si perderebbero circa 0.17 L di resina. Inoltre, le quantità di reagenti da utilizzare sarebbero circa 69 L di acqua, 138 L di NaOH 10 % e 69 L di H2SO4 5% per l’estrazione/rigenerazione (tali quantità sono
acidificazione per l’ottenimento della soluzione di dicromato si è visto che per 1 L di soluzione di Cr3+ pretrattata con farina fossile sono stati necessari 250 mL di acqua, 200 mL di NaOH 10 %, 130 mL di H2O2 (30%) e 90 mL di H2SO4 5%. In tal modo si
ottiene una soluzione pari 1.67 L di dicromato da inviare all’adsorbimento. Pertanto, mantenendo lo stesso rapporto tra reagenti e soluzione di partenza, per processare 1000 L di soluzione di Cr3+ pretrattata saranno necessari 250 L di acqua, 200 L di NaOH 10 %, 130 L di H2O2 (30%) e 90 L di H2SO4 5%.
Di conseguenza se prendiamo come base di riferimento 1000 L di soluzione di Cr3+ pretrattata, si andrebbero ad ottenere 1670 L di soluzione di dicromato con concentrazione di circa 1700 mg/L e si andrebbero ad utilizzare circa 40 L ( = 1670/(9.7·4.5)) di resina e, ipotizzando un’analoga perdita di capacità dopo 4 cicli, per ogni ciclo si andrebbe a perdere circa 0.3 L di resina. Le quantità di reagenti da utilizzare per l’estrazione/rigenerazione della resina sarebbero circa 120 L di acqua, 240 L di NaOH 10 % e 120 L di H2SO4 5% per l’estrazione/rigenerazione.
I consumi dei reagenti e della resina, così valutati, sono riportati nella Tabella 4.4 A questi, ricordiamo, che dovranno essere aggiunti quelli richiesti per processare le due soluzioni ottenute durante sia la fase di adsorbimento (1670 L) che durante la fase di estrazione/rigenerazione (circa 480 L = 12 BV con BV = 40 L). La prima conterrà il Cr6+ non adsorbito e i vari cationi quali Al3+, Fe3+, etc. (non essendo questi
adsorbiti dalla resina anionica), mentre la seconda conterrà essenzialmente Cr6+ e tracce dei vari cationi. Entrambe, separatamente, dovranno essere acidificate, mediante H2SO4, e poi addizionate con H2O2 per favorire la riduzione del Cr6+ a
Cr3+. Infine le due soluzioni di Cr3+ potranno essere portate a pH 8 per far avvenire la precipitazione dell’idrossido di Cr(III). Nel primo caso il precipitato conterrà anche gli altri idrossidi, mentre nel secondo caso si dovrebbe ottenere un pannello di Cr(OH)3 di elevata purezza da riutilizzare nel ciclo conciario. In Fig.4.19 si riporta il
possibile flowsheet dell’intero processo a partire dalla soluzione di Cr3+ di partenza fino agli stadi di riduzione e precipitazione.
Riguardo alla preliminare valutazione dei costi, per i reagenti si è fatto riferimento a dati reperiti in letteratura. Bisogna tener conto che tali costi possono subire ampie variazioni dipendendo anche dalle quantità acquistate. Dato che alcuni dei reagenti utilizzati sono utilizzati anche da CRC, la Tabella 3 può essere aggiornata con i loro prezzi.
Tabella 4.4. Quantità e costo dei reagenti e della resina per 1000 L di soluzione di Cr di
partenza.
Voce Quantità Costo unitario Costo totale
Reagenti H2O2 (30 %) H2SO4 (96 %) NaOH (pellets) Costo totale 130 L 6.2 L 44 kg 0.7 €/L 0.2 €/L 0.24 €/kg € 91 € 1.24 € 10.56 € 102.8 Utility Acqua di processo 1000 L XXX €/L € Y Resina PUROFINE S990* (dovuta a perdita di capacità adsorbente) 0.3 L * 14,25 €/L € 4.3 COSTO TOTALE € 107.1 + Y
* (dovuta a perdita di capacità adsorbente).
Per quantificare il costo della resina per ciclo di adsorbimento è stata utilizzata la perdita percentuale basata su 4 cicli, ovviamente la cosa più realistica sarebbe quella di indagare la perdita di capacità dopo un numero di cicli ben superiore a 4. Infatti, poiché le resine mostrano generalmente andamenti di perdita di performance non lineari con il numero di cicli, ci si aspetta che all’aumentare del numero dei cicli di adsorbimento/rigenerazione la percentuale di perdita di capacità aumenti più marcatamente rispetto a quanto accade nei primi cicli. Sulla base, infatti, dei risultati ottenuti a valle di 4 cicli il costo imputabile alla resina è piccolo se confrontato con le altre voci di costo. Se il dato fosse relativo ad un numero più significativo di cicli (15-20) il suo costo sarebbe più elevato.
Da questa preliminare valutazione appare evidente il massiccio consumo di H2O2
(30%) richiesto per spingere l’ossidazione del cromo quasi a completamento. Sulla base del costo medio reperito in letteratura e su internet, tale voce di costo al momento risulta la più significativa. Teniamo conto che l’H2O2 dovrà essere
utilizzata anche per la fase successiva di riduzione del Cr(VI) a Cr(III) a pH acido. Un’alternativa potrebbe essere quella di utilizzare un altro agente ossidante e riducente del cromo a più basso costo.
adsorbimento su resina Cr6+ (piccole concentrazioni), Al3+,Fe3+, Mn+ Cr 6+ (elevate concentrazioni) H2SO4 5 % RIDUZIONE Cr6+ Æ Cr3+ pH acido estrazione/rigenerazione resina H2O2 (30%) in grande eccesso NaOH 10% H2SO4 5% direttamente in conceria o alla precipitazione
Fig. 4.19 Possibile flowsheet
Cr6+ (eventuali tracce di Cr3+), Al3+ ,Fe3+ NaOH (10%) H2O2 (30%) in grande eccesso OSSIDAZIONE Cr3+ Æ Cr 6+ pH = 12 CrO42- Æ Cr2O7 2-pH = 3 - 3.5 Precipitazione RIDUZIONE Cr6+ Æ Cr3+ pH acido H2O2 (30%) in grande eccesso H2SO4 5 % NaOH (10%) H2SO4 5 %