1 INDICE 1) RIASSUNTO 3 2) IL GLAUCOMA 5 2.1 DEFINIZIONE E FISIOPATOLOGIA 5 2.2 CLASSIFICAZIONE 15 2.3 DIAGNOSI 21
2.4 TERAPIA MEDICA E CHIRURGICA 31
3) IL TRATTAMENTO LASER NELLA PATOLOGIA GLAUCOMATOSA
42
3.1 STUDIO IN VITRO PER DETERMINARE GLI EFFETTI DEL
LASER SULLE CELLULE DEL TESSUTO RETICOLARE
TRABECOLARE (EFFETTI TERMICI DEL TRATTAMENTO
LASER)
50
3.2 STUDI IN VITRO PER LA VALUTAZIONE DEI RESPONSI
DI CITOCINESI ALL’ALT E ALL’SLT (EFFETTI BIOLOGICI DEL TRATTAMENTO LASER)
54
3.3 STUDI IN VIVO (NELL’UOMO) 58
3.3.1 Studio in vivo (primati) – Istologia del tessuto reticolare
trabecolare a seguito di SLT
2
3.3.2 Studio in Vivo (primati) – Effetti biologici del trattamento laser
64
3.4 RIASSUNTO STUDI PRE-CLINICI 65
4) PAZIENTI E METODI 68
5) RISULTATI 73
6) DISCUSSIONE 78
3
1)
RIASSUNTO
Con il termine glaucoma vengono indicate un gruppo di neuropatie ottiche progressive che hanno in comune la lenta degenerazione delle cellule ganglionari retiniche e dei loro assoni, che inducono alterazioni a livello della testa del nervo ottico con concomitante perdita della funzione visiva. Scopo di questa tesi è valutare l’efficacia di una tecnica di laser trabeculoplastica recentemente proposta, la Laser Trabeculoplastica Selettiva, che agisce selettivamente sulle cellule pigmentate del tessuto trabecolare, in modo da limitare il danno ai tessuti circostanti e ridurre la reazione infiammatoria intraoculare. Infatti, questa tecnica a differenza della Argon Laser Trabeculoplastica, che presenta un eccessivo danno coagulativo arrecato alla struttura reticolare trabecolare, permette di colpire in maniera selettiva queste cellule evitando il danneggiamento termico collaterale delle cellule non pigmentate appartenenti allo stesso tessuto e dei sottostanti fasci trabecolari. Questo è possibile poiché è eseguita con laser Q-switched a 532 nm a frequenza raddoppiata Nd:YAG e durata di impulso nell’ordine del nanosecondo. Di conseguenza, essendo la durata dell’impulso inferiore di un microsecondo rispetto al tempo di rilassamento termico della melanina presente nelle cellule pigmentate, la quantità di energia radiante dispersa sotto forma di calore è minima e quindi il danno ai tessuti circostanti è ridotto. Nello
4
studio da noi svolto, sono stati inseriti 70 pazienti, di cui 30 donne e 40 uomini, di età compresa fra i 44 ed gli 81 anni, affetti da glaucoma cronico ad angolo aperto dell’adulto, con una pressione intraoculare media maggiore o uguale a 21mmHg, in trattamento con terapia medica massima tollerata. Questi sono stati trattati su 180° di trabecolato con il laser Tango della Ellex (Nd:YAG laser a frequenza raddoppiata Q-switched a 532nm). Dopo il trattamento sono stati sottoposti ad un follow up tramite visite di controllo rispettivamente a 1g, 15gg, 1mese, 3 mesi, 1anno. I risultati che sono emersi hanno evidenziato una riduzione della pressione intraoculare, evidente già dopo 24h, che si è stabilizzata intorno al 22% dopo un mese ed è rimasta tale anche dopo 1 anno. Non sono state individuate complicanze significative legate al trattamento ed il 76% dei pazienti non ha dovuto subire nessun altro intervento. In conclusione, questo studio basato su un follow up di 1 anno dimostra che la Laser Trabeculoplastica Selettiva ha una efficacia sovrapponibile a quella dell’Argon Laser Trabeculoplastica e inoltre si associa ad un minore danno strutturale a livello del trabecolato. Questa procedura rappresenta quindi una valida indicazione terapeutica nei pazienti affetti da glaucoma cronico scompensato da numerosi anni ed inoltre risulta un presidio prezioso in quei pazienti in cui sia necessario cercare di ridurre il numero dei farmaci utilizzati per ridurre la IOP.
5
2) IL GLAUCOMA
2.1 DEFINIZIONE E FISIOPATOLOGIA Il glaucoma rappresenta la seconda causa di cecità irreversibile nel mondo, e
risulta quindi una malattia dal grave impatto sociale ed economico. Si stima che circa 67,8 milioni di persone soffrano di glaucoma e che, di queste, circa 6,7 milioni siano cieche da entrambi gli occhi1.
Attualmente viene definito glaucoma una patologia oculare caratterizzata da: Aumento della pressione intraoculare (IOP)
Escavazione della testa del nervo ottico Riduzione progressiva del campo visivo.
Tale definizione, per quanto comprenda le peculiari caratteristiche di questa malattia nonché i principali effetti patologici, appare riduttiva o insoddisfacente, se si considera la presenza per esempio di persone affette da glaucoma a pressione normale, oppure di persone con alto tono endoculare, le quali non svilupperanno necessariamente riduzione del campo visivo per un danno alla retina e al nervo ottico.
6
EPIDEMIOLOGIA
Il glaucoma primario ha una prevalenza del 2% nella popolazione ultraquarantenne ed un’incidenza dello 0,025% annua.Colpisce maggiormente individui al di sopra dei 40 anni, maschi, e di razza nera. Sebbene il più importante fattore di rischio nello sviluppo del danno glaucomatoso sia rappresentato dall’aumento pressorio intraoculare superiore a 21-22 mmHg, entrano in gioco anche altri fattori come: la struttura del nervo ottico, l’ipertensione arteriosa, episodi ipotensivi, vasospasmo, malattie dei vasi; questi fattori hanno quasi tutti una base genetica multifattoriale a penetranza variabile2 e sembrano essere il substrato su cui meglio si esplica la malattia glaucomatosa. I forti miopi sembrano avere un rischio maggiore rispetto ai soggetti non miopi.
BASI ANATOMICHE E FISIOPATOLOGICHE
7
Per capire il meccanismo patogenetico della malattia è necessario riferirsi all’anatomia e alla fisiopatologia. L’umor acqueo è un liquido incolore, contenuto all’interno della parte anteriore dell’occhio, con un pH lievemente più basico di quello ematico; contiene poche proteine, poco glucosio, acido urico, acido ascorbico e acido ialuronico.
Ha tre funzioni principali:
Nutritiva per il bulbo
Statica perché regola la pressione intraoculare Rimozione dei residui metabolici
Un aumento della sua pressione all’interno del bulbo oculare è come detto alla base del glaucoma. Questo aumento pressorio è dovuto ad un eccessivo accumulo di umor acqueo il cui scarico, attraverso la rete trabecolare situata nell’angolo irido-corneale, è ostacolato. Per mantenere la forma del bulbo oculare è necessaria una certa pressione ma, se essa supera determinati valori, può causare lesioni, come meglio descritto nella sezione relativa ai meccanismi di danno.
8
PRODUZIONE DELL’UMOR ACQUEO
La zona di produzione dell’umor acqueo è costituita dai processi ciliari. Sono circa 70, costituiti da creste lamellari inserite nella faccia interna del corpo ciliare. Nella struttura dei processi ciliari si distingue l'epitelio e lo stroma. L’epitelio ciliare è suddiviso in due strati monocellulari (interno ed esterno) affrontati reciprocamente per la parte apicale. Si comporta come un'unità funzionale e viene chiamato sincizio epiteliale ciliare. Lo strato interno o epitelio non pigmentato è contiguo alla camera posteriore, dalla quale lo divide una membrana basale (membrana limitante interna) ed è costituito da cellule chiare. Tali cellule presentano un nucleo ovale, numerosi mitocondri, apparati di Golgi, lisosomi. In particolare sono dotate di una propria membrana di rivestimento provvista di giunzioni con le cellule contigue e, soprattutto, di numerose invaginazioni, profonde ed irregolari (betacitomembrane) che provocano un aumento della sua superficie. Lo strato esterno o epitelio pigmentato è contiguo allo stroma ciliare, ed è costituito da cellule pigmentate, di aspetto pavimentoso. Il pigmento, in granuli, è presente soprattutto nella parte esterna del protoplasma. Lo stroma ciliare è composto da tessuto connettivo contenente fibre collagene, fibre elastiche, elementi cellulari (melanociti e fibrociti) e da una rete vascolare assai sviluppata, soprattutto in
9
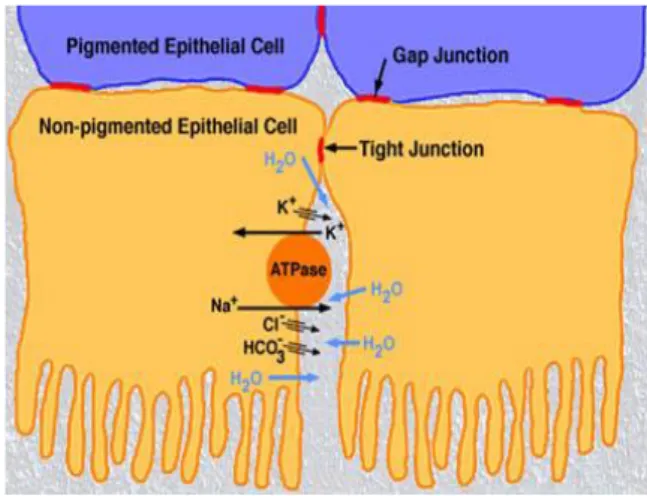
prossimità dello strato epiteliale dove dà luogo ad una fittissima trama di capillari di considerevole superficie. Questi vasi tuttavia non entrano in contatto diretto con l'epitelio ciliare: tra le due formazioni cellulari si interpone infatti una tenue struttura connettivale provvista di fibre nervose con funzione vasomotoria e secretoria. L'umore acqueo viene prodotto alla velocità di 2,2 +/- 0,36 mm3/min. In totale la quantità è circa 100-450 ml. Il turn-over è di circa 100 minuti. Come è noto, il movimento di fluidi attraverso le membrane biologiche avviene per meccanismi fisici (trasporto passivo), per meccanismi biochimici (trasporto attivo) o per meccanismi combinati. I meccanismi passivi non incidono per più del 25% della produzione dell'umore acqueo. Sono rappresentati dalla diffusione, la dialisi e l'ultrafiltrazione. Le ultime due rendono conto della differenza proteica tra plasma e acqueo. I meccanismi attivi spiegano la maggiore concentrazione nell'acqueo di sostanze come sodio, cloro, acido ascorbico, acido lattico e la differenza di potenziale esistente tra stroma ed epitelio. La secrezione dell'acqueo dipende da un trasporto unidirezionale di soluti3, che sono seguiti passivamente dall'acqua per un gradiente di concentrazione osmotica. La secrezione unidirezionale dell'acqueo in camera posteriore (in direzione stroma-PE-NPE-camera posteriore) avviene per via transcellulare e paracellulare. Esiste un riassorbimento parziale dell'acqueo che dalla camera posteriore ritorna alle cellule del NPE.
10
L'anidrasi carbonica catabolizza la reazione tra anidride carbonica ed acqua, portando alla formazione di bicarbonato e ione idrogeno. Lo ione idrogeno viene scambiato con il sodio il quale però viene immediatamente espulso ad opera della sodio/potassio fosfatasi. L'alta concentrazione di sodio e di bicarbonato (quest'ultimo espulso mediante scambiatori con il cloro e canali per la diffusione facilitata per il bicarbonato) negli spazi intercellulari provoca lo spostamento di acqua per gradienti di concentrazione osmotica.
11
ANATOMIA DELLA ZONA DI DEFLUSSO DELL'UMORE ACQUEO
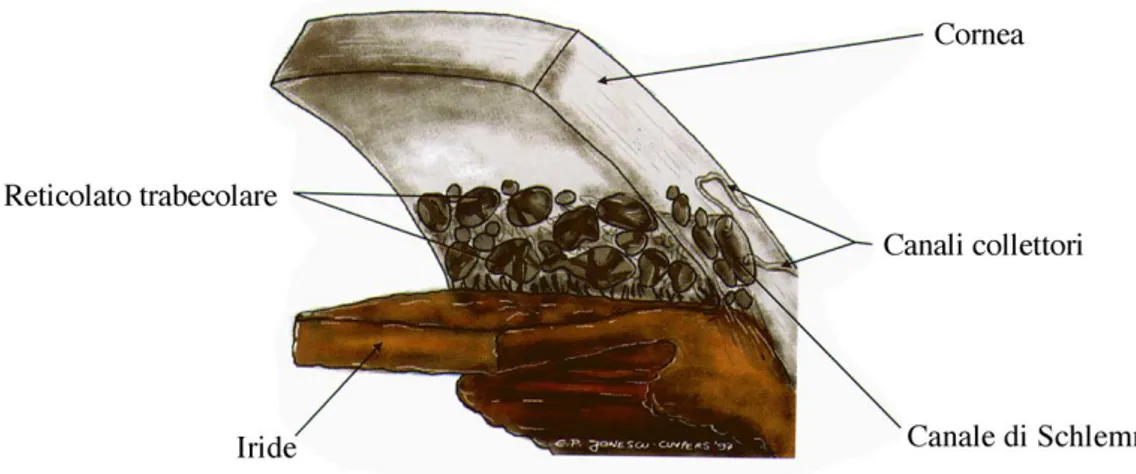
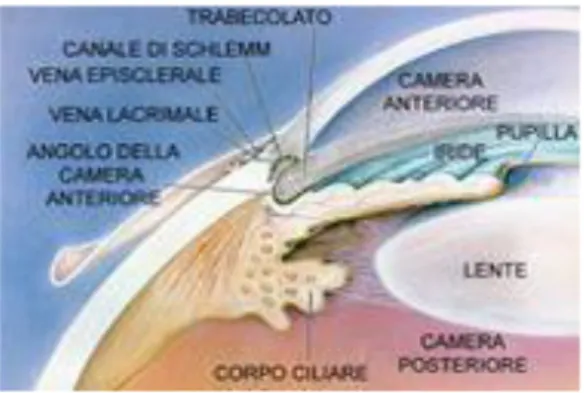
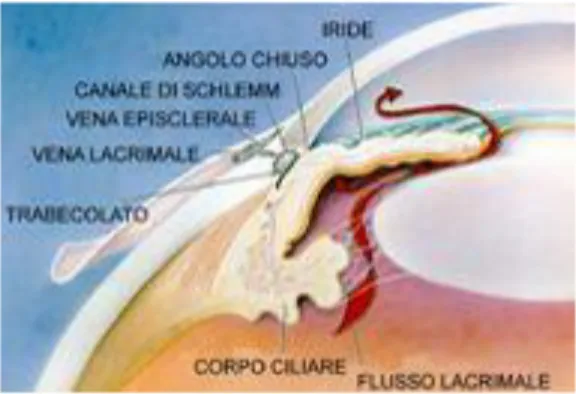
L’angolo camerulare corrisponde al recesso periferico della camera anteriore. La parete anteriore è costituita dalla periferia della Descemet, contrassegnata da un rilievo anulare grigio biancastro (linea di Schwalbe) fatto di fibre collagene ed elastiche, e dal trabecolato attraverso il quale si vedono il canale di Schlemm e lo sperone sclerale.
Fig. 3: Angolo camerulare
La parete posteriore è costituita essenzialmente dalla radice dell'iride.
Il trabecolato è composto da lamelle connettivali. Se ne riconoscono tre porzioni: una più interna, a contatto con l'umore acqueo (trabecolato uveale),
12
una intermedia (trabecolato sclero-corneale), ed una più esterna (trabecolato cribriforme) a diretto contatto della parete profonda del canale dello Schlemm. Le lamelle trabecolari sono separate l'una dall'altra da spazi vuoti (spazi intertrabecolari) ed hanno uno spessore di 5 micron negli strati più vicini alla camera anteriore e diventano più sottili man mano che ci si avvicina al canale dello Schlemm. Il canale dello Schlemm è una formazione fatta a tubo disposta attorno al limbus, a sezione ellittica. Presenta due pareti, una esterna (sclerale) ed una interna (trabecolare): la prima è costituita da uno strato di cellule endoteliali, la seconda da due strati distinti di cellule endoteliali, uno a contatto del trabecolato cribriforme, l'altro a contatto del canale stesso. I collettori post-canalicolari rappresentano la via di immissione dell'acqueo nel sangue e consistono in una serie di 30-40 canalicoli i quali dalla parete superficiale del canale dello Schlemm si portano al plesso venoso episclerale.
13
DEFLUSSO DELL'UMOR ACQUEO
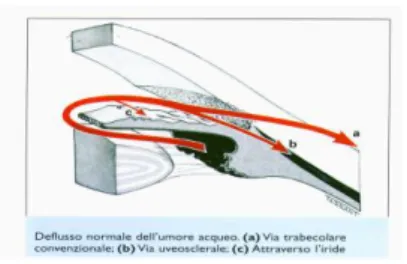
L'umore acqueo, secreto direttamente in camera posteriore dai processi ciliari, attraverso lo spazio irido-lenticolare passa in camera anteriore. Qui, oltre ad un rimescolio legato alle contrazioni dei muscoli ciliari ed iridei, l'acqueo presenta regolari movimenti da parete a parete della cavità camerulare e moti circolatori di convenzione termica, ascendenti davanti all'iride e discendenti verso la cornea, originati dalla differenza di temperatura delle due strutture. L'attraversamento del trabecolato uveale avviene molto agevolmente grazie all'ampiezza dei pori a questo livello. L'acqueo può seguire due vie di deflusso. Deflusso trabecolare (deflusso pressione-dipendente): costituisce la via principale del deflusso (85%). All'altezza del trabecolato corneo-sclerale il passaggio del liquido è meno agevole per il progressivo restringimento dei pori. A questo livello possono inoltre depositarsi detriti veicolati dallo stesso liquido. Il trabecolato cribriforme è ancora meno permeabile: l'acqueo infatti lo attraversa solo dopo aver imbibito lo strato endoteliale e le lamelle circostanti. La sua progressione può essere accelerata dalla contrazione delle fibre longitudinali del muscolo di Brucke che determina l'arretramento dello sperone sclerale e l'apertura a ventaglio delle fibre trabecolari. Superato il trabecolato cribriforme, l'acqueo deve sormontare un ulteriore ostacolo: la parete interna
14
del canale dello Schlemm che potrebbe essere, insieme al trabecolato cribriforme, la sede principale della fisiologica resistenza al deflusso. A questo
punto viene drenato dalle vene episclerali nel circolo sistemico. Questa via è dipendente dalla pressione e dal volume, cosicchè all’aumentare
della pressione aumenta la fuoriuscita.
Deflusso uveosclerale (deflusso pressione-indipendente)4: attraversato il trabecolato uveale l'acqueo abbandona la via classica per deviare lateralmente, lungo le lamelle trabecolari, fino a giungere al tessuto uveale che riveste la faccia esterna del muscolo ciliare. In altre parole, l’acqueo passa attraverso il corpo ciliare verso lo spazio sovracoroideale e viene drenato dalla circolazione venosa del corpo ciliare, della coroide e della sclera. Costituisce il 15% del deflusso dell'acqueo in condizioni normali, ma potrebbe acquistare notevole importanza nelle situazioni di alterato deflusso trabecolare. Questo sistema di deflusso si mantiene costante per IOP > 4 mmHg.
Deflusso irideo: poco rilevante, si verificherebbe per assorbimento diretto da parte dell'iride.
15 2.2 CLASSIFICAZIONE DEL GLAUCOMA
La particolare anatomia della struttura deputata al deflusso e le sue alterazioni ci permettono di classificare diversi tipi di glaucoma.
A seconda della presenza o dell’assenza di fattori associati (particolari patologie oculari o sistemiche) che hanno contribuito al rialzo pressorio, classifichiamo il glaucoma in:
Primario Secondario
A seconda dell’epoca di insorgenza: che sia presente fin dalla nascita o che sia insorto in un periodo successivo, classifichiamo il glaucoma in:
Congenito Acquisito
A seconda del meccanismo con cui il deflusso di acqueo viene ostacolato, classifichiamo il glaucoma in:
Ad angolo aperto Ad angolo chiuso
Nei glaucomi primari, l’aumento di IOP non è associato a altri disturbi oculari, mentre nel glaucoma secondario un fattore riconoscibile oculare o non oculare altera il deflusso di acqueo, che, a sua volta, determina un innalzamento della IOP. I glaucomi secondari possono essere congeniti o acquisiti e ad angolo chiuso o aperto.
16
GLAUCOMA AD ANGOLO APERTO
Fig. 6: Glaucoma ad angolo aperto
Rappresenta la forma più frequente di glaucoma, generalmente bilaterale, non sempre simmetrico, e caratterizzato da:
Esordio in età adulta.
IOP > 21 mmHg, riscontrata almeno una volta nel corso della vita. Angolo camerulare aperto e di aspetto normale.
Danno glaucomatoso al nervo ottico5. Perdita di porzioni del campo visivo.
Questo tipo di glaucoma è dovuto ad un aumento della resistenza al deflusso dell’umor acqueo a livello del trabecolato e, a seconda di dove si instaura il blocco, parliamo di:
1. Glaucoma pre-trabecolare, nel quale la fuoriuscita di acqueo è ostacolata da una membrana che riveste il trabecolato, formata da:
17 neovascolare).
Cellule endoteliali (ad es., sindrome endoteliale iridocorneale).
Cellule epiteliali (ad es., crescita epiteliale verso l’interno).
2. Glaucoma trabecolare, nel quale l’ostruzione avviene per mezzo di “ingombro” del trabecolato da parte di particelle di pigmento, globuli rossi, macrofagi, proteine e materiale pseudoesfoliativo o per restringimento degli spazi intertrabecolari o ancora per collasso del canale per degenerazione delle cellule endoteliali. I glaucomi trabecolari possono essere causati anche da alterazioni delle fibre trabecolari stesse: edema (ad es., irite da herpes zoster), cicatrizzazione (ad es. glaucoma da recessione angolare post-traumatica).
3. Glaucoma post-trabecolare, nel quale il trabecolato è normale, ma la fuoriuscita di acqueo è ostacolata da una pressione venosa episclerale elevata, dovuta a: fistole carotido-cavernose, sindrome di Sturge-Weber, ostruzione della vena cava superiore, tumore retrobulbare, etc..
18
GLAUCOMA AD ANGOLO CHIUSO
Fig. 7: Glaucoma ad angolo chiuso
E’ una condizione nella quale si verifica un innalzamento della IOP come risultato di un’ostruzione al deflusso dell’umor acqueo per parziale o completa chiusura dell’angolo dovuta all’apposizione tra iride periferica e trabecolato per forze sia anteriori sia posteriori:
1. Forze posteriori spingono l’iride periferica contro il trabecolato (ad es., iride bombè da seclusione pupillare).
2. Forze anteriori dovute a contrazione di membrane infiammatorie o fibrovascolari che traggono l’iride sopra il trabecolato.
La vicinanza dell’iride periferica alla cornea facilita la chiusura angolare e tre sono i fattori anatomici predisponenti a questa condizione:
1. Dimensione del cristallino. IL cristallino è l’unica struttura oculare che continua a crescere nel corso della vita. La crescita assiale (antero-posteriore) fa si che la sua faccia anteriore si avvicini alla cornea, mentre l’accrescimento
19
equatoriale allenta il legamento sospensore, consentendo al diaframma iride-lente di muoversi anteriormente. Entrambi questi fattori causano una progressiva riduzione della profondità della camera anteriore.
2. Diametro corneale piccolo.
3. Lunghezza assiale. La posizione del cristallino e il diametro corneale sono correlati alla lunghezza assiale del bulbo. Un occhio piccolo, che è frequentemente ipermetrope, ha un diametro corneale ridotto e un cristallino anteriorizzato. Per questo motivo, gli occhi con nanoftalmo presentano un elevato rischio di glaucoma ad angolo stretto.
Il meccanismo patogenetico di chiusura dell’angolo non è del tutto noto. Di solito, la pressione nella camera posteriore supera quella nella camera anteriore grazie ad una resistenza fisiologica al deflusso in corrispondenza della pupilla, poiché l’iride appoggia posteriormente sulla capsula anteriore del cristallino. Esistono due teorie patogenetiche:
1. Teoria del muscolo dilatatore: postula che la contrazione del muscolo dilatatore della pupilla eserciti una forza diretta all’indietro, che aumenta il livello di apposizione tra l’iride e il cristallino anteriorizzato, incrementando il grado di blocco pupillare fisiologico. Allo stesso tempo, la dilatazione della pupilla rende la periferia iridea più flaccida. Il blocco pupillare aumenta la pressione nella camera posteriore e gonfia l’iride periferica in avanti (iride
20
bombè). In ultima analisi, l’iride tocca la superficie posteriore della cornea, ostruendo l’angolo e la IOP sale.
2. Teoria del muscolo sfintere: postula che lo sfintere pupillare sia la prima causa nel peggiorare la chiusura angolare. La forza del blocco pupillare è maggiore quando il diametro pupillare è 4 mm circa. Sulla base del meccanismo di chiusura angolare, si riconoscono diverse forme:
1) Con blocco pupillare
Primario: Può essere intermittente, acuto, cronico.
Secondario: Da aumento del volume del cristallino, da sinechie posteriori, da miotici, da pseudofachia con vitreo in camera anteriore.
2) Senza blocco pupillare
Primario: cosiddetta iride a plateau.
Secondario: a sinechie angolari per precedente blocco pupillare, riduzione di profondità della camera anteriore, neovascolarizzazione angolare, infiammazioni.
GLAUCOMA CONGENITO
Nella accezione più stretta del termine, tende ad indicare una patologia caratterizzata da malformazioni congenite a livello dell’angolo irido-corneale. Di fatto tale patologia può essere definita Primaria o Secondaria a malattie quali il retinoblastoma, la fibroplasia retrolentale, la microcornea, il nanoftalmo e la disgenesia angolare (s. di Alexander, S. di Peter).
21 2.3 DIAGNOSI
Il glaucoma ad angolo aperto ha sintomatologia molto scarsa se non assente finchè non si verifica una consistente perdita del campo visivo. Ciò accade poiché il difetto si sviluppa gradualmente e la fissazione è coinvolta solo tardivamente nel corso della malattia. Sebbene il difetto sia quasi sempre bilaterale, la progresione è spesso asimmetrica. Pertanto, i pazienti presentano spesso una rilevante perdita del campo visivo in un occhio ed una meno avanzata nell’altro. Anche i pazienti con una notevole capacità di autoanalisi possono non rendersi conto dell’amputazione di vaste aree del loro campo visivo, sebbene alcuni difetti precoci possano essere casualmente scoperti. Per lungo periodo l’unico segno è la riduzione del campo visivo, con inizio nel settore nasale inferiore che successivamente in modo progressivo si estende al settore nasale superiore, temporale inferiore, temporale superiore, fino a portare alla classica “visione tubulare”. Il danno poi prosegue inesorabilmente fino ad interessare anche la visione centrale. Si può solo interrompere il decorso della malattia, ma non portare a “restitutio ad integrum” quando la malattia ha già esplicato un danno. Pertanto solo controlli periodici e procedure di screening possono interrompere il deterioramento visivo in una fase iniziale, quando il visus non è ancora definitivamente compromesso.
22
Per quanto riguarda il glaucoma ad angolo chiuso, questo può essere suddiviso in cinque stadi, ognuno dei quali con una propria sintomatologia. Ciò nonostante la condizione non necessariamente progredisce da uno stadio all’altro in ordine sequenziale. In pratica si osserva spesso una combinazione di questi stadi clinici: latente, subacuto (intermittente), congestizio acuto, postcongestizio, cronico e assoluto. La fase latente ha una diagnosi retrospettiva, posta con un certo grado di certezza solo quando l’occhio controlaterale ha già subito un attacco di glaucoma congestizio acuto. Può quindi essere solo sospettata prospetticamente. In poche parole, il termine “chiusura angolare latente” implica un occhio anatomicamente predisposto e con una sintomatologia assente. La fase intermittente è caratterizzata da attacchi ricorrenti e improvvisi di glaucoma, con rapido aumento di IOP e blocco pupillare che si risolvono spontaneamente dopo 1-2 ore. L’attacco acuto di glaucoma ha una sintomatologia caratteristica, caratterizzata da dolore, cefalea frontale, fotofobia e visione offuscata associata ad aloni colorati intorno alle luci. La fase congestizia acuta è un’emergenza oculistica, che causa una drammatica perdita della visione dovuta a improvvisa e totale chiusura dell’angolo, associata a dolore perioculare e congestione oculare. Alla fine della fase conclamata compaiono deficit irreversibili del campo visivo come allargamento della macchia cieca e scotomi arciformi (fase postcongestizia). La fase cronica, alla gonioscopia, mostra un grado variabile di chiusura angolare, sebbene le sinechie permanenti periferiche anteriori si sviluppino solo tardivamente. La diagnosi sarà errata se la gonioscopia non viene eseguita in tutti gli occhi glaucomatosi.
Infine la fase assoluta è la fase finale del glaucoma ad angolo chiuso congestizio acuto, in cui l’occhio è completamente cieco.
23
tonometro: esistono vari modelli. Il più famoso è sicuramente il tonometro di Goldmann. Altri strumenti per rilevare la IOP sono la Tono-pen, il tonometro a soffio, il tonometro di Pascal. Esistono anche altri sistemi come il pressure phosphene tonometer e alcuni micro-sensori inseribili chirurgicamente attraverso la sclera a diretto contatto con la coroide, capaci di rilevare variazione della IOP.
Fig. 10: Tonometria ad applanazione
Fig. 11: Tonopen
24
La IOP all’interno della popolazione è rappresentabile come una curva gaussiana che ha come picco 15,5 mmHg. Valori più alti di questo si associano ad un aumentato rischio di glaucoma, con rischio <5% tra 21 e 25 mmHg e rischio del 40% tra 25 e 30 mmHg. Se viene utilizzato il tonometro ad applanazione si hanno sottostime in pazienti con età inferiore a 10 anni; si hanno anche sottostime o sovrastime dovute allo spessore corneale, rispettivamente se la cornea è più sottile o più spessa del valore di riferimento normale di 520 micrometri. In caso di medesima IOP reale una differenza di 10 micrometri nello spessore porta a 0,5 mmHg di differenza di rilevamento pressorio. Anche variazioni nella lunghezza assiale sembrano variare la determinazione della IOP: un incremento di 1 mm di lunghezza porta a parità di IOP reale ad un rilievo pressorio incrementato di 0,29 mmHg. Un intervento come la LASIK può però inficiare queste considerazioni nella misura in cui può causare la presenza di un film acquoso tra i lembi corneali.
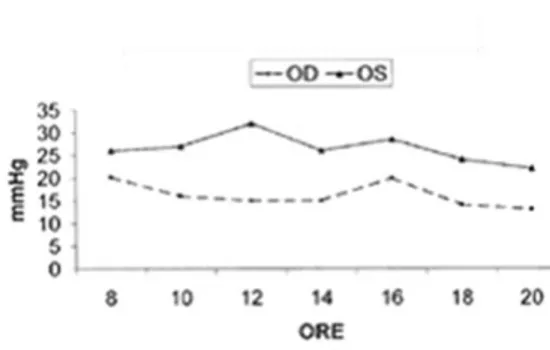
La IOP varia in relazione alle fasi del giorno, in maniera circadiana, con picco pomeridiano: ciò è più accentuato in alcuni pazienti che in altri, portando ad un problema talvolta misconosciuto, la cui diagnosi deve avvalersi delle curve tonometriche.
25
Anche le alterazioni papillari rappresentano un segno inequivocabile dell’avanzare della malattia. La diagnosi in questo caso può essere effettuata con vari strumenti: col più semplice oftalmoscopio, con la tecnica high-resolution photography o con lampada a fessura con lente a 90D, con lente di Goldmann, metodi soggettivi e non riproducibili. Metodi sicuramente più accurati sono l’HRT (Heidelberg retina tomograph o Confocal scanning laser Tomograph) tipo 1 e tipo 2, l’OCT (Optical Coherence Tomography), la polarimetria laser, il Rodenstock optic nerve head analiser.
L’OCT permette di misurare in vivo lo spessore delle fibre nervose. L’HRT permette una valutazione quantitativa della topografia retinica ed un preciso follow-up di eventuali modificazioni topografiche; si rivela analisi di alta specificità, ovvero se il test è negativo si ha bassissima possibilità che il paziente sia glaucomatoso.
All’esame oftalmoscopico il tipico segno del glaucoma ad angolo aperto ad alta pressione è l’escavazione della papilla ottica. In condizioni normali esiste una escavazione fisiologica. Tale escavazione viene definita tale se il rapporto escavazione papilla non eccede 0,3, anche se è possibile in condizioni di normalità, avere un rapporto anche di 0,7. L’escavazione viene valutata notando l’incurvamento dei piccoli vasi retinici nel momento in cui passano al di sopra della papilla.
26
Fig. 14: Differenze tra papilla normale ed escavata
Altri segni sono i nerve head pits, l’atrofia peripapillare e l’uscita principale dei vasi retinici che sembra influire sull’atrofia parapapillare: più distante è l’uscita dei vasi e più larga è l’atrofia parapapillare e più sottile è il margine neuro-retinico. Anche il restringimento arteriolare focale peripapillare correla con la perdita del campo visivo.
La perimetria dà indicazioni sul campo visivo del paziente ed è pertanto un buon indice di danno della malattia glaucomatosa, la cui sensibilità però diminuisce in caso di miopia. Il fumo può ridurre la sensibilità di alcuni indici perimetrici. La progressione dei difetti del campo visivo rimane un buon indice per diagnosticare il glaucoma, e tale progressione talvolta non si arresta nonostante si raggiunga un buon controllo pressorio mediante terapia medica. Tipici segni della riduzione del campo visivo sono gli scotomi: quelli precoci sono l’allargamento della macchia cieca, lo scotoma di Bjerrum, lo scotoma di Seidel, gli scotomi paracentrali isolati, quello tardivo è il restringimento concentrico progressivo delle isoptere.
27
Fig. 15: Perimetro di Humphrey
Come già accennato in precedenza, esistono altri metodi per la determinazione dei danni al nervo Ottico, non usati comunemente per la semplice diagnosi ma per approfondimento diagnostico: uno è la Scanning laser polarimeter6, tecnica che utilizza le proprietà birifrangenti dello strato nervoso ed il principio della polarizzazione. Ha i vantaggi di non dover richiedere dilatazione pupillare e di essere indipendente dagli errori di rifrazione. L’HRT è un microscopio a scansione laser confocale utilizzato per l’acquisizione e l’analisi di immagini tridimensionali del segmento posteriore. Consente una valutazione quantitativa della topografia retinica ed un preciso follow-up di eventuali modificazioni topografiche. Una delle tante applicazioni cliniche di routine dell’HRT, ma forse la più importante, è l’analisi topografica della testa del nervo ottico in pazienti affetti da glaucoma. Il software dell’apparecchiatura consente di paragonare differenti immagini dello stesso paziente acquisite in tempi diversi e di ottenere una mappa dei cambiamenti topografici che sono avvenuti nell’intervallo di tempo tra i test diagnostici. Ciò permette di valutare più accuratamente la progressione del glaucoma.
28
Fig. 16: Apparecchiatura per HRT
Fig. 17: Immagini da HRT
La Tomografia a Coerenza Ottica (OCT) è una moderna metodica che permette di misurare lo spessore delle fibre nervose. L’esame, non invasivo, sfrutta la capacità di un raggio di luce laser di essere riflesso in maniera diversa a seconda della quantità di fibre nervose presenti e consente quindi un dettagliato
29
giudizio clinico sullo strato anatomico maggiormente affetto nel glaucoma. L’ERG, l’elettroretinogramma7
è la risposta bioelettrica retinica ad uno stimolo visivo sia esso costituito da un flash di luce stroboscopica o da un monitor televisivo in cui sono presenti barre o scacchi bianchi e neri che si alternano in modo cadenzato nel tempo (pattern). L'ERG da flash è espressione della funzionalità degli strati retinici più esterni (epitelio pigmentato e fotorecettori), mentre l'ERG da pattern (PERG) è generato degli strati retinici più interni (cellule e fibre ganglionari). I potenziali Evocati Visivi (PEV) si definiscono invece come le variazioni dei potenziali bioelettrici della corteccia occipitale evocati da stimoli visivi.
Fig. 18: Apparecchiatura per esecuzione di ERG e PEV
Alterazioni particolari dei tracciati (aumento del tempo di latenza e la riduzione di ampiezza delle varie onde del PEV ) sono suggestive di glaucoma che non si è ancora esplicato clinicamente.
L’Ocular Blood System OBF8
30
flusso ematico oculare. Questa apparecchiatura è stata impiegata per lo studio di numerose patologie oculari: retinopatia diabetica, retinite pigmentosa, malattie oculari dovute a stenosi carotidee, le arteriti temporali (A. di Horton). Ma è nella malattia glaucomatosa, soprattutto quelle forme con probabile genesi vascolare come il glaucoma a pressione normale, che l’OBF ha trovato il maggior impiego sia per la diagnosi che per la verifica degli effetti della terapia, farmacologica o chirurgica, e sulla progressione della malattia. Uno dei più recenti strumenti diagnostici è il perimetro a duplicazione di frequenza, test utilizzato per determinare anormalità nello strato delle cellule ganglionari magnocellulari, utile soprattutto nelle forme iniziali della malattia. Sembra essere il futuro per quanto riguarda lo screening precoce del glaucoma.
L'ultrabiomicroscopia (UBM)9 è una forma particolare di ecografia ad altissima risoluzione, attualmente limitata alla parte anteriore dell'occhio. E’ in grado di fornire informazioni molto dettagliate delle strutture dell’angolo fondamentali per la diagnosi e differenziazione di numerose forme di glaucoma: glaucoma pigmentario, glaucoma maligno, glaucoma ad angolo stretto o chiuso, iris-plateau, glaucoma da intumescenza del cristallino, etc. Inoltre è di fondamentale importanza per l’evidenziazione e la differenziazione di processi tumorali o cisti dell’iride e dei corpi ciliari.
31 2.4 TERAPIA DEL GLAUCOMA
La terapia ha ovviamente lo scopo di ridurre la IOP, ma si propone anche di garantire neuroprotezione con alcuni preparati come la brimonidina, protettiva nella ischemia retinica. Secondo le recenti linee guida non esiste una pressione target da raggiungere uguale per tutti: è il clinico a scegliere sulla base di vari parametri, primo fra tutti le condizioni del paziente, sia per quanto riguarda l’ambito prettamente oculistico che per quanto riguarda il lato internistico.
CENNI DI TERAPIA MEDICA
Solo un terzo dei pazienti risponde a terapia medica e pochi a dire la verità sono i pazienti che ottengono da questa terapia un blocco completo della progressione della malattia. D’altro canto secondo il principio del “primum non nocere, bene facere”, deve essere la prima arma contro la malattia, soprattutto considerando che la terapia medica è meglio accettata dal paziente, e, se funzionante, non porta alle più gravi complicanze dell’intervento, avendo invece solo le complicanze legate all’uso del farmaco, pertanto scongiurabili dopo l’eliminazione di questo, e solo in rarissimi casi irreversibili ed irrimediabili.
La terapia si basa sulla somministrazione di uno o più farmaci, assunti a seconda del tipo sia per via topica che sistemica, scelti in base ai meccanismi d’azione ed in base alle potenzialità neuroprotettive10
, ed associati anche all’intervento chirurgico se questo si dimostra non del tutto sufficiente allo scopo.
Per controllare la dinamica dell'umore acqueo e la pressione intraoculare dell'occhio glaucomatoso si può agire in vari modi:
32
sulla secrezione dell'acqueo (beta-bloccanti, inibitori dell'anidrasi carbonica, alfa-2-agonisti)
sul deflusso trabecolare (miotici, epinefrina)
Sul deflusso uveo-sclerale (analoghi delle prostaglandine)
sulla pressione episclerale venosa/perfusione del corpo ciliare (alfa-2-agonisti con proprietà alfa-1-agoniste).
TERAPIA CHIRURGICA
I primi interventi per abbassare la IOP si devono a Sir William Mackenzie e Desmarres i quali raccomandarono punture corneali a questo scopo.
La chirurgia del glaucoma nasce con uno dei padri dell’oculistica, Von Graefe, il quale nel 1856 esegue una iridectomia a soggetto affetto da glaucoma, e ciò fu pubblicato due anni dopo, nel 1859.
Da allora l’iridectomia diventò il classico intervento per il glaucoma ad angolo chiuso. In seguito altri interventi furono sviluppati: la trapanazione corneo-sclerale di Helliot (1925), l’iridencleisis di Holth (1932), l’iridosclerotomia di Lagrange (1937), e l’iridectomia filtrante di Scheie (1956). Queste tecniche portavano a buoni risultati ma le complicanze erano molto frequenti: queste erano rappresentate da ipotono, sinechie anteriori e posteriori, distacco di coroide, scompenso endoteliale ed endoftalmite. Solo l’uso del microscopio operatorio ha permesso di diminuire l’incidenza di queste complicazioni, ma non di scongiurarle totalmente, trasformando la chirurgia del glaucoma nella microchirurgia del glaucoma, più nello specifico nella chirurgia dell’angolo
33
camerulare. La vera rivoluzione si ha con Cairns nel 1968 che in questa data descriveva un intervento, la trabeculectomia, aprendo la strada agli interventi di filtrazione protetti da lembo sclerale, che diventerà l’intervento più praticato al mondo da lì a poco, affiancato solo ora da altre metodiche più sofisticate, quali la viscocanalostomia e la sclerectomia profonda.
Trabeculectomia
Trabeculectomia e trabeculotomia sono basate sul principio che la resistenza al deflusso deriva maggiormente dal trabecolato e dalla parte interna del Canale dello Schlemm. Sono interventi che riducono la IOP creando una fistola, per permettere all’umor acqueo di defluire dalla camera anteriore allo spazio sottotenoniano. La fistola è protetta o “riparata” da uno sportello sclerale superficiale. Grant dimostrò in occhi enucleati che il 75% della resistenza al deflusso può essere eliminata tramite trabeculectomia o trabeculotomia. Il successo della trabeculectomia sembra correlato al tipo di glaucoma. Pazienti con glaucoma neovascolare, traumatico, pediatrico od uveitico hanno in genere i peggiori risultati. Solo l’utilizzo di mitomicina C e 5-FU sembra migliorare il risultato. Altre condizioni come chirurgia congiuntivale, trabeculoplastica laser e terapie antiglaucomatose diminuiscono la percentuale di successo. Sembra che queste condizioni abbiano come base anatomopatologica la proliferazione di fibroblasti e di cellule infiammatorie ed il fatto che le terapie antiglaucoma siano associate a cambiamenti istologici nella congiuntiva e nel trabecolato. Questo spiega l’utilità degli antimetaboliti.
34
Fig. 19: Via di deflusso nella trabeculectomia
La micro-trabeculectomia è una nuova tecnica, che si ritiene sicura e riducente effettivamente la IOP. Nella microtrabeculectomia uno sportello sclerale di circa 2 per 2 mm è esposto e viene creato un foro di 0,75 mm tramite il “Kelly descemet membrane punch” o con le “forbici di Vannas” verso la camera anteriore. In seguito viene eseguita una iridectomia periferica. Questa procedura fistolizzante permette un buon controllo pressorio e pare associata a piccolissimi cambiamenti nell’astigmatismo, di poca importanza comunque in questi pazienti. Permette inoltre di evitare insulti alla Capsula di Tenone. Trabeculectomie nasali funzionano meglio di quelle temporali.
La mini trabeculectomia consiste nell’eseguire l’apertura di un lembo congiuntivale base fornice, sclerostomia a 1 mm dal limbus, e tunnel sclero-corneale senza incisioni radiali. Questa tecnica sembra utile nel trattare alte IOP in occhi già operati a rischio di cicatrizzazioni. Nel caso però si utilizzi il lembo base fornice non è possibile utilizzare gli antimetaboliti intraoperatoriamente. Come già detto un sportello sclerale così architettato permette di evitare la camera bassa piatta senza inficiare i risultati
35
dell’intervento. Questa chirurgia sembra associata ad un restringimento del canale dello Schlemm. Questo spiega le difficoltà incontrate dopo un precedente intervento chirurgico di filtrazione. La fibrosi episclerale e della capsula di Tenone sono motivo di fallimento di questo intervento.
Le complicanze della trabeculectomia sono le più disparate11. Per quanto riguarda la bozza queste riguardano schiacciamento e chiusura e sono secondarie ad aderenze e alla già citata formazione di tessuto cicatriziale tra il tessuto episclerale e la capsula di Tenone. Fattori che favoriscono questo sono precedente chirurgia congiuntivale, precedente trattamento con farmaci simpaticomimetici o precedente trattamento Argon Laser. Il fallimento della chirurgia in un occhio suggerisce l’uso, nel controlaterale colpito da glaucoma, di antimetaboliti per evitare queste complicazioni.
Lo stress operatorio è alla base di un’altra complicanza della trabeculectomia, l’ipotonia. L’ipotonia si esplica sia come diminuzione della produzione dell’umor acqueo, sia ovviamente come aumentato deflusso per perdita di liquido dalla bozza o per la ciclodialisi. L’ipotonia può portare ad distacco di coroide o ad ipoema perchè diminuendo la pressione si ha una inversione di flusso ed il sangue va così in camera anteriore. L’ipoema può essere causato da eccessivo stiramento dell’iride. L’ipotonia cronica può causare inoltre diminuzione del visus causata da cataratta, deflusso coroideo, emorragia sovracoroidea e maculopatia. Sembra che sia l’ipotono a predisporre non solo alla cataratta, ma anche alla endoftalmite.
Infezione della bozza ed endoftalmite sono state riportate in una percentuale che va dal 0,06% al 13%. In acuto sembrano legate all’infezione della bozza, la quale può evolvere in endoftalmite, soprattutto se la bozza è inferiore, se il paziente è diabetico, nero, sotto uso di antimetaboliti. Solo una tempestiva terapia medica può scongiurare l’evoluzione. Altro rischio è l’atalamia e
36
l’impegno vitreale, che insieme a tutti gli altri fattori pregiudica la buona riuscita dell’intervento. Già citata, come motivo di insuccesso, la rapida cicatrizzazione della bozza, la quale è più frequente in giovane età, insieme ad una capsula di Tenone più spessa.
Viscocanalostomia
La viscocanalostomia12 è un intervento chirurgico che consiste nell’esecuzione di un lembo sclerale superficiale, seguita dalla resezione di un lembo profondo e successiva messa a nudo del canale dello Schlemm. Una cannula sottile è utilizzata per iniettare sodio ialuronato (Healon GV®) ad alta viscosità all’interno del canale. Il lembo viene richiuso e viene iniettato ancora viscoelastico (Healon GV®) sotto il lembo per prevenire la chiusura del lago sclerale e per evitare la migrazione del fibrinogeno. La viscocanalostomia sembrerebbe avere meno successo della trabeculectomia per quanto riguarda l’abbassamento della IOP raggiunto, ma permette di eliminare completamente la terapia farmacologica, passando da tre a zero farmaci postoperatoriamente.
Sclerectomia profonda
La sclerectomia profonda con o senza impianti13,14 è un intervento chirurgico non perforante, di recente utilizzato per il trattamento del glaucoma ad angolo aperto. L’intervento può essere definito come una procedura che consiste nell’apertura di un lembo congiuntivale, formazione di un lembo sclerale e scolpitura di un tassello sclerale, con formazione di una cavità intrasclerale. Viene rimossa la parte esterna del canale dello Schlemm e viene messa a nudo la membrana di Descemet integra, attraverso la quale l’umor acqueo defluisce
37
nella cavità sclerale creata artificialmente, il cosiddetto lago sclerale che ha il fine di essere una camera di decompressione. Alcuni autori come Kozobolis preferiscono aggiungere, dopo l’apertura del flap congiuntivale, mitomicina C o 5-fluorouracile sulla sclera e sotto la congiuntiva prima della creazione del lembo sclerale, nel tentativo di ritardare o evitare la cicatrizzazione sottocongiuntivale. Altri effettuano trattamenti con l’antimetabolita post-operatoriamente, se necessario, con iniezioni sottocongiuntivali. Infine è in corso l’utilizzo di triamcinolone nella bozza, di cui si aspettano i primi risultati clinici. Il significato di mantenere la membrana trabeculo-descemetica integra sta nel fatto che questa costituisce una sorta di freno al deflusso di umor acqueo, cosa che non avviene nella trabeculectomia, anche se talvolta la membrana trabeculo-descemetica può presentare una aumentata resistenza al deflusso dell’umor acqueo, ab inizio oppure in seguito a fibrosi della membrana stessa dopo diversi mesi dopo l’intervento.
L’intervento di sclerectomia è sconsigliato nelle forme di glaucoma neovascolare e nelle forme di glaucoma ad angolo chiuso, dove mancano i presupposti anatomo-fisiologici, in quanto l’apposizione dell’iride alla cornea rende nulla la possibilità di percolazione tramite la membrana trabeculo-descemetica. Per prevenire la chiusura del lago vengono usati vari materiali, quali il collageno, l’acido ialuronico reticolato SK-GEL®, il T-FLUX® poly Megma polymer implant, la steinless steel T-BAR®, l’Hemacrylic mehta stealth implant® ed anche l’1.0 Chromic Catgut®.
Studi confermano che l’impianto permette di mantenere la riduzione della IOP più a lungo. A livello di imaging (UBM) si nota che in laghi sclerali senza impianto la proliferazione fibroblastica procede velocemente, portando in breve tempo a completa cicatrizzazione.
38
originarie, a prescindere dal fatto che l’impianto sia riassorbibile o meno, almeno per quanto riguarda l’SK-GEL®.
Fig. 20: Procedure nella sclerectomia profonda
E’ possibile convertire l’intervento di sclerectomia profonda in trabeculectomia se l’intervento ha come complicanza la penetrazione in camera anteriore: i risultati sono simili a quelli di una trabeculectomia, ma non le complicanze, più numerose nella conversione dell’ intervento che nella trabeculectomia ab inizio. La sclerectomia profonda si presta bene anche in associazione a facoemulsificazione.
39
La sclerectomia profonda è una procedura con una bassa incidenza di complicanze15, soprattutto rispetto alla trabeculectomia, e permette un buon controllo della IOP16. Sembra inoltre meno afflitta da cambiamenti della rifrazione rispetto alla metodica perforante già citata, soprattutto per quanto riguarda l’astigmatismo17
. Sembra però che, se preceduta da ALT, la sclerectomia sia destinata ad un minor successo. Lo stesso vale se la sclerectomia è preceduta da un uso cronico di agenti topici, che sembrano, come la ALT, attivare la popolazione fibroblastica sottocongiuntivale, compromettendo il risultato chirurgico. A ciò si aggiungano le difficoltà tecniche della sclerectomia e il costo dell’impianto, che ne hanno rallentato la diffusione. Dibattuto invece il risultato della sclerectomia profonda rispetto alla trabeculectomia in termini di abbassamento di IOP. La trabeculectomia sembra, secondo i più, funzionare molto bene in questi termini, talvolta anche troppo, come discusso a proposito delle complicanze; anche se per essere precisi gli impianti di nuova generazione nella sclerectomia profonda permettono di ottenere risultati che si avvicinano a quelli della trabeculectomia. Dovendo fare una stima di tutte le caratteristiche, dobbiamo considerare quale fardello di complicanze si trascini la trabeculectomia, e questo quindi fa sempre più orientare il chirurgo verso interventi molto meno cruenti, ma al tempo stesso efficaci, come la sclerectomia profonda con impianti.
Gli unici accorgimenti da ricordare in questa sede sono il fatto che gli interventi non perforanti non vanno mai eseguiti in angoli stretti o chiusi e mai in angoli bassi: si ha infatti un effetto di “aspirazione” dell’iride verso il sistema di deflusso, e conseguente chiusura dell’angolo.
Discutendo l’intervento in generale, considerando anche studi di altri autori, varie sono le caratteristiche. Dopo l’intervento si può riscontrare la presenza di infiammazione congiuntivale post operatoria ed edema corneale postoperatorio,
40
dovuto ad un insulto al bulbo oculare, che, per quanto minore rispetto alla trabeculectomia, ha comunque una certa rilevanza.
La prima cosa che si rileva alle manovre strumentali è una riduzione della IOP significativa, a prescindere dal tipo di impianto utilizzato, almeno per quanto riguarda il primo periodo post-intervento. Questo è il segno di successo terapeutico, almeno a breve termine. Talvolta il fine dell’intervento, ovvero la riduzione della IOP, non viene raggiunto, e la IOP rimane a valori identici a quelli pre-intervento. Questo è da attribuire ad una non completa dissezione sclerale, e da una membrana trabeculo-descemetica di elevato spessore non filtrante. Alla lampada a fessura si evidenzia una bozza congiuntivale: è uno spazio che ha il significato di facilitare il deflusso dell’acqueo con vari meccanismi. Una “buona bozza” è una bozza diffusa perchè filtrante.
Fig. 21: Bozza congiuntivale
Alla gonioscopia si può prendere visione di una linea trabecolare depigmentata e si nota il trabeculum più trasparente rispetto all’area non operata. L’aspetto è quello di un angolo più o meno aperto e profondo in relazione alla funzionalità dell’intervento. Gli impianti non devono dare nessuna reazione da corpo estraneo. Talvolta si pone indicazione alla terapia medica per non completo
41
successo, con utilizzo in genere di un numero di farmaci inferiore al periodo preoperatorio.
Altra caratteristica degli interventi non perforanti è l’utilizzo delle goniopunture Yag laser in caso di ipertensione endoculare “tarda”18
, causata dalla membrana trabeculo-descemetica. Quest’ultima può presentare una aumentata resistenza al deflusso dell’umor acqueo, ab inizio oppure in seguito a fibrosi della membrana stessa. Il buon risultato dell’intervento comunque viene dato da un esame del campo visivo a distanza di tempo dall’intervento. Questo deve dimostrare una stabilità del quadro rispetto agli esami precedenti, vista l’irreversibilità del danno, associata all’abbassamento della IOP. Il solo calo della IOP non può essere considerato affidabile, poiché il danno può continuare anche a pressioni più basse.
42
3)
IL
TRATTAMENTO
LASER
NELLA
PATOLOGIA
GLAUCOMATOSA
Il laser è stato impiegato nel trattamento del glaucoma per più di 20 anni tramite una ampia gamma di procedure che includono iridotomia, gonioplastica, goniotomia, sclerotomia, ablazione trabecolare e trabeculoplastica. Worthen e Wickham, nel loro primo lavoro19, stabilirono che un’onda continua di argon laser poteva essere utilizzata con sicurezza per fotocoagulare il tessuto trabecolare in modo da ottenere un significativo abbassamento della pressione intraoculare per un consistente numero di mesi. Diversi anni più tardi, Wise e Bitter
20
, utilizzando un’energia laser molto inferiore nella procedura nota come argon laser trabeculoplastica o ALT, ottennero una riduzione sensibile della pressione intraoculare in un campione di pazienti nei quali la terapia medica aveva fallito.
La ALT venne utilizzata inizialmente come una alternativa al trattamento standard e, in alcuni casi, fu aggiunta alla terapia medica per ridurre la pressione intraoculare in pazienti che non avevano ottenuto benefici dalla stessa, in modo da rimandare o evitare completamente l’uso della chirurgia. Con il passare del tempo, man mano che gli effetti positivi nella riduzione della
43
IOP e la sicurezza nell’uso dell’ALT venivano confermati, l’applicazione di tale procedura come punto di partenza per il trattamento del glaucoma primario angolo aperto risultò vincente.
Nella Sperimentazione del “Glaucoma Laser”21, l’iniziale trattamento con argon laser trabeculoplastica ha messo in evidenza, in pazienti con due anni di follow up, un effetto di riduzione della pressione intraoculare superiore a quello ottenuto con la somministrazione di medicinali (timololo maleato 0,5). Comunque, sempre in un arco di tempo di due anni, per un numero inferiore di occhi trattati si è resa necessaria la somministrazione simultanea di due o più medicazioni del glaucoma per tenere sotto controllo la pressione intraoculare. Mentre non sono state riscontrate differenze importanti fra il trattamento medico e la ALT in termini di acuità visiva o di campo visivo nell’arco dei primi due anni di osservazione, in un periodo di monitoraggio di tre anni e mezzo la soglia media del campo visivo, in ogni zona sottoposta a test, risultava più alta per occhi inizialmente trattati con ALT rispetto a quelli sottoposti a cure mediche. I risultati, valutati a distanza di 5 anni, si sono mostrati coerenti con la precedente scoperta per quel che concerne il livello di pressione intraoculare, i risultati del campo visivo, lo stato della papilla ottica, l’acuità visiva e il ricorso a medicazioni; questi valori infatti continuavano ad essere migliori nei casi di occhi precedentemente trattati con laser. Mentre
44
nessuna delle differenze fra i gruppi di trattamento risultava notevole, tuttavia queste suggerivano che il trattamento iniziale con ALT in pazienti con glaucoma primario ad angolo aperto era se non altro efficiente tanto quanto il Timololo22.
Sebbene l’ALT abbia dimostrato di essere una valida alternativa ad un iniziale trattamento con medicamenti, la sua applicazione è stata limitata da diversi fattori, in particolare il danno coagulativo alla struttura reticolare trabecolare indotto dalla procedura. E’ stabilito che la laser trabeculoplastica riduce la pressione intraoculare incrementando il deflusso acquoso, eppure il meccanismo di questo incremento di deflusso non è stato ancora completamente chiarito e spiegato. Sono state avanzate alcune ipotesi generali per spiegare questo aumento di deflusso successivo alla laser trabeculoplastica. Uno dei meccanismi suggeriti è che l’ALT induce un reazione biologica nella struttura reticolare trabecolare che chiama in causa l’aumentata moltiplicazione cellulare e la migrazione di cellule trabecolari nei punti della bruciatura, la fagocitosi dei residui, la produzione di mucopolisaccaride = glicosaminoglicani (GAGs), e l’attivazione di metalloproteasi coinvolte nel mantenimento della matrice extracellulare. Questa teoria è stata supportata da Alvarado e Murphy
23
, i quali hanno esaminato l’ostruzione del deflusso nel glaucoma pigmentario e nel glaucoma
45
primario ad angolo aperto e hanno dimostrato che i macrofagi sono il principale tipo di cellule responsabile dell’eliminazione dalla struttura reticolare trabecolare di pigmento e detriti.
Benchè il ruolo della risposta biologica dell’ALT continui a essere oggetto di investigazione, gli effetti meccanici e termici sul tessuto reticolare trabecolare dovuti a questa tecnica sono stati ben documentati. Studi del tessuto reticolare trabecolare effettuati tramite il microscopio a scansione elettronica e studi istopatologici
24
, suggeriscono che l’energia laser potrebbe indurre un inarcamento del tessuto stesso, necessario appunto per l’apertura del canale di Schlemm. Tuttavia altri ricercatori, durante analisi istologiche condotte su occhi provenienti da cadaveri trattati con il laser, non hanno confermato questo dato. Inoltre, mentre alcuni degli effetti osservati istologicamente potrebbero incrementare il deflusso dell’umore acqueo, altri potrebbero essere responsabili di quei casi di mancato successo riscontrati in alcune procedure di ALT.
In uno studio effettuato sulle scimmie di Cynomolgus dopo la procedura ALT
25
sono state osservate aree di necrosi coagulativa causata dal danno termico sul tessuto trattato e disgregazione dei fasci trabecolari (con cellule frammentate e tessuto fibrocellulare nella regione giuscanalicolare del tessuto reticolare trabecolare). Negli occhi umani trattati con ALT, l’esame istopatologico dei campioni ottenuti con la trabeculectomia ha rivelato
46
modificazioni precoci simili a quelle osservate nelle scimmie, con la distruzione dei fasci trabecolari e l’accumulo di detriti fibrinosi e cellulari. Nei campioni di tessuto ottenuti da 6 a 12 mesi dopo l’ALT, sono state osservate aree confluenti di fibrosi e occlusione degli spazi trabecolari da parte di cellule endoteliali in migrazione anomala.
Tali modificazioni indotte nell’architettura del tessuto reticolare trabecolare, determinano in ultima analisi una fusione del trabecolato e/o un’ occlusione degli spazi trabecolari, ciò porta poi all’ostruzione del deflusso di umore acqueo, così come dimostrato da Melamed
26
nei suoi studi sui primati che valutarono i cambiamenti riscontrati nell’area trattata con laser argon trabeculoplastica.
Questi cambiamenti possono rappresentare la causa dell’aumento di pressione intraoculare osservato successivamente ad un ALT, e possono essere alla base del successo limitato del ritrattamento ALT stesso; oppure se non altro possono costituire uno dei cofattori necessari per lo sviluppo di queste complicanze. Negli studi di valutazione degli esiti di un ritrattamento con ALT
27
, solo una percentuale molto piccola di pazienti hanno dimostrato un ulteriore riduzione della pressione intraoculare. Sembrerebbe che la ripetizione della ALT abbia poche possibilità di successo in occhi che precedentemente non avevano mostrato delle reazioni positive e durature al medesimo trattamento, inoltre il
47
ritrattamento potrebbe anche essere seguito da un aumento della pressione intraoculare talmente importante da rendere necessario un immediato intervento chirurgico. Pertanto possiamo affermare che le modificazioni ultrastrutturali del tessuto reticolare trabecolare umano successive ad una ALT comprendono eventi distruttivi. Mentre la divisione cellulare stimolata dal laser dopo ALT può avere un effetto positivo sulla resistenza al deflusso, causando alterazioni nella sintesi dei componenti della mucoproteina della matrice extracellulare, i meccanismi distruttivi e l’eccessivo dover correre ai ripari associati all’ALT, vengono messi in relazione ad un mancato successo del trattamento. Queste limitazioni dell’ALT, principalmente collegate all’effetto coagulativo che svolge sul tessuto reticolare trabecolare, hanno indotto un certo interesse verso la ricerca e lo sviluppo di procedure laser che possano risultare meno distruttive e nel contempo mantenere i benefici terapeutici delle irradiazioni laser. Nella procedura ALT, applicata con laser ad onda continua e durata degli impulsi compresa nel millisecondo o maggiore, sebbene l’energia laser venga assorbita principalmente da cellule del tessuto reticolare trabecolare contenenti pigmento, c’è comunque un certa dissipazione di calore da parte di queste cellule ai tessuti circostanti, con conseguente coagulazione termica degli stessi. Questo danno ai tessuti contigui mediato dal calore può essere limitato attraverso la fototermolisi selettiva, tecnica che si basa
48
sull’assorbimento selettivo da parte del bersaglio pigmentato di una pulsazione laser breve, in modo da produrre calore circoscrivendolo alla zona di interesse. Un elemento necessario per il corretto svolgersi della fototermolisi selettiva è costituito dal fatto che il target colpito deve avere un potere di assorbimento ottico superiore di quello dei tessuti circostanti. Inizialmente sviluppata con ossiemoglobina come pigmento bersaglio, il puntamento selettivo o fototermolisi, è stato utilizzato nel trattamento di vasi sanguigni ectasici in alcune macchie cutanee di colore rosso scuro e nella telangectasia della pelle
28 . È stato inoltre possibile trattare la pigmentazione cutanea usando la melanina come bersaglio cromoforo.
Il puntamento selettivo può essere usato anche nel trattamento laser di cellule pigmentate del tessuto reticolare trabecolare. Latina e Park29 hanno dimostrato che un laser Q_switched a 532 nm, frequenza raddoppiata Nd:YAG e durata di impulso nell’ordine del nanosecondo, è in grado di colpire in maniera selettiva le cellule pigmentate del tessuto reticolare trabecolare evitando il danneggiamento termico collaterale delle cellule non pigmentate appartenenti allo stesso tessuto e dei sottostanti fasci trabecolari. Basandosi su questo meccanismo di bersagliamento selettivo, la Laser Trabeculoplastica Selettiva, o SLT30, si è proposta come alternativa al ALT nel trattamento del glaucoma. La ridotta energia e la minore durata degli impulsi generati attraverso il laser
49
Tango della Ellex (utilizzato nel nostro studio) hanno come risultato la distruzione selettiva di cellule pigmentate del tessuto reticolare trabecolare, con danno minimo se non nullo alle cellule non pigmentate e ai fasci di collagene31, così come riscontrato per la trabeculoplastica .
Il dispositivo utilizzato per eseguire la SLT è un laser Q-switched Nd:YAG a frequenza raddoppiata, che rilascia singoli impulsi con energie che vanno da 0.1 fino a 2.0 millijoules a impulso, con una durata approssimativa dello stesso di 3 nanosecondi. Questo trattamento laser a bassa energia e impulso breve limita il danno termico alle cellule che contengono il pigmento bersaglio, dette anche cromofore; nel caso del tessuto reticolare trabecolare, questo target è rappresentato dalle cellule pigmentate. Oltre a colpire in maniera elettiva queste cellule, la durata dell’impulso nell’ordine del nanosecondo è un fattore chiave nella prevenzione di danni collaterali termici e del danneggiamento coagulativo. Infatti la durata dell’impulso è inferiore di 1 microsecondo rispetto al tempo di rilassamento termico dei cromofori di melanina delle cellule pigmentate. Il tempo di rilassamento termico è il periodo di tempo di cui il cromoforo, in questo caso la melanina, necessita per convertire l’energia elettromagnetica radiante in calore. Quando l’accumulo di energia radiante è rapido, come nel caso di un impulso nanosecondo, solo una minima parte di tale energia viene convertita in calore. La dissipazione termica nei tessuti
50
circostanti e il danno coagulativo sono così limitate che persino nell’area trattata le strutture e le cellule non pigmentate non subiscono alterazioni. Sono stati inoltre eseguiti dei test per stabilire i parametri di trattamento adeguati ad un bersagliamento selettivo di cellule pigmentate del tessuto reticolare trabecolare e per valutare i notevoli cambiamenti morfologici successivi alla laser trabeculoplastica selettiva.
E’ stata anche condotta una valutazione in vivo dell’SLT sulle scimmie di Cynomolgus per ottimizzare ulteriormente il bersagliamento selettivo del SLT nel tessuto oculare e definire in maniera migliore il sottostante modo di agire del trattamento.
Questi studi sono riportati di seguito.
3.1 Studio in Vitro per determinare gli effetti del laser sulle cellule del
tessuto reticolare trabecolare (effetti termici del trattamento laser) 32
In una serie di esperimenti condotti su cellule del tessuto reticolare trabecolare pigmentate e non, irradiate con diversi tipi di laser, sono stati valutati i seguenti parametri: la soglia di risposta al trattamento laser, la capacità del laser di bersagliare selettivamente le cellule pigmentate, e gli effetti indotti dal trattamento evidenziabili alla microscopia elettronica a trasmissione.
51
I sistemi laser utilizzati sono stati: (1) un laser a onda continua argon; (2a) un laser a lampada flash pulsante con impulsi della durata di 8 microsecondi; (2b) un laser a lampada flash pulsante con durata degli impulsi di 1 microsecondo;(3a) un laser Q-switched Nd:YAG a frequenza raddoppiata che emette a 532nm con durata degli impulsi di 10 nanosecondi e (3b) un laser Q-switched modalità normale Nd:YAG che emette a 1064 nm e con una durata di impulsi di 10 nanosecondi. Le cellule pigmentate di tessuto reticolare trabecolare necessarie sono state generate stimolando colture confluenti di tessuto reticolare trabecolare con melanina.
La determinazione della soglia di risposta è stata ottenuta sottoponendo le colture di cellule a diverse esposizioni di radiazioni. Cellule di controllo sono state preparate stimolando cellule di tessuto reticolare trabecolare contenenti microsfere di lattice, in modo da determinare l’effetto dell’irradiazione del laser sulle cellule con all’interno un materiale diverso dal cromoforo. E’ stata definita la soglia di esposizione quando si è osservato il 50% di citotossicità della cellula. La citotossicità della cellula e la sua selettività sono state determinate grazie ad un saggio fluorescente di vitalità/citotossicità realizzato in un arco di tempo di 30 minuti di irradiazione laser. A seguito della definizione della soglia di esposizione radiante, i due tipi di colture cellulari sono state irradiate con una esposizione che andava da un po’ al di sotto a un
52
po’ al di sopra della soglia stessa, in modo da definire l’intervallo all’interno del quale si poteva ottenere un bersagliamento selettivo. Le cellule sono state anche preparate per la microscopia elettronica a trasmissione (TEM) al fine di determinare le proporzioni del danno cellulare e intracellulare, e per valutare le conseguenze subite dalle adiacenti cellule non pigmentate. Dopo aver irradiato le colture cellulari con ognuno dei sistemi laser presi in considerazione, è stato osservato che, al di sotto di una scorrevolezza di 10-106 mj/cm2, non è stata evidenziata alcuna lesione né nelle cellule del tessuto reticolare trabecolare, né nelle cellule di controllo con microsfere in lattice. Il bersagliamento selettivo delle cellule pigmentate del tessuto reticolare trabecolare al punto di soglia di esposizione radiante è stato ottenuto sia con il laser pulsante a lampada flash a 588 nm con 1 microsecondo di durata dell’impulso, sia con il laser a doppia frequenza Q-switched Nd:YAG a 532 nm con durata dell’impulso di 10 nanosecondi. Con questi due laser, un’irradiazione con livelli di scorrevolezza 20 volte superiori alla soglia della dose di esposizione ha portato ad una completa citotossicità (cioè 100%) delle cellule pigmentate del tessuto reticolare trabecolare. Non è stato possibile ottenere un bersagliamento selettivo di sole cellule pigmentate del tessuto reticolare trabecolare né usando il laser a onda argon-ione emettente 514 nm, né attraverso il laser a lampada a flash pulsante con emissione a 590 nm con impulsi di 8 microsecondi. Con